-
 코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
2025.02.17
조회수 3945
-
 선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10
조회수 3855
-
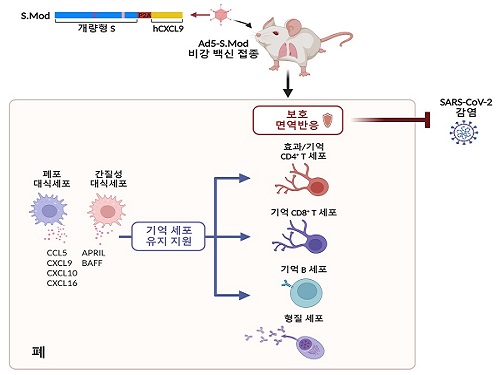 호흡기부터 강력 차단하는 코로나19 백신 개발
코로나바이러스감염증-19는 3년 4개월 만에 비상사태가 해제됐으나, 잦은 돌연변이로 인해 발생한 변이들이 계속해서 보고되고 있어 재유행이 시작될 가능성은 여전히 남아 있다. 이 변이들은 백신 접종이나 감염으로 인해 숙주가 획득한 기존의 면역반응을 회피하는 방향으로 진화하고 있다. 현재 시판되는 근육 접종 백신으로는 바이러스의 확산을 억제할 수 있는 점막 면역은 충분히 일으키기 어렵다는 한계가 있으므로 장기간 지속되는 강력한 점막 면역을 유도할 수 있는 백신의 필요성은 여전하다.
우리 대학 의과학대학원 이흥규 교수 연구팀과 한국화학연구원(원장 이영국)은 아데노바이러스 벡터 플랫폼의 비강 접종 코로나19 백신을 개발하고 마우스 모델을 이용해 이 백신이 장기간 지속되는 강력한 점막 면역을 유도함을 규명했다고 29일 밝혔다.
점막 면역이란 면역 체계를 구성하는 요소 중에서도 호흡기, 소화기, 생식기관 등을 구성하는 체내 상피 조직인 점막에서 작용하는 면역을 말한다. 이는 체내와 체외의 접점이 되는 점막에 침입한 외부 인자를 인지하고 제거해 인체를 감염으로부터 보호하는 방어체계다. 점막이 병원체나 외부 항원이 침입하는 주요 경로라는 점에서 점막 면역은 전신적 면역반응에 비해 병원체의 침입에 빠르게 대응해 감염 및 확산을 막을 수 있다는 장점이 있다.
의과학대학원 연수연구원 정희은 박사가 주도하고 박사과정 구근본, 강병훈 연구원, 김현철 박사, 박장현 박사 및 한국화학연구원 김균도 박사가 참여한 이번 연구에서 연구팀은 아데노바이러스 벡터 플랫폼을 기반으로, 개량된 스파이크 단백질 항원 및 인간 유래 면역증강제(CXCL9)을 탑재한 비강 접종 코로나19 백신(Ad5-S.Mod)을 개발해 그 효능을 실험용 쥐를 이용해 검증했다. 연구팀은 인간 유래 면역증강제가 활성화된 T세포를 특정 위치로 이동하도록 유인한다는 점에 주목해, 이를 백신의 효능을 높이기 위한 면역증강제로 이용하였다.
연구팀은 1회 단일 비강 접종, 혹은 근육-비강 2회 접종하여 백신의 효능을 검증했다. 그 결과 비강 백신이 호흡기 점막의 항체 반응 및 기억 T세포 반응을 높은 수준으로 유도할 수 있음을 확인하였으며, 백신 투여군은 1회 단일 접종만으로도 신종 코로나바이러스 감염 시 100% 생존하였다. 또한 백신 접종으로 만들어진 면역반응은 최소 1년간은 유지된다는 것을 규명해 백신의 강력한 점막 면역반응 유도 능력을 입증했다.
또한, 연구팀은 단일세포 전사체 분석법을 이용해 백신을 접종한 실험용 쥐의 폐 대식세포가 기억 T세포 및 B세포를 유지를 돕는 인자들의 주 생산자이며, 폐 대식세포가 제거되면 기억 T세포 및 B세포가 폐 속에서 확연히 감소함을 확인해 이 세포들이 점막 백신 접종으로 만들어진 호흡기 기억 세포의 유지를 돕고 있음을 규명했다.
이번 연구는 인간 유래 면역증강제(CXCL9)로서 활용해 백신의 효능을 강화한 새로운 백신 설계 전략을 제시하고 있다는 점과, 폐 대식세포가 점막 백신에 의해 형성되는 기억 면역반응을 유지하는 데 중요한 역할을 한다는 사실을 새로이 규명하여 다양한 병원체에 대한 비강 백신 개발에 이용할 수 있는 새로운 타겟을 제시하고 있다는 점에서 그 의의가 있다.
의과학대학원 박사후연수연구원 정희은 박사가 제1 저자로 참여한 이번 연구는 바이러스 분야 국제 학술지 `앤티바이럴 리서치(Antiviral Research)' 온라인판으로 6월 14일에 게재됐다. (논문명: Intranasal delivery of an adenovirus-vector vaccine co-expressing a modified spike protein and a genetic adjuvant confers lasting mucosal immunity against SARS-CoV-2, 논문링크: https://doi.org/10.1016/j.antiviral.2023.105656)
한편 이번 연구는 KAIST 코로나 대응 과학기술 뉴딜사업, 2020 과기원공동연구 프로젝트, 한국연구재단 바이오의료기술개발사업, 창의·도전연구 기반지원 사업 및 한국화학연구원 감염병 예방 융합 플랫폼 개발 과제 및 GO! KRICT 사업의 지원을 받아 수행됐다.
호흡기부터 강력 차단하는 코로나19 백신 개발
코로나바이러스감염증-19는 3년 4개월 만에 비상사태가 해제됐으나, 잦은 돌연변이로 인해 발생한 변이들이 계속해서 보고되고 있어 재유행이 시작될 가능성은 여전히 남아 있다. 이 변이들은 백신 접종이나 감염으로 인해 숙주가 획득한 기존의 면역반응을 회피하는 방향으로 진화하고 있다. 현재 시판되는 근육 접종 백신으로는 바이러스의 확산을 억제할 수 있는 점막 면역은 충분히 일으키기 어렵다는 한계가 있으므로 장기간 지속되는 강력한 점막 면역을 유도할 수 있는 백신의 필요성은 여전하다.
우리 대학 의과학대학원 이흥규 교수 연구팀과 한국화학연구원(원장 이영국)은 아데노바이러스 벡터 플랫폼의 비강 접종 코로나19 백신을 개발하고 마우스 모델을 이용해 이 백신이 장기간 지속되는 강력한 점막 면역을 유도함을 규명했다고 29일 밝혔다.
점막 면역이란 면역 체계를 구성하는 요소 중에서도 호흡기, 소화기, 생식기관 등을 구성하는 체내 상피 조직인 점막에서 작용하는 면역을 말한다. 이는 체내와 체외의 접점이 되는 점막에 침입한 외부 인자를 인지하고 제거해 인체를 감염으로부터 보호하는 방어체계다. 점막이 병원체나 외부 항원이 침입하는 주요 경로라는 점에서 점막 면역은 전신적 면역반응에 비해 병원체의 침입에 빠르게 대응해 감염 및 확산을 막을 수 있다는 장점이 있다.
의과학대학원 연수연구원 정희은 박사가 주도하고 박사과정 구근본, 강병훈 연구원, 김현철 박사, 박장현 박사 및 한국화학연구원 김균도 박사가 참여한 이번 연구에서 연구팀은 아데노바이러스 벡터 플랫폼을 기반으로, 개량된 스파이크 단백질 항원 및 인간 유래 면역증강제(CXCL9)을 탑재한 비강 접종 코로나19 백신(Ad5-S.Mod)을 개발해 그 효능을 실험용 쥐를 이용해 검증했다. 연구팀은 인간 유래 면역증강제가 활성화된 T세포를 특정 위치로 이동하도록 유인한다는 점에 주목해, 이를 백신의 효능을 높이기 위한 면역증강제로 이용하였다.
연구팀은 1회 단일 비강 접종, 혹은 근육-비강 2회 접종하여 백신의 효능을 검증했다. 그 결과 비강 백신이 호흡기 점막의 항체 반응 및 기억 T세포 반응을 높은 수준으로 유도할 수 있음을 확인하였으며, 백신 투여군은 1회 단일 접종만으로도 신종 코로나바이러스 감염 시 100% 생존하였다. 또한 백신 접종으로 만들어진 면역반응은 최소 1년간은 유지된다는 것을 규명해 백신의 강력한 점막 면역반응 유도 능력을 입증했다.
또한, 연구팀은 단일세포 전사체 분석법을 이용해 백신을 접종한 실험용 쥐의 폐 대식세포가 기억 T세포 및 B세포를 유지를 돕는 인자들의 주 생산자이며, 폐 대식세포가 제거되면 기억 T세포 및 B세포가 폐 속에서 확연히 감소함을 확인해 이 세포들이 점막 백신 접종으로 만들어진 호흡기 기억 세포의 유지를 돕고 있음을 규명했다.
이번 연구는 인간 유래 면역증강제(CXCL9)로서 활용해 백신의 효능을 강화한 새로운 백신 설계 전략을 제시하고 있다는 점과, 폐 대식세포가 점막 백신에 의해 형성되는 기억 면역반응을 유지하는 데 중요한 역할을 한다는 사실을 새로이 규명하여 다양한 병원체에 대한 비강 백신 개발에 이용할 수 있는 새로운 타겟을 제시하고 있다는 점에서 그 의의가 있다.
의과학대학원 박사후연수연구원 정희은 박사가 제1 저자로 참여한 이번 연구는 바이러스 분야 국제 학술지 `앤티바이럴 리서치(Antiviral Research)' 온라인판으로 6월 14일에 게재됐다. (논문명: Intranasal delivery of an adenovirus-vector vaccine co-expressing a modified spike protein and a genetic adjuvant confers lasting mucosal immunity against SARS-CoV-2, 논문링크: https://doi.org/10.1016/j.antiviral.2023.105656)
한편 이번 연구는 KAIST 코로나 대응 과학기술 뉴딜사업, 2020 과기원공동연구 프로젝트, 한국연구재단 바이오의료기술개발사업, 창의·도전연구 기반지원 사업 및 한국화학연구원 감염병 예방 융합 플랫폼 개발 과제 및 GO! KRICT 사업의 지원을 받아 수행됐다.
2023.07.01
조회수 7215
-
 항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
2023.05.17
조회수 10350
-
 코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07
조회수 14567
-
 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16
조회수 25069
-
 진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25
조회수 17533
-
 박수형 교수, 중증열성혈소판감소증후군 예방 백신 개발
〈 박수형 교수 〉
우리 대학 의과학대학원 박수형 교수 연구팀이 일명 살인진드기병으로 불리는 중증열성혈소판감소증후군(SFTS) 바이러스 감염을 예방하는 백신을 개발했다.
충북대학교 의과대학 최영기 교수와 진원생명과학(주)이 함께 참여한 공동 연구팀은 개발한 백신이 감염 동물모델 실험을 통해 중증열성혈소판감소증후군 바이러스 감염을 완벽하게 억제할 수 있음을 증명했다.
이번 연구를 통해 예방 백신 도출 및 검증 성과뿐 아니라 면역학적 관점에서 백신의 감염 예방 효능을 극대화할 수 있는 항원을 제시함으로써, 추후 중증열성혈소판감소증후군 바이러스에 대한 대응 전략 확립 및 연구에 기여할 것으로 기대된다.
곽정은 박사과정과 충북대학교 김영일 박사가 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 23일 자 온라인판에 게재됐다. (논문명 : Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets)
흔히 살인진드기병으로 알려진 SFTS는 SFTS 바이러스에 감염된 매개 진드기에 물려 발생하는 신종 감염병으로, 최근 발생 빈도 및 지역의 확산으로 WHO에서도 주의해야 할 10대 신, 변종 바이러스 감염병으로 지정한 질병이다.
일반적으로 6~14일의 잠복기 후 고열(38∼40℃)이 3~10일 이어지고, 혈소판 감소 및 백혈구 감소와 구토, 설사 등 소화기 증상이 발생하며, 일부 사례에서는 중증으로 진행돼 사망에 이르기도 한다.
2013년에 한국에서 처음으로 환자가 발생한 이래 발생 건수가 매년 꾸준히 증가하고 있지만, 진드기 접촉 최소화를 통한 예방이 제시될 뿐 현재까지 예방 백신이 개발되지 않았다.
연구팀은 31종의 서로 다른 SFTS 바이러스의 유전자 서열로부터 공통 서열을 도출해 백신 항원을 설계하고, 진원생명과학의 플랫폼을 이용해 DNA 백신을 제작했다.
DNA 백신 기술은 기존 백신과 달리 바이러스 자체가 아닌 유전자만을 사용해 안전하고 기존 백신 대비 광범위한 면역 반응을 유도할 수 있다는 장점이 있다.
연구팀은 감염 동물모델인 패럿에서 백신이 감염을 완벽하게 억제하며 소화기 증상, 혈소판 및 백혈구 감소, 고열, 간 수치 상승 등 감염 환자에서 발생하는 임상 증상들 역시 관찰되지 않음을 확인했다.
특히 연구팀은 해당 바이러스의 전체 유전자에 대한 5종의 백신을 구상해 SFTS 예방 백신 개발에 대한 전략적 접근법을 제시했다.
연구팀은 수동전달 기법(passive transfer)을 통해 바이러스의 당단백질에 대한 항체 면역 반응이 감염억제에 주요한 역할을 함을 규명했다. 또한, 비-당단백질에 대한 T세포 면역 반응 역시 감염 예방에 기여할 수 있음을 밝혔다.
박 교수는 “이번 연구는 SFTS 바이러스 감염을 완벽하게 방어할 수 있는 백신을 최초로 개발하고, 생쥐 모델이 아닌 환자의 임상 증상과 같게 발생하는 패럿 동물모델에서 완벽한 방어효능을 증명했다는 중요한 의의가 있다”라고 말했다.
최 교수는 “이번 SFTS 바이러스 백신 개발 연구 성과는 국제적으로 SFTS 백신 개발을 위한 기술적 우위를 확보했다는 중요한 의의가 있으며, 연구결과를 바탕으로 지속적인 연구를 통해 SFTS 바이러스 백신의 상용화에 기여할 수 있을 것이다”라고 말했다.
향후 임상개발은 이번 연구에 함께 참여한 DNA 백신 개발 전문기업인 진원생명과학(주)을 통해 진행할 계획이다.
이번 연구는 보건복지부 감염병위기대응기술개발사업의 지원을 받아 수행됐다.
박수형 교수, 중증열성혈소판감소증후군 예방 백신 개발
〈 박수형 교수 〉
우리 대학 의과학대학원 박수형 교수 연구팀이 일명 살인진드기병으로 불리는 중증열성혈소판감소증후군(SFTS) 바이러스 감염을 예방하는 백신을 개발했다.
충북대학교 의과대학 최영기 교수와 진원생명과학(주)이 함께 참여한 공동 연구팀은 개발한 백신이 감염 동물모델 실험을 통해 중증열성혈소판감소증후군 바이러스 감염을 완벽하게 억제할 수 있음을 증명했다.
이번 연구를 통해 예방 백신 도출 및 검증 성과뿐 아니라 면역학적 관점에서 백신의 감염 예방 효능을 극대화할 수 있는 항원을 제시함으로써, 추후 중증열성혈소판감소증후군 바이러스에 대한 대응 전략 확립 및 연구에 기여할 것으로 기대된다.
곽정은 박사과정과 충북대학교 김영일 박사가 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 23일 자 온라인판에 게재됐다. (논문명 : Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets)
흔히 살인진드기병으로 알려진 SFTS는 SFTS 바이러스에 감염된 매개 진드기에 물려 발생하는 신종 감염병으로, 최근 발생 빈도 및 지역의 확산으로 WHO에서도 주의해야 할 10대 신, 변종 바이러스 감염병으로 지정한 질병이다.
일반적으로 6~14일의 잠복기 후 고열(38∼40℃)이 3~10일 이어지고, 혈소판 감소 및 백혈구 감소와 구토, 설사 등 소화기 증상이 발생하며, 일부 사례에서는 중증으로 진행돼 사망에 이르기도 한다.
2013년에 한국에서 처음으로 환자가 발생한 이래 발생 건수가 매년 꾸준히 증가하고 있지만, 진드기 접촉 최소화를 통한 예방이 제시될 뿐 현재까지 예방 백신이 개발되지 않았다.
연구팀은 31종의 서로 다른 SFTS 바이러스의 유전자 서열로부터 공통 서열을 도출해 백신 항원을 설계하고, 진원생명과학의 플랫폼을 이용해 DNA 백신을 제작했다.
DNA 백신 기술은 기존 백신과 달리 바이러스 자체가 아닌 유전자만을 사용해 안전하고 기존 백신 대비 광범위한 면역 반응을 유도할 수 있다는 장점이 있다.
연구팀은 감염 동물모델인 패럿에서 백신이 감염을 완벽하게 억제하며 소화기 증상, 혈소판 및 백혈구 감소, 고열, 간 수치 상승 등 감염 환자에서 발생하는 임상 증상들 역시 관찰되지 않음을 확인했다.
특히 연구팀은 해당 바이러스의 전체 유전자에 대한 5종의 백신을 구상해 SFTS 예방 백신 개발에 대한 전략적 접근법을 제시했다.
연구팀은 수동전달 기법(passive transfer)을 통해 바이러스의 당단백질에 대한 항체 면역 반응이 감염억제에 주요한 역할을 함을 규명했다. 또한, 비-당단백질에 대한 T세포 면역 반응 역시 감염 예방에 기여할 수 있음을 밝혔다.
박 교수는 “이번 연구는 SFTS 바이러스 감염을 완벽하게 방어할 수 있는 백신을 최초로 개발하고, 생쥐 모델이 아닌 환자의 임상 증상과 같게 발생하는 패럿 동물모델에서 완벽한 방어효능을 증명했다는 중요한 의의가 있다”라고 말했다.
최 교수는 “이번 SFTS 바이러스 백신 개발 연구 성과는 국제적으로 SFTS 백신 개발을 위한 기술적 우위를 확보했다는 중요한 의의가 있으며, 연구결과를 바탕으로 지속적인 연구를 통해 SFTS 바이러스 백신의 상용화에 기여할 수 있을 것이다”라고 말했다.
향후 임상개발은 이번 연구에 함께 참여한 DNA 백신 개발 전문기업인 진원생명과학(주)을 통해 진행할 계획이다.
이번 연구는 보건복지부 감염병위기대응기술개발사업의 지원을 받아 수행됐다.
2019.08.28
조회수 18826
-
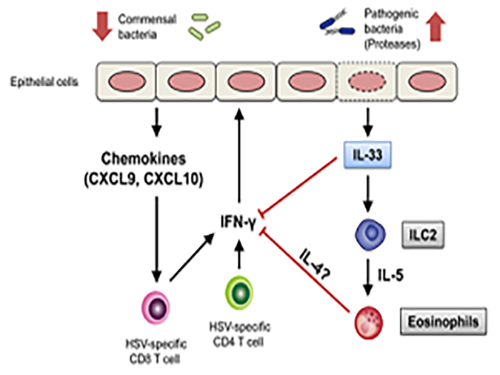 항생제 남용이 바이러스 방어능력을 약화시킨다
〈 이 흥 규 교수 〉
□ 미래창조과학부(장관 최양희)는 항생제 남용에 의한 체내 공생미생물의 불균형이 헤르페스 바이러스 방어 면역에 끼치는 영향에 대한 기전을 국내 연구진이 처음 규명하였다”고 밝혔다.
□ 우리 대학 이흥규 교수 연구팀은 미래창조과학부와 한국연구재단의 기초연구실지원사업의 지원을 받아 연구를 수행하였으며, 연구결과는 자연과학분야의 세계적인 국제학술지「미국국립과학원회보(PNAS)」온라인판 1월 25일자에 게재되었다.
o 논문명과 저자 정보는 다음과 같다.
- <논문명> Dysbiosis-induced IL-33 contributes to impaired antiviral immunity in the genital mucosa - <저자 정보> 교신저자: 이흥규교수 (KAIST), 제 1저자: 오지은박사 (KAIST), 공동저자: 김병찬박사 (한국생명공학연구원), 강덕진박사 (한국표준과학연구원), 김진영박사 (한국기초과학지원연구원), 유제욱교수 (연세대) 등
□ 논문의 주요 내용은 다음과 같다.
1. 연구의 필요성 ○ 공생미생물은 우리 몸에 상재하는 다양한 미생물의 군집으로, 우리몸의 건강유지에 필수적인 다양한 역할을 수행하는 것이 알려져 왔다. 특히 공생미생물의 불균형이 염증성 장질환을 비롯하여 다양한 질환 (ex. 알레르기, 비만, 당뇨, 암 등)의 발병에 기여한다는 것이 밝혀지면서 공생미생물이 우리몸의 건강과 질환 발병에 끼치는 영향에 대한 연구의 필요성이 대두되고 있다.
2. 발견 원리 ○ 이흥규 교수 연구팀은 헤르페스 바이러스 감염을 비롯한 다양한 바이러스 감염 시 체내 면역시스템의 방어기작에 대한 연구를 지속해 왔다. 본 연구에서는 항생제 남용으로 인한 여성생식기의 공생미생물의 불균형이 질점막을 통한 헤르페스 바이러스 감염에 대한 호스트의 방어능력을 현저히 약화시키며 그 기전이 무엇인지를 규명하였다.
○ 특히 본 연구에서는 항생제로 인한 유익한 미생물의 감소와 해로운 미생물의 증가가 마우스의 질점막에서 IL-33의 대량생산을 유도하여, 항바이러스 면역에 필수적인 인터페론 감마 (IFN-γ)를 생산하는 T세포가 감염부위로 적절하게 이동하는 것을 억제함으로써 헤르페스 바이러스 감염에 대한 방어능력을 약화시킨다는 것을 세계 최초로 보여주었다.
○ 또한 항생제를 투여한 마우스의 질세척액에서 다양한 조직손상 및 염증반응에 관계된 물질이 증가한 것을 발견하였으며, 항생제 투여로 인해 증가한 해로운 미생물이 질 내에서 단백질 분해효소를 분비하여 질 상피세포의 손상을 유도함으로써 조직손상을 반영하는 물질 중 하나인 IL-33 의 분비를 촉진시켰을 가능성을 제시하였다.
3. 연구 성과
○ 본 연구는 항생제 남용이 초래하는 공생미생물의 불균형이 바이러스 감염에 대한 방어능력을 현저히 약화시키는 것을 직접적으로 증명함으로써, 항생제 남용에 대한 경각심을 일깨울 수 있을 것이라 기대된다.
○ 또한 공생미생물의 불균형에 의해 질점막에서 분비되는 IL-33과 같은 물질이 감염에 대한 방어능력을 평가할 수 있는 지표로 활용될 수 있을 것으로 기대된다.
○ 체내 공생미생물을 우리 몸에 유익하도록 조절함으로써 방어능력이 향상된 바이러스 치료제 및 백신 개발에 기여할 수 있을 것으로 기대된다.
□ 이흥규 교수는 “항생제 남용이 인체에 해로운 영향을 준다는 것이 막연하게 알려져 있었는데, 어떻게 해로운지 명확하게 규명되지는 않았다”며, “이번 연구는 체내 공생미생물의 불균형으로 인해 여러 바이러스 감염이 악화될 수 있음을 밝혀냄으로써 앞으로 백신 및 치료제 개발에 도움을 줄 것으로 기대된다.”고 연구의 의의를 설명했다.
□ 그림 설명
그림1. 항생제의 남용으로 질내 유익한 공생미생물이 감소하고 해로운 미생물이 증가함으로써 질점막을 통한 헤르페스 바이러스 감염에 더 취약하게 되는 기전이 밝혀짐
.
항생제 남용이 바이러스 방어능력을 약화시킨다
〈 이 흥 규 교수 〉
□ 미래창조과학부(장관 최양희)는 항생제 남용에 의한 체내 공생미생물의 불균형이 헤르페스 바이러스 방어 면역에 끼치는 영향에 대한 기전을 국내 연구진이 처음 규명하였다”고 밝혔다.
□ 우리 대학 이흥규 교수 연구팀은 미래창조과학부와 한국연구재단의 기초연구실지원사업의 지원을 받아 연구를 수행하였으며, 연구결과는 자연과학분야의 세계적인 국제학술지「미국국립과학원회보(PNAS)」온라인판 1월 25일자에 게재되었다.
o 논문명과 저자 정보는 다음과 같다.
- <논문명> Dysbiosis-induced IL-33 contributes to impaired antiviral immunity in the genital mucosa - <저자 정보> 교신저자: 이흥규교수 (KAIST), 제 1저자: 오지은박사 (KAIST), 공동저자: 김병찬박사 (한국생명공학연구원), 강덕진박사 (한국표준과학연구원), 김진영박사 (한국기초과학지원연구원), 유제욱교수 (연세대) 등
□ 논문의 주요 내용은 다음과 같다.
1. 연구의 필요성 ○ 공생미생물은 우리 몸에 상재하는 다양한 미생물의 군집으로, 우리몸의 건강유지에 필수적인 다양한 역할을 수행하는 것이 알려져 왔다. 특히 공생미생물의 불균형이 염증성 장질환을 비롯하여 다양한 질환 (ex. 알레르기, 비만, 당뇨, 암 등)의 발병에 기여한다는 것이 밝혀지면서 공생미생물이 우리몸의 건강과 질환 발병에 끼치는 영향에 대한 연구의 필요성이 대두되고 있다.
2. 발견 원리 ○ 이흥규 교수 연구팀은 헤르페스 바이러스 감염을 비롯한 다양한 바이러스 감염 시 체내 면역시스템의 방어기작에 대한 연구를 지속해 왔다. 본 연구에서는 항생제 남용으로 인한 여성생식기의 공생미생물의 불균형이 질점막을 통한 헤르페스 바이러스 감염에 대한 호스트의 방어능력을 현저히 약화시키며 그 기전이 무엇인지를 규명하였다.
○ 특히 본 연구에서는 항생제로 인한 유익한 미생물의 감소와 해로운 미생물의 증가가 마우스의 질점막에서 IL-33의 대량생산을 유도하여, 항바이러스 면역에 필수적인 인터페론 감마 (IFN-γ)를 생산하는 T세포가 감염부위로 적절하게 이동하는 것을 억제함으로써 헤르페스 바이러스 감염에 대한 방어능력을 약화시킨다는 것을 세계 최초로 보여주었다.
○ 또한 항생제를 투여한 마우스의 질세척액에서 다양한 조직손상 및 염증반응에 관계된 물질이 증가한 것을 발견하였으며, 항생제 투여로 인해 증가한 해로운 미생물이 질 내에서 단백질 분해효소를 분비하여 질 상피세포의 손상을 유도함으로써 조직손상을 반영하는 물질 중 하나인 IL-33 의 분비를 촉진시켰을 가능성을 제시하였다.
3. 연구 성과
○ 본 연구는 항생제 남용이 초래하는 공생미생물의 불균형이 바이러스 감염에 대한 방어능력을 현저히 약화시키는 것을 직접적으로 증명함으로써, 항생제 남용에 대한 경각심을 일깨울 수 있을 것이라 기대된다.
○ 또한 공생미생물의 불균형에 의해 질점막에서 분비되는 IL-33과 같은 물질이 감염에 대한 방어능력을 평가할 수 있는 지표로 활용될 수 있을 것으로 기대된다.
○ 체내 공생미생물을 우리 몸에 유익하도록 조절함으로써 방어능력이 향상된 바이러스 치료제 및 백신 개발에 기여할 수 있을 것으로 기대된다.
□ 이흥규 교수는 “항생제 남용이 인체에 해로운 영향을 준다는 것이 막연하게 알려져 있었는데, 어떻게 해로운지 명확하게 규명되지는 않았다”며, “이번 연구는 체내 공생미생물의 불균형으로 인해 여러 바이러스 감염이 악화될 수 있음을 밝혀냄으로써 앞으로 백신 및 치료제 개발에 도움을 줄 것으로 기대된다.”고 연구의 의의를 설명했다.
□ 그림 설명
그림1. 항생제의 남용으로 질내 유익한 공생미생물이 감소하고 해로운 미생물이 증가함으로써 질점막을 통한 헤르페스 바이러스 감염에 더 취약하게 되는 기전이 밝혀짐
.
2016.02.26
조회수 13926
-
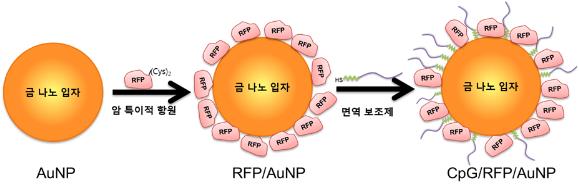 금 알갱이로 항암백신을 만들다
- 앙게반테 케미지 발표,“백신 위치를 추적할 수 있으면서 효능도 탁월한 나노항암백신 개발”
매우 작은 금 알갱이(금 나노입자, 지름이 10억분의 1미터)를 이용해 위치를 추적할 수 있으면서 암을 예방‧치료할 수 있는 효능도 탁월한 항암백신기술이 국내 연구진에 의해 개발되었다.
우리 학교 전상용 교수(42세)가 주도하고 이인현 박사(제1저자) 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △선도연구센터 △신기술융합형성장동력 △바이오의료기술개발 사업의 지원으로 수행되었고, 연구결과는 독일화학회가 발간하는 화학분야의 권위 있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’지 7월호(7월 29일)에 게재되었다.
특히 이번 성과는 상위 5%이내 논문에만 수여하는 VIP(Very Important Paper)로 선정되는 영예를 얻었다. (논문명 : Imageable Antigen-Presenting Gold Nanoparticle Vaccines for Effective Cancer Immunotherapy In Vivo)
암은 현대의학이 정복하지 못한 대표적인 난치성 질환 중 하나이다. 전 세계적으로 연간 3천만 명의 암 환자가 발생하고 있고, 특히 우리나라에서는 매년 사망원인 1위를 차지하고 있다.
암을 효과적으로 치료하기 위해서 부작용(정상세포까지 죽이는 세포독성)을 최소화하면서도 효과를 극대화할 수 있는 면역치료법(백신)이 전 세계적으로 각광받고 있다. 지금까지 백신은 독감에서부터 난치성 질환인 백혈병에 이르기까지 인류의 다양한 질병을 예방‧치료하는데 활용되어왔다.
그러나 기존 대부분의 항암백신은 몸 밖에서 환자의 암 조직 파편 등으로 사람의 면역세포를 활성화한 후, 다시 그 면역세포를 몸속에 넣어 항암 면역반응을 유도함으로써 암을 치료하는 기술이다. 이렇게 하면 여러 단계의 백신 제조과정을 거치게 되고, 치료비도 비싼 것이 단점이다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어, 치료효과를 예측하고 가늠할 수 없었다.
전상용 교수 연구팀은 기존 항암백신과는 달리 일반적인 근육주사로 면역세포들이 많이 모여 있는 국소 림프절을 통해 금 나노입자 백신을 효과적으로 전달하여, 항체를 생산하고 항암 면역반응을 유도함으로써 암을 예방‧치료하는데 이용할 수 있는 핵심원천기술을 개발하였다.
또한 병원에서 진단용으로 많이 사용하는 엑스레이 등의 영상기기를 이용해 주입한 금 나노입자 백신을 추적하여, 백신이 목표하는 곳에 제대로 도달하였는지를 직접 확인할 수 있어 향후 개발될 새로운 백신의 효과를 예측할 수 있다는 점이 큰 특징이다.
전 교수팀은 우선 금 나노입자 표면에 모델 암 항원(RFP 단백질)을 화학적으로 결합한 후, 추가적으로 면역보조제(DNA 단편)도 결합하여 금 나노백신 원천기술을 개발하였다.
이 금 나노백신을 몸에 넣으면 국소 림프절로 선택적으로 이동하여 해당 암에 특이적인 항체 생산을 촉진하고, 암세포를 제거할 수 있는 항암 면역세포도 활성화시켜 우수한 항암 효능을 나타낸다.
또한 연구팀은 동물실험을 통해 금 나노백신이 암을 예방할 뿐만 아니라, 이미 존재하는 암의 성장과 전이도 효과적으로 막을 수 있음을 증명하였다.
전상용 교수는 “이번 연구는 금 나노입자를 이용하면 몸속에 투여한 백신을 쉽게 추적할 수 있고, 기존의 백신에 비해 복잡한 과정 없이도 쉽게 면역세포를 활성화할 수 있어 효과적으로 암을 치료할 수 있는 가능성을 보였다. 특히 이 원천 기반기술은 각종 암뿐만 아니라 현재 임상적으로 치료가 어려운 다양한 바이러스성 질환에도 폭넓게 이용될 수 있을 것으로 기대된다”고 연구의의를 밝혔다.
금 알갱이로 항암백신을 만들다
- 앙게반테 케미지 발표,“백신 위치를 추적할 수 있으면서 효능도 탁월한 나노항암백신 개발”
매우 작은 금 알갱이(금 나노입자, 지름이 10억분의 1미터)를 이용해 위치를 추적할 수 있으면서 암을 예방‧치료할 수 있는 효능도 탁월한 항암백신기술이 국내 연구진에 의해 개발되었다.
우리 학교 전상용 교수(42세)가 주도하고 이인현 박사(제1저자) 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △선도연구센터 △신기술융합형성장동력 △바이오의료기술개발 사업의 지원으로 수행되었고, 연구결과는 독일화학회가 발간하는 화학분야의 권위 있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’지 7월호(7월 29일)에 게재되었다.
특히 이번 성과는 상위 5%이내 논문에만 수여하는 VIP(Very Important Paper)로 선정되는 영예를 얻었다. (논문명 : Imageable Antigen-Presenting Gold Nanoparticle Vaccines for Effective Cancer Immunotherapy In Vivo)
암은 현대의학이 정복하지 못한 대표적인 난치성 질환 중 하나이다. 전 세계적으로 연간 3천만 명의 암 환자가 발생하고 있고, 특히 우리나라에서는 매년 사망원인 1위를 차지하고 있다.
암을 효과적으로 치료하기 위해서 부작용(정상세포까지 죽이는 세포독성)을 최소화하면서도 효과를 극대화할 수 있는 면역치료법(백신)이 전 세계적으로 각광받고 있다. 지금까지 백신은 독감에서부터 난치성 질환인 백혈병에 이르기까지 인류의 다양한 질병을 예방‧치료하는데 활용되어왔다.
그러나 기존 대부분의 항암백신은 몸 밖에서 환자의 암 조직 파편 등으로 사람의 면역세포를 활성화한 후, 다시 그 면역세포를 몸속에 넣어 항암 면역반응을 유도함으로써 암을 치료하는 기술이다. 이렇게 하면 여러 단계의 백신 제조과정을 거치게 되고, 치료비도 비싼 것이 단점이다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어, 치료효과를 예측하고 가늠할 수 없었다.
전상용 교수 연구팀은 기존 항암백신과는 달리 일반적인 근육주사로 면역세포들이 많이 모여 있는 국소 림프절을 통해 금 나노입자 백신을 효과적으로 전달하여, 항체를 생산하고 항암 면역반응을 유도함으로써 암을 예방‧치료하는데 이용할 수 있는 핵심원천기술을 개발하였다.
또한 병원에서 진단용으로 많이 사용하는 엑스레이 등의 영상기기를 이용해 주입한 금 나노입자 백신을 추적하여, 백신이 목표하는 곳에 제대로 도달하였는지를 직접 확인할 수 있어 향후 개발될 새로운 백신의 효과를 예측할 수 있다는 점이 큰 특징이다.
전 교수팀은 우선 금 나노입자 표면에 모델 암 항원(RFP 단백질)을 화학적으로 결합한 후, 추가적으로 면역보조제(DNA 단편)도 결합하여 금 나노백신 원천기술을 개발하였다.
이 금 나노백신을 몸에 넣으면 국소 림프절로 선택적으로 이동하여 해당 암에 특이적인 항체 생산을 촉진하고, 암세포를 제거할 수 있는 항암 면역세포도 활성화시켜 우수한 항암 효능을 나타낸다.
또한 연구팀은 동물실험을 통해 금 나노백신이 암을 예방할 뿐만 아니라, 이미 존재하는 암의 성장과 전이도 효과적으로 막을 수 있음을 증명하였다.
전상용 교수는 “이번 연구는 금 나노입자를 이용하면 몸속에 투여한 백신을 쉽게 추적할 수 있고, 기존의 백신에 비해 복잡한 과정 없이도 쉽게 면역세포를 활성화할 수 있어 효과적으로 암을 치료할 수 있는 가능성을 보였다. 특히 이 원천 기반기술은 각종 암뿐만 아니라 현재 임상적으로 치료가 어려운 다양한 바이러스성 질환에도 폭넓게 이용될 수 있을 것으로 기대된다”고 연구의의를 밝혔다.
2012.08.16
조회수 18447
 코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
2025.02.17 조회수 3945
코로나바이러스 전염 메커니즘 규명
중증급성호흡기증후군(이하 SARS) 코로나바이러스와 같은 코로나 19(COVID-19)는 전 세계적 팬데믹으로 짧은 시간 안에 확산되었지만 왜 급격히 복제돼 빠르게 전염되는지 기전이 아직까지 규명되지 않았다. 우리 연구진이 코로나바이러스 핵심 효소 단백질(헬리케이스)의 복제과정이 급격히 촉진되어 전염되는 메커니즘을 밝혀내며 바이러스 백신 및 치료제 개발에 새로운 가능성을 제시했다.
우리 대학 생명과학과 이광록 교수 연구팀이 nsp13 단백질*은 두 가지 활성을 가지고 있어 시너지 효과를 내며, 이를 통해 SARS 코로나바이러스의 유전물질인 RNA 복제를 촉진한다는 기전을 규명했다고 17일 밝혔다.
*nsp13 단백질: SARS 코로나바이러스의 헬리케이스로, 바이러스가 증식하는 데 필수적인 유전자 복제와 전사 과정에 중요한 효소이다. 헬리케이스는 마치 지퍼를 열고 닫는 것처럼 DNA나 RNA의 꼬인 구조를 풀어주는데, 유전정보를 읽거나 복제할 때 유전물질을 먼저 풀려야 하므로 필수적이다. 쉽게 말해, 헬리케이스는 엉킨 실타래를 푸는 효소단백질이다.
여기 두 가지 활성에 해당되는 첫번째 헬리케이스 활성은 DNA 또는 RNA와 같은 이중 가닥 핵산을 단일 가닥으로 풀어주는 효소 기능이며, 복제나 전사 과정을 촉진시킨다. 두번째 RNA 샤페론 활성은 핵산 구조의 올바른 접힘(folding)과 풀림 기능을 돕는 단백질로, 잘못된 RNA를 교정하거나 안정성을 향상시켜 세포 내 RNA 대사과정을 돕는 역할을 한다.
코로나바이러스가 빠르게 전파하기 위해서는 바이러스의 유전물질을 빠르게 복제하고 구성성분인 단백질을 생산해서 이들을 조합하는 것이 필수적이다.
연구팀은 첫 번째 단계인 유전물질의 RNA 복제가 다른 바이러스에 비해 왜 빠르게 일어나는지 알려지지 않았으나, nsp13 단백질이 기존의 헬리케이스 활성과 이제까지 알려지지 않은 새로운 샤페론 활성으로 유전자 복제 과정을 빠르게 촉진한다는 것을 규명했다.
nsp13 단백질은 유전적으로 잘 보존되어 다양한 변이 코로나바이러스에 대응하는 백신이나 감염 치료의 중요 표적이지만, 정확한 작용 메커니즘에 대해서는 완전한 이해가 부족했다.
연구팀은 nsp13 헬리케이스가 ATP(아데노신 삼인산)*를 분해하여 나온 화학에너지를 이용하여 유전물질인 RNA의 꼬인 구조를 단일 가닥으로 풀어주고 부산물로 ADP(아데노신 이인산)*가 생성하게 된다. 이때 생성된 ADP가 nsp13와 재결합하게 되면 샤페론 기능을 활성화시켜 RNA 이차구조를 추가로 불안정화한다는 사실을 알아냈다.
*ATP(아데노신 삼인산)는 충전된 배터리처럼 에너지를 담고 있고 효소가 일을 할 때는 에너지를 공급해준다. ATP는 인산 3개를 가지고 있어 인산이 분해 될 때 에너지를 방출하고 인산 2개를 가진 ADP(아데노신 이인산)를 부산물로 생성한다.
결론적으로 헬리케이스 활성과 샤페론 활성이 시공간적으로 동시에 협력해 RNA 복제를 촉진하게 된다는 새로운 방식의 작용기전을 규명했다.
이광록 교수는 “이번 연구는 대표적 핵산-효소 단백질인 헬리케이스가 ADP를 통해 샤페론적 활성을 나타내는 새로운 발견이며, 이를 통해 헬리케이스의 기능 다양성에 대한 이해의 폭을 넓혀주고, SARS 코로나바이러스의 다양한 변이에 대응할 효과적 치료제 및 백신 개발의 실마리를 제공할 것으로 기대한다”라고 연구 결과의 의의를 밝혔다.
이 연구는 유정민 박사가 제 1저자로 세계적 국제학술지 ‘핵산 연구 (Nucleic Acids Research)’ (IF: 16.7, 생화학 및 분자생물학 분야 상위 1.8%) 온라인판에 1월 29일 게재됐다. (논문명 : A novel ADP-directed chaperone function facilitates the ATP-driven motor activity of SARS-CoV helicase) (doi: 10.1093/nar/gkaf034)
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구지원, 선도연구센터 지원사업, 글로벌 기초연구 지원사업과 합성생물학핵심기술개발사업의 지원을 받아 수행됐다.
2025.02.17 조회수 3945 선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10 조회수 3855
선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10 조회수 3855 호흡기부터 강력 차단하는 코로나19 백신 개발
코로나바이러스감염증-19는 3년 4개월 만에 비상사태가 해제됐으나, 잦은 돌연변이로 인해 발생한 변이들이 계속해서 보고되고 있어 재유행이 시작될 가능성은 여전히 남아 있다. 이 변이들은 백신 접종이나 감염으로 인해 숙주가 획득한 기존의 면역반응을 회피하는 방향으로 진화하고 있다. 현재 시판되는 근육 접종 백신으로는 바이러스의 확산을 억제할 수 있는 점막 면역은 충분히 일으키기 어렵다는 한계가 있으므로 장기간 지속되는 강력한 점막 면역을 유도할 수 있는 백신의 필요성은 여전하다.
우리 대학 의과학대학원 이흥규 교수 연구팀과 한국화학연구원(원장 이영국)은 아데노바이러스 벡터 플랫폼의 비강 접종 코로나19 백신을 개발하고 마우스 모델을 이용해 이 백신이 장기간 지속되는 강력한 점막 면역을 유도함을 규명했다고 29일 밝혔다.
점막 면역이란 면역 체계를 구성하는 요소 중에서도 호흡기, 소화기, 생식기관 등을 구성하는 체내 상피 조직인 점막에서 작용하는 면역을 말한다. 이는 체내와 체외의 접점이 되는 점막에 침입한 외부 인자를 인지하고 제거해 인체를 감염으로부터 보호하는 방어체계다. 점막이 병원체나 외부 항원이 침입하는 주요 경로라는 점에서 점막 면역은 전신적 면역반응에 비해 병원체의 침입에 빠르게 대응해 감염 및 확산을 막을 수 있다는 장점이 있다.
의과학대학원 연수연구원 정희은 박사가 주도하고 박사과정 구근본, 강병훈 연구원, 김현철 박사, 박장현 박사 및 한국화학연구원 김균도 박사가 참여한 이번 연구에서 연구팀은 아데노바이러스 벡터 플랫폼을 기반으로, 개량된 스파이크 단백질 항원 및 인간 유래 면역증강제(CXCL9)을 탑재한 비강 접종 코로나19 백신(Ad5-S.Mod)을 개발해 그 효능을 실험용 쥐를 이용해 검증했다. 연구팀은 인간 유래 면역증강제가 활성화된 T세포를 특정 위치로 이동하도록 유인한다는 점에 주목해, 이를 백신의 효능을 높이기 위한 면역증강제로 이용하였다.
연구팀은 1회 단일 비강 접종, 혹은 근육-비강 2회 접종하여 백신의 효능을 검증했다. 그 결과 비강 백신이 호흡기 점막의 항체 반응 및 기억 T세포 반응을 높은 수준으로 유도할 수 있음을 확인하였으며, 백신 투여군은 1회 단일 접종만으로도 신종 코로나바이러스 감염 시 100% 생존하였다. 또한 백신 접종으로 만들어진 면역반응은 최소 1년간은 유지된다는 것을 규명해 백신의 강력한 점막 면역반응 유도 능력을 입증했다.
또한, 연구팀은 단일세포 전사체 분석법을 이용해 백신을 접종한 실험용 쥐의 폐 대식세포가 기억 T세포 및 B세포를 유지를 돕는 인자들의 주 생산자이며, 폐 대식세포가 제거되면 기억 T세포 및 B세포가 폐 속에서 확연히 감소함을 확인해 이 세포들이 점막 백신 접종으로 만들어진 호흡기 기억 세포의 유지를 돕고 있음을 규명했다.
이번 연구는 인간 유래 면역증강제(CXCL9)로서 활용해 백신의 효능을 강화한 새로운 백신 설계 전략을 제시하고 있다는 점과, 폐 대식세포가 점막 백신에 의해 형성되는 기억 면역반응을 유지하는 데 중요한 역할을 한다는 사실을 새로이 규명하여 다양한 병원체에 대한 비강 백신 개발에 이용할 수 있는 새로운 타겟을 제시하고 있다는 점에서 그 의의가 있다.
의과학대학원 박사후연수연구원 정희은 박사가 제1 저자로 참여한 이번 연구는 바이러스 분야 국제 학술지 `앤티바이럴 리서치(Antiviral Research)' 온라인판으로 6월 14일에 게재됐다. (논문명: Intranasal delivery of an adenovirus-vector vaccine co-expressing a modified spike protein and a genetic adjuvant confers lasting mucosal immunity against SARS-CoV-2, 논문링크: https://doi.org/10.1016/j.antiviral.2023.105656)
한편 이번 연구는 KAIST 코로나 대응 과학기술 뉴딜사업, 2020 과기원공동연구 프로젝트, 한국연구재단 바이오의료기술개발사업, 창의·도전연구 기반지원 사업 및 한국화학연구원 감염병 예방 융합 플랫폼 개발 과제 및 GO! KRICT 사업의 지원을 받아 수행됐다.
2023.07.01 조회수 7215
호흡기부터 강력 차단하는 코로나19 백신 개발
코로나바이러스감염증-19는 3년 4개월 만에 비상사태가 해제됐으나, 잦은 돌연변이로 인해 발생한 변이들이 계속해서 보고되고 있어 재유행이 시작될 가능성은 여전히 남아 있다. 이 변이들은 백신 접종이나 감염으로 인해 숙주가 획득한 기존의 면역반응을 회피하는 방향으로 진화하고 있다. 현재 시판되는 근육 접종 백신으로는 바이러스의 확산을 억제할 수 있는 점막 면역은 충분히 일으키기 어렵다는 한계가 있으므로 장기간 지속되는 강력한 점막 면역을 유도할 수 있는 백신의 필요성은 여전하다.
우리 대학 의과학대학원 이흥규 교수 연구팀과 한국화학연구원(원장 이영국)은 아데노바이러스 벡터 플랫폼의 비강 접종 코로나19 백신을 개발하고 마우스 모델을 이용해 이 백신이 장기간 지속되는 강력한 점막 면역을 유도함을 규명했다고 29일 밝혔다.
점막 면역이란 면역 체계를 구성하는 요소 중에서도 호흡기, 소화기, 생식기관 등을 구성하는 체내 상피 조직인 점막에서 작용하는 면역을 말한다. 이는 체내와 체외의 접점이 되는 점막에 침입한 외부 인자를 인지하고 제거해 인체를 감염으로부터 보호하는 방어체계다. 점막이 병원체나 외부 항원이 침입하는 주요 경로라는 점에서 점막 면역은 전신적 면역반응에 비해 병원체의 침입에 빠르게 대응해 감염 및 확산을 막을 수 있다는 장점이 있다.
의과학대학원 연수연구원 정희은 박사가 주도하고 박사과정 구근본, 강병훈 연구원, 김현철 박사, 박장현 박사 및 한국화학연구원 김균도 박사가 참여한 이번 연구에서 연구팀은 아데노바이러스 벡터 플랫폼을 기반으로, 개량된 스파이크 단백질 항원 및 인간 유래 면역증강제(CXCL9)을 탑재한 비강 접종 코로나19 백신(Ad5-S.Mod)을 개발해 그 효능을 실험용 쥐를 이용해 검증했다. 연구팀은 인간 유래 면역증강제가 활성화된 T세포를 특정 위치로 이동하도록 유인한다는 점에 주목해, 이를 백신의 효능을 높이기 위한 면역증강제로 이용하였다.
연구팀은 1회 단일 비강 접종, 혹은 근육-비강 2회 접종하여 백신의 효능을 검증했다. 그 결과 비강 백신이 호흡기 점막의 항체 반응 및 기억 T세포 반응을 높은 수준으로 유도할 수 있음을 확인하였으며, 백신 투여군은 1회 단일 접종만으로도 신종 코로나바이러스 감염 시 100% 생존하였다. 또한 백신 접종으로 만들어진 면역반응은 최소 1년간은 유지된다는 것을 규명해 백신의 강력한 점막 면역반응 유도 능력을 입증했다.
또한, 연구팀은 단일세포 전사체 분석법을 이용해 백신을 접종한 실험용 쥐의 폐 대식세포가 기억 T세포 및 B세포를 유지를 돕는 인자들의 주 생산자이며, 폐 대식세포가 제거되면 기억 T세포 및 B세포가 폐 속에서 확연히 감소함을 확인해 이 세포들이 점막 백신 접종으로 만들어진 호흡기 기억 세포의 유지를 돕고 있음을 규명했다.
이번 연구는 인간 유래 면역증강제(CXCL9)로서 활용해 백신의 효능을 강화한 새로운 백신 설계 전략을 제시하고 있다는 점과, 폐 대식세포가 점막 백신에 의해 형성되는 기억 면역반응을 유지하는 데 중요한 역할을 한다는 사실을 새로이 규명하여 다양한 병원체에 대한 비강 백신 개발에 이용할 수 있는 새로운 타겟을 제시하고 있다는 점에서 그 의의가 있다.
의과학대학원 박사후연수연구원 정희은 박사가 제1 저자로 참여한 이번 연구는 바이러스 분야 국제 학술지 `앤티바이럴 리서치(Antiviral Research)' 온라인판으로 6월 14일에 게재됐다. (논문명: Intranasal delivery of an adenovirus-vector vaccine co-expressing a modified spike protein and a genetic adjuvant confers lasting mucosal immunity against SARS-CoV-2, 논문링크: https://doi.org/10.1016/j.antiviral.2023.105656)
한편 이번 연구는 KAIST 코로나 대응 과학기술 뉴딜사업, 2020 과기원공동연구 프로젝트, 한국연구재단 바이오의료기술개발사업, 창의·도전연구 기반지원 사업 및 한국화학연구원 감염병 예방 융합 플랫폼 개발 과제 및 GO! KRICT 사업의 지원을 받아 수행됐다.
2023.07.01 조회수 7215 항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
2023.05.17 조회수 10350
항암 백신 찾는 ‘딥네오(DeepNeo)’ 개발
신생항원이란 암세포의 돌연변이에서 나온 단백질 조각 중 면역반응을 유도할 수 있는 항원들로서 항암 백신 개발의 이상적인 대상으로 주목받고 있다. 모더나 및 바이오엔텍은 암 치료를 위한 신생항원 백신용으로 개발하던 mRNA 플랫폼을 사용해 COVID-19 백신을 성공적으로 개발한 바 있으며, 현재 대규모 제약회사들과 함께 신생항원 암 백신 임상시험을 진행하고 있다. 이런 암 백신 개발을 위해 핵심적인 단계인 환자 맞춤형 신생항원 발굴에 활용될 인공지능 플랫폼이 개발되어 화제다.
우리 대학 바이오및뇌공학과 최정균 교수가 ㈜펜타메딕스와의 공동연구를 통해 개인 맞춤 치료용 암 백신에 사용될 수 있는 신생항원을 예측하는 인공지능(AI) 모델을 개발하고 웹서비스를 구축했다고 17일 밝혔다.
최정균 교수 연구팀은 딥러닝을 이용해 실제로 T 세포 면역반응을 유도할 수 있는 신생항원을 발굴하는 AI 모델을 개발했으며, 연구자들이 손쉽게 활용할 수 있는 웹서비스를 구축해 DeepNeo라는 이름으로 공개했다 (https://deepneo.net).
기존의 신생항원 발굴 방법론은 MHC* 단백질과 결합할 수 있는 돌연변이를 예측하는 데에 한정되어 있었다. 그러나 암 백신이 효과가 있으려면 돌연변이가 MHC와 결합할 뿐만 아니라 그 결합체가 실제로 T 세포 면역반응을 유발할 수 있어야 하는데, 기존 기술로는 그것이 불가능했다. 따라서 현재 암 백신 임상시험들은 이 결합체들이 실제로 면역반응을 자극할 수 있는지를 알 수 없는 상태로 진행되고 있다.
*MHC란 외부에서 들어온 병원균이나 암세포에서 발생한 항원과 결합하여 우리 몸의 면역세포에 제시해 줌으로써 면역반응을 활성화시키는 역할을 하는 단백질을 일컬음
연구팀은 이러한 문제를 해결하기 위해 새로운 개념의 딥러닝 모델을 구축했고, 여러 빅데이터 분석을 통하여 면역성 및 항암 반응성이 뛰어난 신생항원을 발굴할 수 있음을 확인했다. 따라서 이번에 웹서비스 형태로 구축한 방법론은T 세포 반응을 효과적으로 유도할 수 있는 항암 백신 개발에 활용될 수 있다.
우리 대학 바이오및뇌공학과 김정연 박사과정이 제1 저자로 개발한 핵심 알고리즘은 지난 1월 국제 학술지 ‘네이처 지네틱스(Nature Genetics)’ 에 출판됐으며, 이후 ㈜펜타메딕스의 노승재 박사, 방효은 연구원과의 공동연구를 통해 딥러닝 성능이 더욱 개선된 AI 모델이 웹서비스 형태로 개발돼 이번 4월 국제 학술지 ‘핵산 연구(Nucleic Acids Research)’를 통해 공개됐다.
최정균 교수는 “코로나 백신에서 mRNA 플랫폼이 검증된 만큼 이번에 개발된 AI 기술이 암 백신의 상용화에도 도움이 되기를 희망한다.”고 밝혔다. ㈜펜타메딕스 조대연 대표는 “이번 공동연구를 통해 개발된 플랫폼을 적용한 개인맞춤형 암 백신의 사업화에 박차를 가하겠다”고 전했다.
이번 연구는 한국연구재단 기초연구실지원사업의 지원을 받아 수행됐다.
2023.05.17 조회수 10350 코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07 조회수 14567
코로나19 회복 후, 장기간 유지되는 기억 T세포 규명
우리 대학 의과학대학원 신의철 교수 연구팀이 고려대 안산병원 최원석 교수, 충북대병원 정혜원 교수와의 공동연구를 통해 코로나19 회복자들에서 기억 T세포가 10개월 동안 잘 유지되며, 특히 줄기세포 유사 기억세포가 효율적으로 잘 발생함을 규명했다고 7일 밝혔다. 이는 중증 코로나19에 대해 방어를 하는 기억 T세포가 장기간 유지될 것을 제시하는 연구 결과다.
코로나19에 한 번 걸렸다 회복되면 이에 대항하는 방어면역이 형성된다. 그리고 이러한 방어면역의 양대 축으로 중화항체와 기억 T세포가 존재함이 알려져 왔다. 하지만 코로나19 바이러스에 대한 중화항체는 시간이 지남에 따라 감소하는 것으로 알려져, 최근에는 기억 T세포에 관한 관심이 증대되고 있다.
기억 T세포는 코로나19 감염 자체를 예방하지는 못하지만, 중증 코로나19로의 진행을 막는 것으로 알려진 중요한 면역세포다. 하지만, 코로나19 회복자에서 기억 T세포가 얼마나 오래 유지될 수 있는지, 그리고 그 기능도 오랜 기간 잘 유지되는지는 명확히 알려진 바가 없었다.
이번 연구에서 KAIST-고려대안산병원-충북대병원 공동연구팀은 한국인 코로나19 회복자들을 대상으로 10개월 동안 추적 연구를 수행해, 코로나19 바이러스에 대항하는 기억 T세포가 어떤 특성을 보이는지, 그리고 얼마나 오랫동안 유지되는지 등 지금까지 명확히 알려지지 않았던 질문들에 대한 답을 구했다. 특히 이번 연구에서는 최첨단 면역학 연구기법을 활용해, 기억 T세포의 장기 유지에 중요한 줄기세포 유사 기억 T세포의 발생을 분석하고, 한 번에 여러 가지 기능을 나타내는 다기능성 기억 T세포의 존재를 분석했다.
공동연구팀은 코로나19 회복 직후부터 나타나는 기억 T세포가 10개월의 추적관찰 동안 잘 유지됨을 밝혔다. 특히 이러한 기억 T세포 유지는 애초에 걸렸던 코로나19의 경증/중증 여부와는 상관없이 대부분의 회복자들에게서 잘 나타남을 확인했다. 그리고 10개월이 지난 후에도 다시 코로나19 바이러스 항원을 만나면 기억 T세포는 증식을 활발히 하며 한 번에 여러 가지 기능을 수행하는 다기능성을 잘 나타냄도 확인했다. 이러한 결과는 회복자가 코로나19 바이러스에 다시 노출됐을 때 기억 T세포들의 방어면역 기능이 잘 나타날 것임을 시사하는 결과다.
특히, 코로나19 회복자들에서 줄기세포 유사 기억 T세포가 잘 발생함을 규명했다. 줄기세포 유사 기억 T세포는 장기간에 걸쳐 기억 T세포들의 숫자를 유지해주는 재생기능을 가진 세포로서, 이번 연구 결과는 코로나19 회복자들의 기억 T세포가 상당히 오랜 기간 동안 잘 유지될 것임을 기대하게 하는 연구 결과다. 특히 이번 연구는 코로나19 회복 후 세계 처음으로 줄기세포 유사 기억 T세포의 발생을 보고한 것으로 세계 면역학계의 주목을 받고 있다.
삼성미래기술육성재단과 KAIST의 지원을 받아 수행한 공동연구팀의 이번 연구 결과는 국제 저명 학술지인 네이처 커뮤니케이션스(Nature Communications)誌 6월 30일 字에 게재됐다(논문명: SARS-CoV-2-specific T cell memory is sustained in COVID-19 convalescent patients for 10 months with successful development of stem cell-like memory T cells).
연구팀은 코로나19 회복자들의 장기 방어면역을 확인함과 동시에, 현재 사용되고 있는 상용화된 코로나19 백신들의 효능 평가와 추후 백신 개발의 핵심 목표 중 하나인 T세포 방어면역 장기 지속성에 대한 지표를 제시한 점에 관해 연구 의미를 부여했다.
공동연구팀은 현재 코로나19 백신을 접종받은 사람들의 기억 T세포 형성 및 기능 특성을 규명함과 동시에 코로나19 회복자들의 기억 T세포와의 비교를 통해 백신의 면역학적 효과를 파악하는 후속 연구를 진행하고 있다.
이번 연구의 제1 저자인 정재형 우리 대학 박사과정 연구원과 나민석 박사후 연구원(現 연세의대 임상강사)은 "코로나19로부터 회복 후 최대 10개월까지도 기억 T세포 면역반응이 유지됨을 확인했다ˮ며 "이러한 방어면역 지속성에 중요한 역할을 할 것으로 예측되는 줄기세포 유사 기억 T세포의 특성 및 기능 규명을 통해 재감염의 이해 및 코로나19 백신에 의한 기억 T세포 평가의 중요 지표를 마련했다ˮ고 설명했다.
신의철 교수는 "이번 연구는 코로나19 회복자의 기억 T세포 기능 및 특성을 세계에서 최장기간 연구한 결과로서 시간에 따른 방어면역 분석을 통해 향후 최적화된 차세대 백신 개발 전략을 설계할 수 있는 토대를 마련했다는 점에서 의미가 있는 연구ˮ라고 말했다.
2021.07.07 조회수 14567 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 25069
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 25069 진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25 조회수 17533
진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25 조회수 17533 박수형 교수, 중증열성혈소판감소증후군 예방 백신 개발
〈 박수형 교수 〉
우리 대학 의과학대학원 박수형 교수 연구팀이 일명 살인진드기병으로 불리는 중증열성혈소판감소증후군(SFTS) 바이러스 감염을 예방하는 백신을 개발했다.
충북대학교 의과대학 최영기 교수와 진원생명과학(주)이 함께 참여한 공동 연구팀은 개발한 백신이 감염 동물모델 실험을 통해 중증열성혈소판감소증후군 바이러스 감염을 완벽하게 억제할 수 있음을 증명했다.
이번 연구를 통해 예방 백신 도출 및 검증 성과뿐 아니라 면역학적 관점에서 백신의 감염 예방 효능을 극대화할 수 있는 항원을 제시함으로써, 추후 중증열성혈소판감소증후군 바이러스에 대한 대응 전략 확립 및 연구에 기여할 것으로 기대된다.
곽정은 박사과정과 충북대학교 김영일 박사가 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 23일 자 온라인판에 게재됐다. (논문명 : Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets)
흔히 살인진드기병으로 알려진 SFTS는 SFTS 바이러스에 감염된 매개 진드기에 물려 발생하는 신종 감염병으로, 최근 발생 빈도 및 지역의 확산으로 WHO에서도 주의해야 할 10대 신, 변종 바이러스 감염병으로 지정한 질병이다.
일반적으로 6~14일의 잠복기 후 고열(38∼40℃)이 3~10일 이어지고, 혈소판 감소 및 백혈구 감소와 구토, 설사 등 소화기 증상이 발생하며, 일부 사례에서는 중증으로 진행돼 사망에 이르기도 한다.
2013년에 한국에서 처음으로 환자가 발생한 이래 발생 건수가 매년 꾸준히 증가하고 있지만, 진드기 접촉 최소화를 통한 예방이 제시될 뿐 현재까지 예방 백신이 개발되지 않았다.
연구팀은 31종의 서로 다른 SFTS 바이러스의 유전자 서열로부터 공통 서열을 도출해 백신 항원을 설계하고, 진원생명과학의 플랫폼을 이용해 DNA 백신을 제작했다.
DNA 백신 기술은 기존 백신과 달리 바이러스 자체가 아닌 유전자만을 사용해 안전하고 기존 백신 대비 광범위한 면역 반응을 유도할 수 있다는 장점이 있다.
연구팀은 감염 동물모델인 패럿에서 백신이 감염을 완벽하게 억제하며 소화기 증상, 혈소판 및 백혈구 감소, 고열, 간 수치 상승 등 감염 환자에서 발생하는 임상 증상들 역시 관찰되지 않음을 확인했다.
특히 연구팀은 해당 바이러스의 전체 유전자에 대한 5종의 백신을 구상해 SFTS 예방 백신 개발에 대한 전략적 접근법을 제시했다.
연구팀은 수동전달 기법(passive transfer)을 통해 바이러스의 당단백질에 대한 항체 면역 반응이 감염억제에 주요한 역할을 함을 규명했다. 또한, 비-당단백질에 대한 T세포 면역 반응 역시 감염 예방에 기여할 수 있음을 밝혔다.
박 교수는 “이번 연구는 SFTS 바이러스 감염을 완벽하게 방어할 수 있는 백신을 최초로 개발하고, 생쥐 모델이 아닌 환자의 임상 증상과 같게 발생하는 패럿 동물모델에서 완벽한 방어효능을 증명했다는 중요한 의의가 있다”라고 말했다.
최 교수는 “이번 SFTS 바이러스 백신 개발 연구 성과는 국제적으로 SFTS 백신 개발을 위한 기술적 우위를 확보했다는 중요한 의의가 있으며, 연구결과를 바탕으로 지속적인 연구를 통해 SFTS 바이러스 백신의 상용화에 기여할 수 있을 것이다”라고 말했다.
향후 임상개발은 이번 연구에 함께 참여한 DNA 백신 개발 전문기업인 진원생명과학(주)을 통해 진행할 계획이다.
이번 연구는 보건복지부 감염병위기대응기술개발사업의 지원을 받아 수행됐다.
2019.08.28 조회수 18826
박수형 교수, 중증열성혈소판감소증후군 예방 백신 개발
〈 박수형 교수 〉
우리 대학 의과학대학원 박수형 교수 연구팀이 일명 살인진드기병으로 불리는 중증열성혈소판감소증후군(SFTS) 바이러스 감염을 예방하는 백신을 개발했다.
충북대학교 의과대학 최영기 교수와 진원생명과학(주)이 함께 참여한 공동 연구팀은 개발한 백신이 감염 동물모델 실험을 통해 중증열성혈소판감소증후군 바이러스 감염을 완벽하게 억제할 수 있음을 증명했다.
이번 연구를 통해 예방 백신 도출 및 검증 성과뿐 아니라 면역학적 관점에서 백신의 감염 예방 효능을 극대화할 수 있는 항원을 제시함으로써, 추후 중증열성혈소판감소증후군 바이러스에 대한 대응 전략 확립 및 연구에 기여할 것으로 기대된다.
곽정은 박사과정과 충북대학교 김영일 박사가 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 23일 자 온라인판에 게재됐다. (논문명 : Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets)
흔히 살인진드기병으로 알려진 SFTS는 SFTS 바이러스에 감염된 매개 진드기에 물려 발생하는 신종 감염병으로, 최근 발생 빈도 및 지역의 확산으로 WHO에서도 주의해야 할 10대 신, 변종 바이러스 감염병으로 지정한 질병이다.
일반적으로 6~14일의 잠복기 후 고열(38∼40℃)이 3~10일 이어지고, 혈소판 감소 및 백혈구 감소와 구토, 설사 등 소화기 증상이 발생하며, 일부 사례에서는 중증으로 진행돼 사망에 이르기도 한다.
2013년에 한국에서 처음으로 환자가 발생한 이래 발생 건수가 매년 꾸준히 증가하고 있지만, 진드기 접촉 최소화를 통한 예방이 제시될 뿐 현재까지 예방 백신이 개발되지 않았다.
연구팀은 31종의 서로 다른 SFTS 바이러스의 유전자 서열로부터 공통 서열을 도출해 백신 항원을 설계하고, 진원생명과학의 플랫폼을 이용해 DNA 백신을 제작했다.
DNA 백신 기술은 기존 백신과 달리 바이러스 자체가 아닌 유전자만을 사용해 안전하고 기존 백신 대비 광범위한 면역 반응을 유도할 수 있다는 장점이 있다.
연구팀은 감염 동물모델인 패럿에서 백신이 감염을 완벽하게 억제하며 소화기 증상, 혈소판 및 백혈구 감소, 고열, 간 수치 상승 등 감염 환자에서 발생하는 임상 증상들 역시 관찰되지 않음을 확인했다.
특히 연구팀은 해당 바이러스의 전체 유전자에 대한 5종의 백신을 구상해 SFTS 예방 백신 개발에 대한 전략적 접근법을 제시했다.
연구팀은 수동전달 기법(passive transfer)을 통해 바이러스의 당단백질에 대한 항체 면역 반응이 감염억제에 주요한 역할을 함을 규명했다. 또한, 비-당단백질에 대한 T세포 면역 반응 역시 감염 예방에 기여할 수 있음을 밝혔다.
박 교수는 “이번 연구는 SFTS 바이러스 감염을 완벽하게 방어할 수 있는 백신을 최초로 개발하고, 생쥐 모델이 아닌 환자의 임상 증상과 같게 발생하는 패럿 동물모델에서 완벽한 방어효능을 증명했다는 중요한 의의가 있다”라고 말했다.
최 교수는 “이번 SFTS 바이러스 백신 개발 연구 성과는 국제적으로 SFTS 백신 개발을 위한 기술적 우위를 확보했다는 중요한 의의가 있으며, 연구결과를 바탕으로 지속적인 연구를 통해 SFTS 바이러스 백신의 상용화에 기여할 수 있을 것이다”라고 말했다.
향후 임상개발은 이번 연구에 함께 참여한 DNA 백신 개발 전문기업인 진원생명과학(주)을 통해 진행할 계획이다.
이번 연구는 보건복지부 감염병위기대응기술개발사업의 지원을 받아 수행됐다.
2019.08.28 조회수 18826 항생제 남용이 바이러스 방어능력을 약화시킨다
〈 이 흥 규 교수 〉
□ 미래창조과학부(장관 최양희)는 항생제 남용에 의한 체내 공생미생물의 불균형이 헤르페스 바이러스 방어 면역에 끼치는 영향에 대한 기전을 국내 연구진이 처음 규명하였다”고 밝혔다.
□ 우리 대학 이흥규 교수 연구팀은 미래창조과학부와 한국연구재단의 기초연구실지원사업의 지원을 받아 연구를 수행하였으며, 연구결과는 자연과학분야의 세계적인 국제학술지「미국국립과학원회보(PNAS)」온라인판 1월 25일자에 게재되었다.
o 논문명과 저자 정보는 다음과 같다.
- <논문명> Dysbiosis-induced IL-33 contributes to impaired antiviral immunity in the genital mucosa - <저자 정보> 교신저자: 이흥규교수 (KAIST), 제 1저자: 오지은박사 (KAIST), 공동저자: 김병찬박사 (한국생명공학연구원), 강덕진박사 (한국표준과학연구원), 김진영박사 (한국기초과학지원연구원), 유제욱교수 (연세대) 등
□ 논문의 주요 내용은 다음과 같다.
1. 연구의 필요성 ○ 공생미생물은 우리 몸에 상재하는 다양한 미생물의 군집으로, 우리몸의 건강유지에 필수적인 다양한 역할을 수행하는 것이 알려져 왔다. 특히 공생미생물의 불균형이 염증성 장질환을 비롯하여 다양한 질환 (ex. 알레르기, 비만, 당뇨, 암 등)의 발병에 기여한다는 것이 밝혀지면서 공생미생물이 우리몸의 건강과 질환 발병에 끼치는 영향에 대한 연구의 필요성이 대두되고 있다.
2. 발견 원리 ○ 이흥규 교수 연구팀은 헤르페스 바이러스 감염을 비롯한 다양한 바이러스 감염 시 체내 면역시스템의 방어기작에 대한 연구를 지속해 왔다. 본 연구에서는 항생제 남용으로 인한 여성생식기의 공생미생물의 불균형이 질점막을 통한 헤르페스 바이러스 감염에 대한 호스트의 방어능력을 현저히 약화시키며 그 기전이 무엇인지를 규명하였다.
○ 특히 본 연구에서는 항생제로 인한 유익한 미생물의 감소와 해로운 미생물의 증가가 마우스의 질점막에서 IL-33의 대량생산을 유도하여, 항바이러스 면역에 필수적인 인터페론 감마 (IFN-γ)를 생산하는 T세포가 감염부위로 적절하게 이동하는 것을 억제함으로써 헤르페스 바이러스 감염에 대한 방어능력을 약화시킨다는 것을 세계 최초로 보여주었다.
○ 또한 항생제를 투여한 마우스의 질세척액에서 다양한 조직손상 및 염증반응에 관계된 물질이 증가한 것을 발견하였으며, 항생제 투여로 인해 증가한 해로운 미생물이 질 내에서 단백질 분해효소를 분비하여 질 상피세포의 손상을 유도함으로써 조직손상을 반영하는 물질 중 하나인 IL-33 의 분비를 촉진시켰을 가능성을 제시하였다.
3. 연구 성과
○ 본 연구는 항생제 남용이 초래하는 공생미생물의 불균형이 바이러스 감염에 대한 방어능력을 현저히 약화시키는 것을 직접적으로 증명함으로써, 항생제 남용에 대한 경각심을 일깨울 수 있을 것이라 기대된다.
○ 또한 공생미생물의 불균형에 의해 질점막에서 분비되는 IL-33과 같은 물질이 감염에 대한 방어능력을 평가할 수 있는 지표로 활용될 수 있을 것으로 기대된다.
○ 체내 공생미생물을 우리 몸에 유익하도록 조절함으로써 방어능력이 향상된 바이러스 치료제 및 백신 개발에 기여할 수 있을 것으로 기대된다.
□ 이흥규 교수는 “항생제 남용이 인체에 해로운 영향을 준다는 것이 막연하게 알려져 있었는데, 어떻게 해로운지 명확하게 규명되지는 않았다”며, “이번 연구는 체내 공생미생물의 불균형으로 인해 여러 바이러스 감염이 악화될 수 있음을 밝혀냄으로써 앞으로 백신 및 치료제 개발에 도움을 줄 것으로 기대된다.”고 연구의 의의를 설명했다.
□ 그림 설명
그림1. 항생제의 남용으로 질내 유익한 공생미생물이 감소하고 해로운 미생물이 증가함으로써 질점막을 통한 헤르페스 바이러스 감염에 더 취약하게 되는 기전이 밝혀짐
.
2016.02.26 조회수 13926
항생제 남용이 바이러스 방어능력을 약화시킨다
〈 이 흥 규 교수 〉
□ 미래창조과학부(장관 최양희)는 항생제 남용에 의한 체내 공생미생물의 불균형이 헤르페스 바이러스 방어 면역에 끼치는 영향에 대한 기전을 국내 연구진이 처음 규명하였다”고 밝혔다.
□ 우리 대학 이흥규 교수 연구팀은 미래창조과학부와 한국연구재단의 기초연구실지원사업의 지원을 받아 연구를 수행하였으며, 연구결과는 자연과학분야의 세계적인 국제학술지「미국국립과학원회보(PNAS)」온라인판 1월 25일자에 게재되었다.
o 논문명과 저자 정보는 다음과 같다.
- <논문명> Dysbiosis-induced IL-33 contributes to impaired antiviral immunity in the genital mucosa - <저자 정보> 교신저자: 이흥규교수 (KAIST), 제 1저자: 오지은박사 (KAIST), 공동저자: 김병찬박사 (한국생명공학연구원), 강덕진박사 (한국표준과학연구원), 김진영박사 (한국기초과학지원연구원), 유제욱교수 (연세대) 등
□ 논문의 주요 내용은 다음과 같다.
1. 연구의 필요성 ○ 공생미생물은 우리 몸에 상재하는 다양한 미생물의 군집으로, 우리몸의 건강유지에 필수적인 다양한 역할을 수행하는 것이 알려져 왔다. 특히 공생미생물의 불균형이 염증성 장질환을 비롯하여 다양한 질환 (ex. 알레르기, 비만, 당뇨, 암 등)의 발병에 기여한다는 것이 밝혀지면서 공생미생물이 우리몸의 건강과 질환 발병에 끼치는 영향에 대한 연구의 필요성이 대두되고 있다.
2. 발견 원리 ○ 이흥규 교수 연구팀은 헤르페스 바이러스 감염을 비롯한 다양한 바이러스 감염 시 체내 면역시스템의 방어기작에 대한 연구를 지속해 왔다. 본 연구에서는 항생제 남용으로 인한 여성생식기의 공생미생물의 불균형이 질점막을 통한 헤르페스 바이러스 감염에 대한 호스트의 방어능력을 현저히 약화시키며 그 기전이 무엇인지를 규명하였다.
○ 특히 본 연구에서는 항생제로 인한 유익한 미생물의 감소와 해로운 미생물의 증가가 마우스의 질점막에서 IL-33의 대량생산을 유도하여, 항바이러스 면역에 필수적인 인터페론 감마 (IFN-γ)를 생산하는 T세포가 감염부위로 적절하게 이동하는 것을 억제함으로써 헤르페스 바이러스 감염에 대한 방어능력을 약화시킨다는 것을 세계 최초로 보여주었다.
○ 또한 항생제를 투여한 마우스의 질세척액에서 다양한 조직손상 및 염증반응에 관계된 물질이 증가한 것을 발견하였으며, 항생제 투여로 인해 증가한 해로운 미생물이 질 내에서 단백질 분해효소를 분비하여 질 상피세포의 손상을 유도함으로써 조직손상을 반영하는 물질 중 하나인 IL-33 의 분비를 촉진시켰을 가능성을 제시하였다.
3. 연구 성과
○ 본 연구는 항생제 남용이 초래하는 공생미생물의 불균형이 바이러스 감염에 대한 방어능력을 현저히 약화시키는 것을 직접적으로 증명함으로써, 항생제 남용에 대한 경각심을 일깨울 수 있을 것이라 기대된다.
○ 또한 공생미생물의 불균형에 의해 질점막에서 분비되는 IL-33과 같은 물질이 감염에 대한 방어능력을 평가할 수 있는 지표로 활용될 수 있을 것으로 기대된다.
○ 체내 공생미생물을 우리 몸에 유익하도록 조절함으로써 방어능력이 향상된 바이러스 치료제 및 백신 개발에 기여할 수 있을 것으로 기대된다.
□ 이흥규 교수는 “항생제 남용이 인체에 해로운 영향을 준다는 것이 막연하게 알려져 있었는데, 어떻게 해로운지 명확하게 규명되지는 않았다”며, “이번 연구는 체내 공생미생물의 불균형으로 인해 여러 바이러스 감염이 악화될 수 있음을 밝혀냄으로써 앞으로 백신 및 치료제 개발에 도움을 줄 것으로 기대된다.”고 연구의 의의를 설명했다.
□ 그림 설명
그림1. 항생제의 남용으로 질내 유익한 공생미생물이 감소하고 해로운 미생물이 증가함으로써 질점막을 통한 헤르페스 바이러스 감염에 더 취약하게 되는 기전이 밝혀짐
.
2016.02.26 조회수 13926 금 알갱이로 항암백신을 만들다
- 앙게반테 케미지 발표,“백신 위치를 추적할 수 있으면서 효능도 탁월한 나노항암백신 개발”
매우 작은 금 알갱이(금 나노입자, 지름이 10억분의 1미터)를 이용해 위치를 추적할 수 있으면서 암을 예방‧치료할 수 있는 효능도 탁월한 항암백신기술이 국내 연구진에 의해 개발되었다.
우리 학교 전상용 교수(42세)가 주도하고 이인현 박사(제1저자) 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △선도연구센터 △신기술융합형성장동력 △바이오의료기술개발 사업의 지원으로 수행되었고, 연구결과는 독일화학회가 발간하는 화학분야의 권위 있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’지 7월호(7월 29일)에 게재되었다.
특히 이번 성과는 상위 5%이내 논문에만 수여하는 VIP(Very Important Paper)로 선정되는 영예를 얻었다. (논문명 : Imageable Antigen-Presenting Gold Nanoparticle Vaccines for Effective Cancer Immunotherapy In Vivo)
암은 현대의학이 정복하지 못한 대표적인 난치성 질환 중 하나이다. 전 세계적으로 연간 3천만 명의 암 환자가 발생하고 있고, 특히 우리나라에서는 매년 사망원인 1위를 차지하고 있다.
암을 효과적으로 치료하기 위해서 부작용(정상세포까지 죽이는 세포독성)을 최소화하면서도 효과를 극대화할 수 있는 면역치료법(백신)이 전 세계적으로 각광받고 있다. 지금까지 백신은 독감에서부터 난치성 질환인 백혈병에 이르기까지 인류의 다양한 질병을 예방‧치료하는데 활용되어왔다.
그러나 기존 대부분의 항암백신은 몸 밖에서 환자의 암 조직 파편 등으로 사람의 면역세포를 활성화한 후, 다시 그 면역세포를 몸속에 넣어 항암 면역반응을 유도함으로써 암을 치료하는 기술이다. 이렇게 하면 여러 단계의 백신 제조과정을 거치게 되고, 치료비도 비싼 것이 단점이다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어, 치료효과를 예측하고 가늠할 수 없었다.
전상용 교수 연구팀은 기존 항암백신과는 달리 일반적인 근육주사로 면역세포들이 많이 모여 있는 국소 림프절을 통해 금 나노입자 백신을 효과적으로 전달하여, 항체를 생산하고 항암 면역반응을 유도함으로써 암을 예방‧치료하는데 이용할 수 있는 핵심원천기술을 개발하였다.
또한 병원에서 진단용으로 많이 사용하는 엑스레이 등의 영상기기를 이용해 주입한 금 나노입자 백신을 추적하여, 백신이 목표하는 곳에 제대로 도달하였는지를 직접 확인할 수 있어 향후 개발될 새로운 백신의 효과를 예측할 수 있다는 점이 큰 특징이다.
전 교수팀은 우선 금 나노입자 표면에 모델 암 항원(RFP 단백질)을 화학적으로 결합한 후, 추가적으로 면역보조제(DNA 단편)도 결합하여 금 나노백신 원천기술을 개발하였다.
이 금 나노백신을 몸에 넣으면 국소 림프절로 선택적으로 이동하여 해당 암에 특이적인 항체 생산을 촉진하고, 암세포를 제거할 수 있는 항암 면역세포도 활성화시켜 우수한 항암 효능을 나타낸다.
또한 연구팀은 동물실험을 통해 금 나노백신이 암을 예방할 뿐만 아니라, 이미 존재하는 암의 성장과 전이도 효과적으로 막을 수 있음을 증명하였다.
전상용 교수는 “이번 연구는 금 나노입자를 이용하면 몸속에 투여한 백신을 쉽게 추적할 수 있고, 기존의 백신에 비해 복잡한 과정 없이도 쉽게 면역세포를 활성화할 수 있어 효과적으로 암을 치료할 수 있는 가능성을 보였다. 특히 이 원천 기반기술은 각종 암뿐만 아니라 현재 임상적으로 치료가 어려운 다양한 바이러스성 질환에도 폭넓게 이용될 수 있을 것으로 기대된다”고 연구의의를 밝혔다.
2012.08.16 조회수 18447
금 알갱이로 항암백신을 만들다
- 앙게반테 케미지 발표,“백신 위치를 추적할 수 있으면서 효능도 탁월한 나노항암백신 개발”
매우 작은 금 알갱이(금 나노입자, 지름이 10억분의 1미터)를 이용해 위치를 추적할 수 있으면서 암을 예방‧치료할 수 있는 효능도 탁월한 항암백신기술이 국내 연구진에 의해 개발되었다.
우리 학교 전상용 교수(42세)가 주도하고 이인현 박사(제1저자) 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △선도연구센터 △신기술융합형성장동력 △바이오의료기술개발 사업의 지원으로 수행되었고, 연구결과는 독일화학회가 발간하는 화학분야의 권위 있는 학술지인 ‘앙게반테 케미(Angewandte Chemie)’지 7월호(7월 29일)에 게재되었다.
특히 이번 성과는 상위 5%이내 논문에만 수여하는 VIP(Very Important Paper)로 선정되는 영예를 얻었다. (논문명 : Imageable Antigen-Presenting Gold Nanoparticle Vaccines for Effective Cancer Immunotherapy In Vivo)
암은 현대의학이 정복하지 못한 대표적인 난치성 질환 중 하나이다. 전 세계적으로 연간 3천만 명의 암 환자가 발생하고 있고, 특히 우리나라에서는 매년 사망원인 1위를 차지하고 있다.
암을 효과적으로 치료하기 위해서 부작용(정상세포까지 죽이는 세포독성)을 최소화하면서도 효과를 극대화할 수 있는 면역치료법(백신)이 전 세계적으로 각광받고 있다. 지금까지 백신은 독감에서부터 난치성 질환인 백혈병에 이르기까지 인류의 다양한 질병을 예방‧치료하는데 활용되어왔다.
그러나 기존 대부분의 항암백신은 몸 밖에서 환자의 암 조직 파편 등으로 사람의 면역세포를 활성화한 후, 다시 그 면역세포를 몸속에 넣어 항암 면역반응을 유도함으로써 암을 치료하는 기술이다. 이렇게 하면 여러 단계의 백신 제조과정을 거치게 되고, 치료비도 비싼 것이 단점이다. 또한 몸속에 주입한 백신이 원하는 곳에 얼마나 도달했는지 추적할 수 없어, 치료효과를 예측하고 가늠할 수 없었다.
전상용 교수 연구팀은 기존 항암백신과는 달리 일반적인 근육주사로 면역세포들이 많이 모여 있는 국소 림프절을 통해 금 나노입자 백신을 효과적으로 전달하여, 항체를 생산하고 항암 면역반응을 유도함으로써 암을 예방‧치료하는데 이용할 수 있는 핵심원천기술을 개발하였다.
또한 병원에서 진단용으로 많이 사용하는 엑스레이 등의 영상기기를 이용해 주입한 금 나노입자 백신을 추적하여, 백신이 목표하는 곳에 제대로 도달하였는지를 직접 확인할 수 있어 향후 개발될 새로운 백신의 효과를 예측할 수 있다는 점이 큰 특징이다.
전 교수팀은 우선 금 나노입자 표면에 모델 암 항원(RFP 단백질)을 화학적으로 결합한 후, 추가적으로 면역보조제(DNA 단편)도 결합하여 금 나노백신 원천기술을 개발하였다.
이 금 나노백신을 몸에 넣으면 국소 림프절로 선택적으로 이동하여 해당 암에 특이적인 항체 생산을 촉진하고, 암세포를 제거할 수 있는 항암 면역세포도 활성화시켜 우수한 항암 효능을 나타낸다.
또한 연구팀은 동물실험을 통해 금 나노백신이 암을 예방할 뿐만 아니라, 이미 존재하는 암의 성장과 전이도 효과적으로 막을 수 있음을 증명하였다.
전상용 교수는 “이번 연구는 금 나노입자를 이용하면 몸속에 투여한 백신을 쉽게 추적할 수 있고, 기존의 백신에 비해 복잡한 과정 없이도 쉽게 면역세포를 활성화할 수 있어 효과적으로 암을 치료할 수 있는 가능성을 보였다. 특히 이 원천 기반기술은 각종 암뿐만 아니라 현재 임상적으로 치료가 어려운 다양한 바이러스성 질환에도 폭넓게 이용될 수 있을 것으로 기대된다”고 연구의의를 밝혔다.
2012.08.16 조회수 18447