%EB%B9%8C%EB%A6%AC%EB%A3%A8%EB%B9%88
-
 나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 6754
나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 6754 -
 전상용 교수, 인체 담석형성반응 이용한 항암치료 시스템 개발
〈 전상용 교수, 이동윤 박사과정 〉
우리 대학 생명과학과 전상용 교수 연구팀이 인간 체내의 물질을 이용해 광학영상 진단 및 광열 치료가 가능한 항암시스템을 개발했다.
연구팀은 빌리루빈이라는 체내 물질과 그 빌리루빈으로 인해 발생하는 담석형성반응을 응용했다. 인체 내 강력한 항산화제인 빌리루빈의 담석 형성 과정에서 관찰되는 자체 금속 결합 기능과 신생아 황달 치료에 쓰이는 푸른빛에 반응하는 성질을 동시에 이용했다.
이를 통해 높은 생체 적합성과 우수한 광음향 진단 기능 및 광열 치료 효능을 보여 항암 치료 분야에서 적합한 치료 시스템이 될 것으로 기대된다.
이동윤 박사과정이 1저자로 참여한 이번 연구는 응용화학분야 저명학술지 앙케반테 케미(Angewandte Chemie International Edition) 9월 4일자 온라인 판에 게재됐다.
전 교수 연구팀은 과거 연구에서 물과 화합하지 않는 소수성을 갖는 빌리루빈과, 그 반대로 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’ 기반의 나노입자 시스템을 개발한 경험이 있다.
이는 빌리루빈의 항산화 기능을 그대로 유지하면서 체내로 축적되지 않게 해 빌리루빈의 장점만을 취하는 기술이다. 이를 바탕으로 염증성 장 질환, 허혈/재관류, 췌도세포 이식, 천식 등의 동물 질병 모델에서 효능 및 안정성을 확인했다.
이번 연구에서는 앞선 연구의 접근 방식과 다르게 빌리루빈이 갖고 있는 다른 물리 화학적 성질을 이용해 항암 치료에 적용했다.
먼저 황달의 주요 원인체인 노란색 빌리루빈에 특정 파장대의 빛(푸른 빛)을 쬐어주면 이에 반응해 광이성질체(빛에 의해 모양이 변형된 물체)가 되고 배설이 활성화돼 신생아 황달 치료에 널리 쓰일 수 있는 광학물질인 점을 첫 번째 근거로 활용했다.
두 번째로는 인체 내의 쓸개관 혹은 쓸개 등에서 병이 생길 때 종종 발견할 수 있는 검은 색소 담석의 주성분 또한 빌리루빈이라는 점에 주목했다. 빌리루빈이 칼슘이나 구리 등 양이온과 중간 매개체 없이도 결합할 때 검은 색소 담석이 형성되는 점을 응용했다.
연구팀은 구리나 칼슘 대신 시스플라틴이라는 백금 금속 기반 항암제와 빌리루빈을 결합해 노란색의 빌리루빈을 보라색의 복합체로 변환시켰다.
이후 근적외선 파장대의 빛을 쬐었을 때 기존에 비해 크게 향상된 광감응성을 보였고, 실제 정맥 주사된 대장암 동물 모델에서도 종양 부분에서의 유의미한 광음향 신호 증가를 확인했다. 이 기술로 향후 더 향상된 종양 진단을 할 수 있을 것으로 기대된다.
또한 종양 부위에 근적외선 빛을 쬐었을 때 광열 효과에 의해 5분 내에 25℃ 이상의 온도 상승을 확인했고, 2주 후 다른 그룹에 비해 종양 크기의 감소 및 괴사를 확인했다.
전 교수는 “현재 개발된 물질들은 생체 적합성이 낮고 잠재적 생체 독성 가능성이 있는 인공소재 위주이기 때문에 임상으로 이어지는 데 한계가 있었다”며 “이번에 개발한 인체 유래 빌리루빈 기반의 광학물질은 광음향 영상 및 광열 치료의 전임상 중개연구 및 임상 적용에 새로운 플랫폼이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈의 담석형성반응 및 광감응성을 이용한 본 연구의 모식도
그림2. 빌리루빈 나노입자 (왼쪽)와 시스플라틴이 결합된 빌리루빈 나노입자 (오른쪽) 수용액
2017.09.20 조회수 21196
전상용 교수, 인체 담석형성반응 이용한 항암치료 시스템 개발
〈 전상용 교수, 이동윤 박사과정 〉
우리 대학 생명과학과 전상용 교수 연구팀이 인간 체내의 물질을 이용해 광학영상 진단 및 광열 치료가 가능한 항암시스템을 개발했다.
연구팀은 빌리루빈이라는 체내 물질과 그 빌리루빈으로 인해 발생하는 담석형성반응을 응용했다. 인체 내 강력한 항산화제인 빌리루빈의 담석 형성 과정에서 관찰되는 자체 금속 결합 기능과 신생아 황달 치료에 쓰이는 푸른빛에 반응하는 성질을 동시에 이용했다.
이를 통해 높은 생체 적합성과 우수한 광음향 진단 기능 및 광열 치료 효능을 보여 항암 치료 분야에서 적합한 치료 시스템이 될 것으로 기대된다.
이동윤 박사과정이 1저자로 참여한 이번 연구는 응용화학분야 저명학술지 앙케반테 케미(Angewandte Chemie International Edition) 9월 4일자 온라인 판에 게재됐다.
전 교수 연구팀은 과거 연구에서 물과 화합하지 않는 소수성을 갖는 빌리루빈과, 그 반대로 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’ 기반의 나노입자 시스템을 개발한 경험이 있다.
이는 빌리루빈의 항산화 기능을 그대로 유지하면서 체내로 축적되지 않게 해 빌리루빈의 장점만을 취하는 기술이다. 이를 바탕으로 염증성 장 질환, 허혈/재관류, 췌도세포 이식, 천식 등의 동물 질병 모델에서 효능 및 안정성을 확인했다.
이번 연구에서는 앞선 연구의 접근 방식과 다르게 빌리루빈이 갖고 있는 다른 물리 화학적 성질을 이용해 항암 치료에 적용했다.
먼저 황달의 주요 원인체인 노란색 빌리루빈에 특정 파장대의 빛(푸른 빛)을 쬐어주면 이에 반응해 광이성질체(빛에 의해 모양이 변형된 물체)가 되고 배설이 활성화돼 신생아 황달 치료에 널리 쓰일 수 있는 광학물질인 점을 첫 번째 근거로 활용했다.
두 번째로는 인체 내의 쓸개관 혹은 쓸개 등에서 병이 생길 때 종종 발견할 수 있는 검은 색소 담석의 주성분 또한 빌리루빈이라는 점에 주목했다. 빌리루빈이 칼슘이나 구리 등 양이온과 중간 매개체 없이도 결합할 때 검은 색소 담석이 형성되는 점을 응용했다.
연구팀은 구리나 칼슘 대신 시스플라틴이라는 백금 금속 기반 항암제와 빌리루빈을 결합해 노란색의 빌리루빈을 보라색의 복합체로 변환시켰다.
이후 근적외선 파장대의 빛을 쬐었을 때 기존에 비해 크게 향상된 광감응성을 보였고, 실제 정맥 주사된 대장암 동물 모델에서도 종양 부분에서의 유의미한 광음향 신호 증가를 확인했다. 이 기술로 향후 더 향상된 종양 진단을 할 수 있을 것으로 기대된다.
또한 종양 부위에 근적외선 빛을 쬐었을 때 광열 효과에 의해 5분 내에 25℃ 이상의 온도 상승을 확인했고, 2주 후 다른 그룹에 비해 종양 크기의 감소 및 괴사를 확인했다.
전 교수는 “현재 개발된 물질들은 생체 적합성이 낮고 잠재적 생체 독성 가능성이 있는 인공소재 위주이기 때문에 임상으로 이어지는 데 한계가 있었다”며 “이번에 개발한 인체 유래 빌리루빈 기반의 광학물질은 광음향 영상 및 광열 치료의 전임상 중개연구 및 임상 적용에 새로운 플랫폼이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈의 담석형성반응 및 광감응성을 이용한 본 연구의 모식도
그림2. 빌리루빈 나노입자 (왼쪽)와 시스플라틴이 결합된 빌리루빈 나노입자 (오른쪽) 수용액
2017.09.20 조회수 21196 -
 전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
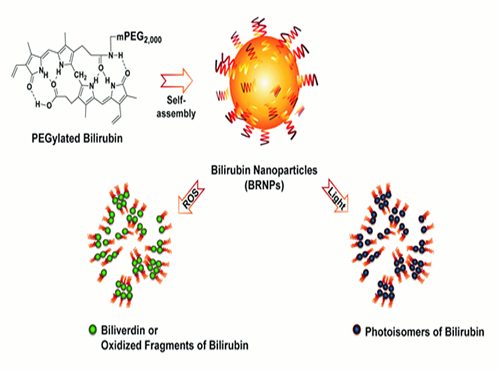
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18 조회수 18693
전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18 조회수 18693