%EC%95%84%EB%B0%80%EB%A1%9C%EC%9D%B4%EB%93%9C
-
 알츠하이머병 유발하는 독성 단백질 발굴
알츠하이머병은 가장 대표적인 신경퇴행성 질환으로, 기억력 감퇴와 인지능력 저하를 유발한다. 알츠하이머병의 발병 인구가 급속히 증가하고 있으나, 현재까지 발병 원인이 명확히 밝혀진 바 없고, 이에 따라 효과적인 치료제 개발 또한 굉장히 더디게 진행되고 있다.
우리 대학 화학과 임미희 교수(금속신경단백질연구단 단장) 연구팀이 한국기초과학지원연구원 바이오융합연구부 이영호 박사 연구팀, 우리 대학 화학과 백무현 교수 연구팀, 의과학대학원 한진주 교수 연구팀과의 공동연구와 한국생명공학연구원 희귀난치질환연구센터 이다용 박사 연구팀과 공동연구를 통해 알츠하이머병 유발인자의 독성을 촉진하는 세포 내 단백질을 발굴함으로써, 알츠하이머병과 관련된 새로운 병리적 네트워크를 제시했다고 20일 밝혔다.
알츠하이머병 환자들의 뇌에서 대표적으로 나타나는 병리적 현상은 노인성 반점 축적이다. 노인성 반점의 주된 구성분은 아밀로이드-베타 펩타이드로인 응집체로 세포 내 물질들과 결합해 세포 손상을 유발한다. 따라서, 이들 응집체와 세포 사멸 간의 상관관계가 활발히 연구되고 있다. 그러나, 아밀로이드-베타와 세포 사멸 유발 인자들 간의 직접적인 상호작용에 관해서는 아직 많은 부분이 밝혀진 바 없다.
최근 미국 FDA에서 승인한 알츠하이머병 신약은 노인성 반점을 나타내는 아밀로이드-베타 펩타이드의 응집체의 세포 손상을 주요 타깃으로 하여 개발됐다. 하지만, 제한된 사용 여부(특히, 부작용)로 그 신약 개발의 방향 전환 및 개선이 필요함을 연구자들은 절실히 느끼고 있다.
임미희 교수 연구팀은 알츠하이머병에서 과발현되며 원인 미상의 신경세포 사멸을 유발하는 ‘아밀로이드 전구체 C 말단 절단체’ 단백질이 아밀로이드-베타 및 금속-아밀로이드-베타 복합체와 결합해 응집을 촉진하고 독성 촉진제 역할을 함을 세계 최초로 증명하는 연구 내용을 발표했다.
이번 연구 결과는 아밀로이드 전구체 C 말단 절단체 자체 또는 아밀로이드-베타과 결합한 복합체가 새로운 알츠하이머병의 새로운 바이오마커로 작용할 수 있고, 또한 그들이 새로운 신약개발 타깃이 될 수 있음을 제시하고 있다.
임미희 교수 연구팀의 남은주 박사(KAIST 화학과 박사 졸업, 現 브리검 여성 병원 및 하버드 의과대학 연구원)가 제1 저자로 참여한 이번 연구는 세포 내 단백질 미세주입 기술을 통해 세포 안에서 아밀로이드 전구체 C 말단 절단체가 아밀로이드-베타 응집 촉진에 미치는 역할을 연구팀은 확인했다. 더 나아가, 뉴런 세포 및 설치류의 뇌에서 아밀로이드-베타와 관련된 세포 사멸, 뉴런 손상, 염증반응이 아밀로이드 전구체 C 말단 절단체에 의해 더욱 증가하는 현상을 최초로 확인해 세계적으로 주목받고 있다.
임미희 교수는 “이번 연구 결과는 알츠하이머병에서 기존에 알려지지 않은 생체 내 아밀로이드-베타 응집 및 독성 촉진제 발굴에 큰 의의가 있다”고 말하며, “이 연구 성과는 새로운 바이오마커 및 치료타깃을 제안하고 있다”고 밝혔다.
이번 연구는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science, Impact factor: 15.1)'에 11월 10일 자 게재됐다. (논문명: APP-C31: An Intracellular Promoter of Both Metal-Free and Metal-Bound Amyloid-β40 Aggregation and Toxicity in Alzheimer’s Disease) Adv. Sci. 2023, 2307182 (https://doi.org/10.1002/advs.202307182)
이번 연구는 한국연구재단 기초연구사업(특히, 리더연구), KBSI, 국가과학기술연구회(NST), IBS 및 KAIST의 지원을 받아 진행됐다.
2023.11.20 조회수 7591
알츠하이머병 유발하는 독성 단백질 발굴
알츠하이머병은 가장 대표적인 신경퇴행성 질환으로, 기억력 감퇴와 인지능력 저하를 유발한다. 알츠하이머병의 발병 인구가 급속히 증가하고 있으나, 현재까지 발병 원인이 명확히 밝혀진 바 없고, 이에 따라 효과적인 치료제 개발 또한 굉장히 더디게 진행되고 있다.
우리 대학 화학과 임미희 교수(금속신경단백질연구단 단장) 연구팀이 한국기초과학지원연구원 바이오융합연구부 이영호 박사 연구팀, 우리 대학 화학과 백무현 교수 연구팀, 의과학대학원 한진주 교수 연구팀과의 공동연구와 한국생명공학연구원 희귀난치질환연구센터 이다용 박사 연구팀과 공동연구를 통해 알츠하이머병 유발인자의 독성을 촉진하는 세포 내 단백질을 발굴함으로써, 알츠하이머병과 관련된 새로운 병리적 네트워크를 제시했다고 20일 밝혔다.
알츠하이머병 환자들의 뇌에서 대표적으로 나타나는 병리적 현상은 노인성 반점 축적이다. 노인성 반점의 주된 구성분은 아밀로이드-베타 펩타이드로인 응집체로 세포 내 물질들과 결합해 세포 손상을 유발한다. 따라서, 이들 응집체와 세포 사멸 간의 상관관계가 활발히 연구되고 있다. 그러나, 아밀로이드-베타와 세포 사멸 유발 인자들 간의 직접적인 상호작용에 관해서는 아직 많은 부분이 밝혀진 바 없다.
최근 미국 FDA에서 승인한 알츠하이머병 신약은 노인성 반점을 나타내는 아밀로이드-베타 펩타이드의 응집체의 세포 손상을 주요 타깃으로 하여 개발됐다. 하지만, 제한된 사용 여부(특히, 부작용)로 그 신약 개발의 방향 전환 및 개선이 필요함을 연구자들은 절실히 느끼고 있다.
임미희 교수 연구팀은 알츠하이머병에서 과발현되며 원인 미상의 신경세포 사멸을 유발하는 ‘아밀로이드 전구체 C 말단 절단체’ 단백질이 아밀로이드-베타 및 금속-아밀로이드-베타 복합체와 결합해 응집을 촉진하고 독성 촉진제 역할을 함을 세계 최초로 증명하는 연구 내용을 발표했다.
이번 연구 결과는 아밀로이드 전구체 C 말단 절단체 자체 또는 아밀로이드-베타과 결합한 복합체가 새로운 알츠하이머병의 새로운 바이오마커로 작용할 수 있고, 또한 그들이 새로운 신약개발 타깃이 될 수 있음을 제시하고 있다.
임미희 교수 연구팀의 남은주 박사(KAIST 화학과 박사 졸업, 現 브리검 여성 병원 및 하버드 의과대학 연구원)가 제1 저자로 참여한 이번 연구는 세포 내 단백질 미세주입 기술을 통해 세포 안에서 아밀로이드 전구체 C 말단 절단체가 아밀로이드-베타 응집 촉진에 미치는 역할을 연구팀은 확인했다. 더 나아가, 뉴런 세포 및 설치류의 뇌에서 아밀로이드-베타와 관련된 세포 사멸, 뉴런 손상, 염증반응이 아밀로이드 전구체 C 말단 절단체에 의해 더욱 증가하는 현상을 최초로 확인해 세계적으로 주목받고 있다.
임미희 교수는 “이번 연구 결과는 알츠하이머병에서 기존에 알려지지 않은 생체 내 아밀로이드-베타 응집 및 독성 촉진제 발굴에 큰 의의가 있다”고 말하며, “이 연구 성과는 새로운 바이오마커 및 치료타깃을 제안하고 있다”고 밝혔다.
이번 연구는 국제 저명 학술지인 `어드밴스드 사이언스(Advanced Science, Impact factor: 15.1)'에 11월 10일 자 게재됐다. (논문명: APP-C31: An Intracellular Promoter of Both Metal-Free and Metal-Bound Amyloid-β40 Aggregation and Toxicity in Alzheimer’s Disease) Adv. Sci. 2023, 2307182 (https://doi.org/10.1002/advs.202307182)
이번 연구는 한국연구재단 기초연구사업(특히, 리더연구), KBSI, 국가과학기술연구회(NST), IBS 및 KAIST의 지원을 받아 진행됐다.
2023.11.20 조회수 7591 -
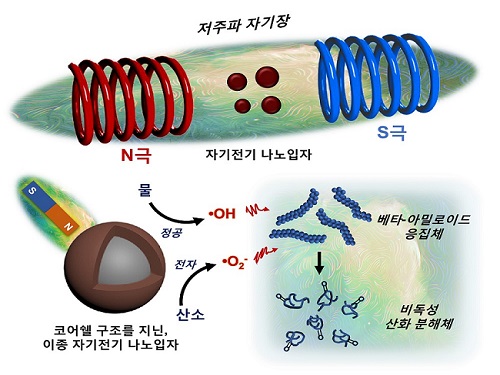 저주파 자기장 반응성 나노입자 개발해 알츠하이머 원인물질 분해 성공
우리 대학 신소재공학과 박찬범 교수 연구팀이 저주파 자기장 반응성 나노입자를 개발하는 데 성공했다고 16일 밝혔다. 연구팀은 이를 이용해 알츠하이머질환을 유발하는 베타-아밀로이드 펩타이드(아미노산 화합물) 응집체를 자기장으로 분해할 수 있다고 밝혔다.
신소재공학과 장진형 박사과정이 제1 저자로 참여한 이번 연구는 국제학술지 `사이언스 어드밴시스(Science Advances)' 5월 13일 字에 게재됐다. (논문명: Magnetoelectric dissociation of Alzheimer's β-amyloid aggregates)
자기 전기(Magnetoelectric) 소재는 자성과 전기성이 결합한 물성을 가지며 스핀트로닉스(Spintronics) 소자, 트랜스듀서(Transducer) 등 다양한 전자기기를 구성하는 핵심 물질이다. 그러나 자기 전기 소재는 원자 내 전자의 회전과 궤도 운동을 방해하는 양성자의 정전기적 상호작용(스핀-오빗 상호작용)으로 인해 성능 향상에 한계를 지닌다.
연구팀은 자기 전기 소재의 일종이며, 반도체 및 배터리 분야에 주로 쓰이는 코발트 페라이트(Cobalt ferrite)와 비스무스 페라이트(Bismuth ferrite)를 코어쉘(Core-shell) 구조로 접합시킴으로써 이종(Heterogeneous) 자기 전기 나노입자를 개발했다. 서로 다른 자기 전기 소재의 균일한 접합을 통해 이들의 경계면에서 저주파 자기장에 반응하는 자기-압전효과(Magneto-piezoelectric effect)를 일으킬 수 있었다.
특히, 나노입자가 저주파 자기장에 반응해 전하 운반체를 생성할 때 열을 방출하지 않는 현상에 연구팀은 주목했다. 자기장은 뇌 조직을 손상 없이 투과할 수 있으며 자기공명영상(MRI, Magnetic Resonance Imaging) 등에서 활용돼 의료적 안전성이 이미 검증된 바가 있다.
연구팀이 개발한 나노입자에 저주파 자기장을 쏘았을 때 베타-아밀로이드 펩타이드(Beta-amyloid peptide)를 산화시킴으로써 그 응집체의 결합력을 약화시켜 분해했고, 신경독성도 중화시킬 수 있음을 연구팀은 관찰했다.
아밀로이드 응집체는 알츠하이머병 등 다양한 퇴행성 신경질환들에서 공통적으로 관찰되며, 규칙적인 수소 결합을 통해 매우 안정적인 단백질 이차구조(Secondary structure)를 가져 분해가 어렵다고 알려져 왔다.
박찬범 교수는 "저주파 자기장 반응성 나노소재는 독성이 낮으며 자기장과 반응해 아밀로이드 응집체를 효율적으로 분해할 수 있기에 의료분야로 확장할 수 있는 잠재력이 있다ˮ면서, "이를 검증하기 위해 향후 알츠하이머 형질변환 마우스 등을 이용한 동물실험 등이 우선적으로 필요하다ˮ고 말했다.
한편 이번 연구는 한편 이번 연구는 과학기술정보통신부 리더연구자지원사업(창의연구)의 지원을 받아 수행됐다.
2022.05.16 조회수 9216
저주파 자기장 반응성 나노입자 개발해 알츠하이머 원인물질 분해 성공
우리 대학 신소재공학과 박찬범 교수 연구팀이 저주파 자기장 반응성 나노입자를 개발하는 데 성공했다고 16일 밝혔다. 연구팀은 이를 이용해 알츠하이머질환을 유발하는 베타-아밀로이드 펩타이드(아미노산 화합물) 응집체를 자기장으로 분해할 수 있다고 밝혔다.
신소재공학과 장진형 박사과정이 제1 저자로 참여한 이번 연구는 국제학술지 `사이언스 어드밴시스(Science Advances)' 5월 13일 字에 게재됐다. (논문명: Magnetoelectric dissociation of Alzheimer's β-amyloid aggregates)
자기 전기(Magnetoelectric) 소재는 자성과 전기성이 결합한 물성을 가지며 스핀트로닉스(Spintronics) 소자, 트랜스듀서(Transducer) 등 다양한 전자기기를 구성하는 핵심 물질이다. 그러나 자기 전기 소재는 원자 내 전자의 회전과 궤도 운동을 방해하는 양성자의 정전기적 상호작용(스핀-오빗 상호작용)으로 인해 성능 향상에 한계를 지닌다.
연구팀은 자기 전기 소재의 일종이며, 반도체 및 배터리 분야에 주로 쓰이는 코발트 페라이트(Cobalt ferrite)와 비스무스 페라이트(Bismuth ferrite)를 코어쉘(Core-shell) 구조로 접합시킴으로써 이종(Heterogeneous) 자기 전기 나노입자를 개발했다. 서로 다른 자기 전기 소재의 균일한 접합을 통해 이들의 경계면에서 저주파 자기장에 반응하는 자기-압전효과(Magneto-piezoelectric effect)를 일으킬 수 있었다.
특히, 나노입자가 저주파 자기장에 반응해 전하 운반체를 생성할 때 열을 방출하지 않는 현상에 연구팀은 주목했다. 자기장은 뇌 조직을 손상 없이 투과할 수 있으며 자기공명영상(MRI, Magnetic Resonance Imaging) 등에서 활용돼 의료적 안전성이 이미 검증된 바가 있다.
연구팀이 개발한 나노입자에 저주파 자기장을 쏘았을 때 베타-아밀로이드 펩타이드(Beta-amyloid peptide)를 산화시킴으로써 그 응집체의 결합력을 약화시켜 분해했고, 신경독성도 중화시킬 수 있음을 연구팀은 관찰했다.
아밀로이드 응집체는 알츠하이머병 등 다양한 퇴행성 신경질환들에서 공통적으로 관찰되며, 규칙적인 수소 결합을 통해 매우 안정적인 단백질 이차구조(Secondary structure)를 가져 분해가 어렵다고 알려져 왔다.
박찬범 교수는 "저주파 자기장 반응성 나노소재는 독성이 낮으며 자기장과 반응해 아밀로이드 응집체를 효율적으로 분해할 수 있기에 의료분야로 확장할 수 있는 잠재력이 있다ˮ면서, "이를 검증하기 위해 향후 알츠하이머 형질변환 마우스 등을 이용한 동물실험 등이 우선적으로 필요하다ˮ고 말했다.
한편 이번 연구는 한편 이번 연구는 과학기술정보통신부 리더연구자지원사업(창의연구)의 지원을 받아 수행됐다.
2022.05.16 조회수 9216 -
 알츠하이머병을 유발하는 새로운 유전인자 발견
우리 대학 바이오및뇌공학과 정용 교수 연구팀이 알츠하이머병을 유발하는 새로운 유전인자를 발견했다고 28일 밝혔다.
정 교수 연구팀은 환자의 뇌 영상·유전자와 함께 뇌척수액 데이터를 이용해 알츠하이머병의 새로운 유전인자를 발견했다. 연구팀은 새로 발견한 이 유전인자가 알츠하이머병의 원인 단백질로 알려진 아밀로이드 및 타우 단백질과는 별도로 환자의 인지 저하를 발생하는 사실과 함께 이 유전자가 항산화 효소 대사와 관련됐음을 입증했다. 이번 연구를 계기로 전 세계 약 1억5000만 명에 달하는 알츠하이머병 환자의 병태생리학적 규명은 물론 새로운 치료제 개발에 기여할 것으로 큰 기대를 모으고 있다.
우리 대학 의과학대학원김항래 박사가 제1 저자로 참여한 이번 연구 논문은 9월 16일 字 신경학 분야 저명 학술지인 '신경학(Neurology)'에 게재됐다. (논문명 : Genetic variants beyond amyloid and tau associated with cognitive decline: A cohort study)
알츠하이머병은 치매의 가장 흔한 원인인데 고령화에 따라 전 세계적으로 환자 수가 급속히 늘고 있다. 알츠하이머병을 유발하는 주요 원인 단백질로는 아밀로이드 및 타우 단백질이 알려져 있다. 따라서 이러한 주원인 단백질을 대상으로 하는 치료제가 많이 개발되는 추세다. 그러나 연이은 신약 개발의 실패로 인해 알츠하이머병에 대한 새로운 병태생리와 치료 대상에 관한 연구에 관심이 증가하고 있다.
정 교수 연구팀은 이번 연구를 위해 미국과 캐나다에 소재한 63개 지역 연구기관으로부터 얻은 정상인, 경도인지장애 관련 자료를 그리고 알츠하이머치매 환자로부터 얻은 뇌 영상·유전자·뇌척수액 데이터를 활용했다.(Alzheimer's Disease Neuroimaging Initiative, ADNI, http://adni.loni.usc.edu)
연구팀은 이와 함께 총 414명의 알츠하이머병 스펙트럼 환자(아밀로이드 단백질 양성 환자)를 대상으로 약 620만 개의 단일염기 다형성(Single Nucleotide Polymorphism, SNP)을 확인하는 과정에서 아밀로이드 및 타우 단백질과 별도로 환자의 인지기능에 영향을 주는 새로운 유전인자를 찾아냈다.
연구팀은 특히 독립된 데이터에서도 해당 유전자분석 결과의 재현에도 성공해 생물 정보학 분석을 통해서도 해당 유전인자가 항산화 효소 대사와 관련된 유전인자임을 입증했다. 연구팀은 실험을 통해 뇌 자기공명영상(Magnetic Resonance Imaging, MRI)으로 계산한 대뇌피질위축 데이터와 구조방정식 모델을 통해 해당 유전자가 뇌의 두정엽과 후두엽의 뇌 위축을 유발한다는 사실을 확인한 것이다. 이 패턴은 아밀로이드 및 타우 단백질에 의한 기존의 뇌 위축 패턴 현상과는 다른 것으로 나타났다.
제1 저자인 김항래 박사는 "이번 연구결과를 바탕으로 해당 유전인자가 있는 환자를 대상으로 항산화 치료의 효율성을 검증하는 추가 연구를 진행할 계획ˮ 이라고 밝혔다. 한편 이번 연구는 보건복지부 치매극복사업과 과학기술정보통신부 뇌과학원천기술사업의 지원을 받아 수행됐다.
2020.09.28 조회수 27079
알츠하이머병을 유발하는 새로운 유전인자 발견
우리 대학 바이오및뇌공학과 정용 교수 연구팀이 알츠하이머병을 유발하는 새로운 유전인자를 발견했다고 28일 밝혔다.
정 교수 연구팀은 환자의 뇌 영상·유전자와 함께 뇌척수액 데이터를 이용해 알츠하이머병의 새로운 유전인자를 발견했다. 연구팀은 새로 발견한 이 유전인자가 알츠하이머병의 원인 단백질로 알려진 아밀로이드 및 타우 단백질과는 별도로 환자의 인지 저하를 발생하는 사실과 함께 이 유전자가 항산화 효소 대사와 관련됐음을 입증했다. 이번 연구를 계기로 전 세계 약 1억5000만 명에 달하는 알츠하이머병 환자의 병태생리학적 규명은 물론 새로운 치료제 개발에 기여할 것으로 큰 기대를 모으고 있다.
우리 대학 의과학대학원김항래 박사가 제1 저자로 참여한 이번 연구 논문은 9월 16일 字 신경학 분야 저명 학술지인 '신경학(Neurology)'에 게재됐다. (논문명 : Genetic variants beyond amyloid and tau associated with cognitive decline: A cohort study)
알츠하이머병은 치매의 가장 흔한 원인인데 고령화에 따라 전 세계적으로 환자 수가 급속히 늘고 있다. 알츠하이머병을 유발하는 주요 원인 단백질로는 아밀로이드 및 타우 단백질이 알려져 있다. 따라서 이러한 주원인 단백질을 대상으로 하는 치료제가 많이 개발되는 추세다. 그러나 연이은 신약 개발의 실패로 인해 알츠하이머병에 대한 새로운 병태생리와 치료 대상에 관한 연구에 관심이 증가하고 있다.
정 교수 연구팀은 이번 연구를 위해 미국과 캐나다에 소재한 63개 지역 연구기관으로부터 얻은 정상인, 경도인지장애 관련 자료를 그리고 알츠하이머치매 환자로부터 얻은 뇌 영상·유전자·뇌척수액 데이터를 활용했다.(Alzheimer's Disease Neuroimaging Initiative, ADNI, http://adni.loni.usc.edu)
연구팀은 이와 함께 총 414명의 알츠하이머병 스펙트럼 환자(아밀로이드 단백질 양성 환자)를 대상으로 약 620만 개의 단일염기 다형성(Single Nucleotide Polymorphism, SNP)을 확인하는 과정에서 아밀로이드 및 타우 단백질과 별도로 환자의 인지기능에 영향을 주는 새로운 유전인자를 찾아냈다.
연구팀은 특히 독립된 데이터에서도 해당 유전자분석 결과의 재현에도 성공해 생물 정보학 분석을 통해서도 해당 유전인자가 항산화 효소 대사와 관련된 유전인자임을 입증했다. 연구팀은 실험을 통해 뇌 자기공명영상(Magnetic Resonance Imaging, MRI)으로 계산한 대뇌피질위축 데이터와 구조방정식 모델을 통해 해당 유전자가 뇌의 두정엽과 후두엽의 뇌 위축을 유발한다는 사실을 확인한 것이다. 이 패턴은 아밀로이드 및 타우 단백질에 의한 기존의 뇌 위축 패턴 현상과는 다른 것으로 나타났다.
제1 저자인 김항래 박사는 "이번 연구결과를 바탕으로 해당 유전인자가 있는 환자를 대상으로 항산화 치료의 효율성을 검증하는 추가 연구를 진행할 계획ˮ 이라고 밝혔다. 한편 이번 연구는 보건복지부 치매극복사업과 과학기술정보통신부 뇌과학원천기술사업의 지원을 받아 수행됐다.
2020.09.28 조회수 27079 -
 알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19466
알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19466 -
 산소 이용해 알츠하이머 유발 단백질 독성 개선
화학과 임미희 교수 연구팀이 공기 중의 산소를 이용해 알츠하이머 유발에 관여하는 단백질의 독성을 개선할 수 있는 화학적 도구를 설계하는 데 성공했다.
연구팀은 알츠하이머 발병에 관여한다고 알려진 구리-아밀로이드 베타 복합체의 응집과 이에 의한 발생한 세포 독성을 개선할 수 있는 화학적 도구를 설계하고, 구리 배위권 이중 변형을 통한 작용 원리를 분자적 수준에서 밝혀냈다.
한지연 박사과정이 1 저자로 참여한 이번 연구 결과는 국제 학술지인 미국 국립과학원회보(PNAS)에 2월 27일 자로 게재됐다.(논문명 : Mechanistic approaches for chemically modifying the coordination sphere of copper-amyloid-β complexes)
전이 금속 중 구리 이온은 항산화 작용과 신경전달물질 생성 등 신체에 필수적인 생리적 기능에 관여한다. 건강한 사람의 뇌와 달리 알츠하이머병 같은 퇴행성 뇌 질환 환자의 뇌에서는 이러한 구리 이온의 항상성이 완전히 무너져있다고 알려져 있다.
알츠하이머 발병에 밀접하게 관계가 있다고 알려진 아밀로이드 베타 펩타이드는 구리 이온과 강하게 결합할 수 있다. 구리 이온은 아밀로이드 베타의 응집을 촉진할 뿐만 아니라, 활성산소를 과다하게 생성해 신경독성을 일으킨다. 따라서 구리-아밀로이드 베타 복합체를 표적하고 그 배위 결합을 효과적으로 막을 수 있는 화학적 접근 기법이 최근 주목받고 있다.
연구팀은 알츠하이머 발병 원리에 직간접적으로 관여하는 구리 이온이 공기 중 산소와 반응할 수 있다는 점을 이용했다. 이에 구리-아밀로이드 베타 복합체와 상호작용할 수 있도록 화합물을 합리적으로 설계하고, 해당분자가 산소가 존재하는 환경에서 구리 배위권에 위치한 특정 아미노산에 결합 및 산화에 의한 이중 변형을 일으킨 것을 확인했다.
연구팀은 연구팀이 개발한 배위권 이중 변형 기법에 따라 구리-아밀로이드 베타의 응집 과정 및 섬유 형성 정도가 확연히 달라짐을 확인했다. 이 기법을 통해 구리 이온의 병리학적 특성 중 하나인 활성산소 생성 정도 또한 두드러지게 개선된 것을 관찰했다.
나아가 기존의 기법과 비교했을 때 구리-아밀로이드 베타 복합체에 의한 세포 독성을 더욱 효과적으로 회복시키는 것으로 나타났다.
이번 연구는 산소의 유무, 전이 금속의 종류, 산화 활성 금속의 산화수, 아밀로이드성 단백질의 종류 등 다양한 변수의 통제를 통해 해당 화합물이 아밀로이드 베타의 구리 배위권을 어떻게 변형시켰는지에 대한 작용 원리를 분자적 수준에서 제안했다는 의의가 있다.
임미희 교수는 “알츠하이머 발병에 관여한다고 알려진 구리 이온이 산소와 반응할 수 있다는 점을 역으로 이용했다”라며 “이번 연구에서 최초로 발표한 단백질 내 구리 배위권 이중 변형 기법을 바탕으로, 다른 퇴행성 뇌질환의 치료제 개발에도 더욱 박차를 가할 수 있을 것이다”라고 말했다.
이번 연구는 한국연구재단과 KAIST의 지원으로 수행됐다.
2020.03.03 조회수 17566
산소 이용해 알츠하이머 유발 단백질 독성 개선
화학과 임미희 교수 연구팀이 공기 중의 산소를 이용해 알츠하이머 유발에 관여하는 단백질의 독성을 개선할 수 있는 화학적 도구를 설계하는 데 성공했다.
연구팀은 알츠하이머 발병에 관여한다고 알려진 구리-아밀로이드 베타 복합체의 응집과 이에 의한 발생한 세포 독성을 개선할 수 있는 화학적 도구를 설계하고, 구리 배위권 이중 변형을 통한 작용 원리를 분자적 수준에서 밝혀냈다.
한지연 박사과정이 1 저자로 참여한 이번 연구 결과는 국제 학술지인 미국 국립과학원회보(PNAS)에 2월 27일 자로 게재됐다.(논문명 : Mechanistic approaches for chemically modifying the coordination sphere of copper-amyloid-β complexes)
전이 금속 중 구리 이온은 항산화 작용과 신경전달물질 생성 등 신체에 필수적인 생리적 기능에 관여한다. 건강한 사람의 뇌와 달리 알츠하이머병 같은 퇴행성 뇌 질환 환자의 뇌에서는 이러한 구리 이온의 항상성이 완전히 무너져있다고 알려져 있다.
알츠하이머 발병에 밀접하게 관계가 있다고 알려진 아밀로이드 베타 펩타이드는 구리 이온과 강하게 결합할 수 있다. 구리 이온은 아밀로이드 베타의 응집을 촉진할 뿐만 아니라, 활성산소를 과다하게 생성해 신경독성을 일으킨다. 따라서 구리-아밀로이드 베타 복합체를 표적하고 그 배위 결합을 효과적으로 막을 수 있는 화학적 접근 기법이 최근 주목받고 있다.
연구팀은 알츠하이머 발병 원리에 직간접적으로 관여하는 구리 이온이 공기 중 산소와 반응할 수 있다는 점을 이용했다. 이에 구리-아밀로이드 베타 복합체와 상호작용할 수 있도록 화합물을 합리적으로 설계하고, 해당분자가 산소가 존재하는 환경에서 구리 배위권에 위치한 특정 아미노산에 결합 및 산화에 의한 이중 변형을 일으킨 것을 확인했다.
연구팀은 연구팀이 개발한 배위권 이중 변형 기법에 따라 구리-아밀로이드 베타의 응집 과정 및 섬유 형성 정도가 확연히 달라짐을 확인했다. 이 기법을 통해 구리 이온의 병리학적 특성 중 하나인 활성산소 생성 정도 또한 두드러지게 개선된 것을 관찰했다.
나아가 기존의 기법과 비교했을 때 구리-아밀로이드 베타 복합체에 의한 세포 독성을 더욱 효과적으로 회복시키는 것으로 나타났다.
이번 연구는 산소의 유무, 전이 금속의 종류, 산화 활성 금속의 산화수, 아밀로이드성 단백질의 종류 등 다양한 변수의 통제를 통해 해당 화합물이 아밀로이드 베타의 구리 배위권을 어떻게 변형시켰는지에 대한 작용 원리를 분자적 수준에서 제안했다는 의의가 있다.
임미희 교수는 “알츠하이머 발병에 관여한다고 알려진 구리 이온이 산소와 반응할 수 있다는 점을 역으로 이용했다”라며 “이번 연구에서 최초로 발표한 단백질 내 구리 배위권 이중 변형 기법을 바탕으로, 다른 퇴행성 뇌질환의 치료제 개발에도 더욱 박차를 가할 수 있을 것이다”라고 말했다.
이번 연구는 한국연구재단과 KAIST의 지원으로 수행됐다.
2020.03.03 조회수 17566 -
 빛 이용해 알츠하이머 완화 가능성 열어
박 찬 범 교수
우리 대학 신소재공학과 박찬범 교수 연구팀과 한국생명공학연구원(원장 오태광) 바이오나노센터 유권 박사팀이 빛과 유기분자인 포르피린을 이용해 알츠하이머 증후군의 원인 물질로 알려진 베타-아밀로이드(beta-amyloid)의 응집 과정을 억제하는 데 성공했다.
이 기술을 통해 알츠하이머 증후군을 비롯한 여러 가지 퇴행성 뇌질환 치료에 새로운 가능성을 제시할 것으로 기대된다.
이번 연구결과는 독일의 국제 저명 학술지인 앙케반테 케미(Angewandte Chemie) 21일자 표지논문에 게재됐다.
빛을 이용한 치료는 시간과 치료 부위를 조절하기 쉽다는 장점이 있다. 암과 같은 경우에는 유기 광감응제를 투여하고 빛을 병변 부위에 조사하는 광역학 치료(photodynamic therapy)가 활용되고 있다. 하지만 광역학 치료가 알츠하이머병과 같은 퇴행성 뇌질환에 적용된 사례는 없었다.
알츠하이머 증후군은 환자의 뇌에서 생성되는 베타-아밀로이드라는 단백질이 응집돼 뇌에 침착하면서 시작된다. 이렇게 형성된 응집체는 뇌세포에 유해한 영향을 주고 손상을 일으켜 치매와 같은 뇌 기능 저하를 일으킨다.
이 과정에서 베타-아밀로이드의 응집 과정을 억제하면 아밀로이드 퇴적물의 형성을 막을 수 있고, 따라서 알츠하이머 증후군을 예방하거나 완화시킬 수 있다.
연구팀은 생체 친화적 유기 화합물인 포르피린 유도체와 청색 LED 광을 이용해 베타-아밀로이드 응집을 효과적으로 억제했다.
포르피린과 같은 광감응제는 빛 에너지를 흡수해 여기 상태가 된 후 바닥상태로 돌아가며 활성 산소를 생성한다. 생성된 활성 산소가 베타-아밀로이드 단량체와 결합해 산화시킴으로써 베타-아밀로이드의 응집을 방해하는 원리이다.
연구팀은 이를 무척추 동물에 적용해 알츠하이머 초파리 모델에서 신경 및 근육 접합부의 손상, 뇌 신경세포의 사멸, 운동성 및 수명 감소 등 알츠하이머 증후군에서 발견되는 증상의 완화를 확인했다.
빛을 이용한 치료법은 기존 약물 치료에 비해 적은 양의 약물로도 높은 치료효과를 볼 수 있고 부작용이 적다는 장점이 있다. 뇌질환에 적용할 수 있는 기술 개발이 완료된다면 그 활용도가 높을 것으로 예상된다.
박 교수는 “빛과 광감응화합물을 사용해 무척추 동물(초파리)에서 베타-아밀로이드 응집과 독성을 막는 것을 세계 최초로 확인한 것에 의의가 있다”며 “향후 다양한 유기 및 무기 광감응소재들의 적용가능성을 알아보고, 알츠하이머 마우스 등 척추동물을 대상으로 알츠하이머병의 광역학적 치료 가능성을 연구하고 싶다"고 말했다.
□ 그림 설명
그림 1. 포르피린과 빛을 이용해 알츠하이머 원인 물질의 응집을 제어한 모식도
그림2. 앙케반테 케미에 게재된 표지논문
2015.09.21 조회수 13748
빛 이용해 알츠하이머 완화 가능성 열어
박 찬 범 교수
우리 대학 신소재공학과 박찬범 교수 연구팀과 한국생명공학연구원(원장 오태광) 바이오나노센터 유권 박사팀이 빛과 유기분자인 포르피린을 이용해 알츠하이머 증후군의 원인 물질로 알려진 베타-아밀로이드(beta-amyloid)의 응집 과정을 억제하는 데 성공했다.
이 기술을 통해 알츠하이머 증후군을 비롯한 여러 가지 퇴행성 뇌질환 치료에 새로운 가능성을 제시할 것으로 기대된다.
이번 연구결과는 독일의 국제 저명 학술지인 앙케반테 케미(Angewandte Chemie) 21일자 표지논문에 게재됐다.
빛을 이용한 치료는 시간과 치료 부위를 조절하기 쉽다는 장점이 있다. 암과 같은 경우에는 유기 광감응제를 투여하고 빛을 병변 부위에 조사하는 광역학 치료(photodynamic therapy)가 활용되고 있다. 하지만 광역학 치료가 알츠하이머병과 같은 퇴행성 뇌질환에 적용된 사례는 없었다.
알츠하이머 증후군은 환자의 뇌에서 생성되는 베타-아밀로이드라는 단백질이 응집돼 뇌에 침착하면서 시작된다. 이렇게 형성된 응집체는 뇌세포에 유해한 영향을 주고 손상을 일으켜 치매와 같은 뇌 기능 저하를 일으킨다.
이 과정에서 베타-아밀로이드의 응집 과정을 억제하면 아밀로이드 퇴적물의 형성을 막을 수 있고, 따라서 알츠하이머 증후군을 예방하거나 완화시킬 수 있다.
연구팀은 생체 친화적 유기 화합물인 포르피린 유도체와 청색 LED 광을 이용해 베타-아밀로이드 응집을 효과적으로 억제했다.
포르피린과 같은 광감응제는 빛 에너지를 흡수해 여기 상태가 된 후 바닥상태로 돌아가며 활성 산소를 생성한다. 생성된 활성 산소가 베타-아밀로이드 단량체와 결합해 산화시킴으로써 베타-아밀로이드의 응집을 방해하는 원리이다.
연구팀은 이를 무척추 동물에 적용해 알츠하이머 초파리 모델에서 신경 및 근육 접합부의 손상, 뇌 신경세포의 사멸, 운동성 및 수명 감소 등 알츠하이머 증후군에서 발견되는 증상의 완화를 확인했다.
빛을 이용한 치료법은 기존 약물 치료에 비해 적은 양의 약물로도 높은 치료효과를 볼 수 있고 부작용이 적다는 장점이 있다. 뇌질환에 적용할 수 있는 기술 개발이 완료된다면 그 활용도가 높을 것으로 예상된다.
박 교수는 “빛과 광감응화합물을 사용해 무척추 동물(초파리)에서 베타-아밀로이드 응집과 독성을 막는 것을 세계 최초로 확인한 것에 의의가 있다”며 “향후 다양한 유기 및 무기 광감응소재들의 적용가능성을 알아보고, 알츠하이머 마우스 등 척추동물을 대상으로 알츠하이머병의 광역학적 치료 가능성을 연구하고 싶다"고 말했다.
□ 그림 설명
그림 1. 포르피린과 빛을 이용해 알츠하이머 원인 물질의 응집을 제어한 모식도
그림2. 앙케반테 케미에 게재된 표지논문
2015.09.21 조회수 13748