%EC%9D%98%EC%95%BD%EB%B0%94%EC%9D%B4%EC%98%A4%EC%BB%A8%EB%B2%84%EC%A0%BC%EC%8A%A4%EC%97%B0%EA%B5%AC%EB%8B%A8
-
 김필한 교수, 초고속 레이저 생체현미경 개발
〈 김 필 한 교수 〉
우리 대학 나노과학기술대학원 김필한 교수 연구팀이 개발한 초고속 생체현미경(IVM: IntraVital Microscopy)을 통해 미래 글로벌 바이오헬스 시장을 겨냥한 상용화에 나선다.
김 교수는 (재)의약바이오컨버젼스연구단, 서울대학교 김성훈 교수와의 공동 연구를 통해 개발한 최첨단 초고속 레이저스캐닝 3차원 생체현미경 기술을 토대로 아이빔테크놀로지(주)(IVIM Technology, Inc)를 창업했다.
이 생체현미경(IntraVital Microscopy : IVM)은 수많은 세포들 간 상호작용을 통해 나타나는 생명 현상을 탐구하고 여러 질환의 복잡한 발생 과정을 밝힘으로써 기초 의생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
연구팀의 기술은 살아있는 생체 내부조직을 구성하는 세포의 움직임을 직접 관찰할 수 있다. MRI나 CT 등 기존 생체영상 기술로는 불가능한 신체 다양한 장기 내부의 수많은 세포 하나하나를 구별하고 각 세포들의 움직임을 3차원으로 즉시 확인 가능하다.
이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 초고속 생체현미경 기술은 여러 색의 레이저 빔을 이용해 기존의 조직분석 기술로는 불가능했던 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화할 수 있다.
이를 활용하면 생체 외부에서 수집한 데이터로 수립한 가정을 실제 살아있는 생체 내 환경에서 세포 단위로 검증하고 분석할 수 있다.
생체현미경은 바이오제약 분야에서도 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
연구팀의 생체현미경은 동물실험에서 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 동영상으로 관찰할 수 있다. 현재 (재)의약바이오컨버젼스연구단과 함께 차세대 신약개발을 위한 핵심기술로 발전시키기 위해 노력 중이다.
김 교수가 창업한 회사는 시장성과 성장가능성을 높게 평가받아 벤처기업으로서는 이례적으로 빠르게 창업 3개월 만에 LB인베스트먼트와 에이티넘인베스트먼트로부터 총 30억 원의 투자를 유치했다.
김 교수는 “이 기술은 다양한 생명 현상을 보다 정밀하게 종합 분석하기 위한 원천기술이다”며 “고령화 사회의 도래와 함께 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술의 발전을 가속화할 핵심 기술이 될 것으로 확신한다”고 말했다.
김 교수 연구팀의 연구는 창업원의 엔드런(End-Run) 사업과 과학기술정보통신부가 추진하는 글로벌프론티어사업의 혁신형의약바이오컨버전스사업의 지원을 받아 수행됐다.
□ 사진 설명
사진1. 초고속 레이저 생체현미경 (IVM) 사진1
사진2. 초고속 레이저 생체현미경 (IVM) 사진2
사진3. 생체 내부 세포수준 변화의 IVM 영상 결과
사진4. 생체 내부 다양한 장기의 세포수준 IVM 영상 결과
2017.11.21 조회수 25566
김필한 교수, 초고속 레이저 생체현미경 개발
〈 김 필 한 교수 〉
우리 대학 나노과학기술대학원 김필한 교수 연구팀이 개발한 초고속 생체현미경(IVM: IntraVital Microscopy)을 통해 미래 글로벌 바이오헬스 시장을 겨냥한 상용화에 나선다.
김 교수는 (재)의약바이오컨버젼스연구단, 서울대학교 김성훈 교수와의 공동 연구를 통해 개발한 최첨단 초고속 레이저스캐닝 3차원 생체현미경 기술을 토대로 아이빔테크놀로지(주)(IVIM Technology, Inc)를 창업했다.
이 생체현미경(IntraVital Microscopy : IVM)은 수많은 세포들 간 상호작용을 통해 나타나는 생명 현상을 탐구하고 여러 질환의 복잡한 발생 과정을 밝힘으로써 기초 의생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
연구팀의 기술은 살아있는 생체 내부조직을 구성하는 세포의 움직임을 직접 관찰할 수 있다. MRI나 CT 등 기존 생체영상 기술로는 불가능한 신체 다양한 장기 내부의 수많은 세포 하나하나를 구별하고 각 세포들의 움직임을 3차원으로 즉시 확인 가능하다.
이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 초고속 생체현미경 기술은 여러 색의 레이저 빔을 이용해 기존의 조직분석 기술로는 불가능했던 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화할 수 있다.
이를 활용하면 생체 외부에서 수집한 데이터로 수립한 가정을 실제 살아있는 생체 내 환경에서 세포 단위로 검증하고 분석할 수 있다.
생체현미경은 바이오제약 분야에서도 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
연구팀의 생체현미경은 동물실험에서 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 동영상으로 관찰할 수 있다. 현재 (재)의약바이오컨버젼스연구단과 함께 차세대 신약개발을 위한 핵심기술로 발전시키기 위해 노력 중이다.
김 교수가 창업한 회사는 시장성과 성장가능성을 높게 평가받아 벤처기업으로서는 이례적으로 빠르게 창업 3개월 만에 LB인베스트먼트와 에이티넘인베스트먼트로부터 총 30억 원의 투자를 유치했다.
김 교수는 “이 기술은 다양한 생명 현상을 보다 정밀하게 종합 분석하기 위한 원천기술이다”며 “고령화 사회의 도래와 함께 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술의 발전을 가속화할 핵심 기술이 될 것으로 확신한다”고 말했다.
김 교수 연구팀의 연구는 창업원의 엔드런(End-Run) 사업과 과학기술정보통신부가 추진하는 글로벌프론티어사업의 혁신형의약바이오컨버전스사업의 지원을 받아 수행됐다.
□ 사진 설명
사진1. 초고속 레이저 생체현미경 (IVM) 사진1
사진2. 초고속 레이저 생체현미경 (IVM) 사진2
사진3. 생체 내부 세포수준 변화의 IVM 영상 결과
사진4. 생체 내부 다양한 장기의 세포수준 IVM 영상 결과
2017.11.21 조회수 25566 -
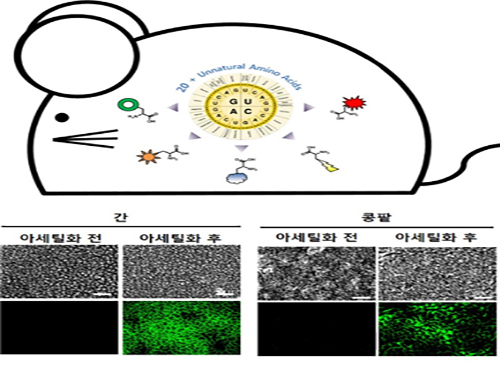 박희성 교수, 맞춤형 단백질 변형기술 동물 모델 적용에 성공
우리 대학 화학과 박희성 교수 연구팀이 아주대 의과대학 박찬배 교수와의 공동 연구를 통해 동물 모델에서 단백질의 아세틸화 변형을 조절할 수 있는 기술을 개발했다.
인간의 질병 연구에 대표적으로 쓰이는 쥐 모델에서 단백질 아세틸화를 조절할 수 있게 돼 다양한 질병의 원인을 밝힐 수 있을 것으로 기대된다.
이번 연구는 미래창조과학부의 글로벌프런티어사업(의약바이오컨버젼스연구단, 단장 김성훈)과 지능형 바이오시스템 설계 및 합성연구단(단장 김선창), 식약처의 미래 맞춤형 모델동물개발 연구사업단(단장 이한웅)의 지원을 받아 수행됐다.
이번 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 21일자 온라인 판에 게재됐다.
우리 몸의 세포에서 만들어지는 2만 여종의 단백질은 생합성 이후 인산화, 아세틸화, 당화 등 200여 종의 다양한 변형(post-translational modification)이 발생하게 된다.
세포 내 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 및 성장 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상돼 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 동물 모델에서 인위적으로 유발시키고 제어하는 기술이 존재하지 않아 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 2016년 9월 다양한 비정상 변형 단백질을 합성할 수 있는 맞춤형 단백질 변형 기술을 개발해 사이언스(Science)지에 발표한 바 있다.
연구팀은 기존 연구를 더 발전시켜 각종 암과 치매 등의 이유가 되는 퇴행성 신경질환의 원인인 비정상적인 단백질 아세틸화를 동물 모델에서 직접 구현하는 기술을 개발했다.
연구팀은 이 기술을 바탕으로 실험용 쥐의 특정한 발달 단계나 시기에 표적 단백질의 특정 위치에서 아세틸화 변형을 조절할 수 있음을 증명했다.
또한 다른 조직에 영향을 주지 않고 간이나 콩팥 등 특정 조직이나 기관에서만 표적 단백질의 아세틸화 변형 제어가 가능함을 확인했다.
연구팀은 “이 기술은 암과 치매 등 단백질의 비정상적 변형으로 발생하는 각종 질병의 바이오마커 발굴 등 질병 원인 규명 연구의 획기적인 전기를 마련할 것으로 기대된다”고 말했다.
박희성 교수는 “실용화 될 경우 지금까지 실현이 어려웠던 다양한 질병에 대한 실질적 동물 모델을 제조할 수 있을 것으로 전망된다”며 “향후 맞춤형 표적 항암제 및 뇌신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다”고 말했다.
□ 그림 설명
그림1. 아세틸화 변형 조절 마우스 개발 및 아세틸화 제어 결과
그림2. 비정상적인 단백질 변형 및 각종 질병의 모식도
2017.03.06 조회수 22369
박희성 교수, 맞춤형 단백질 변형기술 동물 모델 적용에 성공
우리 대학 화학과 박희성 교수 연구팀이 아주대 의과대학 박찬배 교수와의 공동 연구를 통해 동물 모델에서 단백질의 아세틸화 변형을 조절할 수 있는 기술을 개발했다.
인간의 질병 연구에 대표적으로 쓰이는 쥐 모델에서 단백질 아세틸화를 조절할 수 있게 돼 다양한 질병의 원인을 밝힐 수 있을 것으로 기대된다.
이번 연구는 미래창조과학부의 글로벌프런티어사업(의약바이오컨버젼스연구단, 단장 김성훈)과 지능형 바이오시스템 설계 및 합성연구단(단장 김선창), 식약처의 미래 맞춤형 모델동물개발 연구사업단(단장 이한웅)의 지원을 받아 수행됐다.
이번 연구 결과는 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 21일자 온라인 판에 게재됐다.
우리 몸의 세포에서 만들어지는 2만 여종의 단백질은 생합성 이후 인산화, 아세틸화, 당화 등 200여 종의 다양한 변형(post-translational modification)이 발생하게 된다.
세포 내 단백질들은 다양한 변형을 통해 기능과 활성이 조절되며 이러한 변형은 생체 내에서 세포 신호 전달 및 성장 등 우리 몸의 정상적인 신진대사 활동을 조절하는 매우 중요한 역할을 한다.
하지만 유전적 또는 환경적 요인으로 인해 단백질 변형이 비정상적으로 일어나면 세포의 신호 전달, 대사 활동 등이 손상돼 암, 치매, 당뇨를 포함한 다양한 중증 질환을 유발한다.
기존에는 이러한 비정상적 단백질 변형을 동물 모델에서 인위적으로 유발시키고 제어하는 기술이 존재하지 않아 질병의 원인 규명 및 신약 개발 연구에 어려움이 있었다.
박 교수팀은 2016년 9월 다양한 비정상 변형 단백질을 합성할 수 있는 맞춤형 단백질 변형 기술을 개발해 사이언스(Science)지에 발표한 바 있다.
연구팀은 기존 연구를 더 발전시켜 각종 암과 치매 등의 이유가 되는 퇴행성 신경질환의 원인인 비정상적인 단백질 아세틸화를 동물 모델에서 직접 구현하는 기술을 개발했다.
연구팀은 이 기술을 바탕으로 실험용 쥐의 특정한 발달 단계나 시기에 표적 단백질의 특정 위치에서 아세틸화 변형을 조절할 수 있음을 증명했다.
또한 다른 조직에 영향을 주지 않고 간이나 콩팥 등 특정 조직이나 기관에서만 표적 단백질의 아세틸화 변형 제어가 가능함을 확인했다.
연구팀은 “이 기술은 암과 치매 등 단백질의 비정상적 변형으로 발생하는 각종 질병의 바이오마커 발굴 등 질병 원인 규명 연구의 획기적인 전기를 마련할 것으로 기대된다”고 말했다.
박희성 교수는 “실용화 될 경우 지금까지 실현이 어려웠던 다양한 질병에 대한 실질적 동물 모델을 제조할 수 있을 것으로 전망된다”며 “향후 맞춤형 표적 항암제 및 뇌신경 치료제 개발 등 글로벌 신약 연구에 새 패러다임을 열 것이다”고 말했다.
□ 그림 설명
그림1. 아세틸화 변형 조절 마우스 개발 및 아세틸화 제어 결과
그림2. 비정상적인 단백질 변형 및 각종 질병의 모식도
2017.03.06 조회수 22369