-
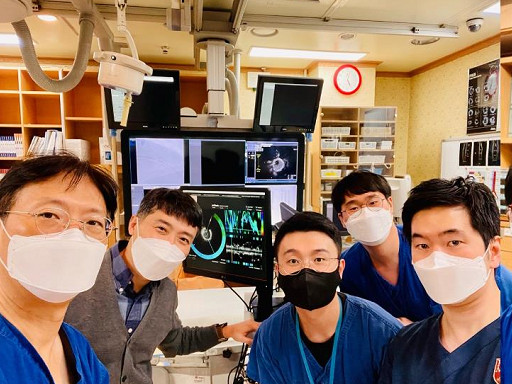 KAIST-고려대, 심혈관 진단 정밀도 높이는 영상기술 개발 및 임상 성공
우리 대학 기계공학과 유홍기 교수팀이 고려대학교 구로병원 심혈관센터 김진원 교수팀과 협력해, 관상동맥 질환의 진단 정밀도를 혁신적으로 높일 수 있는 영상기술을 개발하고, 이를 세계 최초로 사람을 대상으로 한 임상시험에 성공했다.
이번 연구에서는 광간섭단층촬영(OCT)과 형광수명영상(FLIm)을 결합한 차세대 다중 모달 영상 기술을 실제 환자에게 적용해, 심장 혈관 속 동맥경화반*의 구조뿐만 아니라 그 내부의 생화학적 조성까지 실시간으로 정밀하게 파악할 수 있음을 입증했다.
*동맥경화반: 콜레스테롤과 염증 세포 등이 동맥 벽에 쌓여 혈관이 좁아지게 만드는 병변.
기존 영상기술로는 경화반 내부의 복잡한 병변을 정확히 구분하거나 정량화하기 어려웠지만, OCT-FLIm 기술을 통해 염증, 치유반(손상 회복 흔적), 칼슘 침착 등 다양한 병리 정보를 정밀하게 구분할 수 있다. 특히, FLIm의 형광 수명 정보를 활용함으로써, 이러한 생화학적 특성이 환자의 임상 상태와 밀접하게 연관되어 있음을 확인했다.
연구진은 급성 심근경색과 같은 급성 관상동맥 증후군 환자에서는 염증 지표가 높게 나타났으며, 급속히 진행되는 병변에서는 반복된 경화반 파열과 치유로 인해 치유반이 높은 빈도로 뚜렷하게 분포하는 특징을 발견했다. 이는 심혈관 질환의 진행 정도나 개별 경화반의 상태를 보다 정밀하게 파악할 수 있는 단서를 제공한다.
이번 임상에서는 OCT와 FLIm을 완전히 통합한 융합 영상 카테터(Catheter)가 사용되었다. 연구진은 국내 환자 40명을 대상으로 실제 혈관 재개통 시술 중 해당 카테터를 삽입하여 병변을 분석했고, 모든 환자에서 시술이 안전하게 완료되었다. 이는 세계 최초로 융합 영상 카테터를 임상에 성공적으로 적용한 사례다.
*영상카테터: 관상동맥 내부에 삽입되어, 끝단에 부착된 렌즈를 통해 영상을 촬영하는 가느다란 관 모양의 의료기기
동맥경화반의 병태생리는 매우 복잡하며, 단순한 해부학적 정보만으로는 향후 심혈관 질환 발생 여부나 치료 예후를 예측하기 어렵다는 사실이 여러 연구를 통해 밝혀지고 있다. 이번 연구는 실제 환자의 혈관에서 병리학적 위험 요소를 실시간으로 시각화하고 정량화한 세계 최초로 임상 사례로, 심혈관 질환의 정밀 진단과 개인 맞춤형 치료 전략 개발에 있어 중요한 전환점이 될 것으로 기대된다.
유홍기 교수가 공동 교신저자, 남형수 연구교수가 공동 제1 저자로 참여한 이번 연구 결과는 심장학 분야 최고 권위 학술지인 미국의학회 심장학 저널, 자마 카디오로지(JAMA Cardiology, Journal of the American Medical Association)에 2025년 5월 7일 자로 게재되었다.
※ 논문명: Intracoronary Structural-Molecular Imaging for Multitargeted Characterization of High-Risk Plaque
DOI: 10.1001/jamacardio.2025.0928
이번 연구는 삼성미래기술육성사업 및 범부처전주기의료기기연구개발사업의 지원으로 수행되었다.
KAIST-고려대, 심혈관 진단 정밀도 높이는 영상기술 개발 및 임상 성공
우리 대학 기계공학과 유홍기 교수팀이 고려대학교 구로병원 심혈관센터 김진원 교수팀과 협력해, 관상동맥 질환의 진단 정밀도를 혁신적으로 높일 수 있는 영상기술을 개발하고, 이를 세계 최초로 사람을 대상으로 한 임상시험에 성공했다.
이번 연구에서는 광간섭단층촬영(OCT)과 형광수명영상(FLIm)을 결합한 차세대 다중 모달 영상 기술을 실제 환자에게 적용해, 심장 혈관 속 동맥경화반*의 구조뿐만 아니라 그 내부의 생화학적 조성까지 실시간으로 정밀하게 파악할 수 있음을 입증했다.
*동맥경화반: 콜레스테롤과 염증 세포 등이 동맥 벽에 쌓여 혈관이 좁아지게 만드는 병변.
기존 영상기술로는 경화반 내부의 복잡한 병변을 정확히 구분하거나 정량화하기 어려웠지만, OCT-FLIm 기술을 통해 염증, 치유반(손상 회복 흔적), 칼슘 침착 등 다양한 병리 정보를 정밀하게 구분할 수 있다. 특히, FLIm의 형광 수명 정보를 활용함으로써, 이러한 생화학적 특성이 환자의 임상 상태와 밀접하게 연관되어 있음을 확인했다.
연구진은 급성 심근경색과 같은 급성 관상동맥 증후군 환자에서는 염증 지표가 높게 나타났으며, 급속히 진행되는 병변에서는 반복된 경화반 파열과 치유로 인해 치유반이 높은 빈도로 뚜렷하게 분포하는 특징을 발견했다. 이는 심혈관 질환의 진행 정도나 개별 경화반의 상태를 보다 정밀하게 파악할 수 있는 단서를 제공한다.
이번 임상에서는 OCT와 FLIm을 완전히 통합한 융합 영상 카테터(Catheter)가 사용되었다. 연구진은 국내 환자 40명을 대상으로 실제 혈관 재개통 시술 중 해당 카테터를 삽입하여 병변을 분석했고, 모든 환자에서 시술이 안전하게 완료되었다. 이는 세계 최초로 융합 영상 카테터를 임상에 성공적으로 적용한 사례다.
*영상카테터: 관상동맥 내부에 삽입되어, 끝단에 부착된 렌즈를 통해 영상을 촬영하는 가느다란 관 모양의 의료기기
동맥경화반의 병태생리는 매우 복잡하며, 단순한 해부학적 정보만으로는 향후 심혈관 질환 발생 여부나 치료 예후를 예측하기 어렵다는 사실이 여러 연구를 통해 밝혀지고 있다. 이번 연구는 실제 환자의 혈관에서 병리학적 위험 요소를 실시간으로 시각화하고 정량화한 세계 최초로 임상 사례로, 심혈관 질환의 정밀 진단과 개인 맞춤형 치료 전략 개발에 있어 중요한 전환점이 될 것으로 기대된다.
유홍기 교수가 공동 교신저자, 남형수 연구교수가 공동 제1 저자로 참여한 이번 연구 결과는 심장학 분야 최고 권위 학술지인 미국의학회 심장학 저널, 자마 카디오로지(JAMA Cardiology, Journal of the American Medical Association)에 2025년 5월 7일 자로 게재되었다.
※ 논문명: Intracoronary Structural-Molecular Imaging for Multitargeted Characterization of High-Risk Plaque
DOI: 10.1001/jamacardio.2025.0928
이번 연구는 삼성미래기술육성사업 및 범부처전주기의료기기연구개발사업의 지원으로 수행되었다.
2025.05.08
조회수 2226
-
 스트레스 위험 혈관 변화 실시간으로 잡아낸다
심혈관 질환은 전 세계 사망 원인 1위로 매우 심각한 건강 문제다. 특히, 정신적 스트레스가 심혈관 질환을 더 악화시킨다는 것이 보고되어 왔다. 한국 연구진이 그동안 관찰하기 어려웠던 스트레스로 인한 혈관 변화를 실시간으로 알아내는 데 성공했다.
우리 대학 기계공학과 유홍기 교수 연구팀이 고려대학교 구로병원 심혈관센터 김진원 교수 연구팀과 협력해 심장 박동으로 인한 혈관의 움직임을 보상해 실시간으로 혈관 내 세포의 움직임을 관찰할 수 있는 새로운 생체 내 영상 획득 기술을 개발했다고 20일 밝혔다.
연구팀은 초점 가변 렌즈를 생체 내 광학 현미경에 도입해 동맥의 움직임을 추정했고, 이를 현미경의 초점 평면과 동기화하는 기법을 개발했다. 이 기술을 통해 동맥의 움직임으로 인한 이미지 간의 상관 계수(이미지들 간의 유사성을 나타내는 통계적 지표)를 4배 높일 수 있었고, 시간해상도(단위 시간당 촬영 가능한 이미지 수)를 57% 향상해 혈관 내 면역세포의 빠른 움직임을 실시간으로 관찰했다.
즉, 이 기술을 통해 동맥의 움직임으로 인한 영상 왜곡을 크게 줄이고 초점을 안정적으로 유지함으로써, 영상을 놓치지 않고 혈관 내에서 빠르게 움직이는 면역세포를 실시간으로 관찰하는 데 성공했다.
연구팀은 만성 스트레스에 노출된 실험군 쥐와 대조군 쥐의 경동맥에서 생체 내 영상 획득에 본 기술을 적용했고, 동맥경화 병변의 진행 정도를 세포 수준의 해상도에서 정량적으로 평가할 수 있었다.
만성 스트레스에 노출된 쥐의 경동맥에서 골수 세포의 침윤이 대조군 대비 6.09배 증가했으며, 추적 영상에서는 골수 세포가 2.45배 더 증가하는 것을 확인했다. 또한, 조직학적 분석을 통해 스트레스가 동맥경화반의 크기와 염증을 증가시키고, 섬유성 막을 얇게 만들어 경화반의 불안정성을 높인다는 것을 입증했다.
유홍기 교수는 “이번 연구를 통해 비접촉 방법으로 동맥의 움직임을 정확하게 추정할 수 있었고, 이 방법은 실험동물의 높은 생존율을 보장할 수 있어 만성 스트레스가 미치는 영향을 종단 연구로 입증할 수 있었다”라고 말했다.
이어 유 교수는 “이 기술은 우수한 시간 해상도를 제공해 스트레스가 심혈관 질환에 미치는 영향을 세포 수준에서 실시간으로 관찰할 수 있어 앞으로 스트레스 관련 심혈관 질환의 발병 기전을 규명하고 새로운 치료법을 개발하는 데 중요한 도구로 활용될 것으로 기대하고 있다”라고 강조했다.
기계공학과 장민석 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘동맥경화, 혈전, 혈관 생물학(Arteriosclerosis, Thrombosis, and Vascular Biology)’에 지난해 10월 10일 온라인판 게재됐고, 44권 12호에 표지논문과 에디터픽으로 선정됐다.
(논문명: Real-time imaging assessment of stress-induced vascular inflammation using heartbeat-synchronized motion compensation)
한편 이번 연구는 한국연구재단, 범부처전주기의료기기연구개발사업단의 지원을 받아 수행됐다.
스트레스 위험 혈관 변화 실시간으로 잡아낸다
심혈관 질환은 전 세계 사망 원인 1위로 매우 심각한 건강 문제다. 특히, 정신적 스트레스가 심혈관 질환을 더 악화시킨다는 것이 보고되어 왔다. 한국 연구진이 그동안 관찰하기 어려웠던 스트레스로 인한 혈관 변화를 실시간으로 알아내는 데 성공했다.
우리 대학 기계공학과 유홍기 교수 연구팀이 고려대학교 구로병원 심혈관센터 김진원 교수 연구팀과 협력해 심장 박동으로 인한 혈관의 움직임을 보상해 실시간으로 혈관 내 세포의 움직임을 관찰할 수 있는 새로운 생체 내 영상 획득 기술을 개발했다고 20일 밝혔다.
연구팀은 초점 가변 렌즈를 생체 내 광학 현미경에 도입해 동맥의 움직임을 추정했고, 이를 현미경의 초점 평면과 동기화하는 기법을 개발했다. 이 기술을 통해 동맥의 움직임으로 인한 이미지 간의 상관 계수(이미지들 간의 유사성을 나타내는 통계적 지표)를 4배 높일 수 있었고, 시간해상도(단위 시간당 촬영 가능한 이미지 수)를 57% 향상해 혈관 내 면역세포의 빠른 움직임을 실시간으로 관찰했다.
즉, 이 기술을 통해 동맥의 움직임으로 인한 영상 왜곡을 크게 줄이고 초점을 안정적으로 유지함으로써, 영상을 놓치지 않고 혈관 내에서 빠르게 움직이는 면역세포를 실시간으로 관찰하는 데 성공했다.
연구팀은 만성 스트레스에 노출된 실험군 쥐와 대조군 쥐의 경동맥에서 생체 내 영상 획득에 본 기술을 적용했고, 동맥경화 병변의 진행 정도를 세포 수준의 해상도에서 정량적으로 평가할 수 있었다.
만성 스트레스에 노출된 쥐의 경동맥에서 골수 세포의 침윤이 대조군 대비 6.09배 증가했으며, 추적 영상에서는 골수 세포가 2.45배 더 증가하는 것을 확인했다. 또한, 조직학적 분석을 통해 스트레스가 동맥경화반의 크기와 염증을 증가시키고, 섬유성 막을 얇게 만들어 경화반의 불안정성을 높인다는 것을 입증했다.
유홍기 교수는 “이번 연구를 통해 비접촉 방법으로 동맥의 움직임을 정확하게 추정할 수 있었고, 이 방법은 실험동물의 높은 생존율을 보장할 수 있어 만성 스트레스가 미치는 영향을 종단 연구로 입증할 수 있었다”라고 말했다.
이어 유 교수는 “이 기술은 우수한 시간 해상도를 제공해 스트레스가 심혈관 질환에 미치는 영향을 세포 수준에서 실시간으로 관찰할 수 있어 앞으로 스트레스 관련 심혈관 질환의 발병 기전을 규명하고 새로운 치료법을 개발하는 데 중요한 도구로 활용될 것으로 기대하고 있다”라고 강조했다.
기계공학과 장민석 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘동맥경화, 혈전, 혈관 생물학(Arteriosclerosis, Thrombosis, and Vascular Biology)’에 지난해 10월 10일 온라인판 게재됐고, 44권 12호에 표지논문과 에디터픽으로 선정됐다.
(논문명: Real-time imaging assessment of stress-induced vascular inflammation using heartbeat-synchronized motion compensation)
한편 이번 연구는 한국연구재단, 범부처전주기의료기기연구개발사업단의 지원을 받아 수행됐다.
2025.01.22
조회수 3479
-
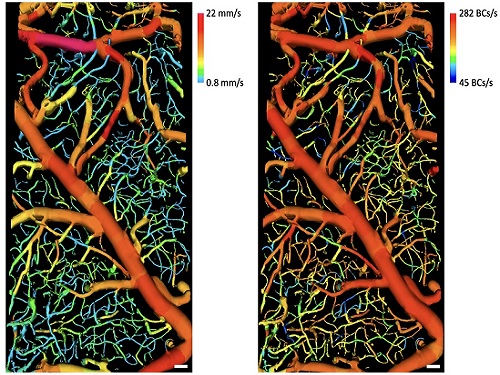 조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.11.01
조회수 5309
-
 희귀질환 환자 치료제 개발 가능해지다
희귀질환들, 특히 뇌나 눈같이 재생되지 않는 조직을 손상시키는 질병들은, 한 번 증상이 시작되면 치료를 통해 되돌릴 수 없기 때문에 증상이 시작되기 전에 진단하고 치료를 시작하는 것이 중요하다. 대부분 희귀질환에 대해서는 치료제가 없는데, 환자맞춤형 치료제 개발이 가능함을 제시해 화제다.
우리 대학 의과학대학원 김진국 교수 연구팀이 희귀질환 환자맞춤형 치료에 가이드라인을 제시하는 연구 결과를 세계 최고 권위의 학술지 중 하나인 ‘네이처(Nature)’지에 발표했다고 13일 밝혔다.
연구 결과에 따르면 이러한 환자 중에서도 약 10%에 대해서는 환자맞춤형 치료제 개발이 가능하다는 것이다. 또한 그 10%의 환자들을 유전체 기반 진단을 활용해 증상이 시작되기 전이라도 신속하고 체계적으로 선별하는 방법을 연구팀은 제시했다.
지금까지는 진단이 되더라도 대부분의 경우 치료제가 없기 때문에 환자들과 가족들이 진단에 소극적인 경우가 있었으나 이번 연구결과를 통해 같은 질환이라도 돌연변이에 따라서 환자맞춤형 치료가 가능할 수 있다는 것이 확인되었기 때문에 유전체 기반 진단에 더 적극적으로 참여함으로써 환자들을 조기에 진단하고 하고 치료를 고려할 수 있을 것으로 기대된다.
향후 유전체 기반 진단의 비용이 크게 떨어지면서 유전체 기반의 진단이 환자뿐만 아니라 모든 신생아에게도 적용되기 시작하면 증상이 시작되기 전에 진단되고 환자맞춤형 치료가 시작되는 사례가 많아질 것으로 기대된다. 실제로 연구팀은 이번 연구에서 신생아 때 유전체 분석을 통해 진단된 환자 1명에 대해서 환자맞춤형 치료제 개발을 진행하고 환자맞춤형 임상시험에 진입한 사례를 보고했다.
김진국 교수는 하버드 의과대학 박사후연구원으로 근무하던 지난 2019년에 RNA기반 신약 개발 플랫폼을 활용해 희귀질환 환자 한 명에 대한 밀라센(milasen)이라는 환자맞춤형 치료제를 세계 최초로 개발하고 세계 최고 권위의 학술지 중 하나인 ‘뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)’지에 발표한 바 있다.
본 연구는 김 교수가 3년 전 KAIST에 조교수로 부임한 후 진행한 후속 연구로서, 김 교수는 모세혈관 확장성 운동실조 증후군(ataxia-telangiectasia 또는 A-T)이라는 희귀질환에 대한 미국의 환자 재단과의 협업을 통해 대규모 환자군에 대한 유전체 분석으로 약 10%의 환자들에 대해 환자맞춤형 치료가 가능하다는 것을 보이고 유전체 검사를 통해서 이런 환자들을 효과적으로 발굴하는 체계를 제시하고 검증했다. 또한 이를 통해 발견한 환자맞춤형 치료가능 환자 중 치료의 성공 가능성이 가장 큰 환자 1명에 대해서 환자맞춤형 치료가능 돌연변이를 확인하고 환자맞춤형 치료제인 아티펙센(atipeksen)을 개발 후 그 환자에 대한 맞춤형 임상시험을 진행하고 있는 사례를 보고했다.
우리 대학에서는 김진국 교수가 공동교신저자, 의과학대학원 우시재 박사과정 학생이 공동 제1 저자로 참여하고 A-T 아동 프로젝트(A-T Children’s Project) 재단 및 하버드 의과대학과의 협업으로 진행한 이번 연구는 국제 학술지 네이처(Nature)지에 7월 12일 온라인(advanced online publication) 형태로 출판됐다. (논문명 : A framework for individualized splice-switching oligonucleotide therapy).
김 교수는 "이번 연구는 희귀질환 환자들의 진료에 있어서, 지금까지 진단 위주의 진료에서 치료 위주의 치료로의 전환을 가속화할 것이며, 지난 2013년 환자의 진단을 위해 정립되었던 미국임상유전학회(ACMG) 가이드라인 연구가 발표된 이후 희귀질환 진료 가이드라인에 있어서 패러다임의 전환을 가져올 것ˮ 이라고 말했다.
또한 “환자맞춤형 치료전략은 현재로서는 기술적인 이유로 뇌, 눈, 및 간에 영향을 미치는 질환들에만 적용할 수 있지만 추후 기술개발을 통해서 다른 질병들에도 적용될 가능성이 있다”고 덧붙였다.
이번 연구는 한국연구재단 해외우수과학자유치사업Plus(Brain Pool Plus) 사업, 기초연구실 사업, 국가바이오빅데이터 사업, 의사과학자양성 사업, 아산사회복지재단의 지원을 받아 수행됐다.
희귀질환 환자 치료제 개발 가능해지다
희귀질환들, 특히 뇌나 눈같이 재생되지 않는 조직을 손상시키는 질병들은, 한 번 증상이 시작되면 치료를 통해 되돌릴 수 없기 때문에 증상이 시작되기 전에 진단하고 치료를 시작하는 것이 중요하다. 대부분 희귀질환에 대해서는 치료제가 없는데, 환자맞춤형 치료제 개발이 가능함을 제시해 화제다.
우리 대학 의과학대학원 김진국 교수 연구팀이 희귀질환 환자맞춤형 치료에 가이드라인을 제시하는 연구 결과를 세계 최고 권위의 학술지 중 하나인 ‘네이처(Nature)’지에 발표했다고 13일 밝혔다.
연구 결과에 따르면 이러한 환자 중에서도 약 10%에 대해서는 환자맞춤형 치료제 개발이 가능하다는 것이다. 또한 그 10%의 환자들을 유전체 기반 진단을 활용해 증상이 시작되기 전이라도 신속하고 체계적으로 선별하는 방법을 연구팀은 제시했다.
지금까지는 진단이 되더라도 대부분의 경우 치료제가 없기 때문에 환자들과 가족들이 진단에 소극적인 경우가 있었으나 이번 연구결과를 통해 같은 질환이라도 돌연변이에 따라서 환자맞춤형 치료가 가능할 수 있다는 것이 확인되었기 때문에 유전체 기반 진단에 더 적극적으로 참여함으로써 환자들을 조기에 진단하고 하고 치료를 고려할 수 있을 것으로 기대된다.
향후 유전체 기반 진단의 비용이 크게 떨어지면서 유전체 기반의 진단이 환자뿐만 아니라 모든 신생아에게도 적용되기 시작하면 증상이 시작되기 전에 진단되고 환자맞춤형 치료가 시작되는 사례가 많아질 것으로 기대된다. 실제로 연구팀은 이번 연구에서 신생아 때 유전체 분석을 통해 진단된 환자 1명에 대해서 환자맞춤형 치료제 개발을 진행하고 환자맞춤형 임상시험에 진입한 사례를 보고했다.
김진국 교수는 하버드 의과대학 박사후연구원으로 근무하던 지난 2019년에 RNA기반 신약 개발 플랫폼을 활용해 희귀질환 환자 한 명에 대한 밀라센(milasen)이라는 환자맞춤형 치료제를 세계 최초로 개발하고 세계 최고 권위의 학술지 중 하나인 ‘뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)’지에 발표한 바 있다.
본 연구는 김 교수가 3년 전 KAIST에 조교수로 부임한 후 진행한 후속 연구로서, 김 교수는 모세혈관 확장성 운동실조 증후군(ataxia-telangiectasia 또는 A-T)이라는 희귀질환에 대한 미국의 환자 재단과의 협업을 통해 대규모 환자군에 대한 유전체 분석으로 약 10%의 환자들에 대해 환자맞춤형 치료가 가능하다는 것을 보이고 유전체 검사를 통해서 이런 환자들을 효과적으로 발굴하는 체계를 제시하고 검증했다. 또한 이를 통해 발견한 환자맞춤형 치료가능 환자 중 치료의 성공 가능성이 가장 큰 환자 1명에 대해서 환자맞춤형 치료가능 돌연변이를 확인하고 환자맞춤형 치료제인 아티펙센(atipeksen)을 개발 후 그 환자에 대한 맞춤형 임상시험을 진행하고 있는 사례를 보고했다.
우리 대학에서는 김진국 교수가 공동교신저자, 의과학대학원 우시재 박사과정 학생이 공동 제1 저자로 참여하고 A-T 아동 프로젝트(A-T Children’s Project) 재단 및 하버드 의과대학과의 협업으로 진행한 이번 연구는 국제 학술지 네이처(Nature)지에 7월 12일 온라인(advanced online publication) 형태로 출판됐다. (논문명 : A framework for individualized splice-switching oligonucleotide therapy).
김 교수는 "이번 연구는 희귀질환 환자들의 진료에 있어서, 지금까지 진단 위주의 진료에서 치료 위주의 치료로의 전환을 가속화할 것이며, 지난 2013년 환자의 진단을 위해 정립되었던 미국임상유전학회(ACMG) 가이드라인 연구가 발표된 이후 희귀질환 진료 가이드라인에 있어서 패러다임의 전환을 가져올 것ˮ 이라고 말했다.
또한 “환자맞춤형 치료전략은 현재로서는 기술적인 이유로 뇌, 눈, 및 간에 영향을 미치는 질환들에만 적용할 수 있지만 추후 기술개발을 통해서 다른 질병들에도 적용될 가능성이 있다”고 덧붙였다.
이번 연구는 한국연구재단 해외우수과학자유치사업Plus(Brain Pool Plus) 사업, 기초연구실 사업, 국가바이오빅데이터 사업, 의사과학자양성 사업, 아산사회복지재단의 지원을 받아 수행됐다.
2023.07.13
조회수 7767
-
 무선으로 심혈관 모니터링 실시간 가능
실시간 혈역학(Hemodynamic) 모니터링은 심혈관 질환을 앓는 환자의 수술 전후 관리에 도움을 준다. 이에 일상에서 실시간으로 심혈관 내 압력, 유량 및 온도 측정을 제공할 수 있는 무선 인체이식형 의료기술에 대한 수요가 증가하고 있다.
우리 대학 전기및전자공학부 권경하 교수가 배터리 없이 실시간으로 심혈관 내 압력, 유량, 온도를 측정해 심혈관 기능을 진단하는 무선 심혈관 임플란트를 개발했다고 24일 밝혔다.
권경하 교수 연구팀과 미국 노스웨스턴대학교 김종욱 박사가 공동연구를 통해 개발한 이 기술은 국제 학술지 네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)에 4월 11일 발표됐다 (논문명 : A battery-less wireless implant for the continuous monitoring of vascular pressure, flow rate and temperature; URL: https://www.nature.com/articles/s41551-023-01022-4)
현재는 침상 모니터에 연결된 유선 테더(tether)와 함께 센서를 동맥에 삽입해 동맥압과 혈류 속도 측정이 가능하지만, 유선 인터페이스가 심혈관 손상 및 감염이나 측정 정확도 저하로 이어질 수 있으므로 병원에서 움직이지 않는 환자를 위해 일시적으로 사용하는 것으로 제한된다. 전문 의료 시설에 접근하지 않고 언제 어디서나 환자의 수술 후 모니터링을 지원하기 위해, 배터리 없이 무선으로 작동하는 임플란트 시스템을 개발하는 것이 핵심 과제다.
이에 연구팀은 무선 통신 및 무선 전력 전송 기술을 이용해 심혈관 내에서 배터리 없이 실시간으로 압력, 유속 및 온도를 측정할 수 있는 이식형 무선 측정 시스템을 개발했다.
연구팀은 배터리 없이 무선으로 동작하는 압력, 유속 및 온도를 측정하는 임플란트 기기를 실제로 제작해, 돼지의 폐동맥 및 양의 대동맥과 좌심실에서 기존 임상 기기와 유사한 성능을 보이는 데 성공했다. 이러한 기술은 혈역학 기능을 객관적이고 정확하게 측정해 심장 환자의 치료와 삶의 질을 개선할 수 있는 잠재력을 가지고 있으며, 가정 또는 병원에서 환자의 행동 제약 없이 언제든지 모바일 모니터링이 가능해진다.
연구를 주도한 권경하 교수는 “앞으로 심장판막 대동맥 이식술(TAVI) 후 경사도 및 기타 유출 검사, 뇌동맥류용 흐름 전환기 내부의 압력 및 유량 측정, 흉부 내 대동맥 내시경적 수술(TEVAR) 및 복부 대동맥류 내시경적 수술(EVAR) - 엔돌릭 감시 등 다양한 임상 분야에서 사용될 수 있을 것으로 기대된다”고 말했다.
한편 이번 연구는 한국연구재단(NRF) 기본연구, 우수신진연구, 지역혁신 선도연구센터 과제의 지원을 받아 수행됐다.
무선으로 심혈관 모니터링 실시간 가능
실시간 혈역학(Hemodynamic) 모니터링은 심혈관 질환을 앓는 환자의 수술 전후 관리에 도움을 준다. 이에 일상에서 실시간으로 심혈관 내 압력, 유량 및 온도 측정을 제공할 수 있는 무선 인체이식형 의료기술에 대한 수요가 증가하고 있다.
우리 대학 전기및전자공학부 권경하 교수가 배터리 없이 실시간으로 심혈관 내 압력, 유량, 온도를 측정해 심혈관 기능을 진단하는 무선 심혈관 임플란트를 개발했다고 24일 밝혔다.
권경하 교수 연구팀과 미국 노스웨스턴대학교 김종욱 박사가 공동연구를 통해 개발한 이 기술은 국제 학술지 네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)에 4월 11일 발표됐다 (논문명 : A battery-less wireless implant for the continuous monitoring of vascular pressure, flow rate and temperature; URL: https://www.nature.com/articles/s41551-023-01022-4)
현재는 침상 모니터에 연결된 유선 테더(tether)와 함께 센서를 동맥에 삽입해 동맥압과 혈류 속도 측정이 가능하지만, 유선 인터페이스가 심혈관 손상 및 감염이나 측정 정확도 저하로 이어질 수 있으므로 병원에서 움직이지 않는 환자를 위해 일시적으로 사용하는 것으로 제한된다. 전문 의료 시설에 접근하지 않고 언제 어디서나 환자의 수술 후 모니터링을 지원하기 위해, 배터리 없이 무선으로 작동하는 임플란트 시스템을 개발하는 것이 핵심 과제다.
이에 연구팀은 무선 통신 및 무선 전력 전송 기술을 이용해 심혈관 내에서 배터리 없이 실시간으로 압력, 유속 및 온도를 측정할 수 있는 이식형 무선 측정 시스템을 개발했다.
연구팀은 배터리 없이 무선으로 동작하는 압력, 유속 및 온도를 측정하는 임플란트 기기를 실제로 제작해, 돼지의 폐동맥 및 양의 대동맥과 좌심실에서 기존 임상 기기와 유사한 성능을 보이는 데 성공했다. 이러한 기술은 혈역학 기능을 객관적이고 정확하게 측정해 심장 환자의 치료와 삶의 질을 개선할 수 있는 잠재력을 가지고 있으며, 가정 또는 병원에서 환자의 행동 제약 없이 언제든지 모바일 모니터링이 가능해진다.
연구를 주도한 권경하 교수는 “앞으로 심장판막 대동맥 이식술(TAVI) 후 경사도 및 기타 유출 검사, 뇌동맥류용 흐름 전환기 내부의 압력 및 유량 측정, 흉부 내 대동맥 내시경적 수술(TEVAR) 및 복부 대동맥류 내시경적 수술(EVAR) - 엔돌릭 감시 등 다양한 임상 분야에서 사용될 수 있을 것으로 기대된다”고 말했다.
한편 이번 연구는 한국연구재단(NRF) 기본연구, 우수신진연구, 지역혁신 선도연구센터 과제의 지원을 받아 수행됐다.
2023.04.24
조회수 7774
-
 손상된 혈관을 정상화하는 새로운 항체를 만들다
혈관은 인체 건강에 핵심적 역할을 한다. 세포에 산소와 영양분을 공급하고, 노폐물을 배설기관으로 옮기며, 면역세포들의 이동을 돕기 때문이다. 혈관의 항상성은 Angiopoietin-TIE2 신호전달체계를 통해 조절된다. 하지만, 암, 패혈증, 당뇨성 망막병증, 족부궤양 등의 질환에서는 혈관 내피세포와 주변 지지세포들이 파괴되면서 심각한 혈관 손상이 일어난다. 이에 국내외 제약회사들이 앞다투어 손상된 혈관의 TIE2를 활성화시키는 치료제 개발에 뛰어들고 있다.
우리 대학 의과학대학원 김호민 교수(기초과학연구원(IBS) 바이오분자 및 세포구조 연구단 CI), 고규영 특훈교수(기초과학연구원(IBS) 혈관 연구단장) 연구팀은 질병 상황에서 손상된 혈관을 정상화하는 항체를 새롭게 개발하고, 3차원 분자구조를 규명하여 치료항체의 작동 기전을 제시했다. 암, 패혈증 등 혈관 손상을 동반하는 다양한 질병의 치료제 개발에 기여할 것으로 기대된다.
Angiopoietin1 단백질은 혈관 내피세포의 TIE2 수용체에 결합하여 세포표면 응집을 유도한다. 이 과정이 TIE2 활성화와 혈관 안정화 유도에 핵심적인 역할을 한다. 현재까지의 TIE2 활성화 유도 치료제는 대부분 단백질 엔지니어링을 통한 Angiopoietin 변이체 개발에 집중되었다. 그러나 이 전략은 낮은 생산성과 안정성, 생체 내 짧은 반감기 등의 문제가 있었다.
연구진은 기존 TIE2 활성화를 유도하는 치료제 개발과는 다른 전략을 채택하였다. 그 결과 혈관 내피세포의 TIE2 수용체에 결합하여 성장과 안정화를 유도하는 “TIE2 활성 항체(hTAAB)” 개발에 성공했다. 또한 단백질 결정학과 바이오투과전자현미경 등을 활용, TIE2 활성 항체와 TIE2의 결합 분자구조와 항체에 의한 TIE2 수용체의 활성화 분자기전도 규명했다.
연구진은 TIE2 수용체/Angiopoietin의 결합 분자구조를 바탕으로 TIE2 수용체에 직접 결합해 응집과 활성화를 유도하지만, Angiopoietin 결합에는 영향을 미치지 않는 항체를 새로 개발하고자 하였다. 이에 마우스 하이브리도마 기술과 혈관 내피세포를 활용한 효능평가를 통해 가장 효과적인 항체를 선별하였고, 단백질 결정학으로 TIE2 수용체와 TIE2 활성항체(hTAAB)의 상호작용에 핵심적인 분자코드를 규명하였다. 또한 바이오투과전자현미경으로 Y자 형태의 항체가 TIE2에 순차 결합하여 다각형 형태로 TIE2수용체의 클러스터(응집)를 유도하는 분자메커니즘을 규명해냈다. 이를 바탕으로 TIE2 인간화 항체 개발에도 성공했다.
김호민 교수는 “TIE2 수용체 활성 항체가 TIE2를 다각형 형태로 응집을 유도하여 활성화시키는 것은 새로운 발견”이라며 “두 연구실의 협력을 통하여 우수한 성과를 거둔 대표 사례이며, 기초연구와 응용․개발연구가 서로 다른 영역이 아님을 보여주는 연구”라고 말했다. 고규영 교수는 “향후 동물실험의 효과 검증을 통해 혈관 이상으로 인한 다양한 질환 치료제 개발로 연계되기를 기대한다”라고 말했다.
우리 대학 의과학대학원 김호민 교수와 고규영 교수가 주도하고, 기초과학연구원 조경희 박사와 배점일 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 ‘네이처 커뮤니케이션즈 (Nature Communications, IF 14.919)’ 온라인 판 11월 1일 자에 게재됐다.
손상된 혈관을 정상화하는 새로운 항체를 만들다
혈관은 인체 건강에 핵심적 역할을 한다. 세포에 산소와 영양분을 공급하고, 노폐물을 배설기관으로 옮기며, 면역세포들의 이동을 돕기 때문이다. 혈관의 항상성은 Angiopoietin-TIE2 신호전달체계를 통해 조절된다. 하지만, 암, 패혈증, 당뇨성 망막병증, 족부궤양 등의 질환에서는 혈관 내피세포와 주변 지지세포들이 파괴되면서 심각한 혈관 손상이 일어난다. 이에 국내외 제약회사들이 앞다투어 손상된 혈관의 TIE2를 활성화시키는 치료제 개발에 뛰어들고 있다.
우리 대학 의과학대학원 김호민 교수(기초과학연구원(IBS) 바이오분자 및 세포구조 연구단 CI), 고규영 특훈교수(기초과학연구원(IBS) 혈관 연구단장) 연구팀은 질병 상황에서 손상된 혈관을 정상화하는 항체를 새롭게 개발하고, 3차원 분자구조를 규명하여 치료항체의 작동 기전을 제시했다. 암, 패혈증 등 혈관 손상을 동반하는 다양한 질병의 치료제 개발에 기여할 것으로 기대된다.
Angiopoietin1 단백질은 혈관 내피세포의 TIE2 수용체에 결합하여 세포표면 응집을 유도한다. 이 과정이 TIE2 활성화와 혈관 안정화 유도에 핵심적인 역할을 한다. 현재까지의 TIE2 활성화 유도 치료제는 대부분 단백질 엔지니어링을 통한 Angiopoietin 변이체 개발에 집중되었다. 그러나 이 전략은 낮은 생산성과 안정성, 생체 내 짧은 반감기 등의 문제가 있었다.
연구진은 기존 TIE2 활성화를 유도하는 치료제 개발과는 다른 전략을 채택하였다. 그 결과 혈관 내피세포의 TIE2 수용체에 결합하여 성장과 안정화를 유도하는 “TIE2 활성 항체(hTAAB)” 개발에 성공했다. 또한 단백질 결정학과 바이오투과전자현미경 등을 활용, TIE2 활성 항체와 TIE2의 결합 분자구조와 항체에 의한 TIE2 수용체의 활성화 분자기전도 규명했다.
연구진은 TIE2 수용체/Angiopoietin의 결합 분자구조를 바탕으로 TIE2 수용체에 직접 결합해 응집과 활성화를 유도하지만, Angiopoietin 결합에는 영향을 미치지 않는 항체를 새로 개발하고자 하였다. 이에 마우스 하이브리도마 기술과 혈관 내피세포를 활용한 효능평가를 통해 가장 효과적인 항체를 선별하였고, 단백질 결정학으로 TIE2 수용체와 TIE2 활성항체(hTAAB)의 상호작용에 핵심적인 분자코드를 규명하였다. 또한 바이오투과전자현미경으로 Y자 형태의 항체가 TIE2에 순차 결합하여 다각형 형태로 TIE2수용체의 클러스터(응집)를 유도하는 분자메커니즘을 규명해냈다. 이를 바탕으로 TIE2 인간화 항체 개발에도 성공했다.
김호민 교수는 “TIE2 수용체 활성 항체가 TIE2를 다각형 형태로 응집을 유도하여 활성화시키는 것은 새로운 발견”이라며 “두 연구실의 협력을 통하여 우수한 성과를 거둔 대표 사례이며, 기초연구와 응용․개발연구가 서로 다른 영역이 아님을 보여주는 연구”라고 말했다. 고규영 교수는 “향후 동물실험의 효과 검증을 통해 혈관 이상으로 인한 다양한 질환 치료제 개발로 연계되기를 기대한다”라고 말했다.
우리 대학 의과학대학원 김호민 교수와 고규영 교수가 주도하고, 기초과학연구원 조경희 박사와 배점일 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 ‘네이처 커뮤니케이션즈 (Nature Communications, IF 14.919)’ 온라인 판 11월 1일 자에 게재됐다.
2021.11.02
조회수 13258
-
 고규영 특훈교수 연구팀, 대사적으로 건강한 비만을 유도하는 원리 밝혔다
대사적으로 건강한 비만을 유도하는 원리가 밝혀졌다. 기초과학연구원(IBS, 원장 노도영) 혈관연구단 고규영 단장(우리 대학 의과학대학원 특훈교수) 연구팀은 혈관 생성을 촉진하는 단백질 ‘안지오포이에틴-2(Angiopoietin-2)’가 건강한 지방 축적 작용의 핵심요소임을 규명했다. 대사 기능에 대한 혈관의 역할과 지방 축적 기전을 이해함으로써 비만, 당뇨병, 고혈압 등 대사질환 치료에 새길을 열 것으로 기대된다.
대사적으로 건강한 비만은 일반 비만에 비해 내장지방 축적이 적으며, 인슐린 저항성 수치, 혈압, 심혈관 질환 발병 위험이 낮다. 비만으로 인해 당 대사기능을 하는 간, 근육 등에 지방이 비정상적으로 축적되면 대사합병증 발병 위험이 높아지는데, 건강한 비만의 경우 혈중 지방이 주로 피하지방으로 축적되기 때문이다.
지방의 축적에는 모세혈관이 관여한다고 알려져 있다. 지방산전달인자들이 모세혈관에서 발현하고, 이들 인자는 모세혈관을 통해 지방의 주구성원인 지방산을 전달하여 지방세포로 축적시킨다. 모세혈관이 지방 축적을 위한 지방산의 전달자이자 이동통로인 셈이다. 그러나 이렇게 비만에 중요한 역할을 하는 모세혈관의 기능을 관장하는 요인과 기전은 밝혀지지 않았다.
이번 연구에서는 안지오포이에틴-2가 피하지방 모세혈관 내 지방산전달인자를 조절하여 건강한 비만을 유도하는 원리를 밝혀 기존의 한계를 극복했다. 연구팀은 피하지방 혈관에 특정 지방산전달인자들이 분포한다는 사실에 주목했다. 우선 건강한 비만환자의 피하지방에만 발현하는 물질을 찾기 위해 건강한 비만 환자군과 일반적인 비만 환자군을 비교분석했다. 그 결과 안지오포이에틴-2가 건강한 비만 환자의 피하지방에만 발현하는 유일한 분비 물질임을 발견했다. 안지오포이에틴-2가 건강한 지방 축적에 핵심 역할을 한다는 의미다. 실제로 안지오포이에틴-2를 지방세포에서 비활성화시킨 생쥐 모델에서 혈중 지방의 피하지방 축적이 감소하는 한편, 간‧골격근‧갈색지방 등에 비정상적으로 축적되어 인슐린 기능과 신진대사에 이상이 생겼다.
나아가 안지오포이에틴-2와 결합하는 ‘인테그린(Integrin)’수용체가 피하지방 혈관에 한해 발현함을 확인했다. 이어 혈관내피세포에서 수용체를 활성화시킨 결과 안지오포이에틴-2에 의한 지방산 전달이 크게 증가했다. 요컨대 인테그린 수용체에 안지오포이에틴-2가 결합하여 지방산전달인자들을 조절함으로써 피하지방으로만 지방을 전달하고 축적시키는 것이다.
배호성 선임연구원은 “혈관의 대사기능을 조절하여 피하지방에 선택적으로 혈중 지방이 축적될 수 있음을 밝혔다”며 “비만, 당뇨병 등 대사질환 치료에 새로운 접근법을 제시할 수 있을 것”이라고 전했다.
이번 연구결과는 국제 학술지 네이처 커뮤니케이션즈(Nature Communications, IF 11.878) 온라인판에 6월 12일 오후 7시(한국시간) 게재됐다.
고규영 특훈교수 연구팀, 대사적으로 건강한 비만을 유도하는 원리 밝혔다
대사적으로 건강한 비만을 유도하는 원리가 밝혀졌다. 기초과학연구원(IBS, 원장 노도영) 혈관연구단 고규영 단장(우리 대학 의과학대학원 특훈교수) 연구팀은 혈관 생성을 촉진하는 단백질 ‘안지오포이에틴-2(Angiopoietin-2)’가 건강한 지방 축적 작용의 핵심요소임을 규명했다. 대사 기능에 대한 혈관의 역할과 지방 축적 기전을 이해함으로써 비만, 당뇨병, 고혈압 등 대사질환 치료에 새길을 열 것으로 기대된다.
대사적으로 건강한 비만은 일반 비만에 비해 내장지방 축적이 적으며, 인슐린 저항성 수치, 혈압, 심혈관 질환 발병 위험이 낮다. 비만으로 인해 당 대사기능을 하는 간, 근육 등에 지방이 비정상적으로 축적되면 대사합병증 발병 위험이 높아지는데, 건강한 비만의 경우 혈중 지방이 주로 피하지방으로 축적되기 때문이다.
지방의 축적에는 모세혈관이 관여한다고 알려져 있다. 지방산전달인자들이 모세혈관에서 발현하고, 이들 인자는 모세혈관을 통해 지방의 주구성원인 지방산을 전달하여 지방세포로 축적시킨다. 모세혈관이 지방 축적을 위한 지방산의 전달자이자 이동통로인 셈이다. 그러나 이렇게 비만에 중요한 역할을 하는 모세혈관의 기능을 관장하는 요인과 기전은 밝혀지지 않았다.
이번 연구에서는 안지오포이에틴-2가 피하지방 모세혈관 내 지방산전달인자를 조절하여 건강한 비만을 유도하는 원리를 밝혀 기존의 한계를 극복했다. 연구팀은 피하지방 혈관에 특정 지방산전달인자들이 분포한다는 사실에 주목했다. 우선 건강한 비만환자의 피하지방에만 발현하는 물질을 찾기 위해 건강한 비만 환자군과 일반적인 비만 환자군을 비교분석했다. 그 결과 안지오포이에틴-2가 건강한 비만 환자의 피하지방에만 발현하는 유일한 분비 물질임을 발견했다. 안지오포이에틴-2가 건강한 지방 축적에 핵심 역할을 한다는 의미다. 실제로 안지오포이에틴-2를 지방세포에서 비활성화시킨 생쥐 모델에서 혈중 지방의 피하지방 축적이 감소하는 한편, 간‧골격근‧갈색지방 등에 비정상적으로 축적되어 인슐린 기능과 신진대사에 이상이 생겼다.
나아가 안지오포이에틴-2와 결합하는 ‘인테그린(Integrin)’수용체가 피하지방 혈관에 한해 발현함을 확인했다. 이어 혈관내피세포에서 수용체를 활성화시킨 결과 안지오포이에틴-2에 의한 지방산 전달이 크게 증가했다. 요컨대 인테그린 수용체에 안지오포이에틴-2가 결합하여 지방산전달인자들을 조절함으로써 피하지방으로만 지방을 전달하고 축적시키는 것이다.
배호성 선임연구원은 “혈관의 대사기능을 조절하여 피하지방에 선택적으로 혈중 지방이 축적될 수 있음을 밝혔다”며 “비만, 당뇨병 등 대사질환 치료에 새로운 접근법을 제시할 수 있을 것”이라고 전했다.
이번 연구결과는 국제 학술지 네이처 커뮤니케이션즈(Nature Communications, IF 11.878) 온라인판에 6월 12일 오후 7시(한국시간) 게재됐다.
2020.06.25
조회수 19860
-
 동맥경화증을 효과적으로 치료할 수 있는 혈관 내 플라크 제거 나노기술 개발
국내 연구진이 만성 혈관염증 질환인 죽상 동맥경화증을 나노 기술을 이용해 기존 치료법보다 효과적으로 치료할 수 있는 기술개발에 성공해 전 세계 사망원인 1위로 꼽히는 심혈관질환을 정복하는데 한 걸음 더 성큼 다가섰다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 나노 기술을 이용해 죽상 동맥경화증(atherosclerosis) 치료를 위한 체내 약물전달 기술을 개발했다.
죽상 동맥경화증이란 오래된 수도관이 녹슬고 각종 이물질이 가라앉아 들러붙으면 좁아지듯이, 혈관 안쪽에 콜레스테롤과 같은 지방질로 이뤄진 퇴적물인 `플라크(plaque)'가 쌓여 혈류 장애를 일으키는 만성 혈관염증 질환이다. 플라크가 혈관을 막게 되면 심근경색, 뇌졸중 등 심각한 병을 유발한다.
KAIST 바이오및뇌공학과 졸업생 김희곤 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `제어 방출 저널 (Journal of Controlled Release)' 3월 10일 字 및 `ACS 나노 (ACS Nano)' 4월 28일 字 온라인판에 각각 게재됐다. (논문명: Cyclodextrin polymer improves atherosclerosis therapy and reduces ototoxicity / Affinity-Driven Design of Cargo-Switching Nanoparticles to Leverage a Cholesterol-Rich Microenvironment for Atherosclerosis Therapy)
일반적으로 약물치료의 경우 대표적 고지혈증 약물인 스타틴(statin)을 경구투여한다. 이 방법은 혈액 내 콜레스테롤 농도를 낮춰 콜레스테롤이 플라크에 쌓이는 것을 억제하기엔 효과적이나 이미 형성된 플라크를 제거하는 데에는 한계가 있다. 따라서 환자들은 평생 스타틴을 복용해야 하며 플라크라는 잠재적인 위험요소를 안고 살아가야 한다.
연구팀은 문제 해결을 위해 콜레스테롤과 결합하면 이를 녹일 수 있어 제거하기가 쉽다고 알려진 일종의 당 화합물인 `사이클로덱스트린(cyclodextrin)'을 연구에 사용했다.
박지호 교수 연구팀은 사이클로덱스트린을 약 10 nm(나노미터) 크기의 폴리머(polymer, 중합체) 나노입자 형태로 제조, 정맥 주입을 하면 기존 사이클로덱스트린보다 약 14배 효과적으로 플라크에 축적되어 보다 효과적으로 플라크를 제거할 수 있다는 결과를 얻었다고 학술지 `제어 방출 저널'에 게재했다. 연구팀은 또 사이클로덱스트린은 귀 내이의 유모세포(hair cell)를 손상시켜 청력손실을 일으킨다고 알려졌으나 이를 폴리머 나노입자 형태로 제조하면 체내분포양상을 변화시켜 귀 내이에 잘 축적되지 않기 때문에 청력손실을 방지할 수 있다는 사실을 알아냈다.
이와 함께 사이클로덱스트린과 스타틴을 자기조립(self-assembly)을 통해 약 100nm(나노미터) 크기의 나노입자 형태로 제조, 정맥 주입하자 사이클로덱스트린은 플라크 내에서 콜레스테롤을 제거하며 스타틴은 혈관을 좁게 만들었던 주요 원인인 염증성 대식거품세포(macrophage foam cell)를 줄이는 현상을 찾아냈다. 연구팀은 이같이 사이클로덱스트린과 스타틴의 동시 전달은 각각의 약물을 따로 전달했을 때보다 월등하게 효과적이기 때문에 시너지 효과를 가질 수 있는 약물들을 이용한 복합치료(combination therapy)의 필요성을 `ACS 나노 저널'을 통해 제시했다.
박지호 교수는 "이번 연구 결과를 계기로 평생 약물을 복용해야 하는 환자들의 삶의 질을 크게 개선할 수 있을 것으로 기대가 된다ˮ며 "종양 치료를 위해서 주로 개발되었던 약물전달 나노 기술이 전 세계 사망원인 1위인 심혈관질환을 효과적으로 치료하는 데도 기여할 수 있음을 보여준 연구”라고 의미를 부여했다.
한편, 이번 연구는 한국연구재단과 KAIST의 지원을 받아 수행됐다.
동맥경화증을 효과적으로 치료할 수 있는 혈관 내 플라크 제거 나노기술 개발
국내 연구진이 만성 혈관염증 질환인 죽상 동맥경화증을 나노 기술을 이용해 기존 치료법보다 효과적으로 치료할 수 있는 기술개발에 성공해 전 세계 사망원인 1위로 꼽히는 심혈관질환을 정복하는데 한 걸음 더 성큼 다가섰다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 나노 기술을 이용해 죽상 동맥경화증(atherosclerosis) 치료를 위한 체내 약물전달 기술을 개발했다.
죽상 동맥경화증이란 오래된 수도관이 녹슬고 각종 이물질이 가라앉아 들러붙으면 좁아지듯이, 혈관 안쪽에 콜레스테롤과 같은 지방질로 이뤄진 퇴적물인 `플라크(plaque)'가 쌓여 혈류 장애를 일으키는 만성 혈관염증 질환이다. 플라크가 혈관을 막게 되면 심근경색, 뇌졸중 등 심각한 병을 유발한다.
KAIST 바이오및뇌공학과 졸업생 김희곤 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `제어 방출 저널 (Journal of Controlled Release)' 3월 10일 字 및 `ACS 나노 (ACS Nano)' 4월 28일 字 온라인판에 각각 게재됐다. (논문명: Cyclodextrin polymer improves atherosclerosis therapy and reduces ototoxicity / Affinity-Driven Design of Cargo-Switching Nanoparticles to Leverage a Cholesterol-Rich Microenvironment for Atherosclerosis Therapy)
일반적으로 약물치료의 경우 대표적 고지혈증 약물인 스타틴(statin)을 경구투여한다. 이 방법은 혈액 내 콜레스테롤 농도를 낮춰 콜레스테롤이 플라크에 쌓이는 것을 억제하기엔 효과적이나 이미 형성된 플라크를 제거하는 데에는 한계가 있다. 따라서 환자들은 평생 스타틴을 복용해야 하며 플라크라는 잠재적인 위험요소를 안고 살아가야 한다.
연구팀은 문제 해결을 위해 콜레스테롤과 결합하면 이를 녹일 수 있어 제거하기가 쉽다고 알려진 일종의 당 화합물인 `사이클로덱스트린(cyclodextrin)'을 연구에 사용했다.
박지호 교수 연구팀은 사이클로덱스트린을 약 10 nm(나노미터) 크기의 폴리머(polymer, 중합체) 나노입자 형태로 제조, 정맥 주입을 하면 기존 사이클로덱스트린보다 약 14배 효과적으로 플라크에 축적되어 보다 효과적으로 플라크를 제거할 수 있다는 결과를 얻었다고 학술지 `제어 방출 저널'에 게재했다. 연구팀은 또 사이클로덱스트린은 귀 내이의 유모세포(hair cell)를 손상시켜 청력손실을 일으킨다고 알려졌으나 이를 폴리머 나노입자 형태로 제조하면 체내분포양상을 변화시켜 귀 내이에 잘 축적되지 않기 때문에 청력손실을 방지할 수 있다는 사실을 알아냈다.
이와 함께 사이클로덱스트린과 스타틴을 자기조립(self-assembly)을 통해 약 100nm(나노미터) 크기의 나노입자 형태로 제조, 정맥 주입하자 사이클로덱스트린은 플라크 내에서 콜레스테롤을 제거하며 스타틴은 혈관을 좁게 만들었던 주요 원인인 염증성 대식거품세포(macrophage foam cell)를 줄이는 현상을 찾아냈다. 연구팀은 이같이 사이클로덱스트린과 스타틴의 동시 전달은 각각의 약물을 따로 전달했을 때보다 월등하게 효과적이기 때문에 시너지 효과를 가질 수 있는 약물들을 이용한 복합치료(combination therapy)의 필요성을 `ACS 나노 저널'을 통해 제시했다.
박지호 교수는 "이번 연구 결과를 계기로 평생 약물을 복용해야 하는 환자들의 삶의 질을 크게 개선할 수 있을 것으로 기대가 된다ˮ며 "종양 치료를 위해서 주로 개발되었던 약물전달 나노 기술이 전 세계 사망원인 1위인 심혈관질환을 효과적으로 치료하는 데도 기여할 수 있음을 보여준 연구”라고 의미를 부여했다.
한편, 이번 연구는 한국연구재단과 KAIST의 지원을 받아 수행됐다.
2020.05.29
조회수 15751
-
 신의철 교수, 암세포의 면역세포 억제 핵심원리 규명
〈 신의철 교수, 김창곤 연구원 〉
우리 대학 의과학대학원 신의철 교수, 연세대학교 의과대학 민병소, 김호근 교수 공동 연구팀이 암 환자의 암세포가 면역세포를 억제해 면역반응을 회피하게 만드는 핵심원리를 발견했다.
이번 연구를 통해 최근 유행하는 면역항암제의 치료 효율을 높일 수 있는 효과적인 암 치료 전략을 제시할 수 있을 것으로 기대된다.
김창곤 연구원, 장미 연구교수가 공동 1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 ‘사이언스 면역학(Science Immunology)’ 11월 8일 자 온라인판에 게재됐다 (논문명 : VEGF-A drives TOX-dependent T cell exhaustion in anti–PD-1–resistant microsatellite stable colorectal cancers).
암 환자는 암세포에 대항하는 면역세포, 특히 T세포의 기능이 현저히 약해져 있다. 이렇게 T세포의 기능이 약해지는 주된 이유는 T세포가 PD-1이라는 억제 수용체를 과다하게 발현하기 때문이다.
최근 유행하고 있는 면역항암제도 바로 이 PD-1 억제 수용체의 기능을 차단해 T세포의 기능을 회복시키는 원리로 작동하는 것이다. 하지만 면역항암제는 아직 부족한 부분이 많아 투여받은 암 환자 중 일부에게만 치료 반응이 나타나는 현실이다. 이러한 이유로 많은 연구자가 암 환자의 T세포 기능이 약해지는 다른 이유를 활발히 찾고 있다.
이번 연구에서 공동 연구팀은, 그간 혈관형성인자로만 알려졌던 혈관내피성장인자(vascular endothelial growth factor; VEGF)라는 혈관형성인자 단백질이 암세포에 대항하는 T세포의 기능을 약하게 만드는 주요 원인임을 새롭게 밝혔다.
종양의 지속적인 성장을 위해 암세포는 혈관내피성장인자를 과다 생성하고, 이로 인해 암 조직에는 혈관이 과다 생성된다는 사실은 이미 잘 알려져 있었다. 연구팀은 이번 연구를 통해 혈관내피성장인자가 혈관 형성 이외에도 T세포 억제라는 중요한 작용을 통해 암의 성장을 돕는다는 사실을 새롭게 규명했다.
암세포에서 생성된 혈관내피성장인자는 암세포에 대항하는 T세포 표면에 발현하는 수용체에 결합해 T세포에 톡스(TOX)라 불리는 단백질의 발현을 유도하고, 톡스는 T세포의 기능을 억제하고 약화하는 유전자 발현 프로그램을 작동시킨다는 것이 이번 연구의 핵심이다.
연구팀은 기초적인 발견에 그치지 않고 암 환자의 면역항암제 치료 효율을 높이는 전략을 제시했다. 암 성장을 막을 목적으로 혈관내피성장인자 저해제가 이미 개발됐기 때문에, 연구팀이 새로 발견한 혈관내피성장인자의 T세포 기능 억제작용을 근거로 혈관내피성장인자 저해제를 면역항암제와 함께 사용한다면 치료 효율을 극대화할 수 있을 것으로 기대하고 있다.
실제 이번 연구에서도 면역항암제와 혈관내피성장인자 저해제를 병합 치료하면 우수한 항암 효과가 있음을 동물 모델에서 증명했다.
이번 연구는 연세대학교 의과대학 외과 및 병리학과 연구팀과 KAIST 의과학대학원이 암 환자의 면역학적 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과로 평가받는다.
신 교수는 “암세포와 면역세포 사이에서 어떤 일이 벌어지는지를 상세히 연구함으로써 임상 치료 전략을 제시하게 된 중요한 연구이다”라며 “향후 암 환자의 생존율을 높일 수 있는 새로운 면역기전 연구 및 면역항암제 개발 연구를 계속하겠다”라고 말했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 신의철 교수 연구팀 연구성과 개념도
신의철 교수, 암세포의 면역세포 억제 핵심원리 규명
〈 신의철 교수, 김창곤 연구원 〉
우리 대학 의과학대학원 신의철 교수, 연세대학교 의과대학 민병소, 김호근 교수 공동 연구팀이 암 환자의 암세포가 면역세포를 억제해 면역반응을 회피하게 만드는 핵심원리를 발견했다.
이번 연구를 통해 최근 유행하는 면역항암제의 치료 효율을 높일 수 있는 효과적인 암 치료 전략을 제시할 수 있을 것으로 기대된다.
김창곤 연구원, 장미 연구교수가 공동 1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 ‘사이언스 면역학(Science Immunology)’ 11월 8일 자 온라인판에 게재됐다 (논문명 : VEGF-A drives TOX-dependent T cell exhaustion in anti–PD-1–resistant microsatellite stable colorectal cancers).
암 환자는 암세포에 대항하는 면역세포, 특히 T세포의 기능이 현저히 약해져 있다. 이렇게 T세포의 기능이 약해지는 주된 이유는 T세포가 PD-1이라는 억제 수용체를 과다하게 발현하기 때문이다.
최근 유행하고 있는 면역항암제도 바로 이 PD-1 억제 수용체의 기능을 차단해 T세포의 기능을 회복시키는 원리로 작동하는 것이다. 하지만 면역항암제는 아직 부족한 부분이 많아 투여받은 암 환자 중 일부에게만 치료 반응이 나타나는 현실이다. 이러한 이유로 많은 연구자가 암 환자의 T세포 기능이 약해지는 다른 이유를 활발히 찾고 있다.
이번 연구에서 공동 연구팀은, 그간 혈관형성인자로만 알려졌던 혈관내피성장인자(vascular endothelial growth factor; VEGF)라는 혈관형성인자 단백질이 암세포에 대항하는 T세포의 기능을 약하게 만드는 주요 원인임을 새롭게 밝혔다.
종양의 지속적인 성장을 위해 암세포는 혈관내피성장인자를 과다 생성하고, 이로 인해 암 조직에는 혈관이 과다 생성된다는 사실은 이미 잘 알려져 있었다. 연구팀은 이번 연구를 통해 혈관내피성장인자가 혈관 형성 이외에도 T세포 억제라는 중요한 작용을 통해 암의 성장을 돕는다는 사실을 새롭게 규명했다.
암세포에서 생성된 혈관내피성장인자는 암세포에 대항하는 T세포 표면에 발현하는 수용체에 결합해 T세포에 톡스(TOX)라 불리는 단백질의 발현을 유도하고, 톡스는 T세포의 기능을 억제하고 약화하는 유전자 발현 프로그램을 작동시킨다는 것이 이번 연구의 핵심이다.
연구팀은 기초적인 발견에 그치지 않고 암 환자의 면역항암제 치료 효율을 높이는 전략을 제시했다. 암 성장을 막을 목적으로 혈관내피성장인자 저해제가 이미 개발됐기 때문에, 연구팀이 새로 발견한 혈관내피성장인자의 T세포 기능 억제작용을 근거로 혈관내피성장인자 저해제를 면역항암제와 함께 사용한다면 치료 효율을 극대화할 수 있을 것으로 기대하고 있다.
실제 이번 연구에서도 면역항암제와 혈관내피성장인자 저해제를 병합 치료하면 우수한 항암 효과가 있음을 동물 모델에서 증명했다.
이번 연구는 연세대학교 의과대학 외과 및 병리학과 연구팀과 KAIST 의과학대학원이 암 환자의 면역학적 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과로 평가받는다.
신 교수는 “암세포와 면역세포 사이에서 어떤 일이 벌어지는지를 상세히 연구함으로써 임상 치료 전략을 제시하게 된 중요한 연구이다”라며 “향후 암 환자의 생존율을 높일 수 있는 새로운 면역기전 연구 및 면역항암제 개발 연구를 계속하겠다”라고 말했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 신의철 교수 연구팀 연구성과 개념도
2019.11.13
조회수 12962
-
 김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
2019.04.01
조회수 23705
-
 이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
2018.05.16
조회수 21068
-
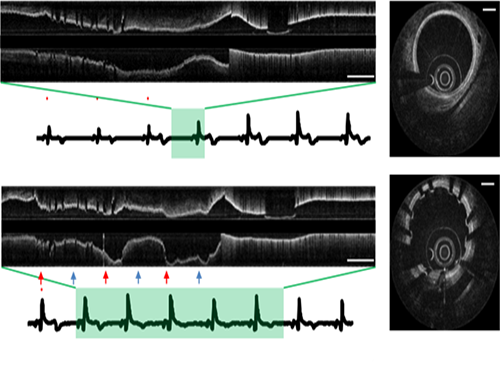 오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
2016.08.04
조회수 17934
 KAIST-고려대, 심혈관 진단 정밀도 높이는 영상기술 개발 및 임상 성공
우리 대학 기계공학과 유홍기 교수팀이 고려대학교 구로병원 심혈관센터 김진원 교수팀과 협력해, 관상동맥 질환의 진단 정밀도를 혁신적으로 높일 수 있는 영상기술을 개발하고, 이를 세계 최초로 사람을 대상으로 한 임상시험에 성공했다.
이번 연구에서는 광간섭단층촬영(OCT)과 형광수명영상(FLIm)을 결합한 차세대 다중 모달 영상 기술을 실제 환자에게 적용해, 심장 혈관 속 동맥경화반*의 구조뿐만 아니라 그 내부의 생화학적 조성까지 실시간으로 정밀하게 파악할 수 있음을 입증했다.
*동맥경화반: 콜레스테롤과 염증 세포 등이 동맥 벽에 쌓여 혈관이 좁아지게 만드는 병변.
기존 영상기술로는 경화반 내부의 복잡한 병변을 정확히 구분하거나 정량화하기 어려웠지만, OCT-FLIm 기술을 통해 염증, 치유반(손상 회복 흔적), 칼슘 침착 등 다양한 병리 정보를 정밀하게 구분할 수 있다. 특히, FLIm의 형광 수명 정보를 활용함으로써, 이러한 생화학적 특성이 환자의 임상 상태와 밀접하게 연관되어 있음을 확인했다.
연구진은 급성 심근경색과 같은 급성 관상동맥 증후군 환자에서는 염증 지표가 높게 나타났으며, 급속히 진행되는 병변에서는 반복된 경화반 파열과 치유로 인해 치유반이 높은 빈도로 뚜렷하게 분포하는 특징을 발견했다. 이는 심혈관 질환의 진행 정도나 개별 경화반의 상태를 보다 정밀하게 파악할 수 있는 단서를 제공한다.
이번 임상에서는 OCT와 FLIm을 완전히 통합한 융합 영상 카테터(Catheter)가 사용되었다. 연구진은 국내 환자 40명을 대상으로 실제 혈관 재개통 시술 중 해당 카테터를 삽입하여 병변을 분석했고, 모든 환자에서 시술이 안전하게 완료되었다. 이는 세계 최초로 융합 영상 카테터를 임상에 성공적으로 적용한 사례다.
*영상카테터: 관상동맥 내부에 삽입되어, 끝단에 부착된 렌즈를 통해 영상을 촬영하는 가느다란 관 모양의 의료기기
동맥경화반의 병태생리는 매우 복잡하며, 단순한 해부학적 정보만으로는 향후 심혈관 질환 발생 여부나 치료 예후를 예측하기 어렵다는 사실이 여러 연구를 통해 밝혀지고 있다. 이번 연구는 실제 환자의 혈관에서 병리학적 위험 요소를 실시간으로 시각화하고 정량화한 세계 최초로 임상 사례로, 심혈관 질환의 정밀 진단과 개인 맞춤형 치료 전략 개발에 있어 중요한 전환점이 될 것으로 기대된다.
유홍기 교수가 공동 교신저자, 남형수 연구교수가 공동 제1 저자로 참여한 이번 연구 결과는 심장학 분야 최고 권위 학술지인 미국의학회 심장학 저널, 자마 카디오로지(JAMA Cardiology, Journal of the American Medical Association)에 2025년 5월 7일 자로 게재되었다.
※ 논문명: Intracoronary Structural-Molecular Imaging for Multitargeted Characterization of High-Risk Plaque
DOI: 10.1001/jamacardio.2025.0928
이번 연구는 삼성미래기술육성사업 및 범부처전주기의료기기연구개발사업의 지원으로 수행되었다.
2025.05.08 조회수 2226
KAIST-고려대, 심혈관 진단 정밀도 높이는 영상기술 개발 및 임상 성공
우리 대학 기계공학과 유홍기 교수팀이 고려대학교 구로병원 심혈관센터 김진원 교수팀과 협력해, 관상동맥 질환의 진단 정밀도를 혁신적으로 높일 수 있는 영상기술을 개발하고, 이를 세계 최초로 사람을 대상으로 한 임상시험에 성공했다.
이번 연구에서는 광간섭단층촬영(OCT)과 형광수명영상(FLIm)을 결합한 차세대 다중 모달 영상 기술을 실제 환자에게 적용해, 심장 혈관 속 동맥경화반*의 구조뿐만 아니라 그 내부의 생화학적 조성까지 실시간으로 정밀하게 파악할 수 있음을 입증했다.
*동맥경화반: 콜레스테롤과 염증 세포 등이 동맥 벽에 쌓여 혈관이 좁아지게 만드는 병변.
기존 영상기술로는 경화반 내부의 복잡한 병변을 정확히 구분하거나 정량화하기 어려웠지만, OCT-FLIm 기술을 통해 염증, 치유반(손상 회복 흔적), 칼슘 침착 등 다양한 병리 정보를 정밀하게 구분할 수 있다. 특히, FLIm의 형광 수명 정보를 활용함으로써, 이러한 생화학적 특성이 환자의 임상 상태와 밀접하게 연관되어 있음을 확인했다.
연구진은 급성 심근경색과 같은 급성 관상동맥 증후군 환자에서는 염증 지표가 높게 나타났으며, 급속히 진행되는 병변에서는 반복된 경화반 파열과 치유로 인해 치유반이 높은 빈도로 뚜렷하게 분포하는 특징을 발견했다. 이는 심혈관 질환의 진행 정도나 개별 경화반의 상태를 보다 정밀하게 파악할 수 있는 단서를 제공한다.
이번 임상에서는 OCT와 FLIm을 완전히 통합한 융합 영상 카테터(Catheter)가 사용되었다. 연구진은 국내 환자 40명을 대상으로 실제 혈관 재개통 시술 중 해당 카테터를 삽입하여 병변을 분석했고, 모든 환자에서 시술이 안전하게 완료되었다. 이는 세계 최초로 융합 영상 카테터를 임상에 성공적으로 적용한 사례다.
*영상카테터: 관상동맥 내부에 삽입되어, 끝단에 부착된 렌즈를 통해 영상을 촬영하는 가느다란 관 모양의 의료기기
동맥경화반의 병태생리는 매우 복잡하며, 단순한 해부학적 정보만으로는 향후 심혈관 질환 발생 여부나 치료 예후를 예측하기 어렵다는 사실이 여러 연구를 통해 밝혀지고 있다. 이번 연구는 실제 환자의 혈관에서 병리학적 위험 요소를 실시간으로 시각화하고 정량화한 세계 최초로 임상 사례로, 심혈관 질환의 정밀 진단과 개인 맞춤형 치료 전략 개발에 있어 중요한 전환점이 될 것으로 기대된다.
유홍기 교수가 공동 교신저자, 남형수 연구교수가 공동 제1 저자로 참여한 이번 연구 결과는 심장학 분야 최고 권위 학술지인 미국의학회 심장학 저널, 자마 카디오로지(JAMA Cardiology, Journal of the American Medical Association)에 2025년 5월 7일 자로 게재되었다.
※ 논문명: Intracoronary Structural-Molecular Imaging for Multitargeted Characterization of High-Risk Plaque
DOI: 10.1001/jamacardio.2025.0928
이번 연구는 삼성미래기술육성사업 및 범부처전주기의료기기연구개발사업의 지원으로 수행되었다.
2025.05.08 조회수 2226 스트레스 위험 혈관 변화 실시간으로 잡아낸다
심혈관 질환은 전 세계 사망 원인 1위로 매우 심각한 건강 문제다. 특히, 정신적 스트레스가 심혈관 질환을 더 악화시킨다는 것이 보고되어 왔다. 한국 연구진이 그동안 관찰하기 어려웠던 스트레스로 인한 혈관 변화를 실시간으로 알아내는 데 성공했다.
우리 대학 기계공학과 유홍기 교수 연구팀이 고려대학교 구로병원 심혈관센터 김진원 교수 연구팀과 협력해 심장 박동으로 인한 혈관의 움직임을 보상해 실시간으로 혈관 내 세포의 움직임을 관찰할 수 있는 새로운 생체 내 영상 획득 기술을 개발했다고 20일 밝혔다.
연구팀은 초점 가변 렌즈를 생체 내 광학 현미경에 도입해 동맥의 움직임을 추정했고, 이를 현미경의 초점 평면과 동기화하는 기법을 개발했다. 이 기술을 통해 동맥의 움직임으로 인한 이미지 간의 상관 계수(이미지들 간의 유사성을 나타내는 통계적 지표)를 4배 높일 수 있었고, 시간해상도(단위 시간당 촬영 가능한 이미지 수)를 57% 향상해 혈관 내 면역세포의 빠른 움직임을 실시간으로 관찰했다.
즉, 이 기술을 통해 동맥의 움직임으로 인한 영상 왜곡을 크게 줄이고 초점을 안정적으로 유지함으로써, 영상을 놓치지 않고 혈관 내에서 빠르게 움직이는 면역세포를 실시간으로 관찰하는 데 성공했다.
연구팀은 만성 스트레스에 노출된 실험군 쥐와 대조군 쥐의 경동맥에서 생체 내 영상 획득에 본 기술을 적용했고, 동맥경화 병변의 진행 정도를 세포 수준의 해상도에서 정량적으로 평가할 수 있었다.
만성 스트레스에 노출된 쥐의 경동맥에서 골수 세포의 침윤이 대조군 대비 6.09배 증가했으며, 추적 영상에서는 골수 세포가 2.45배 더 증가하는 것을 확인했다. 또한, 조직학적 분석을 통해 스트레스가 동맥경화반의 크기와 염증을 증가시키고, 섬유성 막을 얇게 만들어 경화반의 불안정성을 높인다는 것을 입증했다.
유홍기 교수는 “이번 연구를 통해 비접촉 방법으로 동맥의 움직임을 정확하게 추정할 수 있었고, 이 방법은 실험동물의 높은 생존율을 보장할 수 있어 만성 스트레스가 미치는 영향을 종단 연구로 입증할 수 있었다”라고 말했다.
이어 유 교수는 “이 기술은 우수한 시간 해상도를 제공해 스트레스가 심혈관 질환에 미치는 영향을 세포 수준에서 실시간으로 관찰할 수 있어 앞으로 스트레스 관련 심혈관 질환의 발병 기전을 규명하고 새로운 치료법을 개발하는 데 중요한 도구로 활용될 것으로 기대하고 있다”라고 강조했다.
기계공학과 장민석 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘동맥경화, 혈전, 혈관 생물학(Arteriosclerosis, Thrombosis, and Vascular Biology)’에 지난해 10월 10일 온라인판 게재됐고, 44권 12호에 표지논문과 에디터픽으로 선정됐다.
(논문명: Real-time imaging assessment of stress-induced vascular inflammation using heartbeat-synchronized motion compensation)
한편 이번 연구는 한국연구재단, 범부처전주기의료기기연구개발사업단의 지원을 받아 수행됐다.
2025.01.22 조회수 3479
스트레스 위험 혈관 변화 실시간으로 잡아낸다
심혈관 질환은 전 세계 사망 원인 1위로 매우 심각한 건강 문제다. 특히, 정신적 스트레스가 심혈관 질환을 더 악화시킨다는 것이 보고되어 왔다. 한국 연구진이 그동안 관찰하기 어려웠던 스트레스로 인한 혈관 변화를 실시간으로 알아내는 데 성공했다.
우리 대학 기계공학과 유홍기 교수 연구팀이 고려대학교 구로병원 심혈관센터 김진원 교수 연구팀과 협력해 심장 박동으로 인한 혈관의 움직임을 보상해 실시간으로 혈관 내 세포의 움직임을 관찰할 수 있는 새로운 생체 내 영상 획득 기술을 개발했다고 20일 밝혔다.
연구팀은 초점 가변 렌즈를 생체 내 광학 현미경에 도입해 동맥의 움직임을 추정했고, 이를 현미경의 초점 평면과 동기화하는 기법을 개발했다. 이 기술을 통해 동맥의 움직임으로 인한 이미지 간의 상관 계수(이미지들 간의 유사성을 나타내는 통계적 지표)를 4배 높일 수 있었고, 시간해상도(단위 시간당 촬영 가능한 이미지 수)를 57% 향상해 혈관 내 면역세포의 빠른 움직임을 실시간으로 관찰했다.
즉, 이 기술을 통해 동맥의 움직임으로 인한 영상 왜곡을 크게 줄이고 초점을 안정적으로 유지함으로써, 영상을 놓치지 않고 혈관 내에서 빠르게 움직이는 면역세포를 실시간으로 관찰하는 데 성공했다.
연구팀은 만성 스트레스에 노출된 실험군 쥐와 대조군 쥐의 경동맥에서 생체 내 영상 획득에 본 기술을 적용했고, 동맥경화 병변의 진행 정도를 세포 수준의 해상도에서 정량적으로 평가할 수 있었다.
만성 스트레스에 노출된 쥐의 경동맥에서 골수 세포의 침윤이 대조군 대비 6.09배 증가했으며, 추적 영상에서는 골수 세포가 2.45배 더 증가하는 것을 확인했다. 또한, 조직학적 분석을 통해 스트레스가 동맥경화반의 크기와 염증을 증가시키고, 섬유성 막을 얇게 만들어 경화반의 불안정성을 높인다는 것을 입증했다.
유홍기 교수는 “이번 연구를 통해 비접촉 방법으로 동맥의 움직임을 정확하게 추정할 수 있었고, 이 방법은 실험동물의 높은 생존율을 보장할 수 있어 만성 스트레스가 미치는 영향을 종단 연구로 입증할 수 있었다”라고 말했다.
이어 유 교수는 “이 기술은 우수한 시간 해상도를 제공해 스트레스가 심혈관 질환에 미치는 영향을 세포 수준에서 실시간으로 관찰할 수 있어 앞으로 스트레스 관련 심혈관 질환의 발병 기전을 규명하고 새로운 치료법을 개발하는 데 중요한 도구로 활용될 것으로 기대하고 있다”라고 강조했다.
기계공학과 장민석 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘동맥경화, 혈전, 혈관 생물학(Arteriosclerosis, Thrombosis, and Vascular Biology)’에 지난해 10월 10일 온라인판 게재됐고, 44권 12호에 표지논문과 에디터픽으로 선정됐다.
(논문명: Real-time imaging assessment of stress-induced vascular inflammation using heartbeat-synchronized motion compensation)
한편 이번 연구는 한국연구재단, 범부처전주기의료기기연구개발사업단의 지원을 받아 수행됐다.
2025.01.22 조회수 3479 조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.11.01 조회수 5309
조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.11.01 조회수 5309 희귀질환 환자 치료제 개발 가능해지다
희귀질환들, 특히 뇌나 눈같이 재생되지 않는 조직을 손상시키는 질병들은, 한 번 증상이 시작되면 치료를 통해 되돌릴 수 없기 때문에 증상이 시작되기 전에 진단하고 치료를 시작하는 것이 중요하다. 대부분 희귀질환에 대해서는 치료제가 없는데, 환자맞춤형 치료제 개발이 가능함을 제시해 화제다.
우리 대학 의과학대학원 김진국 교수 연구팀이 희귀질환 환자맞춤형 치료에 가이드라인을 제시하는 연구 결과를 세계 최고 권위의 학술지 중 하나인 ‘네이처(Nature)’지에 발표했다고 13일 밝혔다.
연구 결과에 따르면 이러한 환자 중에서도 약 10%에 대해서는 환자맞춤형 치료제 개발이 가능하다는 것이다. 또한 그 10%의 환자들을 유전체 기반 진단을 활용해 증상이 시작되기 전이라도 신속하고 체계적으로 선별하는 방법을 연구팀은 제시했다.
지금까지는 진단이 되더라도 대부분의 경우 치료제가 없기 때문에 환자들과 가족들이 진단에 소극적인 경우가 있었으나 이번 연구결과를 통해 같은 질환이라도 돌연변이에 따라서 환자맞춤형 치료가 가능할 수 있다는 것이 확인되었기 때문에 유전체 기반 진단에 더 적극적으로 참여함으로써 환자들을 조기에 진단하고 하고 치료를 고려할 수 있을 것으로 기대된다.
향후 유전체 기반 진단의 비용이 크게 떨어지면서 유전체 기반의 진단이 환자뿐만 아니라 모든 신생아에게도 적용되기 시작하면 증상이 시작되기 전에 진단되고 환자맞춤형 치료가 시작되는 사례가 많아질 것으로 기대된다. 실제로 연구팀은 이번 연구에서 신생아 때 유전체 분석을 통해 진단된 환자 1명에 대해서 환자맞춤형 치료제 개발을 진행하고 환자맞춤형 임상시험에 진입한 사례를 보고했다.
김진국 교수는 하버드 의과대학 박사후연구원으로 근무하던 지난 2019년에 RNA기반 신약 개발 플랫폼을 활용해 희귀질환 환자 한 명에 대한 밀라센(milasen)이라는 환자맞춤형 치료제를 세계 최초로 개발하고 세계 최고 권위의 학술지 중 하나인 ‘뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)’지에 발표한 바 있다.
본 연구는 김 교수가 3년 전 KAIST에 조교수로 부임한 후 진행한 후속 연구로서, 김 교수는 모세혈관 확장성 운동실조 증후군(ataxia-telangiectasia 또는 A-T)이라는 희귀질환에 대한 미국의 환자 재단과의 협업을 통해 대규모 환자군에 대한 유전체 분석으로 약 10%의 환자들에 대해 환자맞춤형 치료가 가능하다는 것을 보이고 유전체 검사를 통해서 이런 환자들을 효과적으로 발굴하는 체계를 제시하고 검증했다. 또한 이를 통해 발견한 환자맞춤형 치료가능 환자 중 치료의 성공 가능성이 가장 큰 환자 1명에 대해서 환자맞춤형 치료가능 돌연변이를 확인하고 환자맞춤형 치료제인 아티펙센(atipeksen)을 개발 후 그 환자에 대한 맞춤형 임상시험을 진행하고 있는 사례를 보고했다.
우리 대학에서는 김진국 교수가 공동교신저자, 의과학대학원 우시재 박사과정 학생이 공동 제1 저자로 참여하고 A-T 아동 프로젝트(A-T Children’s Project) 재단 및 하버드 의과대학과의 협업으로 진행한 이번 연구는 국제 학술지 네이처(Nature)지에 7월 12일 온라인(advanced online publication) 형태로 출판됐다. (논문명 : A framework for individualized splice-switching oligonucleotide therapy).
김 교수는 "이번 연구는 희귀질환 환자들의 진료에 있어서, 지금까지 진단 위주의 진료에서 치료 위주의 치료로의 전환을 가속화할 것이며, 지난 2013년 환자의 진단을 위해 정립되었던 미국임상유전학회(ACMG) 가이드라인 연구가 발표된 이후 희귀질환 진료 가이드라인에 있어서 패러다임의 전환을 가져올 것ˮ 이라고 말했다.
또한 “환자맞춤형 치료전략은 현재로서는 기술적인 이유로 뇌, 눈, 및 간에 영향을 미치는 질환들에만 적용할 수 있지만 추후 기술개발을 통해서 다른 질병들에도 적용될 가능성이 있다”고 덧붙였다.
이번 연구는 한국연구재단 해외우수과학자유치사업Plus(Brain Pool Plus) 사업, 기초연구실 사업, 국가바이오빅데이터 사업, 의사과학자양성 사업, 아산사회복지재단의 지원을 받아 수행됐다.
2023.07.13 조회수 7767
희귀질환 환자 치료제 개발 가능해지다
희귀질환들, 특히 뇌나 눈같이 재생되지 않는 조직을 손상시키는 질병들은, 한 번 증상이 시작되면 치료를 통해 되돌릴 수 없기 때문에 증상이 시작되기 전에 진단하고 치료를 시작하는 것이 중요하다. 대부분 희귀질환에 대해서는 치료제가 없는데, 환자맞춤형 치료제 개발이 가능함을 제시해 화제다.
우리 대학 의과학대학원 김진국 교수 연구팀이 희귀질환 환자맞춤형 치료에 가이드라인을 제시하는 연구 결과를 세계 최고 권위의 학술지 중 하나인 ‘네이처(Nature)’지에 발표했다고 13일 밝혔다.
연구 결과에 따르면 이러한 환자 중에서도 약 10%에 대해서는 환자맞춤형 치료제 개발이 가능하다는 것이다. 또한 그 10%의 환자들을 유전체 기반 진단을 활용해 증상이 시작되기 전이라도 신속하고 체계적으로 선별하는 방법을 연구팀은 제시했다.
지금까지는 진단이 되더라도 대부분의 경우 치료제가 없기 때문에 환자들과 가족들이 진단에 소극적인 경우가 있었으나 이번 연구결과를 통해 같은 질환이라도 돌연변이에 따라서 환자맞춤형 치료가 가능할 수 있다는 것이 확인되었기 때문에 유전체 기반 진단에 더 적극적으로 참여함으로써 환자들을 조기에 진단하고 하고 치료를 고려할 수 있을 것으로 기대된다.
향후 유전체 기반 진단의 비용이 크게 떨어지면서 유전체 기반의 진단이 환자뿐만 아니라 모든 신생아에게도 적용되기 시작하면 증상이 시작되기 전에 진단되고 환자맞춤형 치료가 시작되는 사례가 많아질 것으로 기대된다. 실제로 연구팀은 이번 연구에서 신생아 때 유전체 분석을 통해 진단된 환자 1명에 대해서 환자맞춤형 치료제 개발을 진행하고 환자맞춤형 임상시험에 진입한 사례를 보고했다.
김진국 교수는 하버드 의과대학 박사후연구원으로 근무하던 지난 2019년에 RNA기반 신약 개발 플랫폼을 활용해 희귀질환 환자 한 명에 대한 밀라센(milasen)이라는 환자맞춤형 치료제를 세계 최초로 개발하고 세계 최고 권위의 학술지 중 하나인 ‘뉴잉글랜드 저널 오브 메디슨(New England Journal of Medicine)’지에 발표한 바 있다.
본 연구는 김 교수가 3년 전 KAIST에 조교수로 부임한 후 진행한 후속 연구로서, 김 교수는 모세혈관 확장성 운동실조 증후군(ataxia-telangiectasia 또는 A-T)이라는 희귀질환에 대한 미국의 환자 재단과의 협업을 통해 대규모 환자군에 대한 유전체 분석으로 약 10%의 환자들에 대해 환자맞춤형 치료가 가능하다는 것을 보이고 유전체 검사를 통해서 이런 환자들을 효과적으로 발굴하는 체계를 제시하고 검증했다. 또한 이를 통해 발견한 환자맞춤형 치료가능 환자 중 치료의 성공 가능성이 가장 큰 환자 1명에 대해서 환자맞춤형 치료가능 돌연변이를 확인하고 환자맞춤형 치료제인 아티펙센(atipeksen)을 개발 후 그 환자에 대한 맞춤형 임상시험을 진행하고 있는 사례를 보고했다.
우리 대학에서는 김진국 교수가 공동교신저자, 의과학대학원 우시재 박사과정 학생이 공동 제1 저자로 참여하고 A-T 아동 프로젝트(A-T Children’s Project) 재단 및 하버드 의과대학과의 협업으로 진행한 이번 연구는 국제 학술지 네이처(Nature)지에 7월 12일 온라인(advanced online publication) 형태로 출판됐다. (논문명 : A framework for individualized splice-switching oligonucleotide therapy).
김 교수는 "이번 연구는 희귀질환 환자들의 진료에 있어서, 지금까지 진단 위주의 진료에서 치료 위주의 치료로의 전환을 가속화할 것이며, 지난 2013년 환자의 진단을 위해 정립되었던 미국임상유전학회(ACMG) 가이드라인 연구가 발표된 이후 희귀질환 진료 가이드라인에 있어서 패러다임의 전환을 가져올 것ˮ 이라고 말했다.
또한 “환자맞춤형 치료전략은 현재로서는 기술적인 이유로 뇌, 눈, 및 간에 영향을 미치는 질환들에만 적용할 수 있지만 추후 기술개발을 통해서 다른 질병들에도 적용될 가능성이 있다”고 덧붙였다.
이번 연구는 한국연구재단 해외우수과학자유치사업Plus(Brain Pool Plus) 사업, 기초연구실 사업, 국가바이오빅데이터 사업, 의사과학자양성 사업, 아산사회복지재단의 지원을 받아 수행됐다.
2023.07.13 조회수 7767 무선으로 심혈관 모니터링 실시간 가능
실시간 혈역학(Hemodynamic) 모니터링은 심혈관 질환을 앓는 환자의 수술 전후 관리에 도움을 준다. 이에 일상에서 실시간으로 심혈관 내 압력, 유량 및 온도 측정을 제공할 수 있는 무선 인체이식형 의료기술에 대한 수요가 증가하고 있다.
우리 대학 전기및전자공학부 권경하 교수가 배터리 없이 실시간으로 심혈관 내 압력, 유량, 온도를 측정해 심혈관 기능을 진단하는 무선 심혈관 임플란트를 개발했다고 24일 밝혔다.
권경하 교수 연구팀과 미국 노스웨스턴대학교 김종욱 박사가 공동연구를 통해 개발한 이 기술은 국제 학술지 네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)에 4월 11일 발표됐다 (논문명 : A battery-less wireless implant for the continuous monitoring of vascular pressure, flow rate and temperature; URL: https://www.nature.com/articles/s41551-023-01022-4)
현재는 침상 모니터에 연결된 유선 테더(tether)와 함께 센서를 동맥에 삽입해 동맥압과 혈류 속도 측정이 가능하지만, 유선 인터페이스가 심혈관 손상 및 감염이나 측정 정확도 저하로 이어질 수 있으므로 병원에서 움직이지 않는 환자를 위해 일시적으로 사용하는 것으로 제한된다. 전문 의료 시설에 접근하지 않고 언제 어디서나 환자의 수술 후 모니터링을 지원하기 위해, 배터리 없이 무선으로 작동하는 임플란트 시스템을 개발하는 것이 핵심 과제다.
이에 연구팀은 무선 통신 및 무선 전력 전송 기술을 이용해 심혈관 내에서 배터리 없이 실시간으로 압력, 유속 및 온도를 측정할 수 있는 이식형 무선 측정 시스템을 개발했다.
연구팀은 배터리 없이 무선으로 동작하는 압력, 유속 및 온도를 측정하는 임플란트 기기를 실제로 제작해, 돼지의 폐동맥 및 양의 대동맥과 좌심실에서 기존 임상 기기와 유사한 성능을 보이는 데 성공했다. 이러한 기술은 혈역학 기능을 객관적이고 정확하게 측정해 심장 환자의 치료와 삶의 질을 개선할 수 있는 잠재력을 가지고 있으며, 가정 또는 병원에서 환자의 행동 제약 없이 언제든지 모바일 모니터링이 가능해진다.
연구를 주도한 권경하 교수는 “앞으로 심장판막 대동맥 이식술(TAVI) 후 경사도 및 기타 유출 검사, 뇌동맥류용 흐름 전환기 내부의 압력 및 유량 측정, 흉부 내 대동맥 내시경적 수술(TEVAR) 및 복부 대동맥류 내시경적 수술(EVAR) - 엔돌릭 감시 등 다양한 임상 분야에서 사용될 수 있을 것으로 기대된다”고 말했다.
한편 이번 연구는 한국연구재단(NRF) 기본연구, 우수신진연구, 지역혁신 선도연구센터 과제의 지원을 받아 수행됐다.
2023.04.24 조회수 7774
무선으로 심혈관 모니터링 실시간 가능
실시간 혈역학(Hemodynamic) 모니터링은 심혈관 질환을 앓는 환자의 수술 전후 관리에 도움을 준다. 이에 일상에서 실시간으로 심혈관 내 압력, 유량 및 온도 측정을 제공할 수 있는 무선 인체이식형 의료기술에 대한 수요가 증가하고 있다.
우리 대학 전기및전자공학부 권경하 교수가 배터리 없이 실시간으로 심혈관 내 압력, 유량, 온도를 측정해 심혈관 기능을 진단하는 무선 심혈관 임플란트를 개발했다고 24일 밝혔다.
권경하 교수 연구팀과 미국 노스웨스턴대학교 김종욱 박사가 공동연구를 통해 개발한 이 기술은 국제 학술지 네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)에 4월 11일 발표됐다 (논문명 : A battery-less wireless implant for the continuous monitoring of vascular pressure, flow rate and temperature; URL: https://www.nature.com/articles/s41551-023-01022-4)
현재는 침상 모니터에 연결된 유선 테더(tether)와 함께 센서를 동맥에 삽입해 동맥압과 혈류 속도 측정이 가능하지만, 유선 인터페이스가 심혈관 손상 및 감염이나 측정 정확도 저하로 이어질 수 있으므로 병원에서 움직이지 않는 환자를 위해 일시적으로 사용하는 것으로 제한된다. 전문 의료 시설에 접근하지 않고 언제 어디서나 환자의 수술 후 모니터링을 지원하기 위해, 배터리 없이 무선으로 작동하는 임플란트 시스템을 개발하는 것이 핵심 과제다.
이에 연구팀은 무선 통신 및 무선 전력 전송 기술을 이용해 심혈관 내에서 배터리 없이 실시간으로 압력, 유속 및 온도를 측정할 수 있는 이식형 무선 측정 시스템을 개발했다.
연구팀은 배터리 없이 무선으로 동작하는 압력, 유속 및 온도를 측정하는 임플란트 기기를 실제로 제작해, 돼지의 폐동맥 및 양의 대동맥과 좌심실에서 기존 임상 기기와 유사한 성능을 보이는 데 성공했다. 이러한 기술은 혈역학 기능을 객관적이고 정확하게 측정해 심장 환자의 치료와 삶의 질을 개선할 수 있는 잠재력을 가지고 있으며, 가정 또는 병원에서 환자의 행동 제약 없이 언제든지 모바일 모니터링이 가능해진다.
연구를 주도한 권경하 교수는 “앞으로 심장판막 대동맥 이식술(TAVI) 후 경사도 및 기타 유출 검사, 뇌동맥류용 흐름 전환기 내부의 압력 및 유량 측정, 흉부 내 대동맥 내시경적 수술(TEVAR) 및 복부 대동맥류 내시경적 수술(EVAR) - 엔돌릭 감시 등 다양한 임상 분야에서 사용될 수 있을 것으로 기대된다”고 말했다.
한편 이번 연구는 한국연구재단(NRF) 기본연구, 우수신진연구, 지역혁신 선도연구센터 과제의 지원을 받아 수행됐다.
2023.04.24 조회수 7774 손상된 혈관을 정상화하는 새로운 항체를 만들다
혈관은 인체 건강에 핵심적 역할을 한다. 세포에 산소와 영양분을 공급하고, 노폐물을 배설기관으로 옮기며, 면역세포들의 이동을 돕기 때문이다. 혈관의 항상성은 Angiopoietin-TIE2 신호전달체계를 통해 조절된다. 하지만, 암, 패혈증, 당뇨성 망막병증, 족부궤양 등의 질환에서는 혈관 내피세포와 주변 지지세포들이 파괴되면서 심각한 혈관 손상이 일어난다. 이에 국내외 제약회사들이 앞다투어 손상된 혈관의 TIE2를 활성화시키는 치료제 개발에 뛰어들고 있다.
우리 대학 의과학대학원 김호민 교수(기초과학연구원(IBS) 바이오분자 및 세포구조 연구단 CI), 고규영 특훈교수(기초과학연구원(IBS) 혈관 연구단장) 연구팀은 질병 상황에서 손상된 혈관을 정상화하는 항체를 새롭게 개발하고, 3차원 분자구조를 규명하여 치료항체의 작동 기전을 제시했다. 암, 패혈증 등 혈관 손상을 동반하는 다양한 질병의 치료제 개발에 기여할 것으로 기대된다.
Angiopoietin1 단백질은 혈관 내피세포의 TIE2 수용체에 결합하여 세포표면 응집을 유도한다. 이 과정이 TIE2 활성화와 혈관 안정화 유도에 핵심적인 역할을 한다. 현재까지의 TIE2 활성화 유도 치료제는 대부분 단백질 엔지니어링을 통한 Angiopoietin 변이체 개발에 집중되었다. 그러나 이 전략은 낮은 생산성과 안정성, 생체 내 짧은 반감기 등의 문제가 있었다.
연구진은 기존 TIE2 활성화를 유도하는 치료제 개발과는 다른 전략을 채택하였다. 그 결과 혈관 내피세포의 TIE2 수용체에 결합하여 성장과 안정화를 유도하는 “TIE2 활성 항체(hTAAB)” 개발에 성공했다. 또한 단백질 결정학과 바이오투과전자현미경 등을 활용, TIE2 활성 항체와 TIE2의 결합 분자구조와 항체에 의한 TIE2 수용체의 활성화 분자기전도 규명했다.
연구진은 TIE2 수용체/Angiopoietin의 결합 분자구조를 바탕으로 TIE2 수용체에 직접 결합해 응집과 활성화를 유도하지만, Angiopoietin 결합에는 영향을 미치지 않는 항체를 새로 개발하고자 하였다. 이에 마우스 하이브리도마 기술과 혈관 내피세포를 활용한 효능평가를 통해 가장 효과적인 항체를 선별하였고, 단백질 결정학으로 TIE2 수용체와 TIE2 활성항체(hTAAB)의 상호작용에 핵심적인 분자코드를 규명하였다. 또한 바이오투과전자현미경으로 Y자 형태의 항체가 TIE2에 순차 결합하여 다각형 형태로 TIE2수용체의 클러스터(응집)를 유도하는 분자메커니즘을 규명해냈다. 이를 바탕으로 TIE2 인간화 항체 개발에도 성공했다.
김호민 교수는 “TIE2 수용체 활성 항체가 TIE2를 다각형 형태로 응집을 유도하여 활성화시키는 것은 새로운 발견”이라며 “두 연구실의 협력을 통하여 우수한 성과를 거둔 대표 사례이며, 기초연구와 응용․개발연구가 서로 다른 영역이 아님을 보여주는 연구”라고 말했다. 고규영 교수는 “향후 동물실험의 효과 검증을 통해 혈관 이상으로 인한 다양한 질환 치료제 개발로 연계되기를 기대한다”라고 말했다.
우리 대학 의과학대학원 김호민 교수와 고규영 교수가 주도하고, 기초과학연구원 조경희 박사와 배점일 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 ‘네이처 커뮤니케이션즈 (Nature Communications, IF 14.919)’ 온라인 판 11월 1일 자에 게재됐다.
2021.11.02 조회수 13258
손상된 혈관을 정상화하는 새로운 항체를 만들다
혈관은 인체 건강에 핵심적 역할을 한다. 세포에 산소와 영양분을 공급하고, 노폐물을 배설기관으로 옮기며, 면역세포들의 이동을 돕기 때문이다. 혈관의 항상성은 Angiopoietin-TIE2 신호전달체계를 통해 조절된다. 하지만, 암, 패혈증, 당뇨성 망막병증, 족부궤양 등의 질환에서는 혈관 내피세포와 주변 지지세포들이 파괴되면서 심각한 혈관 손상이 일어난다. 이에 국내외 제약회사들이 앞다투어 손상된 혈관의 TIE2를 활성화시키는 치료제 개발에 뛰어들고 있다.
우리 대학 의과학대학원 김호민 교수(기초과학연구원(IBS) 바이오분자 및 세포구조 연구단 CI), 고규영 특훈교수(기초과학연구원(IBS) 혈관 연구단장) 연구팀은 질병 상황에서 손상된 혈관을 정상화하는 항체를 새롭게 개발하고, 3차원 분자구조를 규명하여 치료항체의 작동 기전을 제시했다. 암, 패혈증 등 혈관 손상을 동반하는 다양한 질병의 치료제 개발에 기여할 것으로 기대된다.
Angiopoietin1 단백질은 혈관 내피세포의 TIE2 수용체에 결합하여 세포표면 응집을 유도한다. 이 과정이 TIE2 활성화와 혈관 안정화 유도에 핵심적인 역할을 한다. 현재까지의 TIE2 활성화 유도 치료제는 대부분 단백질 엔지니어링을 통한 Angiopoietin 변이체 개발에 집중되었다. 그러나 이 전략은 낮은 생산성과 안정성, 생체 내 짧은 반감기 등의 문제가 있었다.
연구진은 기존 TIE2 활성화를 유도하는 치료제 개발과는 다른 전략을 채택하였다. 그 결과 혈관 내피세포의 TIE2 수용체에 결합하여 성장과 안정화를 유도하는 “TIE2 활성 항체(hTAAB)” 개발에 성공했다. 또한 단백질 결정학과 바이오투과전자현미경 등을 활용, TIE2 활성 항체와 TIE2의 결합 분자구조와 항체에 의한 TIE2 수용체의 활성화 분자기전도 규명했다.
연구진은 TIE2 수용체/Angiopoietin의 결합 분자구조를 바탕으로 TIE2 수용체에 직접 결합해 응집과 활성화를 유도하지만, Angiopoietin 결합에는 영향을 미치지 않는 항체를 새로 개발하고자 하였다. 이에 마우스 하이브리도마 기술과 혈관 내피세포를 활용한 효능평가를 통해 가장 효과적인 항체를 선별하였고, 단백질 결정학으로 TIE2 수용체와 TIE2 활성항체(hTAAB)의 상호작용에 핵심적인 분자코드를 규명하였다. 또한 바이오투과전자현미경으로 Y자 형태의 항체가 TIE2에 순차 결합하여 다각형 형태로 TIE2수용체의 클러스터(응집)를 유도하는 분자메커니즘을 규명해냈다. 이를 바탕으로 TIE2 인간화 항체 개발에도 성공했다.
김호민 교수는 “TIE2 수용체 활성 항체가 TIE2를 다각형 형태로 응집을 유도하여 활성화시키는 것은 새로운 발견”이라며 “두 연구실의 협력을 통하여 우수한 성과를 거둔 대표 사례이며, 기초연구와 응용․개발연구가 서로 다른 영역이 아님을 보여주는 연구”라고 말했다. 고규영 교수는 “향후 동물실험의 효과 검증을 통해 혈관 이상으로 인한 다양한 질환 치료제 개발로 연계되기를 기대한다”라고 말했다.
우리 대학 의과학대학원 김호민 교수와 고규영 교수가 주도하고, 기초과학연구원 조경희 박사와 배점일 박사가 공동 제1 저자로 참여한 이번 연구는 국제학술지 ‘네이처 커뮤니케이션즈 (Nature Communications, IF 14.919)’ 온라인 판 11월 1일 자에 게재됐다.
2021.11.02 조회수 13258 고규영 특훈교수 연구팀, 대사적으로 건강한 비만을 유도하는 원리 밝혔다
대사적으로 건강한 비만을 유도하는 원리가 밝혀졌다. 기초과학연구원(IBS, 원장 노도영) 혈관연구단 고규영 단장(우리 대학 의과학대학원 특훈교수) 연구팀은 혈관 생성을 촉진하는 단백질 ‘안지오포이에틴-2(Angiopoietin-2)’가 건강한 지방 축적 작용의 핵심요소임을 규명했다. 대사 기능에 대한 혈관의 역할과 지방 축적 기전을 이해함으로써 비만, 당뇨병, 고혈압 등 대사질환 치료에 새길을 열 것으로 기대된다.
대사적으로 건강한 비만은 일반 비만에 비해 내장지방 축적이 적으며, 인슐린 저항성 수치, 혈압, 심혈관 질환 발병 위험이 낮다. 비만으로 인해 당 대사기능을 하는 간, 근육 등에 지방이 비정상적으로 축적되면 대사합병증 발병 위험이 높아지는데, 건강한 비만의 경우 혈중 지방이 주로 피하지방으로 축적되기 때문이다.
지방의 축적에는 모세혈관이 관여한다고 알려져 있다. 지방산전달인자들이 모세혈관에서 발현하고, 이들 인자는 모세혈관을 통해 지방의 주구성원인 지방산을 전달하여 지방세포로 축적시킨다. 모세혈관이 지방 축적을 위한 지방산의 전달자이자 이동통로인 셈이다. 그러나 이렇게 비만에 중요한 역할을 하는 모세혈관의 기능을 관장하는 요인과 기전은 밝혀지지 않았다.
이번 연구에서는 안지오포이에틴-2가 피하지방 모세혈관 내 지방산전달인자를 조절하여 건강한 비만을 유도하는 원리를 밝혀 기존의 한계를 극복했다. 연구팀은 피하지방 혈관에 특정 지방산전달인자들이 분포한다는 사실에 주목했다. 우선 건강한 비만환자의 피하지방에만 발현하는 물질을 찾기 위해 건강한 비만 환자군과 일반적인 비만 환자군을 비교분석했다. 그 결과 안지오포이에틴-2가 건강한 비만 환자의 피하지방에만 발현하는 유일한 분비 물질임을 발견했다. 안지오포이에틴-2가 건강한 지방 축적에 핵심 역할을 한다는 의미다. 실제로 안지오포이에틴-2를 지방세포에서 비활성화시킨 생쥐 모델에서 혈중 지방의 피하지방 축적이 감소하는 한편, 간‧골격근‧갈색지방 등에 비정상적으로 축적되어 인슐린 기능과 신진대사에 이상이 생겼다.
나아가 안지오포이에틴-2와 결합하는 ‘인테그린(Integrin)’수용체가 피하지방 혈관에 한해 발현함을 확인했다. 이어 혈관내피세포에서 수용체를 활성화시킨 결과 안지오포이에틴-2에 의한 지방산 전달이 크게 증가했다. 요컨대 인테그린 수용체에 안지오포이에틴-2가 결합하여 지방산전달인자들을 조절함으로써 피하지방으로만 지방을 전달하고 축적시키는 것이다.
배호성 선임연구원은 “혈관의 대사기능을 조절하여 피하지방에 선택적으로 혈중 지방이 축적될 수 있음을 밝혔다”며 “비만, 당뇨병 등 대사질환 치료에 새로운 접근법을 제시할 수 있을 것”이라고 전했다.
이번 연구결과는 국제 학술지 네이처 커뮤니케이션즈(Nature Communications, IF 11.878) 온라인판에 6월 12일 오후 7시(한국시간) 게재됐다.
2020.06.25 조회수 19860
고규영 특훈교수 연구팀, 대사적으로 건강한 비만을 유도하는 원리 밝혔다
대사적으로 건강한 비만을 유도하는 원리가 밝혀졌다. 기초과학연구원(IBS, 원장 노도영) 혈관연구단 고규영 단장(우리 대학 의과학대학원 특훈교수) 연구팀은 혈관 생성을 촉진하는 단백질 ‘안지오포이에틴-2(Angiopoietin-2)’가 건강한 지방 축적 작용의 핵심요소임을 규명했다. 대사 기능에 대한 혈관의 역할과 지방 축적 기전을 이해함으로써 비만, 당뇨병, 고혈압 등 대사질환 치료에 새길을 열 것으로 기대된다.
대사적으로 건강한 비만은 일반 비만에 비해 내장지방 축적이 적으며, 인슐린 저항성 수치, 혈압, 심혈관 질환 발병 위험이 낮다. 비만으로 인해 당 대사기능을 하는 간, 근육 등에 지방이 비정상적으로 축적되면 대사합병증 발병 위험이 높아지는데, 건강한 비만의 경우 혈중 지방이 주로 피하지방으로 축적되기 때문이다.
지방의 축적에는 모세혈관이 관여한다고 알려져 있다. 지방산전달인자들이 모세혈관에서 발현하고, 이들 인자는 모세혈관을 통해 지방의 주구성원인 지방산을 전달하여 지방세포로 축적시킨다. 모세혈관이 지방 축적을 위한 지방산의 전달자이자 이동통로인 셈이다. 그러나 이렇게 비만에 중요한 역할을 하는 모세혈관의 기능을 관장하는 요인과 기전은 밝혀지지 않았다.
이번 연구에서는 안지오포이에틴-2가 피하지방 모세혈관 내 지방산전달인자를 조절하여 건강한 비만을 유도하는 원리를 밝혀 기존의 한계를 극복했다. 연구팀은 피하지방 혈관에 특정 지방산전달인자들이 분포한다는 사실에 주목했다. 우선 건강한 비만환자의 피하지방에만 발현하는 물질을 찾기 위해 건강한 비만 환자군과 일반적인 비만 환자군을 비교분석했다. 그 결과 안지오포이에틴-2가 건강한 비만 환자의 피하지방에만 발현하는 유일한 분비 물질임을 발견했다. 안지오포이에틴-2가 건강한 지방 축적에 핵심 역할을 한다는 의미다. 실제로 안지오포이에틴-2를 지방세포에서 비활성화시킨 생쥐 모델에서 혈중 지방의 피하지방 축적이 감소하는 한편, 간‧골격근‧갈색지방 등에 비정상적으로 축적되어 인슐린 기능과 신진대사에 이상이 생겼다.
나아가 안지오포이에틴-2와 결합하는 ‘인테그린(Integrin)’수용체가 피하지방 혈관에 한해 발현함을 확인했다. 이어 혈관내피세포에서 수용체를 활성화시킨 결과 안지오포이에틴-2에 의한 지방산 전달이 크게 증가했다. 요컨대 인테그린 수용체에 안지오포이에틴-2가 결합하여 지방산전달인자들을 조절함으로써 피하지방으로만 지방을 전달하고 축적시키는 것이다.
배호성 선임연구원은 “혈관의 대사기능을 조절하여 피하지방에 선택적으로 혈중 지방이 축적될 수 있음을 밝혔다”며 “비만, 당뇨병 등 대사질환 치료에 새로운 접근법을 제시할 수 있을 것”이라고 전했다.
이번 연구결과는 국제 학술지 네이처 커뮤니케이션즈(Nature Communications, IF 11.878) 온라인판에 6월 12일 오후 7시(한국시간) 게재됐다.
2020.06.25 조회수 19860 동맥경화증을 효과적으로 치료할 수 있는 혈관 내 플라크 제거 나노기술 개발
국내 연구진이 만성 혈관염증 질환인 죽상 동맥경화증을 나노 기술을 이용해 기존 치료법보다 효과적으로 치료할 수 있는 기술개발에 성공해 전 세계 사망원인 1위로 꼽히는 심혈관질환을 정복하는데 한 걸음 더 성큼 다가섰다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 나노 기술을 이용해 죽상 동맥경화증(atherosclerosis) 치료를 위한 체내 약물전달 기술을 개발했다.
죽상 동맥경화증이란 오래된 수도관이 녹슬고 각종 이물질이 가라앉아 들러붙으면 좁아지듯이, 혈관 안쪽에 콜레스테롤과 같은 지방질로 이뤄진 퇴적물인 `플라크(plaque)'가 쌓여 혈류 장애를 일으키는 만성 혈관염증 질환이다. 플라크가 혈관을 막게 되면 심근경색, 뇌졸중 등 심각한 병을 유발한다.
KAIST 바이오및뇌공학과 졸업생 김희곤 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `제어 방출 저널 (Journal of Controlled Release)' 3월 10일 字 및 `ACS 나노 (ACS Nano)' 4월 28일 字 온라인판에 각각 게재됐다. (논문명: Cyclodextrin polymer improves atherosclerosis therapy and reduces ototoxicity / Affinity-Driven Design of Cargo-Switching Nanoparticles to Leverage a Cholesterol-Rich Microenvironment for Atherosclerosis Therapy)
일반적으로 약물치료의 경우 대표적 고지혈증 약물인 스타틴(statin)을 경구투여한다. 이 방법은 혈액 내 콜레스테롤 농도를 낮춰 콜레스테롤이 플라크에 쌓이는 것을 억제하기엔 효과적이나 이미 형성된 플라크를 제거하는 데에는 한계가 있다. 따라서 환자들은 평생 스타틴을 복용해야 하며 플라크라는 잠재적인 위험요소를 안고 살아가야 한다.
연구팀은 문제 해결을 위해 콜레스테롤과 결합하면 이를 녹일 수 있어 제거하기가 쉽다고 알려진 일종의 당 화합물인 `사이클로덱스트린(cyclodextrin)'을 연구에 사용했다.
박지호 교수 연구팀은 사이클로덱스트린을 약 10 nm(나노미터) 크기의 폴리머(polymer, 중합체) 나노입자 형태로 제조, 정맥 주입을 하면 기존 사이클로덱스트린보다 약 14배 효과적으로 플라크에 축적되어 보다 효과적으로 플라크를 제거할 수 있다는 결과를 얻었다고 학술지 `제어 방출 저널'에 게재했다. 연구팀은 또 사이클로덱스트린은 귀 내이의 유모세포(hair cell)를 손상시켜 청력손실을 일으킨다고 알려졌으나 이를 폴리머 나노입자 형태로 제조하면 체내분포양상을 변화시켜 귀 내이에 잘 축적되지 않기 때문에 청력손실을 방지할 수 있다는 사실을 알아냈다.
이와 함께 사이클로덱스트린과 스타틴을 자기조립(self-assembly)을 통해 약 100nm(나노미터) 크기의 나노입자 형태로 제조, 정맥 주입하자 사이클로덱스트린은 플라크 내에서 콜레스테롤을 제거하며 스타틴은 혈관을 좁게 만들었던 주요 원인인 염증성 대식거품세포(macrophage foam cell)를 줄이는 현상을 찾아냈다. 연구팀은 이같이 사이클로덱스트린과 스타틴의 동시 전달은 각각의 약물을 따로 전달했을 때보다 월등하게 효과적이기 때문에 시너지 효과를 가질 수 있는 약물들을 이용한 복합치료(combination therapy)의 필요성을 `ACS 나노 저널'을 통해 제시했다.
박지호 교수는 "이번 연구 결과를 계기로 평생 약물을 복용해야 하는 환자들의 삶의 질을 크게 개선할 수 있을 것으로 기대가 된다ˮ며 "종양 치료를 위해서 주로 개발되었던 약물전달 나노 기술이 전 세계 사망원인 1위인 심혈관질환을 효과적으로 치료하는 데도 기여할 수 있음을 보여준 연구”라고 의미를 부여했다.
한편, 이번 연구는 한국연구재단과 KAIST의 지원을 받아 수행됐다.
2020.05.29 조회수 15751
동맥경화증을 효과적으로 치료할 수 있는 혈관 내 플라크 제거 나노기술 개발
국내 연구진이 만성 혈관염증 질환인 죽상 동맥경화증을 나노 기술을 이용해 기존 치료법보다 효과적으로 치료할 수 있는 기술개발에 성공해 전 세계 사망원인 1위로 꼽히는 심혈관질환을 정복하는데 한 걸음 더 성큼 다가섰다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 나노 기술을 이용해 죽상 동맥경화증(atherosclerosis) 치료를 위한 체내 약물전달 기술을 개발했다.
죽상 동맥경화증이란 오래된 수도관이 녹슬고 각종 이물질이 가라앉아 들러붙으면 좁아지듯이, 혈관 안쪽에 콜레스테롤과 같은 지방질로 이뤄진 퇴적물인 `플라크(plaque)'가 쌓여 혈류 장애를 일으키는 만성 혈관염증 질환이다. 플라크가 혈관을 막게 되면 심근경색, 뇌졸중 등 심각한 병을 유발한다.
KAIST 바이오및뇌공학과 졸업생 김희곤 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `제어 방출 저널 (Journal of Controlled Release)' 3월 10일 字 및 `ACS 나노 (ACS Nano)' 4월 28일 字 온라인판에 각각 게재됐다. (논문명: Cyclodextrin polymer improves atherosclerosis therapy and reduces ototoxicity / Affinity-Driven Design of Cargo-Switching Nanoparticles to Leverage a Cholesterol-Rich Microenvironment for Atherosclerosis Therapy)
일반적으로 약물치료의 경우 대표적 고지혈증 약물인 스타틴(statin)을 경구투여한다. 이 방법은 혈액 내 콜레스테롤 농도를 낮춰 콜레스테롤이 플라크에 쌓이는 것을 억제하기엔 효과적이나 이미 형성된 플라크를 제거하는 데에는 한계가 있다. 따라서 환자들은 평생 스타틴을 복용해야 하며 플라크라는 잠재적인 위험요소를 안고 살아가야 한다.
연구팀은 문제 해결을 위해 콜레스테롤과 결합하면 이를 녹일 수 있어 제거하기가 쉽다고 알려진 일종의 당 화합물인 `사이클로덱스트린(cyclodextrin)'을 연구에 사용했다.
박지호 교수 연구팀은 사이클로덱스트린을 약 10 nm(나노미터) 크기의 폴리머(polymer, 중합체) 나노입자 형태로 제조, 정맥 주입을 하면 기존 사이클로덱스트린보다 약 14배 효과적으로 플라크에 축적되어 보다 효과적으로 플라크를 제거할 수 있다는 결과를 얻었다고 학술지 `제어 방출 저널'에 게재했다. 연구팀은 또 사이클로덱스트린은 귀 내이의 유모세포(hair cell)를 손상시켜 청력손실을 일으킨다고 알려졌으나 이를 폴리머 나노입자 형태로 제조하면 체내분포양상을 변화시켜 귀 내이에 잘 축적되지 않기 때문에 청력손실을 방지할 수 있다는 사실을 알아냈다.
이와 함께 사이클로덱스트린과 스타틴을 자기조립(self-assembly)을 통해 약 100nm(나노미터) 크기의 나노입자 형태로 제조, 정맥 주입하자 사이클로덱스트린은 플라크 내에서 콜레스테롤을 제거하며 스타틴은 혈관을 좁게 만들었던 주요 원인인 염증성 대식거품세포(macrophage foam cell)를 줄이는 현상을 찾아냈다. 연구팀은 이같이 사이클로덱스트린과 스타틴의 동시 전달은 각각의 약물을 따로 전달했을 때보다 월등하게 효과적이기 때문에 시너지 효과를 가질 수 있는 약물들을 이용한 복합치료(combination therapy)의 필요성을 `ACS 나노 저널'을 통해 제시했다.
박지호 교수는 "이번 연구 결과를 계기로 평생 약물을 복용해야 하는 환자들의 삶의 질을 크게 개선할 수 있을 것으로 기대가 된다ˮ며 "종양 치료를 위해서 주로 개발되었던 약물전달 나노 기술이 전 세계 사망원인 1위인 심혈관질환을 효과적으로 치료하는 데도 기여할 수 있음을 보여준 연구”라고 의미를 부여했다.
한편, 이번 연구는 한국연구재단과 KAIST의 지원을 받아 수행됐다.
2020.05.29 조회수 15751 신의철 교수, 암세포의 면역세포 억제 핵심원리 규명
〈 신의철 교수, 김창곤 연구원 〉
우리 대학 의과학대학원 신의철 교수, 연세대학교 의과대학 민병소, 김호근 교수 공동 연구팀이 암 환자의 암세포가 면역세포를 억제해 면역반응을 회피하게 만드는 핵심원리를 발견했다.
이번 연구를 통해 최근 유행하는 면역항암제의 치료 효율을 높일 수 있는 효과적인 암 치료 전략을 제시할 수 있을 것으로 기대된다.
김창곤 연구원, 장미 연구교수가 공동 1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 ‘사이언스 면역학(Science Immunology)’ 11월 8일 자 온라인판에 게재됐다 (논문명 : VEGF-A drives TOX-dependent T cell exhaustion in anti–PD-1–resistant microsatellite stable colorectal cancers).
암 환자는 암세포에 대항하는 면역세포, 특히 T세포의 기능이 현저히 약해져 있다. 이렇게 T세포의 기능이 약해지는 주된 이유는 T세포가 PD-1이라는 억제 수용체를 과다하게 발현하기 때문이다.
최근 유행하고 있는 면역항암제도 바로 이 PD-1 억제 수용체의 기능을 차단해 T세포의 기능을 회복시키는 원리로 작동하는 것이다. 하지만 면역항암제는 아직 부족한 부분이 많아 투여받은 암 환자 중 일부에게만 치료 반응이 나타나는 현실이다. 이러한 이유로 많은 연구자가 암 환자의 T세포 기능이 약해지는 다른 이유를 활발히 찾고 있다.
이번 연구에서 공동 연구팀은, 그간 혈관형성인자로만 알려졌던 혈관내피성장인자(vascular endothelial growth factor; VEGF)라는 혈관형성인자 단백질이 암세포에 대항하는 T세포의 기능을 약하게 만드는 주요 원인임을 새롭게 밝혔다.
종양의 지속적인 성장을 위해 암세포는 혈관내피성장인자를 과다 생성하고, 이로 인해 암 조직에는 혈관이 과다 생성된다는 사실은 이미 잘 알려져 있었다. 연구팀은 이번 연구를 통해 혈관내피성장인자가 혈관 형성 이외에도 T세포 억제라는 중요한 작용을 통해 암의 성장을 돕는다는 사실을 새롭게 규명했다.
암세포에서 생성된 혈관내피성장인자는 암세포에 대항하는 T세포 표면에 발현하는 수용체에 결합해 T세포에 톡스(TOX)라 불리는 단백질의 발현을 유도하고, 톡스는 T세포의 기능을 억제하고 약화하는 유전자 발현 프로그램을 작동시킨다는 것이 이번 연구의 핵심이다.
연구팀은 기초적인 발견에 그치지 않고 암 환자의 면역항암제 치료 효율을 높이는 전략을 제시했다. 암 성장을 막을 목적으로 혈관내피성장인자 저해제가 이미 개발됐기 때문에, 연구팀이 새로 발견한 혈관내피성장인자의 T세포 기능 억제작용을 근거로 혈관내피성장인자 저해제를 면역항암제와 함께 사용한다면 치료 효율을 극대화할 수 있을 것으로 기대하고 있다.
실제 이번 연구에서도 면역항암제와 혈관내피성장인자 저해제를 병합 치료하면 우수한 항암 효과가 있음을 동물 모델에서 증명했다.
이번 연구는 연세대학교 의과대학 외과 및 병리학과 연구팀과 KAIST 의과학대학원이 암 환자의 면역학적 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과로 평가받는다.
신 교수는 “암세포와 면역세포 사이에서 어떤 일이 벌어지는지를 상세히 연구함으로써 임상 치료 전략을 제시하게 된 중요한 연구이다”라며 “향후 암 환자의 생존율을 높일 수 있는 새로운 면역기전 연구 및 면역항암제 개발 연구를 계속하겠다”라고 말했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 신의철 교수 연구팀 연구성과 개념도
2019.11.13 조회수 12962
신의철 교수, 암세포의 면역세포 억제 핵심원리 규명
〈 신의철 교수, 김창곤 연구원 〉
우리 대학 의과학대학원 신의철 교수, 연세대학교 의과대학 민병소, 김호근 교수 공동 연구팀이 암 환자의 암세포가 면역세포를 억제해 면역반응을 회피하게 만드는 핵심원리를 발견했다.
이번 연구를 통해 최근 유행하는 면역항암제의 치료 효율을 높일 수 있는 효과적인 암 치료 전략을 제시할 수 있을 것으로 기대된다.
김창곤 연구원, 장미 연구교수가 공동 1 저자로 참여한 이번 연구 결과는 면역학 분야 국제 학술지 ‘사이언스 면역학(Science Immunology)’ 11월 8일 자 온라인판에 게재됐다 (논문명 : VEGF-A drives TOX-dependent T cell exhaustion in anti–PD-1–resistant microsatellite stable colorectal cancers).
암 환자는 암세포에 대항하는 면역세포, 특히 T세포의 기능이 현저히 약해져 있다. 이렇게 T세포의 기능이 약해지는 주된 이유는 T세포가 PD-1이라는 억제 수용체를 과다하게 발현하기 때문이다.
최근 유행하고 있는 면역항암제도 바로 이 PD-1 억제 수용체의 기능을 차단해 T세포의 기능을 회복시키는 원리로 작동하는 것이다. 하지만 면역항암제는 아직 부족한 부분이 많아 투여받은 암 환자 중 일부에게만 치료 반응이 나타나는 현실이다. 이러한 이유로 많은 연구자가 암 환자의 T세포 기능이 약해지는 다른 이유를 활발히 찾고 있다.
이번 연구에서 공동 연구팀은, 그간 혈관형성인자로만 알려졌던 혈관내피성장인자(vascular endothelial growth factor; VEGF)라는 혈관형성인자 단백질이 암세포에 대항하는 T세포의 기능을 약하게 만드는 주요 원인임을 새롭게 밝혔다.
종양의 지속적인 성장을 위해 암세포는 혈관내피성장인자를 과다 생성하고, 이로 인해 암 조직에는 혈관이 과다 생성된다는 사실은 이미 잘 알려져 있었다. 연구팀은 이번 연구를 통해 혈관내피성장인자가 혈관 형성 이외에도 T세포 억제라는 중요한 작용을 통해 암의 성장을 돕는다는 사실을 새롭게 규명했다.
암세포에서 생성된 혈관내피성장인자는 암세포에 대항하는 T세포 표면에 발현하는 수용체에 결합해 T세포에 톡스(TOX)라 불리는 단백질의 발현을 유도하고, 톡스는 T세포의 기능을 억제하고 약화하는 유전자 발현 프로그램을 작동시킨다는 것이 이번 연구의 핵심이다.
연구팀은 기초적인 발견에 그치지 않고 암 환자의 면역항암제 치료 효율을 높이는 전략을 제시했다. 암 성장을 막을 목적으로 혈관내피성장인자 저해제가 이미 개발됐기 때문에, 연구팀이 새로 발견한 혈관내피성장인자의 T세포 기능 억제작용을 근거로 혈관내피성장인자 저해제를 면역항암제와 함께 사용한다면 치료 효율을 극대화할 수 있을 것으로 기대하고 있다.
실제 이번 연구에서도 면역항암제와 혈관내피성장인자 저해제를 병합 치료하면 우수한 항암 효과가 있음을 동물 모델에서 증명했다.
이번 연구는 연세대학교 의과대학 외과 및 병리학과 연구팀과 KAIST 의과학대학원이 암 환자의 면역학적 원리를 밝히고 새로운 치료 전략을 제시하기 위해 협동 연구를 한 것으로 중개 연구(translational research)의 주요 성과로 평가받는다.
신 교수는 “암세포와 면역세포 사이에서 어떤 일이 벌어지는지를 상세히 연구함으로써 임상 치료 전략을 제시하게 된 중요한 연구이다”라며 “향후 암 환자의 생존율을 높일 수 있는 새로운 면역기전 연구 및 면역항암제 개발 연구를 계속하겠다”라고 말했다.
이번 연구는 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 신의철 교수 연구팀 연구성과 개념도
2019.11.13 조회수 12962 김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
2019.04.01 조회수 23705
김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
2019.04.01 조회수 23705 이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
2018.05.16 조회수 21068
이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
2018.05.16 조회수 21068 오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
2016.08.04 조회수 17934
오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
2016.08.04 조회수 17934