-
 단백질 나노튜브의 자기조립 분자스위치 발견
- 한국, 미국, 이스라엘 국제 공동 연구 성과 -
- 암 치료와 뇌 질환 메커니즘 단서 -
우리 학교 바이오및뇌공학과 최명철 교수와 송채연 연구교수는 미국
산타바바라 캘리포니아대학교, 이스라엘 히브리대학교와 공동으로 세포분열과 세포간 물질수송에 열쇠가 되는 단백질 나노튜브의 자기조립
구조를 제어하는 분자스위치를 발견했다.
연구 결과는 세계적 학술지 ‘네이처 머티리얼즈(Nature Materials, IF=35.7)’ 19일자에 게재됐다.
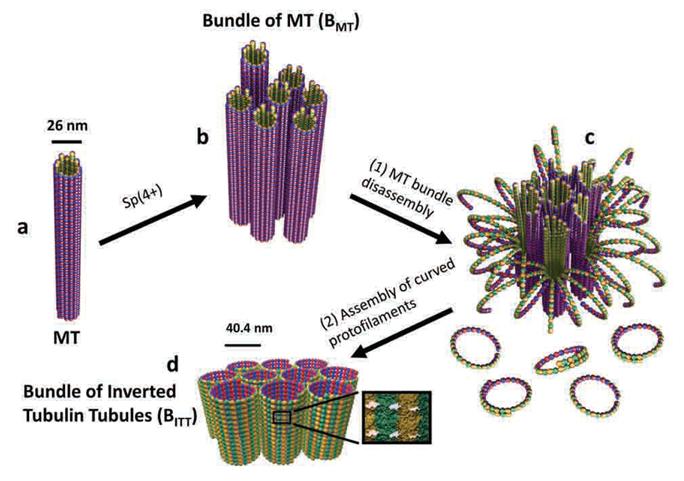
마이크로튜불(microtubule, 미세소관)은 사람의 몸속에서 세포분열·세포골격·세포간 물질수송 도구로 사용되는 튜브 형태의 단백질로 굵기가 25나노미터(1나노미터는 머리카락 굵기의 10만분의 1)에 불과하다.
대부분의 암 치료 약물은 마이크로튜불의 형성을 교란해 암세포 분열을
억제하는 것으로 작용 메커니즘이 알려져 있다. 알츠하이머병은 세포간 물질수송을 담당하는 마이크로튜불의 구조적 안정성이 떨어지면서
신경세포에서의 신호전달이 제대로 이루어지지 않아 생기는 대표적 뇌질환이다.
연구팀은 싱크로트론 X선 산란장치(synchrotron x-ray
scattering: 전자를 빛의 속도에 가깝게 가속시켜 강력한 X선을 발생시키는 장치)와 투과전자현미경을 이용해 단백질
나노튜브의 자기조립 구조를 서브나노미터(1나노미터 미만)의 정확도로 측정했다.
연구팀은 이번 연구를 분자 레벨에서 레고 블록을 쌓아 올리는 것에 비유해
가로×세로×폭이 각각 4×5×8 나노미터인 단백질 블록을 쌓아 올려 25나노미터 굵기의 튜브를 형성하는 메커니즘을 추적했다. 이
과정에서 연구팀은 레고 블록의 형태를 제어하는 분자스위치를 발견했다. 또 지금까지 보고된 바 없는 전혀 새로운 크기와 형태의
단백질 튜브 구조를 만들어 내는데 성공했다.
최명철 교수는 “인간의 생명 시스템은 고도의 자기조립 구조체를 형성해 복잡한 생물학적 기능을 하고 있지만 한편으로는 극히 단순한 물리학적 원리에 의해 제어가 가능하다는 새로운 패러다임을 제시했다”고 이 연구의 의의를 밝혔다.
또 “이번 연구는 암 치료와 뇌질환 메커니즘을 규명하고자하는 작은 발걸음이며 앞으로 바이오 나노튜브를 이용한 공학적 응용이 무궁무진할 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 국제협력사업, 신진연구자지원사업, 학문후속세대양성사업, KAIST 고위험 고수익 프로젝트(High Risk High Return Project)의 지원으로 수행됐다.
단백질 나노튜브의 자기조립 분자스위치 발견
- 한국, 미국, 이스라엘 국제 공동 연구 성과 -
- 암 치료와 뇌 질환 메커니즘 단서 -
우리 학교 바이오및뇌공학과 최명철 교수와 송채연 연구교수는 미국
산타바바라 캘리포니아대학교, 이스라엘 히브리대학교와 공동으로 세포분열과 세포간 물질수송에 열쇠가 되는 단백질 나노튜브의 자기조립
구조를 제어하는 분자스위치를 발견했다.
연구 결과는 세계적 학술지 ‘네이처 머티리얼즈(Nature Materials, IF=35.7)’ 19일자에 게재됐다.
마이크로튜불(microtubule, 미세소관)은 사람의 몸속에서 세포분열·세포골격·세포간 물질수송 도구로 사용되는 튜브 형태의 단백질로 굵기가 25나노미터(1나노미터는 머리카락 굵기의 10만분의 1)에 불과하다.
대부분의 암 치료 약물은 마이크로튜불의 형성을 교란해 암세포 분열을
억제하는 것으로 작용 메커니즘이 알려져 있다. 알츠하이머병은 세포간 물질수송을 담당하는 마이크로튜불의 구조적 안정성이 떨어지면서
신경세포에서의 신호전달이 제대로 이루어지지 않아 생기는 대표적 뇌질환이다.
연구팀은 싱크로트론 X선 산란장치(synchrotron x-ray
scattering: 전자를 빛의 속도에 가깝게 가속시켜 강력한 X선을 발생시키는 장치)와 투과전자현미경을 이용해 단백질
나노튜브의 자기조립 구조를 서브나노미터(1나노미터 미만)의 정확도로 측정했다.
연구팀은 이번 연구를 분자 레벨에서 레고 블록을 쌓아 올리는 것에 비유해
가로×세로×폭이 각각 4×5×8 나노미터인 단백질 블록을 쌓아 올려 25나노미터 굵기의 튜브를 형성하는 메커니즘을 추적했다. 이
과정에서 연구팀은 레고 블록의 형태를 제어하는 분자스위치를 발견했다. 또 지금까지 보고된 바 없는 전혀 새로운 크기와 형태의
단백질 튜브 구조를 만들어 내는데 성공했다.
최명철 교수는 “인간의 생명 시스템은 고도의 자기조립 구조체를 형성해 복잡한 생물학적 기능을 하고 있지만 한편으로는 극히 단순한 물리학적 원리에 의해 제어가 가능하다는 새로운 패러다임을 제시했다”고 이 연구의 의의를 밝혔다.
또 “이번 연구는 암 치료와 뇌질환 메커니즘을 규명하고자하는 작은 발걸음이며 앞으로 바이오 나노튜브를 이용한 공학적 응용이 무궁무진할 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 국제협력사업, 신진연구자지원사업, 학문후속세대양성사업, KAIST 고위험 고수익 프로젝트(High Risk High Return Project)의 지원으로 수행됐다.
2014.01.21
조회수 25881
-
 세계 최초 맞춤형 미생물 균주 대량 생산기술 개발
- 고부가가치 산업원료 생산 균주를 간편하고 빠르게 개발할 수 있는 원천기술 확보 -
우리 학교 생명화학공학과 이상엽 특훈교수와 유승민 연구교수 연구팀은 나일론 등 산업에 필요한 원료를 만드는 미생물 균주를 친환경 방법으로 쉽고 빠르게 대량 생산할 수 있는 ‘합성 조절 RNA’ 설계 원천기술을 세계 최초로 개발했다.
이번 연구결과는 세계적 학술지인 네이처 프로토콜스(Nature Protocols) 9월호 표지논문으로 선정되어 8월 9일 게재(온라인판)됐다.
’합성 조절 RNA 설계 기술’은 기존에 산업 균주를 개량하거나, 아직까지 알려지지 않은 미개척 산업 균주 개발‧개량에 광범위하게 적용이 가능하여 비천연 고분자를 포함한 다양한 화학물질, 원료, 의약품 등을 보다 효율적으로 개발, 생산할 수 있는 핵심원천기술이다.
기존의 균주개발은 유전자 결실(knockout) 이라는 유전공학 기법을 이용하여 미생물 염색체 내의 유전자를 하나씩 제거하는 방법을 통해 미생물내의 생산 물질의 양이 증가하는지를 관찰하는 것이었다.
그러나 아무리 작은 미생물일지라도 수천 개 이상의 유전자로 이루어져 있기에 이런 접근 방법을 통해 생물체 대사회로내의 모든 유전자를 조절한다면 수개월에서 수년의 시간이 소요되고 대용량 실험이 매우 어려우며, 미생물의 생장을 저해하고 원치 않은 물질들이 생산되는 한계가 있었다.
이상엽 교수와 유승민 연구교수는 이러한 기존 방법의 한계 극복을 위해 해당 유전자와 결합되는 부위의 합성 조절 RNA 유전정보를 바꾸는 ‘합성 조절 RNA’ 설계법을 개발하였다.
이를 통해 대장균의 조절 RNA를 기본골격으로 하여 세포내 존재하는 유전자의 발현을 단백질 수준에서 제어할 수 있는 맞춤형 합성 조절 RNA를 3~4일내에 제작할 수 있는 원천기술을 개발하였다.
이렇게 설계된 합성 조절 RNA들은 미생물 게놈을 건드리지 않은 채 유전자 전달체에 삽입하여 제작되므로 여러 종류의 균주들과 여러 유전자들에 대하여 동시다발적인 대용량 실험이 가능하다.
또한, 다양한 균주에 적용시 고효율의 균주를 선별하거나, 유전자 발현조절 효율이 가장 좋은 목적 유전자를 선별할 수 있어 향후 조절 RNA 라이브러리(Library)까지 구축할 수 있다.
네이처 프로토콜스 편집자인 이탄 즈로토린스키(Eytan Zlotorynski) 박사는 “본 논문은 합성 sRNA를 디자인하고 응용하는데 필요한 상세한 프로토콜을 기술하고 있어 생명과학과 생명공학 분야 연구에 매우 널리 활용될 것이며, 특히 대사공학과 합성생물학 연구에서 유용할 것이다”라고 말했다.
KAIST 산학협력단 배중면 단장은 “본 원천기술에 대해 이미 해외 기업들이 관심을 표명하며 기술이전계약을 제안하고 있으므로 2년 이내에 기술이전이 이루어질 것으로 본다“고 밝혔다.
세계 최초 맞춤형 미생물 균주 대량 생산기술 개발
- 고부가가치 산업원료 생산 균주를 간편하고 빠르게 개발할 수 있는 원천기술 확보 -
우리 학교 생명화학공학과 이상엽 특훈교수와 유승민 연구교수 연구팀은 나일론 등 산업에 필요한 원료를 만드는 미생물 균주를 친환경 방법으로 쉽고 빠르게 대량 생산할 수 있는 ‘합성 조절 RNA’ 설계 원천기술을 세계 최초로 개발했다.
이번 연구결과는 세계적 학술지인 네이처 프로토콜스(Nature Protocols) 9월호 표지논문으로 선정되어 8월 9일 게재(온라인판)됐다.
’합성 조절 RNA 설계 기술’은 기존에 산업 균주를 개량하거나, 아직까지 알려지지 않은 미개척 산업 균주 개발‧개량에 광범위하게 적용이 가능하여 비천연 고분자를 포함한 다양한 화학물질, 원료, 의약품 등을 보다 효율적으로 개발, 생산할 수 있는 핵심원천기술이다.
기존의 균주개발은 유전자 결실(knockout) 이라는 유전공학 기법을 이용하여 미생물 염색체 내의 유전자를 하나씩 제거하는 방법을 통해 미생물내의 생산 물질의 양이 증가하는지를 관찰하는 것이었다.
그러나 아무리 작은 미생물일지라도 수천 개 이상의 유전자로 이루어져 있기에 이런 접근 방법을 통해 생물체 대사회로내의 모든 유전자를 조절한다면 수개월에서 수년의 시간이 소요되고 대용량 실험이 매우 어려우며, 미생물의 생장을 저해하고 원치 않은 물질들이 생산되는 한계가 있었다.
이상엽 교수와 유승민 연구교수는 이러한 기존 방법의 한계 극복을 위해 해당 유전자와 결합되는 부위의 합성 조절 RNA 유전정보를 바꾸는 ‘합성 조절 RNA’ 설계법을 개발하였다.
이를 통해 대장균의 조절 RNA를 기본골격으로 하여 세포내 존재하는 유전자의 발현을 단백질 수준에서 제어할 수 있는 맞춤형 합성 조절 RNA를 3~4일내에 제작할 수 있는 원천기술을 개발하였다.
이렇게 설계된 합성 조절 RNA들은 미생물 게놈을 건드리지 않은 채 유전자 전달체에 삽입하여 제작되므로 여러 종류의 균주들과 여러 유전자들에 대하여 동시다발적인 대용량 실험이 가능하다.
또한, 다양한 균주에 적용시 고효율의 균주를 선별하거나, 유전자 발현조절 효율이 가장 좋은 목적 유전자를 선별할 수 있어 향후 조절 RNA 라이브러리(Library)까지 구축할 수 있다.
네이처 프로토콜스 편집자인 이탄 즈로토린스키(Eytan Zlotorynski) 박사는 “본 논문은 합성 sRNA를 디자인하고 응용하는데 필요한 상세한 프로토콜을 기술하고 있어 생명과학과 생명공학 분야 연구에 매우 널리 활용될 것이며, 특히 대사공학과 합성생물학 연구에서 유용할 것이다”라고 말했다.
KAIST 산학협력단 배중면 단장은 “본 원천기술에 대해 이미 해외 기업들이 관심을 표명하며 기술이전계약을 제안하고 있으므로 2년 이내에 기술이전이 이루어질 것으로 본다“고 밝혔다.
2013.08.09
조회수 16842
-
 박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
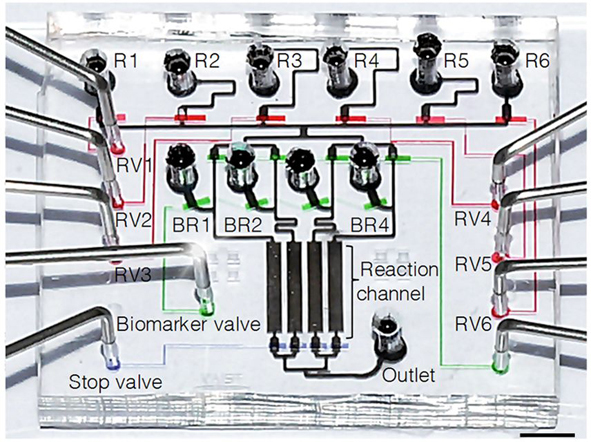
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
2010.05.10
조회수 22325
 단백질 나노튜브의 자기조립 분자스위치 발견
- 한국, 미국, 이스라엘 국제 공동 연구 성과 -
- 암 치료와 뇌 질환 메커니즘 단서 -
우리 학교 바이오및뇌공학과 최명철 교수와 송채연 연구교수는 미국
산타바바라 캘리포니아대학교, 이스라엘 히브리대학교와 공동으로 세포분열과 세포간 물질수송에 열쇠가 되는 단백질 나노튜브의 자기조립
구조를 제어하는 분자스위치를 발견했다.
연구 결과는 세계적 학술지 ‘네이처 머티리얼즈(Nature Materials, IF=35.7)’ 19일자에 게재됐다.
마이크로튜불(microtubule, 미세소관)은 사람의 몸속에서 세포분열·세포골격·세포간 물질수송 도구로 사용되는 튜브 형태의 단백질로 굵기가 25나노미터(1나노미터는 머리카락 굵기의 10만분의 1)에 불과하다.
대부분의 암 치료 약물은 마이크로튜불의 형성을 교란해 암세포 분열을
억제하는 것으로 작용 메커니즘이 알려져 있다. 알츠하이머병은 세포간 물질수송을 담당하는 마이크로튜불의 구조적 안정성이 떨어지면서
신경세포에서의 신호전달이 제대로 이루어지지 않아 생기는 대표적 뇌질환이다.
연구팀은 싱크로트론 X선 산란장치(synchrotron x-ray
scattering: 전자를 빛의 속도에 가깝게 가속시켜 강력한 X선을 발생시키는 장치)와 투과전자현미경을 이용해 단백질
나노튜브의 자기조립 구조를 서브나노미터(1나노미터 미만)의 정확도로 측정했다.
연구팀은 이번 연구를 분자 레벨에서 레고 블록을 쌓아 올리는 것에 비유해
가로×세로×폭이 각각 4×5×8 나노미터인 단백질 블록을 쌓아 올려 25나노미터 굵기의 튜브를 형성하는 메커니즘을 추적했다. 이
과정에서 연구팀은 레고 블록의 형태를 제어하는 분자스위치를 발견했다. 또 지금까지 보고된 바 없는 전혀 새로운 크기와 형태의
단백질 튜브 구조를 만들어 내는데 성공했다.
최명철 교수는 “인간의 생명 시스템은 고도의 자기조립 구조체를 형성해 복잡한 생물학적 기능을 하고 있지만 한편으로는 극히 단순한 물리학적 원리에 의해 제어가 가능하다는 새로운 패러다임을 제시했다”고 이 연구의 의의를 밝혔다.
또 “이번 연구는 암 치료와 뇌질환 메커니즘을 규명하고자하는 작은 발걸음이며 앞으로 바이오 나노튜브를 이용한 공학적 응용이 무궁무진할 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 국제협력사업, 신진연구자지원사업, 학문후속세대양성사업, KAIST 고위험 고수익 프로젝트(High Risk High Return Project)의 지원으로 수행됐다.
2014.01.21 조회수 25881
단백질 나노튜브의 자기조립 분자스위치 발견
- 한국, 미국, 이스라엘 국제 공동 연구 성과 -
- 암 치료와 뇌 질환 메커니즘 단서 -
우리 학교 바이오및뇌공학과 최명철 교수와 송채연 연구교수는 미국
산타바바라 캘리포니아대학교, 이스라엘 히브리대학교와 공동으로 세포분열과 세포간 물질수송에 열쇠가 되는 단백질 나노튜브의 자기조립
구조를 제어하는 분자스위치를 발견했다.
연구 결과는 세계적 학술지 ‘네이처 머티리얼즈(Nature Materials, IF=35.7)’ 19일자에 게재됐다.
마이크로튜불(microtubule, 미세소관)은 사람의 몸속에서 세포분열·세포골격·세포간 물질수송 도구로 사용되는 튜브 형태의 단백질로 굵기가 25나노미터(1나노미터는 머리카락 굵기의 10만분의 1)에 불과하다.
대부분의 암 치료 약물은 마이크로튜불의 형성을 교란해 암세포 분열을
억제하는 것으로 작용 메커니즘이 알려져 있다. 알츠하이머병은 세포간 물질수송을 담당하는 마이크로튜불의 구조적 안정성이 떨어지면서
신경세포에서의 신호전달이 제대로 이루어지지 않아 생기는 대표적 뇌질환이다.
연구팀은 싱크로트론 X선 산란장치(synchrotron x-ray
scattering: 전자를 빛의 속도에 가깝게 가속시켜 강력한 X선을 발생시키는 장치)와 투과전자현미경을 이용해 단백질
나노튜브의 자기조립 구조를 서브나노미터(1나노미터 미만)의 정확도로 측정했다.
연구팀은 이번 연구를 분자 레벨에서 레고 블록을 쌓아 올리는 것에 비유해
가로×세로×폭이 각각 4×5×8 나노미터인 단백질 블록을 쌓아 올려 25나노미터 굵기의 튜브를 형성하는 메커니즘을 추적했다. 이
과정에서 연구팀은 레고 블록의 형태를 제어하는 분자스위치를 발견했다. 또 지금까지 보고된 바 없는 전혀 새로운 크기와 형태의
단백질 튜브 구조를 만들어 내는데 성공했다.
최명철 교수는 “인간의 생명 시스템은 고도의 자기조립 구조체를 형성해 복잡한 생물학적 기능을 하고 있지만 한편으로는 극히 단순한 물리학적 원리에 의해 제어가 가능하다는 새로운 패러다임을 제시했다”고 이 연구의 의의를 밝혔다.
또 “이번 연구는 암 치료와 뇌질환 메커니즘을 규명하고자하는 작은 발걸음이며 앞으로 바이오 나노튜브를 이용한 공학적 응용이 무궁무진할 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 국제협력사업, 신진연구자지원사업, 학문후속세대양성사업, KAIST 고위험 고수익 프로젝트(High Risk High Return Project)의 지원으로 수행됐다.
2014.01.21 조회수 25881 세계 최초 맞춤형 미생물 균주 대량 생산기술 개발
- 고부가가치 산업원료 생산 균주를 간편하고 빠르게 개발할 수 있는 원천기술 확보 -
우리 학교 생명화학공학과 이상엽 특훈교수와 유승민 연구교수 연구팀은 나일론 등 산업에 필요한 원료를 만드는 미생물 균주를 친환경 방법으로 쉽고 빠르게 대량 생산할 수 있는 ‘합성 조절 RNA’ 설계 원천기술을 세계 최초로 개발했다.
이번 연구결과는 세계적 학술지인 네이처 프로토콜스(Nature Protocols) 9월호 표지논문으로 선정되어 8월 9일 게재(온라인판)됐다.
’합성 조절 RNA 설계 기술’은 기존에 산업 균주를 개량하거나, 아직까지 알려지지 않은 미개척 산업 균주 개발‧개량에 광범위하게 적용이 가능하여 비천연 고분자를 포함한 다양한 화학물질, 원료, 의약품 등을 보다 효율적으로 개발, 생산할 수 있는 핵심원천기술이다.
기존의 균주개발은 유전자 결실(knockout) 이라는 유전공학 기법을 이용하여 미생물 염색체 내의 유전자를 하나씩 제거하는 방법을 통해 미생물내의 생산 물질의 양이 증가하는지를 관찰하는 것이었다.
그러나 아무리 작은 미생물일지라도 수천 개 이상의 유전자로 이루어져 있기에 이런 접근 방법을 통해 생물체 대사회로내의 모든 유전자를 조절한다면 수개월에서 수년의 시간이 소요되고 대용량 실험이 매우 어려우며, 미생물의 생장을 저해하고 원치 않은 물질들이 생산되는 한계가 있었다.
이상엽 교수와 유승민 연구교수는 이러한 기존 방법의 한계 극복을 위해 해당 유전자와 결합되는 부위의 합성 조절 RNA 유전정보를 바꾸는 ‘합성 조절 RNA’ 설계법을 개발하였다.
이를 통해 대장균의 조절 RNA를 기본골격으로 하여 세포내 존재하는 유전자의 발현을 단백질 수준에서 제어할 수 있는 맞춤형 합성 조절 RNA를 3~4일내에 제작할 수 있는 원천기술을 개발하였다.
이렇게 설계된 합성 조절 RNA들은 미생물 게놈을 건드리지 않은 채 유전자 전달체에 삽입하여 제작되므로 여러 종류의 균주들과 여러 유전자들에 대하여 동시다발적인 대용량 실험이 가능하다.
또한, 다양한 균주에 적용시 고효율의 균주를 선별하거나, 유전자 발현조절 효율이 가장 좋은 목적 유전자를 선별할 수 있어 향후 조절 RNA 라이브러리(Library)까지 구축할 수 있다.
네이처 프로토콜스 편집자인 이탄 즈로토린스키(Eytan Zlotorynski) 박사는 “본 논문은 합성 sRNA를 디자인하고 응용하는데 필요한 상세한 프로토콜을 기술하고 있어 생명과학과 생명공학 분야 연구에 매우 널리 활용될 것이며, 특히 대사공학과 합성생물학 연구에서 유용할 것이다”라고 말했다.
KAIST 산학협력단 배중면 단장은 “본 원천기술에 대해 이미 해외 기업들이 관심을 표명하며 기술이전계약을 제안하고 있으므로 2년 이내에 기술이전이 이루어질 것으로 본다“고 밝혔다.
2013.08.09 조회수 16842
세계 최초 맞춤형 미생물 균주 대량 생산기술 개발
- 고부가가치 산업원료 생산 균주를 간편하고 빠르게 개발할 수 있는 원천기술 확보 -
우리 학교 생명화학공학과 이상엽 특훈교수와 유승민 연구교수 연구팀은 나일론 등 산업에 필요한 원료를 만드는 미생물 균주를 친환경 방법으로 쉽고 빠르게 대량 생산할 수 있는 ‘합성 조절 RNA’ 설계 원천기술을 세계 최초로 개발했다.
이번 연구결과는 세계적 학술지인 네이처 프로토콜스(Nature Protocols) 9월호 표지논문으로 선정되어 8월 9일 게재(온라인판)됐다.
’합성 조절 RNA 설계 기술’은 기존에 산업 균주를 개량하거나, 아직까지 알려지지 않은 미개척 산업 균주 개발‧개량에 광범위하게 적용이 가능하여 비천연 고분자를 포함한 다양한 화학물질, 원료, 의약품 등을 보다 효율적으로 개발, 생산할 수 있는 핵심원천기술이다.
기존의 균주개발은 유전자 결실(knockout) 이라는 유전공학 기법을 이용하여 미생물 염색체 내의 유전자를 하나씩 제거하는 방법을 통해 미생물내의 생산 물질의 양이 증가하는지를 관찰하는 것이었다.
그러나 아무리 작은 미생물일지라도 수천 개 이상의 유전자로 이루어져 있기에 이런 접근 방법을 통해 생물체 대사회로내의 모든 유전자를 조절한다면 수개월에서 수년의 시간이 소요되고 대용량 실험이 매우 어려우며, 미생물의 생장을 저해하고 원치 않은 물질들이 생산되는 한계가 있었다.
이상엽 교수와 유승민 연구교수는 이러한 기존 방법의 한계 극복을 위해 해당 유전자와 결합되는 부위의 합성 조절 RNA 유전정보를 바꾸는 ‘합성 조절 RNA’ 설계법을 개발하였다.
이를 통해 대장균의 조절 RNA를 기본골격으로 하여 세포내 존재하는 유전자의 발현을 단백질 수준에서 제어할 수 있는 맞춤형 합성 조절 RNA를 3~4일내에 제작할 수 있는 원천기술을 개발하였다.
이렇게 설계된 합성 조절 RNA들은 미생물 게놈을 건드리지 않은 채 유전자 전달체에 삽입하여 제작되므로 여러 종류의 균주들과 여러 유전자들에 대하여 동시다발적인 대용량 실험이 가능하다.
또한, 다양한 균주에 적용시 고효율의 균주를 선별하거나, 유전자 발현조절 효율이 가장 좋은 목적 유전자를 선별할 수 있어 향후 조절 RNA 라이브러리(Library)까지 구축할 수 있다.
네이처 프로토콜스 편집자인 이탄 즈로토린스키(Eytan Zlotorynski) 박사는 “본 논문은 합성 sRNA를 디자인하고 응용하는데 필요한 상세한 프로토콜을 기술하고 있어 생명과학과 생명공학 분야 연구에 매우 널리 활용될 것이며, 특히 대사공학과 합성생물학 연구에서 유용할 것이다”라고 말했다.
KAIST 산학협력단 배중면 단장은 “본 원천기술에 대해 이미 해외 기업들이 관심을 표명하며 기술이전계약을 제안하고 있으므로 2년 이내에 기술이전이 이루어질 것으로 본다“고 밝혔다.
2013.08.09 조회수 16842 박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
2010.05.10 조회수 22325
박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
2010.05.10 조회수 22325