-
 ‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19
조회수 4854
-
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18
조회수 4531
-
 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11
조회수 5031
-
 기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다.
연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다.
iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미세환경 내에서 폐계면활성제와의 상호작용을 유도해 호흡 운동을 활용, mRNA를 높은 효율로 폐 세포 내로 전달할 수 있다.
흡입 전달 및 폐 미세환경을 고려한 모방 환경 및 마우스 폐에서의 단백질 발현을 토대로 한 다차원 선별 과정을 통해 iLPX의 구성 요소들을 최적화시킴으로써 흡입용 mRNA 전달체(Inhalation optimized-iLPX, 이하 IH-iLPX)를 완성했다.
연구팀은 에어로졸화 전후의 입자 크기, 균일도, mRNA 탑재율을 비교함으로써 IH-iLPX의 월등한 에어로졸화 안정성을 증명했다. 나아가, IH-iLPX를 전달한 마우스에서 LNP 전달 마우스보다 26배 높은 단백질 발현이 유도됨을 확인했다.
연구팀은 동물 모델에서 흡입 전달된 IH-iLPX가 폐 특이적으로 단백질을 발현시키며, 폐포 상피세포와 기관지 상피세포에서 mRNA를 효과적으로 전달함을 확인했다. 또한 혈액 생화학 분석과 조직 검사를 토대로 IH-iLPX가 폐와 혈액 환경에서 독성이 없음을 확인했기 때문에 효과적인 폐내 mRNA 발현뿐만 아니라 생체 안전성 측면에서 큰 의의를 갖는다고 밝혔다.
박 교수는 “mRNA를 반드시 내부에 탑재해야 한다는 고정 관념을 깨고 새로운 구성의 입자를 제시함으로써 기존에 불가능했던 흡입형 유전자 치료의 길을 열었다”며 “본 연구실에서 개발한 흡입형 유전자 전달체는 치료 단백질을 암호화하는 mRNA를 탑재해 폐질환에 적용되어 유전자 폐 치료의 적용 범위를 넓힐 것으로 기대된다”이라고 말했다.
바이오및뇌공학과 장민철 박사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)’ 9월 3일 자 18권 35호에 게재됐다. (논문명: Inhalable mRNA Nanoparticle with Enhanced Nebulization Stability and Pulmonary Microenvironment Infilration)
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다.
연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다.
iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미세환경 내에서 폐계면활성제와의 상호작용을 유도해 호흡 운동을 활용, mRNA를 높은 효율로 폐 세포 내로 전달할 수 있다.
흡입 전달 및 폐 미세환경을 고려한 모방 환경 및 마우스 폐에서의 단백질 발현을 토대로 한 다차원 선별 과정을 통해 iLPX의 구성 요소들을 최적화시킴으로써 흡입용 mRNA 전달체(Inhalation optimized-iLPX, 이하 IH-iLPX)를 완성했다.
연구팀은 에어로졸화 전후의 입자 크기, 균일도, mRNA 탑재율을 비교함으로써 IH-iLPX의 월등한 에어로졸화 안정성을 증명했다. 나아가, IH-iLPX를 전달한 마우스에서 LNP 전달 마우스보다 26배 높은 단백질 발현이 유도됨을 확인했다.
연구팀은 동물 모델에서 흡입 전달된 IH-iLPX가 폐 특이적으로 단백질을 발현시키며, 폐포 상피세포와 기관지 상피세포에서 mRNA를 효과적으로 전달함을 확인했다. 또한 혈액 생화학 분석과 조직 검사를 토대로 IH-iLPX가 폐와 혈액 환경에서 독성이 없음을 확인했기 때문에 효과적인 폐내 mRNA 발현뿐만 아니라 생체 안전성 측면에서 큰 의의를 갖는다고 밝혔다.
박 교수는 “mRNA를 반드시 내부에 탑재해야 한다는 고정 관념을 깨고 새로운 구성의 입자를 제시함으로써 기존에 불가능했던 흡입형 유전자 치료의 길을 열었다”며 “본 연구실에서 개발한 흡입형 유전자 전달체는 치료 단백질을 암호화하는 mRNA를 탑재해 폐질환에 적용되어 유전자 폐 치료의 적용 범위를 넓힐 것으로 기대된다”이라고 말했다.
바이오및뇌공학과 장민철 박사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)’ 9월 3일 자 18권 35호에 게재됐다. (논문명: Inhalable mRNA Nanoparticle with Enhanced Nebulization Stability and Pulmonary Microenvironment Infilration)
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.10.10
조회수 5659
-
 단백질 ‘생산 설계도’ 보호하는 RNA 조절 기전 찾았다
생명체는 DNA, RNA, 단백질과 같은 바이오분자들의 조절 작용으로 다양한 생물학적 기능을 수행한다. 바이오분자들의 조절로 유전 정보가 전달되고, 잘못 전달된 정보는 유전자 변형이나 감염성 질병의 원인이 된다. 따라서 분자생물학적 조절 연구는 유전자 치료제와 첨단 백신 개발에 중요하다. 특히, 2023년 코로나 mRNA 백신 기술을 개발한 과학자들이 노벨 생리의학상을 수상하면서 RNA 조절 연구에 기반한 첨단신약, 바이오공학 기술이 크게 주목받고 있다.
우리 대학 바이오및뇌공학과 이영석 교수 연구팀이 기초과학연구원(IBS) RNA 연구단 김빛내리 단장(서울대 생명과학부 석좌교수), 미국 국립암연구소 유진 발코프(Eugene Valkov) 박사팀과 공동연구를 통해 자체 개발한 단일핵산 분석법을 적용해 전령 RNA(messenger RNA, 이하 mRNA) 분해의 새로운 조절 기전을 찾았다고 밝혔다.
mRNA는 긴 단일 가닥 RNA 분자로, DNA에 보관된 유전 정보를 단백질에 전달하는 매개체로서 마치 단백질의 ‘생산 설계도’와 같다. 예를 들어, 코로나 mRNA 백신은 약 4,000개의 RNA 분자로 이루어져 있으며, 코로나 스파이크 단백질의 유전 정보와 다양한 RNA 변형을 활용해 스파이크 단백질 생산을 조절하도록 설계되어 있다. 결국 RNA 기능과 조절에 따라 유전자 치료제 및 mRNA 백신의 효능이 결정된다.
연구진은 다양한 RNA 조절 인자 중 특히 mRNA 꼬리에 주목해 왔다. mRNA는 말단에 50-150개의 아데닌 염기로 구성된 긴 꼬리를 갖는데, mRNA를 보호하고 단백질 합성을 촉진하는 역할을 한다. 그동안 이 꼬리는 아데닌으로만 구성된 것으로 알려졌지만, 연구진은 지난 연구에서 비(非) 아데닌 염기가 추가된 ‘혼합 꼬리(Mixed tail)’가 존재한다는 사실을 보고하였고, 이 혼합 꼬리가 mRNA의 분해를 막는 역할을 하여 유전자 활성을 높이는 데 기여함을 밝힌 바 있다.
그러나 RNA 변형의 결과인 mRNA 꼬리는 그 변형의 특이적인 행태로 인해 생화학 실험과 정량적 분석에 어려움이 있었다. 또한, 50-150개 RNA 분자의 연속적인 변형에 대한 단일염기 분석이 필요하여 mRNA 혼합 꼬리 조절 기전 연구에 제한이 있었다.
이를 해결하기 위해 연구진은 미국 국립암연구소 유진 발코프 박사 연구팀과 함께 mRNA 꼬리 조절 연구를 위한 단일핵산 분석법을 개발했다. 이어 이 분석법을 활용하여 세계 최초로 mRNA 꼬리가 분해되는 속도를 단일핵산 단위로 측정하는데 성공, mRNA 꼬리의 새로운 분해 기전을 규명했다.
연구진은 mRNA 분해를 유도하는 탈아데닐 복합체(CCR4-NOT)를 이용한 탈아데닐화 시스템을 개발하고 단일 염기 단위의 분해 반응을 수학적으로 모델링하여 혼합 꼬리 분해 효과를 정량화했다. 그 결과, 탈아데닐 복합체의 진행이 지연되는 위치를 확인할 수 있었으며, 복합체의 구성 요소들이 비 아데닌 염기에 의해 특정 위치에서 막혀 분해 속도가 조절되는 것을 밝혔다. 즉, 비 아데닌 염기가 일종의 ‘과속 방지턱’ 역할을 한다는 것을 입증한 것이다.
김빛내리 단장은 “mRNA 혼합 꼬리 조절에 대한 이해를 확장해 mRNA 안정성 조절과 유전자 발현 메커니즘에 대한 새로운 통찰을 제공했다”라며, “혼합 꼬리에 기반한 다양한 유전자 치료법 연구와 RNA 첨단 신약 개발에 기여할 것”이라고 말했다.
우리 대학 바이오및뇌공학과 이영석 교수는 “이번 연구는 분자생물학, 생화학 및 수학 분야가 만나 이룬 융합 연구의 결실”이라며, “미래 바이오공학 및 첨단바이오 분야 발전을 위한 공동연구의 중요성을 시사한다”라고 연구의 의의를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 구조 분자생물학(Nature Structural & Molecular Biology, IF=16.8)’에 지난 2월 19일 게재됐다.
단백질 ‘생산 설계도’ 보호하는 RNA 조절 기전 찾았다
생명체는 DNA, RNA, 단백질과 같은 바이오분자들의 조절 작용으로 다양한 생물학적 기능을 수행한다. 바이오분자들의 조절로 유전 정보가 전달되고, 잘못 전달된 정보는 유전자 변형이나 감염성 질병의 원인이 된다. 따라서 분자생물학적 조절 연구는 유전자 치료제와 첨단 백신 개발에 중요하다. 특히, 2023년 코로나 mRNA 백신 기술을 개발한 과학자들이 노벨 생리의학상을 수상하면서 RNA 조절 연구에 기반한 첨단신약, 바이오공학 기술이 크게 주목받고 있다.
우리 대학 바이오및뇌공학과 이영석 교수 연구팀이 기초과학연구원(IBS) RNA 연구단 김빛내리 단장(서울대 생명과학부 석좌교수), 미국 국립암연구소 유진 발코프(Eugene Valkov) 박사팀과 공동연구를 통해 자체 개발한 단일핵산 분석법을 적용해 전령 RNA(messenger RNA, 이하 mRNA) 분해의 새로운 조절 기전을 찾았다고 밝혔다.
mRNA는 긴 단일 가닥 RNA 분자로, DNA에 보관된 유전 정보를 단백질에 전달하는 매개체로서 마치 단백질의 ‘생산 설계도’와 같다. 예를 들어, 코로나 mRNA 백신은 약 4,000개의 RNA 분자로 이루어져 있으며, 코로나 스파이크 단백질의 유전 정보와 다양한 RNA 변형을 활용해 스파이크 단백질 생산을 조절하도록 설계되어 있다. 결국 RNA 기능과 조절에 따라 유전자 치료제 및 mRNA 백신의 효능이 결정된다.
연구진은 다양한 RNA 조절 인자 중 특히 mRNA 꼬리에 주목해 왔다. mRNA는 말단에 50-150개의 아데닌 염기로 구성된 긴 꼬리를 갖는데, mRNA를 보호하고 단백질 합성을 촉진하는 역할을 한다. 그동안 이 꼬리는 아데닌으로만 구성된 것으로 알려졌지만, 연구진은 지난 연구에서 비(非) 아데닌 염기가 추가된 ‘혼합 꼬리(Mixed tail)’가 존재한다는 사실을 보고하였고, 이 혼합 꼬리가 mRNA의 분해를 막는 역할을 하여 유전자 활성을 높이는 데 기여함을 밝힌 바 있다.
그러나 RNA 변형의 결과인 mRNA 꼬리는 그 변형의 특이적인 행태로 인해 생화학 실험과 정량적 분석에 어려움이 있었다. 또한, 50-150개 RNA 분자의 연속적인 변형에 대한 단일염기 분석이 필요하여 mRNA 혼합 꼬리 조절 기전 연구에 제한이 있었다.
이를 해결하기 위해 연구진은 미국 국립암연구소 유진 발코프 박사 연구팀과 함께 mRNA 꼬리 조절 연구를 위한 단일핵산 분석법을 개발했다. 이어 이 분석법을 활용하여 세계 최초로 mRNA 꼬리가 분해되는 속도를 단일핵산 단위로 측정하는데 성공, mRNA 꼬리의 새로운 분해 기전을 규명했다.
연구진은 mRNA 분해를 유도하는 탈아데닐 복합체(CCR4-NOT)를 이용한 탈아데닐화 시스템을 개발하고 단일 염기 단위의 분해 반응을 수학적으로 모델링하여 혼합 꼬리 분해 효과를 정량화했다. 그 결과, 탈아데닐 복합체의 진행이 지연되는 위치를 확인할 수 있었으며, 복합체의 구성 요소들이 비 아데닌 염기에 의해 특정 위치에서 막혀 분해 속도가 조절되는 것을 밝혔다. 즉, 비 아데닌 염기가 일종의 ‘과속 방지턱’ 역할을 한다는 것을 입증한 것이다.
김빛내리 단장은 “mRNA 혼합 꼬리 조절에 대한 이해를 확장해 mRNA 안정성 조절과 유전자 발현 메커니즘에 대한 새로운 통찰을 제공했다”라며, “혼합 꼬리에 기반한 다양한 유전자 치료법 연구와 RNA 첨단 신약 개발에 기여할 것”이라고 말했다.
우리 대학 바이오및뇌공학과 이영석 교수는 “이번 연구는 분자생물학, 생화학 및 수학 분야가 만나 이룬 융합 연구의 결실”이라며, “미래 바이오공학 및 첨단바이오 분야 발전을 위한 공동연구의 중요성을 시사한다”라고 연구의 의의를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 구조 분자생물학(Nature Structural & Molecular Biology, IF=16.8)’에 지난 2월 19일 게재됐다.
2024.02.28
조회수 7052
-
 암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06
조회수 6548
-
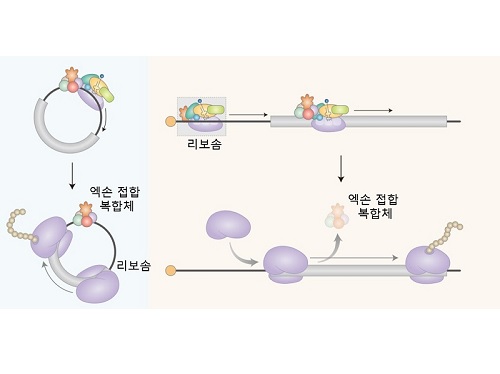 저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24
조회수 7371
-
 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02
조회수 14001
-
 빛으로 RNA 이동과 단백질 합성 조절한다
빛으로 세포 내 특정 RNA 이동과 단백질 합성을 조절할 수 있는 기술이 개발됐다. 생명과학과 허원도 교수 연구팀이 빛을 이용해 유전정보를 전달하는 전령RNA와 단백질을 생성하는 리보솜의 결합을 제어해 단백질 합성을 조절하는데 성공했다.
이번 연구성과는 네이처 셀 바이올로지(Nature Cell Biology, IF 17.728)에 2월 18일 오전 1시(한국시간)자 온라인 판에 실렸으며, Nature Reviews Genetics에 하이라이트 논문으로 소개됐다.
DNA의 유전정보는 RNA를 거쳐 단백질로 전달된다. 이때 중간에서 유전정보를 전달하는 RNA를 ‘전령RNA’라고 한다. 단백질 생성공장인 리보솜이 전령RNA의 유전정보를 읽어 단백질을 합성한다. 단백질 합성에 있어 전령RNA는 DNA 유전정보의 중간 전달자, 리보솜은 생성공장, 단백질은 완성품인 셈이다.
이전에는 화학물질을 처리해 전령RNA를 조절하는 방법으로 모든 전령RNA를 한꺼번에 조절하기 때문에 특정 종류의 전령RNA만을 세밀하게 조절하기 어려웠다. 이번 연구에서는 살아있는 세포에 청색광을 비춰줌으로써 세포 내 특정 전령RNA 이동 및 단백질 합성을 시공간 특이적으로 조절하는 mRNA-LARIAT 광유전학 기술을 개발했다.
연구팀은 이전 연구로 개발한 라리아트 올가미(LARIAT, Light-Activated Reversible Inhibition by Assembled Trap) 기술과 RNA 이미징 기술을 융합해 mRNA-LARIAT 기술을 개발했다. mRNA-LARIAT 광유전학 기술을 이용하면 빛의 유무에 따라 라리아트 올가미에 전령RNA를 가두거나 분리하고, 이를 실시간으로 관찰하는 것이 가능하다.
연구팀은 헬라 세포에 청색광을 비춰주면 라리아트 올가미에 전령RNA가 가둬지면서 리보솜과 격리되고 단백질 합성이 감소함을 관찰했다. 이어 청색광을 차단하면 라리아트 올가미로부터 전령RNA가 빠져나오면서 리보솜과 단백질 합성을 다시 시작함을 확인했다. 이는 mRNA-LARIAT 광유전학 기술로 빛의 유무에 따라 매우 빠르고 가역적으로 단백질 합성을 조절할 수 있음을 의미한다.
대부분 단백질은 전령RNA와 리보솜에 의해 합성된 후, 각 단백질이 작용하는 위치로 이동한다. 하지만 전령RNA가 라리아트 올가미에 가둬지면 전령RNA가 향후 단백질이 작용하는 위치까지 이동이 멈추고 단백질 합성이 차단된다. 전령RNA는 단백질보다 비교적 작은 분자로, 세포 내 이동이 더 효율적이고 빠르다. 이처럼 mRNA-LARIAT 광유전학 기술로 전령RNA 이동 및 단백질 합성을 빛으로 조절하면 살아있는 세포에서의 RNA의 위치 및 합성되는 신생 단백질의 기능을 효율적으로 연구할 수 있게 되었다.
연구팀은 베타액틴(β-actin) 단백질 합성에 관여하는 전령RNA에 mRNA-LARIAT 기술을 적용했다. 베타액틴 단백질 합성에 관여하는 전령RNA에 청색광을 비추니 세포 골격 구성 및 이동 기능이 제대로 이뤄지지 않음을 관찰했다. 또한 베타액틴 단백질 합성 효율이 최대 90%까지 감소됨을 확인했다.
허원도 교수는 “mRNA-LARIAT 광유전학 기술을 활용하면 암세포, 신경세포 등 다양한 세포 내 전령RNA 이동 및 단백질 합성을 빛으로 조절할 수 있다”라며 “앞으로 암세포 전이, 신경질환 등 전령 RNA 관련 질병 연구에 응용 가능할 것이다”라고 말했다.
빛으로 RNA 이동과 단백질 합성 조절한다
빛으로 세포 내 특정 RNA 이동과 단백질 합성을 조절할 수 있는 기술이 개발됐다. 생명과학과 허원도 교수 연구팀이 빛을 이용해 유전정보를 전달하는 전령RNA와 단백질을 생성하는 리보솜의 결합을 제어해 단백질 합성을 조절하는데 성공했다.
이번 연구성과는 네이처 셀 바이올로지(Nature Cell Biology, IF 17.728)에 2월 18일 오전 1시(한국시간)자 온라인 판에 실렸으며, Nature Reviews Genetics에 하이라이트 논문으로 소개됐다.
DNA의 유전정보는 RNA를 거쳐 단백질로 전달된다. 이때 중간에서 유전정보를 전달하는 RNA를 ‘전령RNA’라고 한다. 단백질 생성공장인 리보솜이 전령RNA의 유전정보를 읽어 단백질을 합성한다. 단백질 합성에 있어 전령RNA는 DNA 유전정보의 중간 전달자, 리보솜은 생성공장, 단백질은 완성품인 셈이다.
이전에는 화학물질을 처리해 전령RNA를 조절하는 방법으로 모든 전령RNA를 한꺼번에 조절하기 때문에 특정 종류의 전령RNA만을 세밀하게 조절하기 어려웠다. 이번 연구에서는 살아있는 세포에 청색광을 비춰줌으로써 세포 내 특정 전령RNA 이동 및 단백질 합성을 시공간 특이적으로 조절하는 mRNA-LARIAT 광유전학 기술을 개발했다.
연구팀은 이전 연구로 개발한 라리아트 올가미(LARIAT, Light-Activated Reversible Inhibition by Assembled Trap) 기술과 RNA 이미징 기술을 융합해 mRNA-LARIAT 기술을 개발했다. mRNA-LARIAT 광유전학 기술을 이용하면 빛의 유무에 따라 라리아트 올가미에 전령RNA를 가두거나 분리하고, 이를 실시간으로 관찰하는 것이 가능하다.
연구팀은 헬라 세포에 청색광을 비춰주면 라리아트 올가미에 전령RNA가 가둬지면서 리보솜과 격리되고 단백질 합성이 감소함을 관찰했다. 이어 청색광을 차단하면 라리아트 올가미로부터 전령RNA가 빠져나오면서 리보솜과 단백질 합성을 다시 시작함을 확인했다. 이는 mRNA-LARIAT 광유전학 기술로 빛의 유무에 따라 매우 빠르고 가역적으로 단백질 합성을 조절할 수 있음을 의미한다.
대부분 단백질은 전령RNA와 리보솜에 의해 합성된 후, 각 단백질이 작용하는 위치로 이동한다. 하지만 전령RNA가 라리아트 올가미에 가둬지면 전령RNA가 향후 단백질이 작용하는 위치까지 이동이 멈추고 단백질 합성이 차단된다. 전령RNA는 단백질보다 비교적 작은 분자로, 세포 내 이동이 더 효율적이고 빠르다. 이처럼 mRNA-LARIAT 광유전학 기술로 전령RNA 이동 및 단백질 합성을 빛으로 조절하면 살아있는 세포에서의 RNA의 위치 및 합성되는 신생 단백질의 기능을 효율적으로 연구할 수 있게 되었다.
연구팀은 베타액틴(β-actin) 단백질 합성에 관여하는 전령RNA에 mRNA-LARIAT 기술을 적용했다. 베타액틴 단백질 합성에 관여하는 전령RNA에 청색광을 비추니 세포 골격 구성 및 이동 기능이 제대로 이뤄지지 않음을 관찰했다. 또한 베타액틴 단백질 합성 효율이 최대 90%까지 감소됨을 확인했다.
허원도 교수는 “mRNA-LARIAT 광유전학 기술을 활용하면 암세포, 신경세포 등 다양한 세포 내 전령RNA 이동 및 단백질 합성을 빛으로 조절할 수 있다”라며 “앞으로 암세포 전이, 신경질환 등 전령 RNA 관련 질병 연구에 응용 가능할 것이다”라고 말했다.
2020.02.21
조회수 20990
 ‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19 조회수 4854
‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19 조회수 4854 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4531
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4531 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 5031
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 5031 기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다.
연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다.
iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미세환경 내에서 폐계면활성제와의 상호작용을 유도해 호흡 운동을 활용, mRNA를 높은 효율로 폐 세포 내로 전달할 수 있다.
흡입 전달 및 폐 미세환경을 고려한 모방 환경 및 마우스 폐에서의 단백질 발현을 토대로 한 다차원 선별 과정을 통해 iLPX의 구성 요소들을 최적화시킴으로써 흡입용 mRNA 전달체(Inhalation optimized-iLPX, 이하 IH-iLPX)를 완성했다.
연구팀은 에어로졸화 전후의 입자 크기, 균일도, mRNA 탑재율을 비교함으로써 IH-iLPX의 월등한 에어로졸화 안정성을 증명했다. 나아가, IH-iLPX를 전달한 마우스에서 LNP 전달 마우스보다 26배 높은 단백질 발현이 유도됨을 확인했다.
연구팀은 동물 모델에서 흡입 전달된 IH-iLPX가 폐 특이적으로 단백질을 발현시키며, 폐포 상피세포와 기관지 상피세포에서 mRNA를 효과적으로 전달함을 확인했다. 또한 혈액 생화학 분석과 조직 검사를 토대로 IH-iLPX가 폐와 혈액 환경에서 독성이 없음을 확인했기 때문에 효과적인 폐내 mRNA 발현뿐만 아니라 생체 안전성 측면에서 큰 의의를 갖는다고 밝혔다.
박 교수는 “mRNA를 반드시 내부에 탑재해야 한다는 고정 관념을 깨고 새로운 구성의 입자를 제시함으로써 기존에 불가능했던 흡입형 유전자 치료의 길을 열었다”며 “본 연구실에서 개발한 흡입형 유전자 전달체는 치료 단백질을 암호화하는 mRNA를 탑재해 폐질환에 적용되어 유전자 폐 치료의 적용 범위를 넓힐 것으로 기대된다”이라고 말했다.
바이오및뇌공학과 장민철 박사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)’ 9월 3일 자 18권 35호에 게재됐다. (논문명: Inhalable mRNA Nanoparticle with Enhanced Nebulization Stability and Pulmonary Microenvironment Infilration)
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.10.10 조회수 5659
기존보다 26배 효과적인 폐질환 흡입치료 가능
코로나19의 전 세계적 유행 이후, 폐 등 호흡기 질병에 대비하기 위한 mRNA 백신 및 치료제는 차세대 치료제로 주목받고 있다. 하지만 기존 mRNA 백신용 전달체가 가지고 있는 한계점을 극복하고 우리 대학 연구진이 호흡기 바이러스 및 난치성 폐질환의 mRNA 흡입 치료를 가능케 하며 유전자 폐 치료 연구의 근간이 될 연구에 성공했다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 유전자 폐 치료에 최적화된 나노 전달체를 개발했다고 7일 밝혔다.
연구팀은 기존 mRNA 전달을 위해 활용되던 지질나노입자(이하 lipid nanoparticle, LNP)의 에어로졸화 과정에서의 불안정성과 폐 미세환경에서의 낮은 전달 효율을 해결하기 위해 이온화성 지질나노복합체(ionizable lipocomplex, iLPX)를 개발했다.
iLPX는 이온화성 리포좀의 외부에 mRNA를 결합한 형태로, 에어로졸화 과정에서 입자의 구조를 유지하기 때문에 흡입 전달에 용이하다. 또한, 폐 미세환경 내에서 폐계면활성제와의 상호작용을 유도해 호흡 운동을 활용, mRNA를 높은 효율로 폐 세포 내로 전달할 수 있다.
흡입 전달 및 폐 미세환경을 고려한 모방 환경 및 마우스 폐에서의 단백질 발현을 토대로 한 다차원 선별 과정을 통해 iLPX의 구성 요소들을 최적화시킴으로써 흡입용 mRNA 전달체(Inhalation optimized-iLPX, 이하 IH-iLPX)를 완성했다.
연구팀은 에어로졸화 전후의 입자 크기, 균일도, mRNA 탑재율을 비교함으로써 IH-iLPX의 월등한 에어로졸화 안정성을 증명했다. 나아가, IH-iLPX를 전달한 마우스에서 LNP 전달 마우스보다 26배 높은 단백질 발현이 유도됨을 확인했다.
연구팀은 동물 모델에서 흡입 전달된 IH-iLPX가 폐 특이적으로 단백질을 발현시키며, 폐포 상피세포와 기관지 상피세포에서 mRNA를 효과적으로 전달함을 확인했다. 또한 혈액 생화학 분석과 조직 검사를 토대로 IH-iLPX가 폐와 혈액 환경에서 독성이 없음을 확인했기 때문에 효과적인 폐내 mRNA 발현뿐만 아니라 생체 안전성 측면에서 큰 의의를 갖는다고 밝혔다.
박 교수는 “mRNA를 반드시 내부에 탑재해야 한다는 고정 관념을 깨고 새로운 구성의 입자를 제시함으로써 기존에 불가능했던 흡입형 유전자 치료의 길을 열었다”며 “본 연구실에서 개발한 흡입형 유전자 전달체는 치료 단백질을 암호화하는 mRNA를 탑재해 폐질환에 적용되어 유전자 폐 치료의 적용 범위를 넓힐 것으로 기대된다”이라고 말했다.
바이오및뇌공학과 장민철 박사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)’ 9월 3일 자 18권 35호에 게재됐다. (논문명: Inhalable mRNA Nanoparticle with Enhanced Nebulization Stability and Pulmonary Microenvironment Infilration)
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.10.10 조회수 5659 단백질 ‘생산 설계도’ 보호하는 RNA 조절 기전 찾았다
생명체는 DNA, RNA, 단백질과 같은 바이오분자들의 조절 작용으로 다양한 생물학적 기능을 수행한다. 바이오분자들의 조절로 유전 정보가 전달되고, 잘못 전달된 정보는 유전자 변형이나 감염성 질병의 원인이 된다. 따라서 분자생물학적 조절 연구는 유전자 치료제와 첨단 백신 개발에 중요하다. 특히, 2023년 코로나 mRNA 백신 기술을 개발한 과학자들이 노벨 생리의학상을 수상하면서 RNA 조절 연구에 기반한 첨단신약, 바이오공학 기술이 크게 주목받고 있다.
우리 대학 바이오및뇌공학과 이영석 교수 연구팀이 기초과학연구원(IBS) RNA 연구단 김빛내리 단장(서울대 생명과학부 석좌교수), 미국 국립암연구소 유진 발코프(Eugene Valkov) 박사팀과 공동연구를 통해 자체 개발한 단일핵산 분석법을 적용해 전령 RNA(messenger RNA, 이하 mRNA) 분해의 새로운 조절 기전을 찾았다고 밝혔다.
mRNA는 긴 단일 가닥 RNA 분자로, DNA에 보관된 유전 정보를 단백질에 전달하는 매개체로서 마치 단백질의 ‘생산 설계도’와 같다. 예를 들어, 코로나 mRNA 백신은 약 4,000개의 RNA 분자로 이루어져 있으며, 코로나 스파이크 단백질의 유전 정보와 다양한 RNA 변형을 활용해 스파이크 단백질 생산을 조절하도록 설계되어 있다. 결국 RNA 기능과 조절에 따라 유전자 치료제 및 mRNA 백신의 효능이 결정된다.
연구진은 다양한 RNA 조절 인자 중 특히 mRNA 꼬리에 주목해 왔다. mRNA는 말단에 50-150개의 아데닌 염기로 구성된 긴 꼬리를 갖는데, mRNA를 보호하고 단백질 합성을 촉진하는 역할을 한다. 그동안 이 꼬리는 아데닌으로만 구성된 것으로 알려졌지만, 연구진은 지난 연구에서 비(非) 아데닌 염기가 추가된 ‘혼합 꼬리(Mixed tail)’가 존재한다는 사실을 보고하였고, 이 혼합 꼬리가 mRNA의 분해를 막는 역할을 하여 유전자 활성을 높이는 데 기여함을 밝힌 바 있다.
그러나 RNA 변형의 결과인 mRNA 꼬리는 그 변형의 특이적인 행태로 인해 생화학 실험과 정량적 분석에 어려움이 있었다. 또한, 50-150개 RNA 분자의 연속적인 변형에 대한 단일염기 분석이 필요하여 mRNA 혼합 꼬리 조절 기전 연구에 제한이 있었다.
이를 해결하기 위해 연구진은 미국 국립암연구소 유진 발코프 박사 연구팀과 함께 mRNA 꼬리 조절 연구를 위한 단일핵산 분석법을 개발했다. 이어 이 분석법을 활용하여 세계 최초로 mRNA 꼬리가 분해되는 속도를 단일핵산 단위로 측정하는데 성공, mRNA 꼬리의 새로운 분해 기전을 규명했다.
연구진은 mRNA 분해를 유도하는 탈아데닐 복합체(CCR4-NOT)를 이용한 탈아데닐화 시스템을 개발하고 단일 염기 단위의 분해 반응을 수학적으로 모델링하여 혼합 꼬리 분해 효과를 정량화했다. 그 결과, 탈아데닐 복합체의 진행이 지연되는 위치를 확인할 수 있었으며, 복합체의 구성 요소들이 비 아데닌 염기에 의해 특정 위치에서 막혀 분해 속도가 조절되는 것을 밝혔다. 즉, 비 아데닌 염기가 일종의 ‘과속 방지턱’ 역할을 한다는 것을 입증한 것이다.
김빛내리 단장은 “mRNA 혼합 꼬리 조절에 대한 이해를 확장해 mRNA 안정성 조절과 유전자 발현 메커니즘에 대한 새로운 통찰을 제공했다”라며, “혼합 꼬리에 기반한 다양한 유전자 치료법 연구와 RNA 첨단 신약 개발에 기여할 것”이라고 말했다.
우리 대학 바이오및뇌공학과 이영석 교수는 “이번 연구는 분자생물학, 생화학 및 수학 분야가 만나 이룬 융합 연구의 결실”이라며, “미래 바이오공학 및 첨단바이오 분야 발전을 위한 공동연구의 중요성을 시사한다”라고 연구의 의의를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 구조 분자생물학(Nature Structural & Molecular Biology, IF=16.8)’에 지난 2월 19일 게재됐다.
2024.02.28 조회수 7052
단백질 ‘생산 설계도’ 보호하는 RNA 조절 기전 찾았다
생명체는 DNA, RNA, 단백질과 같은 바이오분자들의 조절 작용으로 다양한 생물학적 기능을 수행한다. 바이오분자들의 조절로 유전 정보가 전달되고, 잘못 전달된 정보는 유전자 변형이나 감염성 질병의 원인이 된다. 따라서 분자생물학적 조절 연구는 유전자 치료제와 첨단 백신 개발에 중요하다. 특히, 2023년 코로나 mRNA 백신 기술을 개발한 과학자들이 노벨 생리의학상을 수상하면서 RNA 조절 연구에 기반한 첨단신약, 바이오공학 기술이 크게 주목받고 있다.
우리 대학 바이오및뇌공학과 이영석 교수 연구팀이 기초과학연구원(IBS) RNA 연구단 김빛내리 단장(서울대 생명과학부 석좌교수), 미국 국립암연구소 유진 발코프(Eugene Valkov) 박사팀과 공동연구를 통해 자체 개발한 단일핵산 분석법을 적용해 전령 RNA(messenger RNA, 이하 mRNA) 분해의 새로운 조절 기전을 찾았다고 밝혔다.
mRNA는 긴 단일 가닥 RNA 분자로, DNA에 보관된 유전 정보를 단백질에 전달하는 매개체로서 마치 단백질의 ‘생산 설계도’와 같다. 예를 들어, 코로나 mRNA 백신은 약 4,000개의 RNA 분자로 이루어져 있으며, 코로나 스파이크 단백질의 유전 정보와 다양한 RNA 변형을 활용해 스파이크 단백질 생산을 조절하도록 설계되어 있다. 결국 RNA 기능과 조절에 따라 유전자 치료제 및 mRNA 백신의 효능이 결정된다.
연구진은 다양한 RNA 조절 인자 중 특히 mRNA 꼬리에 주목해 왔다. mRNA는 말단에 50-150개의 아데닌 염기로 구성된 긴 꼬리를 갖는데, mRNA를 보호하고 단백질 합성을 촉진하는 역할을 한다. 그동안 이 꼬리는 아데닌으로만 구성된 것으로 알려졌지만, 연구진은 지난 연구에서 비(非) 아데닌 염기가 추가된 ‘혼합 꼬리(Mixed tail)’가 존재한다는 사실을 보고하였고, 이 혼합 꼬리가 mRNA의 분해를 막는 역할을 하여 유전자 활성을 높이는 데 기여함을 밝힌 바 있다.
그러나 RNA 변형의 결과인 mRNA 꼬리는 그 변형의 특이적인 행태로 인해 생화학 실험과 정량적 분석에 어려움이 있었다. 또한, 50-150개 RNA 분자의 연속적인 변형에 대한 단일염기 분석이 필요하여 mRNA 혼합 꼬리 조절 기전 연구에 제한이 있었다.
이를 해결하기 위해 연구진은 미국 국립암연구소 유진 발코프 박사 연구팀과 함께 mRNA 꼬리 조절 연구를 위한 단일핵산 분석법을 개발했다. 이어 이 분석법을 활용하여 세계 최초로 mRNA 꼬리가 분해되는 속도를 단일핵산 단위로 측정하는데 성공, mRNA 꼬리의 새로운 분해 기전을 규명했다.
연구진은 mRNA 분해를 유도하는 탈아데닐 복합체(CCR4-NOT)를 이용한 탈아데닐화 시스템을 개발하고 단일 염기 단위의 분해 반응을 수학적으로 모델링하여 혼합 꼬리 분해 효과를 정량화했다. 그 결과, 탈아데닐 복합체의 진행이 지연되는 위치를 확인할 수 있었으며, 복합체의 구성 요소들이 비 아데닌 염기에 의해 특정 위치에서 막혀 분해 속도가 조절되는 것을 밝혔다. 즉, 비 아데닌 염기가 일종의 ‘과속 방지턱’ 역할을 한다는 것을 입증한 것이다.
김빛내리 단장은 “mRNA 혼합 꼬리 조절에 대한 이해를 확장해 mRNA 안정성 조절과 유전자 발현 메커니즘에 대한 새로운 통찰을 제공했다”라며, “혼합 꼬리에 기반한 다양한 유전자 치료법 연구와 RNA 첨단 신약 개발에 기여할 것”이라고 말했다.
우리 대학 바이오및뇌공학과 이영석 교수는 “이번 연구는 분자생물학, 생화학 및 수학 분야가 만나 이룬 융합 연구의 결실”이라며, “미래 바이오공학 및 첨단바이오 분야 발전을 위한 공동연구의 중요성을 시사한다”라고 연구의 의의를 밝혔다.
이번 연구결과는 국제 학술지 ‘네이처 구조 분자생물학(Nature Structural & Molecular Biology, IF=16.8)’에 지난 2월 19일 게재됐다.
2024.02.28 조회수 7052 암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06 조회수 6548
암, 루게릭병 등 난치성 질환 발병 기전 밝혀
단백질 정보를 가진 mRNA 유전자 조절 기전에서 알루 요소(Alu)의 중요성을 제시하고, 나아가 종양 형성, 퇴행성 뇌질환 등 mRNA가 변화하는 다양한 질환에서 역방향 알루 반복구조(IRAlus)라는 새로운 발병 원인을 최초로 제시함으로써 질병 치료에 획기적인 방안을 제시하였다.
우리 대학 생명화학공학과 김유식 교수와 바이오및뇌공학과 이영석 교수 공동 연구팀이 종양 형성과 퇴행성 뇌질환을 유발하는 새로운 유전자 조절 기전을 찾아냈다고 6일 밝혔다.
인간 유전체의 약 10%를 차지하는 반복서열인 알루 요소(Alu element, Alu)는 단백질 정보를 가지는 전령 RNA(messenger RNA, mRNA)의 단백질 생산 효율을 조절할 수 있다. 특히, mRNA가 2개의 알루 요소로 형성된 역방향 알루 반복 구조(Inverted Alu repeats, IRAlus)를 가지게 되면 mRNA의 세포 내 이동이 방해되어 단백질 생산이 감소한다.
연구팀은 질환 특이적으로 mRNA가 변화하는 과정에서 주요 mRNA가 역방향 알루 반복 구조(IRAlus)에 의해 조절받게 하고 이는 mRNA가 가지고 있는 유전자 발현 억제로 이어져 질환을 일으킨다는 새로운 발병 기전을 밝혔다.
알루(Alu)는 유전체의 단백질 정보를 가지고 있지만 유전체 상에서 본인의 서열만을 복제하는 성질이 있어 ‘이기적 서열’로 알려져 있었다. 최근 연구에 의하면 mRNA 내의 존재하는 역방향 알루 반복 구조(IRAlus)는 숙주 mRNA의 세포질로의 이동을 방해하여 해당 유전자의 단백질 번역을 억제한다. 그러나, 해당 유전자 발현 조절 기전의 생물학적 중요성에 대해서는 보고된 바가 없었다.
연구팀은 역방향 알루 반복 구조(IRAlus)를 인지할 수 있는 항체를 활용한 차세대 염기서열 분석법을 사용해 특정 세포 내 활성화된, 기능적인 역방향 알루 반복 구조(IRAlus)를 가지고 있어 역방향 알루 반복 구조(IRAlus)에 의해 단백질 합성이 억제될 수 있는 mRNA 유전자 목록을 완성했다.
종양 형성 과정에서 역방향 알루 반복 구조(IRAlus)의 유전자 조절 기전의 영향을 분석했다. 연구팀은 대표적인 종양억제유전자를 억제하는 종양 유전자 조절을 하고 이는 단백질 발현 증가로 이어지며 결과적으로 종양억제유전자 활성이 억제됨으로써 암 발달을 촉진할 수 있다.
나아가, 특정 mRNA 서열과 상보적으로 결합해 mRNA의 기능을 억제해 다양한 질병 치료 및 조절 도구로 현재 연구되고 있는 혁신 RNA 치료제인 안티센스 올리고뉴클레오타이드(Antisense oligonucleotide, 이하 ASO)를 활용해 단백질 발현을 복구하는 암 치료 전략을 탐색했다.
연구팀은 신경계 세포에서 역방향 알루 반복 구조(IRAlus)로 인한 유전자 조절이 활발하다는 것을 확인했다. 또한, 해당 현상의 과도한 활성과 루게릭병으로 알려진 근위축성 측삭경화증을 비롯한 퇴행성 뇌질환 간의 연관성을 최초로 제시했다.
생명화학공학과 김유식 교수는 “이번 연구는 인간 유전체 내 반복서열인 역방향 알루 반복 구조(IRAlus)를 가지는 유전자를 목록화하는 것을 넘어서 해당 유전자 발현 조절이 인간 질환, 특히 종양 형성 및 퇴행성 뇌질환 발병과정에서 핵심적인 역할을 하는 것을 최초로 확인했다”면서 “이번 연구에서 제시한 역방향 알루 반복 구조(IRAlus)라는 새로운 타겟 물질을 활용하면 종양과 노화를 비롯해 다양한 퇴행성 질환의 발병 기전 분석에 근본적이고 효과적인 치료전략을 마련하는 데 유용할 것”이라고 말했다.
생명화학공학과 구자영 박사(현 보스턴 아동병원 (Boston Children’s Hospital) 및 하버드 의과대학 (Harvard Medical School) 박사후연구원)와 이건용 박사과정 학생이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 셀(Cell) 자매지인 ‘몰레큘러 셀(Molecular Cell)’ 2월 2일 字에 온라인 게재됐다. (논문명 : Alternative Polyadenylation Determines the Functional Landscape of Inverted Alu Repeats).
우리 대학 생명과학과 임정훈 교수 연구팀과 의과학대학원 한진주 교수 연구팀이 참여한 이번 연구는 한국연구재단 기초연구실 지원사업과 KAIST 도약연구사업의 지원을 받아 수행됐다.
2024.02.06 조회수 6548 저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 7371
저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 7371 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 14001
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 14001 빛으로 RNA 이동과 단백질 합성 조절한다
빛으로 세포 내 특정 RNA 이동과 단백질 합성을 조절할 수 있는 기술이 개발됐다. 생명과학과 허원도 교수 연구팀이 빛을 이용해 유전정보를 전달하는 전령RNA와 단백질을 생성하는 리보솜의 결합을 제어해 단백질 합성을 조절하는데 성공했다.
이번 연구성과는 네이처 셀 바이올로지(Nature Cell Biology, IF 17.728)에 2월 18일 오전 1시(한국시간)자 온라인 판에 실렸으며, Nature Reviews Genetics에 하이라이트 논문으로 소개됐다.
DNA의 유전정보는 RNA를 거쳐 단백질로 전달된다. 이때 중간에서 유전정보를 전달하는 RNA를 ‘전령RNA’라고 한다. 단백질 생성공장인 리보솜이 전령RNA의 유전정보를 읽어 단백질을 합성한다. 단백질 합성에 있어 전령RNA는 DNA 유전정보의 중간 전달자, 리보솜은 생성공장, 단백질은 완성품인 셈이다.
이전에는 화학물질을 처리해 전령RNA를 조절하는 방법으로 모든 전령RNA를 한꺼번에 조절하기 때문에 특정 종류의 전령RNA만을 세밀하게 조절하기 어려웠다. 이번 연구에서는 살아있는 세포에 청색광을 비춰줌으로써 세포 내 특정 전령RNA 이동 및 단백질 합성을 시공간 특이적으로 조절하는 mRNA-LARIAT 광유전학 기술을 개발했다.
연구팀은 이전 연구로 개발한 라리아트 올가미(LARIAT, Light-Activated Reversible Inhibition by Assembled Trap) 기술과 RNA 이미징 기술을 융합해 mRNA-LARIAT 기술을 개발했다. mRNA-LARIAT 광유전학 기술을 이용하면 빛의 유무에 따라 라리아트 올가미에 전령RNA를 가두거나 분리하고, 이를 실시간으로 관찰하는 것이 가능하다.
연구팀은 헬라 세포에 청색광을 비춰주면 라리아트 올가미에 전령RNA가 가둬지면서 리보솜과 격리되고 단백질 합성이 감소함을 관찰했다. 이어 청색광을 차단하면 라리아트 올가미로부터 전령RNA가 빠져나오면서 리보솜과 단백질 합성을 다시 시작함을 확인했다. 이는 mRNA-LARIAT 광유전학 기술로 빛의 유무에 따라 매우 빠르고 가역적으로 단백질 합성을 조절할 수 있음을 의미한다.
대부분 단백질은 전령RNA와 리보솜에 의해 합성된 후, 각 단백질이 작용하는 위치로 이동한다. 하지만 전령RNA가 라리아트 올가미에 가둬지면 전령RNA가 향후 단백질이 작용하는 위치까지 이동이 멈추고 단백질 합성이 차단된다. 전령RNA는 단백질보다 비교적 작은 분자로, 세포 내 이동이 더 효율적이고 빠르다. 이처럼 mRNA-LARIAT 광유전학 기술로 전령RNA 이동 및 단백질 합성을 빛으로 조절하면 살아있는 세포에서의 RNA의 위치 및 합성되는 신생 단백질의 기능을 효율적으로 연구할 수 있게 되었다.
연구팀은 베타액틴(β-actin) 단백질 합성에 관여하는 전령RNA에 mRNA-LARIAT 기술을 적용했다. 베타액틴 단백질 합성에 관여하는 전령RNA에 청색광을 비추니 세포 골격 구성 및 이동 기능이 제대로 이뤄지지 않음을 관찰했다. 또한 베타액틴 단백질 합성 효율이 최대 90%까지 감소됨을 확인했다.
허원도 교수는 “mRNA-LARIAT 광유전학 기술을 활용하면 암세포, 신경세포 등 다양한 세포 내 전령RNA 이동 및 단백질 합성을 빛으로 조절할 수 있다”라며 “앞으로 암세포 전이, 신경질환 등 전령 RNA 관련 질병 연구에 응용 가능할 것이다”라고 말했다.
2020.02.21 조회수 20990
빛으로 RNA 이동과 단백질 합성 조절한다
빛으로 세포 내 특정 RNA 이동과 단백질 합성을 조절할 수 있는 기술이 개발됐다. 생명과학과 허원도 교수 연구팀이 빛을 이용해 유전정보를 전달하는 전령RNA와 단백질을 생성하는 리보솜의 결합을 제어해 단백질 합성을 조절하는데 성공했다.
이번 연구성과는 네이처 셀 바이올로지(Nature Cell Biology, IF 17.728)에 2월 18일 오전 1시(한국시간)자 온라인 판에 실렸으며, Nature Reviews Genetics에 하이라이트 논문으로 소개됐다.
DNA의 유전정보는 RNA를 거쳐 단백질로 전달된다. 이때 중간에서 유전정보를 전달하는 RNA를 ‘전령RNA’라고 한다. 단백질 생성공장인 리보솜이 전령RNA의 유전정보를 읽어 단백질을 합성한다. 단백질 합성에 있어 전령RNA는 DNA 유전정보의 중간 전달자, 리보솜은 생성공장, 단백질은 완성품인 셈이다.
이전에는 화학물질을 처리해 전령RNA를 조절하는 방법으로 모든 전령RNA를 한꺼번에 조절하기 때문에 특정 종류의 전령RNA만을 세밀하게 조절하기 어려웠다. 이번 연구에서는 살아있는 세포에 청색광을 비춰줌으로써 세포 내 특정 전령RNA 이동 및 단백질 합성을 시공간 특이적으로 조절하는 mRNA-LARIAT 광유전학 기술을 개발했다.
연구팀은 이전 연구로 개발한 라리아트 올가미(LARIAT, Light-Activated Reversible Inhibition by Assembled Trap) 기술과 RNA 이미징 기술을 융합해 mRNA-LARIAT 기술을 개발했다. mRNA-LARIAT 광유전학 기술을 이용하면 빛의 유무에 따라 라리아트 올가미에 전령RNA를 가두거나 분리하고, 이를 실시간으로 관찰하는 것이 가능하다.
연구팀은 헬라 세포에 청색광을 비춰주면 라리아트 올가미에 전령RNA가 가둬지면서 리보솜과 격리되고 단백질 합성이 감소함을 관찰했다. 이어 청색광을 차단하면 라리아트 올가미로부터 전령RNA가 빠져나오면서 리보솜과 단백질 합성을 다시 시작함을 확인했다. 이는 mRNA-LARIAT 광유전학 기술로 빛의 유무에 따라 매우 빠르고 가역적으로 단백질 합성을 조절할 수 있음을 의미한다.
대부분 단백질은 전령RNA와 리보솜에 의해 합성된 후, 각 단백질이 작용하는 위치로 이동한다. 하지만 전령RNA가 라리아트 올가미에 가둬지면 전령RNA가 향후 단백질이 작용하는 위치까지 이동이 멈추고 단백질 합성이 차단된다. 전령RNA는 단백질보다 비교적 작은 분자로, 세포 내 이동이 더 효율적이고 빠르다. 이처럼 mRNA-LARIAT 광유전학 기술로 전령RNA 이동 및 단백질 합성을 빛으로 조절하면 살아있는 세포에서의 RNA의 위치 및 합성되는 신생 단백질의 기능을 효율적으로 연구할 수 있게 되었다.
연구팀은 베타액틴(β-actin) 단백질 합성에 관여하는 전령RNA에 mRNA-LARIAT 기술을 적용했다. 베타액틴 단백질 합성에 관여하는 전령RNA에 청색광을 비추니 세포 골격 구성 및 이동 기능이 제대로 이뤄지지 않음을 관찰했다. 또한 베타액틴 단백질 합성 효율이 최대 90%까지 감소됨을 확인했다.
허원도 교수는 “mRNA-LARIAT 광유전학 기술을 활용하면 암세포, 신경세포 등 다양한 세포 내 전령RNA 이동 및 단백질 합성을 빛으로 조절할 수 있다”라며 “앞으로 암세포 전이, 신경질환 등 전령 RNA 관련 질병 연구에 응용 가능할 것이다”라고 말했다.
2020.02.21 조회수 20990