%EA%B0%95%EC%84%9D%EC%A1%B0
-
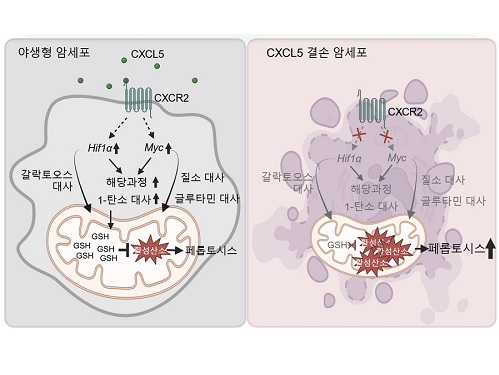 암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07 조회수 3620
암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07 조회수 3620 -
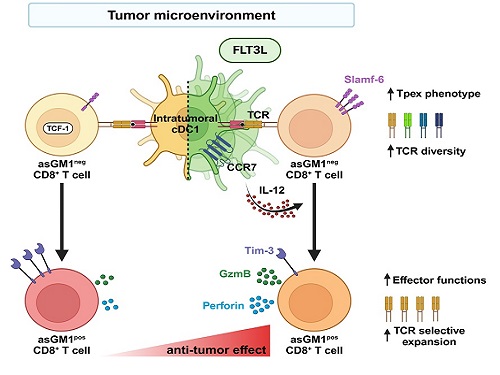 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3979
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3979 -
 DNA 인식 선천면역인자의 방호패치 발견
우리 대학 생명과학과 강석조 교수 연구팀이 선천면역반응을 매개하는 중요 단백질인 STING의 활성을 조절하는 새로운 기전으로, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제인 MARCH5가 STING을 유비퀴틴시켜서 활성산소에 의해 STING이 비활성형 다량체로 응집되는 것을 억제함을 규명했다고 4일 밝혔다.
STING(Stimulator of interferon genes)은 선천면역 신호경로의 필수적인 어댑터 단백질로서 외부로부터 들어온 세균 및 바이러스로부터 유래한 세포질 내 DNA를 감지하는 cGAS(cyclic GMP-AMP synthase)가 생성한 cGAMP(2'3'-cyclic GMP-AMP)에 결합하여 활성화되면 TBK1(TANK-binding kinase 1)과 IRF3(Interferon regulatory factor 3)를 활성화하여 제1형 인터페론을 유도한다. 이를 통해서 염증반응과 다양한 면역세포를 활성화하여 병원균으로부터 우리 몸을 방어하는 면역반응을 일으킨다. STING은 또한 자가 염증성 질환, 암, 노화 및 퇴행성 뇌질환을 포함한 다양한 염증질환의 주요 매개체로 작용한다.
STING의 활성은 다양한 방법으로 조절되는 데, 세포내 이동, 번역 후 변형(post-translational modification, PTM), 고차원 구조체인 다량체 (polymer)의 형성 등이 알려져 있다. STING은 세포내 소기관인 소포체(endoplasmic reticulum)에 위치하고 활성 후 골지체로 이동하여 하위 신호전달을 매개한다. 인산화(phosphorylation), 유비퀴틴화(ubiquitination), 팔미토일화(palmitoylation), 산화(oxidation) 등의 다양한 번역 후 변형을 받으며, 활성화된 STING은 이량체(dimer)를 거쳐 활성형 다량체를 형성하여 신호전달을 매개한다. 하지만, 이들 조절 기전의 다이나믹스와 상호작용에 대해서는 알려진 바가 적다. 특히, 염증과 같은 조건에서 다량 생성되는 활성산소에 의해 STING이 비활성형 다량체를 형성하는 데 이를 억제하는 번역 후 변형 및 그 조절 기전에 대해서는 전혀 알려지지 않았다.
강 교수 연구팀은 이전 연구에서 STING이 위치한 소포체와 인접한 미토콘드리아의 다이나믹스를 조절하는 인자가 STING 활성에 영향을 미친다는 것을 밝혔다. 이에 대한 후속연구를 수행하던 중, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제로 알려진 MARCH5(Membrane associated RING-CH-type finger 5)가 결손된 마우스 배아 섬유아세포에서 STING 매개 제1형 인터페론 형성이 감소하며 STING 활성경로의 하위단계인 TBK1, IRF3의 활성 또한 저해되어있음을 통해 MARCH5가 STING의 활성에 양성 조절자로서 역할을 한다는 사실을 밝혔다. 나아가 강 교수팀은 MARCH5가 결손된 세포주에서 활성산소(reactive oxygen species, ROS)가 정상 세포주에 비해 높다는 것과 높은 활성산소는 STING이 정상 세포주에 보이는 STING의 활성형 다량체가 아닌 비활성형 다량체로의 형성을 촉진한다는 사실을 확인하였다.
기전적으로 MARCH5 단백질이 STING과 결합하며 STING의 Lysine 19 잔기를 선택적으로 타겟하여 Lysine-63형으로 유비퀴틴화하는 것을 확인하였다. STING은 높은 활성산소 조건에서 Cysteine 205 잔기에 산화가 일어나는데, MARCH5에 의한 STING 유비퀴틴화는 과도한 활성산소 조건에서 산화된 STING이 비활성 STING 다량체를 형성하는 것을 억제하여 정상적인 STING활성을 갖도록 돕는다는 사실을 규명하였다.
강석조 교수는 “본 연구는 미토콘드리아 막 단백질이 산화된 STING의 다량체 형성을 조절하는 원리를 최초로 제공한 연구이면서 STING이라는 단백질을 통하여, 다양한 번역 후 변형간의 상호 작용과 고차원 구조적 변화, 그리고 이에 기여하는 세포내 소기관의 교류를 동시에 밝혀 보다 넓은 학문분야에 활용되는 지식을 제공했다는 데 의의가 크다”고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 STING이 매개하는 다양한 염증성 질환에 대한 보다 깊은 이해와 치료제 개발 연구에 가치 있게 활용될 것으로 기대한다”고 전했다.
이번 연구는 유럽 분자생물학의 권위있는 국제 학술지 `엠보 리포트 저널 (EMBO (European Molecular Biology Organization) Reports)’에 11월 2일 字 온라인판에 게재됐다 (논문명: MARCH5 promotes STING pathway activation by suppressing polymer formation of oxidized STING). KAIST 생명과학과 손경표 박사과정, 정석환 박사과정, 엄은총 박사과정이 공동 제1 저자로 연구를 주도하였고, 권도형 박사(現 부스트이뮨)가 함께 참여하였다.
이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.04 조회수 6457
DNA 인식 선천면역인자의 방호패치 발견
우리 대학 생명과학과 강석조 교수 연구팀이 선천면역반응을 매개하는 중요 단백질인 STING의 활성을 조절하는 새로운 기전으로, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제인 MARCH5가 STING을 유비퀴틴시켜서 활성산소에 의해 STING이 비활성형 다량체로 응집되는 것을 억제함을 규명했다고 4일 밝혔다.
STING(Stimulator of interferon genes)은 선천면역 신호경로의 필수적인 어댑터 단백질로서 외부로부터 들어온 세균 및 바이러스로부터 유래한 세포질 내 DNA를 감지하는 cGAS(cyclic GMP-AMP synthase)가 생성한 cGAMP(2'3'-cyclic GMP-AMP)에 결합하여 활성화되면 TBK1(TANK-binding kinase 1)과 IRF3(Interferon regulatory factor 3)를 활성화하여 제1형 인터페론을 유도한다. 이를 통해서 염증반응과 다양한 면역세포를 활성화하여 병원균으로부터 우리 몸을 방어하는 면역반응을 일으킨다. STING은 또한 자가 염증성 질환, 암, 노화 및 퇴행성 뇌질환을 포함한 다양한 염증질환의 주요 매개체로 작용한다.
STING의 활성은 다양한 방법으로 조절되는 데, 세포내 이동, 번역 후 변형(post-translational modification, PTM), 고차원 구조체인 다량체 (polymer)의 형성 등이 알려져 있다. STING은 세포내 소기관인 소포체(endoplasmic reticulum)에 위치하고 활성 후 골지체로 이동하여 하위 신호전달을 매개한다. 인산화(phosphorylation), 유비퀴틴화(ubiquitination), 팔미토일화(palmitoylation), 산화(oxidation) 등의 다양한 번역 후 변형을 받으며, 활성화된 STING은 이량체(dimer)를 거쳐 활성형 다량체를 형성하여 신호전달을 매개한다. 하지만, 이들 조절 기전의 다이나믹스와 상호작용에 대해서는 알려진 바가 적다. 특히, 염증과 같은 조건에서 다량 생성되는 활성산소에 의해 STING이 비활성형 다량체를 형성하는 데 이를 억제하는 번역 후 변형 및 그 조절 기전에 대해서는 전혀 알려지지 않았다.
강 교수 연구팀은 이전 연구에서 STING이 위치한 소포체와 인접한 미토콘드리아의 다이나믹스를 조절하는 인자가 STING 활성에 영향을 미친다는 것을 밝혔다. 이에 대한 후속연구를 수행하던 중, 미토콘드리아 막 단백질이자 E3 유비퀴틴 리가아제로 알려진 MARCH5(Membrane associated RING-CH-type finger 5)가 결손된 마우스 배아 섬유아세포에서 STING 매개 제1형 인터페론 형성이 감소하며 STING 활성경로의 하위단계인 TBK1, IRF3의 활성 또한 저해되어있음을 통해 MARCH5가 STING의 활성에 양성 조절자로서 역할을 한다는 사실을 밝혔다. 나아가 강 교수팀은 MARCH5가 결손된 세포주에서 활성산소(reactive oxygen species, ROS)가 정상 세포주에 비해 높다는 것과 높은 활성산소는 STING이 정상 세포주에 보이는 STING의 활성형 다량체가 아닌 비활성형 다량체로의 형성을 촉진한다는 사실을 확인하였다.
기전적으로 MARCH5 단백질이 STING과 결합하며 STING의 Lysine 19 잔기를 선택적으로 타겟하여 Lysine-63형으로 유비퀴틴화하는 것을 확인하였다. STING은 높은 활성산소 조건에서 Cysteine 205 잔기에 산화가 일어나는데, MARCH5에 의한 STING 유비퀴틴화는 과도한 활성산소 조건에서 산화된 STING이 비활성 STING 다량체를 형성하는 것을 억제하여 정상적인 STING활성을 갖도록 돕는다는 사실을 규명하였다.
강석조 교수는 “본 연구는 미토콘드리아 막 단백질이 산화된 STING의 다량체 형성을 조절하는 원리를 최초로 제공한 연구이면서 STING이라는 단백질을 통하여, 다양한 번역 후 변형간의 상호 작용과 고차원 구조적 변화, 그리고 이에 기여하는 세포내 소기관의 교류를 동시에 밝혀 보다 넓은 학문분야에 활용되는 지식을 제공했다는 데 의의가 크다”고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 STING이 매개하는 다양한 염증성 질환에 대한 보다 깊은 이해와 치료제 개발 연구에 가치 있게 활용될 것으로 기대한다”고 전했다.
이번 연구는 유럽 분자생물학의 권위있는 국제 학술지 `엠보 리포트 저널 (EMBO (European Molecular Biology Organization) Reports)’에 11월 2일 字 온라인판에 게재됐다 (논문명: MARCH5 promotes STING pathway activation by suppressing polymer formation of oxidized STING). KAIST 생명과학과 손경표 박사과정, 정석환 박사과정, 엄은총 박사과정이 공동 제1 저자로 연구를 주도하였고, 권도형 박사(現 부스트이뮨)가 함께 참여하였다.
이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2023.12.04 조회수 6457 -
 이행 호염구, 알레르기 매개 세포에 대한 새로운 이해
우리 대학 생명과학과 강석조 교수 연구팀이 알레르기를 매개하는 중요한 면역세포인 호염구의 새로운 전구세포를 발견하고, 호염구 말단 분화단계에서 그 고유 기능을 획득하는 데 중요한 전사인자를 규명했다고 7일 밝혔다.
호염구(basophil)는 체내에 극소수로 존재하는 백혈구지만, 알레르기와 같이 제2형 면역 반응으로 매개되는 질환의 주된 작용 세포다. 호염구의 혈액 내 증감을 통해서 알레르기 반응 정도를 판별할 수 있고, 질환의 면역 반응의 중증도에도 영향을 미친다. 호염구는 인체 내로 유입된 알레르기 유발 물질에 특이적인 Immunoglobulin E (IgE)에 대한 수용체를 통해 활성화되면 탈과립(degranulation)과 면역조절 물질인 사이토카인(cytokine)을 비롯해 다양한 염증 유도 물질들을 분비한다. 이를 통하여 호염구는 알레르기 반응을 매개하고 다른 면역세포들의 침윤을 도와 염증 반응을 심화시킨다. 하지만, 이러한 호염구의 초기 분화 과정 연구에 비해 그 고유 기능을 획득하는 말단 분화 과정과 이를 조절하는 인자에 대해서는 알려진 바가 없었다.
강 교수 연구팀은 마우스 골수 내에서 호염구 전구세포(basophil progenitor, BaP)가 세포분열이 없는 최종 분화단계의 성숙한 호염구(mature basophil)로 분화하는 과정 중간에 위치한, 세포분열 능력을 보유한 새로운 전구세포를 발견하였으며 그 특성을 다양한 실험으로 규명하고 ‘이행 호염구(transitional basophil, tBaso)’로 명명하였다. 이행 호염구의 발견을 통하여 강 교수팀은 호염구의 분화과정에서 변화하는 유전자 발현을 더욱 세밀하게 분석할 수 있었으며 세포분열 및 주기 조절과 호염구의 고유한 기능의 조절에 관계하는 유전자의 발현은 분화단계에 따라 다르게 조절됨을 확인하였다.
이어, 호염구의 분화단계에 따라 발현이 변화하는 전사인자 NFIL3를 확인하였고, NFIL3 단백질이 호염구의 말단 분화단계에서 IgE 수용체 활성화에 따라 유도된 호염구의 기능적 특징을 부여하는 중요 인자임을 규명하여 보고하였다. 또한, 호염구 특이적으로 NFIL3가 결손된 마우스를 이용하여, 호염구 내 NFIL3 단백질이 아토피성 피부 질환의 염증 반응을 조절함을 밝혔다.
연구팀은 이행 호염구가 성숙 호염구에 비해 사이토카인 생성 능력이 뛰어남을 추가로 확인하였으며, 사이토카인 자극의 종류에 따라 다른 종류의 제2형 면역반응 사이토카인을 생성함을 밝혔다. 이러한 차별적 사이토카인 생성 능력은 호염구에서는 최초로 발견된 것으로, 추후 호염구 매개 질환에서 그 작용기전을 설명하는 데 중요한 지식을 제공할 것으로 기대한다.
강석조 교수는 “호염구의 말단 분화과정의 중요 전구세포를 발견하고 호염구의 기능적 전문성을 획득하는 다이나믹한 과정을 밝힌 연구”라고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 호염구가 매개하는 알레르기 질환에 대한 이해와 치료제 개발에 활용될 것으로 기대한다”고 전했다.
이번 연구는 면역학 및 알레르기 분야의 세계 최고 국제 학술지 ‘알레르기 및 임상면역학 저널 (The Journal of Allergy and Clinical Immunology)’에 10월 1일 字 온라인판에 게재됐다 (논문명: The transcription factor NFIL3/E4BP4 regulates the developmental stage-specific acquisition of basophil function). KAIST 생명과학과 강석조 교수 연구팀 박지연 박사, 조유리 박사(現 LG화학)가 공동 제1 저자로 연구를 주도하였고, 바이오및뇌공학과 양동찬 박사, 생명과학과 양한슬, 이대엽 교수팀, RIKEN Masato Kubo 교수 연구팀이 함께 참여하였다.
한편 이번 연구는 한국연구재단의 선도연구센터사업의 지원을 받아 수행됐다.
2023.11.07 조회수 5789
이행 호염구, 알레르기 매개 세포에 대한 새로운 이해
우리 대학 생명과학과 강석조 교수 연구팀이 알레르기를 매개하는 중요한 면역세포인 호염구의 새로운 전구세포를 발견하고, 호염구 말단 분화단계에서 그 고유 기능을 획득하는 데 중요한 전사인자를 규명했다고 7일 밝혔다.
호염구(basophil)는 체내에 극소수로 존재하는 백혈구지만, 알레르기와 같이 제2형 면역 반응으로 매개되는 질환의 주된 작용 세포다. 호염구의 혈액 내 증감을 통해서 알레르기 반응 정도를 판별할 수 있고, 질환의 면역 반응의 중증도에도 영향을 미친다. 호염구는 인체 내로 유입된 알레르기 유발 물질에 특이적인 Immunoglobulin E (IgE)에 대한 수용체를 통해 활성화되면 탈과립(degranulation)과 면역조절 물질인 사이토카인(cytokine)을 비롯해 다양한 염증 유도 물질들을 분비한다. 이를 통하여 호염구는 알레르기 반응을 매개하고 다른 면역세포들의 침윤을 도와 염증 반응을 심화시킨다. 하지만, 이러한 호염구의 초기 분화 과정 연구에 비해 그 고유 기능을 획득하는 말단 분화 과정과 이를 조절하는 인자에 대해서는 알려진 바가 없었다.
강 교수 연구팀은 마우스 골수 내에서 호염구 전구세포(basophil progenitor, BaP)가 세포분열이 없는 최종 분화단계의 성숙한 호염구(mature basophil)로 분화하는 과정 중간에 위치한, 세포분열 능력을 보유한 새로운 전구세포를 발견하였으며 그 특성을 다양한 실험으로 규명하고 ‘이행 호염구(transitional basophil, tBaso)’로 명명하였다. 이행 호염구의 발견을 통하여 강 교수팀은 호염구의 분화과정에서 변화하는 유전자 발현을 더욱 세밀하게 분석할 수 있었으며 세포분열 및 주기 조절과 호염구의 고유한 기능의 조절에 관계하는 유전자의 발현은 분화단계에 따라 다르게 조절됨을 확인하였다.
이어, 호염구의 분화단계에 따라 발현이 변화하는 전사인자 NFIL3를 확인하였고, NFIL3 단백질이 호염구의 말단 분화단계에서 IgE 수용체 활성화에 따라 유도된 호염구의 기능적 특징을 부여하는 중요 인자임을 규명하여 보고하였다. 또한, 호염구 특이적으로 NFIL3가 결손된 마우스를 이용하여, 호염구 내 NFIL3 단백질이 아토피성 피부 질환의 염증 반응을 조절함을 밝혔다.
연구팀은 이행 호염구가 성숙 호염구에 비해 사이토카인 생성 능력이 뛰어남을 추가로 확인하였으며, 사이토카인 자극의 종류에 따라 다른 종류의 제2형 면역반응 사이토카인을 생성함을 밝혔다. 이러한 차별적 사이토카인 생성 능력은 호염구에서는 최초로 발견된 것으로, 추후 호염구 매개 질환에서 그 작용기전을 설명하는 데 중요한 지식을 제공할 것으로 기대한다.
강석조 교수는 “호염구의 말단 분화과정의 중요 전구세포를 발견하고 호염구의 기능적 전문성을 획득하는 다이나믹한 과정을 밝힌 연구”라고 언급하면서, “본 연구를 통해 얻은 새로운 지식은 호염구가 매개하는 알레르기 질환에 대한 이해와 치료제 개발에 활용될 것으로 기대한다”고 전했다.
이번 연구는 면역학 및 알레르기 분야의 세계 최고 국제 학술지 ‘알레르기 및 임상면역학 저널 (The Journal of Allergy and Clinical Immunology)’에 10월 1일 字 온라인판에 게재됐다 (논문명: The transcription factor NFIL3/E4BP4 regulates the developmental stage-specific acquisition of basophil function). KAIST 생명과학과 강석조 교수 연구팀 박지연 박사, 조유리 박사(現 LG화학)가 공동 제1 저자로 연구를 주도하였고, 바이오및뇌공학과 양동찬 박사, 생명과학과 양한슬, 이대엽 교수팀, RIKEN Masato Kubo 교수 연구팀이 함께 참여하였다.
한편 이번 연구는 한국연구재단의 선도연구센터사업의 지원을 받아 수행됐다.
2023.11.07 조회수 5789