%EA%B9%80%ED%98%B8%EB%AF%BC
-
 선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10 조회수 3837
선천성면역을 조절하는 인공단백질 디자인, 차세대 백신·면역 치료제 개발 가능성 제시
우리 대학 생명과학과 김호민 교수 연구팀과 국제 공동연구팀인 미국 워싱턴대학교 단백질디자인 연구소 (Institute for Protein Design, IPD) 닐 킹 교수 (Prof. Neil King) 연구팀은 컴퓨터기반 단백질디자인 기술을 활용하여 선천성면역을 활성화시키는 새로운 인공단백질을 디자인하고, 그들의 3차원 분자구조를 규명하는데 성공했다고 10일 밝혔다.
김호민 교수 연구팀과 Neil King 교수 연구팀은 컴퓨터 기반 단백질디자인 기술을 활용하여 선천성면역 수용체인 TLR3와 높은 친화도를 갖는 인공단백질을 개발했다. 또한, 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 TLR3와 결합하는 분자결합모드를 규명하였다. 특히, 자연계의 TLR3 작용제(dsRNA)와는 전혀 다른 구조를 가진 디자인된 인공단백질에 의해 선천성면역 수용체 TLR3을 효과적으로 활성화시킬 수 있음을 보인 첫 사례이다.
생명과학과 김호민 교수가 교신저자로 참여한 이번 연구는 국제 학술지 `네이쳐 커뮤니케이션 (Nature Communications)'에 1월 31일 출판됐다. (논문명 : De novo design of protein minibinder agonists of TLR3)
TLR3 (Toll-like Receptor 3)는 이중가닥 RNA (double-stranded RNA, dsRNA)를 인식하여 선천성 면역반응을 활성화하는 패턴 인식 수용체 (pattern recognition receptor)이다. 기존의 TLR3 작용제는 백신면역 증강제 (adjuvant) 및 항암면역치료제로 활용될 가능성이 있었으나, 화학적 불안정성, 면역 과활성화 위험, 균질한 대량제조의 어려움 등으로 인해 임상적 적용이 제한적이었다.
이에 연구팀은 컴퓨터 기반 단백질디자인 (computational protein design) 기술을 활용하여 TLR3과 결합하는 초소형 인공단백질 (minibinder)을 디자인하였다. 해당 인공단백질은 크기가 작고, 높은 안정성을 가지며, 지정한 TLR3의 특정 부위에만 특이적으로 결합할 수 있도록 디자인하였다. 이후 초저온 투과전자현미경 (Cryo-EM) 분석을 통해 설계된 인공단백질이 초기디자인 의도와 잘 부합되게 TLR3의 오목한 표면 (concave surface)에 결합하고 있음을 확인하였고, 이들의 분자상호작용을 규명하였다.
기존 dsRNA기반 작용제보다 더 정밀하게 TLR3 신호를 활성화할 수 있도록 Cryo-EM 구조를 통해 규명된 분자구조를 바탕으로 인공단백질을 이어 붙인 다중 결합(multivalent) 형태의 단백질을 추가적으로 개발하였고, TLR3 하위 신호인 NF-κB 신호를 활성화시킴을 확인하였다. 이를 통해 자연계에 존재하지 않은 디자인된 인공단백질에 의하여 선천성 면역반응을 효과적으로 조절할 수 있음을 확인하였다.
이번 연구는 KAIST 연구진과 미국 워싱턴대학교 단백질디자인 연구소 연구진 간의 긴밀한 국제공동연구를 통해 이루어졌으며, 향후 면역 조절 인공단백질에 기반한 다양한 백신면역 증강제, 항암면역치료제 등의 개발에 활용될 수 있을 것으로 기대한다.
교신저자인 김호민 교수는 “인공지능기반 단백질디자인 연구는 2024년 노벨화학상 (데이비드 베이커교수, 단백질디자인 연구소)을 수상하며 큰 주목을 받고 있으며, 인공지능 기술의 발전에 힘입어 빠르게 성장하고 있는 첨단바이오 연구분야이다. 향후 백신, 신약, 진단키트, 산업용효소 등 다양한 바이오신소재 개발에 크게 기여할 수 있을 것이다. 이번 연구는 긴밀한 국제 공동연구를 통해 우수한 성과를 거둔 성공적 사례”라고 말했다.
한편 이번 연구는 IBS 바이오분자 및 세포구조연구단의 지원을 받아 수행되었다.
2025.02.10 조회수 3837 -
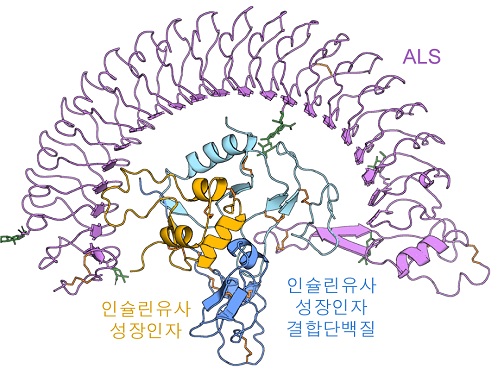 성장 조절하는 인슐린 유사성장 인자의 비밀을 밝히다
인슐린유사성장인자(Insulin-like Growth Factor, IGF)는 인슐린과 유사한 분자구조를 가진 호르몬으로, 신체의 유지와 신진대사에 관여하며, 특히 태아 및 소아·청소년기 성장에 중요한 역할을 한다. 인슐린유사성장인자의 결핍은 느린 성장, 작은 체구, 지연된 발육과 같은 성장기 발달 장애, 그리고 성인에게는 골밀도와 근육강도 저하 등의 증상으로 나타난다. 인슐린유사성장인자의 과잉은 거인증 혹은 말단 비대증을 유발하고 다양한 성인병 위험도를 증가시킨다. 인슐린유사성장인자는 신체의 발달을 촉진시키는 작용 외에도 인슐린과 협동하여 혈당을 조절하는 작용도 하며, 종양의 발생에도 관여함이 알려져 있어, 인슐린유사성장인자의 작동 원리를 밝히기 위한 다양한 연구가 국내외에서 활발하게 진행 중이다.
우리 대학 의과학대학원 김호민 교수(기초과학연구원 (IBS), 바이오분자 및 세포구조연구단, Chief Investigator)는 인슐린유사성장인자 복합체의 3차원 분자구조를 규명하고, 인슐린유사성장인자 복합체의 조립과정 및 인슐린유사성장인자 활성화 메커니즘을 제시했다. 본 연구 결과는 성장과 대사에 관련된 다양한 질병에 대한 이해를 높이고 진단·치료제 개발에도 기여할 것으로 기대된다.
인슐린유사성장인자는 다양한 조직 세포막에 분포하는 인슐린유사성장인자 수용체를 활성화시켜 세포분열, 세포 증식·분화와 생존을 조절한다. 하지만 인슐린유사성장인자는 단독으로는 매우 불안정하여 체내반감기가 10분이 채 되지 않는다. 이 때문에 혈중 인슐린유사성장인자의 70% 이상은 체내에서 12시간 이상 머무를 수 있도록 인슐린유사성장인자 결합단백질들인 IGFBP 단백질(IGF Binding Protein), ALS 단백질(Acid labile subunit)과 결합하여 안정한 삼중복합체 형태로 존재한다.
IGFBP 단백질과 ALS 단백질은 인슐린유사성장인자와 결합하는 운반체 역할 뿐만 아니라 인슐린유사성장인자의 생물학적 작용을 조절하는 중요한 기능도 수행한다. 즉, 인슐린유사성장인자 삼중복합체(IGF1/IGFBP3/ALS)는 생체 내에서 아주 정교하게 조립되고, 필요시에만 활성화되어 적절하게 성장조절 효과를 나타낼 수 있게 된다. 이 때문에 인슐린유사성장인자와 이들 결합단백질의 혈중 농도는 성장호르몬결핍증, ALS 결핍증과 같은 성장관련 질환을 평가하는데 검사항목으로도 이용되고 있다.
연구진은 인슐린유사성장인자 삼중복합체의 3차원 분자구조를 초저온투과전자현미경(cryo-EM)을 활용하여 규명하고, 각 구성요소 간의 상호작용을 밝혀냈다. 특히, 인슐린유사성장인자가 IGFBP 단백질에 둘러쌓여 이중복합체를 이루고 있으며, 말발굽 모양의 ALS 단백질이 이중복합체를 한번 더 감싸는 안정된 구조로 인해 인슐린유사성장인자가 체내에서 쉽게 분해되지 않는 것을 발견했다.
또한, 다양한 생화학적 실험 방법을 통해 인슐린유사성장인자 삼중복합체의 순차적 조립과정과 삼중복합체로부터 인슐린유사성장인자가 분리되어 인슐린유사성장인자 수용체를 활성화시키는 분자 메커니즘을 규명했다. 인슐린유사성장인자 삼중복합체에 포함된 IGFBP 단백질이 생체 내 단백질분해효소에 의해 잘리면, IGFBP 단백질의 C-말단이 떨어져나가면서 불안정한 중간 삼중복합체가 형성된다. 이 과정이 인슐린유사성장인자가 활성을 나타내게 하는 핵심 과정임을 새롭게 발견했다.
김호민 교수는 “첨단 초저온투과전자현미경을 활용하여 고해상도 분자구조를 규명한 연구성과”라며, “인슐린유사성장인자 삼중복합체의 분자구조와 활성화 메커니즘은 향후 청소년기 성장 관련 연구 또는 인슐린유사성장인자 관련 질환의 진단 및 치료제 개발에 크게 기여할 것으로 기대한다.”라고 말했다.
이번 연구는 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 17.69)’ 온라인 판 7월 30일 자에 게재되었다.
2022.08.04 조회수 16994
성장 조절하는 인슐린 유사성장 인자의 비밀을 밝히다
인슐린유사성장인자(Insulin-like Growth Factor, IGF)는 인슐린과 유사한 분자구조를 가진 호르몬으로, 신체의 유지와 신진대사에 관여하며, 특히 태아 및 소아·청소년기 성장에 중요한 역할을 한다. 인슐린유사성장인자의 결핍은 느린 성장, 작은 체구, 지연된 발육과 같은 성장기 발달 장애, 그리고 성인에게는 골밀도와 근육강도 저하 등의 증상으로 나타난다. 인슐린유사성장인자의 과잉은 거인증 혹은 말단 비대증을 유발하고 다양한 성인병 위험도를 증가시킨다. 인슐린유사성장인자는 신체의 발달을 촉진시키는 작용 외에도 인슐린과 협동하여 혈당을 조절하는 작용도 하며, 종양의 발생에도 관여함이 알려져 있어, 인슐린유사성장인자의 작동 원리를 밝히기 위한 다양한 연구가 국내외에서 활발하게 진행 중이다.
우리 대학 의과학대학원 김호민 교수(기초과학연구원 (IBS), 바이오분자 및 세포구조연구단, Chief Investigator)는 인슐린유사성장인자 복합체의 3차원 분자구조를 규명하고, 인슐린유사성장인자 복합체의 조립과정 및 인슐린유사성장인자 활성화 메커니즘을 제시했다. 본 연구 결과는 성장과 대사에 관련된 다양한 질병에 대한 이해를 높이고 진단·치료제 개발에도 기여할 것으로 기대된다.
인슐린유사성장인자는 다양한 조직 세포막에 분포하는 인슐린유사성장인자 수용체를 활성화시켜 세포분열, 세포 증식·분화와 생존을 조절한다. 하지만 인슐린유사성장인자는 단독으로는 매우 불안정하여 체내반감기가 10분이 채 되지 않는다. 이 때문에 혈중 인슐린유사성장인자의 70% 이상은 체내에서 12시간 이상 머무를 수 있도록 인슐린유사성장인자 결합단백질들인 IGFBP 단백질(IGF Binding Protein), ALS 단백질(Acid labile subunit)과 결합하여 안정한 삼중복합체 형태로 존재한다.
IGFBP 단백질과 ALS 단백질은 인슐린유사성장인자와 결합하는 운반체 역할 뿐만 아니라 인슐린유사성장인자의 생물학적 작용을 조절하는 중요한 기능도 수행한다. 즉, 인슐린유사성장인자 삼중복합체(IGF1/IGFBP3/ALS)는 생체 내에서 아주 정교하게 조립되고, 필요시에만 활성화되어 적절하게 성장조절 효과를 나타낼 수 있게 된다. 이 때문에 인슐린유사성장인자와 이들 결합단백질의 혈중 농도는 성장호르몬결핍증, ALS 결핍증과 같은 성장관련 질환을 평가하는데 검사항목으로도 이용되고 있다.
연구진은 인슐린유사성장인자 삼중복합체의 3차원 분자구조를 초저온투과전자현미경(cryo-EM)을 활용하여 규명하고, 각 구성요소 간의 상호작용을 밝혀냈다. 특히, 인슐린유사성장인자가 IGFBP 단백질에 둘러쌓여 이중복합체를 이루고 있으며, 말발굽 모양의 ALS 단백질이 이중복합체를 한번 더 감싸는 안정된 구조로 인해 인슐린유사성장인자가 체내에서 쉽게 분해되지 않는 것을 발견했다.
또한, 다양한 생화학적 실험 방법을 통해 인슐린유사성장인자 삼중복합체의 순차적 조립과정과 삼중복합체로부터 인슐린유사성장인자가 분리되어 인슐린유사성장인자 수용체를 활성화시키는 분자 메커니즘을 규명했다. 인슐린유사성장인자 삼중복합체에 포함된 IGFBP 단백질이 생체 내 단백질분해효소에 의해 잘리면, IGFBP 단백질의 C-말단이 떨어져나가면서 불안정한 중간 삼중복합체가 형성된다. 이 과정이 인슐린유사성장인자가 활성을 나타내게 하는 핵심 과정임을 새롭게 발견했다.
김호민 교수는 “첨단 초저온투과전자현미경을 활용하여 고해상도 분자구조를 규명한 연구성과”라며, “인슐린유사성장인자 삼중복합체의 분자구조와 활성화 메커니즘은 향후 청소년기 성장 관련 연구 또는 인슐린유사성장인자 관련 질환의 진단 및 치료제 개발에 크게 기여할 것으로 기대한다.”라고 말했다.
이번 연구는 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 17.69)’ 온라인 판 7월 30일 자에 게재되었다.
2022.08.04 조회수 16994 -
 김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 21955
김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 21955 -
 김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21590
김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21590 -
 새 인공 형광 단백질 나노 조립체 개발
정 용 원 교수
우리 대학 화학과 정용원 교수 연구팀이 새로운 모양과 다양한 크기의 인공적 형광 단백질 나노 조립체를 개발했다.
이 단백질 나노 조립체 연구로 단백질 기반 신약 및 백신 개발 등 새로운 나노구조체 분야에 활발한 적용이 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 14일자 온라인 판에 게재됐다.
우리 몸의 필수 구성요소인 단백질은 나노미터 크기의 특성과 더불어 무한한 기능과 구조를 갖고 있다는 점에서 새로운 물질 및 구조체 개발에 매우 적합한 것으로 알려져 있다.
특히 단백질 다수가 조립된 다중 조립체는 새로운 성질과 모양, 크기를 가지며 생체친화적인 나노 구조체이기 때문에 많은 관심을 받고 있다. 단백질 다중 조립체는 다수의 단백질이 동시에 작용하기 때문에 결합력을 극대화 해 신약, 백신 기능 향상 연구에 중요한 방법론을 제시할 것으로 기대되기 때문이다.
이 조립체의 상업적, 연구적 이용을 위해선 조립된 단백질의 수가 정확히 조절되고, 다양한 크기의 조립체를 제작할 수 있어야 한다. 하지만 현재의 기술로는 조립체의 크기에 따라 정밀히 분리하는 것이 쉽지 않다.
연구팀은 문제 해결을 위해 인공적 형광 단백질 조립체를 세포 내 합성을 통해 다양한 크기로 제작했다. 또한 조립체 표면 개량을 통해 거대 생체분자의 안정성을 향상시켰고, 다양한 크기의 조립체를 분리할 수 있는 방법을 최초로 개발했다.
이 방법을 이용해 다각형 및 선형 배열을 갖는 형광 단백질 조립체 또한 제작해 관찰했다. 이 과정에서 나노크기 공간에서의 결합 단백질의 개수를 증가시켰고, 기존 단일 단백질보다 비약적으로 향상된 결합력을 확인했다.
정 교수는 “이번 단백질 조립체 제작 기술은 다양한 모양과 크기, 기능성을 갖는 새 조립체 제작의 기반이 될 것이다”며 “비약적으로 향상된 기능을 가진 단백질 신약, 백신, 혹은 결합 리셉터 연구에 핵심적 역할을 할 것”이라 말했다.
정용원 교수 지도 아래 김영은 박사과정 학생이 1저자로 참여한 이번 연구는 우리 대학 김호민 교수 연구팀이 참여했으며, 한국연구재단이 추진하는 글로벌프론티어사업(바이오나노 헬스가드 연구단) 및 기초연구실지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림 1. 형광단백질 조립체 모식도 및 전자현미경 사진
2015.05.26 조회수 15926
새 인공 형광 단백질 나노 조립체 개발
정 용 원 교수
우리 대학 화학과 정용원 교수 연구팀이 새로운 모양과 다양한 크기의 인공적 형광 단백질 나노 조립체를 개발했다.
이 단백질 나노 조립체 연구로 단백질 기반 신약 및 백신 개발 등 새로운 나노구조체 분야에 활발한 적용이 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 14일자 온라인 판에 게재됐다.
우리 몸의 필수 구성요소인 단백질은 나노미터 크기의 특성과 더불어 무한한 기능과 구조를 갖고 있다는 점에서 새로운 물질 및 구조체 개발에 매우 적합한 것으로 알려져 있다.
특히 단백질 다수가 조립된 다중 조립체는 새로운 성질과 모양, 크기를 가지며 생체친화적인 나노 구조체이기 때문에 많은 관심을 받고 있다. 단백질 다중 조립체는 다수의 단백질이 동시에 작용하기 때문에 결합력을 극대화 해 신약, 백신 기능 향상 연구에 중요한 방법론을 제시할 것으로 기대되기 때문이다.
이 조립체의 상업적, 연구적 이용을 위해선 조립된 단백질의 수가 정확히 조절되고, 다양한 크기의 조립체를 제작할 수 있어야 한다. 하지만 현재의 기술로는 조립체의 크기에 따라 정밀히 분리하는 것이 쉽지 않다.
연구팀은 문제 해결을 위해 인공적 형광 단백질 조립체를 세포 내 합성을 통해 다양한 크기로 제작했다. 또한 조립체 표면 개량을 통해 거대 생체분자의 안정성을 향상시켰고, 다양한 크기의 조립체를 분리할 수 있는 방법을 최초로 개발했다.
이 방법을 이용해 다각형 및 선형 배열을 갖는 형광 단백질 조립체 또한 제작해 관찰했다. 이 과정에서 나노크기 공간에서의 결합 단백질의 개수를 증가시켰고, 기존 단일 단백질보다 비약적으로 향상된 결합력을 확인했다.
정 교수는 “이번 단백질 조립체 제작 기술은 다양한 모양과 크기, 기능성을 갖는 새 조립체 제작의 기반이 될 것이다”며 “비약적으로 향상된 기능을 가진 단백질 신약, 백신, 혹은 결합 리셉터 연구에 핵심적 역할을 할 것”이라 말했다.
정용원 교수 지도 아래 김영은 박사과정 학생이 1저자로 참여한 이번 연구는 우리 대학 김호민 교수 연구팀이 참여했으며, 한국연구재단이 추진하는 글로벌프론티어사업(바이오나노 헬스가드 연구단) 및 기초연구실지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림 1. 형광단백질 조립체 모식도 및 전자현미경 사진
2015.05.26 조회수 15926 -
 신경세포 전달 후 분해 원리 30년 만에 규명
윤태영 교수
2013년도의 노벨 생리의학상은 제임스 로스먼, 랜디 셰크먼, 토마스 쥐트호프에게 돌아갔다. 그들은 신경전달물질, 호르몬 등의 주요 물질이 자루 모양의 지질막인 소포(vesicles)에 담겨 택배처럼 전달되는 과정을 발생시키는 단백질을 발견한 공로를 인정받았다.
수상자들은 소포의 막을 열어 세포막과 융합해 물질을 분출하는 방식으로 에너지를 전달하는 역할인 스네어(SNARE)라는 단백질과, 물질을 분출한 후의 스네어 단백질 재활용을 위해 기능하는 NSF라는 단백질을 발견했다.
우리에게 잘 알려진 보톡스도 스네어 단백질의 작용 과정을 역으로 이용한 것이다. 보톡스가 스네어를 절단해 소포가 세포막과 융합하지 못하게 만들어 신경전달물질의 방출을 막고, 그로인해 근육의 수축을 방해하는 것이다.
이런 운송 업무가 있기 때문에 우리 세포는 신체 곳곳에 단백질과 같은 물질이 공급돼 정상적인 기능을 할 수 있다.
우리 대학 물리학과 윤태영 교수 연구팀은 그간 명확하지 않았던 NSF가 스네어 결합체를 분해해 세포수송을 지속시키는 원리를 규명했다고 밝혔다.
이번 연구 결과는 저명 학술지 사이언스지 3월 27일자에 게재됐다.
NSF와 스네어 단백질은 30여 년 전에 발견됐지만 각각의 물질이 작용하는 방식은 명확히 규명되지 않았다. 특히 세포막과 결합한 스네어 결합체를 NSF가 어떤 방법으로 분해해 재활용하는지에 대해선 의견이 분분했다.
지금까지 과학자들은 NSF가 스네어 결합체를 분해할 때 끈을 조금씩 푸는 것처럼 점진적인 과정을 통해 분해가 이뤄지고, 하나의 스네어 결합체를 분해하는 데 ATP라는 연료 역할을 하는 유기화합물 수십 개가 필요하다는 가설을 주장했다.
하지만 윤 교수팀의 연구는 단분자 형광 기법과 자기집게 기술(magnetic tweezers)을 사용해 가설을 반박했다. 마치 매듭의 양 끝을 잡고 당기면 한 번에 풀리듯, ATP를 주입하면 NSF가 스프링처럼 에너지를 저장했다가 스네어 결합체 전체를 단번에 폭발적으로 풀어냄을 증명한 것이다.
이번에 규명된 NSF는 근육의 이동, 단백질 분해, DNA의 복제 및 이동 등 신체에서 중요한 역할을 하는 AAA+ 단백질 그룹에 속해있다. 따라서 NSF와 비슷한 구조의 AAA+ 단백질 그룹은 함께 동작할 것으로 예상되며, 앞으로 많은 생물 현상 이해의 주춧돌이 될 것으로 보인다.
스네어 단백질은 신경세포 통신과 인슐린 분비 등에 중추적 역할을 하고 있어 윤 교수팀의 성과는 알츠하이머와 같은 퇴행성 뇌질환, 당뇨병과 같은 대사질환 관련 연구 뿐 아니라 피부미용 연구에도 이바지 할 것으로 기대된다.
윤 교수는 “생물 물리 분야에서 우리나라가 최고수준의 기초과학 연구력을 보유하고 있음을 증명했다”며 “이번 연구결과는 여러 대사질환을 분자수준에서 이해할 수 있는 토대가 될 것”이라고 말했다.
이번 연구는 고등과학원의 현창봉 교수팀, 독일 막스 플랑크 연구소 라인하르트 얀(Reinhard Jahn) 교수팀, 우리 대학 의과학대학원 김호민 교수팀과의 공동 연구로 진행됐으며, 윤 교수 연구팀의 류제경, 민두영 박사, 나상현 학생의 주도로 이뤄졌다.
□ 그림 설명
그림 1. 신경전달물질의 분비가 끝난 후 NSF가 SNARE 단백질 복합체를 한 번에 분해하는 모습
그림 2. NSF 가 SNARE 복합체를 풀어내는 모습
2015.03.27 조회수 14768
신경세포 전달 후 분해 원리 30년 만에 규명
윤태영 교수
2013년도의 노벨 생리의학상은 제임스 로스먼, 랜디 셰크먼, 토마스 쥐트호프에게 돌아갔다. 그들은 신경전달물질, 호르몬 등의 주요 물질이 자루 모양의 지질막인 소포(vesicles)에 담겨 택배처럼 전달되는 과정을 발생시키는 단백질을 발견한 공로를 인정받았다.
수상자들은 소포의 막을 열어 세포막과 융합해 물질을 분출하는 방식으로 에너지를 전달하는 역할인 스네어(SNARE)라는 단백질과, 물질을 분출한 후의 스네어 단백질 재활용을 위해 기능하는 NSF라는 단백질을 발견했다.
우리에게 잘 알려진 보톡스도 스네어 단백질의 작용 과정을 역으로 이용한 것이다. 보톡스가 스네어를 절단해 소포가 세포막과 융합하지 못하게 만들어 신경전달물질의 방출을 막고, 그로인해 근육의 수축을 방해하는 것이다.
이런 운송 업무가 있기 때문에 우리 세포는 신체 곳곳에 단백질과 같은 물질이 공급돼 정상적인 기능을 할 수 있다.
우리 대학 물리학과 윤태영 교수 연구팀은 그간 명확하지 않았던 NSF가 스네어 결합체를 분해해 세포수송을 지속시키는 원리를 규명했다고 밝혔다.
이번 연구 결과는 저명 학술지 사이언스지 3월 27일자에 게재됐다.
NSF와 스네어 단백질은 30여 년 전에 발견됐지만 각각의 물질이 작용하는 방식은 명확히 규명되지 않았다. 특히 세포막과 결합한 스네어 결합체를 NSF가 어떤 방법으로 분해해 재활용하는지에 대해선 의견이 분분했다.
지금까지 과학자들은 NSF가 스네어 결합체를 분해할 때 끈을 조금씩 푸는 것처럼 점진적인 과정을 통해 분해가 이뤄지고, 하나의 스네어 결합체를 분해하는 데 ATP라는 연료 역할을 하는 유기화합물 수십 개가 필요하다는 가설을 주장했다.
하지만 윤 교수팀의 연구는 단분자 형광 기법과 자기집게 기술(magnetic tweezers)을 사용해 가설을 반박했다. 마치 매듭의 양 끝을 잡고 당기면 한 번에 풀리듯, ATP를 주입하면 NSF가 스프링처럼 에너지를 저장했다가 스네어 결합체 전체를 단번에 폭발적으로 풀어냄을 증명한 것이다.
이번에 규명된 NSF는 근육의 이동, 단백질 분해, DNA의 복제 및 이동 등 신체에서 중요한 역할을 하는 AAA+ 단백질 그룹에 속해있다. 따라서 NSF와 비슷한 구조의 AAA+ 단백질 그룹은 함께 동작할 것으로 예상되며, 앞으로 많은 생물 현상 이해의 주춧돌이 될 것으로 보인다.
스네어 단백질은 신경세포 통신과 인슐린 분비 등에 중추적 역할을 하고 있어 윤 교수팀의 성과는 알츠하이머와 같은 퇴행성 뇌질환, 당뇨병과 같은 대사질환 관련 연구 뿐 아니라 피부미용 연구에도 이바지 할 것으로 기대된다.
윤 교수는 “생물 물리 분야에서 우리나라가 최고수준의 기초과학 연구력을 보유하고 있음을 증명했다”며 “이번 연구결과는 여러 대사질환을 분자수준에서 이해할 수 있는 토대가 될 것”이라고 말했다.
이번 연구는 고등과학원의 현창봉 교수팀, 독일 막스 플랑크 연구소 라인하르트 얀(Reinhard Jahn) 교수팀, 우리 대학 의과학대학원 김호민 교수팀과의 공동 연구로 진행됐으며, 윤 교수 연구팀의 류제경, 민두영 박사, 나상현 학생의 주도로 이뤄졌다.
□ 그림 설명
그림 1. 신경전달물질의 분비가 끝난 후 NSF가 SNARE 단백질 복합체를 한 번에 분해하는 모습
그림 2. NSF 가 SNARE 복합체를 풀어내는 모습
2015.03.27 조회수 14768 -
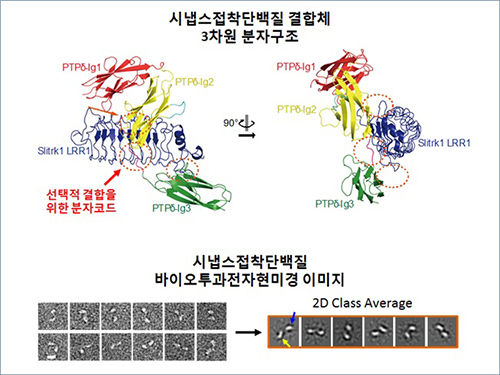 신경세포 연결해주는 접착단백질 결합구조 규명
국내 연구진이 신경세포 연결을 주관하는 시냅스접착단백질**의 3차원 복합체 구조를 규명함으로써, 시냅스* 형성초기 기전을 제시하였다. 시냅스 이상으로 인한 강박증이나 조울증 등 다양한 뇌질환의 발병기전 규명과 치료제 개발에 활용될 것으로 기대된다.
* 시냅스 : 신경전달물질의 분비와 흡수가 일어나는 1,000억 여 개에 달하는 신경세포의 접합부위로 학습과 기억, 감각, 운동 등을 조절하는 뇌 활동의 기본단위이다. ** 시냅스접착단백질 : 벨크로처럼 두 개의 신경세포를 단단하게 연결해 시냅스 형성을 돕는 신경세포막에 존재하는 단백질
우리 학교 의과학대학원 김호민 교수와 연세대 생화학과 고재원 교수 (이상 교신저자)가 주도하고, 연세대 엄지원 연구교수, KAIST 김기훈 석사과정 연구원 및 을지대 박범석 교수(이상 제1저자)가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 지원하는 신진연구자지원사업, 중견연구자지원사업(핵심연구) 및 교육부 학문후속세대양성사업의 지원으로 수행되었고 자연과학 분야 국제학술지 네이처 커뮤니케이션스(Nature Communications)지 온라인판 11월 14일자에 게재되었다. (논문명 : Structural basis for LAR-RPTP/Slitrk complex-mediated synaptic adhesion)
신경세포막에 존재하는 단백질 슬릿트랙*은 다른 신경세포의 막에 존재하는 단백질 LAR-RPTP**와 복합체를 이뤄 초기 시냅스 형성과 신경세포의 흥분과 억제간의 균형 유지에 관여하는 것으로 알려져 있었다.
* 슬릿트랙(Slitrk) : 뇌의 중추신경계에서 강하게 발현되는 단백질. 이 유전자가 결핍된 형질전환생쥐의 경우 다양한 뇌질환 표현형을 나타냄. 최근 LAR-RPTP와 결합하여 시냅스 형성을 조절하는 시냅스접착단백질임이 밝혀짐
** LAR-RPTP : 신경세포의 초기 발달과정에서 중요한 역할을 하는 단백질 군. 최근 시냅스 형성에 관계된 주요 기능들이 조금씩 밝혀지면서 새롭게 주목 받기 시작한시냅스접착단백질
이들 두 단백질의 이상은 시냅스의 기능이상을 유발해 자폐증, 정신분열증, 간질, 강박증 및 조울증 같은 다양한 신경·정신질환을 유발하는 것으로 알려져 있지만 두 단백질의 결합구조와 구체적인 작용기전이 규명되지 않아 치료제 개발에 한계가 있었다.
연구팀은 단백질 결정학기술과 바이오투과전자현미경을 활용해 두 시냅스접착단백질(슬릿트랙(Slitrk)과 LAR-RPTP)이 결합된 3차원 구조를 밝혀내고 이들 상호간의 결합의 핵심이 되는 부위를 찾아냈다.
나아가 두 시냅스접착 단백질이 결합한 후 클러스터를 형성하면서 시냅스 생성이 유도된다는 것을 규명하였다.
김호민 교수는 “시냅스접착단백질의 기능 이상으로 나타나는 다양한 뇌질환의 발병기전 이해에 큰 밑거름이 될 것. 특히, 단백질 구조생물학과 신경생물학의 유기적인 협력연구를 통하여 우수한 성과를 거둔 대표적 사례가 될 것”이라고 밝혔다. 고재원 교수는 “시냅스접착단백질 분자기전을 이해함으로써 시냅스 형성 관련 연구의 새로운 방향을 제시할 것”이라고 연구의의를 밝혔다.
그림 1. 시냅스접착단백질 결합체 구조 및 슬릿트랫 바이오투과전자현미경 이미지
(위) 시냅스접착단백질 슬릿트랙(Slitrk)과 LAR-RPTP 결합체 분자구조
단백질결정학을 통해 시냅스접착단백질 결합체 분자구조를 분석한 결과 두 시냅스접착단백질의 결합에 중추적인 역할을 하는 핵심적인 아미노산을 도출할 수 있었다.
특히 LAR-RPTP 단백질에 위치한 선택적 접합(Alternative splicing) 부위(붉은색 화살표)가 슬릿트랙 (Slitrk)과 선택적으로 결합하기 위한 분자코드임을 규명하였다.
(아래) 슬릿트랙의 바이오투과전자현미경 이미지 단백질결정학으로는 규명이 어려운 전체 슬릿트랙 단백질 구조(세포막 바깥쪽부위)를 바이오투과전자현미경을 사용하여 분석하였다. 그림에서 보듯 전체 슬릿트랙은 땅콩처럼 생긴 비슷한 두 개의 단백질 모듈(푸른색, 노란색 화살표)로 구성되어 있고, 이들 중 한 부분(파란색 화살표)만 LAR-RPTP와 결합하게 된다는 것을 규명하였다.
그림 2. 시냅스접착단백질 결합에 의해 유도되는 시냅스형성 분자기전
전시냅스의 LAR-RPTP과 후시냅스의 슬릿트랙(Slitrk)의 결합이 단순한 결합에 그치는 것이 아니라 결합 이후 신경세포 막에서의 배열변화를 통해 단백질 클러스터 형성을 유도할 수 있음을 보였다.
그림 3. 시냅스 및 시냅스접착단백질 개요
시냅스는 1000 억여 개에 달하는 신경세포들의 접합 부위인 뇌기능의 기본단위로서 신경세포 간 교환되는 신경전달물질들에 의하여 학습 및 기억, 감각, 운동 등이 원활히 조절된다. 시냅스에는 약 1,000여종 단백질이 존재하며, 이들 중 신경세포 막에 존재하며 벨크로처럼 두 개의 신경세포를 단단하게 연결하여 시냅스 형성을 돕는 단백질을 시냅스접착단백질이라 한다. 현재 불과 10여개의 시냅스접착단백질만이 밝혀져 있고, 이중 최근에 주목받기 시작한 시냅스접착단백질이 슬릿트랫과 LAR-RPTP이다.
2014.11.20 조회수 20634
신경세포 연결해주는 접착단백질 결합구조 규명
국내 연구진이 신경세포 연결을 주관하는 시냅스접착단백질**의 3차원 복합체 구조를 규명함으로써, 시냅스* 형성초기 기전을 제시하였다. 시냅스 이상으로 인한 강박증이나 조울증 등 다양한 뇌질환의 발병기전 규명과 치료제 개발에 활용될 것으로 기대된다.
* 시냅스 : 신경전달물질의 분비와 흡수가 일어나는 1,000억 여 개에 달하는 신경세포의 접합부위로 학습과 기억, 감각, 운동 등을 조절하는 뇌 활동의 기본단위이다. ** 시냅스접착단백질 : 벨크로처럼 두 개의 신경세포를 단단하게 연결해 시냅스 형성을 돕는 신경세포막에 존재하는 단백질
우리 학교 의과학대학원 김호민 교수와 연세대 생화학과 고재원 교수 (이상 교신저자)가 주도하고, 연세대 엄지원 연구교수, KAIST 김기훈 석사과정 연구원 및 을지대 박범석 교수(이상 제1저자)가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 지원하는 신진연구자지원사업, 중견연구자지원사업(핵심연구) 및 교육부 학문후속세대양성사업의 지원으로 수행되었고 자연과학 분야 국제학술지 네이처 커뮤니케이션스(Nature Communications)지 온라인판 11월 14일자에 게재되었다. (논문명 : Structural basis for LAR-RPTP/Slitrk complex-mediated synaptic adhesion)
신경세포막에 존재하는 단백질 슬릿트랙*은 다른 신경세포의 막에 존재하는 단백질 LAR-RPTP**와 복합체를 이뤄 초기 시냅스 형성과 신경세포의 흥분과 억제간의 균형 유지에 관여하는 것으로 알려져 있었다.
* 슬릿트랙(Slitrk) : 뇌의 중추신경계에서 강하게 발현되는 단백질. 이 유전자가 결핍된 형질전환생쥐의 경우 다양한 뇌질환 표현형을 나타냄. 최근 LAR-RPTP와 결합하여 시냅스 형성을 조절하는 시냅스접착단백질임이 밝혀짐
** LAR-RPTP : 신경세포의 초기 발달과정에서 중요한 역할을 하는 단백질 군. 최근 시냅스 형성에 관계된 주요 기능들이 조금씩 밝혀지면서 새롭게 주목 받기 시작한시냅스접착단백질
이들 두 단백질의 이상은 시냅스의 기능이상을 유발해 자폐증, 정신분열증, 간질, 강박증 및 조울증 같은 다양한 신경·정신질환을 유발하는 것으로 알려져 있지만 두 단백질의 결합구조와 구체적인 작용기전이 규명되지 않아 치료제 개발에 한계가 있었다.
연구팀은 단백질 결정학기술과 바이오투과전자현미경을 활용해 두 시냅스접착단백질(슬릿트랙(Slitrk)과 LAR-RPTP)이 결합된 3차원 구조를 밝혀내고 이들 상호간의 결합의 핵심이 되는 부위를 찾아냈다.
나아가 두 시냅스접착 단백질이 결합한 후 클러스터를 형성하면서 시냅스 생성이 유도된다는 것을 규명하였다.
김호민 교수는 “시냅스접착단백질의 기능 이상으로 나타나는 다양한 뇌질환의 발병기전 이해에 큰 밑거름이 될 것. 특히, 단백질 구조생물학과 신경생물학의 유기적인 협력연구를 통하여 우수한 성과를 거둔 대표적 사례가 될 것”이라고 밝혔다. 고재원 교수는 “시냅스접착단백질 분자기전을 이해함으로써 시냅스 형성 관련 연구의 새로운 방향을 제시할 것”이라고 연구의의를 밝혔다.
그림 1. 시냅스접착단백질 결합체 구조 및 슬릿트랫 바이오투과전자현미경 이미지
(위) 시냅스접착단백질 슬릿트랙(Slitrk)과 LAR-RPTP 결합체 분자구조
단백질결정학을 통해 시냅스접착단백질 결합체 분자구조를 분석한 결과 두 시냅스접착단백질의 결합에 중추적인 역할을 하는 핵심적인 아미노산을 도출할 수 있었다.
특히 LAR-RPTP 단백질에 위치한 선택적 접합(Alternative splicing) 부위(붉은색 화살표)가 슬릿트랙 (Slitrk)과 선택적으로 결합하기 위한 분자코드임을 규명하였다.
(아래) 슬릿트랙의 바이오투과전자현미경 이미지 단백질결정학으로는 규명이 어려운 전체 슬릿트랙 단백질 구조(세포막 바깥쪽부위)를 바이오투과전자현미경을 사용하여 분석하였다. 그림에서 보듯 전체 슬릿트랙은 땅콩처럼 생긴 비슷한 두 개의 단백질 모듈(푸른색, 노란색 화살표)로 구성되어 있고, 이들 중 한 부분(파란색 화살표)만 LAR-RPTP와 결합하게 된다는 것을 규명하였다.
그림 2. 시냅스접착단백질 결합에 의해 유도되는 시냅스형성 분자기전
전시냅스의 LAR-RPTP과 후시냅스의 슬릿트랙(Slitrk)의 결합이 단순한 결합에 그치는 것이 아니라 결합 이후 신경세포 막에서의 배열변화를 통해 단백질 클러스터 형성을 유도할 수 있음을 보였다.
그림 3. 시냅스 및 시냅스접착단백질 개요
시냅스는 1000 억여 개에 달하는 신경세포들의 접합 부위인 뇌기능의 기본단위로서 신경세포 간 교환되는 신경전달물질들에 의하여 학습 및 기억, 감각, 운동 등이 원활히 조절된다. 시냅스에는 약 1,000여종 단백질이 존재하며, 이들 중 신경세포 막에 존재하며 벨크로처럼 두 개의 신경세포를 단단하게 연결하여 시냅스 형성을 돕는 단백질을 시냅스접착단백질이라 한다. 현재 불과 10여개의 시냅스접착단백질만이 밝혀져 있고, 이중 최근에 주목받기 시작한 시냅스접착단백질이 슬릿트랫과 LAR-RPTP이다.
2014.11.20 조회수 20634 -
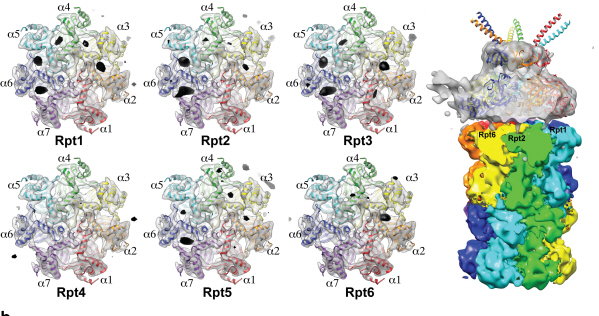 세포 내 단백질분해 복합체 조립과정 규명
- 바이오 투과전자현미경을 사용한 고해상도 3차원 구조분석 성공 -
- “신규 항암제 개발에 커다란 도움 될 것” -- 네이처(Nature) 5월 5일자 게재 -
단백질분자도 전자현미경을 이용해 관찰하고, 고해상도 3차원 구조를 분석하는 것이 가능해졌다.
우리 학교 의과학대학원 김호민 교수가 바이오 투과전자현미경을 이용해 세포 내 단백질의 분해를 담당하는 프로테아좀(proteasome) 복합체의 고해상도 구조를 규명했다.
이번 연구는 세계 최고 권위 학술지 ‘네이처(Nature, IF= 36.28)’ 5월 5일자 온라인판에 게재됐다.
우리 몸은 단백질의 생성과 소멸을 통해 세포 내 여러 가지 작용을 조절하고, 항상성을 유지한다. 프로테아좀 복합체는 폐기물 처리시설처럼 세포 내부에 있는 필요 없는 단백질들을 적절한 시기에 없애주면서 생체 조절의 핵심기능을 맡고 있다.
그러나 프로테아좀 복합체에 돌연변이가 생기면 사람에게 발생하는 주요 질병인 암, 퇴행성 뇌질환, 면역질환 등으로 이어질 수 있다.
현재 혈액암의 일종인 다발성 골수종의 치료제로 사용되고 있는 벨케이드(Velcade)가 바로 이 프로테아좀의 기능을 억제해 암세포 분열을 억제하는 항암제인데, 보다 더 약효가 좋고 부작용이 적은 항암제 및 질병치료제 개발을 위해 프로테아좀 복합체 관련 연구가 20년 이상 꾸준히 진행되고 있다.
30여개의 단백질이 모여서 만들어진 프로테아좀 복합체의 경우 크기가 매우 크고 구조가 복잡하기 때문에 기능을 이해하기 위한 3차원 구조 분석에 많은 어려움을 겪어왔다.
연구팀은 기존에 널리 사용되던 단백질 구조분석기술인 단백질결정학 기술 대신, 바이오 투과전자현미경 안에 얼려진 단백질샘플을 넣고 수백 장의 사진을 찍은 후 여러 각도에서 찍힌 단백질 사진을 고성능 컴퓨터를 이용해 분석함으로써 프로테아좀 복합체의 3차원 구조를 규명하는데 성공했다.
이 기술은 단백질결정학을 이용한 방법 보다 적은 단백질 샘플로 분석이 가능하며, 크기가 아주 큰 복합체 분석에 용이하다는 장점이 있다.
김호민 교수는 이번 연구에 대해 “프로테아좀 복합체 조립과정 이해 및 3차원 구조 규명은 생체 내 단백질 소멸 조절 과정에 대한 이해를 높일 뿐 아니라 이를 활용한 신약 개발이 활발히 이루어 질 것”이라고 말했다.
또 “국내 처음으로 도입된 바이오 투과전자현미경을 이용한 고해상도 단백질 구조분석은 기존의 단백질 결정학 기술로 접근이 어려웠던 매우 큰 단백질 복합체의 구조 분석을 가능케 할 것”이라며 “단백질결정학 기술과 바이오 투과전자현미경기술을 상호보완적으로 사용한다면 향후 여러 단백질복합체 3차 구조 연구에 큰 시너지효과를 가져올 수 있을 것으로 기대된다”고 말했다.
이번 연구는 KAIST 김호민 교수가 미국 캘리포니아대학 샌프란시스코 캠퍼스에서 박사 후 연구원으로 있을 당시부터 수행해 온 연구로 이판 쳉(Yifan Cheng) 교수의 지도를 받았으며, 하버드대, 콜로라도대와 공동으로 수행됐다.
그림1. 바이오 투과전자현미경으로 찍은 얼려진 상태의 단백질 샘플(프로테아좀 복합체) 사진
그림2. 바이오 투과전자현미경 이미지 분석을 통한 단백질 3차 구조
2013.05.06 조회수 16701
세포 내 단백질분해 복합체 조립과정 규명
- 바이오 투과전자현미경을 사용한 고해상도 3차원 구조분석 성공 -
- “신규 항암제 개발에 커다란 도움 될 것” -- 네이처(Nature) 5월 5일자 게재 -
단백질분자도 전자현미경을 이용해 관찰하고, 고해상도 3차원 구조를 분석하는 것이 가능해졌다.
우리 학교 의과학대학원 김호민 교수가 바이오 투과전자현미경을 이용해 세포 내 단백질의 분해를 담당하는 프로테아좀(proteasome) 복합체의 고해상도 구조를 규명했다.
이번 연구는 세계 최고 권위 학술지 ‘네이처(Nature, IF= 36.28)’ 5월 5일자 온라인판에 게재됐다.
우리 몸은 단백질의 생성과 소멸을 통해 세포 내 여러 가지 작용을 조절하고, 항상성을 유지한다. 프로테아좀 복합체는 폐기물 처리시설처럼 세포 내부에 있는 필요 없는 단백질들을 적절한 시기에 없애주면서 생체 조절의 핵심기능을 맡고 있다.
그러나 프로테아좀 복합체에 돌연변이가 생기면 사람에게 발생하는 주요 질병인 암, 퇴행성 뇌질환, 면역질환 등으로 이어질 수 있다.
현재 혈액암의 일종인 다발성 골수종의 치료제로 사용되고 있는 벨케이드(Velcade)가 바로 이 프로테아좀의 기능을 억제해 암세포 분열을 억제하는 항암제인데, 보다 더 약효가 좋고 부작용이 적은 항암제 및 질병치료제 개발을 위해 프로테아좀 복합체 관련 연구가 20년 이상 꾸준히 진행되고 있다.
30여개의 단백질이 모여서 만들어진 프로테아좀 복합체의 경우 크기가 매우 크고 구조가 복잡하기 때문에 기능을 이해하기 위한 3차원 구조 분석에 많은 어려움을 겪어왔다.
연구팀은 기존에 널리 사용되던 단백질 구조분석기술인 단백질결정학 기술 대신, 바이오 투과전자현미경 안에 얼려진 단백질샘플을 넣고 수백 장의 사진을 찍은 후 여러 각도에서 찍힌 단백질 사진을 고성능 컴퓨터를 이용해 분석함으로써 프로테아좀 복합체의 3차원 구조를 규명하는데 성공했다.
이 기술은 단백질결정학을 이용한 방법 보다 적은 단백질 샘플로 분석이 가능하며, 크기가 아주 큰 복합체 분석에 용이하다는 장점이 있다.
김호민 교수는 이번 연구에 대해 “프로테아좀 복합체 조립과정 이해 및 3차원 구조 규명은 생체 내 단백질 소멸 조절 과정에 대한 이해를 높일 뿐 아니라 이를 활용한 신약 개발이 활발히 이루어 질 것”이라고 말했다.
또 “국내 처음으로 도입된 바이오 투과전자현미경을 이용한 고해상도 단백질 구조분석은 기존의 단백질 결정학 기술로 접근이 어려웠던 매우 큰 단백질 복합체의 구조 분석을 가능케 할 것”이라며 “단백질결정학 기술과 바이오 투과전자현미경기술을 상호보완적으로 사용한다면 향후 여러 단백질복합체 3차 구조 연구에 큰 시너지효과를 가져올 수 있을 것으로 기대된다”고 말했다.
이번 연구는 KAIST 김호민 교수가 미국 캘리포니아대학 샌프란시스코 캠퍼스에서 박사 후 연구원으로 있을 당시부터 수행해 온 연구로 이판 쳉(Yifan Cheng) 교수의 지도를 받았으며, 하버드대, 콜로라도대와 공동으로 수행됐다.
그림1. 바이오 투과전자현미경으로 찍은 얼려진 상태의 단백질 샘플(프로테아좀 복합체) 사진
그림2. 바이오 투과전자현미경 이미지 분석을 통한 단백질 3차 구조
2013.05.06 조회수 16701