%EC%86%A1%EC%A7%80%EC%A4%80
-
 헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
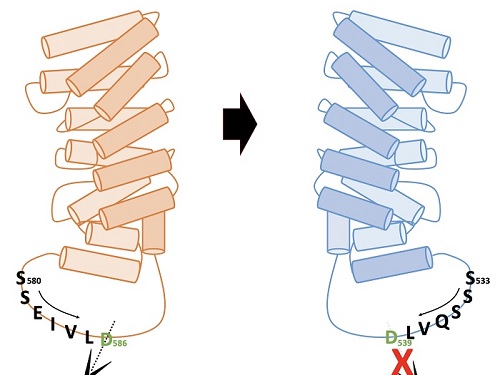
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 8979
헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 8979 -
 호르몬 조절 수용체 구조와 작용 메커니즘 규명으로 뇌기능 향상 물질 개발 가속
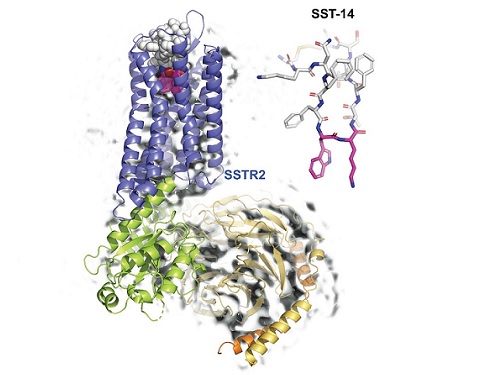
우리 대학 생명과학과 송지준 교수 연구팀이 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
소마토스타틴은 성장호르몬의 분비를 억제하는 작용이 있는 호르몬으로 내장과 뇌에 관련된 호르몬이며, 호르몬 분비 조절, 세포의 증식, 뇌 신경 물질 전달에 관한 작용을 한다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `이라이프(eLife)' 에 4월 22일에 출판됐다. (논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다. 이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는, 3차원 원자구조는 알려지지 않았다.
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
연구팀은 더 나아가 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 말단비대증, 신경뇌분비 종양의 제어 및 뇌기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
한편 이번 연구는 한국연구재단 바이오-의료기술개발사업의 지원을 받아 수행됐다.
2022.05.09 조회수 9362
호르몬 조절 수용체 구조와 작용 메커니즘 규명으로 뇌기능 향상 물질 개발 가속
우리 대학 생명과학과 송지준 교수 연구팀이 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
소마토스타틴은 성장호르몬의 분비를 억제하는 작용이 있는 호르몬으로 내장과 뇌에 관련된 호르몬이며, 호르몬 분비 조절, 세포의 증식, 뇌 신경 물질 전달에 관한 작용을 한다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `이라이프(eLife)' 에 4월 22일에 출판됐다. (논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다. 이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는, 3차원 원자구조는 알려지지 않았다.
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
연구팀은 더 나아가 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 말단비대증, 신경뇌분비 종양의 제어 및 뇌기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
한편 이번 연구는 한국연구재단 바이오-의료기술개발사업의 지원을 받아 수행됐다.
2022.05.09 조회수 9362