%EC%A0%84%EC%83%81%EC%9A%A9
-
 장기 별 직접 약물 전달이 가능해지다
장기 선택적 약물 전달 기술은 치료 효과를 극대화하고 부작용을 최소화할 수 있어 큰 기대를 받고 있다. 그러나 현존하는 기술로는 간, 비장, 폐와 같은 대식세포가 활발히 활동하는 장기에만 약물을 전달하는 것이 가능하나 콩팥, 심장, 뇌와 같은 장기로의 약물 전달은 도전적인 과제로 알려져 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 체내에서 여러 생물학적 상호작용에 관여하는 당질 층을 모방한 인공 탄수화물 나노입자(Glycocalyx-mimicking nanoparticle, GlyNP) 수십 종을 합성하여 이를 다양한 장기로의 특이적 약물 전달과 치료를 가능하게 하는 새로운 나노의약 개발에 성공했다고 3일 밝혔다.
연구팀은 다섯 가지의 단당류 단위체를 기반으로 한 조합적인 패턴을 구현해 ‘인공 탄수화물 나노입자(GlyNP)’ 라이브러리 수십 종을 합성했고, 이를 직접 동물 체내에서 선택성을 평가해 간, 신장, 비장, 폐, 심장, 뇌에 대해 차별화된 선택성을 가지는 인공 탄수화물 나노입자 후보군을 선별했다. 특히, 간, 신장, 비장에 선택성을 가지는 인공 탄수화물 나노입자 후보군은 해당 장기 내에서 각각 간세포, 신장 상피세포, 대식 세포를 표적하는 것을 확인했다.
궁극적으로 각 장기 선택적인 인공 탄수화물 나노입자 후보군을 사용하면 해당 장기에 생긴 질병을 더욱 효과적으로 치료할 수 있음을 보여주며 장기별 맞춤형 치료의 가능성을 보였다.
전상용 교수는 "이번 연구를 통해 개발한 장기 및 세포 선택적인 약물전달시스템을 이용하면 독성을 낮추고 효능을 크게 올릴 수 있어 기존에 가능하지 않았던 장기별 질병 치료에 한 걸음 더 나아갈 수 있을 것이고, 또한, 뇌나 심장과 같이 표적 약물 전달이 어려운 장기들로 기술을 확장해 나갈 것이다”라고 말했다.
생명과학과 김도현 박사과정 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 3월 15일 字 온라인판에 게재됐고 속 표지논문(Inside back cover) 및 화제의 논문(Hot Paper)으로 선정됐다.
(https://doi.org/10.1002/adma.202311283. 논문명: Glycocalyx-Mimicking Nanoparticles with Differential Organ Selectivity for Drug Delivery and Therapy, This article also appears in Hot Topic: Drug Delivery)
또한, 해당 주제는 제30회 삼성휴먼테크논문대상 생명공학 & 생명과학(Bio engineering & Life Science) 분야에서 은상을 수상하며 장기별 맞춤형 치료의 새로운 전략을 제시한 성과로 인정받았다.
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2024.05.03 조회수 9459
장기 별 직접 약물 전달이 가능해지다
장기 선택적 약물 전달 기술은 치료 효과를 극대화하고 부작용을 최소화할 수 있어 큰 기대를 받고 있다. 그러나 현존하는 기술로는 간, 비장, 폐와 같은 대식세포가 활발히 활동하는 장기에만 약물을 전달하는 것이 가능하나 콩팥, 심장, 뇌와 같은 장기로의 약물 전달은 도전적인 과제로 알려져 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 체내에서 여러 생물학적 상호작용에 관여하는 당질 층을 모방한 인공 탄수화물 나노입자(Glycocalyx-mimicking nanoparticle, GlyNP) 수십 종을 합성하여 이를 다양한 장기로의 특이적 약물 전달과 치료를 가능하게 하는 새로운 나노의약 개발에 성공했다고 3일 밝혔다.
연구팀은 다섯 가지의 단당류 단위체를 기반으로 한 조합적인 패턴을 구현해 ‘인공 탄수화물 나노입자(GlyNP)’ 라이브러리 수십 종을 합성했고, 이를 직접 동물 체내에서 선택성을 평가해 간, 신장, 비장, 폐, 심장, 뇌에 대해 차별화된 선택성을 가지는 인공 탄수화물 나노입자 후보군을 선별했다. 특히, 간, 신장, 비장에 선택성을 가지는 인공 탄수화물 나노입자 후보군은 해당 장기 내에서 각각 간세포, 신장 상피세포, 대식 세포를 표적하는 것을 확인했다.
궁극적으로 각 장기 선택적인 인공 탄수화물 나노입자 후보군을 사용하면 해당 장기에 생긴 질병을 더욱 효과적으로 치료할 수 있음을 보여주며 장기별 맞춤형 치료의 가능성을 보였다.
전상용 교수는 "이번 연구를 통해 개발한 장기 및 세포 선택적인 약물전달시스템을 이용하면 독성을 낮추고 효능을 크게 올릴 수 있어 기존에 가능하지 않았던 장기별 질병 치료에 한 걸음 더 나아갈 수 있을 것이고, 또한, 뇌나 심장과 같이 표적 약물 전달이 어려운 장기들로 기술을 확장해 나갈 것이다”라고 말했다.
생명과학과 김도현 박사과정 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 3월 15일 字 온라인판에 게재됐고 속 표지논문(Inside back cover) 및 화제의 논문(Hot Paper)으로 선정됐다.
(https://doi.org/10.1002/adma.202311283. 논문명: Glycocalyx-Mimicking Nanoparticles with Differential Organ Selectivity for Drug Delivery and Therapy, This article also appears in Hot Topic: Drug Delivery)
또한, 해당 주제는 제30회 삼성휴먼테크논문대상 생명공학 & 생명과학(Bio engineering & Life Science) 분야에서 은상을 수상하며 장기별 맞춤형 치료의 새로운 전략을 제시한 성과로 인정받았다.
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2024.05.03 조회수 9459 -
 비알콜성 지방간염은 이제 MRI로 진단하세요
간 건강을 위협하는 질환인 비알콜성 지방간 질환과 그 진행 형태인 비알콜성 지방간염의 현재 표준 진단 방법은 주로 간 조직을 채취하는 간 생검에 의존하고 있어 환자의 위험 부담이 크며, 질병의 진행 단계를 추적하는 데 어려움이 있었다.
우리 대학 생명과학과 전상용 교수와 바이오및뇌공학과 박성홍 교수 공동연구팀이 활성산소에 반응해 자기공명영상(MRI) 신호가 증강되는 MRI 영상 조영제를 개발했고 한 번의 MRI 촬영으로 손쉽게 비알콜성 지방간염의 진행 정도를 모니터링하고 진단하는 기술을 세계 최초로 개발했다고 2일 밝혔다.
비알콜성 지방간염은 간세포 손상, 염증, 그리고 최종적으로 간경화로 진행될 수 있는 질환으로, 간 내 활성산소 수준의 증가와 밀접한 관련이 있다. 활성산소는 간세포의 산화 스트레스를 유발하고, 비알콜성 지방간염의 진행을 촉진하는 주요 요인 중 하나로 알려져 있다.
이에 착안해 연구팀은 비알콜성 지방간염의 진행을 비침습적으로 모니터링할 수 있는 새로운 방법을 모색하고자 했다. 특히, 간 내 활성산소 양 변화에 반응해 MRI 신호를 강화할 수 있는 망간 이온 결합 빌리루빈 나노입자를 개발하고, 이를 활용하여 비알콜성 지방간염의 진행 상태를 정밀하게 추적할 수 있는 기술을 연구했다.
망간 이온 결합 빌리루빈 나노입자는 간 내 활성산소 증가에 따라 MRI 신호를 증폭했고 연구팀은‘유사 3-구획 모델’을 통해 한 번의 MRI 촬영으로 비알콜성 지방간염의 진행 정도를 결정할 수 있었다. 이를 통해 비알콜성 지방간염의 초기 단계부터 간경화에 이르기까지 간 질환의 진행 상태를 연속적으로 모니터링 할 수 있었다.
연구팀은 다양한 실험을 통해 망간 이온 결합 빌리루빈 나노입자가 간 질환 모델 마우스에서 활성산소 양의 변화에 민감하게 반응해 MRI 신호의 강도를 조절하는 것을 확인했다. 이러한 발견은 간 질환의 진행 상태를 정밀하게 파악할 수 있게 함으로써, 환자 개개인에 맞춘 맞춤형 치료 전략 수립에 크게 기여할 수 있을 것으로 기대된다. 더 나아가, 이 기술은 비침습적이라는 점에서 환자의 부담을 크게 줄여주며, 장기적으로는 간 질환 관리 및 치료의 효율성을 높일 수 있을 것으로 전망된다.
전상용 교수는 “이번 연구를 통해 개발된 새로운 MRI 조영제와 영상해석 모델을 사용함으로써 기존에 표준 진단으로 사용하던 환자들에게 위험한 간 생검을 대체할 수 있을 것으로 기대한다”며, “또한, 병원에서 쉽게 접할 수 있는 대표적인 영상 장비인 MRI로 비알콜성 지방간염의 진행 상태 및 간경화로의 전이되는 단계를 손쉽게 진단할 수 있어 지방간염 약물의 효능을 평가하는 데 필수적인 진단 장비가 될 수 있을 것이므로 효율적인 지방간염 치료제 개발에 기여할 수 있을 것으로 기대한다”라고 말했다.
우리 대학 생명과학과 정원식 박사 및 바이오및뇌공학과 무하메드 아사두딘(Muhammad Asaduddin) 박사가 공동 제1 저자로 참여한 이번 연구는 재료과학 분야 최정상급 학술지인 `어드밴스드 머터리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 온라인판에 지난 3월 9일 字 게재됐다.
(https://doi.org/10.1002/adma.202305830 논문명: Longitudinal Magnetic Resonance Imaging with ROS-Responsive Bilirubin Nanoparticles Enables Monitoring of Non-Alcoholic Steatohepatitis Progression to Cirrhosis).
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 기초연구실지원사업(뇌척수액 순환 기반 뇌인지기능 기초연구실)의 지원을 받아 수행됐다.
2024.04.02 조회수 7394
비알콜성 지방간염은 이제 MRI로 진단하세요
간 건강을 위협하는 질환인 비알콜성 지방간 질환과 그 진행 형태인 비알콜성 지방간염의 현재 표준 진단 방법은 주로 간 조직을 채취하는 간 생검에 의존하고 있어 환자의 위험 부담이 크며, 질병의 진행 단계를 추적하는 데 어려움이 있었다.
우리 대학 생명과학과 전상용 교수와 바이오및뇌공학과 박성홍 교수 공동연구팀이 활성산소에 반응해 자기공명영상(MRI) 신호가 증강되는 MRI 영상 조영제를 개발했고 한 번의 MRI 촬영으로 손쉽게 비알콜성 지방간염의 진행 정도를 모니터링하고 진단하는 기술을 세계 최초로 개발했다고 2일 밝혔다.
비알콜성 지방간염은 간세포 손상, 염증, 그리고 최종적으로 간경화로 진행될 수 있는 질환으로, 간 내 활성산소 수준의 증가와 밀접한 관련이 있다. 활성산소는 간세포의 산화 스트레스를 유발하고, 비알콜성 지방간염의 진행을 촉진하는 주요 요인 중 하나로 알려져 있다.
이에 착안해 연구팀은 비알콜성 지방간염의 진행을 비침습적으로 모니터링할 수 있는 새로운 방법을 모색하고자 했다. 특히, 간 내 활성산소 양 변화에 반응해 MRI 신호를 강화할 수 있는 망간 이온 결합 빌리루빈 나노입자를 개발하고, 이를 활용하여 비알콜성 지방간염의 진행 상태를 정밀하게 추적할 수 있는 기술을 연구했다.
망간 이온 결합 빌리루빈 나노입자는 간 내 활성산소 증가에 따라 MRI 신호를 증폭했고 연구팀은‘유사 3-구획 모델’을 통해 한 번의 MRI 촬영으로 비알콜성 지방간염의 진행 정도를 결정할 수 있었다. 이를 통해 비알콜성 지방간염의 초기 단계부터 간경화에 이르기까지 간 질환의 진행 상태를 연속적으로 모니터링 할 수 있었다.
연구팀은 다양한 실험을 통해 망간 이온 결합 빌리루빈 나노입자가 간 질환 모델 마우스에서 활성산소 양의 변화에 민감하게 반응해 MRI 신호의 강도를 조절하는 것을 확인했다. 이러한 발견은 간 질환의 진행 상태를 정밀하게 파악할 수 있게 함으로써, 환자 개개인에 맞춘 맞춤형 치료 전략 수립에 크게 기여할 수 있을 것으로 기대된다. 더 나아가, 이 기술은 비침습적이라는 점에서 환자의 부담을 크게 줄여주며, 장기적으로는 간 질환 관리 및 치료의 효율성을 높일 수 있을 것으로 전망된다.
전상용 교수는 “이번 연구를 통해 개발된 새로운 MRI 조영제와 영상해석 모델을 사용함으로써 기존에 표준 진단으로 사용하던 환자들에게 위험한 간 생검을 대체할 수 있을 것으로 기대한다”며, “또한, 병원에서 쉽게 접할 수 있는 대표적인 영상 장비인 MRI로 비알콜성 지방간염의 진행 상태 및 간경화로의 전이되는 단계를 손쉽게 진단할 수 있어 지방간염 약물의 효능을 평가하는 데 필수적인 진단 장비가 될 수 있을 것이므로 효율적인 지방간염 치료제 개발에 기여할 수 있을 것으로 기대한다”라고 말했다.
우리 대학 생명과학과 정원식 박사 및 바이오및뇌공학과 무하메드 아사두딘(Muhammad Asaduddin) 박사가 공동 제1 저자로 참여한 이번 연구는 재료과학 분야 최정상급 학술지인 `어드밴스드 머터리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 온라인판에 지난 3월 9일 字 게재됐다.
(https://doi.org/10.1002/adma.202305830 논문명: Longitudinal Magnetic Resonance Imaging with ROS-Responsive Bilirubin Nanoparticles Enables Monitoring of Non-Alcoholic Steatohepatitis Progression to Cirrhosis).
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 기초연구실지원사업(뇌척수액 순환 기반 뇌인지기능 기초연구실)의 지원을 받아 수행됐다.
2024.04.02 조회수 7394 -
 나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 6860
나노입자로 염증부터 면역치료까지 가능
최근 서구화된 식습관, 유전 및 여러 환경 요인에 의해 장에서 발생하는 만성 염증을 일으키는 염증성 장 질환 환자가 우리나라에서 지속적으로 늘어나는 추세이지만, 여전히 효과적인 치료제 개발이 미흡한 상황이다.
우리 대학 생명과학과 전상용, 조병관 교수 공동연구팀이 경구투여 시 염증성 장에서 과도하게 활성화된 대식세포를 표적 할 수 있는 키토산-빌리루빈 (Bilirubin) 나노입자를 개발했다고 21일 밝혔다.
빌리루빈은 헤모글로빈이 분해될 때 나오는 물질로 염증에서 발생하는 활성산소에 대해 강력한 환원력(scavenging effect)을 가지며, 이로 인해 항염증성 효과가 탁월해 약물 개발로의 시도가 지속되고 있다. 그러나 빌리루빈 자체의 소수성 특성(hydrophobicity)에 의해 임상 단계에서의 직접적인 활용이 어렵다.
연구팀은 빌리루빈을 체내, 특히 경구투여로 전달할 수 있도록 점막부착성과 수용성 성질을 동시에 지니는 저분자량 수용성 키토산(Low molecular weight water soluble chitosan, LMWC)과 결합해 키토산-빌리루빈 나노입자(LMWC-BRNPs)를 합성하는 데 성공했다.
특히 키토산-빌리루빈 나노입자는 기존 염증성 장 질환 치료제로 사용되고 있는 비스테로이드 계열 항염증(non-steroidal anti-inflammatory agent, NSAID) 약물 중 하나인 아미노살리실리산(5-Aminosalicylic acid, 5-ASA) 대비 탁월한 장 기능 정상화 효과를 보였으며, 경구투여 시 점막층과의 정전기적 인력(Electrostatic interaction)으로 장벽 안으로 흡수됨으로써 기존 경구용 치료제 대비 강력한 점막 부착성을 보였다. 또한 염증성 대식세포에 의해 흡수되어 이들의 활성을 저해시켜 염증성 장 질환의 주요 염증성 사이토카인(Pro-inflammatory cytokine)과 활성 산소종(reactive oxygen species, ROS) 분비를 줄이고, 염증성 조력 Th17 세포 대비 면역 조절 T 세포 (Regulatory T cell) 비율을 조절함으로써 망가진 장내 면역 항상성을 되돌리는 효능을 보였다.
연구팀은 마지막으로 키토산-빌리루빈 나노입자가 장내 흡수 시 염증에 의해 유발되는 장내 미생물 패턴 변화를 막아 염증성 박테리아 중 하나인 ‘튜리시박터(Turicibacter)’의 증식을 억제하며, 세 가지 핵심 유산균인 ‘서터렐라(Sutterella)’, ‘오실로스피라(Oscillospira)’, ‘락토바실러스(Lactobacillus)’의 수를 유지하는 효능을 동물 실험을 통해 밝힘으로써, 본 나노입자가 단순히 염증만 저해하는 기존 치료제를 뛰어넘는 우수한 나노 의약(Nanomedicine)으로 개발될 수 있음을 강조했다.
우리 대학 생명과학과 아피아 박사과정생, 신종오 박사(현 캘리포니아대학교 샌디에이고캠퍼스 박사후 연구원)가 공동 제1 저자로 참여한 이번 연구는 나노-재료공학 분야 저명 학술지인 ‘ACS 나노(Nano)’ (ISSN: 1936-0851 print, 1936-086X online, Impact factor: 18.027) 5월 25일 온라인판에 게재됐다. (https://pubs.acs.org/doi/10.1021/acsnano.3c03252. 논문명: Bilirubin Nanomedicine Rescues Intestinal Barrier Destruction and Restores Mucosal Immunity in Colitis)
전상용 교수는 “ 이번 연구결과로 단순히 염증만 저해하는 기존 치료법을 뛰어넘는, 장내 미생물 환경을 효과적으로 조절 및 무너진 면역반응을 정상화하는 우수한 나노의약으로 개발될 수 있음을 제시하였다. 이로써, 나노입자 기반의 장 질환 치료법에 대한 새로운 가능성을 보여주었다” 고 말했다.
한편, 이번 연구는 한국연구재단의 ‘리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단)’ 및 대한민국 ‘바이오 위대한 도전 사업’의 지원을 받아 수행됐다.
2023.06.21 조회수 6860 -
 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 12281
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 12281 -
 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 25325
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 25325 -
 전상용 교수, 펩타이드-항체 하이브리드 항암제 기반기술 개발
〈 전상용 교수, 유병준 박사과정 〉
우리 대학 생명과학과 전상용 교수와 서울대학교 의과대학 정준호 교수 공동 연구팀이 암 치료를 위한 새로운 펩타이드-항체 복합체(하이브리드) 기술을 개발했다.
연구팀은 두 가지 암 표적에 결합하는 펩타이드를 니코틴의 대사체인 코티닌에 항체와 복합체 형태로 형성함으로써 항암 펩타이드의 약효 지속기간을 늘리는 동시에 암 조직 침투 효능을 높여 효과적으로 암 치료가 가능함을 증명했다.
유병준 박사과정이 1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 ‘앙게반테 케미(Angewandte chemi)’ 1월 26일자 온라인판에 게재됐다 (논문명 : A Hybrid Platform Based on a Bispecific Peptide–Antibody Complex for Targeted Cancer Therapy).
펩타이드 의약품은 상대적으로 크기가 작아 신장을 통해 빠르게 제거돼 혈중 반감기가 짧다. 이로 인해 약효가 반감되거나 약을 자주 투여해야 하는 한계가 있다. 항체 의약품은 혈중 반감기는 길지만 크기가 커 암 조직의 깊은 곳까지 전달되지 않아서 약효가 충분히 발휘하지 못한다.
연구팀은 문제 해결을 위해 새로운 형태의 펩타이드-항체 복합체를 개발했다. 암 조직에 특이적으로 발현되는 표적에 결합하는 펩타이드와 혈관 형성 물질을 억제하는 펩타이드, 그리고 코티닌의 결합체를 합성했다. 이를 항 코티닌 항체와 함께 섞어 두 가지 표적에 특이적인 펩타이드-항원 복합체를 만들었다.
이 결합체는 펩타이드의 암 조직 특이적 결합 및 혈관 형성 물질을 저해하는 특성을 보존하면서도 펩타이드 형태 대비 약 20배 증가한 혈중 반감기를 보였다.
연구팀은 쥐를 이용한 암 동물모델에 투여했을 때 암 조직에 특이적으로 축적되고 표적 부위에서 펩타이드가 항체에서 분리돼 나와 암 조직의 깊은 곳까지 분포하는 것을 확인했다. 이러한 특징을 통해 효과적으로 암의 성장을 억제할 수 있음을 증명했다.
전상용 교수는 “암 치료를 위한 새로운 형태의 펩타이드-항원 복합체 플랫폼을 개발했다”라며 “기존 펩타이드와 항체 의약품이 가지는 한계를 극복할 수 있는 하나의 새로운 플랫폼으로서 향후 다양한 펩타이드 의약품에 적용해 효과적인 암 치료제를 개발하는데 기여할 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단의 리더연구사업 및 글로벌박사펠로우십의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 두 가지 표적에 특이적인 펩타이드-항체 복합체의 모식도
2019.02.18 조회수 11751
전상용 교수, 펩타이드-항체 하이브리드 항암제 기반기술 개발
〈 전상용 교수, 유병준 박사과정 〉
우리 대학 생명과학과 전상용 교수와 서울대학교 의과대학 정준호 교수 공동 연구팀이 암 치료를 위한 새로운 펩타이드-항체 복합체(하이브리드) 기술을 개발했다.
연구팀은 두 가지 암 표적에 결합하는 펩타이드를 니코틴의 대사체인 코티닌에 항체와 복합체 형태로 형성함으로써 항암 펩타이드의 약효 지속기간을 늘리는 동시에 암 조직 침투 효능을 높여 효과적으로 암 치료가 가능함을 증명했다.
유병준 박사과정이 1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 ‘앙게반테 케미(Angewandte chemi)’ 1월 26일자 온라인판에 게재됐다 (논문명 : A Hybrid Platform Based on a Bispecific Peptide–Antibody Complex for Targeted Cancer Therapy).
펩타이드 의약품은 상대적으로 크기가 작아 신장을 통해 빠르게 제거돼 혈중 반감기가 짧다. 이로 인해 약효가 반감되거나 약을 자주 투여해야 하는 한계가 있다. 항체 의약품은 혈중 반감기는 길지만 크기가 커 암 조직의 깊은 곳까지 전달되지 않아서 약효가 충분히 발휘하지 못한다.
연구팀은 문제 해결을 위해 새로운 형태의 펩타이드-항체 복합체를 개발했다. 암 조직에 특이적으로 발현되는 표적에 결합하는 펩타이드와 혈관 형성 물질을 억제하는 펩타이드, 그리고 코티닌의 결합체를 합성했다. 이를 항 코티닌 항체와 함께 섞어 두 가지 표적에 특이적인 펩타이드-항원 복합체를 만들었다.
이 결합체는 펩타이드의 암 조직 특이적 결합 및 혈관 형성 물질을 저해하는 특성을 보존하면서도 펩타이드 형태 대비 약 20배 증가한 혈중 반감기를 보였다.
연구팀은 쥐를 이용한 암 동물모델에 투여했을 때 암 조직에 특이적으로 축적되고 표적 부위에서 펩타이드가 항체에서 분리돼 나와 암 조직의 깊은 곳까지 분포하는 것을 확인했다. 이러한 특징을 통해 효과적으로 암의 성장을 억제할 수 있음을 증명했다.
전상용 교수는 “암 치료를 위한 새로운 형태의 펩타이드-항원 복합체 플랫폼을 개발했다”라며 “기존 펩타이드와 항체 의약품이 가지는 한계를 극복할 수 있는 하나의 새로운 플랫폼으로서 향후 다양한 펩타이드 의약품에 적용해 효과적인 암 치료제를 개발하는데 기여할 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단의 리더연구사업 및 글로벌박사펠로우십의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 두 가지 표적에 특이적인 펩타이드-항체 복합체의 모식도
2019.02.18 조회수 11751 -
 전상용, 이대엽, 임성갑 교수, 암 줄기세포 제작 원천기술 개발
우리 대학 생명과학과 전상용, 이대엽 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 특수 고분자박막을 이용해 3차원 암 줄기세포 스페로이드(spheroids)를 손쉽게 제작할 수 있는 세포배양 플랫폼을 개발했다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법’을 이용한 고분자 박막을 형성해 암 줄기세포를 제작하는 데 성공했다. 이번 연구를 통해 암 줄기세포 기초 연구 및 약물 개발 플랫폼의 원천 기술을 제공할 수 있을 것으로 기대된다.
최민석, 최윤정 박사, 유승정 박사과정이 공동 1 저자로 참여한 이번 연구는 미국 암학회(AACR) 대표 국제학술지인‘암 연구(Cancer Research)’ 10월 24일자 온라인 판에 게재됐다.(논문명 : Polymer thin film-induced tumor spheroids acquire cancer stem cell-like properties)
암 줄기세포는 항암제에 대한 내재적 저항성을 가져 암의 전이와 재발에 깊이 관여하고 있다. 그러나 종양 안에 극히 일부 존재하기 때문에 지금까지는 다양한 암 줄기세포의 대량 확보가 어려워 암 연구 및 약물 개발에 제약이 있었다. 생체 내에서 암은 3차원 조직 덩어리 형태로 존재하므로 암 줄기세포를 스페로이드 형태로 배양하는 연구가 필요하다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용해 세포배양 기판 위에 특정 고분자 (pV4D4)박막을 형성했다.
그 위에 다양한 암세포를 배양한 결과 암세포들이 고분자박막 표면으로부터 자극을 받아 서로 뭉치면서 3차원 스페로이드 형태를 만들었고, 이와 동시에 항암제에 대한 저항성을 가진 종양 암 줄기세포로 변화하는 것을 확인했다.
연구팀은 이러한 ‘표면자극 유도 암 줄기세포(Surface stimuli-induced cancer stem cell-like cell)’를 고효율로 손쉽게 대량 배양하는 데 성공했다.
연구팀은 이번 연구에서 특정 고분자 박막에서 배양된 표면 자극 유도 암 줄기세포 스페로이드가 약 24시간 안에 형성되며 분석결과 암 줄기세포 관련 유전자의 양이 배양시간에 따라 증가함을 발견했다.
연구팀이 개발한 플랫폼을 통해 형성된 암 줄기세포 스페로이드는 실제 항암제를 처리했을 때 뛰어난 약물저항성을 지니고 있음을 확인했다. 또한 종양 동물모델에서 비교그룹에서는 보이지 않았던 다른 장기로 암이 전이되는 것을 확인했다.
연구팀은 전체염기서열분석(Whole-genome sequencing)을 통해 표면 자극 유도 암 줄기세포와 실제 암 환자 암 줄기세포와의 유사성을 확인했다.
전상용 교수는 “이미 시판되고 있는 다양한 종류의 암 세포주들 뿐만 아니라 환자에서 유래한 생체 내 환경과 유사한 3차원 스페로이드 형태로 양질의 암 줄기세포를 고효율로 손쉽게 대량 배양할 수 있는 원천 기술을 개발했다”라며 “향후 암 줄기세포 기초 연구 및 약물 개발의 패러다임을 바꿀 수 있을 것으로 기대한다”라고 말했다.
또한 “나아가 암 줄기세포 제작용 플랫폼 소재에 대한 원천 기술 확보를 통해 거대한 암 관련 의료시장에서의 경제적인 부가가치 창출도 가능할 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성재단의 지원을 받아 수행됐다. 재단에서는 이 연구의 중요성을 높이 평가해 올해 9월부터 후속 과제 사업을 통해 3년 연장 지원을 결정했다.
□ 그림 설명
그림1. 3차원 암줄기세포 스페로이드 형성 모식도
그림2. 형성된 암줄기세포를 이용하여 약물 저항성 확인
2018.11.28 조회수 15356
전상용, 이대엽, 임성갑 교수, 암 줄기세포 제작 원천기술 개발
우리 대학 생명과학과 전상용, 이대엽 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 특수 고분자박막을 이용해 3차원 암 줄기세포 스페로이드(spheroids)를 손쉽게 제작할 수 있는 세포배양 플랫폼을 개발했다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법’을 이용한 고분자 박막을 형성해 암 줄기세포를 제작하는 데 성공했다. 이번 연구를 통해 암 줄기세포 기초 연구 및 약물 개발 플랫폼의 원천 기술을 제공할 수 있을 것으로 기대된다.
최민석, 최윤정 박사, 유승정 박사과정이 공동 1 저자로 참여한 이번 연구는 미국 암학회(AACR) 대표 국제학술지인‘암 연구(Cancer Research)’ 10월 24일자 온라인 판에 게재됐다.(논문명 : Polymer thin film-induced tumor spheroids acquire cancer stem cell-like properties)
암 줄기세포는 항암제에 대한 내재적 저항성을 가져 암의 전이와 재발에 깊이 관여하고 있다. 그러나 종양 안에 극히 일부 존재하기 때문에 지금까지는 다양한 암 줄기세포의 대량 확보가 어려워 암 연구 및 약물 개발에 제약이 있었다. 생체 내에서 암은 3차원 조직 덩어리 형태로 존재하므로 암 줄기세포를 스페로이드 형태로 배양하는 연구가 필요하다.
연구팀은 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용해 세포배양 기판 위에 특정 고분자 (pV4D4)박막을 형성했다.
그 위에 다양한 암세포를 배양한 결과 암세포들이 고분자박막 표면으로부터 자극을 받아 서로 뭉치면서 3차원 스페로이드 형태를 만들었고, 이와 동시에 항암제에 대한 저항성을 가진 종양 암 줄기세포로 변화하는 것을 확인했다.
연구팀은 이러한 ‘표면자극 유도 암 줄기세포(Surface stimuli-induced cancer stem cell-like cell)’를 고효율로 손쉽게 대량 배양하는 데 성공했다.
연구팀은 이번 연구에서 특정 고분자 박막에서 배양된 표면 자극 유도 암 줄기세포 스페로이드가 약 24시간 안에 형성되며 분석결과 암 줄기세포 관련 유전자의 양이 배양시간에 따라 증가함을 발견했다.
연구팀이 개발한 플랫폼을 통해 형성된 암 줄기세포 스페로이드는 실제 항암제를 처리했을 때 뛰어난 약물저항성을 지니고 있음을 확인했다. 또한 종양 동물모델에서 비교그룹에서는 보이지 않았던 다른 장기로 암이 전이되는 것을 확인했다.
연구팀은 전체염기서열분석(Whole-genome sequencing)을 통해 표면 자극 유도 암 줄기세포와 실제 암 환자 암 줄기세포와의 유사성을 확인했다.
전상용 교수는 “이미 시판되고 있는 다양한 종류의 암 세포주들 뿐만 아니라 환자에서 유래한 생체 내 환경과 유사한 3차원 스페로이드 형태로 양질의 암 줄기세포를 고효율로 손쉽게 대량 배양할 수 있는 원천 기술을 개발했다”라며 “향후 암 줄기세포 기초 연구 및 약물 개발의 패러다임을 바꿀 수 있을 것으로 기대한다”라고 말했다.
또한 “나아가 암 줄기세포 제작용 플랫폼 소재에 대한 원천 기술 확보를 통해 거대한 암 관련 의료시장에서의 경제적인 부가가치 창출도 가능할 것으로 기대한다”라고 말했다.
이번 연구는 삼성전자 미래기술육성재단의 지원을 받아 수행됐다. 재단에서는 이 연구의 중요성을 높이 평가해 올해 9월부터 후속 과제 사업을 통해 3년 연장 지원을 결정했다.
□ 그림 설명
그림1. 3차원 암줄기세포 스페로이드 형성 모식도
그림2. 형성된 암줄기세포를 이용하여 약물 저항성 확인
2018.11.28 조회수 15356 -
 전상용 교수, 건선,아토피 치료용 펩타이드 개발
우리 대학 생명과학과 전상용 교수 연구팀이 피부 전달을 통해 건선을 치료할 수 있는 펩타이드 치료제를 개발했다.
연구팀은 수 년 전 발견한 펩타이드를 나노입자로 제작해 피부를 통해 전달함으로써 동물 모델에서 건선을 치료하는 데 성공했다.
김진용 박사가 1저자로 참여한 이번 연구는 나노분야 국제 학술지 ‘에이시에스 나노(ACS Nano)’ 6월 27일자 온라인 판에 게재됐다.(논문명 :Nanoparticle-Assisted Transcutaneous Delivery of a Signal Transducer and Activator of Transcription 3-Inhibiting Peptide Ameliorates Psoriasis-like Skin Inflammation)
건선은 대표적인 만성 염증성 피부질환으로 전 세계 성인의 약 3%가 앓고 있는 자가 면역질환 중 하나이다. 최근 건선의 원인에 STAT3라는 단백질이 핵심 역할을 한다는 사실이 밝혀졌다.
연구팀은 수 년 전 STAT3라는 단백질의 기능을 저하시킬 수 있는 펩타이드를 최초로 발견해 항암 치료제로 개발한 바 있다. 그러나 건선 피부는 각질층이 매우 두껍기 때문에 피부를 통해 펩타이드를 투과시켜 표적 약물 치료를 하는 데에는 기술적인 한계가 존재했다.
연구팀은 이번 연구에서 길이가 서로 다른 두 개의 인지질과 STAT3 억제 펩타이드가 특정 조건에서 약 30나노미터 크기의 매우 작은 원반 모양의 나노입자를 안정적으로 형성함을 발견했다.
연구팀은 특수 지질성분으로 이뤄진 제형(劑形)을 통해 수십 나노미터 크기의 원판형 나노입자로 이뤄진 STAT3 억제용 펩타이드를 제조했다.
연구팀이 개발한 STAT3 억제 펩타이드는 건선 피부를 가진 동물 모델에 투여했을 때 뛰어난 항염증 효과를 보였고, 건선 발병의 핵심 요소인 각질세포의 과증식과 염증성 싸이토카인인 IL-17 등의 분비를 막는 역할을 했다.
연구팀은 의과학대학원 김필한 교수와의 공동 연구를 통해 펩타이드가 피부 속으로 얼마나 깊이 투과되는지 관찰했고, 이를 통해 나노입자가 각질층을 통과해 진피층 상부까지 전달됨을 확인했다.
전상용 교수는 “STAT3 억제 앱타이드가 난치성 염증성 피부질환인 건선에 대해 우수한 치료 효과를 보이는 바이오 신약 후보물질이 될 수 있음을 확인했다.”며 “효율적인 피부 전달이 가능한 시스템을 구축했다는 점에서 큰 의미가 있으며 향후 임상 적용이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 글로벌연구실사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 앱타이드-지질 나노복합체의 건선 유발 생쥐 귀 모델에서의 치료효능 평가
그림2. 앱타이드-지질 나노복합체의 건선 유발 생쥐모델에서의 피부투과 효능 평가
2018.07.17 조회수 19430
전상용 교수, 건선,아토피 치료용 펩타이드 개발
우리 대학 생명과학과 전상용 교수 연구팀이 피부 전달을 통해 건선을 치료할 수 있는 펩타이드 치료제를 개발했다.
연구팀은 수 년 전 발견한 펩타이드를 나노입자로 제작해 피부를 통해 전달함으로써 동물 모델에서 건선을 치료하는 데 성공했다.
김진용 박사가 1저자로 참여한 이번 연구는 나노분야 국제 학술지 ‘에이시에스 나노(ACS Nano)’ 6월 27일자 온라인 판에 게재됐다.(논문명 :Nanoparticle-Assisted Transcutaneous Delivery of a Signal Transducer and Activator of Transcription 3-Inhibiting Peptide Ameliorates Psoriasis-like Skin Inflammation)
건선은 대표적인 만성 염증성 피부질환으로 전 세계 성인의 약 3%가 앓고 있는 자가 면역질환 중 하나이다. 최근 건선의 원인에 STAT3라는 단백질이 핵심 역할을 한다는 사실이 밝혀졌다.
연구팀은 수 년 전 STAT3라는 단백질의 기능을 저하시킬 수 있는 펩타이드를 최초로 발견해 항암 치료제로 개발한 바 있다. 그러나 건선 피부는 각질층이 매우 두껍기 때문에 피부를 통해 펩타이드를 투과시켜 표적 약물 치료를 하는 데에는 기술적인 한계가 존재했다.
연구팀은 이번 연구에서 길이가 서로 다른 두 개의 인지질과 STAT3 억제 펩타이드가 특정 조건에서 약 30나노미터 크기의 매우 작은 원반 모양의 나노입자를 안정적으로 형성함을 발견했다.
연구팀은 특수 지질성분으로 이뤄진 제형(劑形)을 통해 수십 나노미터 크기의 원판형 나노입자로 이뤄진 STAT3 억제용 펩타이드를 제조했다.
연구팀이 개발한 STAT3 억제 펩타이드는 건선 피부를 가진 동물 모델에 투여했을 때 뛰어난 항염증 효과를 보였고, 건선 발병의 핵심 요소인 각질세포의 과증식과 염증성 싸이토카인인 IL-17 등의 분비를 막는 역할을 했다.
연구팀은 의과학대학원 김필한 교수와의 공동 연구를 통해 펩타이드가 피부 속으로 얼마나 깊이 투과되는지 관찰했고, 이를 통해 나노입자가 각질층을 통과해 진피층 상부까지 전달됨을 확인했다.
전상용 교수는 “STAT3 억제 앱타이드가 난치성 염증성 피부질환인 건선에 대해 우수한 치료 효과를 보이는 바이오 신약 후보물질이 될 수 있음을 확인했다.”며 “효율적인 피부 전달이 가능한 시스템을 구축했다는 점에서 큰 의미가 있으며 향후 임상 적용이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 글로벌연구실사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 앱타이드-지질 나노복합체의 건선 유발 생쥐 귀 모델에서의 치료효능 평가
그림2. 앱타이드-지질 나노복합체의 건선 유발 생쥐모델에서의 피부투과 효능 평가
2018.07.17 조회수 19430 -
 전상용 교수, 인체 담석형성반응 이용한 항암치료 시스템 개발
〈 전상용 교수, 이동윤 박사과정 〉
우리 대학 생명과학과 전상용 교수 연구팀이 인간 체내의 물질을 이용해 광학영상 진단 및 광열 치료가 가능한 항암시스템을 개발했다.
연구팀은 빌리루빈이라는 체내 물질과 그 빌리루빈으로 인해 발생하는 담석형성반응을 응용했다. 인체 내 강력한 항산화제인 빌리루빈의 담석 형성 과정에서 관찰되는 자체 금속 결합 기능과 신생아 황달 치료에 쓰이는 푸른빛에 반응하는 성질을 동시에 이용했다.
이를 통해 높은 생체 적합성과 우수한 광음향 진단 기능 및 광열 치료 효능을 보여 항암 치료 분야에서 적합한 치료 시스템이 될 것으로 기대된다.
이동윤 박사과정이 1저자로 참여한 이번 연구는 응용화학분야 저명학술지 앙케반테 케미(Angewandte Chemie International Edition) 9월 4일자 온라인 판에 게재됐다.
전 교수 연구팀은 과거 연구에서 물과 화합하지 않는 소수성을 갖는 빌리루빈과, 그 반대로 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’ 기반의 나노입자 시스템을 개발한 경험이 있다.
이는 빌리루빈의 항산화 기능을 그대로 유지하면서 체내로 축적되지 않게 해 빌리루빈의 장점만을 취하는 기술이다. 이를 바탕으로 염증성 장 질환, 허혈/재관류, 췌도세포 이식, 천식 등의 동물 질병 모델에서 효능 및 안정성을 확인했다.
이번 연구에서는 앞선 연구의 접근 방식과 다르게 빌리루빈이 갖고 있는 다른 물리 화학적 성질을 이용해 항암 치료에 적용했다.
먼저 황달의 주요 원인체인 노란색 빌리루빈에 특정 파장대의 빛(푸른 빛)을 쬐어주면 이에 반응해 광이성질체(빛에 의해 모양이 변형된 물체)가 되고 배설이 활성화돼 신생아 황달 치료에 널리 쓰일 수 있는 광학물질인 점을 첫 번째 근거로 활용했다.
두 번째로는 인체 내의 쓸개관 혹은 쓸개 등에서 병이 생길 때 종종 발견할 수 있는 검은 색소 담석의 주성분 또한 빌리루빈이라는 점에 주목했다. 빌리루빈이 칼슘이나 구리 등 양이온과 중간 매개체 없이도 결합할 때 검은 색소 담석이 형성되는 점을 응용했다.
연구팀은 구리나 칼슘 대신 시스플라틴이라는 백금 금속 기반 항암제와 빌리루빈을 결합해 노란색의 빌리루빈을 보라색의 복합체로 변환시켰다.
이후 근적외선 파장대의 빛을 쬐었을 때 기존에 비해 크게 향상된 광감응성을 보였고, 실제 정맥 주사된 대장암 동물 모델에서도 종양 부분에서의 유의미한 광음향 신호 증가를 확인했다. 이 기술로 향후 더 향상된 종양 진단을 할 수 있을 것으로 기대된다.
또한 종양 부위에 근적외선 빛을 쬐었을 때 광열 효과에 의해 5분 내에 25℃ 이상의 온도 상승을 확인했고, 2주 후 다른 그룹에 비해 종양 크기의 감소 및 괴사를 확인했다.
전 교수는 “현재 개발된 물질들은 생체 적합성이 낮고 잠재적 생체 독성 가능성이 있는 인공소재 위주이기 때문에 임상으로 이어지는 데 한계가 있었다”며 “이번에 개발한 인체 유래 빌리루빈 기반의 광학물질은 광음향 영상 및 광열 치료의 전임상 중개연구 및 임상 적용에 새로운 플랫폼이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈의 담석형성반응 및 광감응성을 이용한 본 연구의 모식도
그림2. 빌리루빈 나노입자 (왼쪽)와 시스플라틴이 결합된 빌리루빈 나노입자 (오른쪽) 수용액
2017.09.20 조회수 21506
전상용 교수, 인체 담석형성반응 이용한 항암치료 시스템 개발
〈 전상용 교수, 이동윤 박사과정 〉
우리 대학 생명과학과 전상용 교수 연구팀이 인간 체내의 물질을 이용해 광학영상 진단 및 광열 치료가 가능한 항암시스템을 개발했다.
연구팀은 빌리루빈이라는 체내 물질과 그 빌리루빈으로 인해 발생하는 담석형성반응을 응용했다. 인체 내 강력한 항산화제인 빌리루빈의 담석 형성 과정에서 관찰되는 자체 금속 결합 기능과 신생아 황달 치료에 쓰이는 푸른빛에 반응하는 성질을 동시에 이용했다.
이를 통해 높은 생체 적합성과 우수한 광음향 진단 기능 및 광열 치료 효능을 보여 항암 치료 분야에서 적합한 치료 시스템이 될 것으로 기대된다.
이동윤 박사과정이 1저자로 참여한 이번 연구는 응용화학분야 저명학술지 앙케반테 케미(Angewandte Chemie International Edition) 9월 4일자 온라인 판에 게재됐다.
전 교수 연구팀은 과거 연구에서 물과 화합하지 않는 소수성을 갖는 빌리루빈과, 그 반대로 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’ 기반의 나노입자 시스템을 개발한 경험이 있다.
이는 빌리루빈의 항산화 기능을 그대로 유지하면서 체내로 축적되지 않게 해 빌리루빈의 장점만을 취하는 기술이다. 이를 바탕으로 염증성 장 질환, 허혈/재관류, 췌도세포 이식, 천식 등의 동물 질병 모델에서 효능 및 안정성을 확인했다.
이번 연구에서는 앞선 연구의 접근 방식과 다르게 빌리루빈이 갖고 있는 다른 물리 화학적 성질을 이용해 항암 치료에 적용했다.
먼저 황달의 주요 원인체인 노란색 빌리루빈에 특정 파장대의 빛(푸른 빛)을 쬐어주면 이에 반응해 광이성질체(빛에 의해 모양이 변형된 물체)가 되고 배설이 활성화돼 신생아 황달 치료에 널리 쓰일 수 있는 광학물질인 점을 첫 번째 근거로 활용했다.
두 번째로는 인체 내의 쓸개관 혹은 쓸개 등에서 병이 생길 때 종종 발견할 수 있는 검은 색소 담석의 주성분 또한 빌리루빈이라는 점에 주목했다. 빌리루빈이 칼슘이나 구리 등 양이온과 중간 매개체 없이도 결합할 때 검은 색소 담석이 형성되는 점을 응용했다.
연구팀은 구리나 칼슘 대신 시스플라틴이라는 백금 금속 기반 항암제와 빌리루빈을 결합해 노란색의 빌리루빈을 보라색의 복합체로 변환시켰다.
이후 근적외선 파장대의 빛을 쬐었을 때 기존에 비해 크게 향상된 광감응성을 보였고, 실제 정맥 주사된 대장암 동물 모델에서도 종양 부분에서의 유의미한 광음향 신호 증가를 확인했다. 이 기술로 향후 더 향상된 종양 진단을 할 수 있을 것으로 기대된다.
또한 종양 부위에 근적외선 빛을 쬐었을 때 광열 효과에 의해 5분 내에 25℃ 이상의 온도 상승을 확인했고, 2주 후 다른 그룹에 비해 종양 크기의 감소 및 괴사를 확인했다.
전 교수는 “현재 개발된 물질들은 생체 적합성이 낮고 잠재적 생체 독성 가능성이 있는 인공소재 위주이기 때문에 임상으로 이어지는 데 한계가 있었다”며 “이번에 개발한 인체 유래 빌리루빈 기반의 광학물질은 광음향 영상 및 광열 치료의 전임상 중개연구 및 임상 적용에 새로운 플랫폼이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈의 담석형성반응 및 광감응성을 이용한 본 연구의 모식도
그림2. 빌리루빈 나노입자 (왼쪽)와 시스플라틴이 결합된 빌리루빈 나노입자 (오른쪽) 수용액
2017.09.20 조회수 21506 -
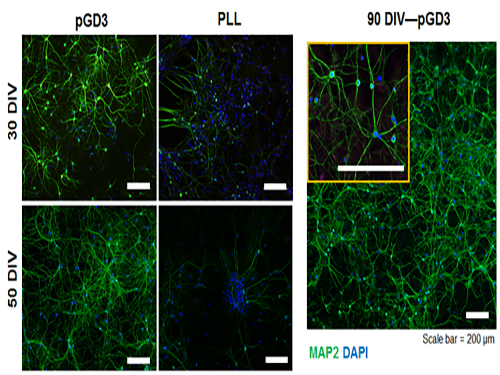 전상용, 임성갑 교수, 신경세포의 안정적 배양 가능한 플랫폼 개발
우리 대학 생명과학과 전상용 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 신경세포를 장기적, 안정적으로 배양할 수 있는 아세틸콜린 유사 고분자 박막 소재를 개발했다.
특히 이 연구는 KAIST의 ‘학부생 연구 참여 프로그램(URP : Undergraduate research program)’을 통해 유승윤 학부생이 참여해 더욱 큰 의미를 갖는다.
유승윤 학부생을 포함해 백지응 박사과정, 최민석 박사가 공동 1저자로 참여한 이번 연구 성과는 나노분야 학술지 ‘에이시에스 나노(ACS Nano)’ 10월 28일자 온라인 판에 게재됐다.
신경세포는 알츠하이머, 파킨슨병, 헌팅턴병 등의 신경퇴행성 질환 및 신경 기반 바이오센서 등 전반적인 신경관련 응용연구에 꼭 필요한 요소이다.
대부분의 신경 질환이 노인성, 퇴행성이기 때문에 신경세포가 오래됐을 때 어떤 현상이 발생하는지 관찰할 수 있어야 한다. 하지만 신경세포는 장기 배양이 어려워 퇴행 상태가 되기 전에 세포가 죽게 돼 관찰이 어려웠다.
기존에는 특정 수용성 고분자(PLL)를 배양접시 위에 코팅하는 방법을 통해 신경세포를 배양했다. 그러나 이 방법은 장기적, 안정적인 세포 배양이 불가능하기 때문에 신경세포를 안정적으로 장기 배양할 수 있는 새로운 플랫폼이 필요하다.
연구팀은 문제 해결을 위해 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용했다. iCVD는 기체 상태의 반응물을 이용해 고분자를 박막 형태로 합성하는 방법으로, 기존 세포 배양 기판 위에 손쉽게 얇고 안정적인 박막을 형성시킬 수 있다.
연구팀은 이러한 기체상 공정의 장점을 이용해 신경세포를 장기적으로 배양할 수 있는 기능을 가진 공중합체 고분자 박막을 합성하는 데 성공했다. 새로 합성된 이 고분자 박막은 신경전달물질로 알려진 아세틸콜린과 유사한 물질로 이뤄져 있다.
또한 신경세포가 고분자 박막에서 배양될 수 있는 최적화된 조건을 발견했고, 이 조건에서 생존에 관여하는 여러 신경관련 유전자를 확인했다.
연구팀은 생명과학과 손종우 교수 연구팀의 도움을 통해 새로 배양된 신경세포가 기존의 신경세포보다 전기생리학적 측면 및 신경전달 기능적 측면에서 안정화됨을 확인했다.
연구팀은 “신경세포를 장기적으로 배양할 수 있는 이 기술은 향후 신경세포를 이용한 바이오센서와 신경세포 칩 개발의 핵심 소재로 활용될 것이다”며 “다양한 신경 관련 질병의 원리를 이해할 수 있는 역할을 할 것으로 기대된다”고 말했다.
이번 연구는 한국보건산업진흥원과 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 본 연구에서 개발된 표면(pGD3) 및 폴리라이신 코팅 위에서 장시간 배양된 신경세포
그림2. 신경전달물질 유사 작용기를 도입한 표면 형성 과정
2016.11.17 조회수 27036
전상용, 임성갑 교수, 신경세포의 안정적 배양 가능한 플랫폼 개발
우리 대학 생명과학과 전상용 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 신경세포를 장기적, 안정적으로 배양할 수 있는 아세틸콜린 유사 고분자 박막 소재를 개발했다.
특히 이 연구는 KAIST의 ‘학부생 연구 참여 프로그램(URP : Undergraduate research program)’을 통해 유승윤 학부생이 참여해 더욱 큰 의미를 갖는다.
유승윤 학부생을 포함해 백지응 박사과정, 최민석 박사가 공동 1저자로 참여한 이번 연구 성과는 나노분야 학술지 ‘에이시에스 나노(ACS Nano)’ 10월 28일자 온라인 판에 게재됐다.
신경세포는 알츠하이머, 파킨슨병, 헌팅턴병 등의 신경퇴행성 질환 및 신경 기반 바이오센서 등 전반적인 신경관련 응용연구에 꼭 필요한 요소이다.
대부분의 신경 질환이 노인성, 퇴행성이기 때문에 신경세포가 오래됐을 때 어떤 현상이 발생하는지 관찰할 수 있어야 한다. 하지만 신경세포는 장기 배양이 어려워 퇴행 상태가 되기 전에 세포가 죽게 돼 관찰이 어려웠다.
기존에는 특정 수용성 고분자(PLL)를 배양접시 위에 코팅하는 방법을 통해 신경세포를 배양했다. 그러나 이 방법은 장기적, 안정적인 세포 배양이 불가능하기 때문에 신경세포를 안정적으로 장기 배양할 수 있는 새로운 플랫폼이 필요하다.
연구팀은 문제 해결을 위해 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용했다. iCVD는 기체 상태의 반응물을 이용해 고분자를 박막 형태로 합성하는 방법으로, 기존 세포 배양 기판 위에 손쉽게 얇고 안정적인 박막을 형성시킬 수 있다.
연구팀은 이러한 기체상 공정의 장점을 이용해 신경세포를 장기적으로 배양할 수 있는 기능을 가진 공중합체 고분자 박막을 합성하는 데 성공했다. 새로 합성된 이 고분자 박막은 신경전달물질로 알려진 아세틸콜린과 유사한 물질로 이뤄져 있다.
또한 신경세포가 고분자 박막에서 배양될 수 있는 최적화된 조건을 발견했고, 이 조건에서 생존에 관여하는 여러 신경관련 유전자를 확인했다.
연구팀은 생명과학과 손종우 교수 연구팀의 도움을 통해 새로 배양된 신경세포가 기존의 신경세포보다 전기생리학적 측면 및 신경전달 기능적 측면에서 안정화됨을 확인했다.
연구팀은 “신경세포를 장기적으로 배양할 수 있는 이 기술은 향후 신경세포를 이용한 바이오센서와 신경세포 칩 개발의 핵심 소재로 활용될 것이다”며 “다양한 신경 관련 질병의 원리를 이해할 수 있는 역할을 할 것으로 기대된다”고 말했다.
이번 연구는 한국보건산업진흥원과 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 본 연구에서 개발된 표면(pGD3) 및 폴리라이신 코팅 위에서 장시간 배양된 신경세포
그림2. 신경전달물질 유사 작용기를 도입한 표면 형성 과정
2016.11.17 조회수 27036 -
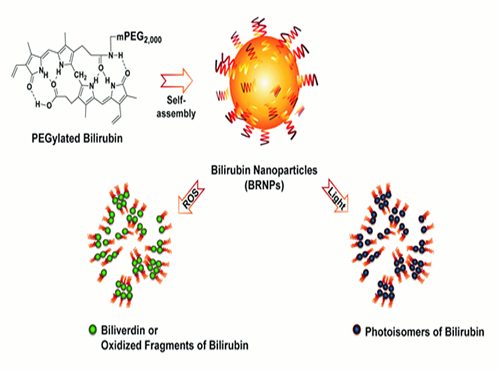 전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18 조회수 18882
전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18 조회수 18882 -
 전상용 교수, 몸 속 물질 이용한 염증 치료제 개발
〈 전 상 용 교수 〉
우리 대학 생명과학과 전상용 교수 연구팀(1저자 이용현 박사)이 신체 내부의 항산화물질을 이용한 새로운 항염증 나노의약품을 개발했다.
빌리루빈이라 불리는 생리활성물질 기반 100나노미터 크기의 나노입자로 이뤄진 이 약품은 만성 및 급성 난치성 염증질환 치료에 쓰일 것으로 기대된다.
이번 연구는 화학분야 저명학술지 ‘앙게반테 케미(Angewandte Chemie international Edition)’ 5월 4일자 온라인 판에 게재됐다.
고분자, 무기 나노입자 등의 많은 나노소재들이 질병 진단 및 치료용 나노의약품으로 개발되고 있다. 그러나 대부분의 약품들은 인공소재로 이뤄져 생분해성 및 생체적합성이 낮다. 이러한 약품들이 신체에 장기간 남을 경우 잠재적인 독성을 유발할 가능성이 있어 실제 임상적용이 되는 예는 소수에 불과하다.
연구팀은 문제 해결을 위해 이미 우리 몸속에 존재하는 항산화 및 면역조절 물질인 빌리루빈을 이용했다. 빌리루빈은 헤모글로빈에 존재하는 산소결합 물질인 헴(Heme)의 최종 대사체이다.
빌리루빈은 노란색 담즙 색소로서 혈중 농도가 높아지면 황달의 원인이 돼 예전에는 쓸데없는 물질로 여겨졌다. 하지만 근래 발표된 역학조사에 따르면 빌리루빈의 혈중 농도가 다소 높으면 심혈관 질환이나 암 발병 가능성이 현저히 낮아진다는 사실이 밝혀졌다.
또한 빌리루빈은 여러 활성산소들을 제거하고 염증과 관련된 면역세포를 조절하는 등의 기능을 해 세포와 조직을 보호한다는 사실이 동물 실험을 통해 확인됐다.
그러나 물에 거의 녹지 않는 특성 때문에 빌리루빈을 실제 치료에 적용하지 못했다. 전 교수 연구팀은 빌리루빈에 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’을 합성해 수용액에서 자가 조립돼 약 100나노미터 직경을 갖는 빌리루빈 나노입자로 재탄생시켰다.
이 빌리루빈 나노입자는 항산화 및 항염증 효능을 그대로 유지하면서 신체에 축적되지 않고 배설돼 빌리루빈의 장점만 갖는 나노의약품이 됐다.
효능 확인을 위해 대표적 난치성 만성 염증 질병인 대장염 모델을 쥐에게 투여한 후 빌리루빈 나노입자를 투여했다. 염증이 형성된 부위에 나노입자가 선택적으로 분포됐고 대장염 진행을 효과적으로 차단했다.
또한 장 길이가 짧아지고 혈변 등의 부작용이 생기는 대조군과 다르게 정상 생쥐와 비슷한 수준으로 회복됐고, 황달 등의 부작용이 발생하지 않아 높은 수준의 항염증 효과를 확인했다.
연구팀은 빌리루빈 나노입자가 대장염 모델 외에도 허혈성 간질환, 천식, 췌장소도세포 이식 동물 모델에서 우수한 효과를 보여 향후 범용 항염증 나노의약품이 될 수 있을 것으로 기대된다고 밝혔다.
연구팀은 “빌리루빈 나노입자는 우리 몸속에 존재하는 생리활성물질과 친수성 고분자가 접합된 간단한 화학물질로 구성됐다”며 “생분해성 및 생체적합성이 높고 대량 생산이 가능해 바로 임상 적용이 가능하다”고 말했다.
전 교수는 “향후 국내외 연구진들과 전임상 및 임상실험을 수행할 예정이다”며 “적절한 치료제가 없는 난치성 염증질환을 치료할 수 있는 새로운 나노의약품을 개발해 환자들의 고통을 덜어주고 싶다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실 및 KAIST 시스템헬스케어 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 형광물질 ICG가 로딩된 빌리루빈 나노입자가 염증조직(대장, Colon)으로 선택적으로 축적됨
그림2. 빌리루빈과 폴리에틸렌 글리콜의 축합방법 및 제조된 빌리루빈 기반 나노입자의 모식도
그림3. 고용량의 빌리루빈 나노의약품이 정맥주사되었을 때, 부작용이 없음을 나타내는 결과
그림4. 빌리루빈 나노입자를 처리한 염증그룹에서는 정상그룹과 비슷해진 대장을 관찰가능
2016.05.19 조회수 17055
전상용 교수, 몸 속 물질 이용한 염증 치료제 개발
〈 전 상 용 교수 〉
우리 대학 생명과학과 전상용 교수 연구팀(1저자 이용현 박사)이 신체 내부의 항산화물질을 이용한 새로운 항염증 나노의약품을 개발했다.
빌리루빈이라 불리는 생리활성물질 기반 100나노미터 크기의 나노입자로 이뤄진 이 약품은 만성 및 급성 난치성 염증질환 치료에 쓰일 것으로 기대된다.
이번 연구는 화학분야 저명학술지 ‘앙게반테 케미(Angewandte Chemie international Edition)’ 5월 4일자 온라인 판에 게재됐다.
고분자, 무기 나노입자 등의 많은 나노소재들이 질병 진단 및 치료용 나노의약품으로 개발되고 있다. 그러나 대부분의 약품들은 인공소재로 이뤄져 생분해성 및 생체적합성이 낮다. 이러한 약품들이 신체에 장기간 남을 경우 잠재적인 독성을 유발할 가능성이 있어 실제 임상적용이 되는 예는 소수에 불과하다.
연구팀은 문제 해결을 위해 이미 우리 몸속에 존재하는 항산화 및 면역조절 물질인 빌리루빈을 이용했다. 빌리루빈은 헤모글로빈에 존재하는 산소결합 물질인 헴(Heme)의 최종 대사체이다.
빌리루빈은 노란색 담즙 색소로서 혈중 농도가 높아지면 황달의 원인이 돼 예전에는 쓸데없는 물질로 여겨졌다. 하지만 근래 발표된 역학조사에 따르면 빌리루빈의 혈중 농도가 다소 높으면 심혈관 질환이나 암 발병 가능성이 현저히 낮아진다는 사실이 밝혀졌다.
또한 빌리루빈은 여러 활성산소들을 제거하고 염증과 관련된 면역세포를 조절하는 등의 기능을 해 세포와 조직을 보호한다는 사실이 동물 실험을 통해 확인됐다.
그러나 물에 거의 녹지 않는 특성 때문에 빌리루빈을 실제 치료에 적용하지 못했다. 전 교수 연구팀은 빌리루빈에 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’을 합성해 수용액에서 자가 조립돼 약 100나노미터 직경을 갖는 빌리루빈 나노입자로 재탄생시켰다.
이 빌리루빈 나노입자는 항산화 및 항염증 효능을 그대로 유지하면서 신체에 축적되지 않고 배설돼 빌리루빈의 장점만 갖는 나노의약품이 됐다.
효능 확인을 위해 대표적 난치성 만성 염증 질병인 대장염 모델을 쥐에게 투여한 후 빌리루빈 나노입자를 투여했다. 염증이 형성된 부위에 나노입자가 선택적으로 분포됐고 대장염 진행을 효과적으로 차단했다.
또한 장 길이가 짧아지고 혈변 등의 부작용이 생기는 대조군과 다르게 정상 생쥐와 비슷한 수준으로 회복됐고, 황달 등의 부작용이 발생하지 않아 높은 수준의 항염증 효과를 확인했다.
연구팀은 빌리루빈 나노입자가 대장염 모델 외에도 허혈성 간질환, 천식, 췌장소도세포 이식 동물 모델에서 우수한 효과를 보여 향후 범용 항염증 나노의약품이 될 수 있을 것으로 기대된다고 밝혔다.
연구팀은 “빌리루빈 나노입자는 우리 몸속에 존재하는 생리활성물질과 친수성 고분자가 접합된 간단한 화학물질로 구성됐다”며 “생분해성 및 생체적합성이 높고 대량 생산이 가능해 바로 임상 적용이 가능하다”고 말했다.
전 교수는 “향후 국내외 연구진들과 전임상 및 임상실험을 수행할 예정이다”며 “적절한 치료제가 없는 난치성 염증질환을 치료할 수 있는 새로운 나노의약품을 개발해 환자들의 고통을 덜어주고 싶다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실 및 KAIST 시스템헬스케어 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 형광물질 ICG가 로딩된 빌리루빈 나노입자가 염증조직(대장, Colon)으로 선택적으로 축적됨
그림2. 빌리루빈과 폴리에틸렌 글리콜의 축합방법 및 제조된 빌리루빈 기반 나노입자의 모식도
그림3. 고용량의 빌리루빈 나노의약품이 정맥주사되었을 때, 부작용이 없음을 나타내는 결과
그림4. 빌리루빈 나노입자를 처리한 염증그룹에서는 정상그룹과 비슷해진 대장을 관찰가능
2016.05.19 조회수 17055