%EC%A1%B0%EA%B4%91%ED%98%84
-
 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 3003
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 3003 -
 암세포 발생 순간 되돌리는 분자스위치 발견
조광현 교수 연구팀은 암세포를 죽이지 않고 그 상태만을 변환시켜 정상 세포와 유사한 상태로 되돌리는 암 가역 치료 원천기술을 개발한 바 있다. 이번에는 정상세포가 암세포로 변화되는 순간의 유전자 네트워크에 암 가역화를 유도할 수 있는 분자스위치가 숨겨져 있음을 최초로 밝히는데 성공하였다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 정상세포에서 암세포로 변화하는 순간의 임계 전이(臨界轉移, critical transition) 현상을 포착하고 이를 분석해 암세포를 다시 정상세포로 되돌릴 수 있는 분자스위치를 발굴하는 기술 개발에 성공했다고 5일 밝혔다.
임계 전이란 물이 섭씨 100도에서 증기로 변하는 것처럼 특정 시점에 갑작스러운 상태변화가 일어나는 현상을 말한다. 정상세포가 유전적, 후성유전적 변화의 축적으로 인해 특정 시점에 암세포로 변화되는 과정에도 이러한 임계 전이 현상이 나타난다.
연구팀은 암 발생 과정에서 정상세포가 암세포로 전환되기 직전, 정상세포와 암세포들이 공존하는 불안정한 임계 전이 상태에 놓일 수 있음을 발견하고 이러한 임계 전이 상태를 시스템생물학 방법으로 분석해 암화 과정을 역전시킬 수 있는 암 가역화 분자스위치 발굴 기술을 개발했다. 그리고 이를 대장암세포에 적용해 암세포가 정상세포의 특징을 회복할 수 있음을 분자세포실험으로 확인했다.
암 발생의 임계 전이를 관장하는 유전자 네트워크의 컴퓨터 모델을 단일세포 유전자 발현 데이터로부터 자동 추론해내고 이를 시뮬레이션 분석해 암 가역화 분자스위치를 체계적으로 찾아내는 원천기술을 개발한 것이어서 향후 다른 암종의 가역 치료제 개발에도 응용될 수 있을 것으로 기대된다.
조광현 교수는 "정상세포가 되돌릴 수 없는 암세포 상태로 변화되기 직전의 임계 전이 순간을 포착해 암세포의 운명을 다시 정상세포 상태로 되돌릴 수 있는 분자스위치를 발굴해 낸 것이다ˮ라고 말했다.
이어 “특히 이번 연구에서는 그동안 수수께끼로 여겨졌던 암 발생 과정 이면의 세포 내에 어떠한 변화가 일어나는지를 유전자 네트워크 차원에서 상세히 밝혀냈다”며 “암세포의 운명을 다시 정상세포로 되돌릴 수 있는 중요한 단서가 바로 이러한 변화의 순간에 숨어있다는 것을 처음으로 규명한 연구다”라고 강조했다.
우리 대학 신동관 박사(現 국립암센터), 공정렬 박사, 정서윤 박사과정 학생 등이 참여했으며 서울대학교 연구팀이 대장암 환자 오가노이드(체외배양조직)를 제공해 진행된 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 1월 22일 字 온라인판 논문으로 출판됐다. (논문명: Attractor landscape analysis reveals a reversion switch in the transition of colorectal tumorigenesis) (DOI: https://doi.org/10.1002/advs.202412503)
한편 이번 연구는 과학기술정보통신부 한국연구재단의 중견연구사업과 기초연구실사업, 그리고 보건복지부 한국보건산업진흥원의 질병중심 중개연구사업의 지원을 통해 수행됐다.
2025.02.05 조회수 8372
암세포 발생 순간 되돌리는 분자스위치 발견
조광현 교수 연구팀은 암세포를 죽이지 않고 그 상태만을 변환시켜 정상 세포와 유사한 상태로 되돌리는 암 가역 치료 원천기술을 개발한 바 있다. 이번에는 정상세포가 암세포로 변화되는 순간의 유전자 네트워크에 암 가역화를 유도할 수 있는 분자스위치가 숨겨져 있음을 최초로 밝히는데 성공하였다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 정상세포에서 암세포로 변화하는 순간의 임계 전이(臨界轉移, critical transition) 현상을 포착하고 이를 분석해 암세포를 다시 정상세포로 되돌릴 수 있는 분자스위치를 발굴하는 기술 개발에 성공했다고 5일 밝혔다.
임계 전이란 물이 섭씨 100도에서 증기로 변하는 것처럼 특정 시점에 갑작스러운 상태변화가 일어나는 현상을 말한다. 정상세포가 유전적, 후성유전적 변화의 축적으로 인해 특정 시점에 암세포로 변화되는 과정에도 이러한 임계 전이 현상이 나타난다.
연구팀은 암 발생 과정에서 정상세포가 암세포로 전환되기 직전, 정상세포와 암세포들이 공존하는 불안정한 임계 전이 상태에 놓일 수 있음을 발견하고 이러한 임계 전이 상태를 시스템생물학 방법으로 분석해 암화 과정을 역전시킬 수 있는 암 가역화 분자스위치 발굴 기술을 개발했다. 그리고 이를 대장암세포에 적용해 암세포가 정상세포의 특징을 회복할 수 있음을 분자세포실험으로 확인했다.
암 발생의 임계 전이를 관장하는 유전자 네트워크의 컴퓨터 모델을 단일세포 유전자 발현 데이터로부터 자동 추론해내고 이를 시뮬레이션 분석해 암 가역화 분자스위치를 체계적으로 찾아내는 원천기술을 개발한 것이어서 향후 다른 암종의 가역 치료제 개발에도 응용될 수 있을 것으로 기대된다.
조광현 교수는 "정상세포가 되돌릴 수 없는 암세포 상태로 변화되기 직전의 임계 전이 순간을 포착해 암세포의 운명을 다시 정상세포 상태로 되돌릴 수 있는 분자스위치를 발굴해 낸 것이다ˮ라고 말했다.
이어 “특히 이번 연구에서는 그동안 수수께끼로 여겨졌던 암 발생 과정 이면의 세포 내에 어떠한 변화가 일어나는지를 유전자 네트워크 차원에서 상세히 밝혀냈다”며 “암세포의 운명을 다시 정상세포로 되돌릴 수 있는 중요한 단서가 바로 이러한 변화의 순간에 숨어있다는 것을 처음으로 규명한 연구다”라고 강조했다.
우리 대학 신동관 박사(現 국립암센터), 공정렬 박사, 정서윤 박사과정 학생 등이 참여했으며 서울대학교 연구팀이 대장암 환자 오가노이드(체외배양조직)를 제공해 진행된 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 1월 22일 字 온라인판 논문으로 출판됐다. (논문명: Attractor landscape analysis reveals a reversion switch in the transition of colorectal tumorigenesis) (DOI: https://doi.org/10.1002/advs.202412503)
한편 이번 연구는 과학기술정보통신부 한국연구재단의 중견연구사업과 기초연구실사업, 그리고 보건복지부 한국보건산업진흥원의 질병중심 중개연구사업의 지원을 통해 수행됐다.
2025.02.05 조회수 8372 -
 암세포를 정상세포로 되돌려 치료하는 원천기술 개발
지금까지 다양한 항암 치료 기술이 개발됐음에도 현재 시행되고 있는 모든 항암치료의 공통점은 암세포를 사멸시켜서 치료하는 것을 목표로 하고 있다. 이로 인해 암세포가 내성을 획득해 재발하거나 정상세포까지 사멸시켜 큰 부작용을 유발하는 등 근본적인 한계를 지니고 있다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암세포를 죽이지 않고 그 상태만을 변환시켜 정상 대장세포와 유사한 상태로 되돌림으로써 부작용 없이 치료할 수 있는 대장암 가역 치료를 위한 원천기술을 개발하였다고 22일 밝혔다.
연구팀은 정상세포의 암화 과정에서 정상적인 세포분화 궤적을 역행한다는 관찰 결과에 주목하고, 이를 기반으로 정상세포의 분화궤적에 대한 유전자네트워크의 디지털트윈을 제작하는 기술을 개발했다.
그리고 이를 시뮬레이션 분석해 정상세포 분화를 유도하는 마스터 분자스위치를 체계적으로 탐색해 발굴한 뒤 대장암세포에 적용했을 때 대장암세포의 상태가 정상화된다는 것을 분자세포 실험과 동물실험을 통해 입증했다.
이번 연구성과는 암세포를 정상세포로 가역화 하는 것이 우연한 현상적 발견에 의존하는 것이 아니라 암세포 유전자 네트워크의 디지털 트윈을 제작하고 분석함으로써 체계적으로 접근해 이루어낼 수 있음을 보인 원천기술 개발이며 이 기술을 다른 다양한 암종에 응용하여 암 가역 치료제 개발이 가능함을 제시한 것에 큰 의미가 있다.
조광현 교수는 "암세포가 정상세포로 변환될 수 있다는 것은 놀라운 현상이다. 이번 성과는 이를 체계적으로 유도해낼 수 있음을 증명한 것이다ˮ라고 말했다.
이어 “이번 연구 결과는 암세포를 정상세포로 되돌리는 가역 치료 개념을 최초로 제시한 성과들을 바탕으로 정상세포의 분화궤적을 체계적으로 분석해 암 가역화 치료타겟을 발굴하는 원천기술을 개발한 것이다”라고 강조했다.
우리 대학 공정렬 박사, 이춘경 박사과정 학생, 김훈민 박사과정 학생, 김주희 박사과정 학생 등이 참여한 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 12월 11일 字 온라인판 논문으로 출판됐다. (논문명: Control of cellular differentiation trajectories for cancer reversion) DOI: https://doi.org/10.1002/advs.202402132
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 통해 수행되었으며 연구 성과는 바이오리버트(주)로 기술이전 되어 실제 암 가역치료제 개발에 활용될 예정이다.
2024.12.23 조회수 10304
암세포를 정상세포로 되돌려 치료하는 원천기술 개발
지금까지 다양한 항암 치료 기술이 개발됐음에도 현재 시행되고 있는 모든 항암치료의 공통점은 암세포를 사멸시켜서 치료하는 것을 목표로 하고 있다. 이로 인해 암세포가 내성을 획득해 재발하거나 정상세포까지 사멸시켜 큰 부작용을 유발하는 등 근본적인 한계를 지니고 있다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암세포를 죽이지 않고 그 상태만을 변환시켜 정상 대장세포와 유사한 상태로 되돌림으로써 부작용 없이 치료할 수 있는 대장암 가역 치료를 위한 원천기술을 개발하였다고 22일 밝혔다.
연구팀은 정상세포의 암화 과정에서 정상적인 세포분화 궤적을 역행한다는 관찰 결과에 주목하고, 이를 기반으로 정상세포의 분화궤적에 대한 유전자네트워크의 디지털트윈을 제작하는 기술을 개발했다.
그리고 이를 시뮬레이션 분석해 정상세포 분화를 유도하는 마스터 분자스위치를 체계적으로 탐색해 발굴한 뒤 대장암세포에 적용했을 때 대장암세포의 상태가 정상화된다는 것을 분자세포 실험과 동물실험을 통해 입증했다.
이번 연구성과는 암세포를 정상세포로 가역화 하는 것이 우연한 현상적 발견에 의존하는 것이 아니라 암세포 유전자 네트워크의 디지털 트윈을 제작하고 분석함으로써 체계적으로 접근해 이루어낼 수 있음을 보인 원천기술 개발이며 이 기술을 다른 다양한 암종에 응용하여 암 가역 치료제 개발이 가능함을 제시한 것에 큰 의미가 있다.
조광현 교수는 "암세포가 정상세포로 변환될 수 있다는 것은 놀라운 현상이다. 이번 성과는 이를 체계적으로 유도해낼 수 있음을 증명한 것이다ˮ라고 말했다.
이어 “이번 연구 결과는 암세포를 정상세포로 되돌리는 가역 치료 개념을 최초로 제시한 성과들을 바탕으로 정상세포의 분화궤적을 체계적으로 분석해 암 가역화 치료타겟을 발굴하는 원천기술을 개발한 것이다”라고 강조했다.
우리 대학 공정렬 박사, 이춘경 박사과정 학생, 김훈민 박사과정 학생, 김주희 박사과정 학생 등이 참여한 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 12월 11일 字 온라인판 논문으로 출판됐다. (논문명: Control of cellular differentiation trajectories for cancer reversion) DOI: https://doi.org/10.1002/advs.202402132
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 통해 수행되었으며 연구 성과는 바이오리버트(주)로 기술이전 되어 실제 암 가역치료제 개발에 활용될 예정이다.
2024.12.23 조회수 10304 -
 암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2024.06.03 조회수 7359
암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2024.06.03 조회수 7359 -
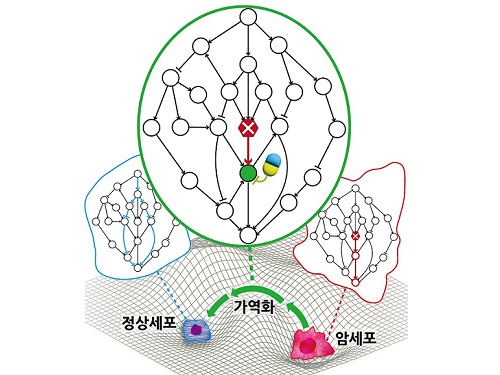 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10456
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10456 -
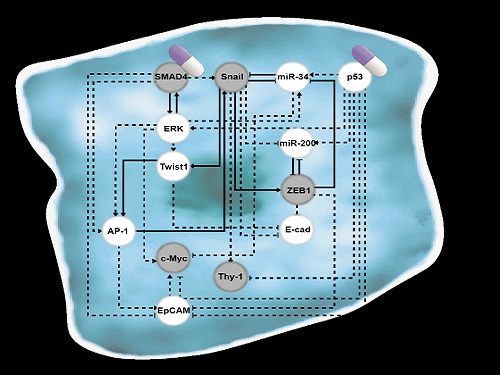 폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 11662
폐암 전이를 막고 치료 가능한 세포로 되돌리는 원천기술 개발
고령화에 따라 암의 발생이 늘어나면서 암은 인류의 건강수명을 위협하는 가장 치명적인 질환이 됐다. 특히 조기 발견을 놓쳐 여러 장기로 전이될 때 암의 치명률은 높아진다. 이러한 문제를 해결하기 위해 암세포의 전이 능력을 제거하거나 낮추려는 시도가 이어졌으나 오히려 중간상태의 불안정한 암세포 상태가 되면서 더욱 악성을 보이게 되어 암 치료의 난제로 남아 있었다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 폐암 세포의 성질을 변환시켜 암세포의 전이를 막고 약물에 대한 저항성을 제거할 수 있는 기술을 개발하는 데 성공했다고 30일 밝혔다.
조광현 교수 연구팀은 폐암 세포의 전이능력이 없는 상피(epithelial, 세포 방향성이 있어 유동성 없이 표면조직을 이루는 상태)세포에서 전이가 가능한 중간엽(mesenchymal, 방향성없이 개별적인 이동성을 가진 상태)세포로 변화되는 천이 과정(epithelial-to-mesenchymal transition, 이하 EMT)에서 나타나는 다양한 암세포 상태들을 나타낼 수 있는 세포의 분자 네트워크 수학모델을 만들었다. 컴퓨터 시뮬레이션 분석과 분자 세포실험을 통해 악성종양으로 증식하여 인접한 조직이나 세포로 침입하거나 약물에 내성을 가진 중간엽세포 상태에서 전이가 되지 않은 상피세포 상태로 다시 바뀔수 있도록 세포의 성질을 변환시켜주는 핵심 조절인자들을 발굴했다.
특히 이 과정에서 그동안 난제로 남아 있었던 중간과정의 불안정한 암세포 상태(EMT 하이브리드 세포 상태)를 피하는 동시에 항암 화학요법(chemotherapy) 치료가 잘 되는 상피세포 상태로 온전히 역전하는 데 성공했다.
우리 대학 김남희 박사과정, 황채영 박사, 김태영 연구원, 김현진 박사과정이 참여한 이번 연구 결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치(Cancer Research)' 1월 30일 字 온라인판 논문으로 출판됐다. (논문명: A cell fate reprogramming strategy reverses epithelial-to-mesenchymal transition of lung cancer cells while avoiding hybrid states)
암세포의 EMT 과정에서 불완전한 천이(변화과정)로 인해 발생하는 EMT 하이브리드 상태의 세포들은 상피세포와 중간엽세포의 특성을 모두 갖고 있으며, 높은 줄기세포능*을 획득해 약물저항성 및 전이 잠재성이 큰 것으로 알려져 있다. 불안정한 암세포 상태(EMT)는 매우 복잡하여 높은 전이 능력과 약물저항성을 가지는 EMT 하이브리드 세포 상태를 회피하면서 암세포를 전이 능력과 약물저항성이 제거된 상피세포 상태로 온전히 역전시키는 것은 매우 어려운 일이었다.
*줄기세포능: 줄기세포가 지속적 자가복제를 할 수 있도록 하는 세포내 신호전달체계
조광현 교수 연구팀은 복잡한 EMT를 지배하는 유전자 조절 네트워크의 수학모델을 정립한 후, 대규모 컴퓨터 시뮬레이션 분석 및 복잡계 네트워크 제어기술을 적용해 중간엽세포 상태인 폐암 세포를 EMT 하이브리드 세포 상태를 회피하면서 전이 능력이 상실된 상피세포 상태로 역전시킬 수 있는 세 개의 핵심 분자 타깃인 ‘p53 (암 억제 단백질)’, ‘SMAD4 (EMT를 조절하는 대표적 신호전달을 매개하는 중심물질로 SMAD 그룹에 포함된 단백질)’와 ‘ERK1/2 (세포의 성장 및 분화에 관여하는 조절인자)’를 발굴하고 이를 분자 세포실험을 통해 검증했다. 이러한 발견은 실제 인체 내 암 조직의 환경에서처럼 자극이 주어진 상황에서 중간엽세포 상태가 상피세포 상태로 역전될 수 있음을 증명해 그 의미가 크다.
암세포의 비정상적인 EMT는 암세포의 이동과 침윤, 화학요법 치료에 대한 반응성 변화, 강화된 줄기세포능, 암의 전이 등 다양한 악성 형질로 이어지게 된다. 특히 암세포의 전이 능력 획득은 암 환자의 예후를 결정짓는 매우 중요한 요소다. 이번에 개발된 폐암 세포의 EMT 역전 기술은 암세포를 리프로그래밍해 높은 가소성과 전이 능력을 제거하고 항암 화학치료의 반응성을 높이도록 하는 새로운 항암 치료 전략이다.
조광현 교수는 "높은 전이 능력과 약물저항성을 획득한 폐암 세포를 전이 능력이 제거되고 항암 화학요법치료에 민감한 상피세포 상태로 온전히 역전시키는 데 성공함으로써 암 환자의 예후를 증진할 수 있는 새로운 치료전략을 제시했다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역 치료원리를 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구 결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 이번 연구 결과는 전이 능력을 획득한 폐암 세포 상태를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 기술 개발의 세 번째 성과다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업 등의 지원으로 수행됐다.
2023.01.30 조회수 11662 -
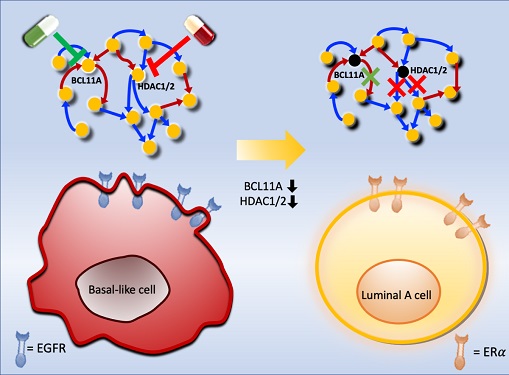 악성 유방암 세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 악성 유방암세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술을 개발하는 데 성공했다고 30일 밝혔다.
연구팀은 유방암 아류 중에서 가장 악성으로 알려진 삼중음성 유방암(basal-like 혹은 triple negative) 환자들과 호르몬 치료가 가능한 루미날-A 유방암(luminal-A) 환자들의 유전자 네트워크를 컴퓨터시뮬레이션을 통해 분석함으로써 삼중음성 유방암세포를 루미날-A 유방암세포로 변환하는데 필요한 핵심 인자를 규명했다. 그리고 이를 조절해 삼중음성 유방암세포를 루미날-A 유방암세포로 리프로그래밍한 뒤 호르몬 치료를 시행하는 새로운 치료 원리를 개발했다.
우리 대학 최새롬 박사과정, 황채영 박사, 이종훈 박사과정 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치 (Cancer Research)' 11월 30일 字 논문으로 출판됐다. (논문명: Network analysis identifies regulators of basal-like breast cancer reprogramming and endocrine therapy vulnerability)
현재 삼중음성 유방암 환자들에게 적용되는 항암 화학요법은 빠르게 분열해 전이를 일으키는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 하지만 이러한 치료는 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 심각한 부작용을 일으킨다. 또한 삼중음성 유방암세포들은 이와 같은 독성항암제에 처음부터 내성을 갖거나 새로운 내성을 획득하면서 결국 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 삼중음성 유방암에 대한 현재의 항암치료는 내성을 갖는 암세포를 없애기 위해 더 많은 정상세포의 사멸을 감수해야만 하는 큰 한계를 지니고 있다.
이를 극복하기 위해 암세포만을 특이적으로 공격하는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽이려는 공통적인 원리 때문에 근본적인 한계를 가진다.
조 교수 연구팀은 시스템생물학 연구기법을 통해 악성 유방암세포인 삼중음성 유방암세포를 호르몬 치료가 가능한 루미날-A 유방암세포로 변환시킨 뒤 치료하는 새로운 개념의 치료전략을 개발했다. 이를 위해 유전자 네트워크의 수학모델을 개발하고 대규모 컴퓨터시뮬레이션 분석과 복잡계 네트워크 제어기술을 적용한 결과 두 개의 핵심 분자 타겟인 `BCL11A'와 `HDAC1/2'를 발굴했다.
조 교수 연구팀은 BCL11A와 HDAC1/2를 억제함으로써 삼중음성 유방암세포를 효과적으로 루미날-A 유방암세포로 변환시킬 수 있음을 분자 세포실험을 통해 증명했다. 삼중음성 유방암세포에서 이 핵심 인자들을 억제했을 때 세포의 분열이 감소하고, 삼중음성 유방암세포의 주요 세포성장 신호 흐름 경로인 `EGFR'과 관련된 인자들의 활동이 감소했으며, 루미날-A 유방암세포의 주요 세포성장 신호흐름 경로인 `ERa' 신호전달 경로 인자들의 활성이 회복되는 것을 확인했다.
이번 연구에서 발굴된 분자 타겟 중 BCL11A 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 임상실험을 통해 악성 유방암세포를 치료 가능한 세포상태로 리프로그래밍 함으로써 안전하고 효과적으로 치료하는 새로운 치료기술이 실현될 수 있을 것으로 보인다. 특히 이처럼 암세포의 성질을 되돌리거나 변환하는 암세포 리프로그래밍 기반의 새로운 치료전략이 임상에서 실현된다면 현재 항암치료의 많은 부작용과 내성 발생을 근본적으로 해결함으로써 암 환자의 고통을 최소화하고 삶의 질을 크게 향상시킬 수 있을 것으로 기대된다.
조 교수는 "그동안 유방암 중에서도 가장 악성인 삼중음성 유방암은 독성이 강해 큰 부작용을 일으키는 화학 항암치료 외에는 방법이 없었으나 이를 호르몬 치료가 가능하며 덜 악성인 루미날-A 유방암세포로 리프로그래밍해 효과적으로 치료할 수 있는 새로운 가능성을 열었다ˮ라며 "이번 연구는 악성 암세포를 직접 없애려고 하기보다 치료가 수월한 세포 상태로 되돌린 뒤 치료하는 새로운 방식의 항암 치료전략을 제시했다ˮ라고 말했다.
조 교수 연구팀은 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구에 성공한 바 있으며, 이번 연구 결과는 암세포 리프로그래밍을 통한 가역화 기술 개발의 두 번째 성과다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 한국전자통신연구소 공동연구사업, KAIST Grand Challenge 30의 지원으로 수행됐다.
2021.11.30 조회수 12606
악성 유방암 세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 악성 유방암세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술을 개발하는 데 성공했다고 30일 밝혔다.
연구팀은 유방암 아류 중에서 가장 악성으로 알려진 삼중음성 유방암(basal-like 혹은 triple negative) 환자들과 호르몬 치료가 가능한 루미날-A 유방암(luminal-A) 환자들의 유전자 네트워크를 컴퓨터시뮬레이션을 통해 분석함으로써 삼중음성 유방암세포를 루미날-A 유방암세포로 변환하는데 필요한 핵심 인자를 규명했다. 그리고 이를 조절해 삼중음성 유방암세포를 루미날-A 유방암세포로 리프로그래밍한 뒤 호르몬 치료를 시행하는 새로운 치료 원리를 개발했다.
우리 대학 최새롬 박사과정, 황채영 박사, 이종훈 박사과정 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치 (Cancer Research)' 11월 30일 字 논문으로 출판됐다. (논문명: Network analysis identifies regulators of basal-like breast cancer reprogramming and endocrine therapy vulnerability)
현재 삼중음성 유방암 환자들에게 적용되는 항암 화학요법은 빠르게 분열해 전이를 일으키는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 하지만 이러한 치료는 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 심각한 부작용을 일으킨다. 또한 삼중음성 유방암세포들은 이와 같은 독성항암제에 처음부터 내성을 갖거나 새로운 내성을 획득하면서 결국 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 삼중음성 유방암에 대한 현재의 항암치료는 내성을 갖는 암세포를 없애기 위해 더 많은 정상세포의 사멸을 감수해야만 하는 큰 한계를 지니고 있다.
이를 극복하기 위해 암세포만을 특이적으로 공격하는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽이려는 공통적인 원리 때문에 근본적인 한계를 가진다.
조 교수 연구팀은 시스템생물학 연구기법을 통해 악성 유방암세포인 삼중음성 유방암세포를 호르몬 치료가 가능한 루미날-A 유방암세포로 변환시킨 뒤 치료하는 새로운 개념의 치료전략을 개발했다. 이를 위해 유전자 네트워크의 수학모델을 개발하고 대규모 컴퓨터시뮬레이션 분석과 복잡계 네트워크 제어기술을 적용한 결과 두 개의 핵심 분자 타겟인 `BCL11A'와 `HDAC1/2'를 발굴했다.
조 교수 연구팀은 BCL11A와 HDAC1/2를 억제함으로써 삼중음성 유방암세포를 효과적으로 루미날-A 유방암세포로 변환시킬 수 있음을 분자 세포실험을 통해 증명했다. 삼중음성 유방암세포에서 이 핵심 인자들을 억제했을 때 세포의 분열이 감소하고, 삼중음성 유방암세포의 주요 세포성장 신호 흐름 경로인 `EGFR'과 관련된 인자들의 활동이 감소했으며, 루미날-A 유방암세포의 주요 세포성장 신호흐름 경로인 `ERa' 신호전달 경로 인자들의 활성이 회복되는 것을 확인했다.
이번 연구에서 발굴된 분자 타겟 중 BCL11A 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 임상실험을 통해 악성 유방암세포를 치료 가능한 세포상태로 리프로그래밍 함으로써 안전하고 효과적으로 치료하는 새로운 치료기술이 실현될 수 있을 것으로 보인다. 특히 이처럼 암세포의 성질을 되돌리거나 변환하는 암세포 리프로그래밍 기반의 새로운 치료전략이 임상에서 실현된다면 현재 항암치료의 많은 부작용과 내성 발생을 근본적으로 해결함으로써 암 환자의 고통을 최소화하고 삶의 질을 크게 향상시킬 수 있을 것으로 기대된다.
조 교수는 "그동안 유방암 중에서도 가장 악성인 삼중음성 유방암은 독성이 강해 큰 부작용을 일으키는 화학 항암치료 외에는 방법이 없었으나 이를 호르몬 치료가 가능하며 덜 악성인 루미날-A 유방암세포로 리프로그래밍해 효과적으로 치료할 수 있는 새로운 가능성을 열었다ˮ라며 "이번 연구는 악성 암세포를 직접 없애려고 하기보다 치료가 수월한 세포 상태로 되돌린 뒤 치료하는 새로운 방식의 항암 치료전략을 제시했다ˮ라고 말했다.
조 교수 연구팀은 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구에 성공한 바 있으며, 이번 연구 결과는 암세포 리프로그래밍을 통한 가역화 기술 개발의 두 번째 성과다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 한국전자통신연구소 공동연구사업, KAIST Grand Challenge 30의 지원으로 수행됐다.
2021.11.30 조회수 12606 -
 시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 75472
시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 75472 -
 노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26 조회수 48517
노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26 조회수 48517 -
 조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09 조회수 20563
조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09 조회수 20563 -
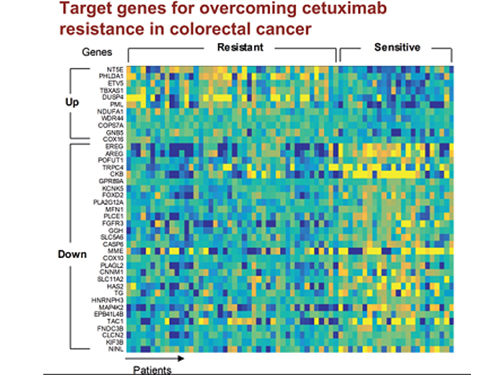 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 24431
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 24431 -
 조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10 조회수 23851
조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10 조회수 23851