%EC%B5%9C%EB%AA%85%EC%B2%A0
-
 ‘불균일 확산’ 160년 난제 풀다
우리 연구진이 160년 넘게 풀리지 않던 불균일 확산 현상의 물리적 원인을 규명했다.
우리 대학 수리과학과 김용정 교수와 바이오및뇌공학과 최명철 교수 연구팀이 기존 확산 법칙이 하지 못했던 불균일한 환경에서 발생하는 분류 현상을 설명하는 새로운 확산 법칙과 실험적 증명을 제시해, 과학의 중요한 진전을 이뤄냈다고 2일 밝혔다.
미시적 입자들의 무작위적인 움직임이 만들어 내는 거시적 질량 이동 현상을 '확산'이라고 한다. 확산은 물리, 화학, 생물, 재료 등 자연 현상뿐만 아니라 정보, 경제, 주가 변동 등 사회 현상에 이르기까지 거의 모든 분야에서 발생하는데, 이는 무작위성(randomness)이 확산 현상의 주요 원인이기 때문이다.
1905년 아인슈타인은 확산을 브라운 운동과 결합해 분자의 무작위 행보(random walk)로 설명했고, 그 이후 균일한(homogeneous) 환경에서의 확산 이론은 완벽하게 정립됐다.
반면, 1856년 루트비히(Ludwig)는 불균일(heterogeneous)한 환경에서는 물질이 확산에 의해 섞이는 것이 아니라 오히려 분류(fractionation)되는 현상을 발견했다.
이후, 확산 이외에 다른 추가적인 대류(advection) 현상이 존재해서 분류 현상을 만드는지, 아니면 입자의 무작위 움직임에 의한 것인지에 대한 의문과 논쟁은 160여 년간 이어져 왔다.
연구팀은 ‘아인슈타인의 입자적 설명'이 불균일한 환경에서 발생하는 분류 현상을 설명할 수 있을 것이라는 가정하에 연구를 진행했다. 연구 결과, 미시적 수준에서의 무작위 행보(random walk)가 불균일한 환경에 적용되면 확산 계수 D는 전도도 K와 운동성 M으로 나뉘며 (D = KM), 이 중 운동성 M에 의해 분류 현상이 발생한다는 것을 수학적 계산과 유도로 밝혔다.
물리적 직관으로 보이지 않던 것이 수학적 계산을 통해 명확해진 것이다. 이렇게 만들어진 새로운 확산 법칙은 기존의 확산 법칙처럼 계수 D 하나로만 이루어지지 않고, 두 계수에 의해 결정되는 ‘2개 요소 확산 법칙(two-component diffusion law)'이 된다.
새로운 확산 법칙이 분류 현상을 완벽하게 설명할 수 있다면, 추가적인 대류 현상은 존재하지 않으며, 오직 입자들의 무작위 운동만으로 분류 현상이 발생한다는 것이 증명된다.
확산의 특성상, 분류 현상을 검증할 정도의 정밀도로 데이터를 측정하는 것이 KAIST 연구팀이 수행한 실험의 도전적 요소였으며, 연구팀은 이 사실을 실험으로 검증해 냈다.
김용정 교수는 "이번 연구는 공간적으로 이질적인 환경에서 확산만으로도 입자의 분류가 가능하다는 것을 입증한 중요한 발견으로 기존 확산 법칙이 설명하지 못한 현상을 정확히 해석해냈다.”고 말했다. 최명철 교수는 “향후 생명과학 및 재료과학 분야에서 새로운 분리 기술 개발에 기여할 것이며 나아가, 불균일한 환경에서의 확산 현상을 다루는 다양한 분야에서 제시된 확산 법칙이 활용될 수 있을 것으로 기대한다" 고 밝혔다.
연구팀은 후속 연구로 온도 불균일에 의한 분류 현상과 고체 내의 성분 불균일에 의한 분류 현상을 연구할 계획이다. 다양한 종류의 분류 현상이 2개 요소 확산 법칙으로 설명될 수 있음을 밝히고, 그 특성을 규명할 것을 계획하고 있다.
수리과학과 김호연 박사와 바이오및뇌공학과 이근민 박사과정생이 공동 제1 저자로, 김용정 교수와 최명철 교수가 공동 교신저자로 참여한 이번 연구는 국제학술지 '미국화학회지(Journal of American Chemical Society)'에 8월 30일 字 온라인 게재됐다.
(논문명: Fractionation by Spatially Heterogeneous Diffusion: Experiments and Two-Component Random Walk Model)
이 연구는 한국연구재단, 보건복지부, KAIST의 지원을 받아 수행됐다.
2024.10.02 조회수 4607
‘불균일 확산’ 160년 난제 풀다
우리 연구진이 160년 넘게 풀리지 않던 불균일 확산 현상의 물리적 원인을 규명했다.
우리 대학 수리과학과 김용정 교수와 바이오및뇌공학과 최명철 교수 연구팀이 기존 확산 법칙이 하지 못했던 불균일한 환경에서 발생하는 분류 현상을 설명하는 새로운 확산 법칙과 실험적 증명을 제시해, 과학의 중요한 진전을 이뤄냈다고 2일 밝혔다.
미시적 입자들의 무작위적인 움직임이 만들어 내는 거시적 질량 이동 현상을 '확산'이라고 한다. 확산은 물리, 화학, 생물, 재료 등 자연 현상뿐만 아니라 정보, 경제, 주가 변동 등 사회 현상에 이르기까지 거의 모든 분야에서 발생하는데, 이는 무작위성(randomness)이 확산 현상의 주요 원인이기 때문이다.
1905년 아인슈타인은 확산을 브라운 운동과 결합해 분자의 무작위 행보(random walk)로 설명했고, 그 이후 균일한(homogeneous) 환경에서의 확산 이론은 완벽하게 정립됐다.
반면, 1856년 루트비히(Ludwig)는 불균일(heterogeneous)한 환경에서는 물질이 확산에 의해 섞이는 것이 아니라 오히려 분류(fractionation)되는 현상을 발견했다.
이후, 확산 이외에 다른 추가적인 대류(advection) 현상이 존재해서 분류 현상을 만드는지, 아니면 입자의 무작위 움직임에 의한 것인지에 대한 의문과 논쟁은 160여 년간 이어져 왔다.
연구팀은 ‘아인슈타인의 입자적 설명'이 불균일한 환경에서 발생하는 분류 현상을 설명할 수 있을 것이라는 가정하에 연구를 진행했다. 연구 결과, 미시적 수준에서의 무작위 행보(random walk)가 불균일한 환경에 적용되면 확산 계수 D는 전도도 K와 운동성 M으로 나뉘며 (D = KM), 이 중 운동성 M에 의해 분류 현상이 발생한다는 것을 수학적 계산과 유도로 밝혔다.
물리적 직관으로 보이지 않던 것이 수학적 계산을 통해 명확해진 것이다. 이렇게 만들어진 새로운 확산 법칙은 기존의 확산 법칙처럼 계수 D 하나로만 이루어지지 않고, 두 계수에 의해 결정되는 ‘2개 요소 확산 법칙(two-component diffusion law)'이 된다.
새로운 확산 법칙이 분류 현상을 완벽하게 설명할 수 있다면, 추가적인 대류 현상은 존재하지 않으며, 오직 입자들의 무작위 운동만으로 분류 현상이 발생한다는 것이 증명된다.
확산의 특성상, 분류 현상을 검증할 정도의 정밀도로 데이터를 측정하는 것이 KAIST 연구팀이 수행한 실험의 도전적 요소였으며, 연구팀은 이 사실을 실험으로 검증해 냈다.
김용정 교수는 "이번 연구는 공간적으로 이질적인 환경에서 확산만으로도 입자의 분류가 가능하다는 것을 입증한 중요한 발견으로 기존 확산 법칙이 설명하지 못한 현상을 정확히 해석해냈다.”고 말했다. 최명철 교수는 “향후 생명과학 및 재료과학 분야에서 새로운 분리 기술 개발에 기여할 것이며 나아가, 불균일한 환경에서의 확산 현상을 다루는 다양한 분야에서 제시된 확산 법칙이 활용될 수 있을 것으로 기대한다" 고 밝혔다.
연구팀은 후속 연구로 온도 불균일에 의한 분류 현상과 고체 내의 성분 불균일에 의한 분류 현상을 연구할 계획이다. 다양한 종류의 분류 현상이 2개 요소 확산 법칙으로 설명될 수 있음을 밝히고, 그 특성을 규명할 것을 계획하고 있다.
수리과학과 김호연 박사와 바이오및뇌공학과 이근민 박사과정생이 공동 제1 저자로, 김용정 교수와 최명철 교수가 공동 교신저자로 참여한 이번 연구는 국제학술지 '미국화학회지(Journal of American Chemical Society)'에 8월 30일 字 온라인 게재됐다.
(논문명: Fractionation by Spatially Heterogeneous Diffusion: Experiments and Two-Component Random Walk Model)
이 연구는 한국연구재단, 보건복지부, KAIST의 지원을 받아 수행됐다.
2024.10.02 조회수 4607 -
 지질 뗏목의 원리 밝혀 질병 치료에 희소식
지질 뗏목은 세포막 간 융합, 신호 전달, 바이러스 침투 등 세포 기능과 질병 발병의 핵심 과정에 중요한 역할을 한다. 한국 연구진이 지금까지 알려지지 않았던 지질 뗏목의 정렬 원인과 그 조절 메커니즘을 밝혀내어 세포막 간 상호작용을 조절하여 질병 치료에 새로운 접근법을 제공할 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 최명철 교수팀이 고등과학원(원장 최재경) 현창봉 교수팀, 포항가속기연구소(소장 강흥식) 이현휘 박사와 공동으로 세포막 간의 상호작용을 매개하는 지질 뗏목(Lipid Raft)의 정렬 현상의 원리를 최초로 규명했다고 5일 밝혔다. 세포 융합, 바이러스 침투, 세포 간 신호 전달 등 다양한 세포막 간의 상호작용을 조절할 수 있는 핵심 기전을 밝힌 것이다.
세포막(Cell membrane)은 세포의 내부와 외부를 구분하는 얇고 유연한 막으로, 지질 이중층(lipid bilayer)으로 구성돼 있다. 세포막에는 수많은 막단백질(membrane proteins)이 존재하는데, 이들은 세포가 외부 환경과 소통할 수 있는 창구 기능을 한다.
지질 뗏목은 세포막의 특정 영역으로서, 높은 유동성을 가지는 세포막의 다른 부분들과는 달리 매우 낮은 유동성을 가지며, 기능적으로 연관된 막단백질들을 안정된 뗏목 안으로 모아 효율적인 상호작용을 가능하게 한다. 세포막을 바다로, 막단백질을 사람으로 비유하자면, 망망대해에서 멀리 떨어져 헤엄치는 사람들끼리는 서로 의사소통하기 어렵지만, 이들을 한 뗏목 위에 모두 태워 놓으면 서로 쉽게 대화할 수 있는 것과 비슷하다.
연구팀은 지질 뗏목 위에 존재하는 막단백질 중 많은 수가 세포막 간의 상호작용, 즉 두 세포막이 서로 생체신호를 주고받거나, 단백질을 통해 결합하거나, 두 막이 하나로 합쳐지는 등의 작용에 관여한다는 점에 주목했다.
연구팀은 두 세포막 간의 거리가 지질 뗏목의 정렬을 조절하는 핵심 요인일 것이라는 가설을 세우고, 세포막을 여러 겹 쌓아 놓은 구조의 지질 다중막(lipid multilayer)을 재구성해 이 가설을 검증했다. 이때 지질 뗏목들은 단순히 정렬만 되는 것이 아니라, 각각의 지질 뗏목의 크기가 커지면서 보다 안정된 구조를 형성했다. 두 세포막 사이의 거리가 지질 뗏목의 정렬과 크기를 조절하는 핵심 스위치인 것을 밝혀낸 것이다.
연구팀은 분자동역학(molecular dynamics) 시뮬레이션*을 통해 물 분자층을 분석한 결과, 지질 뗏목들이 정렬된 상태가 정렬되지 않은 상태보다 불안정한 수소결합 층의 부피가 작기 때문에 전체 시스템의 에너지를 최소화하기 위해 지질 뗏목이 자연적으로 정렬되는 것을 밝혀냈다.
*분자동역학 시뮬레이션: 분자 간 상호작용이 주어졌을 때 운동 방정식을 수치적으로 풀어 구조와 동적 과정을 해석하는 방법
최명철 교수는 “지질 뗏목이 세포막 간의 상호작용에 관여한다는 사실은 잘 알려져 있지만, 어떤 원리로 상호작용을 매개하는지는 아직 베일에 싸여 있었다”며, “이번 논문은 세포막 간의 거리가 지질 뗏목의 정렬, 나아가 세포막 사이의 상호작용을 조절하는 핵심 스위치임을 밝혀내어 생명 현상의 바탕이 되는 물리적 환경의 중요성을 재조명하는 이정표적 연구”라고 연구의 의의를 설명했다.
최 교수는 또한 “특히 물 분자의 수소결합이 지질 뗏목의 정렬을 매개하는 중요한 요소임을 보여주었는데, 이는 우리 몸의 약 70%를 차지하는 물이 생명 현상이 일어나는 무대에서 단순한 조연이 아닌 주연으로 활약할 수 있음을 보여준다”고 강조했다. 이어 최 교수는 “지질 뗏목을 모사하는 구조는 현재 생체 센서 등에 활발하게 활용되고 있으며, 이번에 발견한 세포막 사이의 거리라는 스위치를 통해 보다 다양한 기능을 가진 생체 센서들이 개발될 수 있는 공학적 토대도 제공할 것이다”라고 기대감을 내비쳤다.
우리 대학 이수호 박사와 고등과학원 박지현 박사가 공동 제1 저자로, 고등과학원 현창봉 교수와 KAIST 최명철 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘미국화학회지(Journal of American Chemical Society)’에 5월 22일 字 표지논문(supplementary journal cover)으로 게재됐다. (논문명: Water Hydrogen-Bond Mediated Layer by Layer Alignment of Lipid Rafts as a Precursor of Intermembrane Processes)
한편 이번 연구는 한국연구재단, 보건복지부, KAIST의 지원을 받아 수행됐다.
2024.06.05 조회수 7127
지질 뗏목의 원리 밝혀 질병 치료에 희소식
지질 뗏목은 세포막 간 융합, 신호 전달, 바이러스 침투 등 세포 기능과 질병 발병의 핵심 과정에 중요한 역할을 한다. 한국 연구진이 지금까지 알려지지 않았던 지질 뗏목의 정렬 원인과 그 조절 메커니즘을 밝혀내어 세포막 간 상호작용을 조절하여 질병 치료에 새로운 접근법을 제공할 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 최명철 교수팀이 고등과학원(원장 최재경) 현창봉 교수팀, 포항가속기연구소(소장 강흥식) 이현휘 박사와 공동으로 세포막 간의 상호작용을 매개하는 지질 뗏목(Lipid Raft)의 정렬 현상의 원리를 최초로 규명했다고 5일 밝혔다. 세포 융합, 바이러스 침투, 세포 간 신호 전달 등 다양한 세포막 간의 상호작용을 조절할 수 있는 핵심 기전을 밝힌 것이다.
세포막(Cell membrane)은 세포의 내부와 외부를 구분하는 얇고 유연한 막으로, 지질 이중층(lipid bilayer)으로 구성돼 있다. 세포막에는 수많은 막단백질(membrane proteins)이 존재하는데, 이들은 세포가 외부 환경과 소통할 수 있는 창구 기능을 한다.
지질 뗏목은 세포막의 특정 영역으로서, 높은 유동성을 가지는 세포막의 다른 부분들과는 달리 매우 낮은 유동성을 가지며, 기능적으로 연관된 막단백질들을 안정된 뗏목 안으로 모아 효율적인 상호작용을 가능하게 한다. 세포막을 바다로, 막단백질을 사람으로 비유하자면, 망망대해에서 멀리 떨어져 헤엄치는 사람들끼리는 서로 의사소통하기 어렵지만, 이들을 한 뗏목 위에 모두 태워 놓으면 서로 쉽게 대화할 수 있는 것과 비슷하다.
연구팀은 지질 뗏목 위에 존재하는 막단백질 중 많은 수가 세포막 간의 상호작용, 즉 두 세포막이 서로 생체신호를 주고받거나, 단백질을 통해 결합하거나, 두 막이 하나로 합쳐지는 등의 작용에 관여한다는 점에 주목했다.
연구팀은 두 세포막 간의 거리가 지질 뗏목의 정렬을 조절하는 핵심 요인일 것이라는 가설을 세우고, 세포막을 여러 겹 쌓아 놓은 구조의 지질 다중막(lipid multilayer)을 재구성해 이 가설을 검증했다. 이때 지질 뗏목들은 단순히 정렬만 되는 것이 아니라, 각각의 지질 뗏목의 크기가 커지면서 보다 안정된 구조를 형성했다. 두 세포막 사이의 거리가 지질 뗏목의 정렬과 크기를 조절하는 핵심 스위치인 것을 밝혀낸 것이다.
연구팀은 분자동역학(molecular dynamics) 시뮬레이션*을 통해 물 분자층을 분석한 결과, 지질 뗏목들이 정렬된 상태가 정렬되지 않은 상태보다 불안정한 수소결합 층의 부피가 작기 때문에 전체 시스템의 에너지를 최소화하기 위해 지질 뗏목이 자연적으로 정렬되는 것을 밝혀냈다.
*분자동역학 시뮬레이션: 분자 간 상호작용이 주어졌을 때 운동 방정식을 수치적으로 풀어 구조와 동적 과정을 해석하는 방법
최명철 교수는 “지질 뗏목이 세포막 간의 상호작용에 관여한다는 사실은 잘 알려져 있지만, 어떤 원리로 상호작용을 매개하는지는 아직 베일에 싸여 있었다”며, “이번 논문은 세포막 간의 거리가 지질 뗏목의 정렬, 나아가 세포막 사이의 상호작용을 조절하는 핵심 스위치임을 밝혀내어 생명 현상의 바탕이 되는 물리적 환경의 중요성을 재조명하는 이정표적 연구”라고 연구의 의의를 설명했다.
최 교수는 또한 “특히 물 분자의 수소결합이 지질 뗏목의 정렬을 매개하는 중요한 요소임을 보여주었는데, 이는 우리 몸의 약 70%를 차지하는 물이 생명 현상이 일어나는 무대에서 단순한 조연이 아닌 주연으로 활약할 수 있음을 보여준다”고 강조했다. 이어 최 교수는 “지질 뗏목을 모사하는 구조는 현재 생체 센서 등에 활발하게 활용되고 있으며, 이번에 발견한 세포막 사이의 거리라는 스위치를 통해 보다 다양한 기능을 가진 생체 센서들이 개발될 수 있는 공학적 토대도 제공할 것이다”라고 기대감을 내비쳤다.
우리 대학 이수호 박사와 고등과학원 박지현 박사가 공동 제1 저자로, 고등과학원 현창봉 교수와 KAIST 최명철 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘미국화학회지(Journal of American Chemical Society)’에 5월 22일 字 표지논문(supplementary journal cover)으로 게재됐다. (논문명: Water Hydrogen-Bond Mediated Layer by Layer Alignment of Lipid Rafts as a Precursor of Intermembrane Processes)
한편 이번 연구는 한국연구재단, 보건복지부, KAIST의 지원을 받아 수행됐다.
2024.06.05 조회수 7127 -
 단백질로 엮어낸 이중나선 개발
우리 대학 바이오및뇌공학과 최명철 교수 연구팀이 나노소재의 기초물질로 활용할 수 있는 단백질을 새롭게 발굴했다고 30일 밝혔다. 연구팀이 몸속에서 미세소관을 구성하는 `튜불린(Tubulin) 단백질'을 나노공학의 측면에서 재조명해 거둔 성과다.
바이오및뇌공학과 이준철 박사과정과 송채연 박사(現 아모레퍼시픽 R&D 센터)가 공동 제1 저자로 그리고 최명철 교수가 교신저자로 참여한 이번 연구결과는 국제학술지 `스몰(Small)'에 지난 9월 17일 字 표지논문(Back Cover)으로 게재됐다. (논문명: Tubulin Double Helix: Lateral and Longitudinal Curvature Changes of Tubulin Protofilament)
자연계와 산업계의 나노소재들은 놀라울 정도로 크고 복잡한 구조를 가진다. 이 구조들의 기본 형성원리는 작고 단순한 단위체들의 고유 형태가 전체구조를 결정한다는 원리다. 일반적으로 다양한 곡면 구조를 만들려면 서로 다른 모양을 가지는 최소 두 종류의 분자들을 이어 붙여야 한다. 예를 들어, 세포막의 경우 발아와 융합 과정에서 막의 곡률이 역동적으로 변하는데, 이는 형태가 다른 여러 종류의 인지질 분자들이 혼합돼 있어 가능한 특성이다.
최 교수 연구팀은 생명 현상의 중요한 역할을 담당하는 *미세소관의 특이한 성질에 주목했다. 바로 미세소관이 성장과 붕괴 과정에 필요한 다양한 곡면을 오직 한 종류의 단위체인 튜불린 단백질만으로 구현하기 때문이다.
☞ 미세소관 (Microtubule): 튜불린 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다. 물질 수송의 고속도로, 세포 분열 과정의 분자기계 역할을 수행한다.
연구팀은 튜불린이 수직한 두 방향으로 접히는 독특한 성질에 핵심이 있다고 판단, 튜불린의 형태 변형을 인공적으로 제어하겠다는 점에 아이디어를 얻은 후 곧장 연구를 시작했다. 튜불린 단백질의 접힘을 제어하는 분자스위치를 찾고자 한 것이다.
튜불린이 강한 음전하를 띤 단백질이라는 점을 감안해 양전하 중합체인 폴리라이신(poly-L-lysine)이 미세소관의 구조를 변형하는 과정을 관찰했다. 가속기 X선 산란장치를 이용해 옹스트롱(Å, 100억 분의 1미터)의 정확도로 측정하자 DNA 이중나선 구조의 결정적 증거가 된 로절린드 프랭클린의 *`포토 51'과 유사한 결과를 확인했다.
☞ 포토 51 (photo 51): 로절린드 프랭클린이 촬영한 DNA의 엑스선 회절 이미지로, 프랜시스 크릭과 제임스 왓슨이 DNA 이중나선 구조를 밝히는데 결정적인 증거가 되었다.
이 결과는 튜불린들이 꼭 두 줄씩 길게 늘어선 `튜불린 이중나선' 구조의 형성을 의미하는 것으로 연구팀은 튜불린을 두 방향으로 접을 수 있는 분자스위치를 찾아낸 것이다.
분자스위치의 크기와 개수를 조절함에 따라, 최 교수 연구팀은 단일 벽 나노튜브에서 이중벽 나노튜브로 변환하거나 이중나선의 간격을 자유자재로 조절이 가능한 성과를 거둘 수 있었다.
연구팀 관계자는 "우리 몸속 세포물질을 그대로 이용하되, 자연의 설계를 뛰어넘어 혁신적인 나노건축물을 구현해낸 것ˮ이라고 의미를 부여했다. 최 교수 연구팀의 이번 연구 결과는 튜불린 단백질을 나노소재의 기초물질로 활용하게 해줄 핵심 전략을 제시했다는 점에서 의미가 있다.
최명철 교수는 "이 논문을 계기로 튜불린을 나노소재로 활용하는 연구들이 본격적으로 시작될 것ˮ 이라면서 "새로운 바이오-나노기술의 특이점이 될 선도적 연구ˮ라고 이번 연구에 대한 의미를 부여했다.
최 교수는 이어 "나노미터 크기의 광학/전기/의료 소재를 개발하는 플랫폼으로는 물론 모터 단백질 키네신과 결합해 분자기계를 개발하는 등 활용 가능성이 무궁무진하다ˮ고 강조하면서 "향후 다양한 형태와 특성을 가진 나노소재를 만들어낼 `튜불린 나노공학'의 발전 기반 조성과 함께 이번 연구를 통해 발견한 분자스위치는 알츠하이머병 등 뇌질환의 새로운 치료 전략으로 활용될 것ˮ이라고 기대감을 내비쳤다.
앞서 연구팀은 이 분자스위치를 이용한 튜불린 나노소재의 의료적 가치를 입증한 바 있다. 튜불린 나노튜브를 항암 약물의 일종인 미세소관 표적 치료제의 만능 전달체로 활용할 수 있다는 결과를 지난 8월 20일 字 `어드밴스드 머티리얼스(Advanced Materials)'誌에 표지논문으로 발표했다.
미국 산타바바라 캘리포니아대와 공동으로 진행된 이번 연구는 한국연구재단 (중견연구, 방사선기술)과 한국원자력연구원·KAIST의 지원을 받았으며 포항 방사광 가속기의 소각 X선 산란 장치를 이용해 실험을 수행했다.
2020.10.30 조회수 29025
단백질로 엮어낸 이중나선 개발
우리 대학 바이오및뇌공학과 최명철 교수 연구팀이 나노소재의 기초물질로 활용할 수 있는 단백질을 새롭게 발굴했다고 30일 밝혔다. 연구팀이 몸속에서 미세소관을 구성하는 `튜불린(Tubulin) 단백질'을 나노공학의 측면에서 재조명해 거둔 성과다.
바이오및뇌공학과 이준철 박사과정과 송채연 박사(現 아모레퍼시픽 R&D 센터)가 공동 제1 저자로 그리고 최명철 교수가 교신저자로 참여한 이번 연구결과는 국제학술지 `스몰(Small)'에 지난 9월 17일 字 표지논문(Back Cover)으로 게재됐다. (논문명: Tubulin Double Helix: Lateral and Longitudinal Curvature Changes of Tubulin Protofilament)
자연계와 산업계의 나노소재들은 놀라울 정도로 크고 복잡한 구조를 가진다. 이 구조들의 기본 형성원리는 작고 단순한 단위체들의 고유 형태가 전체구조를 결정한다는 원리다. 일반적으로 다양한 곡면 구조를 만들려면 서로 다른 모양을 가지는 최소 두 종류의 분자들을 이어 붙여야 한다. 예를 들어, 세포막의 경우 발아와 융합 과정에서 막의 곡률이 역동적으로 변하는데, 이는 형태가 다른 여러 종류의 인지질 분자들이 혼합돼 있어 가능한 특성이다.
최 교수 연구팀은 생명 현상의 중요한 역할을 담당하는 *미세소관의 특이한 성질에 주목했다. 바로 미세소관이 성장과 붕괴 과정에 필요한 다양한 곡면을 오직 한 종류의 단위체인 튜불린 단백질만으로 구현하기 때문이다.
☞ 미세소관 (Microtubule): 튜불린 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다. 물질 수송의 고속도로, 세포 분열 과정의 분자기계 역할을 수행한다.
연구팀은 튜불린이 수직한 두 방향으로 접히는 독특한 성질에 핵심이 있다고 판단, 튜불린의 형태 변형을 인공적으로 제어하겠다는 점에 아이디어를 얻은 후 곧장 연구를 시작했다. 튜불린 단백질의 접힘을 제어하는 분자스위치를 찾고자 한 것이다.
튜불린이 강한 음전하를 띤 단백질이라는 점을 감안해 양전하 중합체인 폴리라이신(poly-L-lysine)이 미세소관의 구조를 변형하는 과정을 관찰했다. 가속기 X선 산란장치를 이용해 옹스트롱(Å, 100억 분의 1미터)의 정확도로 측정하자 DNA 이중나선 구조의 결정적 증거가 된 로절린드 프랭클린의 *`포토 51'과 유사한 결과를 확인했다.
☞ 포토 51 (photo 51): 로절린드 프랭클린이 촬영한 DNA의 엑스선 회절 이미지로, 프랜시스 크릭과 제임스 왓슨이 DNA 이중나선 구조를 밝히는데 결정적인 증거가 되었다.
이 결과는 튜불린들이 꼭 두 줄씩 길게 늘어선 `튜불린 이중나선' 구조의 형성을 의미하는 것으로 연구팀은 튜불린을 두 방향으로 접을 수 있는 분자스위치를 찾아낸 것이다.
분자스위치의 크기와 개수를 조절함에 따라, 최 교수 연구팀은 단일 벽 나노튜브에서 이중벽 나노튜브로 변환하거나 이중나선의 간격을 자유자재로 조절이 가능한 성과를 거둘 수 있었다.
연구팀 관계자는 "우리 몸속 세포물질을 그대로 이용하되, 자연의 설계를 뛰어넘어 혁신적인 나노건축물을 구현해낸 것ˮ이라고 의미를 부여했다. 최 교수 연구팀의 이번 연구 결과는 튜불린 단백질을 나노소재의 기초물질로 활용하게 해줄 핵심 전략을 제시했다는 점에서 의미가 있다.
최명철 교수는 "이 논문을 계기로 튜불린을 나노소재로 활용하는 연구들이 본격적으로 시작될 것ˮ 이라면서 "새로운 바이오-나노기술의 특이점이 될 선도적 연구ˮ라고 이번 연구에 대한 의미를 부여했다.
최 교수는 이어 "나노미터 크기의 광학/전기/의료 소재를 개발하는 플랫폼으로는 물론 모터 단백질 키네신과 결합해 분자기계를 개발하는 등 활용 가능성이 무궁무진하다ˮ고 강조하면서 "향후 다양한 형태와 특성을 가진 나노소재를 만들어낼 `튜불린 나노공학'의 발전 기반 조성과 함께 이번 연구를 통해 발견한 분자스위치는 알츠하이머병 등 뇌질환의 새로운 치료 전략으로 활용될 것ˮ이라고 기대감을 내비쳤다.
앞서 연구팀은 이 분자스위치를 이용한 튜불린 나노소재의 의료적 가치를 입증한 바 있다. 튜불린 나노튜브를 항암 약물의 일종인 미세소관 표적 치료제의 만능 전달체로 활용할 수 있다는 결과를 지난 8월 20일 字 `어드밴스드 머티리얼스(Advanced Materials)'誌에 표지논문으로 발표했다.
미국 산타바바라 캘리포니아대와 공동으로 진행된 이번 연구는 한국연구재단 (중견연구, 방사선기술)과 한국원자력연구원·KAIST의 지원을 받았으며 포항 방사광 가속기의 소각 X선 산란 장치를 이용해 실험을 수행했다.
2020.10.30 조회수 29025 -
 항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25 조회수 33569
항암제 표적 단백질을 약물 전달체로 쓴다?
우리 대학 바이오및뇌공학과와 생명과학과 공동연구팀이 항암제의 표적 단백질을 전달체로 이용하는 역발상 연구결과를 내놨다. 항암제를 이용한 암 치료에 새로운 가능성이 열릴 전망이다.
우리 대학 생명과학과 김진주 박사·바이오및뇌공학과 이준철 박사과정 학생이 공동 제1 저자로 그리고 생명과학과 전상용·바이오및뇌공학과 최명철 교수가 공동 교신저자로 참여한 이번 연구결과는 국제학술지 ‘어드밴스드 머티리얼스(Advanced Materials, IF=27.4)’ 8월 20일 字 표지논문으로 게재됐다. (논문명: Tubulin-based Nanotubes as Delivery Platform for Microtubule-Targeting Agents)
우리 몸속 세포가 분열할 때 염색체*들은 세포 한가운데에 정렬해 두 개의 딸세포로 나눠지는데 이 염색체들을 끌어당기는 끈이 바로 `미세소관(microtubule)'이다. 미세소관은 `튜불린(tubulin)' 단백질로 이루어진 긴 튜브 형태의 나노 구조물이다.
☞ 염색체(Chromosome): DNA와 단백질이 응축하여 만드는 막대 형태의 구조체로 생명체의 모든 유전 정보를 지니고 있다.
미세소관을 표적으로 하는 항암 약물인 ‘미세소관 표적 치료제(microtubule-targeting agents)’는 임상에서 다양한 암의 치료에 활용되고 있다. 이들은 암세포 미세소관에 결합해 앞서 언급한 끈 역할을 방해함으로써, 암세포의 분열을 억제, 결국 사멸을 유도한다.
튜불린 단백질에는 이 약물이 강하게 결합하는 고유의 결합 자리(binding site)가 여럿 존재한다. 연구진은 이 점에 착안해 표적 물질인 튜불린 단백질을 약물 전달체로 사용한다는 획기적인 아이디어를 세계 최초로 구현했다. 공동연구팀은 튜불린 나노 튜브(Tubulin-based NanoTube), 약자로 TNT로 명명한 전달체를 개발하고 항암 효능을 실험으로 확인한 것이다. TNT라는 이름에는 암 치료를 위한 폭발물이라는 의미도 담고 있다.
미세소관 표적 치료제는 TNT에 자발적으로 탑재된다. 약물 입장에서는 세포 내 미세소관에 결합하는 것과 다를 바가 없기 때문이다. 이는 항암제마다 적합한 전달체를 찾아야 했던 기존의 어려움을 해소해준다. 즉 TNT는 미세소관을 표적으로 하는 모든 약물을 탑재할 수 있는 잠재력을 가진‘만능 전달체’인 셈이다.
연구진은 먼저 튜불린 단백질에 블록 혼성 중합체*인 PEG-PLL(pegylated poly-L-lysine)을 섞어 기본적인 TNT 구조를 만들었다. 여기서 튜불린은 빌딩 블록, PEG-PLL은 이들을 붙여주는 접착제이다. 그 다음, 도세탁셀(docetaxel), 라우리말라이드(laulimalide), 그리고 모노메틸아우리스타틴 E(monomethyl auristatin E) 3종의 약물이 TNT에 탑재됨을 보였다. 이 약물들은 실제 유방암, 두경부암, 위암, 방광암 등의 화학요법에 활용되고 있는 항암제들이다.
☞ 블록 혼성 중합체(Block copolymer): 두 종류 이상의 단위체로 이루어진 고분자 화합물로, 각 단위체들이 길게 반복되는 특징이 있다.
연구팀은 또 탑재되는 약물의 종류와 개수에 따라 TNT의 구조가 변할 뿐 아니라 약물 전달체로서의 물리·화학적 특성도 달라진다는 사실을 밝혀냈다. 이는 TNT가 탑재하려는 약물에 맞춰 자발적으로 형태를 변형하는‘적응형 전달체’임을 보여주고 있다.
연구팀은 특히 항암제가 탑재된 TNT가 엔도좀-리소좀 경로(endo-lysosomal pathway)로 암세포에 들어가 뛰어난 항암 및 혈관 형성 억제 효과를 보인다는 점을 세포 및 동물을 대상으로 한 실험을 통해 확인했다.
적응형 만능 약물 전달체가 성공적으로 구현이 가능했던 배경에는 연구진이 보유한 튜불린 분자 제어 기술력 때문이다. 연구진은 튜불린 단백질을 일종의 레고 블록으로 보았다. 블록의 형태를 변형하고 쌓아 올리는 방식을 제어하여, 튜브 형태의 구조체를 조립하는 노하우를 축적해왔다. 연구팀은 이번 연구에서 포항 방사광 가속기의 소각 X-선 산란 장치를 이용해 TNT 구조를 나노미터(nm, 10억 분의 1미터) 이하의 정확도로 분석했다.
공동연구팀은 "이번 연구결과는 지금까지 학계에 보고되지 않은 완전히 새로운 방식의 약물 전달체를 구현했다는 점에서 의미가 크다ˮ고 밝혔다. 연구팀은 이어 "TNT는 현재까지 개발된, 또 향후 개발예정인 미세소관 표적 치료제까지 운송할 수 있는 범용적인 전달체이며, 다양한 항암제들의 시너지 효과(synergy effect)를 기대할 수 있는 `플랫폼 전달체'가 될 것ˮ이라고 강조했다.
이번 연구는 한국연구재단 (중견연구, 리더연구, 방사선기술, 바이오의료기술개발사업) 한국원자력연구원, KUSTAR-KAIST의 지원으로 수행됐다.
2020.08.25 조회수 33569 -
 최명철 교수팀 연구 성과, 사이언스지 퍼스펙티브에 소개
우리 학교 바이오및뇌공학과 최명철 교수팀이 최근 발표한 ‘마이크로튜불의 새로운 구조’에 관한 논문이 과학 분야 가장 권위 있는 학술지인 사이언스(Science) 퍼스펙티브(Perspective)에 지난달 28일 소개됐다.
퍼스펙티브는 전 세계의 학술지 중 가장 영향력 있는 논문을 선정해 재조명하는 섹션이다.
KAIST 송채연 박사와 최명철 교수, 미국 UC Santa Barbara의 Safinya교수와 Wilson교수, 이스라엘 Hebrew University의 Raviv교수로 구성된 국제 공동연구팀은 가속기 엑스선 산란장치(synchrotron x-ray scattering)와 전자현미경을 이용해 마이크로튜불의 초미세구조를 이해하고, 이를 제어하는 스위치를 발견해 새로운 단백질 나노튜브 구조를 최초로 밝힌 연구결과를 네이처 머티리얼즈(Nature Materials)에 발표한 바 있다.
튜불린(마이크로튜불의 기본 단위체)의 형태 변화가 마이크로튜불의 구조 형성에 결정적인 영향을 미친다.연구진은 이 형태 변화를 제어하는 스위치를 찾음으로써 마이크로튜불의 새로운 크기와 형태의 구조를 발견했다.
사이언스 홈페이지
2014.03.11 조회수 18575
최명철 교수팀 연구 성과, 사이언스지 퍼스펙티브에 소개
우리 학교 바이오및뇌공학과 최명철 교수팀이 최근 발표한 ‘마이크로튜불의 새로운 구조’에 관한 논문이 과학 분야 가장 권위 있는 학술지인 사이언스(Science) 퍼스펙티브(Perspective)에 지난달 28일 소개됐다.
퍼스펙티브는 전 세계의 학술지 중 가장 영향력 있는 논문을 선정해 재조명하는 섹션이다.
KAIST 송채연 박사와 최명철 교수, 미국 UC Santa Barbara의 Safinya교수와 Wilson교수, 이스라엘 Hebrew University의 Raviv교수로 구성된 국제 공동연구팀은 가속기 엑스선 산란장치(synchrotron x-ray scattering)와 전자현미경을 이용해 마이크로튜불의 초미세구조를 이해하고, 이를 제어하는 스위치를 발견해 새로운 단백질 나노튜브 구조를 최초로 밝힌 연구결과를 네이처 머티리얼즈(Nature Materials)에 발표한 바 있다.
튜불린(마이크로튜불의 기본 단위체)의 형태 변화가 마이크로튜불의 구조 형성에 결정적인 영향을 미친다.연구진은 이 형태 변화를 제어하는 스위치를 찾음으로써 마이크로튜불의 새로운 크기와 형태의 구조를 발견했다.
사이언스 홈페이지
2014.03.11 조회수 18575 -
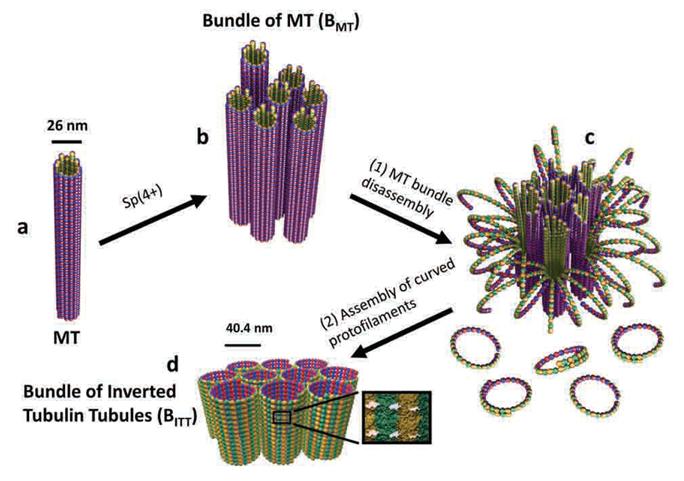 단백질 나노튜브의 자기조립 분자스위치 발견
- 한국, 미국, 이스라엘 국제 공동 연구 성과 -
- 암 치료와 뇌 질환 메커니즘 단서 -
우리 학교 바이오및뇌공학과 최명철 교수와 송채연 연구교수는 미국
산타바바라 캘리포니아대학교, 이스라엘 히브리대학교와 공동으로 세포분열과 세포간 물질수송에 열쇠가 되는 단백질 나노튜브의 자기조립
구조를 제어하는 분자스위치를 발견했다.
연구 결과는 세계적 학술지 ‘네이처 머티리얼즈(Nature Materials, IF=35.7)’ 19일자에 게재됐다.
마이크로튜불(microtubule, 미세소관)은 사람의 몸속에서 세포분열·세포골격·세포간 물질수송 도구로 사용되는 튜브 형태의 단백질로 굵기가 25나노미터(1나노미터는 머리카락 굵기의 10만분의 1)에 불과하다.
대부분의 암 치료 약물은 마이크로튜불의 형성을 교란해 암세포 분열을
억제하는 것으로 작용 메커니즘이 알려져 있다. 알츠하이머병은 세포간 물질수송을 담당하는 마이크로튜불의 구조적 안정성이 떨어지면서
신경세포에서의 신호전달이 제대로 이루어지지 않아 생기는 대표적 뇌질환이다.
연구팀은 싱크로트론 X선 산란장치(synchrotron x-ray
scattering: 전자를 빛의 속도에 가깝게 가속시켜 강력한 X선을 발생시키는 장치)와 투과전자현미경을 이용해 단백질
나노튜브의 자기조립 구조를 서브나노미터(1나노미터 미만)의 정확도로 측정했다.
연구팀은 이번 연구를 분자 레벨에서 레고 블록을 쌓아 올리는 것에 비유해
가로×세로×폭이 각각 4×5×8 나노미터인 단백질 블록을 쌓아 올려 25나노미터 굵기의 튜브를 형성하는 메커니즘을 추적했다. 이
과정에서 연구팀은 레고 블록의 형태를 제어하는 분자스위치를 발견했다. 또 지금까지 보고된 바 없는 전혀 새로운 크기와 형태의
단백질 튜브 구조를 만들어 내는데 성공했다.
최명철 교수는 “인간의 생명 시스템은 고도의 자기조립 구조체를 형성해 복잡한 생물학적 기능을 하고 있지만 한편으로는 극히 단순한 물리학적 원리에 의해 제어가 가능하다는 새로운 패러다임을 제시했다”고 이 연구의 의의를 밝혔다.
또 “이번 연구는 암 치료와 뇌질환 메커니즘을 규명하고자하는 작은 발걸음이며 앞으로 바이오 나노튜브를 이용한 공학적 응용이 무궁무진할 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 국제협력사업, 신진연구자지원사업, 학문후속세대양성사업, KAIST 고위험 고수익 프로젝트(High Risk High Return Project)의 지원으로 수행됐다.
2014.01.21 조회수 25422
단백질 나노튜브의 자기조립 분자스위치 발견
- 한국, 미국, 이스라엘 국제 공동 연구 성과 -
- 암 치료와 뇌 질환 메커니즘 단서 -
우리 학교 바이오및뇌공학과 최명철 교수와 송채연 연구교수는 미국
산타바바라 캘리포니아대학교, 이스라엘 히브리대학교와 공동으로 세포분열과 세포간 물질수송에 열쇠가 되는 단백질 나노튜브의 자기조립
구조를 제어하는 분자스위치를 발견했다.
연구 결과는 세계적 학술지 ‘네이처 머티리얼즈(Nature Materials, IF=35.7)’ 19일자에 게재됐다.
마이크로튜불(microtubule, 미세소관)은 사람의 몸속에서 세포분열·세포골격·세포간 물질수송 도구로 사용되는 튜브 형태의 단백질로 굵기가 25나노미터(1나노미터는 머리카락 굵기의 10만분의 1)에 불과하다.
대부분의 암 치료 약물은 마이크로튜불의 형성을 교란해 암세포 분열을
억제하는 것으로 작용 메커니즘이 알려져 있다. 알츠하이머병은 세포간 물질수송을 담당하는 마이크로튜불의 구조적 안정성이 떨어지면서
신경세포에서의 신호전달이 제대로 이루어지지 않아 생기는 대표적 뇌질환이다.
연구팀은 싱크로트론 X선 산란장치(synchrotron x-ray
scattering: 전자를 빛의 속도에 가깝게 가속시켜 강력한 X선을 발생시키는 장치)와 투과전자현미경을 이용해 단백질
나노튜브의 자기조립 구조를 서브나노미터(1나노미터 미만)의 정확도로 측정했다.
연구팀은 이번 연구를 분자 레벨에서 레고 블록을 쌓아 올리는 것에 비유해
가로×세로×폭이 각각 4×5×8 나노미터인 단백질 블록을 쌓아 올려 25나노미터 굵기의 튜브를 형성하는 메커니즘을 추적했다. 이
과정에서 연구팀은 레고 블록의 형태를 제어하는 분자스위치를 발견했다. 또 지금까지 보고된 바 없는 전혀 새로운 크기와 형태의
단백질 튜브 구조를 만들어 내는데 성공했다.
최명철 교수는 “인간의 생명 시스템은 고도의 자기조립 구조체를 형성해 복잡한 생물학적 기능을 하고 있지만 한편으로는 극히 단순한 물리학적 원리에 의해 제어가 가능하다는 새로운 패러다임을 제시했다”고 이 연구의 의의를 밝혔다.
또 “이번 연구는 암 치료와 뇌질환 메커니즘을 규명하고자하는 작은 발걸음이며 앞으로 바이오 나노튜브를 이용한 공학적 응용이 무궁무진할 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 국제협력사업, 신진연구자지원사업, 학문후속세대양성사업, KAIST 고위험 고수익 프로젝트(High Risk High Return Project)의 지원으로 수행됐다.
2014.01.21 조회수 25422