%EB%8F%99%EC%97%AD%ED%95%99
-
 지질 뗏목의 원리 밝혀 질병 치료에 희소식
지질 뗏목은 세포막 간 융합, 신호 전달, 바이러스 침투 등 세포 기능과 질병 발병의 핵심 과정에 중요한 역할을 한다. 한국 연구진이 지금까지 알려지지 않았던 지질 뗏목의 정렬 원인과 그 조절 메커니즘을 밝혀내어 세포막 간 상호작용을 조절하여 질병 치료에 새로운 접근법을 제공할 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 최명철 교수팀이 고등과학원(원장 최재경) 현창봉 교수팀, 포항가속기연구소(소장 강흥식) 이현휘 박사와 공동으로 세포막 간의 상호작용을 매개하는 지질 뗏목(Lipid Raft)의 정렬 현상의 원리를 최초로 규명했다고 5일 밝혔다. 세포 융합, 바이러스 침투, 세포 간 신호 전달 등 다양한 세포막 간의 상호작용을 조절할 수 있는 핵심 기전을 밝힌 것이다.
세포막(Cell membrane)은 세포의 내부와 외부를 구분하는 얇고 유연한 막으로, 지질 이중층(lipid bilayer)으로 구성돼 있다. 세포막에는 수많은 막단백질(membrane proteins)이 존재하는데, 이들은 세포가 외부 환경과 소통할 수 있는 창구 기능을 한다.
지질 뗏목은 세포막의 특정 영역으로서, 높은 유동성을 가지는 세포막의 다른 부분들과는 달리 매우 낮은 유동성을 가지며, 기능적으로 연관된 막단백질들을 안정된 뗏목 안으로 모아 효율적인 상호작용을 가능하게 한다. 세포막을 바다로, 막단백질을 사람으로 비유하자면, 망망대해에서 멀리 떨어져 헤엄치는 사람들끼리는 서로 의사소통하기 어렵지만, 이들을 한 뗏목 위에 모두 태워 놓으면 서로 쉽게 대화할 수 있는 것과 비슷하다.
연구팀은 지질 뗏목 위에 존재하는 막단백질 중 많은 수가 세포막 간의 상호작용, 즉 두 세포막이 서로 생체신호를 주고받거나, 단백질을 통해 결합하거나, 두 막이 하나로 합쳐지는 등의 작용에 관여한다는 점에 주목했다.
연구팀은 두 세포막 간의 거리가 지질 뗏목의 정렬을 조절하는 핵심 요인일 것이라는 가설을 세우고, 세포막을 여러 겹 쌓아 놓은 구조의 지질 다중막(lipid multilayer)을 재구성해 이 가설을 검증했다. 이때 지질 뗏목들은 단순히 정렬만 되는 것이 아니라, 각각의 지질 뗏목의 크기가 커지면서 보다 안정된 구조를 형성했다. 두 세포막 사이의 거리가 지질 뗏목의 정렬과 크기를 조절하는 핵심 스위치인 것을 밝혀낸 것이다.
연구팀은 분자동역학(molecular dynamics) 시뮬레이션*을 통해 물 분자층을 분석한 결과, 지질 뗏목들이 정렬된 상태가 정렬되지 않은 상태보다 불안정한 수소결합 층의 부피가 작기 때문에 전체 시스템의 에너지를 최소화하기 위해 지질 뗏목이 자연적으로 정렬되는 것을 밝혀냈다.
*분자동역학 시뮬레이션: 분자 간 상호작용이 주어졌을 때 운동 방정식을 수치적으로 풀어 구조와 동적 과정을 해석하는 방법
최명철 교수는 “지질 뗏목이 세포막 간의 상호작용에 관여한다는 사실은 잘 알려져 있지만, 어떤 원리로 상호작용을 매개하는지는 아직 베일에 싸여 있었다”며, “이번 논문은 세포막 간의 거리가 지질 뗏목의 정렬, 나아가 세포막 사이의 상호작용을 조절하는 핵심 스위치임을 밝혀내어 생명 현상의 바탕이 되는 물리적 환경의 중요성을 재조명하는 이정표적 연구”라고 연구의 의의를 설명했다.
최 교수는 또한 “특히 물 분자의 수소결합이 지질 뗏목의 정렬을 매개하는 중요한 요소임을 보여주었는데, 이는 우리 몸의 약 70%를 차지하는 물이 생명 현상이 일어나는 무대에서 단순한 조연이 아닌 주연으로 활약할 수 있음을 보여준다”고 강조했다. 이어 최 교수는 “지질 뗏목을 모사하는 구조는 현재 생체 센서 등에 활발하게 활용되고 있으며, 이번에 발견한 세포막 사이의 거리라는 스위치를 통해 보다 다양한 기능을 가진 생체 센서들이 개발될 수 있는 공학적 토대도 제공할 것이다”라고 기대감을 내비쳤다.
우리 대학 이수호 박사와 고등과학원 박지현 박사가 공동 제1 저자로, 고등과학원 현창봉 교수와 KAIST 최명철 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘미국화학회지(Journal of American Chemical Society)’에 5월 22일 字 표지논문(supplementary journal cover)으로 게재됐다. (논문명: Water Hydrogen-Bond Mediated Layer by Layer Alignment of Lipid Rafts as a Precursor of Intermembrane Processes)
한편 이번 연구는 한국연구재단, 보건복지부, KAIST의 지원을 받아 수행됐다.
2024.06.05 조회수 7233
지질 뗏목의 원리 밝혀 질병 치료에 희소식
지질 뗏목은 세포막 간 융합, 신호 전달, 바이러스 침투 등 세포 기능과 질병 발병의 핵심 과정에 중요한 역할을 한다. 한국 연구진이 지금까지 알려지지 않았던 지질 뗏목의 정렬 원인과 그 조절 메커니즘을 밝혀내어 세포막 간 상호작용을 조절하여 질병 치료에 새로운 접근법을 제공할 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 최명철 교수팀이 고등과학원(원장 최재경) 현창봉 교수팀, 포항가속기연구소(소장 강흥식) 이현휘 박사와 공동으로 세포막 간의 상호작용을 매개하는 지질 뗏목(Lipid Raft)의 정렬 현상의 원리를 최초로 규명했다고 5일 밝혔다. 세포 융합, 바이러스 침투, 세포 간 신호 전달 등 다양한 세포막 간의 상호작용을 조절할 수 있는 핵심 기전을 밝힌 것이다.
세포막(Cell membrane)은 세포의 내부와 외부를 구분하는 얇고 유연한 막으로, 지질 이중층(lipid bilayer)으로 구성돼 있다. 세포막에는 수많은 막단백질(membrane proteins)이 존재하는데, 이들은 세포가 외부 환경과 소통할 수 있는 창구 기능을 한다.
지질 뗏목은 세포막의 특정 영역으로서, 높은 유동성을 가지는 세포막의 다른 부분들과는 달리 매우 낮은 유동성을 가지며, 기능적으로 연관된 막단백질들을 안정된 뗏목 안으로 모아 효율적인 상호작용을 가능하게 한다. 세포막을 바다로, 막단백질을 사람으로 비유하자면, 망망대해에서 멀리 떨어져 헤엄치는 사람들끼리는 서로 의사소통하기 어렵지만, 이들을 한 뗏목 위에 모두 태워 놓으면 서로 쉽게 대화할 수 있는 것과 비슷하다.
연구팀은 지질 뗏목 위에 존재하는 막단백질 중 많은 수가 세포막 간의 상호작용, 즉 두 세포막이 서로 생체신호를 주고받거나, 단백질을 통해 결합하거나, 두 막이 하나로 합쳐지는 등의 작용에 관여한다는 점에 주목했다.
연구팀은 두 세포막 간의 거리가 지질 뗏목의 정렬을 조절하는 핵심 요인일 것이라는 가설을 세우고, 세포막을 여러 겹 쌓아 놓은 구조의 지질 다중막(lipid multilayer)을 재구성해 이 가설을 검증했다. 이때 지질 뗏목들은 단순히 정렬만 되는 것이 아니라, 각각의 지질 뗏목의 크기가 커지면서 보다 안정된 구조를 형성했다. 두 세포막 사이의 거리가 지질 뗏목의 정렬과 크기를 조절하는 핵심 스위치인 것을 밝혀낸 것이다.
연구팀은 분자동역학(molecular dynamics) 시뮬레이션*을 통해 물 분자층을 분석한 결과, 지질 뗏목들이 정렬된 상태가 정렬되지 않은 상태보다 불안정한 수소결합 층의 부피가 작기 때문에 전체 시스템의 에너지를 최소화하기 위해 지질 뗏목이 자연적으로 정렬되는 것을 밝혀냈다.
*분자동역학 시뮬레이션: 분자 간 상호작용이 주어졌을 때 운동 방정식을 수치적으로 풀어 구조와 동적 과정을 해석하는 방법
최명철 교수는 “지질 뗏목이 세포막 간의 상호작용에 관여한다는 사실은 잘 알려져 있지만, 어떤 원리로 상호작용을 매개하는지는 아직 베일에 싸여 있었다”며, “이번 논문은 세포막 간의 거리가 지질 뗏목의 정렬, 나아가 세포막 사이의 상호작용을 조절하는 핵심 스위치임을 밝혀내어 생명 현상의 바탕이 되는 물리적 환경의 중요성을 재조명하는 이정표적 연구”라고 연구의 의의를 설명했다.
최 교수는 또한 “특히 물 분자의 수소결합이 지질 뗏목의 정렬을 매개하는 중요한 요소임을 보여주었는데, 이는 우리 몸의 약 70%를 차지하는 물이 생명 현상이 일어나는 무대에서 단순한 조연이 아닌 주연으로 활약할 수 있음을 보여준다”고 강조했다. 이어 최 교수는 “지질 뗏목을 모사하는 구조는 현재 생체 센서 등에 활발하게 활용되고 있으며, 이번에 발견한 세포막 사이의 거리라는 스위치를 통해 보다 다양한 기능을 가진 생체 센서들이 개발될 수 있는 공학적 토대도 제공할 것이다”라고 기대감을 내비쳤다.
우리 대학 이수호 박사와 고등과학원 박지현 박사가 공동 제1 저자로, 고등과학원 현창봉 교수와 KAIST 최명철 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘미국화학회지(Journal of American Chemical Society)’에 5월 22일 字 표지논문(supplementary journal cover)으로 게재됐다. (논문명: Water Hydrogen-Bond Mediated Layer by Layer Alignment of Lipid Rafts as a Precursor of Intermembrane Processes)
한편 이번 연구는 한국연구재단, 보건복지부, KAIST의 지원을 받아 수행됐다.
2024.06.05 조회수 7233 -
 양자 비평형 현상의 물리적 법칙은
비평형 현상이란, 평형에서 벗어난 상태를 지칭하는 것으로 우리가 일상적으로 자주 마주하는 현상이다. 커피에 우유를 넣고 섞게 되면 우유 분자들은 에스프레소와 섞이면서 카페라테가 되는데, 이렇게 평형을 찾아가는 과정을 비평형 동역학이라고 볼 수 있다. 물리학에서 답하고자 하는 주요한 질문은 ‘양자 역학계에서 일어나는 비평형 현상은 어떤 물리 법칙에 의해 지배되며, 과연 보편적으로 적용할 수 있는 법칙이 존재할지’ 여부다.
우리 대학 물리학과 최재윤 교수 연구팀이 극저온 중성원자 양자 시뮬레이터를 이용해 이론적으로 추측된 비평형 상태의 양자 물성 변화의 보편적 물리 법칙을 확인하는데 성공했다고 27일 밝혔다.
보편적 물리 법칙에 대한 예는 평형상태에서 액체에서 기체가 되는 것처럼 물질의 상이 변화하는 ‘상전이 현상’에서 찾아볼 수 있다. 상전이 일어나는 지점을 임계지점이라고 하는데, 이 지점에 물성의 변화는 입자들의 크기, 밀도, 및 상호작용의 세기 등 물리량에 의존하지 않는다.
예를 들어, 물에서 관측할 수 있는 액체-기체 상전이 임계점 및 자석에서 관측되는 상자성-강자성 상전이 임계점은, 비록 서로 매우 다른 계이지만, 동일한 형태의 물성 변화를 확인할 수 있다. 즉. 물질의 상이 변화되는 임계지점에서 물성의 변화는 입자들의 크기, 밀도, 등 계를 구성하는 미시적인 물리량에 의존하지 않으며, 이를 가리켜 ‘상전이점 근처에서 보편성(universal) 이 존재한다’라고 할 수 있다. 또한 물성의 변화가 수학적으로 동일한 함수를 따를 때 우리는 ‘같은 보편성 부류에(universality class) 속한다’라고 할 수 있다.
비평형 양자 동역학에서도 ‘상전이’ 현상과 같이 보편성 및 보편성 부류가 존재함이 약 10년 전에 제기됐으나, 매우 긴 시간 동안 관측해야 하는 실험적인 어려움이 있어 이에 대한 검증을 엄밀하게 할 수 없었다.
최재윤 교수 연구팀은 강한 상호작용을 갖는 스피너 응집체*를 이용하여, 자기 도메인들의 비평형 조대화 동역학**을 매우 긴시간 동안 연구하였으며, 이를 통해 해당 가설을 검증하였다. 연구팀은 조대화 동역학의 동역학적 형태가 다양한 초기 상태와는 상관없이 동일한 수학적 형태를 따르는 것을 보여 보편성을 확인하였다. 더 나아가 시스템의 대칭성을 바꾸어 주었을 때만 동역학의 수학적 형태가 바뀌는 것을 확인하여, 보편적인 양자 동역학의 분류도 가능함을 보여주었다.
*스피너 응집체: 서로 다른 스핀들 간의 상호작용이 있는 보즈-아인슈타인 응집체를 말하며, 보즈-아인슈타인 응집체란 모든 원자들이 하나의 파동함수로 기술이 되는 양자 상태임
**조대화 동역학: 초기에 무수히 많은 자기 영역(magnetic domain)들이 서로 합해지면서 영역들의 크기가 커지는 동역학을 지칭함
물리학과 최재윤 교수는 “이번 연구는 중성원자 양자 시뮬레이터가 비평형 양자 동역학에 가설을 검증하는 데 활용된 중요한 사례이며, 향후 고전 컴퓨터가 흉내 내기 어려운 영역에서 비평형 동역학을 연구해 새로운 물리 법칙을 발견하고 싶다”고 포부를 밝혔다.
물리학과 허승정, 권기량, 허준혁 대학원생 연구원이 참여한 이번 연구는 국제 학술지 `네이처 피직스(Nature Physics)' 3월에 표지로 선정됐다 (논문명: Universality class of a spinor Bose-Einstein condensate far from equilibrium).
한편 이번 연구는 삼성미래기술재단과 한국연구재단의 지원으로 수행됐다.
2024.03.27 조회수 7017
양자 비평형 현상의 물리적 법칙은
비평형 현상이란, 평형에서 벗어난 상태를 지칭하는 것으로 우리가 일상적으로 자주 마주하는 현상이다. 커피에 우유를 넣고 섞게 되면 우유 분자들은 에스프레소와 섞이면서 카페라테가 되는데, 이렇게 평형을 찾아가는 과정을 비평형 동역학이라고 볼 수 있다. 물리학에서 답하고자 하는 주요한 질문은 ‘양자 역학계에서 일어나는 비평형 현상은 어떤 물리 법칙에 의해 지배되며, 과연 보편적으로 적용할 수 있는 법칙이 존재할지’ 여부다.
우리 대학 물리학과 최재윤 교수 연구팀이 극저온 중성원자 양자 시뮬레이터를 이용해 이론적으로 추측된 비평형 상태의 양자 물성 변화의 보편적 물리 법칙을 확인하는데 성공했다고 27일 밝혔다.
보편적 물리 법칙에 대한 예는 평형상태에서 액체에서 기체가 되는 것처럼 물질의 상이 변화하는 ‘상전이 현상’에서 찾아볼 수 있다. 상전이 일어나는 지점을 임계지점이라고 하는데, 이 지점에 물성의 변화는 입자들의 크기, 밀도, 및 상호작용의 세기 등 물리량에 의존하지 않는다.
예를 들어, 물에서 관측할 수 있는 액체-기체 상전이 임계점 및 자석에서 관측되는 상자성-강자성 상전이 임계점은, 비록 서로 매우 다른 계이지만, 동일한 형태의 물성 변화를 확인할 수 있다. 즉. 물질의 상이 변화되는 임계지점에서 물성의 변화는 입자들의 크기, 밀도, 등 계를 구성하는 미시적인 물리량에 의존하지 않으며, 이를 가리켜 ‘상전이점 근처에서 보편성(universal) 이 존재한다’라고 할 수 있다. 또한 물성의 변화가 수학적으로 동일한 함수를 따를 때 우리는 ‘같은 보편성 부류에(universality class) 속한다’라고 할 수 있다.
비평형 양자 동역학에서도 ‘상전이’ 현상과 같이 보편성 및 보편성 부류가 존재함이 약 10년 전에 제기됐으나, 매우 긴 시간 동안 관측해야 하는 실험적인 어려움이 있어 이에 대한 검증을 엄밀하게 할 수 없었다.
최재윤 교수 연구팀은 강한 상호작용을 갖는 스피너 응집체*를 이용하여, 자기 도메인들의 비평형 조대화 동역학**을 매우 긴시간 동안 연구하였으며, 이를 통해 해당 가설을 검증하였다. 연구팀은 조대화 동역학의 동역학적 형태가 다양한 초기 상태와는 상관없이 동일한 수학적 형태를 따르는 것을 보여 보편성을 확인하였다. 더 나아가 시스템의 대칭성을 바꾸어 주었을 때만 동역학의 수학적 형태가 바뀌는 것을 확인하여, 보편적인 양자 동역학의 분류도 가능함을 보여주었다.
*스피너 응집체: 서로 다른 스핀들 간의 상호작용이 있는 보즈-아인슈타인 응집체를 말하며, 보즈-아인슈타인 응집체란 모든 원자들이 하나의 파동함수로 기술이 되는 양자 상태임
**조대화 동역학: 초기에 무수히 많은 자기 영역(magnetic domain)들이 서로 합해지면서 영역들의 크기가 커지는 동역학을 지칭함
물리학과 최재윤 교수는 “이번 연구는 중성원자 양자 시뮬레이터가 비평형 양자 동역학에 가설을 검증하는 데 활용된 중요한 사례이며, 향후 고전 컴퓨터가 흉내 내기 어려운 영역에서 비평형 동역학을 연구해 새로운 물리 법칙을 발견하고 싶다”고 포부를 밝혔다.
물리학과 허승정, 권기량, 허준혁 대학원생 연구원이 참여한 이번 연구는 국제 학술지 `네이처 피직스(Nature Physics)' 3월에 표지로 선정됐다 (논문명: Universality class of a spinor Bose-Einstein condensate far from equilibrium).
한편 이번 연구는 삼성미래기술재단과 한국연구재단의 지원으로 수행됐다.
2024.03.27 조회수 7017 -
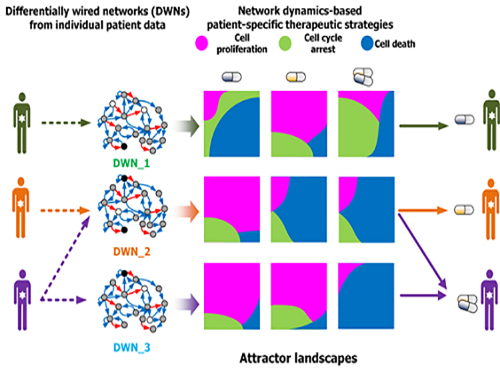 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 24863
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 24863 -
 단백질의 생체분자에 대한 결합력 조절기작 규명
우리 학교 생명과학과 김학성 교수와 서문형 박사 연구팀은 단백질이 생체 내 분자를 인식하고 기능을 수행하는데 중요한 단백질의 생체분자에 대한 결합력을 조절하는 메커니즘을 새롭게 밝혀냈다 .
연구 결과는 과학 분야의 권위지인 ‘ 네이처 커뮤니케이션즈 (Nature Communications)’ 24일자 온라인판에 게재됐다.
연구팀은 지난해에 단백질의 생체분자 인식 메커니즘을 최초로 밝혀내 Nature Chemical Biology 에 발표한데 이어 , 이번 연구를 통해 단백질이 생체분자에 대한 결합력을 조절하는 핵심 원리를 규명함으로써 생체 내 단백질의 기능과 조절 기작을 보다 명확하게 이해하는 데 크게 기여할 것으로 전망된다 .
효소나 항체 , 호르몬 등으로 대표되는 단백질은 모든 생명체 내에서 다양한 생체 분자를 특이적으로 인식하여 신호전달 , 면역반응 등을 정교하게 진행시켜 생명현상을 유지하고 조절하는데 가장 중요한 역할을 담당한다 . 이런 과정에서 단백질이 생체분자에 대한 결합력은 두 분자 사이의 결합지속 시간이 정해지고 , 단백질의 생체 내 기능을 결정하고 조절하는 핵심 요인이다 . 이번 연구 결과를 바탕으로 단백질 활성을 보다 정교하게 조절하는 것이 가능해질 것으로 예상된다 .
연구팀은 단백질들이 생체분자를 인식하는 과정에서 , 단백질의 생체분자에 대한 결합력은 두 분자 사이의 비 공유 상호작용의 크기뿐만 아니라 단백질의 고유한 동역학적 성질도 긴밀하게 연관되어 있다는 점에 주목했다 .
김 교수 연구팀은 단백질의 생체분자에 대한 결합력을 결정하는 기본 기작을 규명하기 위해 , 단백질의 allosteric site 에 돌연변이를 가하여 동일한 화학적 접촉면을 가지고 있지만 수십 배에서 수백 배의 결합력 차이를 보이는 다양한 돌연변이 단백질을 제작하였다 . 단백질의 allosteric site 는 생체분자와 직접 결합하는 부위는 아니지만 생체 분자 인식에 영향을 미치는 부위를 지칭한다 .
제작된 돌연변이 단백질들의 고유한 동역학적 성질을 단 분자 수준에서 실시간으로 분석하여 , 생체분자에 대한 결합력이 단백질의 고유한 동력학적 특성인 구조 열림 속도에 직접적으로 연관되어 있음을 밝혀냈다 .
또한 , 단백질이 생체 분자와 직접 결합하는 부위가 아닌 allosteric site 에서 단백질의 고유한 특성을 변화시킬 수 있음을 증명함으로써 , 생체 내 단백질들의 기능을 조절하는 새로운 방법론을 제시하였다 .
연구팀의 이번 결과는 다양한 생명현상을 관장하는 단백질의 특성을 보다 깊이 이해하는데 큰 역할을 하였으며 , 단백질의 생체분자에 대한 결합력을 결정하는 원리를 단백질의 동력학적 관점에서 입증한 것으로 평가되고 있다 .
김 학성 교수는 이번 연구에 대해 “ 지금까지는 단백질의 생체분자에 대한 결합력은 두 분자 사이의 직접적인 상호작용에 의해 결정되는 것으로 알려져 왔지만 , 본 연구를 통해 단백질의 고유한 동력학적 특성 , 즉 구조 열림 속도도 결합력을 결정하는 데 핵심적인 역할을 한다는 새로운 사실을 밝힌 것이 큰 의미가 있다 ” 라고 의의를 밝혔다 .
그림 1. 단백질의 안정한 상태인 열린 구조 (open) 와 불안정한 상태인 부분적으로 열린 구조 (partially closed) 사이의 전환 속도 (kopening; opening rate) 와 결합력 (Kd) 사이의 상관관계 그래프
2014.04.25 조회수 20661
단백질의 생체분자에 대한 결합력 조절기작 규명
우리 학교 생명과학과 김학성 교수와 서문형 박사 연구팀은 단백질이 생체 내 분자를 인식하고 기능을 수행하는데 중요한 단백질의 생체분자에 대한 결합력을 조절하는 메커니즘을 새롭게 밝혀냈다 .
연구 결과는 과학 분야의 권위지인 ‘ 네이처 커뮤니케이션즈 (Nature Communications)’ 24일자 온라인판에 게재됐다.
연구팀은 지난해에 단백질의 생체분자 인식 메커니즘을 최초로 밝혀내 Nature Chemical Biology 에 발표한데 이어 , 이번 연구를 통해 단백질이 생체분자에 대한 결합력을 조절하는 핵심 원리를 규명함으로써 생체 내 단백질의 기능과 조절 기작을 보다 명확하게 이해하는 데 크게 기여할 것으로 전망된다 .
효소나 항체 , 호르몬 등으로 대표되는 단백질은 모든 생명체 내에서 다양한 생체 분자를 특이적으로 인식하여 신호전달 , 면역반응 등을 정교하게 진행시켜 생명현상을 유지하고 조절하는데 가장 중요한 역할을 담당한다 . 이런 과정에서 단백질이 생체분자에 대한 결합력은 두 분자 사이의 결합지속 시간이 정해지고 , 단백질의 생체 내 기능을 결정하고 조절하는 핵심 요인이다 . 이번 연구 결과를 바탕으로 단백질 활성을 보다 정교하게 조절하는 것이 가능해질 것으로 예상된다 .
연구팀은 단백질들이 생체분자를 인식하는 과정에서 , 단백질의 생체분자에 대한 결합력은 두 분자 사이의 비 공유 상호작용의 크기뿐만 아니라 단백질의 고유한 동역학적 성질도 긴밀하게 연관되어 있다는 점에 주목했다 .
김 교수 연구팀은 단백질의 생체분자에 대한 결합력을 결정하는 기본 기작을 규명하기 위해 , 단백질의 allosteric site 에 돌연변이를 가하여 동일한 화학적 접촉면을 가지고 있지만 수십 배에서 수백 배의 결합력 차이를 보이는 다양한 돌연변이 단백질을 제작하였다 . 단백질의 allosteric site 는 생체분자와 직접 결합하는 부위는 아니지만 생체 분자 인식에 영향을 미치는 부위를 지칭한다 .
제작된 돌연변이 단백질들의 고유한 동역학적 성질을 단 분자 수준에서 실시간으로 분석하여 , 생체분자에 대한 결합력이 단백질의 고유한 동력학적 특성인 구조 열림 속도에 직접적으로 연관되어 있음을 밝혀냈다 .
또한 , 단백질이 생체 분자와 직접 결합하는 부위가 아닌 allosteric site 에서 단백질의 고유한 특성을 변화시킬 수 있음을 증명함으로써 , 생체 내 단백질들의 기능을 조절하는 새로운 방법론을 제시하였다 .
연구팀의 이번 결과는 다양한 생명현상을 관장하는 단백질의 특성을 보다 깊이 이해하는데 큰 역할을 하였으며 , 단백질의 생체분자에 대한 결합력을 결정하는 원리를 단백질의 동력학적 관점에서 입증한 것으로 평가되고 있다 .
김 학성 교수는 이번 연구에 대해 “ 지금까지는 단백질의 생체분자에 대한 결합력은 두 분자 사이의 직접적인 상호작용에 의해 결정되는 것으로 알려져 왔지만 , 본 연구를 통해 단백질의 고유한 동력학적 특성 , 즉 구조 열림 속도도 결합력을 결정하는 데 핵심적인 역할을 한다는 새로운 사실을 밝힌 것이 큰 의미가 있다 ” 라고 의의를 밝혔다 .
그림 1. 단백질의 안정한 상태인 열린 구조 (open) 와 불안정한 상태인 부분적으로 열린 구조 (partially closed) 사이의 전환 속도 (kopening; opening rate) 와 결합력 (Kd) 사이의 상관관계 그래프
2014.04.25 조회수 20661 -
 이효철 교수팀, 물에 녹은단백질 모양 변화 실시간 관찰 성공
- 관련 논문, 9월 22일(일)자 네이처 메서드(Nature Methods)誌 게재- 단백질의 작동메커니즘 규명에 중요한 도구 역할 및 신약개발에도 큰 도움 줄 것으로 기대
KAIST(총장 서남표) 화학과 이효철(李效澈, 36) 교수팀이 ‘물에서 변하는 단백질 분자구조를 실시간으로 규명’ 하는데 성공했다. 관련 논문은 네이처 자매지인 네이처 메서드(Nature Methods)誌 9월 22일자 온라인 판에 게재됐고 10월호에 출판될 예정이다.
논문의 제목은 “시간분해 엑스선 산란을 이용한 용액상의 단백질의 구조동역학 추적(Tracking the structural dynamics of proteins in solution using time-resolved wide-angle X-ray scattering)”으로 온라인에 게재되는 논문들 중에서도 특히 주목받는 하이라이트 논문으로 소개될 예정이다. 李 교수는 이 논문의 교신저자다.
이번 연구결과는 李 교수팀의 집념의 산물이라 할 수 있다. 李 교수팀은 지난 2005년 5월, 소금처럼 딱딱하게 고체상으로 굳어 있는 상태에서의 단백질의 안정적인 구조만을 볼 수 있는 기존의 방법을 시간분해 엑스선 결정법으로 발전시켜, 정지되어 있는 단백질의 구조뿐 만 아니라 움직이는 단백질의 동영상을 촬영하는데 성공했다. 관련 논문은 미국 국립과학원회보(PNAS, Proceedings of National Academy of Science)에 발표되었으며, 학계의 큰 주목을 받았다.
그러나 이 방법으로도 해결할 수 없는 치명적인 문제는 우리 몸에서 작용하는 일반적인 단백질은 고체상으로 있지 않고 물에 녹아있는 용액상태라는 점이다. 마치 고체 소금이 물에 녹아 소금물이 되는 것과 같은 원리다. 물은 인간의 몸의 약 70% 이상을 차지하고 있고 생명 유지에 필수적인 단백질들은 물에 녹아 있는 상태로 존재한다고 볼 수 있다. 따라서 단백질이 어떻게 기능을 발휘하는 지를 실시간으로 관측하기 위해서는 물에 녹아 있는 단백질 분자의 모양 변화를 실시간으로 추적할 수 있는 기술이 필요하다.
이러한 목표를 향한 첫 열매로 물에 녹아 있는 간단한 유기분자의 구조변화를 실시간 측정하는 데 성공하였으며, 관련 연구논문이 2005년 7월 사이언스(Science)誌에 발표된 바 있다. 당시 이 연구결과는 용액상에서 분자의 움직임을 실시간 추적할 수 있다는 점 때문에 많은 관심을 불러 일으켰는데, 李 교수는 그 기술을 더욱 발전시키면 단백질에도 응용 가능할 것으로 전망했다. 그러나 일반적으로 단백질은 그 당시 성공한 유기분자보다 적어도 1,000배 정도 크고 구조가 훨씬 더 복잡할 뿐 아니라 훨씬 적은 양으로 존재하기 때문에 물에 녹아 있는 단백질에서도 성공할 수 있다는 것에는 많은 과학자들이 회의적으로 생각했다.
이번 네이처 메서드誌에 발표한 연구결과는 그러한 부정적인 생각을 깨고 기존에 성공한 유기분자보다 ‘1,000배 더 큰 단백질 분자가 물에 녹아 있을 때에 이들의 3차원 구조변화를 실시간으로 관측하는데 성공’한 획기적인 연구성과다. 논문에서는 3가지 종류의 단백질에 대한 연구결과를 발표했는데, 우리 몸에서 산소를 이동하는데 중요한 헤모글로빈 단백질과, 근육에서의 산소공급에 관여하는 미오글로빈 단백질 등이다. 이 외에도 단백질은 주로 접혀있어 특정한 구조를 형성하는데 환경이 바뀌면 이 구조가 풀리게 된다. 풀려 있는 단백질은 일반적으로 제 역할을 할 수 없어 이러한 단백질의 접힘-풀림 현상을 이해하는 것은 매우 중요한데 씨토크롬씨라는 단백질이 풀린 상태에서 접히는 과정도 실시간으로 추적하는데 성공하였다.
이 새로운 기술을 사용하면 물에서 움직이는 단백질의 동영상을 촬영할 수도 있어 단백질의 작동메커니즘을 밝히는 데에 중요한 도구가 될 것이며, 앞으로 신약개발을 하는 데에도 큰 도움을 줄 것으로 기대된다. 또한 이 기술은 단백질은 물론이고 나노물질에도 응용이 가능하므로 BT뿐만 아니라 NT분야에도 기여할 수 있을 것으로 전망된다.
이 연구는 교육과학기술부의 창의적연구진흥사업의 연구비 지원으로 진행되었다. 연구결과는 유럽연합방사광가속기센터에서 측정되었으며, 李 교수의 주도하에 이뤄진 국제적인 공동연구의 성과다.
李 교수는 “현재 포항에 있는 제3세대 가속기에 이어 한국에서도 차세대 광원으로 건설이 논의되고 있는 제4세대 방사광가속기(XFEL)가 성공적으로 가동되면, 현재 발표된 데이터보다 적어도 1,000배정도 더 좋은 데이터를 얻을 수 있을 것으로 예상된다.”고 밝혔다.
<이효철 교수 프로필>
■ 학 력
1990 경남과학고 2년 수료, KAIST 화학과 학사과정 입학
1994 KAIST 화학과 학사과정 졸업
1994 Caltech(California Institute of Technology) 박사과정 입학
2001 Caltech 졸업(박사)
2001 시카고 대학 박사 후 연구원(Post Doc.)
2003.8.1-2007.2.28 KAIST 화학과 조교수 2007.3.1-현재 KAIST 화학과 부교수
■ 수상경력
2006 젊은 과학자상(과학기술부/한국과학기술한림원)
2006 과학기술우수논문상(한국과학기술단체총연합회)
2006 KAIST 학술상 2001-2003 美國 대먼 러년 암재단(Damon Runyon Cancer Research Foundation)펠로우쉽
(설명) 시간분해 엑스선 산란의 개념을 예술적으로 표현한 그림
2008.09.22 조회수 30226
이효철 교수팀, 물에 녹은단백질 모양 변화 실시간 관찰 성공
- 관련 논문, 9월 22일(일)자 네이처 메서드(Nature Methods)誌 게재- 단백질의 작동메커니즘 규명에 중요한 도구 역할 및 신약개발에도 큰 도움 줄 것으로 기대
KAIST(총장 서남표) 화학과 이효철(李效澈, 36) 교수팀이 ‘물에서 변하는 단백질 분자구조를 실시간으로 규명’ 하는데 성공했다. 관련 논문은 네이처 자매지인 네이처 메서드(Nature Methods)誌 9월 22일자 온라인 판에 게재됐고 10월호에 출판될 예정이다.
논문의 제목은 “시간분해 엑스선 산란을 이용한 용액상의 단백질의 구조동역학 추적(Tracking the structural dynamics of proteins in solution using time-resolved wide-angle X-ray scattering)”으로 온라인에 게재되는 논문들 중에서도 특히 주목받는 하이라이트 논문으로 소개될 예정이다. 李 교수는 이 논문의 교신저자다.
이번 연구결과는 李 교수팀의 집념의 산물이라 할 수 있다. 李 교수팀은 지난 2005년 5월, 소금처럼 딱딱하게 고체상으로 굳어 있는 상태에서의 단백질의 안정적인 구조만을 볼 수 있는 기존의 방법을 시간분해 엑스선 결정법으로 발전시켜, 정지되어 있는 단백질의 구조뿐 만 아니라 움직이는 단백질의 동영상을 촬영하는데 성공했다. 관련 논문은 미국 국립과학원회보(PNAS, Proceedings of National Academy of Science)에 발표되었으며, 학계의 큰 주목을 받았다.
그러나 이 방법으로도 해결할 수 없는 치명적인 문제는 우리 몸에서 작용하는 일반적인 단백질은 고체상으로 있지 않고 물에 녹아있는 용액상태라는 점이다. 마치 고체 소금이 물에 녹아 소금물이 되는 것과 같은 원리다. 물은 인간의 몸의 약 70% 이상을 차지하고 있고 생명 유지에 필수적인 단백질들은 물에 녹아 있는 상태로 존재한다고 볼 수 있다. 따라서 단백질이 어떻게 기능을 발휘하는 지를 실시간으로 관측하기 위해서는 물에 녹아 있는 단백질 분자의 모양 변화를 실시간으로 추적할 수 있는 기술이 필요하다.
이러한 목표를 향한 첫 열매로 물에 녹아 있는 간단한 유기분자의 구조변화를 실시간 측정하는 데 성공하였으며, 관련 연구논문이 2005년 7월 사이언스(Science)誌에 발표된 바 있다. 당시 이 연구결과는 용액상에서 분자의 움직임을 실시간 추적할 수 있다는 점 때문에 많은 관심을 불러 일으켰는데, 李 교수는 그 기술을 더욱 발전시키면 단백질에도 응용 가능할 것으로 전망했다. 그러나 일반적으로 단백질은 그 당시 성공한 유기분자보다 적어도 1,000배 정도 크고 구조가 훨씬 더 복잡할 뿐 아니라 훨씬 적은 양으로 존재하기 때문에 물에 녹아 있는 단백질에서도 성공할 수 있다는 것에는 많은 과학자들이 회의적으로 생각했다.
이번 네이처 메서드誌에 발표한 연구결과는 그러한 부정적인 생각을 깨고 기존에 성공한 유기분자보다 ‘1,000배 더 큰 단백질 분자가 물에 녹아 있을 때에 이들의 3차원 구조변화를 실시간으로 관측하는데 성공’한 획기적인 연구성과다. 논문에서는 3가지 종류의 단백질에 대한 연구결과를 발표했는데, 우리 몸에서 산소를 이동하는데 중요한 헤모글로빈 단백질과, 근육에서의 산소공급에 관여하는 미오글로빈 단백질 등이다. 이 외에도 단백질은 주로 접혀있어 특정한 구조를 형성하는데 환경이 바뀌면 이 구조가 풀리게 된다. 풀려 있는 단백질은 일반적으로 제 역할을 할 수 없어 이러한 단백질의 접힘-풀림 현상을 이해하는 것은 매우 중요한데 씨토크롬씨라는 단백질이 풀린 상태에서 접히는 과정도 실시간으로 추적하는데 성공하였다.
이 새로운 기술을 사용하면 물에서 움직이는 단백질의 동영상을 촬영할 수도 있어 단백질의 작동메커니즘을 밝히는 데에 중요한 도구가 될 것이며, 앞으로 신약개발을 하는 데에도 큰 도움을 줄 것으로 기대된다. 또한 이 기술은 단백질은 물론이고 나노물질에도 응용이 가능하므로 BT뿐만 아니라 NT분야에도 기여할 수 있을 것으로 전망된다.
이 연구는 교육과학기술부의 창의적연구진흥사업의 연구비 지원으로 진행되었다. 연구결과는 유럽연합방사광가속기센터에서 측정되었으며, 李 교수의 주도하에 이뤄진 국제적인 공동연구의 성과다.
李 교수는 “현재 포항에 있는 제3세대 가속기에 이어 한국에서도 차세대 광원으로 건설이 논의되고 있는 제4세대 방사광가속기(XFEL)가 성공적으로 가동되면, 현재 발표된 데이터보다 적어도 1,000배정도 더 좋은 데이터를 얻을 수 있을 것으로 예상된다.”고 밝혔다.
<이효철 교수 프로필>
■ 학 력
1990 경남과학고 2년 수료, KAIST 화학과 학사과정 입학
1994 KAIST 화학과 학사과정 졸업
1994 Caltech(California Institute of Technology) 박사과정 입학
2001 Caltech 졸업(박사)
2001 시카고 대학 박사 후 연구원(Post Doc.)
2003.8.1-2007.2.28 KAIST 화학과 조교수 2007.3.1-현재 KAIST 화학과 부교수
■ 수상경력
2006 젊은 과학자상(과학기술부/한국과학기술한림원)
2006 과학기술우수논문상(한국과학기술단체총연합회)
2006 KAIST 학술상 2001-2003 美國 대먼 러년 암재단(Damon Runyon Cancer Research Foundation)펠로우쉽
(설명) 시간분해 엑스선 산란의 개념을 예술적으로 표현한 그림
2008.09.22 조회수 30226