%EC%83%9D%ED%95%A9%EC%84%B1
-
 누구나 천연물 합성 경로 예측 가능하다
식물은 고착생활을 하면서 환경 스트레스에 대응하기 위해 진화적으로 다양하고 복잡한 천연물을 만들고 있다. 이 천연물들은 인류의 생존에도 필수적인 역할을 하고 있는데 미국식품의약국(FDA) 승인 저분자 약물의 30% 이상이 식물 천연물에 기초하고 있다는 사실이 이를 증명하고 있다. 한국 연구진이 딥러닝을 활용, 천연물의 역-생합성 경로를 예측하는 모델을 제시해 천연물 기반 의약품 대량 생산에 활용될 수 있도록 해 화제다.
우리 대학 생명과학과 김상규 교수 연구팀과 김재철AI대학원 황성주 교수 연구팀의 공동연구를 통해 천연물 생합성 경로를 예측하는 딥러닝 모델을 개발하고 부산대학교 박정빈 교수 연구팀과 협업을 통해 관심있는 누구나 모델을 활용할 수 있도록 인터넷 웹사이트(readretro.net)를 구축했다고 14일 밝혔다.
천연물 활용 및 대량 생산을 위해서는 생합성 경로를 밝히는 것이 필수적이다. 하지만 복잡한 구조를 가진 많은 약용 천연물의 생합성 경로가 잘 밝혀져 있지 않아 현재는 식물로부터 직접 추출해 사용하고 있다. 생합성 경로 연구는 도전적이지만 이를 밝히고 생합성 효소를 찾을 수 있다면 천연물의 활용 가치를 증진할 수 있다.
식물 천연물 생합성 경로 연구의 첫 단계는 식물이 어떻게 물질을 합성하는지 그 경로를 역추적(역합성 경로를 제시)하는 것으로 시작된다. 공동연구팀은 딥러닝을 활용해 천연물의 역-생합성 경로를 예측하는 모델을 제시했다. 이번 연구에서 연구팀은 발전된 역합성 모델과 생화학적 직관을 결합해 성공적으로 천연물 생합성 경로 예측을 수행하는 인공지능 모델을 개발했다.
연구팀은 개발한 인공지능의 이름을 ‘역합성을 읽어내는 모델’이라는 뜻을 담아 ‘리드레트로(READRetro)’라고 명명했다. 이 모델은 천연물 역합성을 예측하는 인공지능 모델 중 최고의 성능을 보이는 것으로 확인되었고 이를 개별 연구자들이 쉽게 활용할 수 있도록 구현했다는 데 의미를 가진다.
김상규 교수는 “식물이 어떻게 복잡한 천연물을 만들 수 있게 되었는지 이해하는 기초 연구에서부터 천연물 기반 의약품을 대량으로 생산하기 위한 합성생물학 연구 등에 활용이 기대된다. 추후 합성 경로를 매개하는 효소를 예측하거나 거대 분자의 역합성 예측 정확도를 높이는 연구를 실시할 계획이다” 라고 말했다. 또한 김 교수는 “이번 연구는 2022년 KAIST 인공지능연구원에서 주최한 멜팅 팟(Melting pot) 세미나에서 저와 황성주 교수가 발제자와 토론자로 만난 인연으로 시작됐다. KAIST가 표방하는 융합이 생화학자와 전산학자의 힘을 합쳐 이끌어 낸 좋은 연구로 큰 의미를 갖는다고 생각한다”고 강조했다.
생명과학과 김태인 석박사통합과정과 김재철AI대학원 이슬 석박사통합과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘뉴 파이톨로지스트(New Phytologist)'에 출판됐다. (논문명 : READRetro: natural product biosynthesis predicting with retrieval-augmented dual-view retrosynthesis).
한편 이번 연구는 KAIST POST-AI, 한국연구재단, 과학기술정보통신부 등의 지원을 받아 수행됐다.
2024.08.14 조회수 6162
누구나 천연물 합성 경로 예측 가능하다
식물은 고착생활을 하면서 환경 스트레스에 대응하기 위해 진화적으로 다양하고 복잡한 천연물을 만들고 있다. 이 천연물들은 인류의 생존에도 필수적인 역할을 하고 있는데 미국식품의약국(FDA) 승인 저분자 약물의 30% 이상이 식물 천연물에 기초하고 있다는 사실이 이를 증명하고 있다. 한국 연구진이 딥러닝을 활용, 천연물의 역-생합성 경로를 예측하는 모델을 제시해 천연물 기반 의약품 대량 생산에 활용될 수 있도록 해 화제다.
우리 대학 생명과학과 김상규 교수 연구팀과 김재철AI대학원 황성주 교수 연구팀의 공동연구를 통해 천연물 생합성 경로를 예측하는 딥러닝 모델을 개발하고 부산대학교 박정빈 교수 연구팀과 협업을 통해 관심있는 누구나 모델을 활용할 수 있도록 인터넷 웹사이트(readretro.net)를 구축했다고 14일 밝혔다.
천연물 활용 및 대량 생산을 위해서는 생합성 경로를 밝히는 것이 필수적이다. 하지만 복잡한 구조를 가진 많은 약용 천연물의 생합성 경로가 잘 밝혀져 있지 않아 현재는 식물로부터 직접 추출해 사용하고 있다. 생합성 경로 연구는 도전적이지만 이를 밝히고 생합성 효소를 찾을 수 있다면 천연물의 활용 가치를 증진할 수 있다.
식물 천연물 생합성 경로 연구의 첫 단계는 식물이 어떻게 물질을 합성하는지 그 경로를 역추적(역합성 경로를 제시)하는 것으로 시작된다. 공동연구팀은 딥러닝을 활용해 천연물의 역-생합성 경로를 예측하는 모델을 제시했다. 이번 연구에서 연구팀은 발전된 역합성 모델과 생화학적 직관을 결합해 성공적으로 천연물 생합성 경로 예측을 수행하는 인공지능 모델을 개발했다.
연구팀은 개발한 인공지능의 이름을 ‘역합성을 읽어내는 모델’이라는 뜻을 담아 ‘리드레트로(READRetro)’라고 명명했다. 이 모델은 천연물 역합성을 예측하는 인공지능 모델 중 최고의 성능을 보이는 것으로 확인되었고 이를 개별 연구자들이 쉽게 활용할 수 있도록 구현했다는 데 의미를 가진다.
김상규 교수는 “식물이 어떻게 복잡한 천연물을 만들 수 있게 되었는지 이해하는 기초 연구에서부터 천연물 기반 의약품을 대량으로 생산하기 위한 합성생물학 연구 등에 활용이 기대된다. 추후 합성 경로를 매개하는 효소를 예측하거나 거대 분자의 역합성 예측 정확도를 높이는 연구를 실시할 계획이다” 라고 말했다. 또한 김 교수는 “이번 연구는 2022년 KAIST 인공지능연구원에서 주최한 멜팅 팟(Melting pot) 세미나에서 저와 황성주 교수가 발제자와 토론자로 만난 인연으로 시작됐다. KAIST가 표방하는 융합이 생화학자와 전산학자의 힘을 합쳐 이끌어 낸 좋은 연구로 큰 의미를 갖는다고 생각한다”고 강조했다.
생명과학과 김태인 석박사통합과정과 김재철AI대학원 이슬 석박사통합과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘뉴 파이톨로지스트(New Phytologist)'에 출판됐다. (논문명 : READRetro: natural product biosynthesis predicting with retrieval-augmented dual-view retrosynthesis).
한편 이번 연구는 KAIST POST-AI, 한국연구재단, 과학기술정보통신부 등의 지원을 받아 수행됐다.
2024.08.14 조회수 6162 -
 미생물 기반 다양한 일차 아민 생산 기술 최초 개발
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 `비식용 바이오매스를 여러 가지 짧은 길이의 일차 아민들로 전환하는 미생물 균주 개발'에 성공했다고 11일 밝혔다.
이번 연구결과는 국제적인 학술지인 `네이쳐 커뮤니케이션스(Nature Communications)'에 게재됐다.
※ 논문명 : Microbial production of multiple short-chain primary amines via retrobiosynthesis
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 김동인(한국과학기술원, 공동 제1저자), 채동언(한국과학기술원, 공동 제1저자), 김현욱(한국과학기술원, 공동 제1저자), 장우대(한국과학기술원, 제4저자), 포함 총 5명
석유화학산업은 화석원료를 이용해 우리 생활 전반에 광범위하게 이용되는 범용화학물질들을 생산해왔다. 그러나 원유 매장량 고갈에 대한 우려와 원유 산업으로부터 발생하는 지구 온난화 등의 환경문제가 전 세계적으로 매우 심각한 상황이다. 특히 우리나라의 경우 석유를 전량 수입에 의존하기 때문에, 국제 유가 변동에 매우 취약한 실정이다. 이에 환경문제를 해결하면서 원유를 대체할 수 있는 지속 가능한 바이오리파이너리의 구축이 시급히 요구되고 있다.
바이오 리파이너리란 화석원료가 아닌 비식용 바이오매스를 원료로 사용해 미생물로 산업적으로 유용한 화학물질들을 생산하는 기술이다. 여기서 미생물은 원료인 바이오매스를 우리가 원하는 화학물질로 전환하는 세포 공장과 같은 역할을 한다. 이러한 미생물의 복잡한 대사회로를 효과적으로 조작할 수 있게 하는 시스템 대사공학은 바이오 리파이너리에서 핵심기술 중 하나다.
지금껏 석유화학 공정을 통해서 합성되던 화학물질 중에는 미생물 시스템 대사공학을 통해서 바이오 기반으로 생산되는 사례가 점차 늘고 있지만, 아직 의약품 및 농약품들의 전구체로 널리 사용되는 짧은 탄소 길이를 가진 일차 아민들의 생산은 보고된 바가 없었다.
이에 KAIST 이상엽 특훈교수 연구팀은 여러 가지 짧은 탄소 길이를 갖는 일차 아민들을 생산할 수 있는 대장균 균주 개발 연구를 수행했다.
지금까지 이러한 일차 아민들을 생산하는 균주들이 개발되지 못한 가장 큰 이유는 생합성 대사회로의 부재였다. 이러한 문제를 해결하기 위해 역 생합성 시뮬레이션을 통해 모든 가능한 대사경로들을 예측했다. 그 후 전구체 선택과정을 통해 가장 유망한 대사회로들을 선정했다.
이렇게 디자인된 신규 대사회로들을 실제 실험을 통해 검증했으며 이를 통해 10가지 종류의 다른 짧은 길이의 일차 아민들을 생산하는 대장균 균주들을 최초로 개발하는 데 성공했다.
또한 대표적인 일차 아민들을 선정해 폐목재, 잡초 등 지구상에서 가장 풍부한 바이오매스의 주원료인 포도당을 단일 탄소원으로 사용한 생산과 시스템 대사공학을 통한 생산량 증대를 보임으로써 바이오 기반 생산의 가능성을 보여줬다.
이번 연구에서 활용된 역 생합성과 전구체 선택과정을 같이 사용한 전략은 짧은 탄소 길이를 가진 일차 아민들 뿐만 아니라 다른 그룹의 여러 가지 화학물질들을 동시에 생산하는 대사회로들을 구축하는 데도 유용하게 쓰일 것으로 예상된다.
이상엽 특훈교수는 “이번 연구는 지금까지 석유화학 산업 기반으로만 생산할 수 있었던 짧은 탄소 길이를 가진 일차 아민들을 재생 가능한 바이오 기반 화학산업을 통해 생산할 가능성을 세계 최초로 제시한 점에 의의가 있다”며 “앞으로 더 많은 연구를 통해 생산량과 생산성을 증대시킬 계획이다”라고 밝혔다.
한편 이번 연구는 과기정통부가 지원하는 기후변화대응기술개발사업의 '바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제'의 지원을 받아 수행됐다.
2021.01.11 조회수 65820
미생물 기반 다양한 일차 아민 생산 기술 최초 개발
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 `비식용 바이오매스를 여러 가지 짧은 길이의 일차 아민들로 전환하는 미생물 균주 개발'에 성공했다고 11일 밝혔다.
이번 연구결과는 국제적인 학술지인 `네이쳐 커뮤니케이션스(Nature Communications)'에 게재됐다.
※ 논문명 : Microbial production of multiple short-chain primary amines via retrobiosynthesis
※ 저자 정보 : 이상엽(한국과학기술원, 교신저자), 김동인(한국과학기술원, 공동 제1저자), 채동언(한국과학기술원, 공동 제1저자), 김현욱(한국과학기술원, 공동 제1저자), 장우대(한국과학기술원, 제4저자), 포함 총 5명
석유화학산업은 화석원료를 이용해 우리 생활 전반에 광범위하게 이용되는 범용화학물질들을 생산해왔다. 그러나 원유 매장량 고갈에 대한 우려와 원유 산업으로부터 발생하는 지구 온난화 등의 환경문제가 전 세계적으로 매우 심각한 상황이다. 특히 우리나라의 경우 석유를 전량 수입에 의존하기 때문에, 국제 유가 변동에 매우 취약한 실정이다. 이에 환경문제를 해결하면서 원유를 대체할 수 있는 지속 가능한 바이오리파이너리의 구축이 시급히 요구되고 있다.
바이오 리파이너리란 화석원료가 아닌 비식용 바이오매스를 원료로 사용해 미생물로 산업적으로 유용한 화학물질들을 생산하는 기술이다. 여기서 미생물은 원료인 바이오매스를 우리가 원하는 화학물질로 전환하는 세포 공장과 같은 역할을 한다. 이러한 미생물의 복잡한 대사회로를 효과적으로 조작할 수 있게 하는 시스템 대사공학은 바이오 리파이너리에서 핵심기술 중 하나다.
지금껏 석유화학 공정을 통해서 합성되던 화학물질 중에는 미생물 시스템 대사공학을 통해서 바이오 기반으로 생산되는 사례가 점차 늘고 있지만, 아직 의약품 및 농약품들의 전구체로 널리 사용되는 짧은 탄소 길이를 가진 일차 아민들의 생산은 보고된 바가 없었다.
이에 KAIST 이상엽 특훈교수 연구팀은 여러 가지 짧은 탄소 길이를 갖는 일차 아민들을 생산할 수 있는 대장균 균주 개발 연구를 수행했다.
지금까지 이러한 일차 아민들을 생산하는 균주들이 개발되지 못한 가장 큰 이유는 생합성 대사회로의 부재였다. 이러한 문제를 해결하기 위해 역 생합성 시뮬레이션을 통해 모든 가능한 대사경로들을 예측했다. 그 후 전구체 선택과정을 통해 가장 유망한 대사회로들을 선정했다.
이렇게 디자인된 신규 대사회로들을 실제 실험을 통해 검증했으며 이를 통해 10가지 종류의 다른 짧은 길이의 일차 아민들을 생산하는 대장균 균주들을 최초로 개발하는 데 성공했다.
또한 대표적인 일차 아민들을 선정해 폐목재, 잡초 등 지구상에서 가장 풍부한 바이오매스의 주원료인 포도당을 단일 탄소원으로 사용한 생산과 시스템 대사공학을 통한 생산량 증대를 보임으로써 바이오 기반 생산의 가능성을 보여줬다.
이번 연구에서 활용된 역 생합성과 전구체 선택과정을 같이 사용한 전략은 짧은 탄소 길이를 가진 일차 아민들 뿐만 아니라 다른 그룹의 여러 가지 화학물질들을 동시에 생산하는 대사회로들을 구축하는 데도 유용하게 쓰일 것으로 예상된다.
이상엽 특훈교수는 “이번 연구는 지금까지 석유화학 산업 기반으로만 생산할 수 있었던 짧은 탄소 길이를 가진 일차 아민들을 재생 가능한 바이오 기반 화학산업을 통해 생산할 가능성을 세계 최초로 제시한 점에 의의가 있다”며 “앞으로 더 많은 연구를 통해 생산량과 생산성을 증대시킬 계획이다”라고 밝혔다.
한편 이번 연구는 과기정통부가 지원하는 기후변화대응기술개발사업의 '바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제'의 지원을 받아 수행됐다.
2021.01.11 조회수 65820 -
 한순규 교수, 마약중독치료제 및 항암제 후보물질 합성 기술 개발
〈 왼쪽부터 임형근 연구원, 한순규 교수, 성시광 연구원 〉
우리 대학 화학과 한순규 교수 연구팀이 마약중독 치료제, 항암제 후보물질로 쓰일 수 있는 천연물을 인공적으로 합성하는 데 성공했다.
연구팀은 시중에서 구할 수 있는 카타란틴(catharanthine)을 원료로 해 산화와 재배열을 통해 7종의 이보가 및 포스트이보가 천연물을 합성해냈다. 이번 연구결과는 마약중독 치료제, 항암제 후보물질 생산의 원천기술이 될 것으로 기대된다.
성시광, 임형근 석박사통합과정이 공동 1 저자로 참여한 연구는 화학 분야 국제 학술지이자 셀(Cell) 자매지인 ‘켐(Chem)’ 11월 15일 자에 게재됐다. (논문명 : Biosynthetically Inspired Transformation of Iboga to Monomeric Post-Iboga Alkaloids, 생합성 가설에 기반한 이보가 알칼로이드의 단위체 포스트이보가 알칼로이드로의 변환)
이보가 알칼로이드가 학계의 관심을 끈 이유는 이들의 천연물군이 마약중독 치료제로써 가능성을 보였기 때문이다. 또한 이보가 알칼로이드가 생 합성적으로 변형된 천연물 중 빈블라스틴(vinblastine)은 현재 항암제로 쓰이고 있다. 최근에는 이보가 알칼로이드로부터 자연적으로 파생된 다양한 형태의 천연물군이 대거 발견되며 학계와 산업계의 관심도 커지고 있다.
천연물 전합성(全合成)은 간단한 시작물질로부터 다단계의 화학반응을 통해 원하는 천연물을 합성하는 학문 분야이다. 그러나 이 다단계 화학반응을 거치는 과정에서 합성효율이 낮아지는 한계가 있다.
한 교수 연구팀은 이보가 알칼로이드 천연물인 카타란틴이 미 식품의약국(FDA) 승인 항암제인 나벨빈(Navelbine®)의 공업원료로 쓰여 시중에서 쉽게 구할 수 있다는 점에 착안했다. 산화와 재배열을 통해 카타란틴의 구조를 변형시켜 고부가가치의 포스트이보가 천연물을 효율적으로 합성했다.
연구팀은 이번 연구에서 이보가 알칼로이드에서 자연적으로 파생되면서 분자적 재배열을 이룬 천연물군을 ‘포스트이보가’ 알칼로이드라고 이름 지었다. 그리고 다양한 효소의 작용을 통해 식물 내에서 이뤄지는 이보가 골격의 분자적 재배열을 화학적으로 구현하는 데 성공했다.
한 교수팀이 합성에 성공한 포스트이보가 알칼로이드는 타버틴진(tabertinggine), 보아틴진(voatinggine), 디피닌(dippinine) B로 이 중 보아틴진과 디피닌 B는 최초의 합성이다.
특히 디피닌 천연물군은 30년 이상 학계의 관심을 받아왔음에도 정복하지 못한 난공불락의 천연물로 여겨졌는데 한 교수 연구팀이 이번에 최초로 합성에 성공했다.
한 교수는 “이번 연구는 포스트이보가 알칼로이드 합성에 새로운 패러다임을 부여한 연구이다”며 “본 연구를 통해 다양한 항암제 및 마약중독 치료제 후보물질을 합성할 수 있는 원천기술을 확보했다는 데 의의가 있다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업 중견연구자지원사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 포스트이보가 알칼로이드의 합성전략 모식도
그림2. 디피닌 B의 합성 경로
2018.11.15 조회수 12560
한순규 교수, 마약중독치료제 및 항암제 후보물질 합성 기술 개발
〈 왼쪽부터 임형근 연구원, 한순규 교수, 성시광 연구원 〉
우리 대학 화학과 한순규 교수 연구팀이 마약중독 치료제, 항암제 후보물질로 쓰일 수 있는 천연물을 인공적으로 합성하는 데 성공했다.
연구팀은 시중에서 구할 수 있는 카타란틴(catharanthine)을 원료로 해 산화와 재배열을 통해 7종의 이보가 및 포스트이보가 천연물을 합성해냈다. 이번 연구결과는 마약중독 치료제, 항암제 후보물질 생산의 원천기술이 될 것으로 기대된다.
성시광, 임형근 석박사통합과정이 공동 1 저자로 참여한 연구는 화학 분야 국제 학술지이자 셀(Cell) 자매지인 ‘켐(Chem)’ 11월 15일 자에 게재됐다. (논문명 : Biosynthetically Inspired Transformation of Iboga to Monomeric Post-Iboga Alkaloids, 생합성 가설에 기반한 이보가 알칼로이드의 단위체 포스트이보가 알칼로이드로의 변환)
이보가 알칼로이드가 학계의 관심을 끈 이유는 이들의 천연물군이 마약중독 치료제로써 가능성을 보였기 때문이다. 또한 이보가 알칼로이드가 생 합성적으로 변형된 천연물 중 빈블라스틴(vinblastine)은 현재 항암제로 쓰이고 있다. 최근에는 이보가 알칼로이드로부터 자연적으로 파생된 다양한 형태의 천연물군이 대거 발견되며 학계와 산업계의 관심도 커지고 있다.
천연물 전합성(全合成)은 간단한 시작물질로부터 다단계의 화학반응을 통해 원하는 천연물을 합성하는 학문 분야이다. 그러나 이 다단계 화학반응을 거치는 과정에서 합성효율이 낮아지는 한계가 있다.
한 교수 연구팀은 이보가 알칼로이드 천연물인 카타란틴이 미 식품의약국(FDA) 승인 항암제인 나벨빈(Navelbine®)의 공업원료로 쓰여 시중에서 쉽게 구할 수 있다는 점에 착안했다. 산화와 재배열을 통해 카타란틴의 구조를 변형시켜 고부가가치의 포스트이보가 천연물을 효율적으로 합성했다.
연구팀은 이번 연구에서 이보가 알칼로이드에서 자연적으로 파생되면서 분자적 재배열을 이룬 천연물군을 ‘포스트이보가’ 알칼로이드라고 이름 지었다. 그리고 다양한 효소의 작용을 통해 식물 내에서 이뤄지는 이보가 골격의 분자적 재배열을 화학적으로 구현하는 데 성공했다.
한 교수팀이 합성에 성공한 포스트이보가 알칼로이드는 타버틴진(tabertinggine), 보아틴진(voatinggine), 디피닌(dippinine) B로 이 중 보아틴진과 디피닌 B는 최초의 합성이다.
특히 디피닌 천연물군은 30년 이상 학계의 관심을 받아왔음에도 정복하지 못한 난공불락의 천연물로 여겨졌는데 한 교수 연구팀이 이번에 최초로 합성에 성공했다.
한 교수는 “이번 연구는 포스트이보가 알칼로이드 합성에 새로운 패러다임을 부여한 연구이다”며 “본 연구를 통해 다양한 항암제 및 마약중독 치료제 후보물질을 합성할 수 있는 원천기술을 확보했다는 데 의의가 있다”라고 말했다.
이번 연구는 한국연구재단의 이공분야 기초연구사업 중견연구자지원사업의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 포스트이보가 알칼로이드의 합성전략 모식도
그림2. 디피닌 B의 합성 경로
2018.11.15 조회수 12560 -
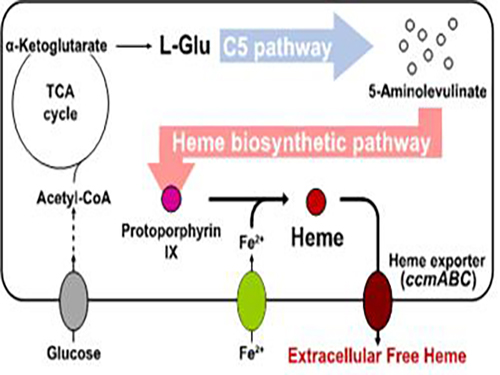 이상엽 교수, 미생물 발효한 친환경 기술로 햄(haem) 생산 기술 개발
〈 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 대장균을 발효시켜 바이오매스로부터 헴(haem)을 생산하고 세포 밖으로 분비할 수 있는 기술을 개발했다.
이는 대사공학 전략을 통해 헴의 생산량을 대폭 높이고 생산된 헴을 효과적으로 세포 바깥에 분비하는 데 성공한 친환경적, 효율적 원천기술로 생산한 헴을 이용해 각종 산업의 확장에 기여할 수 있을 것으로 기대된다.
자오신루이, 최경록 연구원이 참여한 이번 연구는 국제 학술지 ‘네이처 카탈리시스(Nature Catalysis)’ 8월 28일자 온라인 판에 게재됐다.
헴은 생명 유지에 필수적인 철분으로 혈액에서 산소를 운반하는 헤모글로빈이나 세포 호흡에 필수적인 사이토크롬을 비롯한 여러 중요한 단백질 기능에 핵심적 역할을 한다. 특히 인체 흡수율이 높기 때문에 고급 철분제나 약물로 이용된다.
무분별한 가축의 사육이 여러 사회 이슈를 불러일으키는 상황에서 최근 헴이 고기 맛을 내는 핵심 요소로 밝혀지며 콩고기에 미생물이나 식물에서 추출한 헴을 넣어 맛과 영양, 환경 등을 고려한 콩고기 조리법이 주목받기도 했다.
그러나 기존의 헴 생산 방식은 유기 용매를 이용한 동물의 혈액과 일부 식물 조직으로부터의 추출에 의존하고 있기 때문에 비효율적일 뿐 아니라 친환경적이지 않다는 한계가 있다.
대장균을 이용한 헴 생산 기술이 개발된 바 있지만 생산량이 수 밀리그램(mg)에 그치고 생산된 헴이 세포 내에 축적되기 때문에 헴 추출 등의 문제를 해결하지 못했다. 따라서 고농도로 헴을 생산하면서도 세포 바깥으로 헴을 분비해 정제를 용이하게 하는 친환경 생산 시스템 개발이 필요했다.
연구팀은 바이오매스를 이용한 고효율 헴 생산 미생물을 제작하기 위해 대장균 고유의 헴 생합성 회로를 구성했다. 또한 기존에 사용되지 않았던 C5 대사회로를 사용해 헴 생산의 전구체인 5-아미노레불린산을 생합성했다.
이를 통해 원가가 비싸고 세포 독성을 일으키는 물질인 글리신을 사용하지 않고도 헴 생산량을 대폭 높였다. 이 과정에서 연구팀은 헴 생산량이 향상됨에 따라 생산된 헴이 상당 비율로 세포 바깥으로 분비되는 것을 발견했다.
연구팀은 구성한 대장균의 헴 분비량을 더욱 높이기 위해 사이토크롬 생합성에 관여한다고 알려진 단백질인 헴 엑스포터를 과발현함으로써 헴 생산량과 세포외 분비량 모두가 향상된 헴 분비생산 균주를 개발했다. 이를 통해 헴 엑스포터와 헴의 세포외 분비 사이의 연관성을 밝혔다.
이번 연구를 통해 개발된 기술을 활용하면 환경, 위생, 윤리적 문제없이 재생 가능한 자원을 통해 헴 생산을 할 수 있다. 향후 의료 및 식품 산업 등 헴을 이용하는 다양한 분야에 중요한 역할을 할 것으로 예상된다.
이 특훈교수는 “건강 보조제, 의약품, 식품 첨가물 등 다양한 활용이 가능한 헴을 미생물발효를 통해 고효율로 생산했다”며 “생산된 헴의 3분의 2 가량을 세포 바깥으로 분비하는 시스템을 개발함으로써 산업적 활용을 위한 헴의 생산 및 정제를 용이하게 했다는 의의를 갖는다”고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 ‘바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제’ 지원을 받아 수행됐다.
□ 그림 설명
그림1. 대장균을 이용한 헴 생산 및 세포외 분비 전체 개념도
2018.09.06 조회수 18773
이상엽 교수, 미생물 발효한 친환경 기술로 햄(haem) 생산 기술 개발
〈 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 대장균을 발효시켜 바이오매스로부터 헴(haem)을 생산하고 세포 밖으로 분비할 수 있는 기술을 개발했다.
이는 대사공학 전략을 통해 헴의 생산량을 대폭 높이고 생산된 헴을 효과적으로 세포 바깥에 분비하는 데 성공한 친환경적, 효율적 원천기술로 생산한 헴을 이용해 각종 산업의 확장에 기여할 수 있을 것으로 기대된다.
자오신루이, 최경록 연구원이 참여한 이번 연구는 국제 학술지 ‘네이처 카탈리시스(Nature Catalysis)’ 8월 28일자 온라인 판에 게재됐다.
헴은 생명 유지에 필수적인 철분으로 혈액에서 산소를 운반하는 헤모글로빈이나 세포 호흡에 필수적인 사이토크롬을 비롯한 여러 중요한 단백질 기능에 핵심적 역할을 한다. 특히 인체 흡수율이 높기 때문에 고급 철분제나 약물로 이용된다.
무분별한 가축의 사육이 여러 사회 이슈를 불러일으키는 상황에서 최근 헴이 고기 맛을 내는 핵심 요소로 밝혀지며 콩고기에 미생물이나 식물에서 추출한 헴을 넣어 맛과 영양, 환경 등을 고려한 콩고기 조리법이 주목받기도 했다.
그러나 기존의 헴 생산 방식은 유기 용매를 이용한 동물의 혈액과 일부 식물 조직으로부터의 추출에 의존하고 있기 때문에 비효율적일 뿐 아니라 친환경적이지 않다는 한계가 있다.
대장균을 이용한 헴 생산 기술이 개발된 바 있지만 생산량이 수 밀리그램(mg)에 그치고 생산된 헴이 세포 내에 축적되기 때문에 헴 추출 등의 문제를 해결하지 못했다. 따라서 고농도로 헴을 생산하면서도 세포 바깥으로 헴을 분비해 정제를 용이하게 하는 친환경 생산 시스템 개발이 필요했다.
연구팀은 바이오매스를 이용한 고효율 헴 생산 미생물을 제작하기 위해 대장균 고유의 헴 생합성 회로를 구성했다. 또한 기존에 사용되지 않았던 C5 대사회로를 사용해 헴 생산의 전구체인 5-아미노레불린산을 생합성했다.
이를 통해 원가가 비싸고 세포 독성을 일으키는 물질인 글리신을 사용하지 않고도 헴 생산량을 대폭 높였다. 이 과정에서 연구팀은 헴 생산량이 향상됨에 따라 생산된 헴이 상당 비율로 세포 바깥으로 분비되는 것을 발견했다.
연구팀은 구성한 대장균의 헴 분비량을 더욱 높이기 위해 사이토크롬 생합성에 관여한다고 알려진 단백질인 헴 엑스포터를 과발현함으로써 헴 생산량과 세포외 분비량 모두가 향상된 헴 분비생산 균주를 개발했다. 이를 통해 헴 엑스포터와 헴의 세포외 분비 사이의 연관성을 밝혔다.
이번 연구를 통해 개발된 기술을 활용하면 환경, 위생, 윤리적 문제없이 재생 가능한 자원을 통해 헴 생산을 할 수 있다. 향후 의료 및 식품 산업 등 헴을 이용하는 다양한 분야에 중요한 역할을 할 것으로 예상된다.
이 특훈교수는 “건강 보조제, 의약품, 식품 첨가물 등 다양한 활용이 가능한 헴을 미생물발효를 통해 고효율로 생산했다”며 “생산된 헴의 3분의 2 가량을 세포 바깥으로 분비하는 시스템을 개발함으로써 산업적 활용을 위한 헴의 생산 및 정제를 용이하게 했다는 의의를 갖는다”고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 ‘바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제’ 지원을 받아 수행됐다.
□ 그림 설명
그림1. 대장균을 이용한 헴 생산 및 세포외 분비 전체 개념도
2018.09.06 조회수 18773 -
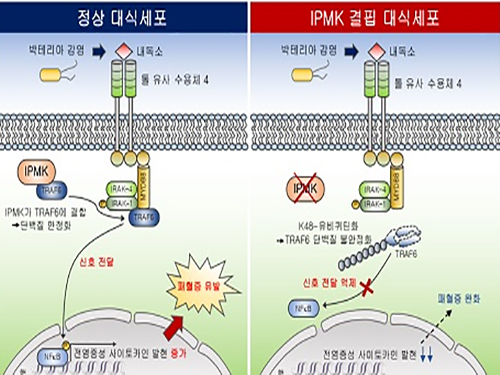 김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
2017.04.25 조회수 23503
김세윤 교수, 이노시톨 대사효소에 의한 패혈증 유발 염증전달신호 규명
우리 대학 생명과학과 김세윤 교수 연구팀이 이노시톨 생합성 대사의 핵심효소인 IPMK (Inositol polyphosphate multikinase)에 의해 패혈증 등의 선천성 면역반응을 매개하는 신호전달네트워크가 정교하게 조절되는 현상을 규명했다.
김은하 박사과정이 제1저자로 참여한 이번 연구 결과는 서울대학교 성노현 교수 연구팀과 공동으로 진행됐고 사이언스 어드밴시스(Science Advances)지 4월 21일자에 게재됐다.
김세윤 교수 연구팀은 이노시톨 대사체 및 생합성 대사를 수 년 간 연구했고 이노시톨 다인산 멀티키나아제 효소(IPMK)에 의한 세포 성장 및 에너지 대사조절 기능을 다각적으로 규명한 바 있다.
이번 연구에서는 대식세포(macrophage) 특이적으로 IPMK 효소가 결핍된 생쥐에서 패혈성 쇼크를 유발시켰을 때 염증수준이 현저히 저하되고 또한 높은 생존율을 보이는 것을 확인했다. 이는 선천성 면역의 핵심인 염증반응이 강력히 저해되는 것을 의미한다.
IPMK 효소가 면역신호조절물질인 TRAF6 단백질과 직접 결합해 TRAF6 단백질의 분해를 조절하는 유비퀴틴화를 억제함을 규명했고, IPMK효소와 TRAF6단백질간 결합력을 저해할 수 있는 펩타이드를 활용함으로써 내독소에 의한 염증반응을 낮출 수 있음을 다각적으로 검증했다.
이번 연구는 미생물 감염 등에 의한 패혈증 발병의 원리를 규명함과 동시에 최근 급증하는 선천 면역 질환 (ex. 신경계 염증질환 및 당뇨)에 대한 이해를 넓히고 새로운 치료기술개발에 필요한 학문적 토대를 제공했다는 의의를 갖는다.
이번 연구는 미래창조과학부 뇌과학원천기술개발사업의 지원을 받아 이뤄졌다.
□ 그림 설명
그림1. IPMK 효소의 선천성 면역조절 모식도
2017.04.25 조회수 23503