%EC%96%B5%EC%A0%9C%EC%A0%9C
-
 면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
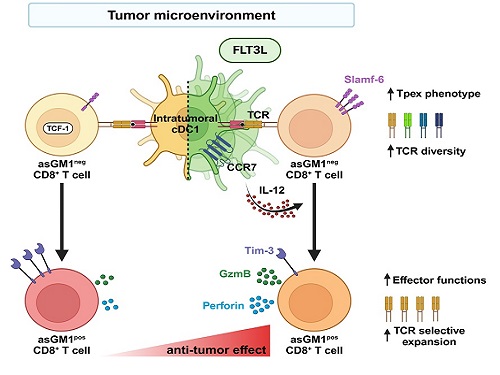
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3630
면역관문억제제의 한계를 극복할 수 있는 수지상세포 기반 면역치료
우리 대학 생명과학과 강석조 교수 연구팀이 성장인자 FLT3L에 의해 종양 내에서 증대된 제1형 수지상세포(cDC1, conventional dendritic cell type 1)가 종양침윤 항암 CD8+ T 세포의 기능과 클론의 다양성을 향상한다고 7일 밝혔다.
제1형 수지상세포는 종양 유래 항원을 림프절로 운반하여 CD8+ T 세포에 제시하고, IL-12를 비롯한 사이토카인(cytokine)을 생성하여 T 세포의 항종양 면역반응을 촉진한다고 이해되어 왔다. 하지만, 종양내에 존재하는 제1형 수지상세포가 항종양 CD8+ T 세포의 분화와 이들의 다양성에 어떤 영향을 미치는 지는 알려진 바가 없다.
강 교수 연구팀은 종양미세환경 내 CD8+ T 세포를 asialoGM1 (asGM1) 발현을 기반으로 두 집단으로 구별하고, 기존 연구에서 밝혀진 종양 침윤 T 세포 아형(subset)과 비교한 결과, asGM1neg CD8+ T 세포는 자가재생능을 갖는 Tpex (precursor exhausted T cells)와 전사체가 유사하고, asGM1pos CD8+ T 세포는 탈진된(exhausted) 세포와 유사함을 확인했다.
연구팀은 종양 내에 수지상세포의 성장인자인 FLT3L를 발현시켜 수지상세포를 증대시키고 활성화하였을 때, asGM1neg CD8+ T 세포의 Tpex 특성은 더욱 강화되었으며, 동시에 asGM1neg CD8+ T 세포가 asGM1pos CD8+ T 세포로의 분화가 촉진되었는데, 이 때 asGM1pos CD8+ T 세포가 작용 T 세포(effector T cell)의 기능을 확보하면서 항암 면역기능이 향상됨을 확인하였다. 특히 연구팀은 이러한 분화가 제1형 수지상세포의 확장 및 활성으로 분비되는 IL-12에 의해 매개됨을 밝혔다. 연구팀은 나아가 항암치료의 혁신을 가져온 면역관문억제제인 PD-1 억제제 처리가 공통적으로 asGM1을 발현하는 작용 T 세포로의 분화를 유도함을 보였다.
하지만, 본 연구진은 놀랍게도 종양 내 FLT3L 발현은 PD-1 억제제와는 전혀 다른 T 세포 다이내믹스를 통하여 항종양 T 세포 클론의 다양성을 증대시킴을 밝혔다. 이러한 T 세포 수용체의 클론 다양성 증대는 면역관문억제제가 일부 환자에게만 작용하는 제한점을 극복하는 중요 전략이 될 것임을 시사하였다.
강석조 교수는 “본 연구는 제1형 수지상세포의 증대를 통하여 감춰져있던 종양항원의 제시를 증가시켰고, 이를 인식하는 새로운 항종양 CD8+ T 세포가 활성됨을 보인 연구”라고 언급하면서, “본 연구 결과는 면역관문억제제의 항암면역 활성기전과 차별적인 기전을 제시함으로써 합리적인 병용요법의 논거를 제공할 것으로 기대한다”라고 전했다.
이번 연구 결과는 국제 학술지 `셀 리포트 (Cell Reports)’에 11월 30일 字 온라인판에 게재됐다 (논문명: Flt3L enhances clonal diversification and selective expansion of intratumoral CD8+ T cells while differentiating into effector-like cells). KAIST 생명과학과 전동민 박사(現 아이엠바이오로직스), 박지연 박사가 공동 제1저자로 연구를 주도하였고, 이슬기 박사과정 학생과 의과학대학원의 박종은 교수와 김효재 박사(現 아산병원)가 함께 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 선도연구센터지원사업의 지원을 받아 수행됐다.
2025.01.07 조회수 3630 -
 난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 5989
난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 5989 -
 암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27 조회수 31956
암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27 조회수 31956 -
 항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 24990
항암 백신 및 면역치료를 최적화한 신기술 개발
우리 연구진이 새로운 항암 나노 백신을 개발하고 또 이를 이용해 면역치료를 최적화한 기술 개발을 통해 효과적인 암 예방 및 암 치료가 가능케 함으로써 암 정복에 한 걸음 더 다가서는 계기를 마련했다.
우리 대학 생명과학과 전상용 교수 연구팀이 효과적인 항암 면역치료를 위한 나노입자 백신 개발에 성공했다고 16일 밝혔다.
전 교수 연구팀은 면역 반응을 유도하는 아미노산 중합체인 종양 펩타이드 항원과 면역보조제의 동시전달이 가능한 나노입자 기반 항암 백신을 개발했다. 전 교수 연구팀은 또 세포성 면역을 담당하는 림프구의 일종인 T 세포(면역 세포) 기반 `특이적 면역(specific immunity, 선천 면역과는 다른 고도로 발전된 방어체계)' 반응을 얻는 성과를 거뒀다. 결과적으로 전 교수팀은 특히 새로 개발한 나노입자 기반 항암 백신을 기존 항암 면역 치료제로 주목받고 있는 면역 관용 억제제를 병용하여 투여 순서와 시기를 적절히 조절, 사용하면 효능은 물론 치료 효과를 크게 증대시킬 수 있음을 확인했다.
생명과학과 김유진 박사과정, 강석모 박사가 공동 제1 저자로 참여한 이번 연구는 화학 분야 국제 학술지 `앙게반테 케미(Angewandte chemie, 독일화학회지)' 5월 19일 字 온라인판에 게재됐다. (논문명 : Sequential and timely combination of cancer nanovaccine with immune checkpoint blockade effectively inhibits tumor growth and relapse)
항암 백신은 종양 항원 특이적 면역 반응을 유도할 수 있다는 장점에도 불구하고, 면역 회피가 유도돼 우리 몸에서 백신에 대한 저항성이 발생할 수 있다는 한계가 있다. 최근 항암 치료제로 주목받고 있는 면역 관용 억제제의 경우 면역 억제를 되돌려 항암 효과를 유도할 수는 있으나, 적절한 면역 반응이 존재하지 않는 경우 효과가 극히 제한적인 것으로 알려져 있다.
연구팀은 이 같은 한계를 극복하기 위해 항암 백신과 면역 관용 억제제의 병용요법 진행을 통해 병용요법의 치료 효능을 증대시킬 수 있는 전략을 활용했다. 특히 항암 백신의 효능 증가를 위해 나노입자 전달 플랫폼을 새롭게 개발했다. 결과적으로 새로 개발한 나노입자 백신이 기존 대비 항원과 T 세포 기반 특이적 면역 반응을 더욱 증가시킬 뿐만 아니라 종양 동물모델에서 효과적인 암 예방 및 치료 효과를 거두는 성과를 확인했다.
연구팀은 또 항암 나노 백신의 치료 효과를 더욱 증대시키기 위해 면역 관용 억제제인 `PD-1 항체(활성화된 T 세포의 표면에 있는 단백질)'와 병용해 진행했는데 병용 순서에 따라 치료 효능이 달라질 수 있음을 발견했다. 이 밖에 나노 백신과 PD-1 항체의 병용 치료를 순차적으로 시기를 조절하면 종양 성장과 종양 재발을 효과적으로 억제한다는 사실도 함께 입증했다.
전상용 교수는 "효과적인 항암 면역치료를 목적으로 나노입자 백신을 개발했다ˮ면서 "이와 함께 기존 항암 백신 및 면역 관용 억제제가 가지는 한계를 극복할 수 있는 새로운 병용요법 전략을 개발했는데 이를 통해 향후 다양한 항암 면역치료법에 적용해 치료 효능을 더욱 증대시킬 수 있을 것으로 기대한다ˮ고 말했다. 한편, 이번 연구는 한국연구재단의 리더연구사업 및 바이오 의료기술 개발사업의 지원을 받아 수행됐다.
2020.06.16 조회수 24990 -
 박수형 교수, 간암 복합면역치료 적용 가능성 확인
〈 박 수 형 교수 〉
우리 대학 의과학대학원 박수형 교수와 서울아산병원 황신, 송기원 교수 공동연구팀이 간암 환자의 탈진(exhausted)된 종양 침투 면역세포 구성의 차이에 따른 간암 환자군을 구분하는 데 성공했다.
이번 연구를 통해 간암 환자의 새로운 면역치료법 적용 가능성을 확인함으로써 향후 맞춤 의학의 근거를 제시할 수 있는 기반이 될 것으로 기대된다.
특히 이번 연구는 서울아산병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 임상을 통해 새 면역 항암 치료법을 위한 협업을 진행한 것으로 중개 연구(translational research)의 우수 모델로 평가받는다.
김형돈 박사과정이 1저자로 참여한 이번 연구는 국제 학술지 ‘소화기학(Gastroenterology)’ 12월 4일 자에 게재됐다.
암이 발생하면 인체는 암세포를 제거하기 위해 면역세포인 ‘T세포’를 활성화하는데, 종양은 T세포의 기능을 억제하기 위한 환경을 구성한다. 이때 침투한 T세포들은 ‘피디-1(PD-1)’ 단백질과 같은 면역 관문 수용체를 세포 표면에 발현하면서 활성이 저하되고 탈진된 상태가 된다.
‘PD-1 억제제’로 대표되는 면역 관문 억제제는 PD-1 신호에 의해 저하된 T세포의 활성을 회복시키는 역할을 한다. 암세포는 생존을 위해 면역세포로부터 몸을 숨기는데, 면역 관문 억제제는 암세포가 숨는 데 도움을 주는 PD-1, PD-L1의 작용을 차단함으로써 면역세포가 정상적으로 암세포를 공격할 수 있게 되는 것이다.
그러나 면역 관문 억제제는 약 2~30%의 환자에게만 효능이 있고 70% 이상의 환자에게는 효과가 없어 면역항암제의 치료 효능을 높이기 위한 연구가 계속되고 있다.
연구팀은 간암 환자의 탈진한 T세포 중에서 PD-1 단백질을 많이 발현하는 T세포가 그렇지 않은 T세포에 비해 면역세포의 기능이 더 많이 저하돼 있고, PD-1 이외의 다양한 면역 관문 수용체를 동시에 발현하는 것을 발견했다.
특히 간암 환자 중에서 약 절반 정도의 환자만이 PD-1을 많이 발현하는 탈진 T세포를 갖고 있으며, 이러한 환자들이 복합 면역 관문 억제제에 의해 T세포의 기능이 효과적으로 회복됨을 확인했다.
이번 결과를 통해 복합 면역 관문 억제제의 대상이 되는 환자군을 제시함으로써 효과적인 면역 치료를 효율적으로 적용하는 데 기여할 것으로 예상된다.
박 교수는 “이번에 새롭게 제시된 환자군은 현재 적용 중인 면역 관문 억제제 치료의 반응을 예측할 수 있는 바이오 마커로서 유용하게 활용될 수 있다”라며 “복합 면역 관문 억제제가 특정 환자에게만 효능이 있음을 제시해 맞춤 의학의 근거가 될 수 있다는 임상적 의의를 갖는다”라고 말했다.
이번 연구는 보건복지부 첨단의료기술개발 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. PD-1 발현에 따른 각 세포군의 특징적인 유전자 발현 양상
그림2. PD-1을 과발현하는 세포군의 존재 유무에 따른 특징적인 두가지 환자군
2018.12.12 조회수 10895
박수형 교수, 간암 복합면역치료 적용 가능성 확인
〈 박 수 형 교수 〉
우리 대학 의과학대학원 박수형 교수와 서울아산병원 황신, 송기원 교수 공동연구팀이 간암 환자의 탈진(exhausted)된 종양 침투 면역세포 구성의 차이에 따른 간암 환자군을 구분하는 데 성공했다.
이번 연구를 통해 간암 환자의 새로운 면역치료법 적용 가능성을 확인함으로써 향후 맞춤 의학의 근거를 제시할 수 있는 기반이 될 것으로 기대된다.
특히 이번 연구는 서울아산병원 임상 연구팀과 KAIST 의과학대학원이 동물 모델이 아닌 임상을 통해 새 면역 항암 치료법을 위한 협업을 진행한 것으로 중개 연구(translational research)의 우수 모델로 평가받는다.
김형돈 박사과정이 1저자로 참여한 이번 연구는 국제 학술지 ‘소화기학(Gastroenterology)’ 12월 4일 자에 게재됐다.
암이 발생하면 인체는 암세포를 제거하기 위해 면역세포인 ‘T세포’를 활성화하는데, 종양은 T세포의 기능을 억제하기 위한 환경을 구성한다. 이때 침투한 T세포들은 ‘피디-1(PD-1)’ 단백질과 같은 면역 관문 수용체를 세포 표면에 발현하면서 활성이 저하되고 탈진된 상태가 된다.
‘PD-1 억제제’로 대표되는 면역 관문 억제제는 PD-1 신호에 의해 저하된 T세포의 활성을 회복시키는 역할을 한다. 암세포는 생존을 위해 면역세포로부터 몸을 숨기는데, 면역 관문 억제제는 암세포가 숨는 데 도움을 주는 PD-1, PD-L1의 작용을 차단함으로써 면역세포가 정상적으로 암세포를 공격할 수 있게 되는 것이다.
그러나 면역 관문 억제제는 약 2~30%의 환자에게만 효능이 있고 70% 이상의 환자에게는 효과가 없어 면역항암제의 치료 효능을 높이기 위한 연구가 계속되고 있다.
연구팀은 간암 환자의 탈진한 T세포 중에서 PD-1 단백질을 많이 발현하는 T세포가 그렇지 않은 T세포에 비해 면역세포의 기능이 더 많이 저하돼 있고, PD-1 이외의 다양한 면역 관문 수용체를 동시에 발현하는 것을 발견했다.
특히 간암 환자 중에서 약 절반 정도의 환자만이 PD-1을 많이 발현하는 탈진 T세포를 갖고 있으며, 이러한 환자들이 복합 면역 관문 억제제에 의해 T세포의 기능이 효과적으로 회복됨을 확인했다.
이번 결과를 통해 복합 면역 관문 억제제의 대상이 되는 환자군을 제시함으로써 효과적인 면역 치료를 효율적으로 적용하는 데 기여할 것으로 예상된다.
박 교수는 “이번에 새롭게 제시된 환자군은 현재 적용 중인 면역 관문 억제제 치료의 반응을 예측할 수 있는 바이오 마커로서 유용하게 활용될 수 있다”라며 “복합 면역 관문 억제제가 특정 환자에게만 효능이 있음을 제시해 맞춤 의학의 근거가 될 수 있다는 임상적 의의를 갖는다”라고 말했다.
이번 연구는 보건복지부 첨단의료기술개발 사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. PD-1 발현에 따른 각 세포군의 특징적인 유전자 발현 양상
그림2. PD-1을 과발현하는 세포군의 존재 유무에 따른 특징적인 두가지 환자군
2018.12.12 조회수 10895 -
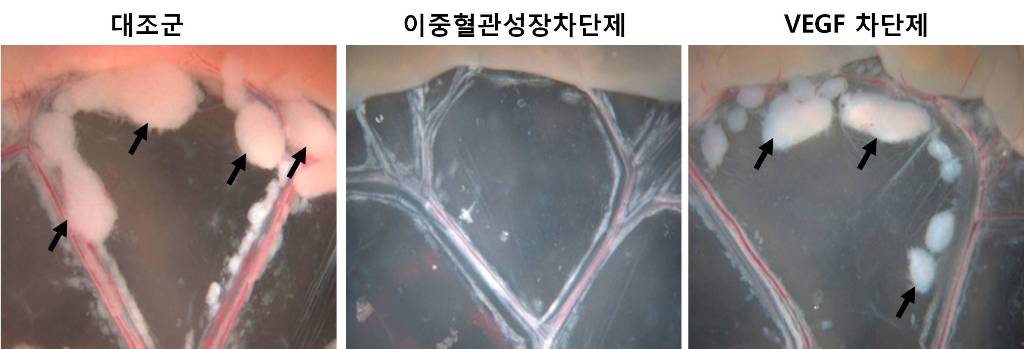 암 성장과 전이를 억제하는 혈관신생차단제 개발
-캔서 셀誌 표지논문 선정, “부작용 적고 효과 탁월한 신개념 항암치료제 개발 가능성 열어”-
국내 연구진이 암 성장과 전이에 필수적인 혈관신생*에 관여하는 새로운 인자를 발견하고 이를 효과적으로 차단하는 제재를 개발하여, 신개념 암 치료제 개발에 전기를 마련하였다. * 혈관신생(angiogenesis) : 몸속에 새로운 혈관이 만들어지는 현상으로, 악성 종양(암)의 성장과 전이에 매우 중요한 과정
우리학교 의과학대학원 고규영 교수와 삼성의료원 남도현 교수가 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원사업(도약연구)과 삼성의료원의 난치암정복연구사업의 지원을 받아 수행되었다.
이번 연구결과는 암 분야 최고 권위의 학술지인 ‘캔서 셀(Cancer Cell, IF=25.3)’ 표지 논문(8월 17일자)에 선정되었으며, 국내 연구진이 주도한 연구업적이 “캔서 셀”에 표지 논문으로 게재된 것은 이번이 처음이다.
고규영 교수팀은 기존의 혈관성장인자*(VEGF) 이외에 또 다른 성장인자(안지오포이에틴-2, Ang2)가 혈관신생을 촉진한다는 사실을 새롭게 발견하고, 두 인자를 효과적으로 차단하는 “이중혈관성장차단제”를 개발하는데 성공하였다. * 혈관성장인자 : 혈관신생을 촉진하는 인자로, 지금까지 VEGF가 대표적인 인자로 인식되었으나, 고 교수팀이 Ang2도 암의 혈관신생을 촉진한다는 사실을 새롭게 발견함.
지금까지 의학계에서는 VEGF가 혈관신생에 중추적인 역할을 수행하는 것으로 인식하여, 이를 억제하는 항암제인 아바스틴(Avastin)을 개발하여 암 환자들에게 투여해왔다. 그러나 항암 효과가 크지 않고 오히려 암을 촉진시키는(전체 환자 50%) 등 부작용이 적지 않아 치료에 어려움이 있었다.
고 교수팀은 VEGF 억제제를 투여하자 Ang2가 급격히 증가한다는 사실을 발견하고, VEGF과 Ang2을 동시에 차단하는 “이중혈관성장 차단제”를 제작하여 환자에게 투여한 결과, 기존의 VEGF만을 차단했던 제재보다 암 성장(2.1배)과 전이(6.5배)를 효과적으로 차단한다는 사실을 검증하였다.
고 교수는 “Ang2가 VEGF 못지않게 중요한 혈관신생인자라는 사실을 새롭게 확인하여, 두 인자를 동시에 효과적으로 차단하는 ‘이중 혈관성장차단제’ 개발에 성공함으로써, 효과는 탁월하지만 부작용은 적은 신개념 항암치료제 신약 개발에 새로운 가능성을 제시하였다”라고 연구의의를 밝혔다.
2010.08.18 조회수 19197
암 성장과 전이를 억제하는 혈관신생차단제 개발
-캔서 셀誌 표지논문 선정, “부작용 적고 효과 탁월한 신개념 항암치료제 개발 가능성 열어”-
국내 연구진이 암 성장과 전이에 필수적인 혈관신생*에 관여하는 새로운 인자를 발견하고 이를 효과적으로 차단하는 제재를 개발하여, 신개념 암 치료제 개발에 전기를 마련하였다. * 혈관신생(angiogenesis) : 몸속에 새로운 혈관이 만들어지는 현상으로, 악성 종양(암)의 성장과 전이에 매우 중요한 과정
우리학교 의과학대학원 고규영 교수와 삼성의료원 남도현 교수가 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원사업(도약연구)과 삼성의료원의 난치암정복연구사업의 지원을 받아 수행되었다.
이번 연구결과는 암 분야 최고 권위의 학술지인 ‘캔서 셀(Cancer Cell, IF=25.3)’ 표지 논문(8월 17일자)에 선정되었으며, 국내 연구진이 주도한 연구업적이 “캔서 셀”에 표지 논문으로 게재된 것은 이번이 처음이다.
고규영 교수팀은 기존의 혈관성장인자*(VEGF) 이외에 또 다른 성장인자(안지오포이에틴-2, Ang2)가 혈관신생을 촉진한다는 사실을 새롭게 발견하고, 두 인자를 효과적으로 차단하는 “이중혈관성장차단제”를 개발하는데 성공하였다. * 혈관성장인자 : 혈관신생을 촉진하는 인자로, 지금까지 VEGF가 대표적인 인자로 인식되었으나, 고 교수팀이 Ang2도 암의 혈관신생을 촉진한다는 사실을 새롭게 발견함.
지금까지 의학계에서는 VEGF가 혈관신생에 중추적인 역할을 수행하는 것으로 인식하여, 이를 억제하는 항암제인 아바스틴(Avastin)을 개발하여 암 환자들에게 투여해왔다. 그러나 항암 효과가 크지 않고 오히려 암을 촉진시키는(전체 환자 50%) 등 부작용이 적지 않아 치료에 어려움이 있었다.
고 교수팀은 VEGF 억제제를 투여하자 Ang2가 급격히 증가한다는 사실을 발견하고, VEGF과 Ang2을 동시에 차단하는 “이중혈관성장 차단제”를 제작하여 환자에게 투여한 결과, 기존의 VEGF만을 차단했던 제재보다 암 성장(2.1배)과 전이(6.5배)를 효과적으로 차단한다는 사실을 검증하였다.
고 교수는 “Ang2가 VEGF 못지않게 중요한 혈관신생인자라는 사실을 새롭게 확인하여, 두 인자를 동시에 효과적으로 차단하는 ‘이중 혈관성장차단제’ 개발에 성공함으로써, 효과는 탁월하지만 부작용은 적은 신개념 항암치료제 신약 개발에 새로운 가능성을 제시하였다”라고 연구의의를 밝혔다.
2010.08.18 조회수 19197