%EC%98%A4%EA%B0%80%EB%85%B8%EC%9D%B4%EB%93%9C
-
 뇌 오가노이드의 매우 작은 전기신호도 측정 가능하다
오가노이드*는 인체 조직을 높은 정확도로 모사하기 때문에 질병 모델 개발이나 약물 스크리닝뿐만 아니라 개인 맞춤형 의학에도 활용이 가능하다. 하지만 매우 작은 크기의 전기 신호가 발생하는 심장과 뇌 오가노이드는 전기생리신호를 측정하는 것이 매우 어려웠다. 한국 연구진이 다양한 오가노이드에 손쉽게 적용가능한 전기생리신호 모니터링 시스템을 개발하는 데 성공했다.
*오가노이드 : 인간유래 줄기세포를 기반으로 제작되는 3차원 형태의 세포 집합체로, 동물 실험 모델과 2차원 세포 배양 모델을 대체할 실험 모델로 큰 주목을 받고 있다.
우리 대학 전기및전자공학부 이현주 교수 연구팀이 한국생명공학연구원(원장 김장성, KRIBB) 국가아젠다연구부 손미영 부장 연구팀 및 줄기세포융합연구센터 이미옥 박사 연구팀과 공동 연구를 통해 오가노이드의 비침습적 전기생리신호 측정을 위한 고신축성 돌출형 미세전극 어레이 플랫폼을 개발했다고 14일 밝혔다.
기존의 오가노이드 관련 연구는 유전자 분석을 위주로 진행되어 왔으며, 상대적으로 오가노이드의 기능성에 대한 연구는 미비한 상태다. 효과적인 약물 평가와 정밀한 생물학 연구를 위해서는 오가노이드의 3차원 형태와 상태를 보존하며 그 기능을 실시간으로 모니터링할 수 있는 기술의 개발이 필요하다.
이 중 전기신호가 발생하는 심장과 뇌 오가노이드의 전기생리신호 측정의 경우, 오가노이드의 제작 방식에 따라 그 크기가 수백 마이크로미터(μm)부터 수 밀리미터(mm)까지 다양하고 형태가 불규칙하기 때문에 오가노이드를 파괴하지 않고 외부 표면에 전극을 밀착하여 측정하는 것은 매우 어려운 일이다.
연구팀은 오가노이드의 크기와 형태에 맞춰 스스로 늘어나 그 표면에 밀착할 수 있는 고신축성 돌출형 미세전극 어레이를 개발했다. 또한, 이를 활용해 오가노이드에서 발생하는 전기생리신호의 실시간 변화를 성공적으로 측정하여 평가했다.
연구팀은 미소 전자 기계 시스템(Micro Electro Mechanical Systems; MEMS) 공정을 개발해 서펜타인(Serpentine) 구조 기반의 고신축성 미세전극 어레이를 제작했으며, 전기증착 공정을 통해 돌출형 미세전극을 제작했다. 돌출형 미세전극은 오가노이드에 전극을 좀 더 강하게 밀착시켜 주어 오가노이드에는 손상이 가하지 않으면서도 안정적으로 전기생리신호를 측정할 수 있게 하였다.
이현주 교수는 “다양한 크기의 오가노이드에 활용 가능한 고신축성 돌출형 미세전극 어레이를 개발하여 실시간으로 오가노이드의 상태를 평가할 수 있다. 이번 기술은 신약 개발 시 실험동물을 대체하거나 재생 치료제로써 사용되는 오가노이드의 품질 평가에 바로 적용할 수 있을 것”이라고 말했다.
이번 연구 결과는 전기및전자공학부 김기업 박사과정과 한국생명공학연구원 이영선 박사과정이 제1 저자로 참여했으며, 국제 학술지 ‘어드밴스드 머티리얼스 (Advanced Materials)’지에 지난 12월 15일 자 온라인에 게재됐다.
(논문명: Highly Stretchable 3D Microelectrode Array for Noninvasive Functional Evaluation of Cardiac Spheroids and Midbrain Organoids), DOI: https://doi.org/10.1002/adma.202412953
한편, 이번 연구는 산업통상자원부 3D생체조직칩기반신약개발플랫폼구축기술개발사업 및 과학기술정보통신부 국산연구장비기술경쟁력강화사업, 바이오의료기술개발사업의 지원을 받아 수행됐다.
2025.01.14 조회수 4740
뇌 오가노이드의 매우 작은 전기신호도 측정 가능하다
오가노이드*는 인체 조직을 높은 정확도로 모사하기 때문에 질병 모델 개발이나 약물 스크리닝뿐만 아니라 개인 맞춤형 의학에도 활용이 가능하다. 하지만 매우 작은 크기의 전기 신호가 발생하는 심장과 뇌 오가노이드는 전기생리신호를 측정하는 것이 매우 어려웠다. 한국 연구진이 다양한 오가노이드에 손쉽게 적용가능한 전기생리신호 모니터링 시스템을 개발하는 데 성공했다.
*오가노이드 : 인간유래 줄기세포를 기반으로 제작되는 3차원 형태의 세포 집합체로, 동물 실험 모델과 2차원 세포 배양 모델을 대체할 실험 모델로 큰 주목을 받고 있다.
우리 대학 전기및전자공학부 이현주 교수 연구팀이 한국생명공학연구원(원장 김장성, KRIBB) 국가아젠다연구부 손미영 부장 연구팀 및 줄기세포융합연구센터 이미옥 박사 연구팀과 공동 연구를 통해 오가노이드의 비침습적 전기생리신호 측정을 위한 고신축성 돌출형 미세전극 어레이 플랫폼을 개발했다고 14일 밝혔다.
기존의 오가노이드 관련 연구는 유전자 분석을 위주로 진행되어 왔으며, 상대적으로 오가노이드의 기능성에 대한 연구는 미비한 상태다. 효과적인 약물 평가와 정밀한 생물학 연구를 위해서는 오가노이드의 3차원 형태와 상태를 보존하며 그 기능을 실시간으로 모니터링할 수 있는 기술의 개발이 필요하다.
이 중 전기신호가 발생하는 심장과 뇌 오가노이드의 전기생리신호 측정의 경우, 오가노이드의 제작 방식에 따라 그 크기가 수백 마이크로미터(μm)부터 수 밀리미터(mm)까지 다양하고 형태가 불규칙하기 때문에 오가노이드를 파괴하지 않고 외부 표면에 전극을 밀착하여 측정하는 것은 매우 어려운 일이다.
연구팀은 오가노이드의 크기와 형태에 맞춰 스스로 늘어나 그 표면에 밀착할 수 있는 고신축성 돌출형 미세전극 어레이를 개발했다. 또한, 이를 활용해 오가노이드에서 발생하는 전기생리신호의 실시간 변화를 성공적으로 측정하여 평가했다.
연구팀은 미소 전자 기계 시스템(Micro Electro Mechanical Systems; MEMS) 공정을 개발해 서펜타인(Serpentine) 구조 기반의 고신축성 미세전극 어레이를 제작했으며, 전기증착 공정을 통해 돌출형 미세전극을 제작했다. 돌출형 미세전극은 오가노이드에 전극을 좀 더 강하게 밀착시켜 주어 오가노이드에는 손상이 가하지 않으면서도 안정적으로 전기생리신호를 측정할 수 있게 하였다.
이현주 교수는 “다양한 크기의 오가노이드에 활용 가능한 고신축성 돌출형 미세전극 어레이를 개발하여 실시간으로 오가노이드의 상태를 평가할 수 있다. 이번 기술은 신약 개발 시 실험동물을 대체하거나 재생 치료제로써 사용되는 오가노이드의 품질 평가에 바로 적용할 수 있을 것”이라고 말했다.
이번 연구 결과는 전기및전자공학부 김기업 박사과정과 한국생명공학연구원 이영선 박사과정이 제1 저자로 참여했으며, 국제 학술지 ‘어드밴스드 머티리얼스 (Advanced Materials)’지에 지난 12월 15일 자 온라인에 게재됐다.
(논문명: Highly Stretchable 3D Microelectrode Array for Noninvasive Functional Evaluation of Cardiac Spheroids and Midbrain Organoids), DOI: https://doi.org/10.1002/adma.202412953
한편, 이번 연구는 산업통상자원부 3D생체조직칩기반신약개발플랫폼구축기술개발사업 및 과학기술정보통신부 국산연구장비기술경쟁력강화사업, 바이오의료기술개발사업의 지원을 받아 수행됐다.
2025.01.14 조회수 4740 -
 홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
2024.10.14 조회수 4757
홀로토모그래피로 오가노이드 실시간 관찰 성공
인체 장기의 구조와 기능을 모사한 3차원 미니 장기인 오가노이드는 다양한 질병 연구와 신약 개발에 필수적인 역할을 하고 있다. 한국 연구진이 기존 이미징 기술의 한계를 극복하고 살아있는 오가노이드를 고해상도로 실시간 동적 변화를 관찰하는 데 성공했다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영) 유전체 교정 연구단(단장 구본경) 연구팀과 ㈜토모큐브의 협력으로, 홀로토모그래피 (holotomography) 기술을 활용해 살아있는 소장 오가노이드를 실시간으로 고해상도로 관찰할 수 있는 이미징 기술을 개발했다고 14일 밝혔다.
기존의 이미징 기법들은 살아있는 오가노이드를 장기간 고해상도로 관찰하는 데 한계가 있었고, 형광 염색 등의 추가적인 처리가 필요한 경우가 많았다.
연구팀은 이러한 문제를 해결하기 위해 형광 등 염색 없이도 고해상도의 이미지를 제공하고, 세포 손상 없이 오랜 시간 동안 실시간으로 동적 변화를 관찰할 수 있는 홀로토모그래피 기술을 도입했다.
연구진은 실험용 쥐(마우스) 소장 오가노이드를 이용해 이 기술을 검증했으며, 그 결과 홀로토모그래피를 통해 오가노이드 내부의 다양한 세포 구조를 세밀하게 관찰할 수 있었고, 오가노이드의 성장 과정과 세포 분열, 세포 사멸 등의 동적 변화를 실시간으로 포착할 수 있었다.
또한, 약물 처리에 따른 오가노이드의 반응을 정밀하게 분석해 세포 생존 여부를 확인할 수 있었다.
연구진은 이번 연구를 통해 오가노이드 연구의 새로운 지평을 열었으며, 이를 통해 신약 개발, 맞춤형 치료, 재생 의학 등 다양한 분야에서 오가노이드의 활용을 극대화할 수 있을 것이라고 기대하고 있다.
향후 연구는 오가노이드의 생체 내 환경을 더 정확히 재현하고, 더욱 정교한 3차원 이미징을 통해 세포 수준에서의 다양한 생명현상을 이해하는 데 큰 기여를 할 것으로 전망된다.
논문의 제1 저자인 이만재 박사(KAIST 의과학대학원 졸, 現 충남대병원)는 “이번 연구는 기존의 한계를 뛰어넘는 새로운 이미징 기술로, 향후 오가노이드를 활용한 질병 모델링, 환자 맞춤형 치료 및 신약 개발 연구에 크게 기여할 것”이라고 밝혔다.
이번 연구 결과는 2024년 10월 1일 국제 학술지 ‘Experimental & Molecular Medicine’에 온라인 게재됐으며, 해당 기술은 다양한 생명과학 분야에서의 적용 가능성을 인정받고 있다.
(논문명: Long-term three-dimensional high-resolution imaging of live unlabeled small intestinal organoids via low-coherence holotomography)
본 연구는 한국연구재단 리더연구사업, KAIST 연구소 및 기초과학연구원의 지원을 받아 수행됐다.
2024.10.14 조회수 4757 -
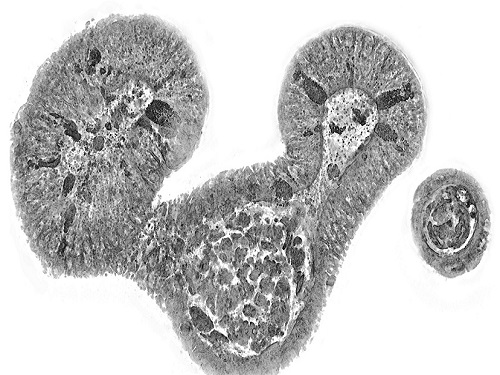 홀로토모그래피 첨단바이오 분석 전략 소개
첨단 바이오/의학 분야에서 살아있는 세포와 조직 뿐만 아니라 오가노이드의 3차원 영상을 측정하고 정밀하게 분석하는 기술에 대한 중요도가 커지고 있다. 홀로토모그래피기술은 세포와 조직의 내부를 고해상도로 관찰할 수 있게 하여 재생의료, 맞춤형 의료, 난임 치료 등 연구에서 잠재력이 높게 평가되고 있다. 한국연구진이 광학 전문가가 아닌 의생명과학 연구자들을 대상으로 홀로토모그래피 장점과 넓은 응용 가능성을 알리는 논문을 발표해서 화제다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영), 한국기초과학지원연구원(KBSI, 원장 양성광)과 공동 집필하여 홀로토모그래피의 원리와 응용 현황, 한계점 및 향후 방향성을 망라한 논문을 국제학술지에 게재했다고 30일 밝혔다.
홀로토모그래피는 엑스레이(X-ray) CT와 물리적인 원리는 동일하나 X선을 이용해 사람 몸속을 보는 CT와는 달리, 빛을 이용하여 세포와 조직의 내부를 고해상도로 관찰할 수 있게 한다. 염색이나 표지(label)와 같은 화학적⋅유전적 처리 없이 세포와 조직의 3차원 영상을 세포 소기관 수준의 해상도로 관찰할 수 있게 해주어, 이전에는 불가능했던 바이오 연구와 산업의 다양한 측정과 분석 한계를 극복할 수 있다.
살아있는 세포와 조직 뿐만 아니라 장기를 모사하는 3차원 구조체인 오가노이드(organoids)는 신약 개발 과정에서 동물 실험을 대체하고, 환자 맞춤형 치료법을 빠르고 효과적으로 확인하며, 궁극적으로 장기를 대체하는 치료 목적으로 활발하게 연구 개발이 진행 중이다.
오가노이드와 줄기세포 콜로니와 같은 3차원 생체 시편을 염색이나 전처리 없이 세포 소기관 수준으로 관찰하는 것은 3차원 생물학과 재생의학 분야에서 기초 연구 혁신과 바이오산업 응용 측면에서 모두 중요한 의미를 지니고 있다.
연구팀이 집필한 이번 논문에서는 3차원 생물학, 재생의료, 암 연구 등 다양한 분야에 홀로토모그래피 기술을 적용한 사례와 미래 발전 가능성을 소개했다. 또한, 광원의 결맞음(coherency) 정도에 따른 홀로토모그래피 기술을 유형화하고, 각 기술의 원리, 한계점, 극복 방안을 자세히 설명했다. 특히, 인공지능과 홀로토모그래피를 결합해 세포와 오가노이드를 관찰할 수 있는 한계를 크게 확장할 수 있는 전략을 심도 있게 다뤘다.
홀로토모그래피 기술은 첨단 바이오산업을 견인할 수 있는 가능성으로 인해, 전 세계 주요 대학 연구진들과 기업들이 관심을 갖고 연구 기술 개발에 투자하고 있는 분야다. 박용근 교수 연구팀은 지난 10여 년간 다양한 핵심 원천 기술과 응용 연구를 수행하며, 홀로토모그래피 분야를 국제적으로 선도하고 있다.
우리 대학 자연과학연구소 김건 박사, 생명과학과 윤기준 교수팀, IBS 유전체 교정 연구단(구본경 단장), 한국기초과학지원연구원의 이성수 박사팀 등 연구진과 공동 집필한 이번 논문은 ‘Nature Reviews Methods Primers’에 7월 25일 자 게재됐다. (논문명: Holotomography)
한편, 이번 연구는 연구재단의 리더연구사업과 창의도전연구지원사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업, 보건복지부의 보건의료 R&D 사업의 지원을 받아 수행됐다.
2024.07.30 조회수 8699
홀로토모그래피 첨단바이오 분석 전략 소개
첨단 바이오/의학 분야에서 살아있는 세포와 조직 뿐만 아니라 오가노이드의 3차원 영상을 측정하고 정밀하게 분석하는 기술에 대한 중요도가 커지고 있다. 홀로토모그래피기술은 세포와 조직의 내부를 고해상도로 관찰할 수 있게 하여 재생의료, 맞춤형 의료, 난임 치료 등 연구에서 잠재력이 높게 평가되고 있다. 한국연구진이 광학 전문가가 아닌 의생명과학 연구자들을 대상으로 홀로토모그래피 장점과 넓은 응용 가능성을 알리는 논문을 발표해서 화제다.
우리 대학 물리학과 박용근 교수 연구팀이 기초과학연구원(IBS, 원장 노도영), 한국기초과학지원연구원(KBSI, 원장 양성광)과 공동 집필하여 홀로토모그래피의 원리와 응용 현황, 한계점 및 향후 방향성을 망라한 논문을 국제학술지에 게재했다고 30일 밝혔다.
홀로토모그래피는 엑스레이(X-ray) CT와 물리적인 원리는 동일하나 X선을 이용해 사람 몸속을 보는 CT와는 달리, 빛을 이용하여 세포와 조직의 내부를 고해상도로 관찰할 수 있게 한다. 염색이나 표지(label)와 같은 화학적⋅유전적 처리 없이 세포와 조직의 3차원 영상을 세포 소기관 수준의 해상도로 관찰할 수 있게 해주어, 이전에는 불가능했던 바이오 연구와 산업의 다양한 측정과 분석 한계를 극복할 수 있다.
살아있는 세포와 조직 뿐만 아니라 장기를 모사하는 3차원 구조체인 오가노이드(organoids)는 신약 개발 과정에서 동물 실험을 대체하고, 환자 맞춤형 치료법을 빠르고 효과적으로 확인하며, 궁극적으로 장기를 대체하는 치료 목적으로 활발하게 연구 개발이 진행 중이다.
오가노이드와 줄기세포 콜로니와 같은 3차원 생체 시편을 염색이나 전처리 없이 세포 소기관 수준으로 관찰하는 것은 3차원 생물학과 재생의학 분야에서 기초 연구 혁신과 바이오산업 응용 측면에서 모두 중요한 의미를 지니고 있다.
연구팀이 집필한 이번 논문에서는 3차원 생물학, 재생의료, 암 연구 등 다양한 분야에 홀로토모그래피 기술을 적용한 사례와 미래 발전 가능성을 소개했다. 또한, 광원의 결맞음(coherency) 정도에 따른 홀로토모그래피 기술을 유형화하고, 각 기술의 원리, 한계점, 극복 방안을 자세히 설명했다. 특히, 인공지능과 홀로토모그래피를 결합해 세포와 오가노이드를 관찰할 수 있는 한계를 크게 확장할 수 있는 전략을 심도 있게 다뤘다.
홀로토모그래피 기술은 첨단 바이오산업을 견인할 수 있는 가능성으로 인해, 전 세계 주요 대학 연구진들과 기업들이 관심을 갖고 연구 기술 개발에 투자하고 있는 분야다. 박용근 교수 연구팀은 지난 10여 년간 다양한 핵심 원천 기술과 응용 연구를 수행하며, 홀로토모그래피 분야를 국제적으로 선도하고 있다.
우리 대학 자연과학연구소 김건 박사, 생명과학과 윤기준 교수팀, IBS 유전체 교정 연구단(구본경 단장), 한국기초과학지원연구원의 이성수 박사팀 등 연구진과 공동 집필한 이번 논문은 ‘Nature Reviews Methods Primers’에 7월 25일 자 게재됐다. (논문명: Holotomography)
한편, 이번 연구는 연구재단의 리더연구사업과 창의도전연구지원사업, 과학기술정보통신부의 홀로그램핵심기술지원사업, 나노 및 소재 기술개발사업, 보건복지부의 보건의료 R&D 사업의 지원을 받아 수행됐다.
2024.07.30 조회수 8699 -
 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7019
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7019 -
 시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 75348
시스템생물학 이용 세계 최초 알츠하이머성 치매 환자 맞춤형 치료 효능 예측 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀 (장소영 박사과정(제1저자), 강의룡 박사과정, 장홍준 박사과정)은 서울대학교 의과대학 묵인희 교수 연구팀과 공동연구를 통해 시스템생물학*과 알츠하이머 환자 유래 뇌 오가노이드** 모델의 융합으로 환자 맞춤형 약물 효능평가 플랫폼(Drug-screening platform)을 세계 최초로 개발했다고 13일 밝혔다.
* 시스템생물학: IT의 수학모델링 및 컴퓨터시뮬레이션과 BT의 분자세포생물학 실험을 융합하여 복잡한 생명현상을 규명하고 설명하는 연구 패러다임
** 뇌 오가노이드: 환자의 역분화 줄기세포(iPSC) 유래 인공 미니 뇌
알츠하이머병은 치매의 약 70%를 차지하는 대표적 치매 질환이나 현재까지 발병 원인이 불명확하며, 근본적인 치료제도 없는 인류가 극복하지 못한 질병 중 하나다.
알츠하이머병 치료제 개발 난제 중 하나는 실제 살아있는 환자의 뇌를 직접 실험 샘플로 사용할 수 없다는 것이었다. 이는 수많은 치료제 후보군의 약물 효능을 정확히 평가하기가 어려워 치료제 개발의 걸림돌로 작용해왔다.
조광현 교수 공동 연구팀은 실제 치매환자에서 유래한 뇌 오가노이드 기반으로 생물학적 메커니즘에 대한 수학 모델링을 융합하여 약물효능 예측이 가능한 플랫폼을 세계 최초로 개발했다. 환자 혈액으로부터 역분화줄기세포(Induced-pluripotent stem cell)*를 구축 후 이를 이용하여 3D 뇌 오가노이드를 제작해 실제 환자의 뇌와 유사한 환경 구축을 통해 실험적 한계를 극복했다.
* 역분화줄기세포: 다능성이 없는 혈액 면역세포에 역분화를 일으키는 4가지 특정 유전자를 도입하여 배아 줄기세포와 같이 모든 종류의 세포로 분화할 수 있는 성질(다능성)을 가진 줄기세포
또한, 시스템생물학 기반 수학 모델링 기법으로 알츠하이머병의 신경세포 특이적 네트워크망을 구축하고, 이를 실제 알츠하이머병 환자 및 정상군 유래 뇌 오가노이드를 통하여 신경세포 컴퓨터 모델의 실효성을 검증했다.
이 연구결과는 알츠하이머병의 시스템생물학 기반 신경세포 컴퓨터 모델을 실제 환자 유래 뇌 오가노이드로 검증한 세계 최초의 사례이다. 이는 환자 맞춤형 치료(Precision medicine)의 불모지로 여겨졌던 뇌 질환분야에서도 알츠하이머병 환자의 유전형에 따른 최적의 약물 효능 예측이 가능하게 됨을 의미하며 향후 약물 타겟 발굴에 기여할 것으로 기대된다.
조광현 교수는 “이번에 개발한 시스템생물학 기반 알츠하이머성 치매환자 약물 효능평가 플랫폼을 통해 향후 치매 치료제 개발 경쟁에서 우리나라가 국가적 우위를 선점할 수 있을 것으로 기대한다”고 밝혔다.
이번 연구는 보건복지부 한국보건산업진흥원의 국가치매극복기술개발 사업 및 한국연구재단의 중견연구자지원사업으로 수행됐으며, 연구성과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)의 2021년 1월 12일자 논문으로 게재됐다.
(https://www.nature.com/articles/s41467-020-20440-5)
2021.01.13 조회수 75348