%EC%9C%A0%EC%A0%84%EC%9E%90+%EA%B0%80%EC%9C%84
-
 암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7277
암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7277 -
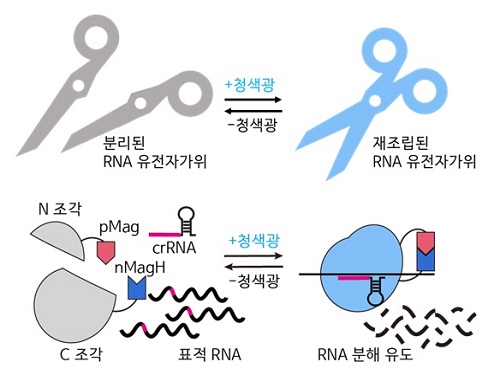 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 9773
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 9773 -
 유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 10567
유전자 가위와 약물로 동시에 암을 잡는 신약 개발
암은 과거부터 인류의 건강을 위협하는 요인이다. 암을 치료하는 방법으로 임상에서 주로 화학 약물 및 항체 치료가 사용되고 있으나, 심각한 부작용 또는 반복 투여가 필요해 어려움이 있다. 따라서, 영구적인 유전자 조절을 일으키는 유전자가위(CRISPR, 이하 크리스퍼) 기반 유전자 교정 기술을 이용하면 문제를 극복할 수 있지만, 생체 내 전달이 어려워 효과적인 전달 방법이 절실히 필요한 실정이다.
우리 대학 생명과학과 정현정 교수, 화학과 박희성 교수 공동연구팀이 유전자가위 기반 항암 신약으로 크리스퍼 단백질 및 화학 약물을 동시에 생체 내에 전달하는 나노복합체를 개발해 기존 항암제보다 월등한 항암 효능을 보였다고 3일 밝혔다.
크리스퍼 기술은 표적 세포에서 정밀하고 영구적으로 유전자 교정을 일으킬 수 있어 기존 유전자 조절 방법에 비해 암의 치료제로서 큰 장점이 있다. 하지만 크리스퍼의 구성 요소인 단백질과 가이드 RNA를 생체 내에 전달했을 때 극히 낮은 조직 투과성 및 세포 유입 효율로 인해 치료 효능이 떨어진다. 이러한 한계점을 극복하기 위해 지질 나노입자, 고분자, 무기나노입자 등에 나노 전달체에 기반한 전달 방법이 개발됐으나, 여전히 효능이 떨어지고 심각한 독성 및 부작용 문제가 나타났다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질 Cas9에 서로다른 작용기가 간단히 결합되는 클릭 화학 작용기를 내재하기 위해 비천연 아미노산을 도입한 생직교 반응형 Cas9을 개발했다. 생직교 반응은 살아있는 시스템 내에서 본질적인 생화학 과정을 방해하지 않고 일어나는 반응을 말한다. 연구팀은 기존 나노 전달체의 독성 및 한계를 극복하기 위해 극미량의 고분자 물질을 생직교 반응형 Cas9에 결합시킴으로써 생체 내에 안전하게 전달 및 유전자 교정을 일으킬 수 있음을 확인했다. 또, 항암 신약으로써 효능을 극대화하기 위해 기존에 유방암 항암제로 사용되는 올라파리브(olaparib)을 생직교 반응에 의해 Cas9에 결합시킴으로써 병용 치료를 위한 유전자가위 나노복합체인 콤바인 (ComBiNE, Combinatorial and bioorthogonal nano-editing complex)을 개발했다.
연구팀은 개발한 유전자교정 나노복합체를 이용해 유방암 세포 및 동물모델에서 DNA 복구에 관여하는 유전자 교정 및 올라파리브의 작용으로 기존 항암제 및 단독 치료제에 비해 월등한 항암효과가 나타남을 확인했다.
이번 연구는 최초로 크리스퍼 단백질과 화학 항암제를 단일 제형으로 안전하고 효과적인 생체 내 유전자 교정을 일으켜 높은 항암 효능을 보였다는 점에서 큰 의의가 있다. 연구팀은 이번 연구 결과가 향후 다양한 암종에 대해 유전자 및 화학 약물 기반 병용 치료제로서 적용할 수 있는 강력한 플랫폼 기술로 활용될 것을 기대하고 있다.
우리 대학 생명과학과 마셀 야니스 베하(Marcel Janis Beha) 박사와 석박사통합과정 임산해 학생, 화학과 석박사통합과정 김주찬 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 7월 23일 온라인 게재됐다. (논문명: Bioorthogonal CRISPR/Cas9-Drug Conjugate: A Combinatorial Nanomedicine Platform)
한편 이번 연구는 한국연구재단, 보건복지부 및 삼성미래기술육성사업의 지원을 통해 이뤄졌다.
2023.08.03 조회수 10567 -
 RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 13965
RNA 유전자 가위 기술로 코로나바이러스 싹둑
엔데믹(endemic)으로 지정된 코로나 19 바이러스(이하 SARS-CoV-2)는 변이가 매우 빈번하고 빠른 RNA 바이러스이다. 따라서 전 세계 연구자들은 신·변종 바이러스 출현에 따른 새로운 팬데믹에 대비하기 위해 범용 코로나 바이러스 감염병 치료제 개발에 몰두하고 있다.
우리 대학 생명과학과 허원도 교수 연구팀과 전북대 강상민 교수 연구팀이 공동연구를 통해 세계 최초로 RNA 유전자 가위 기술을 이용해 RNA 바이러스 유전체 내 슈도낫 부위를 타겟해 바이러스 증식을 강력하게 차단할 수 있는 핵심 타겟부위를 발견했고, 전북대학교 인수공통감염병 연구소와의 협업을 통해 동물모델에서 COVID-19 치료 효과를 입증했다고 1일 밝혔다.
우리 대학 자연과학연구소 유다슬이 연구조교수, 전북대학교 한희정 박사과정, KAIST 생명과학과 유정혜 박사과정, KAIST 생명과학과 김지혜 선임연구원이 공동 제 1저자로 수행한 이번 연구는 저명 국제 학술지 ‘몰레큘러 테라피 (Molecular Therapy)’ 2023년 3월호에 온라인으로 출판됐다. (논문명: Pseudoknot-targeting Cas13b combats SARS-CoV-2 infection by suppressing viral replication). (Impact Factor: 12.91). (DOI: https://doi.org/10.1016/j.ymthe.2023.03.018)
SARS-CoV-2 바이러스는 세포 내 감염 후 매우 빠른 속도로 바이러스 단백질을 복제하고 증식하여 숙주 세포의 기능을 완전히 망가뜨린다. RNA 바이러스 유전체를 직접 분해해 바이러스 증식을 억제하는 시도는 이전부터 있어왔으나 이런 빠른 코로나 증식을 완전히 막기에는 역부족이었다.
연구팀은 RNA 유전자 가위 기술로 코로나 바이러스 내 유전자 발현 조절 중추 역할을 하는 슈도낫 부위를 타겟함으로써 99.9퍼센트의 바이러스 증식 억제 효과가 있음을 입증했다. 이는 슈도낫 부위가 코로나 바이러스의 가장 취약한 급소임을 보여주는 결과이기도 하다.
본 기술은 mRNA 기반 유전자 치료제 전달하는 방식으로 DNA 기반 유전자 치료제에 비해 전달 효율이 매우 높으며 치료제 발현 시간 또한 매우 빠르다. 연구진이 제작한 mRNA 기반 치료제 전달로 감염 세포에 2시간 이내, 감염 동물에 6시간 이내에 RNA 유전자 가위 기술 발현을 유도할 수 있었다.
연구진이 타겟한 슈도낫 부위는 MERS, SARS-CoV 유전체 내에서도 보존성이 높은 염기서열을 가졌으며, SARS-CoV-2 변이체 (알파, 베타, 감마, 델타, 오미크론) 모두에서 동일한 염기서열을 가졌다. 연구진은 전북대학교 인수공통연구소와의 공동연구를 통해 SARS-CoV-2 (Hu-1) 뿐만 아니라 변이체 증식 또한 매우 효과적으로 억제됨을 보여주며 해당 기술의 범용성을 증명하였다. 또한 SARS-CoV-2 감염 쥐 모델에 해당 치료제 기술이 투여된 쥐에서 뚜렷한 COVID-19 치료 효과를 입증했다.
유다슬이 연구조교수는 “이번 연구 결과는 바이러스 유전체 중 단백질을 구성하는 유전자가 아닌 단백질 발현을 조절하는 유전자를 세계 최초로 타겟 했다는 점과, 그것이 다른 유전자 타겟 부위보다 바이러스 증식 억제 효율이 뛰어났다는 점에서 중요한 의미를 갖는다”고 말했다.
허원도 교수는 “우리 RNA유전자가위 연구는 본래 바이러스 감염병 치료 목적으로 시작하지는 않았지만 팬데믹이라는 세계적 재난 상황에서 기여하고자 연구를 시작했고, 전북대 인수공통감염병연구소와 공동연구를 통해 치료 효과를 입증할 수 있었다. 또한 mRNA 백신으로 인류가 빠르게 팬데믹을 극복했듯이 mRNA 치료제 개발로 미래에 출현할 바이러스 감염병에 신속한 대응을 하도록 본 기술을 발전시키겠다”며 앞으로의 계획을 밝혔다.
한편, 이번 연구는 KAIST 코로나대응 과학기술뉴딜사업과 보건복지부 감염병 예방 치료기술개발 사업의 지원을 받아 수행됐다.
2023.05.02 조회수 13965 -
 질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14 조회수 15500
질병 세포만 찾아 교정치료 가능한 유전자 가위 시스템 개발
우리 대학 의과학대학원 이지민 교수 연구팀이 한국과학기술연구원(KIST) 오승자 선임연구원, 강원대학교 이주용 교수와 공동 연구를 통해 질병 세포에서만 핵 내 유전자 교정을 수행할 수 있는 유전자 가위 시스템(CRISPR/Cas9)을 개발했다고 14일 밝혔다.
연구팀은 세포 내 마이크로RNA가 특정 서열을 인식해 절단한다는 특성을 활용해, 질병 세포에서 과발현되는 마이크로RNA에 의해 특이적으로 절단될 수 있는 링커를 연결한 유전자 가위 시스템을 설계했다. 이렇게 설계된 시스템은 질병 세포 특이적 마이크로RNA가 적은 정상세포에서는 세포질에 머물러 유전자 교정을 수행하지 않지만, 질병 세포에서는 링커가 절단되면서 유전자 가위가 세포핵으로 들어가 유전자 교정을 수행할 수 있다.
이러한 플랫폼은 유전자 가위를 질병 세포에서만 기능 할 수 있게 해 정상세포와 질병 세포가 혼합돼있는 실제 환자에게도 효과적인 유전자 교정 치료를 진행할 수 있을 것으로 기대된다.
KIST 신철희 박사와 우리 대학 의과학대학원 박수찬 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `뉴클레익 엑시드 리서치(Nucleic Acids Research, IF 16.971)' 온라인판에 지난달 30일 자 출판됐다. (논문명 : Cytosolic microRNA-inducible nuclear translocation of Cas9 protein for disease-specific genome modification).
마이크로RNA는 유전자를 전사 후 조절하는 19~24 뉴클레오티드(DNA나 RNA의 기본 단위) 길이의 RNA다. 마이크로RNA는 DNA로부터 전사된 메신저 RNA에 아르고너트(Argonaute; Ago) 단백질을 통해 결합하며, 결합한 메신저 RNA를 절단한다. 마이크로RNA의 비정상적인 발현이 다양한 질병에서 보고되고 있으며, 질병의 치료를 위한 표적 바이오마커로 많이 연구되고 있다.
다양한 질병에서 마이크로RNA를 표적으로 하는 치료법들이 빠르게 연구되고 있지만, 치료 물질의 전달 및 투여량의 문제, 세포 독성 및 비정상적 면역 반응 활성화 등의 문제가 있다.
유전자 가위 시스템은 단일 가이드 RNA(single guide RNA)를 조합해 정교한 유전자 교정을 수행하는 매우 효과적인 도구다. 하지만, 이 시스템의 실제 활용에는 기술적 한계들이 존재한다. 가장 큰 문제는 안정성 문제로, 표적 유전자가 아닌 다른 유전자를 편집하는 오프-타겟 이펙트(off-target effect)다. 또한, 다양한 세포가 혼합된 환경에서는 유전자 교정을 수행하기 어렵다.
연구팀은 이러한 문제를 해결하기 위해 질병 세포 본연의 생태를 활용하는 접근법을 고안했다. 연구팀은 핵 위치 신호(Nuclear localization signal; NLS)가 부착된 기존 유전자 가위(Cas9)에 핵 외 수송신호(Nuclear export signal; NES)를 연결한 질병 세포 마이크로RNA의 메신저 RNA 표적 서열을 결합한 유전자 가위를 제작했고, 이를 유전자 가위 `셀프 체크인'으로 명명했다.
연구팀은 인간 질병 세포에서 과발현되는 마이크로RNA-21의 표적 서열과 실험용 쥐의 마이크로RNA-294의 표적 서열을 연결한 유전자 가위의 인간 질병 세포 내 유전자 교정 기능을 비교했고, 마이크로RNA-21 표적 서열 연결 유전자 가위만이 세포 내 마이크로RNA-21에 의해 절단돼 핵까지 전달되어 기능을 수행할 수 있음을 확인했다.
연구팀은 다양한 폐암 세포에서 마이크로RNA-21의 발현량과 발암 단백질 Ezh2가 양의 상관관계가 있다는 것을 증명했고, `셀프 체크인'을 적용해 마이크로RNA-21이 과발현된 폐암 세포에서 발암 유전자 Ezh2의 유전자 교정을 성공적으로 수행했다.
또한, 암세포는 항암 약물에 지속해서 노출되게 되면, 약물 저항성을 획득하게 되는데, 연구팀은 폐암 세포에서 마이크로RNA-21과 Ezh2의 발현이 항암 약물 시스플라틴을 투여하면 오히려 증가함을 확인했다. 유전자 가위 셀프 체크인 기술을 통한 Ezh2 유전자 교정과 항암제(시스플라틴)의 병행 사용은 폐암 세포의 성장을 더욱 효과적으로 억제할 수 있음을 마우스 실험을 통해서 밝혔다.
연구팀이 개발한 유전자 가위 셀프 체크인 기술은 질병 세포에서만 기능하기 때문에, 오프-타겟 이펙트를 최소화할 수 있다는 장점이 있으며, 세포 내 시스템을 활용한다는 점에서 안정성이 높다고 할 수 있다. 또한, 단일 가이드 RNA 및 메신저 RNA 표적 서열을 상황에 맞게 교체해 사용할 수 있어, 다양한 질병에 적용이 가능할 것으로 기대된다.
연구팀은 "유전자 가위 셀프 체크인 기술은 기존 유전자 가위 시스템의 문제를 개선해, 높은 특이성을 가지고 질병 세포에 대한 유전자를 세포 특이적으로 교정할 수 있다는 것을 확인할 수 있다ˮ 라며 "다양한 질병 연관 마이크로RNA에 대응해 기술을 적용할 수 있을 것이다ˮ 라고 전했다.
한편 이번 연구는 삼성미래기술육성사업, 한국연구재단 이공분야기초연구사업 및 한국과학기술연구원 지원을 받아 수행됐다.
2022.06.14 조회수 15500