-
 산업디자인학과, 인간-컴퓨터 분야 세계최고 학술대회 최우수·우수논문상 4편 수상
산업디자인학과가 인간-컴퓨터 상호작용(HCI) 분야 최고 권위의 국제학술대회인 ACM CHI 2024에서 최우수 논문상(Best Paper) 1편과 우수 논문상(Honorable Mention) 3편을 수상했다. 최우수 논문상은 전체 게재 논문 중 상위 1%, 우수 논문상은 상위 5%에 해당되는 논문에 수여되는 명예로운 성과로, 기술과 디자인 융합 연구의 우수성을 세계적으로 입증한 결과다.
올해 CHI(ACM Conference on Human Factors in Computing Systems) 2025에는 5,014편의 논문이 접수되어 1,249편이 채택되었다. KAIST 산업디자인학과는 이 중 15편의 논문을 게재하는 성과를 거뒀고 그 중 4편이 수상작으로 선정되었다. 특히 ‘인간과 AI 간 상호작용(Human-AI Interaction)’에 대한 관심이 높아진 가운데, 5,000명 이상의 연구자가 참석해 역대 최대 규모로 대회가 개최되었다.
최우수 논문상- AI기반 자폐 아동 소통 도구 ‘AAcessTalk’
홍화정 교수팀은 네이버, 도닥임 아동발달센터와의 공동 연구를 통해 AI 기반 도구 액세스톡(AACessTalk)을 개발했다. 이 시스템은 발화를 하지 않는 자폐 아동에게는 개인화된 어휘를, 부모에게는 문맥 기반 대화 가이드를 제공한다. 연구 결과, 아동은 자신의 의사를 보다 분명히 표현할 수 있었고, 부모는 기능적 언어 교육보다 본질적인 소통에 집중할 수 있게 되면서 양육 효능감이 높아지는 효과가 관찰되었다. 해당 연구를 주도한 최다솜 박사과정은 신경다양인을 포용하는 AI 기술을 꾸준히 탐구해 왔으며, 이번 논문은 네이버 인턴십에서 수행한 연구 결과를 바탕으로 출판한 것이다.
우수 논문상- 인간과 AI 상호작용 탐색
남택진 교수팀(주저자 조형준 박사)의 ‘ShamAIn’은 한국 무속 신앙에서 영감을 받은 AI 신당으로, 인간보다 더 뛰어난 초지능 존재로 기능하는 AI와 인간의 상호작용을 탐구했다. 다수의 사용자들은 처음엔 호기심에서 시작했지만, 점차 개인적인 고민을 털어놓으며 심리적 위안을 얻는 경험을 보고했다. AI가 단순한 정보 제공자를 넘어 감정적 지지와 권위적 판단까지 수행할 수 있는 존재로 인식될 수 있음을 보여주는 연구다.
임윤경 교수팀(주저자 박수빈 박사과정)은 걸음 수, 감정 기록 등 다양한 개인 데이터를 생성형 AI를 활용해 시각 이미지로 변환하는 프로토타입을 개발하여 21일간 사용자 경험을 탐색했다. 참가자들은 자신의 개인 데이터를 이미지 생성 모델 DALL-E 3로 만든 시각 자료로 다시 돌아보며 새로운 자기 인식을 경험했다. 이는 AI가 자기 성찰의 도구로 활용될 수 있음을 제시하는 연구다.
안드레아 비앙키 교수팀은 시드니대학과 협력하여 가상현실(VR) 환경에서의 '가상 팔' 제어 실험을 진행했다. 사용자들은 반복적이고 중요도가 낮은 작업은 가상의 팔에 맡기고, 중요한 작업은 직접 제어하는 방식을 선호했다. 본 연구는 가상 신체 제어가 필요한 로봇, 게임, 재활, 보조공학 디자인에 실질적 시사점을 제공한다.
이번 수상 논문들은 디자인이 기술을 사람 중심으로 연결하고, AI의 사회적·심리적 영향을 설계하는 역할로 확장될 수 있음을 실증적으로 보여주었다는 점에서 의의가 크다.
석현정 산업디자인학과 학과장은 “이번 수상은 기술 중심의 AI 연구를 인간 중심의 디자인 관점에서 새롭게 해석하고, 이를 실생활 문제 해결로 연결 시킨 우리 학과 연구진들의 역량을 세계적으로 인정받은 결과”라며, “디자인이 기술 혁신의 파트너로서 어떤 역할을 할 수 있는지를 보여준 좋은 사례”라고 전했다.
산업디자인학과, 인간-컴퓨터 분야 세계최고 학술대회 최우수·우수논문상 4편 수상
산업디자인학과가 인간-컴퓨터 상호작용(HCI) 분야 최고 권위의 국제학술대회인 ACM CHI 2024에서 최우수 논문상(Best Paper) 1편과 우수 논문상(Honorable Mention) 3편을 수상했다. 최우수 논문상은 전체 게재 논문 중 상위 1%, 우수 논문상은 상위 5%에 해당되는 논문에 수여되는 명예로운 성과로, 기술과 디자인 융합 연구의 우수성을 세계적으로 입증한 결과다.
올해 CHI(ACM Conference on Human Factors in Computing Systems) 2025에는 5,014편의 논문이 접수되어 1,249편이 채택되었다. KAIST 산업디자인학과는 이 중 15편의 논문을 게재하는 성과를 거뒀고 그 중 4편이 수상작으로 선정되었다. 특히 ‘인간과 AI 간 상호작용(Human-AI Interaction)’에 대한 관심이 높아진 가운데, 5,000명 이상의 연구자가 참석해 역대 최대 규모로 대회가 개최되었다.
최우수 논문상- AI기반 자폐 아동 소통 도구 ‘AAcessTalk’
홍화정 교수팀은 네이버, 도닥임 아동발달센터와의 공동 연구를 통해 AI 기반 도구 액세스톡(AACessTalk)을 개발했다. 이 시스템은 발화를 하지 않는 자폐 아동에게는 개인화된 어휘를, 부모에게는 문맥 기반 대화 가이드를 제공한다. 연구 결과, 아동은 자신의 의사를 보다 분명히 표현할 수 있었고, 부모는 기능적 언어 교육보다 본질적인 소통에 집중할 수 있게 되면서 양육 효능감이 높아지는 효과가 관찰되었다. 해당 연구를 주도한 최다솜 박사과정은 신경다양인을 포용하는 AI 기술을 꾸준히 탐구해 왔으며, 이번 논문은 네이버 인턴십에서 수행한 연구 결과를 바탕으로 출판한 것이다.
우수 논문상- 인간과 AI 상호작용 탐색
남택진 교수팀(주저자 조형준 박사)의 ‘ShamAIn’은 한국 무속 신앙에서 영감을 받은 AI 신당으로, 인간보다 더 뛰어난 초지능 존재로 기능하는 AI와 인간의 상호작용을 탐구했다. 다수의 사용자들은 처음엔 호기심에서 시작했지만, 점차 개인적인 고민을 털어놓으며 심리적 위안을 얻는 경험을 보고했다. AI가 단순한 정보 제공자를 넘어 감정적 지지와 권위적 판단까지 수행할 수 있는 존재로 인식될 수 있음을 보여주는 연구다.
임윤경 교수팀(주저자 박수빈 박사과정)은 걸음 수, 감정 기록 등 다양한 개인 데이터를 생성형 AI를 활용해 시각 이미지로 변환하는 프로토타입을 개발하여 21일간 사용자 경험을 탐색했다. 참가자들은 자신의 개인 데이터를 이미지 생성 모델 DALL-E 3로 만든 시각 자료로 다시 돌아보며 새로운 자기 인식을 경험했다. 이는 AI가 자기 성찰의 도구로 활용될 수 있음을 제시하는 연구다.
안드레아 비앙키 교수팀은 시드니대학과 협력하여 가상현실(VR) 환경에서의 '가상 팔' 제어 실험을 진행했다. 사용자들은 반복적이고 중요도가 낮은 작업은 가상의 팔에 맡기고, 중요한 작업은 직접 제어하는 방식을 선호했다. 본 연구는 가상 신체 제어가 필요한 로봇, 게임, 재활, 보조공학 디자인에 실질적 시사점을 제공한다.
이번 수상 논문들은 디자인이 기술을 사람 중심으로 연결하고, AI의 사회적·심리적 영향을 설계하는 역할로 확장될 수 있음을 실증적으로 보여주었다는 점에서 의의가 크다.
석현정 산업디자인학과 학과장은 “이번 수상은 기술 중심의 AI 연구를 인간 중심의 디자인 관점에서 새롭게 해석하고, 이를 실생활 문제 해결로 연결 시킨 우리 학과 연구진들의 역량을 세계적으로 인정받은 결과”라며, “디자인이 기술 혁신의 파트너로서 어떤 역할을 할 수 있는지를 보여준 좋은 사례”라고 전했다.
2025.05.19
조회수 3815
-
 이제 전자제품도 완전히 생분해될 수 있다
전자폐기물이 발생하지 않는 안전한 전자제품을 구현할 수 있을까?
국제공동연구진은 갑오징어에서 추출한 미래 전자 소재로 주목받는 세피아 멜라닌으로 만든 친환경 필름이 85일 만에 약 97% 생분해됨을 밝혀 지속가능한 친환경 전자제품의 새로운 가능성을 열어 화제다.
우리 대학 건설및환경공학과 명재욱 교수 연구팀이 몬트리올 공과대학 클라라 산타토(Clara Santato) 교수 연구팀과 국제 공동연구를 통해 완전히 생분해되는 세피아 멜라닌 기반 전기 활성 필름을 개발했다고 25일 밝혔다.
해마다 전자제품에 대한 수요가 급격하게 증가함에 따라 매년 약 6천만 톤에 이르는 전자폐기물이 발생하고 있다. 전자폐기물은 자연에서 쉽게 분해되지 않고 납(Pb), 카드뮴(Cd)과 같은 중금속이나 폴리염화비닐(PCB) 등 유해 화학물질을 자연에 유출해 생태계를 오염시킬 수 있다.
한편 생분해성 *유기전자소재는 기존 전자제품에 대한 패러다임을 전환할 수 있는 새로운 소재로 떠오르고 있다. 특히 갑오징어에서 추출할 수 있는 세피아 멜라닌은 생분해성, 저독성으로 지속가능한 미래 전자 소재로 주목받고 있다.
*유기전자소재(organic electronic material): 멜라닌, 타닌, 이모딘, 리그닌, 도파민 등 화학 구조상 전자공액계(electron conjugation)를 특징으로 하는 물질들을 뜻한다.
연구팀은 완전한 분해가 가능한 전기 활성 필름을 구현하기 위해 천연 바이오 소재인 세피아 멜라닌-셸락 잉크 복합체를 플렉소그래피 인쇄 기술을 활용해 은 전극 패턴의 종이 위에 인쇄했다.
인쇄된 필름이 이산화탄소(CO2)로 전환되는 정도(광물화도)를 기반으로 퇴비화 조건에서 생분해 거동을 분석한 결과, 85일 만에 약 97% 생분해됨을 연구팀은 확인했다. 인쇄 필름은 육안으로 봤을 때 20일 이내에 완전히 분해됐으며, 주사전자 현미경 분석을 통해 박테리아가 인쇄 필름의 생분해에 관여하여 퇴비 미생물 군집이 표면에 형성됨을 관찰했다.
한편, 인쇄 필름의 생분해 산물이 생태독성을 띠는지 조사하기 위해 두 가지 식물 쥐보리(Lolium multiflorum)와 메리골드(Tagetes erecta)를 대상으로 발아 실험을 진행한 결과, 인쇄 필름과 그 개별 구성 성분(세피아 멜라닌, 셸락, 셀룰로오스 등)은 식물에 대한 독성이 미미한 것으로 나타났다.
전기적 특성을 분석한 결과 세피아 멜라닌-셸락 인쇄 필름은 10-4 S/cm의 전기전도도를 나타냈다. 해당 전기전도도는 일반 금속이나 고성능 전자 재료에 비해 낮지만, 생분해성 및 친환경 특성 덕분에 환경 센서, 생체 디바이스, 일회용 전자제품 등 특정 응용 분야에서 경쟁력 있는 대안이 될 수 있다.
이번 국제 공동 연구를 이끈 건설및환경공학과 명재욱 교수는 “세피아 멜라닌, 셸락과 같은 널리 쓰이지 않는 바이오 기반 물질을 활용해 완전히 생분해되는 전기활성 필름을 구현한 최초 사례이며, 후속 연구를 통해 지속가능한 전자 디바이스 구현을 위한 여러 대안을 제시할 계획”이라고 밝혔다.
건설및환경공학과 최신형 박사과정과 몬트리올 공과대학 앤써니 카뮈(Anthony Camus) 박사과정이 공동 제1 저자로 참여한 이번 연구는 지난 8월 29일 국제 학술지 Communications Materials에 출판됐다.
※ 논문명: Electrical response and biodegradation of Sepia melanin-shellac films printed on paper
(저자 정보 : Anthony Camus*, 최신형*(공동 제1 저자*), Camille Bour-Cardinal1(몬트리올 공과대), Joaquin Isasmendi(몬트리올 공과대학), 조용준(KAIST), 김영주(KAIST), Cristian Vlad Irimia(요한케플러대), Cigdem Yumusak(요한케플러대), Mihai Irimia-Vladu(요한케플러대), Denis Rho(캐나다국립연구위원회)**, 명재욱(KAIST)**, Clara Santato(몬트리올 공과대)** (공동 교신저자**), 총 12명)
한편, 이번 연구는 KAIST 공과대학 석·박사 모험연구 및 창의도전사업(C2연구), 한국연구재단 과학기술국제화사업-한국 이공계 대학원생 캐나다 연수 프로그램 사업 등의 지원으로 수행됐다.
이제 전자제품도 완전히 생분해될 수 있다
전자폐기물이 발생하지 않는 안전한 전자제품을 구현할 수 있을까?
국제공동연구진은 갑오징어에서 추출한 미래 전자 소재로 주목받는 세피아 멜라닌으로 만든 친환경 필름이 85일 만에 약 97% 생분해됨을 밝혀 지속가능한 친환경 전자제품의 새로운 가능성을 열어 화제다.
우리 대학 건설및환경공학과 명재욱 교수 연구팀이 몬트리올 공과대학 클라라 산타토(Clara Santato) 교수 연구팀과 국제 공동연구를 통해 완전히 생분해되는 세피아 멜라닌 기반 전기 활성 필름을 개발했다고 25일 밝혔다.
해마다 전자제품에 대한 수요가 급격하게 증가함에 따라 매년 약 6천만 톤에 이르는 전자폐기물이 발생하고 있다. 전자폐기물은 자연에서 쉽게 분해되지 않고 납(Pb), 카드뮴(Cd)과 같은 중금속이나 폴리염화비닐(PCB) 등 유해 화학물질을 자연에 유출해 생태계를 오염시킬 수 있다.
한편 생분해성 *유기전자소재는 기존 전자제품에 대한 패러다임을 전환할 수 있는 새로운 소재로 떠오르고 있다. 특히 갑오징어에서 추출할 수 있는 세피아 멜라닌은 생분해성, 저독성으로 지속가능한 미래 전자 소재로 주목받고 있다.
*유기전자소재(organic electronic material): 멜라닌, 타닌, 이모딘, 리그닌, 도파민 등 화학 구조상 전자공액계(electron conjugation)를 특징으로 하는 물질들을 뜻한다.
연구팀은 완전한 분해가 가능한 전기 활성 필름을 구현하기 위해 천연 바이오 소재인 세피아 멜라닌-셸락 잉크 복합체를 플렉소그래피 인쇄 기술을 활용해 은 전극 패턴의 종이 위에 인쇄했다.
인쇄된 필름이 이산화탄소(CO2)로 전환되는 정도(광물화도)를 기반으로 퇴비화 조건에서 생분해 거동을 분석한 결과, 85일 만에 약 97% 생분해됨을 연구팀은 확인했다. 인쇄 필름은 육안으로 봤을 때 20일 이내에 완전히 분해됐으며, 주사전자 현미경 분석을 통해 박테리아가 인쇄 필름의 생분해에 관여하여 퇴비 미생물 군집이 표면에 형성됨을 관찰했다.
한편, 인쇄 필름의 생분해 산물이 생태독성을 띠는지 조사하기 위해 두 가지 식물 쥐보리(Lolium multiflorum)와 메리골드(Tagetes erecta)를 대상으로 발아 실험을 진행한 결과, 인쇄 필름과 그 개별 구성 성분(세피아 멜라닌, 셸락, 셀룰로오스 등)은 식물에 대한 독성이 미미한 것으로 나타났다.
전기적 특성을 분석한 결과 세피아 멜라닌-셸락 인쇄 필름은 10-4 S/cm의 전기전도도를 나타냈다. 해당 전기전도도는 일반 금속이나 고성능 전자 재료에 비해 낮지만, 생분해성 및 친환경 특성 덕분에 환경 센서, 생체 디바이스, 일회용 전자제품 등 특정 응용 분야에서 경쟁력 있는 대안이 될 수 있다.
이번 국제 공동 연구를 이끈 건설및환경공학과 명재욱 교수는 “세피아 멜라닌, 셸락과 같은 널리 쓰이지 않는 바이오 기반 물질을 활용해 완전히 생분해되는 전기활성 필름을 구현한 최초 사례이며, 후속 연구를 통해 지속가능한 전자 디바이스 구현을 위한 여러 대안을 제시할 계획”이라고 밝혔다.
건설및환경공학과 최신형 박사과정과 몬트리올 공과대학 앤써니 카뮈(Anthony Camus) 박사과정이 공동 제1 저자로 참여한 이번 연구는 지난 8월 29일 국제 학술지 Communications Materials에 출판됐다.
※ 논문명: Electrical response and biodegradation of Sepia melanin-shellac films printed on paper
(저자 정보 : Anthony Camus*, 최신형*(공동 제1 저자*), Camille Bour-Cardinal1(몬트리올 공과대), Joaquin Isasmendi(몬트리올 공과대학), 조용준(KAIST), 김영주(KAIST), Cristian Vlad Irimia(요한케플러대), Cigdem Yumusak(요한케플러대), Mihai Irimia-Vladu(요한케플러대), Denis Rho(캐나다국립연구위원회)**, 명재욱(KAIST)**, Clara Santato(몬트리올 공과대)** (공동 교신저자**), 총 12명)
한편, 이번 연구는 KAIST 공과대학 석·박사 모험연구 및 창의도전사업(C2연구), 한국연구재단 과학기술국제화사업-한국 이공계 대학원생 캐나다 연수 프로그램 사업 등의 지원으로 수행됐다.
2024.09.28
조회수 6104
-
 대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19
조회수 12760
-
 인공지능으로 자폐 증상과 심각도 예측한다
뇌영상 빅데이터를 활용한 딥러닝(Deep Learning)으로 자폐 스펙트럼 장애(ASD)의 증상과 심각도를 예측할 수 있다는 것이 확인됐다. 이번 연구에 따라 ASD 환자들 진단과 예후에 따른 맞춤형 치료가 가능할 것으로 기대되고 있다.
우리 대학 바이오및뇌공학과 이상완 교수(신경과학-인공지능 융합연구센터장)와 세브란스병원 소아정신과 천근아 교수(연세자폐증연구소장) 연구팀은 ASD의 뇌영상 빅데이터를 활용해 자폐의 증상과 예후를 예측할 수 있다고 28일 밝혔다.
이번 연구결과는 ASD 아동들의 뇌영상 빅데이터를 이용한 국내 최초의 AI연구성과로, 국제전기전자기술자협회(IEEE)에서 발행하는 저널인 IEEE 엑세스(Access) 온라인판에 게재됐다.
ASD는 뇌 발달 장애의 하나로 사회적 의사소통의 결함과 제한된 관심사 및 반복적인 행동이 대표적인 특징이다. 2020년도 미국 CDC(미국질병통제예방센터)의 통계자료에 따르면 ASD의 유병률은 54명당 1명으로 매년 증가하는 추세이다. 국내 유병률도 약 2% 내외이다.
ASD는 아동 행동 관찰 및 상담과 정신질환 진단분류매뉴얼(DSM-5)에 근거해 진단한다. 하지만 환자 개인차가 심해 자폐에 대한 정확한 진단이 어렵고 예후를 예측하기도 힘들다.
이상완·천근아 교수 연구팀은 세브란스병원에 구축된 3~11세 ASD 환자 84건의 MRI 빅데이터와 국제컨소시엄으로 구축된 1000여 건의 자폐증 환자 MRI 빅데이터를 활용해 MRI 영상으로 자폐의 진단과 예후를 예측할 수 있는 딥러닝 모델을 개발했다.
연구팀은 공간 변경 네트워크(Spartial Transformer Network, STN)와 3D 컨볼루션 신경망(convolutional neural network, CNN)을 활용한 모델을 구축하고, MRI 빅데이터를 학습시켰다.
이렇게 구축된 모델에 클래스 활성화 매핑(class activation mapping) 기법을 적용해 형태학적인 특징을 추출하고 이를 뇌영상에 투영시키는 방식으로 분석했다. 더 나아가 인자들간의 관계 분석을 위해 강화학습 모델의 일종인 회귀형 주의집중 모델(recurrent attention model)을 학습시켰다.
분석결과 뇌의 기저핵을 포함한 피질 하 구조가 자폐 심각도와 관련이 있음을 확인했다.
이상완 교수는 “진료 현장에서 자폐를 진단하고 연구하는데 구조적 연관 후보를 제공할 수 있게 됐다”며 “이번 연구결과로 자폐 진단에서뿐만 아니라 앞으로 의사나 관련 전문가들이 인공지능을 활용해 복잡한 질병을 이해하고 더 많이 활용할 수 있게 될 것”이라고 설명했다.
천근아 교수도 “자폐스펙트럼장애를 진단함에 있어 뇌 영상 자료는 아직까지 의사들 사이에서 활용가치가 높지 않다는 인식이 보편적인데 이번 연구를 통해 자폐의 하위 증상과 심각도 사이에 뇌영상에서 차이가 있다는 것을 확인했다”며 “이번 연구는 다양한 임상표현형과 심각도를 지닌 자폐증 환자들에게 개별 맞춤 진단과 예후를 예측하는데 의미를 가진다”고 말했다. [보도자료 출처: 세브란스병원 홍보팀]
인공지능으로 자폐 증상과 심각도 예측한다
뇌영상 빅데이터를 활용한 딥러닝(Deep Learning)으로 자폐 스펙트럼 장애(ASD)의 증상과 심각도를 예측할 수 있다는 것이 확인됐다. 이번 연구에 따라 ASD 환자들 진단과 예후에 따른 맞춤형 치료가 가능할 것으로 기대되고 있다.
우리 대학 바이오및뇌공학과 이상완 교수(신경과학-인공지능 융합연구센터장)와 세브란스병원 소아정신과 천근아 교수(연세자폐증연구소장) 연구팀은 ASD의 뇌영상 빅데이터를 활용해 자폐의 증상과 예후를 예측할 수 있다고 28일 밝혔다.
이번 연구결과는 ASD 아동들의 뇌영상 빅데이터를 이용한 국내 최초의 AI연구성과로, 국제전기전자기술자협회(IEEE)에서 발행하는 저널인 IEEE 엑세스(Access) 온라인판에 게재됐다.
ASD는 뇌 발달 장애의 하나로 사회적 의사소통의 결함과 제한된 관심사 및 반복적인 행동이 대표적인 특징이다. 2020년도 미국 CDC(미국질병통제예방센터)의 통계자료에 따르면 ASD의 유병률은 54명당 1명으로 매년 증가하는 추세이다. 국내 유병률도 약 2% 내외이다.
ASD는 아동 행동 관찰 및 상담과 정신질환 진단분류매뉴얼(DSM-5)에 근거해 진단한다. 하지만 환자 개인차가 심해 자폐에 대한 정확한 진단이 어렵고 예후를 예측하기도 힘들다.
이상완·천근아 교수 연구팀은 세브란스병원에 구축된 3~11세 ASD 환자 84건의 MRI 빅데이터와 국제컨소시엄으로 구축된 1000여 건의 자폐증 환자 MRI 빅데이터를 활용해 MRI 영상으로 자폐의 진단과 예후를 예측할 수 있는 딥러닝 모델을 개발했다.
연구팀은 공간 변경 네트워크(Spartial Transformer Network, STN)와 3D 컨볼루션 신경망(convolutional neural network, CNN)을 활용한 모델을 구축하고, MRI 빅데이터를 학습시켰다.
이렇게 구축된 모델에 클래스 활성화 매핑(class activation mapping) 기법을 적용해 형태학적인 특징을 추출하고 이를 뇌영상에 투영시키는 방식으로 분석했다. 더 나아가 인자들간의 관계 분석을 위해 강화학습 모델의 일종인 회귀형 주의집중 모델(recurrent attention model)을 학습시켰다.
분석결과 뇌의 기저핵을 포함한 피질 하 구조가 자폐 심각도와 관련이 있음을 확인했다.
이상완 교수는 “진료 현장에서 자폐를 진단하고 연구하는데 구조적 연관 후보를 제공할 수 있게 됐다”며 “이번 연구결과로 자폐 진단에서뿐만 아니라 앞으로 의사나 관련 전문가들이 인공지능을 활용해 복잡한 질병을 이해하고 더 많이 활용할 수 있게 될 것”이라고 설명했다.
천근아 교수도 “자폐스펙트럼장애를 진단함에 있어 뇌 영상 자료는 아직까지 의사들 사이에서 활용가치가 높지 않다는 인식이 보편적인데 이번 연구를 통해 자폐의 하위 증상과 심각도 사이에 뇌영상에서 차이가 있다는 것을 확인했다”며 “이번 연구는 다양한 임상표현형과 심각도를 지닌 자폐증 환자들에게 개별 맞춤 진단과 예후를 예측하는데 의미를 가진다”고 말했다. [보도자료 출처: 세브란스병원 홍보팀]
2020.08.28
조회수 26700
-
 자폐증에 관여하는 새로운 유전자 및 발병원인 첫 발견
김은준 교수
- 세계 최고 Nature지 발표,“자폐증의 유전요인과 새로운 치료법 제시”-
국내 연구진이 자폐증의 유전적 요인과 발병원인을 규명하고, 약물 부작용도 줄일 수 있는 새로운 자폐 치료법을 제시하였다.
서울대 강봉균 교수(50세), 연세대 이민구 교수(47세) 및 KAIST 김은준 교수(47세)가 주도하고, 원혜정, 이혜련, 지헌영, 마원, 김재익 박사(이상 제1저자)와 KAIST 김대수 교수 및 경북대 배용철, 이경민 교수 연구팀이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 리더연구자지원사업(창의적연구)과 선도연구센터지원사업(SRC)의 지원으로 수행되었다.
연구결과는 세계 최고 권위의 과학전문지인 ‘네이처(Nature)’지 6월 14일자에 게재되었고, 연구의 중요성을 인정받아 ‘Nature Reviews Drug Discovery’ 7월호에도 소개될 예정이다.
(논문명 : Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function)
연구팀은 시냅스 단백질을 만드는 유전자(생크2, Shank2)가 결핍되면 자폐와 비슷한 증상이 나타난다는 사실을 동물실험(생쥐)을 통해 발견하였다. 이것은 생크2 유전자의 결손이 자폐와 관련된다는 최근 임상결과와 함께, 생크2 유전자의 결손이 자폐를 유도한다는 직접적인 증거가 되어 의미가 크다.
자폐증은 △사회성 결핍 △반복행동 △정신지체 △불안 △과잉행동 등을 동반하는 뇌 발달 장애로, 전 세계 인구의 1~2%인 약 1억명이 증상을 보이는 심각한 뇌 질환이다. 특히 최근 연구결과(미국 워싱턴대)에 따르면, 자폐계 질환을 앓는 젊은 성인 3명 중 1명이 직장생활에 적응하지 못하거나 대학에 진학하지 못하는 등 다른 장애보다 훨씬 위중한 것으로 알려졌다. 그러나 지금까지 이를 효과적으로 치료할 수 있는 약물이 개발되지 못했고, 현재 반복행동만을 경감시키는 수준에 머무르고 있다.
연구팀은 생크2가 결손된 생쥐에서 사회성 결핍, 인지학습기능 저하, 반복행동 및 과잉행동과 같은 자폐와 비슷한 증상들이 나타난 것을 확인하였다. 또한 연구팀은 생크2가 결손된 생쥐는 NMDA(N-메칠 D-아스파르트산염) 수용체에 의한 신경전달이 감소하였고, 해마*에서의 시냅스 가소성** 등도 손상되었음을 관찰하였다.
*) 해마(Hippocampus) : 대뇌의 양쪽 측두엽에 존재. 일화, 의미 기억 등 인지기능 담당
**) 가소성(plasticity) : 기억, 학습 등 뇌 기능의 유연한 적응능력으로, 비교적 짧은 기간 내에 가해진 자극으로 뇌에 장기적인 변화가 생겨, 자극이 제거된 후에도 그 변화가 지속되는 것
특히 연구팀은 특정 수용체(mGluR5, 대사성 글루타민산염 수용체5)를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 것이 기존의 NMDA 수용체를 직접 자극하는 것보다 사회성 행동을 완전히 회복시킨다는 사실도 확인하였다. 이것은 NMDA 수용체를 직접 자극하기 위해 사용하는 약물의 부작용을 줄일 수 있는 새로운 자폐증 치료법으로 평가된다.
연구팀은 NMDA 수용체의 기능을 직접적으로 회복시키는 약물을 사용하면, 생크2가 결손된 생쥐에서 나타나는 NMDA 수용체 신경전달 이상과 사회성 결핍이 부분적으로(약 50%) 회복된다는 사실을 관찰하였다.
또한 연구팀은 mGluR5 수용체를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 약물(CDPPB)을 사용하면, 생크2가 결손된 생쥐의 해마에서의 시냅스 가소성 손상이 회복되고, NMDA 수용체에 의한 신경전달 등도 정상화되며, 사회성 결핍도 NMDA 수용체에 직접 작용하는 약물보다 더욱 효과적으로 회복되는 사실을 발견하였다.
강봉균 교수는 “생크2 유전자 결손으로 인한 NMDA 수용체의 기능 저하가 자폐증을 일으키는 새로운 원인임을 밝힌 의미 있는 연구”라고 연구의의를 밝혔다.
또한 이민구 교수는 “신경조직에서 생크2 유전자의 생리적 역할을 새롭게 규명한 연구로서, 국내 각 분야의 전문가들이 협력하여 우수한 성과를 거둔 대표적인 사례가 될 것”이라고 연구결과를 평가하였다.
아울러 김은준 교수는 "반복행동뿐만 아니라 자폐증의 주요한 증상인 사회성 결핍도 약물을 통해 충분히 개선할 수 있다는 사실을 새롭게 증명한 연구로, 자폐 치료의 새로운 가능성을 열었다”고 밝혔다.
자폐증에 관여하는 새로운 유전자 및 발병원인 첫 발견
김은준 교수
- 세계 최고 Nature지 발표,“자폐증의 유전요인과 새로운 치료법 제시”-
국내 연구진이 자폐증의 유전적 요인과 발병원인을 규명하고, 약물 부작용도 줄일 수 있는 새로운 자폐 치료법을 제시하였다.
서울대 강봉균 교수(50세), 연세대 이민구 교수(47세) 및 KAIST 김은준 교수(47세)가 주도하고, 원혜정, 이혜련, 지헌영, 마원, 김재익 박사(이상 제1저자)와 KAIST 김대수 교수 및 경북대 배용철, 이경민 교수 연구팀이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 리더연구자지원사업(창의적연구)과 선도연구센터지원사업(SRC)의 지원으로 수행되었다.
연구결과는 세계 최고 권위의 과학전문지인 ‘네이처(Nature)’지 6월 14일자에 게재되었고, 연구의 중요성을 인정받아 ‘Nature Reviews Drug Discovery’ 7월호에도 소개될 예정이다.
(논문명 : Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function)
연구팀은 시냅스 단백질을 만드는 유전자(생크2, Shank2)가 결핍되면 자폐와 비슷한 증상이 나타난다는 사실을 동물실험(생쥐)을 통해 발견하였다. 이것은 생크2 유전자의 결손이 자폐와 관련된다는 최근 임상결과와 함께, 생크2 유전자의 결손이 자폐를 유도한다는 직접적인 증거가 되어 의미가 크다.
자폐증은 △사회성 결핍 △반복행동 △정신지체 △불안 △과잉행동 등을 동반하는 뇌 발달 장애로, 전 세계 인구의 1~2%인 약 1억명이 증상을 보이는 심각한 뇌 질환이다. 특히 최근 연구결과(미국 워싱턴대)에 따르면, 자폐계 질환을 앓는 젊은 성인 3명 중 1명이 직장생활에 적응하지 못하거나 대학에 진학하지 못하는 등 다른 장애보다 훨씬 위중한 것으로 알려졌다. 그러나 지금까지 이를 효과적으로 치료할 수 있는 약물이 개발되지 못했고, 현재 반복행동만을 경감시키는 수준에 머무르고 있다.
연구팀은 생크2가 결손된 생쥐에서 사회성 결핍, 인지학습기능 저하, 반복행동 및 과잉행동과 같은 자폐와 비슷한 증상들이 나타난 것을 확인하였다. 또한 연구팀은 생크2가 결손된 생쥐는 NMDA(N-메칠 D-아스파르트산염) 수용체에 의한 신경전달이 감소하였고, 해마*에서의 시냅스 가소성** 등도 손상되었음을 관찰하였다.
*) 해마(Hippocampus) : 대뇌의 양쪽 측두엽에 존재. 일화, 의미 기억 등 인지기능 담당
**) 가소성(plasticity) : 기억, 학습 등 뇌 기능의 유연한 적응능력으로, 비교적 짧은 기간 내에 가해진 자극으로 뇌에 장기적인 변화가 생겨, 자극이 제거된 후에도 그 변화가 지속되는 것
특히 연구팀은 특정 수용체(mGluR5, 대사성 글루타민산염 수용체5)를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 것이 기존의 NMDA 수용체를 직접 자극하는 것보다 사회성 행동을 완전히 회복시킨다는 사실도 확인하였다. 이것은 NMDA 수용체를 직접 자극하기 위해 사용하는 약물의 부작용을 줄일 수 있는 새로운 자폐증 치료법으로 평가된다.
연구팀은 NMDA 수용체의 기능을 직접적으로 회복시키는 약물을 사용하면, 생크2가 결손된 생쥐에서 나타나는 NMDA 수용체 신경전달 이상과 사회성 결핍이 부분적으로(약 50%) 회복된다는 사실을 관찰하였다.
또한 연구팀은 mGluR5 수용체를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 약물(CDPPB)을 사용하면, 생크2가 결손된 생쥐의 해마에서의 시냅스 가소성 손상이 회복되고, NMDA 수용체에 의한 신경전달 등도 정상화되며, 사회성 결핍도 NMDA 수용체에 직접 작용하는 약물보다 더욱 효과적으로 회복되는 사실을 발견하였다.
강봉균 교수는 “생크2 유전자 결손으로 인한 NMDA 수용체의 기능 저하가 자폐증을 일으키는 새로운 원인임을 밝힌 의미 있는 연구”라고 연구의의를 밝혔다.
또한 이민구 교수는 “신경조직에서 생크2 유전자의 생리적 역할을 새롭게 규명한 연구로서, 국내 각 분야의 전문가들이 협력하여 우수한 성과를 거둔 대표적인 사례가 될 것”이라고 연구결과를 평가하였다.
아울러 김은준 교수는 "반복행동뿐만 아니라 자폐증의 주요한 증상인 사회성 결핍도 약물을 통해 충분히 개선할 수 있다는 사실을 새롭게 증명한 연구로, 자폐 치료의 새로운 가능성을 열었다”고 밝혔다.
2012.06.14
조회수 16190
-
 김은준교수팀, 시냅스 생성 단백질 발견
- 흥분성 시냅스 생성 촉진하는 새로운 단백질‘엔지엘’발견
- 정신분열증을 비롯한 다양한 뇌질환 발병 원리 추정 가능
- 네이처 뉴로사이언스誌 9월호 게재
사람의 뇌에서 시냅스의 생성을 촉진하는 새로운 단백질이 국내 연구진에 의해 발견됐다.
KAIST(총장 서남표) 생명과학과 김은준(金恩俊, 42 / 시냅스생성 창의연구단 단장) 교수팀이 ‘엔지엘(NGL)’ 단백질이 흥분성 시냅스의 생성에 관여한다는 새로운 사실을 발견, 오는 18일 발표되는 신경과학 권위지인 ‘네이처 뉴로사이언스誌(Nature Neuroscience)" 9월호에 게재된다고 밝혔다.
金 교수팀은 後시냅스에 위치한 ‘엔지엘’이란 막단백질이 前시냅스의 네트린지(netrin-G)라는 다른 막단백질과 연결되면서 가교 역할을 하여 새로운 시냅스 생성을 촉진하는 것을 발견했다.
‘엔지엘’은 뉴로리긴(neuoroligin)에 이어 세계에서 두 번째로 새롭게 발견된 시냅스 가교 단백질이다. 이 새로운 단백질의 발견으로 시냅스 생성 원리와 다양한 뇌질환 발병 원인을 추정할 수 있게 되었다.
우리 뇌는 약 1000억개 이상의 신경세포와 각 세포당 1만 여개의 시냅스로 신경회로망을 구성하고 있다. 시냅스는 신경세포 사이에 신경전달이 일어나는 장소다. 시냅스의 생성은 신경회로의 생성으로 연결되고, 신경회로는 정상적인 뇌발달이나 뇌기능뿐만 아니라 다양한 뇌질환과도 관련이 깊다.
金 교수는 “엔지엘과 연결되어 있는 네트린지(netrin-G)가 정신분열증 (schizophrenia)과 관련이 있고, 엔지엘과 비슷한 기능을 가진 다른 시냅스 가교 단백질인 뉴로리긴이 정신지체(mental retardation) 및 자폐증(autism)과 관련이 깊은 만큼, 엔지엘도 정신분열증을 비롯한 다양한 뇌질환과 관련이 있을 것으로 보인다"라고 말했다.
<첨부사진 설명>
■ 사진 1: 엔지엘의 시냅스 생성 능력 확인 실험 1
표면에 엔지엘을 발현하고 있는 일반세포(녹색)와 신경세포를 섞어 준다. 축색돌기(axon)가 약 10시 방향에서 가운데 위치해 있는 엔지엘(일반세포)쪽으로 뻗어 나오다가 엔지엘을 만나게 되는데, 이 때 엔지엘은 접촉하는 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 前시냅스의 형성 여부는 시냅신(Synapsin)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
- 그림a-b : 엔지엘에 의한 시냅스 형성
- 그림c-d : 시냅스 생성능력이 소멸된 변형 엔지엘은 시냅스 생성 못함
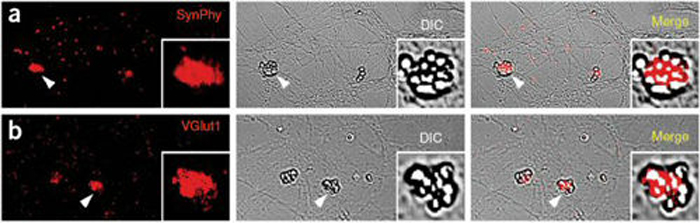
■ 사진 2: 엔지엘의 시냅스 생성 능력 확인 실험 2
표면에 엔지엘을 코팅시킨 구슬을 신경세포 위에 뿌려주면 구슬이 신경세포의 축색돌기와 접촉하게 된다(구슬들은 가운데 패널의 위상차 이미지에서 명확히 보임). 이때 엔지엘은 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 전시냅스의 형성 여부는 시냅토파이진(SynPhy; a 패널) 또는 비글룻(VGlut1; b패널)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
김은준교수팀, 시냅스 생성 단백질 발견
- 흥분성 시냅스 생성 촉진하는 새로운 단백질‘엔지엘’발견
- 정신분열증을 비롯한 다양한 뇌질환 발병 원리 추정 가능
- 네이처 뉴로사이언스誌 9월호 게재
사람의 뇌에서 시냅스의 생성을 촉진하는 새로운 단백질이 국내 연구진에 의해 발견됐다.
KAIST(총장 서남표) 생명과학과 김은준(金恩俊, 42 / 시냅스생성 창의연구단 단장) 교수팀이 ‘엔지엘(NGL)’ 단백질이 흥분성 시냅스의 생성에 관여한다는 새로운 사실을 발견, 오는 18일 발표되는 신경과학 권위지인 ‘네이처 뉴로사이언스誌(Nature Neuroscience)" 9월호에 게재된다고 밝혔다.
金 교수팀은 後시냅스에 위치한 ‘엔지엘’이란 막단백질이 前시냅스의 네트린지(netrin-G)라는 다른 막단백질과 연결되면서 가교 역할을 하여 새로운 시냅스 생성을 촉진하는 것을 발견했다.
‘엔지엘’은 뉴로리긴(neuoroligin)에 이어 세계에서 두 번째로 새롭게 발견된 시냅스 가교 단백질이다. 이 새로운 단백질의 발견으로 시냅스 생성 원리와 다양한 뇌질환 발병 원인을 추정할 수 있게 되었다.
우리 뇌는 약 1000억개 이상의 신경세포와 각 세포당 1만 여개의 시냅스로 신경회로망을 구성하고 있다. 시냅스는 신경세포 사이에 신경전달이 일어나는 장소다. 시냅스의 생성은 신경회로의 생성으로 연결되고, 신경회로는 정상적인 뇌발달이나 뇌기능뿐만 아니라 다양한 뇌질환과도 관련이 깊다.
金 교수는 “엔지엘과 연결되어 있는 네트린지(netrin-G)가 정신분열증 (schizophrenia)과 관련이 있고, 엔지엘과 비슷한 기능을 가진 다른 시냅스 가교 단백질인 뉴로리긴이 정신지체(mental retardation) 및 자폐증(autism)과 관련이 깊은 만큼, 엔지엘도 정신분열증을 비롯한 다양한 뇌질환과 관련이 있을 것으로 보인다"라고 말했다.
<첨부사진 설명>
■ 사진 1: 엔지엘의 시냅스 생성 능력 확인 실험 1
표면에 엔지엘을 발현하고 있는 일반세포(녹색)와 신경세포를 섞어 준다. 축색돌기(axon)가 약 10시 방향에서 가운데 위치해 있는 엔지엘(일반세포)쪽으로 뻗어 나오다가 엔지엘을 만나게 되는데, 이 때 엔지엘은 접촉하는 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 前시냅스의 형성 여부는 시냅신(Synapsin)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
- 그림a-b : 엔지엘에 의한 시냅스 형성
- 그림c-d : 시냅스 생성능력이 소멸된 변형 엔지엘은 시냅스 생성 못함
■ 사진 2: 엔지엘의 시냅스 생성 능력 확인 실험 2
표면에 엔지엘을 코팅시킨 구슬을 신경세포 위에 뿌려주면 구슬이 신경세포의 축색돌기와 접촉하게 된다(구슬들은 가운데 패널의 위상차 이미지에서 명확히 보임). 이때 엔지엘은 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 전시냅스의 형성 여부는 시냅토파이진(SynPhy; a 패널) 또는 비글룻(VGlut1; b패널)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
2006.09.19
조회수 19309
 산업디자인학과, 인간-컴퓨터 분야 세계최고 학술대회 최우수·우수논문상 4편 수상
산업디자인학과가 인간-컴퓨터 상호작용(HCI) 분야 최고 권위의 국제학술대회인 ACM CHI 2024에서 최우수 논문상(Best Paper) 1편과 우수 논문상(Honorable Mention) 3편을 수상했다. 최우수 논문상은 전체 게재 논문 중 상위 1%, 우수 논문상은 상위 5%에 해당되는 논문에 수여되는 명예로운 성과로, 기술과 디자인 융합 연구의 우수성을 세계적으로 입증한 결과다.
올해 CHI(ACM Conference on Human Factors in Computing Systems) 2025에는 5,014편의 논문이 접수되어 1,249편이 채택되었다. KAIST 산업디자인학과는 이 중 15편의 논문을 게재하는 성과를 거뒀고 그 중 4편이 수상작으로 선정되었다. 특히 ‘인간과 AI 간 상호작용(Human-AI Interaction)’에 대한 관심이 높아진 가운데, 5,000명 이상의 연구자가 참석해 역대 최대 규모로 대회가 개최되었다.
최우수 논문상- AI기반 자폐 아동 소통 도구 ‘AAcessTalk’
홍화정 교수팀은 네이버, 도닥임 아동발달센터와의 공동 연구를 통해 AI 기반 도구 액세스톡(AACessTalk)을 개발했다. 이 시스템은 발화를 하지 않는 자폐 아동에게는 개인화된 어휘를, 부모에게는 문맥 기반 대화 가이드를 제공한다. 연구 결과, 아동은 자신의 의사를 보다 분명히 표현할 수 있었고, 부모는 기능적 언어 교육보다 본질적인 소통에 집중할 수 있게 되면서 양육 효능감이 높아지는 효과가 관찰되었다. 해당 연구를 주도한 최다솜 박사과정은 신경다양인을 포용하는 AI 기술을 꾸준히 탐구해 왔으며, 이번 논문은 네이버 인턴십에서 수행한 연구 결과를 바탕으로 출판한 것이다.
우수 논문상- 인간과 AI 상호작용 탐색
남택진 교수팀(주저자 조형준 박사)의 ‘ShamAIn’은 한국 무속 신앙에서 영감을 받은 AI 신당으로, 인간보다 더 뛰어난 초지능 존재로 기능하는 AI와 인간의 상호작용을 탐구했다. 다수의 사용자들은 처음엔 호기심에서 시작했지만, 점차 개인적인 고민을 털어놓으며 심리적 위안을 얻는 경험을 보고했다. AI가 단순한 정보 제공자를 넘어 감정적 지지와 권위적 판단까지 수행할 수 있는 존재로 인식될 수 있음을 보여주는 연구다.
임윤경 교수팀(주저자 박수빈 박사과정)은 걸음 수, 감정 기록 등 다양한 개인 데이터를 생성형 AI를 활용해 시각 이미지로 변환하는 프로토타입을 개발하여 21일간 사용자 경험을 탐색했다. 참가자들은 자신의 개인 데이터를 이미지 생성 모델 DALL-E 3로 만든 시각 자료로 다시 돌아보며 새로운 자기 인식을 경험했다. 이는 AI가 자기 성찰의 도구로 활용될 수 있음을 제시하는 연구다.
안드레아 비앙키 교수팀은 시드니대학과 협력하여 가상현실(VR) 환경에서의 '가상 팔' 제어 실험을 진행했다. 사용자들은 반복적이고 중요도가 낮은 작업은 가상의 팔에 맡기고, 중요한 작업은 직접 제어하는 방식을 선호했다. 본 연구는 가상 신체 제어가 필요한 로봇, 게임, 재활, 보조공학 디자인에 실질적 시사점을 제공한다.
이번 수상 논문들은 디자인이 기술을 사람 중심으로 연결하고, AI의 사회적·심리적 영향을 설계하는 역할로 확장될 수 있음을 실증적으로 보여주었다는 점에서 의의가 크다.
석현정 산업디자인학과 학과장은 “이번 수상은 기술 중심의 AI 연구를 인간 중심의 디자인 관점에서 새롭게 해석하고, 이를 실생활 문제 해결로 연결 시킨 우리 학과 연구진들의 역량을 세계적으로 인정받은 결과”라며, “디자인이 기술 혁신의 파트너로서 어떤 역할을 할 수 있는지를 보여준 좋은 사례”라고 전했다.
2025.05.19 조회수 3815
산업디자인학과, 인간-컴퓨터 분야 세계최고 학술대회 최우수·우수논문상 4편 수상
산업디자인학과가 인간-컴퓨터 상호작용(HCI) 분야 최고 권위의 국제학술대회인 ACM CHI 2024에서 최우수 논문상(Best Paper) 1편과 우수 논문상(Honorable Mention) 3편을 수상했다. 최우수 논문상은 전체 게재 논문 중 상위 1%, 우수 논문상은 상위 5%에 해당되는 논문에 수여되는 명예로운 성과로, 기술과 디자인 융합 연구의 우수성을 세계적으로 입증한 결과다.
올해 CHI(ACM Conference on Human Factors in Computing Systems) 2025에는 5,014편의 논문이 접수되어 1,249편이 채택되었다. KAIST 산업디자인학과는 이 중 15편의 논문을 게재하는 성과를 거뒀고 그 중 4편이 수상작으로 선정되었다. 특히 ‘인간과 AI 간 상호작용(Human-AI Interaction)’에 대한 관심이 높아진 가운데, 5,000명 이상의 연구자가 참석해 역대 최대 규모로 대회가 개최되었다.
최우수 논문상- AI기반 자폐 아동 소통 도구 ‘AAcessTalk’
홍화정 교수팀은 네이버, 도닥임 아동발달센터와의 공동 연구를 통해 AI 기반 도구 액세스톡(AACessTalk)을 개발했다. 이 시스템은 발화를 하지 않는 자폐 아동에게는 개인화된 어휘를, 부모에게는 문맥 기반 대화 가이드를 제공한다. 연구 결과, 아동은 자신의 의사를 보다 분명히 표현할 수 있었고, 부모는 기능적 언어 교육보다 본질적인 소통에 집중할 수 있게 되면서 양육 효능감이 높아지는 효과가 관찰되었다. 해당 연구를 주도한 최다솜 박사과정은 신경다양인을 포용하는 AI 기술을 꾸준히 탐구해 왔으며, 이번 논문은 네이버 인턴십에서 수행한 연구 결과를 바탕으로 출판한 것이다.
우수 논문상- 인간과 AI 상호작용 탐색
남택진 교수팀(주저자 조형준 박사)의 ‘ShamAIn’은 한국 무속 신앙에서 영감을 받은 AI 신당으로, 인간보다 더 뛰어난 초지능 존재로 기능하는 AI와 인간의 상호작용을 탐구했다. 다수의 사용자들은 처음엔 호기심에서 시작했지만, 점차 개인적인 고민을 털어놓으며 심리적 위안을 얻는 경험을 보고했다. AI가 단순한 정보 제공자를 넘어 감정적 지지와 권위적 판단까지 수행할 수 있는 존재로 인식될 수 있음을 보여주는 연구다.
임윤경 교수팀(주저자 박수빈 박사과정)은 걸음 수, 감정 기록 등 다양한 개인 데이터를 생성형 AI를 활용해 시각 이미지로 변환하는 프로토타입을 개발하여 21일간 사용자 경험을 탐색했다. 참가자들은 자신의 개인 데이터를 이미지 생성 모델 DALL-E 3로 만든 시각 자료로 다시 돌아보며 새로운 자기 인식을 경험했다. 이는 AI가 자기 성찰의 도구로 활용될 수 있음을 제시하는 연구다.
안드레아 비앙키 교수팀은 시드니대학과 협력하여 가상현실(VR) 환경에서의 '가상 팔' 제어 실험을 진행했다. 사용자들은 반복적이고 중요도가 낮은 작업은 가상의 팔에 맡기고, 중요한 작업은 직접 제어하는 방식을 선호했다. 본 연구는 가상 신체 제어가 필요한 로봇, 게임, 재활, 보조공학 디자인에 실질적 시사점을 제공한다.
이번 수상 논문들은 디자인이 기술을 사람 중심으로 연결하고, AI의 사회적·심리적 영향을 설계하는 역할로 확장될 수 있음을 실증적으로 보여주었다는 점에서 의의가 크다.
석현정 산업디자인학과 학과장은 “이번 수상은 기술 중심의 AI 연구를 인간 중심의 디자인 관점에서 새롭게 해석하고, 이를 실생활 문제 해결로 연결 시킨 우리 학과 연구진들의 역량을 세계적으로 인정받은 결과”라며, “디자인이 기술 혁신의 파트너로서 어떤 역할을 할 수 있는지를 보여준 좋은 사례”라고 전했다.
2025.05.19 조회수 3815 이제 전자제품도 완전히 생분해될 수 있다
전자폐기물이 발생하지 않는 안전한 전자제품을 구현할 수 있을까?
국제공동연구진은 갑오징어에서 추출한 미래 전자 소재로 주목받는 세피아 멜라닌으로 만든 친환경 필름이 85일 만에 약 97% 생분해됨을 밝혀 지속가능한 친환경 전자제품의 새로운 가능성을 열어 화제다.
우리 대학 건설및환경공학과 명재욱 교수 연구팀이 몬트리올 공과대학 클라라 산타토(Clara Santato) 교수 연구팀과 국제 공동연구를 통해 완전히 생분해되는 세피아 멜라닌 기반 전기 활성 필름을 개발했다고 25일 밝혔다.
해마다 전자제품에 대한 수요가 급격하게 증가함에 따라 매년 약 6천만 톤에 이르는 전자폐기물이 발생하고 있다. 전자폐기물은 자연에서 쉽게 분해되지 않고 납(Pb), 카드뮴(Cd)과 같은 중금속이나 폴리염화비닐(PCB) 등 유해 화학물질을 자연에 유출해 생태계를 오염시킬 수 있다.
한편 생분해성 *유기전자소재는 기존 전자제품에 대한 패러다임을 전환할 수 있는 새로운 소재로 떠오르고 있다. 특히 갑오징어에서 추출할 수 있는 세피아 멜라닌은 생분해성, 저독성으로 지속가능한 미래 전자 소재로 주목받고 있다.
*유기전자소재(organic electronic material): 멜라닌, 타닌, 이모딘, 리그닌, 도파민 등 화학 구조상 전자공액계(electron conjugation)를 특징으로 하는 물질들을 뜻한다.
연구팀은 완전한 분해가 가능한 전기 활성 필름을 구현하기 위해 천연 바이오 소재인 세피아 멜라닌-셸락 잉크 복합체를 플렉소그래피 인쇄 기술을 활용해 은 전극 패턴의 종이 위에 인쇄했다.
인쇄된 필름이 이산화탄소(CO2)로 전환되는 정도(광물화도)를 기반으로 퇴비화 조건에서 생분해 거동을 분석한 결과, 85일 만에 약 97% 생분해됨을 연구팀은 확인했다. 인쇄 필름은 육안으로 봤을 때 20일 이내에 완전히 분해됐으며, 주사전자 현미경 분석을 통해 박테리아가 인쇄 필름의 생분해에 관여하여 퇴비 미생물 군집이 표면에 형성됨을 관찰했다.
한편, 인쇄 필름의 생분해 산물이 생태독성을 띠는지 조사하기 위해 두 가지 식물 쥐보리(Lolium multiflorum)와 메리골드(Tagetes erecta)를 대상으로 발아 실험을 진행한 결과, 인쇄 필름과 그 개별 구성 성분(세피아 멜라닌, 셸락, 셀룰로오스 등)은 식물에 대한 독성이 미미한 것으로 나타났다.
전기적 특성을 분석한 결과 세피아 멜라닌-셸락 인쇄 필름은 10-4 S/cm의 전기전도도를 나타냈다. 해당 전기전도도는 일반 금속이나 고성능 전자 재료에 비해 낮지만, 생분해성 및 친환경 특성 덕분에 환경 센서, 생체 디바이스, 일회용 전자제품 등 특정 응용 분야에서 경쟁력 있는 대안이 될 수 있다.
이번 국제 공동 연구를 이끈 건설및환경공학과 명재욱 교수는 “세피아 멜라닌, 셸락과 같은 널리 쓰이지 않는 바이오 기반 물질을 활용해 완전히 생분해되는 전기활성 필름을 구현한 최초 사례이며, 후속 연구를 통해 지속가능한 전자 디바이스 구현을 위한 여러 대안을 제시할 계획”이라고 밝혔다.
건설및환경공학과 최신형 박사과정과 몬트리올 공과대학 앤써니 카뮈(Anthony Camus) 박사과정이 공동 제1 저자로 참여한 이번 연구는 지난 8월 29일 국제 학술지 Communications Materials에 출판됐다.
※ 논문명: Electrical response and biodegradation of Sepia melanin-shellac films printed on paper
(저자 정보 : Anthony Camus*, 최신형*(공동 제1 저자*), Camille Bour-Cardinal1(몬트리올 공과대), Joaquin Isasmendi(몬트리올 공과대학), 조용준(KAIST), 김영주(KAIST), Cristian Vlad Irimia(요한케플러대), Cigdem Yumusak(요한케플러대), Mihai Irimia-Vladu(요한케플러대), Denis Rho(캐나다국립연구위원회)**, 명재욱(KAIST)**, Clara Santato(몬트리올 공과대)** (공동 교신저자**), 총 12명)
한편, 이번 연구는 KAIST 공과대학 석·박사 모험연구 및 창의도전사업(C2연구), 한국연구재단 과학기술국제화사업-한국 이공계 대학원생 캐나다 연수 프로그램 사업 등의 지원으로 수행됐다.
2024.09.28 조회수 6104
이제 전자제품도 완전히 생분해될 수 있다
전자폐기물이 발생하지 않는 안전한 전자제품을 구현할 수 있을까?
국제공동연구진은 갑오징어에서 추출한 미래 전자 소재로 주목받는 세피아 멜라닌으로 만든 친환경 필름이 85일 만에 약 97% 생분해됨을 밝혀 지속가능한 친환경 전자제품의 새로운 가능성을 열어 화제다.
우리 대학 건설및환경공학과 명재욱 교수 연구팀이 몬트리올 공과대학 클라라 산타토(Clara Santato) 교수 연구팀과 국제 공동연구를 통해 완전히 생분해되는 세피아 멜라닌 기반 전기 활성 필름을 개발했다고 25일 밝혔다.
해마다 전자제품에 대한 수요가 급격하게 증가함에 따라 매년 약 6천만 톤에 이르는 전자폐기물이 발생하고 있다. 전자폐기물은 자연에서 쉽게 분해되지 않고 납(Pb), 카드뮴(Cd)과 같은 중금속이나 폴리염화비닐(PCB) 등 유해 화학물질을 자연에 유출해 생태계를 오염시킬 수 있다.
한편 생분해성 *유기전자소재는 기존 전자제품에 대한 패러다임을 전환할 수 있는 새로운 소재로 떠오르고 있다. 특히 갑오징어에서 추출할 수 있는 세피아 멜라닌은 생분해성, 저독성으로 지속가능한 미래 전자 소재로 주목받고 있다.
*유기전자소재(organic electronic material): 멜라닌, 타닌, 이모딘, 리그닌, 도파민 등 화학 구조상 전자공액계(electron conjugation)를 특징으로 하는 물질들을 뜻한다.
연구팀은 완전한 분해가 가능한 전기 활성 필름을 구현하기 위해 천연 바이오 소재인 세피아 멜라닌-셸락 잉크 복합체를 플렉소그래피 인쇄 기술을 활용해 은 전극 패턴의 종이 위에 인쇄했다.
인쇄된 필름이 이산화탄소(CO2)로 전환되는 정도(광물화도)를 기반으로 퇴비화 조건에서 생분해 거동을 분석한 결과, 85일 만에 약 97% 생분해됨을 연구팀은 확인했다. 인쇄 필름은 육안으로 봤을 때 20일 이내에 완전히 분해됐으며, 주사전자 현미경 분석을 통해 박테리아가 인쇄 필름의 생분해에 관여하여 퇴비 미생물 군집이 표면에 형성됨을 관찰했다.
한편, 인쇄 필름의 생분해 산물이 생태독성을 띠는지 조사하기 위해 두 가지 식물 쥐보리(Lolium multiflorum)와 메리골드(Tagetes erecta)를 대상으로 발아 실험을 진행한 결과, 인쇄 필름과 그 개별 구성 성분(세피아 멜라닌, 셸락, 셀룰로오스 등)은 식물에 대한 독성이 미미한 것으로 나타났다.
전기적 특성을 분석한 결과 세피아 멜라닌-셸락 인쇄 필름은 10-4 S/cm의 전기전도도를 나타냈다. 해당 전기전도도는 일반 금속이나 고성능 전자 재료에 비해 낮지만, 생분해성 및 친환경 특성 덕분에 환경 센서, 생체 디바이스, 일회용 전자제품 등 특정 응용 분야에서 경쟁력 있는 대안이 될 수 있다.
이번 국제 공동 연구를 이끈 건설및환경공학과 명재욱 교수는 “세피아 멜라닌, 셸락과 같은 널리 쓰이지 않는 바이오 기반 물질을 활용해 완전히 생분해되는 전기활성 필름을 구현한 최초 사례이며, 후속 연구를 통해 지속가능한 전자 디바이스 구현을 위한 여러 대안을 제시할 계획”이라고 밝혔다.
건설및환경공학과 최신형 박사과정과 몬트리올 공과대학 앤써니 카뮈(Anthony Camus) 박사과정이 공동 제1 저자로 참여한 이번 연구는 지난 8월 29일 국제 학술지 Communications Materials에 출판됐다.
※ 논문명: Electrical response and biodegradation of Sepia melanin-shellac films printed on paper
(저자 정보 : Anthony Camus*, 최신형*(공동 제1 저자*), Camille Bour-Cardinal1(몬트리올 공과대), Joaquin Isasmendi(몬트리올 공과대학), 조용준(KAIST), 김영주(KAIST), Cristian Vlad Irimia(요한케플러대), Cigdem Yumusak(요한케플러대), Mihai Irimia-Vladu(요한케플러대), Denis Rho(캐나다국립연구위원회)**, 명재욱(KAIST)**, Clara Santato(몬트리올 공과대)** (공동 교신저자**), 총 12명)
한편, 이번 연구는 KAIST 공과대학 석·박사 모험연구 및 창의도전사업(C2연구), 한국연구재단 과학기술국제화사업-한국 이공계 대학원생 캐나다 연수 프로그램 사업 등의 지원으로 수행됐다.
2024.09.28 조회수 6104 대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19 조회수 12760
대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19 조회수 12760 인공지능으로 자폐 증상과 심각도 예측한다
뇌영상 빅데이터를 활용한 딥러닝(Deep Learning)으로 자폐 스펙트럼 장애(ASD)의 증상과 심각도를 예측할 수 있다는 것이 확인됐다. 이번 연구에 따라 ASD 환자들 진단과 예후에 따른 맞춤형 치료가 가능할 것으로 기대되고 있다.
우리 대학 바이오및뇌공학과 이상완 교수(신경과학-인공지능 융합연구센터장)와 세브란스병원 소아정신과 천근아 교수(연세자폐증연구소장) 연구팀은 ASD의 뇌영상 빅데이터를 활용해 자폐의 증상과 예후를 예측할 수 있다고 28일 밝혔다.
이번 연구결과는 ASD 아동들의 뇌영상 빅데이터를 이용한 국내 최초의 AI연구성과로, 국제전기전자기술자협회(IEEE)에서 발행하는 저널인 IEEE 엑세스(Access) 온라인판에 게재됐다.
ASD는 뇌 발달 장애의 하나로 사회적 의사소통의 결함과 제한된 관심사 및 반복적인 행동이 대표적인 특징이다. 2020년도 미국 CDC(미국질병통제예방센터)의 통계자료에 따르면 ASD의 유병률은 54명당 1명으로 매년 증가하는 추세이다. 국내 유병률도 약 2% 내외이다.
ASD는 아동 행동 관찰 및 상담과 정신질환 진단분류매뉴얼(DSM-5)에 근거해 진단한다. 하지만 환자 개인차가 심해 자폐에 대한 정확한 진단이 어렵고 예후를 예측하기도 힘들다.
이상완·천근아 교수 연구팀은 세브란스병원에 구축된 3~11세 ASD 환자 84건의 MRI 빅데이터와 국제컨소시엄으로 구축된 1000여 건의 자폐증 환자 MRI 빅데이터를 활용해 MRI 영상으로 자폐의 진단과 예후를 예측할 수 있는 딥러닝 모델을 개발했다.
연구팀은 공간 변경 네트워크(Spartial Transformer Network, STN)와 3D 컨볼루션 신경망(convolutional neural network, CNN)을 활용한 모델을 구축하고, MRI 빅데이터를 학습시켰다.
이렇게 구축된 모델에 클래스 활성화 매핑(class activation mapping) 기법을 적용해 형태학적인 특징을 추출하고 이를 뇌영상에 투영시키는 방식으로 분석했다. 더 나아가 인자들간의 관계 분석을 위해 강화학습 모델의 일종인 회귀형 주의집중 모델(recurrent attention model)을 학습시켰다.
분석결과 뇌의 기저핵을 포함한 피질 하 구조가 자폐 심각도와 관련이 있음을 확인했다.
이상완 교수는 “진료 현장에서 자폐를 진단하고 연구하는데 구조적 연관 후보를 제공할 수 있게 됐다”며 “이번 연구결과로 자폐 진단에서뿐만 아니라 앞으로 의사나 관련 전문가들이 인공지능을 활용해 복잡한 질병을 이해하고 더 많이 활용할 수 있게 될 것”이라고 설명했다.
천근아 교수도 “자폐스펙트럼장애를 진단함에 있어 뇌 영상 자료는 아직까지 의사들 사이에서 활용가치가 높지 않다는 인식이 보편적인데 이번 연구를 통해 자폐의 하위 증상과 심각도 사이에 뇌영상에서 차이가 있다는 것을 확인했다”며 “이번 연구는 다양한 임상표현형과 심각도를 지닌 자폐증 환자들에게 개별 맞춤 진단과 예후를 예측하는데 의미를 가진다”고 말했다. [보도자료 출처: 세브란스병원 홍보팀]
2020.08.28 조회수 26700
인공지능으로 자폐 증상과 심각도 예측한다
뇌영상 빅데이터를 활용한 딥러닝(Deep Learning)으로 자폐 스펙트럼 장애(ASD)의 증상과 심각도를 예측할 수 있다는 것이 확인됐다. 이번 연구에 따라 ASD 환자들 진단과 예후에 따른 맞춤형 치료가 가능할 것으로 기대되고 있다.
우리 대학 바이오및뇌공학과 이상완 교수(신경과학-인공지능 융합연구센터장)와 세브란스병원 소아정신과 천근아 교수(연세자폐증연구소장) 연구팀은 ASD의 뇌영상 빅데이터를 활용해 자폐의 증상과 예후를 예측할 수 있다고 28일 밝혔다.
이번 연구결과는 ASD 아동들의 뇌영상 빅데이터를 이용한 국내 최초의 AI연구성과로, 국제전기전자기술자협회(IEEE)에서 발행하는 저널인 IEEE 엑세스(Access) 온라인판에 게재됐다.
ASD는 뇌 발달 장애의 하나로 사회적 의사소통의 결함과 제한된 관심사 및 반복적인 행동이 대표적인 특징이다. 2020년도 미국 CDC(미국질병통제예방센터)의 통계자료에 따르면 ASD의 유병률은 54명당 1명으로 매년 증가하는 추세이다. 국내 유병률도 약 2% 내외이다.
ASD는 아동 행동 관찰 및 상담과 정신질환 진단분류매뉴얼(DSM-5)에 근거해 진단한다. 하지만 환자 개인차가 심해 자폐에 대한 정확한 진단이 어렵고 예후를 예측하기도 힘들다.
이상완·천근아 교수 연구팀은 세브란스병원에 구축된 3~11세 ASD 환자 84건의 MRI 빅데이터와 국제컨소시엄으로 구축된 1000여 건의 자폐증 환자 MRI 빅데이터를 활용해 MRI 영상으로 자폐의 진단과 예후를 예측할 수 있는 딥러닝 모델을 개발했다.
연구팀은 공간 변경 네트워크(Spartial Transformer Network, STN)와 3D 컨볼루션 신경망(convolutional neural network, CNN)을 활용한 모델을 구축하고, MRI 빅데이터를 학습시켰다.
이렇게 구축된 모델에 클래스 활성화 매핑(class activation mapping) 기법을 적용해 형태학적인 특징을 추출하고 이를 뇌영상에 투영시키는 방식으로 분석했다. 더 나아가 인자들간의 관계 분석을 위해 강화학습 모델의 일종인 회귀형 주의집중 모델(recurrent attention model)을 학습시켰다.
분석결과 뇌의 기저핵을 포함한 피질 하 구조가 자폐 심각도와 관련이 있음을 확인했다.
이상완 교수는 “진료 현장에서 자폐를 진단하고 연구하는데 구조적 연관 후보를 제공할 수 있게 됐다”며 “이번 연구결과로 자폐 진단에서뿐만 아니라 앞으로 의사나 관련 전문가들이 인공지능을 활용해 복잡한 질병을 이해하고 더 많이 활용할 수 있게 될 것”이라고 설명했다.
천근아 교수도 “자폐스펙트럼장애를 진단함에 있어 뇌 영상 자료는 아직까지 의사들 사이에서 활용가치가 높지 않다는 인식이 보편적인데 이번 연구를 통해 자폐의 하위 증상과 심각도 사이에 뇌영상에서 차이가 있다는 것을 확인했다”며 “이번 연구는 다양한 임상표현형과 심각도를 지닌 자폐증 환자들에게 개별 맞춤 진단과 예후를 예측하는데 의미를 가진다”고 말했다. [보도자료 출처: 세브란스병원 홍보팀]
2020.08.28 조회수 26700 자폐증에 관여하는 새로운 유전자 및 발병원인 첫 발견
김은준 교수
- 세계 최고 Nature지 발표,“자폐증의 유전요인과 새로운 치료법 제시”-
국내 연구진이 자폐증의 유전적 요인과 발병원인을 규명하고, 약물 부작용도 줄일 수 있는 새로운 자폐 치료법을 제시하였다.
서울대 강봉균 교수(50세), 연세대 이민구 교수(47세) 및 KAIST 김은준 교수(47세)가 주도하고, 원혜정, 이혜련, 지헌영, 마원, 김재익 박사(이상 제1저자)와 KAIST 김대수 교수 및 경북대 배용철, 이경민 교수 연구팀이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 리더연구자지원사업(창의적연구)과 선도연구센터지원사업(SRC)의 지원으로 수행되었다.
연구결과는 세계 최고 권위의 과학전문지인 ‘네이처(Nature)’지 6월 14일자에 게재되었고, 연구의 중요성을 인정받아 ‘Nature Reviews Drug Discovery’ 7월호에도 소개될 예정이다.
(논문명 : Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function)
연구팀은 시냅스 단백질을 만드는 유전자(생크2, Shank2)가 결핍되면 자폐와 비슷한 증상이 나타난다는 사실을 동물실험(생쥐)을 통해 발견하였다. 이것은 생크2 유전자의 결손이 자폐와 관련된다는 최근 임상결과와 함께, 생크2 유전자의 결손이 자폐를 유도한다는 직접적인 증거가 되어 의미가 크다.
자폐증은 △사회성 결핍 △반복행동 △정신지체 △불안 △과잉행동 등을 동반하는 뇌 발달 장애로, 전 세계 인구의 1~2%인 약 1억명이 증상을 보이는 심각한 뇌 질환이다. 특히 최근 연구결과(미국 워싱턴대)에 따르면, 자폐계 질환을 앓는 젊은 성인 3명 중 1명이 직장생활에 적응하지 못하거나 대학에 진학하지 못하는 등 다른 장애보다 훨씬 위중한 것으로 알려졌다. 그러나 지금까지 이를 효과적으로 치료할 수 있는 약물이 개발되지 못했고, 현재 반복행동만을 경감시키는 수준에 머무르고 있다.
연구팀은 생크2가 결손된 생쥐에서 사회성 결핍, 인지학습기능 저하, 반복행동 및 과잉행동과 같은 자폐와 비슷한 증상들이 나타난 것을 확인하였다. 또한 연구팀은 생크2가 결손된 생쥐는 NMDA(N-메칠 D-아스파르트산염) 수용체에 의한 신경전달이 감소하였고, 해마*에서의 시냅스 가소성** 등도 손상되었음을 관찰하였다.
*) 해마(Hippocampus) : 대뇌의 양쪽 측두엽에 존재. 일화, 의미 기억 등 인지기능 담당
**) 가소성(plasticity) : 기억, 학습 등 뇌 기능의 유연한 적응능력으로, 비교적 짧은 기간 내에 가해진 자극으로 뇌에 장기적인 변화가 생겨, 자극이 제거된 후에도 그 변화가 지속되는 것
특히 연구팀은 특정 수용체(mGluR5, 대사성 글루타민산염 수용체5)를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 것이 기존의 NMDA 수용체를 직접 자극하는 것보다 사회성 행동을 완전히 회복시킨다는 사실도 확인하였다. 이것은 NMDA 수용체를 직접 자극하기 위해 사용하는 약물의 부작용을 줄일 수 있는 새로운 자폐증 치료법으로 평가된다.
연구팀은 NMDA 수용체의 기능을 직접적으로 회복시키는 약물을 사용하면, 생크2가 결손된 생쥐에서 나타나는 NMDA 수용체 신경전달 이상과 사회성 결핍이 부분적으로(약 50%) 회복된다는 사실을 관찰하였다.
또한 연구팀은 mGluR5 수용체를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 약물(CDPPB)을 사용하면, 생크2가 결손된 생쥐의 해마에서의 시냅스 가소성 손상이 회복되고, NMDA 수용체에 의한 신경전달 등도 정상화되며, 사회성 결핍도 NMDA 수용체에 직접 작용하는 약물보다 더욱 효과적으로 회복되는 사실을 발견하였다.
강봉균 교수는 “생크2 유전자 결손으로 인한 NMDA 수용체의 기능 저하가 자폐증을 일으키는 새로운 원인임을 밝힌 의미 있는 연구”라고 연구의의를 밝혔다.
또한 이민구 교수는 “신경조직에서 생크2 유전자의 생리적 역할을 새롭게 규명한 연구로서, 국내 각 분야의 전문가들이 협력하여 우수한 성과를 거둔 대표적인 사례가 될 것”이라고 연구결과를 평가하였다.
아울러 김은준 교수는 "반복행동뿐만 아니라 자폐증의 주요한 증상인 사회성 결핍도 약물을 통해 충분히 개선할 수 있다는 사실을 새롭게 증명한 연구로, 자폐 치료의 새로운 가능성을 열었다”고 밝혔다.
2012.06.14 조회수 16190
자폐증에 관여하는 새로운 유전자 및 발병원인 첫 발견
김은준 교수
- 세계 최고 Nature지 발표,“자폐증의 유전요인과 새로운 치료법 제시”-
국내 연구진이 자폐증의 유전적 요인과 발병원인을 규명하고, 약물 부작용도 줄일 수 있는 새로운 자폐 치료법을 제시하였다.
서울대 강봉균 교수(50세), 연세대 이민구 교수(47세) 및 KAIST 김은준 교수(47세)가 주도하고, 원혜정, 이혜련, 지헌영, 마원, 김재익 박사(이상 제1저자)와 KAIST 김대수 교수 및 경북대 배용철, 이경민 교수 연구팀이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 리더연구자지원사업(창의적연구)과 선도연구센터지원사업(SRC)의 지원으로 수행되었다.
연구결과는 세계 최고 권위의 과학전문지인 ‘네이처(Nature)’지 6월 14일자에 게재되었고, 연구의 중요성을 인정받아 ‘Nature Reviews Drug Discovery’ 7월호에도 소개될 예정이다.
(논문명 : Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function)
연구팀은 시냅스 단백질을 만드는 유전자(생크2, Shank2)가 결핍되면 자폐와 비슷한 증상이 나타난다는 사실을 동물실험(생쥐)을 통해 발견하였다. 이것은 생크2 유전자의 결손이 자폐와 관련된다는 최근 임상결과와 함께, 생크2 유전자의 결손이 자폐를 유도한다는 직접적인 증거가 되어 의미가 크다.
자폐증은 △사회성 결핍 △반복행동 △정신지체 △불안 △과잉행동 등을 동반하는 뇌 발달 장애로, 전 세계 인구의 1~2%인 약 1억명이 증상을 보이는 심각한 뇌 질환이다. 특히 최근 연구결과(미국 워싱턴대)에 따르면, 자폐계 질환을 앓는 젊은 성인 3명 중 1명이 직장생활에 적응하지 못하거나 대학에 진학하지 못하는 등 다른 장애보다 훨씬 위중한 것으로 알려졌다. 그러나 지금까지 이를 효과적으로 치료할 수 있는 약물이 개발되지 못했고, 현재 반복행동만을 경감시키는 수준에 머무르고 있다.
연구팀은 생크2가 결손된 생쥐에서 사회성 결핍, 인지학습기능 저하, 반복행동 및 과잉행동과 같은 자폐와 비슷한 증상들이 나타난 것을 확인하였다. 또한 연구팀은 생크2가 결손된 생쥐는 NMDA(N-메칠 D-아스파르트산염) 수용체에 의한 신경전달이 감소하였고, 해마*에서의 시냅스 가소성** 등도 손상되었음을 관찰하였다.
*) 해마(Hippocampus) : 대뇌의 양쪽 측두엽에 존재. 일화, 의미 기억 등 인지기능 담당
**) 가소성(plasticity) : 기억, 학습 등 뇌 기능의 유연한 적응능력으로, 비교적 짧은 기간 내에 가해진 자극으로 뇌에 장기적인 변화가 생겨, 자극이 제거된 후에도 그 변화가 지속되는 것
특히 연구팀은 특정 수용체(mGluR5, 대사성 글루타민산염 수용체5)를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 것이 기존의 NMDA 수용체를 직접 자극하는 것보다 사회성 행동을 완전히 회복시킨다는 사실도 확인하였다. 이것은 NMDA 수용체를 직접 자극하기 위해 사용하는 약물의 부작용을 줄일 수 있는 새로운 자폐증 치료법으로 평가된다.
연구팀은 NMDA 수용체의 기능을 직접적으로 회복시키는 약물을 사용하면, 생크2가 결손된 생쥐에서 나타나는 NMDA 수용체 신경전달 이상과 사회성 결핍이 부분적으로(약 50%) 회복된다는 사실을 관찰하였다.
또한 연구팀은 mGluR5 수용체를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 약물(CDPPB)을 사용하면, 생크2가 결손된 생쥐의 해마에서의 시냅스 가소성 손상이 회복되고, NMDA 수용체에 의한 신경전달 등도 정상화되며, 사회성 결핍도 NMDA 수용체에 직접 작용하는 약물보다 더욱 효과적으로 회복되는 사실을 발견하였다.
강봉균 교수는 “생크2 유전자 결손으로 인한 NMDA 수용체의 기능 저하가 자폐증을 일으키는 새로운 원인임을 밝힌 의미 있는 연구”라고 연구의의를 밝혔다.
또한 이민구 교수는 “신경조직에서 생크2 유전자의 생리적 역할을 새롭게 규명한 연구로서, 국내 각 분야의 전문가들이 협력하여 우수한 성과를 거둔 대표적인 사례가 될 것”이라고 연구결과를 평가하였다.
아울러 김은준 교수는 "반복행동뿐만 아니라 자폐증의 주요한 증상인 사회성 결핍도 약물을 통해 충분히 개선할 수 있다는 사실을 새롭게 증명한 연구로, 자폐 치료의 새로운 가능성을 열었다”고 밝혔다.
2012.06.14 조회수 16190 김은준교수팀, 시냅스 생성 단백질 발견
- 흥분성 시냅스 생성 촉진하는 새로운 단백질‘엔지엘’발견
- 정신분열증을 비롯한 다양한 뇌질환 발병 원리 추정 가능
- 네이처 뉴로사이언스誌 9월호 게재
사람의 뇌에서 시냅스의 생성을 촉진하는 새로운 단백질이 국내 연구진에 의해 발견됐다.
KAIST(총장 서남표) 생명과학과 김은준(金恩俊, 42 / 시냅스생성 창의연구단 단장) 교수팀이 ‘엔지엘(NGL)’ 단백질이 흥분성 시냅스의 생성에 관여한다는 새로운 사실을 발견, 오는 18일 발표되는 신경과학 권위지인 ‘네이처 뉴로사이언스誌(Nature Neuroscience)" 9월호에 게재된다고 밝혔다.
金 교수팀은 後시냅스에 위치한 ‘엔지엘’이란 막단백질이 前시냅스의 네트린지(netrin-G)라는 다른 막단백질과 연결되면서 가교 역할을 하여 새로운 시냅스 생성을 촉진하는 것을 발견했다.
‘엔지엘’은 뉴로리긴(neuoroligin)에 이어 세계에서 두 번째로 새롭게 발견된 시냅스 가교 단백질이다. 이 새로운 단백질의 발견으로 시냅스 생성 원리와 다양한 뇌질환 발병 원인을 추정할 수 있게 되었다.
우리 뇌는 약 1000억개 이상의 신경세포와 각 세포당 1만 여개의 시냅스로 신경회로망을 구성하고 있다. 시냅스는 신경세포 사이에 신경전달이 일어나는 장소다. 시냅스의 생성은 신경회로의 생성으로 연결되고, 신경회로는 정상적인 뇌발달이나 뇌기능뿐만 아니라 다양한 뇌질환과도 관련이 깊다.
金 교수는 “엔지엘과 연결되어 있는 네트린지(netrin-G)가 정신분열증 (schizophrenia)과 관련이 있고, 엔지엘과 비슷한 기능을 가진 다른 시냅스 가교 단백질인 뉴로리긴이 정신지체(mental retardation) 및 자폐증(autism)과 관련이 깊은 만큼, 엔지엘도 정신분열증을 비롯한 다양한 뇌질환과 관련이 있을 것으로 보인다"라고 말했다.
<첨부사진 설명>
■ 사진 1: 엔지엘의 시냅스 생성 능력 확인 실험 1
표면에 엔지엘을 발현하고 있는 일반세포(녹색)와 신경세포를 섞어 준다. 축색돌기(axon)가 약 10시 방향에서 가운데 위치해 있는 엔지엘(일반세포)쪽으로 뻗어 나오다가 엔지엘을 만나게 되는데, 이 때 엔지엘은 접촉하는 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 前시냅스의 형성 여부는 시냅신(Synapsin)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
- 그림a-b : 엔지엘에 의한 시냅스 형성
- 그림c-d : 시냅스 생성능력이 소멸된 변형 엔지엘은 시냅스 생성 못함
■ 사진 2: 엔지엘의 시냅스 생성 능력 확인 실험 2
표면에 엔지엘을 코팅시킨 구슬을 신경세포 위에 뿌려주면 구슬이 신경세포의 축색돌기와 접촉하게 된다(구슬들은 가운데 패널의 위상차 이미지에서 명확히 보임). 이때 엔지엘은 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 전시냅스의 형성 여부는 시냅토파이진(SynPhy; a 패널) 또는 비글룻(VGlut1; b패널)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
2006.09.19 조회수 19309
김은준교수팀, 시냅스 생성 단백질 발견
- 흥분성 시냅스 생성 촉진하는 새로운 단백질‘엔지엘’발견
- 정신분열증을 비롯한 다양한 뇌질환 발병 원리 추정 가능
- 네이처 뉴로사이언스誌 9월호 게재
사람의 뇌에서 시냅스의 생성을 촉진하는 새로운 단백질이 국내 연구진에 의해 발견됐다.
KAIST(총장 서남표) 생명과학과 김은준(金恩俊, 42 / 시냅스생성 창의연구단 단장) 교수팀이 ‘엔지엘(NGL)’ 단백질이 흥분성 시냅스의 생성에 관여한다는 새로운 사실을 발견, 오는 18일 발표되는 신경과학 권위지인 ‘네이처 뉴로사이언스誌(Nature Neuroscience)" 9월호에 게재된다고 밝혔다.
金 교수팀은 後시냅스에 위치한 ‘엔지엘’이란 막단백질이 前시냅스의 네트린지(netrin-G)라는 다른 막단백질과 연결되면서 가교 역할을 하여 새로운 시냅스 생성을 촉진하는 것을 발견했다.
‘엔지엘’은 뉴로리긴(neuoroligin)에 이어 세계에서 두 번째로 새롭게 발견된 시냅스 가교 단백질이다. 이 새로운 단백질의 발견으로 시냅스 생성 원리와 다양한 뇌질환 발병 원인을 추정할 수 있게 되었다.
우리 뇌는 약 1000억개 이상의 신경세포와 각 세포당 1만 여개의 시냅스로 신경회로망을 구성하고 있다. 시냅스는 신경세포 사이에 신경전달이 일어나는 장소다. 시냅스의 생성은 신경회로의 생성으로 연결되고, 신경회로는 정상적인 뇌발달이나 뇌기능뿐만 아니라 다양한 뇌질환과도 관련이 깊다.
金 교수는 “엔지엘과 연결되어 있는 네트린지(netrin-G)가 정신분열증 (schizophrenia)과 관련이 있고, 엔지엘과 비슷한 기능을 가진 다른 시냅스 가교 단백질인 뉴로리긴이 정신지체(mental retardation) 및 자폐증(autism)과 관련이 깊은 만큼, 엔지엘도 정신분열증을 비롯한 다양한 뇌질환과 관련이 있을 것으로 보인다"라고 말했다.
<첨부사진 설명>
■ 사진 1: 엔지엘의 시냅스 생성 능력 확인 실험 1
표면에 엔지엘을 발현하고 있는 일반세포(녹색)와 신경세포를 섞어 준다. 축색돌기(axon)가 약 10시 방향에서 가운데 위치해 있는 엔지엘(일반세포)쪽으로 뻗어 나오다가 엔지엘을 만나게 되는데, 이 때 엔지엘은 접촉하는 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 前시냅스의 형성 여부는 시냅신(Synapsin)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
- 그림a-b : 엔지엘에 의한 시냅스 형성
- 그림c-d : 시냅스 생성능력이 소멸된 변형 엔지엘은 시냅스 생성 못함
■ 사진 2: 엔지엘의 시냅스 생성 능력 확인 실험 2
표면에 엔지엘을 코팅시킨 구슬을 신경세포 위에 뿌려주면 구슬이 신경세포의 축색돌기와 접촉하게 된다(구슬들은 가운데 패널의 위상차 이미지에서 명확히 보임). 이때 엔지엘은 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 전시냅스의 형성 여부는 시냅토파이진(SynPhy; a 패널) 또는 비글룻(VGlut1; b패널)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
2006.09.19 조회수 19309