%ED%98%B8%EB%A5%B4%EB%AA%AC
-
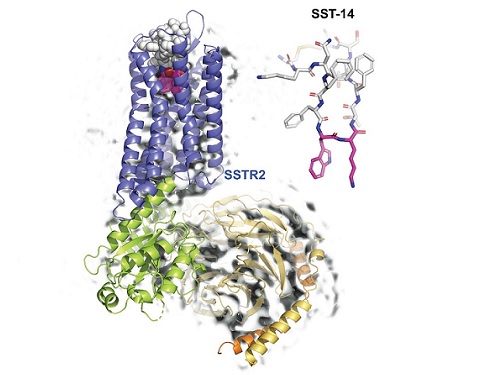 호르몬 조절 수용체 구조와 작용 메커니즘 규명으로 뇌기능 향상 물질 개발 가속
우리 대학 생명과학과 송지준 교수 연구팀이 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
소마토스타틴은 성장호르몬의 분비를 억제하는 작용이 있는 호르몬으로 내장과 뇌에 관련된 호르몬이며, 호르몬 분비 조절, 세포의 증식, 뇌 신경 물질 전달에 관한 작용을 한다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `이라이프(eLife)' 에 4월 22일에 출판됐다. (논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다. 이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는, 3차원 원자구조는 알려지지 않았다.
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
연구팀은 더 나아가 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 말단비대증, 신경뇌분비 종양의 제어 및 뇌기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
한편 이번 연구는 한국연구재단 바이오-의료기술개발사업의 지원을 받아 수행됐다.
2022.05.09 조회수 9380
호르몬 조절 수용체 구조와 작용 메커니즘 규명으로 뇌기능 향상 물질 개발 가속
우리 대학 생명과학과 송지준 교수 연구팀이 초저온 전자 현미경(cryo-Electron Microscopy)을 이용해 호르몬 조절 물질인 소마토스타틴(somatostatin)과 그 수용체인 소마토스타틴 리셉터 2(Somatostatin Receptor 2, 이하 SSTR2) 복합체의 3차원 원자 해상도 구조를 규명해 호르몬 조절 메커니즘을 밝혔다고 6일 밝혔다.
소마토스타틴은 성장호르몬의 분비를 억제하는 작용이 있는 호르몬으로 내장과 뇌에 관련된 호르몬이며, 호르몬 분비 조절, 세포의 증식, 뇌 신경 물질 전달에 관한 작용을 한다.
송 교수 연구팀은 연세대학교 이원태 교수 연구팀, 피씨지-바이오텍 연구팀과의 공동연구를 통해, 소마토스타틴과 결합해 다양한 호르몬의 분비를 억제하는 SSTR2 복합체 구조를 3차원 원자 해상도로 초저온 전자현미경을 이용해 규명하고, 소마토스타틴이 SSTR2를 통해 호르몬 분비를 억제하는 메커니즘을 규명했다. 이러한 연구 결과는 호르몬 분비의 이상에서 유발되는 말단비대증, 신경 뇌분비 종양을 제어하는 방법을 개발하는데 적용될 수 있을 것으로 기대된다.
생명과학과 윤어진 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `이라이프(eLife)' 에 4월 22일에 출판됐다. (논문명 : Cryo-EM structure of the human somatostatin receptor 2 complex with its agonist somatostatin delineates the ligand binding specificity)
SSTR2은 세포막에 존재하는 막 단백질로, 세포 밖의 소마토스타틴을 신호로 인식해 세포 내로 전달하는 역할을 한다. 최근 생명과학과 이승희 교수 연구팀에서도 소마토스타틴이 인지기능 향상에 기여한다 것을 밝힌 바 있다. 이렇게 소마토스타틴의 생체 내 기능 및 질병에 역할의 중요성에도 불구하고, 소마토스타틴이 세포막에 존재하는 수용체와 결합하는 자세한 메커니즘에 대해서는 알려지지 않았고, 신약 개발에 필수적인 역할을 하는, 3차원 원자구조는 알려지지 않았다.
송지준 교수 연구팀은 소마토스타틴이 수용체인 SSTR2와 결합하는 원리를 규명하기 위해, 초저온 전자현미경을 이용해 소마토스타틴이 결합된 SSTR2 복합체의 원자 3차원 구조를 규명했다. 또한 연구팀은 소마토스타틴과 수용체가 결합한 3차원 구조를 바탕으로 소마토스타틴과 결합하는데 중요한 아미노산들을 발견하고, 이들의 기능성을 세포 내에서 확인했다.
연구팀은 더 나아가 인공지능을 이용한 구조예측 프로그램인 알파폴드(AlphaFold)를 이용해 소마토스타틴 수용체의 이성질 형태(같은 분자식을 갖는 화합물이지만 분자 구조가 다른 형태)인 SSTR1, SSTR3, SSTR4, SSTR5의 구조를 예측해 이성질 형태 각각의 소마토스타틴 결합 메커니즘을 밝혀냈다.
이번 연구 결과는 소마토스타틴 수용체의 작용 메커니즘을 이용해 말단비대증, 신경뇌분비 종양의 제어 및 뇌기능을 향상할 수 있는 물질 개발에 이용될 수 있을 것으로 기대된다.
한편 이번 연구는 한국연구재단 바이오-의료기술개발사업의 지원을 받아 수행됐다.
2022.05.09 조회수 9380 -
 서성배 교수 연구팀, 동물의 식습관을 조절하는 원리 규명해 네이처 게재
우리 대학 생명과학과 서성배 교수 연구팀이 서울대학교 생명과학부 이원재 교수 연구팀과 공동연구를 통해 체내 단백질, 필수아미노산 부족을 감지하는 장 세포와 필수아미노산을 섭취하도록 섭식행동을 조절하는 구체적인 원리를 규명했다고 7일 밝혔다. 그뿐만 아니라, 공동연구팀은 필수아미노산을 생산하는 장내미생물이 이러한 메커니즘에 어떠한 영향을 미치는 지도 규명했다.
사람이든 동물이든 수분이 부족하면 갈증을 느끼고 물을 마시고, 혈당량이 떨어지면 당을 찾아 먹는다. 필수 영양소가 부족하면 자연스럽게 이를 섭취하기 위한 행동 변화가 있다는 것은 누구나 경험적으로 쉽게 알 수 있는 사실이다. 과학자들은 수분이나 당분뿐만 아니라 필수아미노산과 같은 영양소에 대해서도 동물들이 결핍을 인지하여 항상성을 유지하는 메커니즘을 가지고 있을 것이라 오랫동안 예상해 왔지만, 그동안 이를 구체적으로 밝힌 연구는 없었다.
필수아미노산 항상성은 수분 항상성보다 복잡한 메커니즘을 가질 수밖에 없다. 장내미생물의 종류에 따라 반드시 섭취해야 하는 필수아미노산의 종류가 달라지기 때문이다. 예를 들면, 코알라의 경우 주된 먹이가 되는 나뭇잎의 섬유질을 직접 소화하지 못하고, 장내미생물이 나뭇잎을 분해하여 흡수 가능한 영양소를 만들어 내면 이를 흡수한다. 그런데 장내미생물의 종류에 따라 분해할 수 있는 나뭇잎의 종류가 달라지고, 이에 따라 코알라의 식성도 달라진다. 이는 필수아미노산과 같이 미생물을 통해 합성이 가능한 영양소의 경우, 똑같은 종의 동물들이라 해도, 동일한 필수아미노산이 부족한 상황에서 각 개체가 보유하고 있는 장내미생물의 종류에 따라 다른 식성을 보일 수 있다는 것을 의미한다.
공동연구팀은 이번 연구에서 어떤 유전자가 체내 필수아미노산 부족을 감지하는지 찾아내고, 어떤 신호를 통해 부족한 아미노산을 섭취하도록 섭식행동을 조절하는지 규명했으며, 필수아미노산을 생산하는 장내미생물이 이러한 메커니즘에 어떠한 영향을 미치는지 확인하기 위한 실험을 진행했다.
연구진은 초파리에 필수아미노산이 결핍된 먹이를 제공하거나 유전적 결핍 혹은 유전자 조작을 이용해 필수아미노산을 생산하지 못하는 장내미생물을 초파리에 도입하면, 초파리의 장 호르몬 중 하나인 CNMa 호르몬의 발현이 유도됨을 확인했다. 흥미롭게도, 이 호르몬은 그동안 장 호르몬이 발현된다고 알려진 내분비세포 (enteroendocrine cells)가 아닌 장 상피세포(enterocytes)에서 발현되는데 이는 장 상피세포가 필수아미노산 결핍을 직접 인지한다는 것을 의미한다. 또한 공동연구팀은 CNMa 호르몬이 발현되는 과정에서 기존에 세포 내 아미노산 센서로 잘 알려진 Gcn2와 Tor 분자들이 관여한다는 사실도 증명했다. CNMa 호르몬의 수용체는 두뇌와 장 신경세포(enteric neuron)에서 발현하는데 CNMa 수용체를 발현하는 신경세포가 활성화되는지 여부에 따라 필수아미노산을 섭취하려는 섭식행동이 증가하거나 감소한다.
이번 논문은 동물이 필수아미노산의 부족을 인지한 후 필수아미노산이 풍부한 음식을 섭취하는 행동을 장내미생물-장-뇌 축(microbiome-gut-brain axis)을 통해 분자적 수준에서 설명한 최초의 논문이다.
제 1저자인 우리 대학 김보람 연구원은 “이번 연구 결과는 장내미생물에서 동물의 장 그리고 뇌로 이어지는 장내미생물-장-뇌 축을 통해 아미노산 결핍이 일어난다는 사실을 처음으로 밝혔다는데 큰 의미가 있으며, 초파리뿐만 아니라, 사람을 포함한 척추동물에서도 이런 경로를 통해 장내미생물이 동물의 식성을 조절할 가능성을 제기한다. 만약 장내미생물과 동물의 식습관이 장뇌 축을 통해 조절된다면, 미생물 섭취라는 방법을 통해 현대인의 불균형한 식습관으로 인한 만성 질병을 개선할 수도 있을 것이며, 그런 점에서 이 논문의 가치를 찾을 수 있다”라고 말했다.
최근 10여 년간 탄수화물 영양소를 감지하는 체내의 센서나 센싱세포를 두뇌나 다른 기관에서 규명했고 이번 공동연구를 통해 장 세포에서 필수아미노산 결핍을 인지하는 원리를 밝힌 서성배 교수는 “여러 영양소가 미각에 의해 피상적으로 1차 감지되지만 어떻게 체내에서 인지되고 섭식행동을 유도하는 연구는 그의 중요성에 비해 아직 매우 제한적이다. 그 이유는 체내의 영양소 센서를 마우스나 복잡한 포유류에서 발견하기는 쉽지 않기에 유전자 조작이 용이한 초파리를 이용해서 영양소 센서를 초파리에서 규명한 후에 쥐나 인간에서 그의 대응체를 찾는 방법을 선택했다. 영양소 센서는 모든 개체에 중요하고 진화적으로도 보존이 돼 있을 것 같아 초파리에서 밝힌 센서들이 포유류에서도 비슷한 역할을 할 것이라고 추측된다. 영양소에는 탄수화물, 단백질, 지방 같은 거대영양소뿐 아니라 비타민, 아연, 소금 등 소량영양소가 존재하는데 그 센서들을 규명하고 섭식행동에 미치는 영향이나 대사 질환, 성인병에 관련성 연구는 더욱 증폭될 것이라 예상된다.”고 말했다.
김보람 박사가 제1 저자로 참여하고 우리 대학 서성배 교수, 서울대학교 이원재 교수가 공동교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 5월 5일 자 온라인판에 게재됐다 (논문명 : Response of the Drosophila microbiome-gut-brain axis to amino acid deficit).
2021.05.07 조회수 28587
서성배 교수 연구팀, 동물의 식습관을 조절하는 원리 규명해 네이처 게재
우리 대학 생명과학과 서성배 교수 연구팀이 서울대학교 생명과학부 이원재 교수 연구팀과 공동연구를 통해 체내 단백질, 필수아미노산 부족을 감지하는 장 세포와 필수아미노산을 섭취하도록 섭식행동을 조절하는 구체적인 원리를 규명했다고 7일 밝혔다. 그뿐만 아니라, 공동연구팀은 필수아미노산을 생산하는 장내미생물이 이러한 메커니즘에 어떠한 영향을 미치는 지도 규명했다.
사람이든 동물이든 수분이 부족하면 갈증을 느끼고 물을 마시고, 혈당량이 떨어지면 당을 찾아 먹는다. 필수 영양소가 부족하면 자연스럽게 이를 섭취하기 위한 행동 변화가 있다는 것은 누구나 경험적으로 쉽게 알 수 있는 사실이다. 과학자들은 수분이나 당분뿐만 아니라 필수아미노산과 같은 영양소에 대해서도 동물들이 결핍을 인지하여 항상성을 유지하는 메커니즘을 가지고 있을 것이라 오랫동안 예상해 왔지만, 그동안 이를 구체적으로 밝힌 연구는 없었다.
필수아미노산 항상성은 수분 항상성보다 복잡한 메커니즘을 가질 수밖에 없다. 장내미생물의 종류에 따라 반드시 섭취해야 하는 필수아미노산의 종류가 달라지기 때문이다. 예를 들면, 코알라의 경우 주된 먹이가 되는 나뭇잎의 섬유질을 직접 소화하지 못하고, 장내미생물이 나뭇잎을 분해하여 흡수 가능한 영양소를 만들어 내면 이를 흡수한다. 그런데 장내미생물의 종류에 따라 분해할 수 있는 나뭇잎의 종류가 달라지고, 이에 따라 코알라의 식성도 달라진다. 이는 필수아미노산과 같이 미생물을 통해 합성이 가능한 영양소의 경우, 똑같은 종의 동물들이라 해도, 동일한 필수아미노산이 부족한 상황에서 각 개체가 보유하고 있는 장내미생물의 종류에 따라 다른 식성을 보일 수 있다는 것을 의미한다.
공동연구팀은 이번 연구에서 어떤 유전자가 체내 필수아미노산 부족을 감지하는지 찾아내고, 어떤 신호를 통해 부족한 아미노산을 섭취하도록 섭식행동을 조절하는지 규명했으며, 필수아미노산을 생산하는 장내미생물이 이러한 메커니즘에 어떠한 영향을 미치는지 확인하기 위한 실험을 진행했다.
연구진은 초파리에 필수아미노산이 결핍된 먹이를 제공하거나 유전적 결핍 혹은 유전자 조작을 이용해 필수아미노산을 생산하지 못하는 장내미생물을 초파리에 도입하면, 초파리의 장 호르몬 중 하나인 CNMa 호르몬의 발현이 유도됨을 확인했다. 흥미롭게도, 이 호르몬은 그동안 장 호르몬이 발현된다고 알려진 내분비세포 (enteroendocrine cells)가 아닌 장 상피세포(enterocytes)에서 발현되는데 이는 장 상피세포가 필수아미노산 결핍을 직접 인지한다는 것을 의미한다. 또한 공동연구팀은 CNMa 호르몬이 발현되는 과정에서 기존에 세포 내 아미노산 센서로 잘 알려진 Gcn2와 Tor 분자들이 관여한다는 사실도 증명했다. CNMa 호르몬의 수용체는 두뇌와 장 신경세포(enteric neuron)에서 발현하는데 CNMa 수용체를 발현하는 신경세포가 활성화되는지 여부에 따라 필수아미노산을 섭취하려는 섭식행동이 증가하거나 감소한다.
이번 논문은 동물이 필수아미노산의 부족을 인지한 후 필수아미노산이 풍부한 음식을 섭취하는 행동을 장내미생물-장-뇌 축(microbiome-gut-brain axis)을 통해 분자적 수준에서 설명한 최초의 논문이다.
제 1저자인 우리 대학 김보람 연구원은 “이번 연구 결과는 장내미생물에서 동물의 장 그리고 뇌로 이어지는 장내미생물-장-뇌 축을 통해 아미노산 결핍이 일어난다는 사실을 처음으로 밝혔다는데 큰 의미가 있으며, 초파리뿐만 아니라, 사람을 포함한 척추동물에서도 이런 경로를 통해 장내미생물이 동물의 식성을 조절할 가능성을 제기한다. 만약 장내미생물과 동물의 식습관이 장뇌 축을 통해 조절된다면, 미생물 섭취라는 방법을 통해 현대인의 불균형한 식습관으로 인한 만성 질병을 개선할 수도 있을 것이며, 그런 점에서 이 논문의 가치를 찾을 수 있다”라고 말했다.
최근 10여 년간 탄수화물 영양소를 감지하는 체내의 센서나 센싱세포를 두뇌나 다른 기관에서 규명했고 이번 공동연구를 통해 장 세포에서 필수아미노산 결핍을 인지하는 원리를 밝힌 서성배 교수는 “여러 영양소가 미각에 의해 피상적으로 1차 감지되지만 어떻게 체내에서 인지되고 섭식행동을 유도하는 연구는 그의 중요성에 비해 아직 매우 제한적이다. 그 이유는 체내의 영양소 센서를 마우스나 복잡한 포유류에서 발견하기는 쉽지 않기에 유전자 조작이 용이한 초파리를 이용해서 영양소 센서를 초파리에서 규명한 후에 쥐나 인간에서 그의 대응체를 찾는 방법을 선택했다. 영양소 센서는 모든 개체에 중요하고 진화적으로도 보존이 돼 있을 것 같아 초파리에서 밝힌 센서들이 포유류에서도 비슷한 역할을 할 것이라고 추측된다. 영양소에는 탄수화물, 단백질, 지방 같은 거대영양소뿐 아니라 비타민, 아연, 소금 등 소량영양소가 존재하는데 그 센서들을 규명하고 섭식행동에 미치는 영향이나 대사 질환, 성인병에 관련성 연구는 더욱 증폭될 것이라 예상된다.”고 말했다.
김보람 박사가 제1 저자로 참여하고 우리 대학 서성배 교수, 서울대학교 이원재 교수가 공동교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 5월 5일 자 온라인판에 게재됐다 (논문명 : Response of the Drosophila microbiome-gut-brain axis to amino acid deficit).
2021.05.07 조회수 28587 -
 암 환자들이 겪는 섭식장애 원인 찾아
국내 연구진이 암 환자들이 겪는 섭식장애 원인을 규명했다. 암 환자의 섭식장애 개선을 통한 항암치료 부작용을 개선할 수 있을 것으로 기대된다.
우리 대학 의과학대학원 서재명 교수 연구팀이 한국생명공학연구원 유권 질환표적구조연구센터장과 이규선 바이오나노연구센터장 연구팀, 김송철 서울아산병원 교수 연구팀과 공동연구를 통해 암세포에서 특이적으로 분비되는 특정 단백질이 뇌신경세포의 특정 수용체를 통해 식욕조절 호르몬을 조절하는 원리를 발견했다고 18일 밝혔다. 연구결과는 국제학술지 ‘네이처 세포생물학’ 2월 9일자 온라인판에 게재됐다.
암 환자의 대표적인 합병증인 ‘암 악액질 증후군’은 심각한 섭식장애와 지속적인 체중 감소 현상을 동반한다. 암환자 생존율과 항암치료에도 좋지 않은 영향을 주는 것으로 알려져 있지만 암 환자 섭식장애 원인은 아직 규명되지 않았다.
연구팀은 초파리 암 모델과 RNA 전사체 분석으로 암 세포에서 유래된 특정 단백질(Dilp8 펩타이드)의 발현과 분비가 현저하게 증가된다는 사실을 확인했다. 특정 단백질은 뇌신경세포 수용체를 통해 식욕 조절에 관여하는 신경펩타이드 호르몬 발현을 변화시켜 초파리 모델에서 섭식장애를 유도한다는 사실을 알아냈다.
이같은 연구결과를 바탕으로 우리 대학 의과학대학원 서재명 교수 연구팀은 암을 유발한 쥐 모델에서도 특정 단백질과 상동인자인 ‘INSL3’가 현저하게 증가돼 섭식장애를 유발한다는 사실을 확인했다. 특히 암 세포에서 분비되는 단백질 INSL3을 쥐 뇌에 직접 주입할 경우 먹이 섭취량과 체중이 감소했다.
김송철 서울아산병원 연구팀은 암 악액질 증후군 발생 빈도가 가장 높은 췌장암 환자를 대상으로 임상 연관성 연구를 진행했다. 그 결과 섭식장애가 나타는 췌장암 환자에서 INSL3의 농도가 높게 나타났다.
암 세포에서 분비되는 단백질(INSL3)이 뇌신경계의 식욕 조절에 관여하는 신경세포에 작용해 암 환자의 식욕을 감소시킨 것이다. INSL3 단백질이 암 환자 섭식장애를 유발하는 중요한 신호인자라는 사실을 규명했다.
유권 생명연 책임연구원은 “초파리 실험모델에서 발견한 기초·원천 연구결과를 쥐에서 확인했고 암 환자 임상 연구에서 재확인한 연구 사례”라며 “규명된 단백질 진단과 조절로 암 환자의 섭식장애를 해결하는 치료 전략이 개발되면 암 환자의 항암치료 보조제 뿐만 아니라 일반인 대상 대사질환 치료제 개발에도 활용될 수 있을 것”이라고 밝혔다.
2021.03.02 조회수 93006
암 환자들이 겪는 섭식장애 원인 찾아
국내 연구진이 암 환자들이 겪는 섭식장애 원인을 규명했다. 암 환자의 섭식장애 개선을 통한 항암치료 부작용을 개선할 수 있을 것으로 기대된다.
우리 대학 의과학대학원 서재명 교수 연구팀이 한국생명공학연구원 유권 질환표적구조연구센터장과 이규선 바이오나노연구센터장 연구팀, 김송철 서울아산병원 교수 연구팀과 공동연구를 통해 암세포에서 특이적으로 분비되는 특정 단백질이 뇌신경세포의 특정 수용체를 통해 식욕조절 호르몬을 조절하는 원리를 발견했다고 18일 밝혔다. 연구결과는 국제학술지 ‘네이처 세포생물학’ 2월 9일자 온라인판에 게재됐다.
암 환자의 대표적인 합병증인 ‘암 악액질 증후군’은 심각한 섭식장애와 지속적인 체중 감소 현상을 동반한다. 암환자 생존율과 항암치료에도 좋지 않은 영향을 주는 것으로 알려져 있지만 암 환자 섭식장애 원인은 아직 규명되지 않았다.
연구팀은 초파리 암 모델과 RNA 전사체 분석으로 암 세포에서 유래된 특정 단백질(Dilp8 펩타이드)의 발현과 분비가 현저하게 증가된다는 사실을 확인했다. 특정 단백질은 뇌신경세포 수용체를 통해 식욕 조절에 관여하는 신경펩타이드 호르몬 발현을 변화시켜 초파리 모델에서 섭식장애를 유도한다는 사실을 알아냈다.
이같은 연구결과를 바탕으로 우리 대학 의과학대학원 서재명 교수 연구팀은 암을 유발한 쥐 모델에서도 특정 단백질과 상동인자인 ‘INSL3’가 현저하게 증가돼 섭식장애를 유발한다는 사실을 확인했다. 특히 암 세포에서 분비되는 단백질 INSL3을 쥐 뇌에 직접 주입할 경우 먹이 섭취량과 체중이 감소했다.
김송철 서울아산병원 연구팀은 암 악액질 증후군 발생 빈도가 가장 높은 췌장암 환자를 대상으로 임상 연관성 연구를 진행했다. 그 결과 섭식장애가 나타는 췌장암 환자에서 INSL3의 농도가 높게 나타났다.
암 세포에서 분비되는 단백질(INSL3)이 뇌신경계의 식욕 조절에 관여하는 신경세포에 작용해 암 환자의 식욕을 감소시킨 것이다. INSL3 단백질이 암 환자 섭식장애를 유발하는 중요한 신호인자라는 사실을 규명했다.
유권 생명연 책임연구원은 “초파리 실험모델에서 발견한 기초·원천 연구결과를 쥐에서 확인했고 암 환자 임상 연구에서 재확인한 연구 사례”라며 “규명된 단백질 진단과 조절로 암 환자의 섭식장애를 해결하는 치료 전략이 개발되면 암 환자의 항암치료 보조제 뿐만 아니라 일반인 대상 대사질환 치료제 개발에도 활용될 수 있을 것”이라고 밝혔다.
2021.03.02 조회수 93006 -
 서성배 교수, 스트레스 세포(CRF 세포) 변화 초 단위 관찰 성공
〈 서성배 교수 〉
우리 대학 생명과학과 서성배 교수 연구팀이 스트레스에 따른 몸의 반응을 조절하는 일명 부신피질 자극 호르몬 방출인자, 일명 ‘스트레스 세포 (CRF 세포)’의 새로운 역할을 밝혀냈다.
연구팀은 부정적 판단을 유도하는 외부 자극이 발생할 때 CRF 세포가 활성화되고 반대로 긍정적인 외부자극을 줄 때 억제되는 현상을 초 단위로 측정하는 데 성공함으로써 기존보다 확대된 CRF 세포의 역할이 있다는 사실을 밝혔다.
이는 동물의 본능적 감정 판단에 대한 실마리가 될 수 있는 결과로, 우울증이나 불안장애, 외상후 스트레스 장애 등의 치료제 개발에 새로운 단서를 제시할 수 있을 것으로 기대된다.
김진은 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 뉴로사이언스(Nature Neuroscience)’ 4월호 22권에 게재됐다. (논문명 : Rapid, biphasic CRF neuronal responses encode positive and negative valence)
자연환경에서 동물은 천적을 만나면 빠르게 도망가지만 좋아하는 음식을 발견하면 자연스럽게 다가가는 선천적 행동 양식을 보인다. 도망가거나 이끌리는 본능적 행동은 주어진 특정 자극을 부정적이거나 긍정적으로 판단하는 두뇌에 의해 결정된다.
시상하부-뇌하수체-부신 축(Hypothalamus-Pioituitary-Adrenal Axis, 이하 HPA Axis)은 심리적, 물리적 스트레스에 대한 우리 몸의 생리학적 반응을 조절하는 영역이다. 이 HPA Axis를 조절하는 것이 흔히 스트레스 조절인자로 알려진 ‘부신피질 자극 호르몬 방출인자(Corticotropin Releasing Factor, 이하 CRF)’이다.
시상하부 영역의 부신피질 자극 호르몬 방출인자를 방출하는 세포는 다양한 스트레스에 의해 자극돼 혈액의 코티졸 인자를 증가시키는 연쇄반응을 유도하고 동물의 생리학적 신진대사 상태를 유지하는 신경내분비 조절의 중추로, 흔히 스트레스 세포로 알려져 있다.
이 CRF 세포가 활성화되면 동물의 부정적 감정이 커진다는 가설은 예전부터 있었지만 약 30분 단위로만 측정할 수 있고, 쥐 등의 실험체를 부검해야만 호르몬의 변화를 파악할 수 있다는 한계가 있어 CRF 세포의 활성도가 스트레스성 자극, 특히 좋은 자극에 대해 초 단위로 어떻게 변화하는지 파악이 어려웠다.
연구팀은 뉴욕대와의 공동연구를 통해 생쥐 두뇌의 시상하부 영역의 CRF 세포의 활성도를 실시간으로 측정하는 칼슘이미징 기술 중 파이버포토메트리(fiberphotometry)를 도입했다. 연구팀은 부정적, 긍정적 감정의 판단을 유도하는 다양한 자극에 쥐를 노출해 세포의 반응성을 관찰했다.
그 결과 생쥐를 물에 빠뜨리거나 날아오는 새를 모방한 시각적 자극, 천적의 오줌 냄새 등 위협적 외부 자극에 의해 쥐가 도망할 때 CRF가 빠르게 활성화되는 것을 확인했다. 반대로 맛있는 음식, 암컷 쥐 등 긍정적 판단을 유도하는 자극에 노출했을 때 CRF 활성도가 억제되는 양방향성의 특징을 규명했다.
서성배 교수는 “음식 냄새와 시각적 자극에 의해 쥐들의 행동이 유도되기 전부터 CRF 세포가 감소하는 부분이 흥미롭다”라고 말하며 그 이유를 설명했다. “시상하부의 CRF 세포가 이러한 예측에 의한 기능을 보인다는 것은 그간 알려진 시상하부 영역의 세포들과는 차별성이 있는 역할이고, 쥐들이 좋은 자극에 노출 되면 CRF 세포 활성도가 감소하는 점도 혁신적인 패러다임의 전환이다”라고 말했다.
연구팀은 생명과학과 김대수 교수 연구팀과의 협력으로 빛을 이용해 특정 세포의 활성을 조절할 수 있는 광유전학을 적용했다. 이를 통해 CRF 세포를 자극해 인위적으로 특정 환경을 싫어하거나 좋아하게 만들 수 있음을 확인했다. 이 결과는 CRF 세포의 활성도가 대상에 대한 선호도 판단에 중요한 역할을 할 수 있다는 것을 증명했다.
김진은 연구원은 “시상하부에서 다양한 세포와 복잡하게 얽힌 CRF 세포의 활성도를 측정하기 위해 칼슘이미징이라는 새 기술을 도입함으로써 기존 기술적 한계를 극복했다”라며 “CRF 호르몬의 아미노산 서열이 밝혀진 이래 40여 년 동안 느린 내분비 조절 기능만으로 알고 있던 CRF의 역할에 대한 이해를 새 기술을 통해 넓혔다는 의의가 있다”라고 말했다.
이번 연구 결과는 호르몬 방출을 통해 시상하부-뇌하수체-부신 축(HPA axis)을 조절한다는 CRF의 기존 기능을 넘어, CRF 세포가 다양한 감각적 자극에 대한 긍정 또는 부정적 판단을 통해 적절한 행동 반응을 조절하는 역할을 할 수 있음을 시사한다.
서성배 교수는 “우울증, 불안증, 외상후 스트레스 장애 등의 질환이 스트레스와 관련이 높다는 사실을 밝혔다”라며 “CRF 세포 활성도를 생쥐를 통해 실시간 측정함으로써 우울증 치료제, 약물의 효과를 시험하는 데 적용할 수 있을 것이다”라고 말했다.
이번 연구는 KAIST 신임교원 정착 연구비, KAIST 석박사 모험연구 사업, 포스코 청암재단 포스코 사이언스 펠로우십의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 광유전학을 통한 시상하부 CRF 세포의 활성도 인위적 조절
그림2. 시상하부 CRF 세포의 양방향성의 활성도와 인비보 칼슘이미징모식도 (위) 시각적 위협, 공격성이 있는 쥐로부터의 위협 (나쁜 자극)과 음식, 새끼쥐 (좋은 자극)에 이의한 시상하부 CRF 세포의 활성화 혹은 억제에 대한 예시. (아래)
2019.04.18 조회수 18111
서성배 교수, 스트레스 세포(CRF 세포) 변화 초 단위 관찰 성공
〈 서성배 교수 〉
우리 대학 생명과학과 서성배 교수 연구팀이 스트레스에 따른 몸의 반응을 조절하는 일명 부신피질 자극 호르몬 방출인자, 일명 ‘스트레스 세포 (CRF 세포)’의 새로운 역할을 밝혀냈다.
연구팀은 부정적 판단을 유도하는 외부 자극이 발생할 때 CRF 세포가 활성화되고 반대로 긍정적인 외부자극을 줄 때 억제되는 현상을 초 단위로 측정하는 데 성공함으로써 기존보다 확대된 CRF 세포의 역할이 있다는 사실을 밝혔다.
이는 동물의 본능적 감정 판단에 대한 실마리가 될 수 있는 결과로, 우울증이나 불안장애, 외상후 스트레스 장애 등의 치료제 개발에 새로운 단서를 제시할 수 있을 것으로 기대된다.
김진은 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 뉴로사이언스(Nature Neuroscience)’ 4월호 22권에 게재됐다. (논문명 : Rapid, biphasic CRF neuronal responses encode positive and negative valence)
자연환경에서 동물은 천적을 만나면 빠르게 도망가지만 좋아하는 음식을 발견하면 자연스럽게 다가가는 선천적 행동 양식을 보인다. 도망가거나 이끌리는 본능적 행동은 주어진 특정 자극을 부정적이거나 긍정적으로 판단하는 두뇌에 의해 결정된다.
시상하부-뇌하수체-부신 축(Hypothalamus-Pioituitary-Adrenal Axis, 이하 HPA Axis)은 심리적, 물리적 스트레스에 대한 우리 몸의 생리학적 반응을 조절하는 영역이다. 이 HPA Axis를 조절하는 것이 흔히 스트레스 조절인자로 알려진 ‘부신피질 자극 호르몬 방출인자(Corticotropin Releasing Factor, 이하 CRF)’이다.
시상하부 영역의 부신피질 자극 호르몬 방출인자를 방출하는 세포는 다양한 스트레스에 의해 자극돼 혈액의 코티졸 인자를 증가시키는 연쇄반응을 유도하고 동물의 생리학적 신진대사 상태를 유지하는 신경내분비 조절의 중추로, 흔히 스트레스 세포로 알려져 있다.
이 CRF 세포가 활성화되면 동물의 부정적 감정이 커진다는 가설은 예전부터 있었지만 약 30분 단위로만 측정할 수 있고, 쥐 등의 실험체를 부검해야만 호르몬의 변화를 파악할 수 있다는 한계가 있어 CRF 세포의 활성도가 스트레스성 자극, 특히 좋은 자극에 대해 초 단위로 어떻게 변화하는지 파악이 어려웠다.
연구팀은 뉴욕대와의 공동연구를 통해 생쥐 두뇌의 시상하부 영역의 CRF 세포의 활성도를 실시간으로 측정하는 칼슘이미징 기술 중 파이버포토메트리(fiberphotometry)를 도입했다. 연구팀은 부정적, 긍정적 감정의 판단을 유도하는 다양한 자극에 쥐를 노출해 세포의 반응성을 관찰했다.
그 결과 생쥐를 물에 빠뜨리거나 날아오는 새를 모방한 시각적 자극, 천적의 오줌 냄새 등 위협적 외부 자극에 의해 쥐가 도망할 때 CRF가 빠르게 활성화되는 것을 확인했다. 반대로 맛있는 음식, 암컷 쥐 등 긍정적 판단을 유도하는 자극에 노출했을 때 CRF 활성도가 억제되는 양방향성의 특징을 규명했다.
서성배 교수는 “음식 냄새와 시각적 자극에 의해 쥐들의 행동이 유도되기 전부터 CRF 세포가 감소하는 부분이 흥미롭다”라고 말하며 그 이유를 설명했다. “시상하부의 CRF 세포가 이러한 예측에 의한 기능을 보인다는 것은 그간 알려진 시상하부 영역의 세포들과는 차별성이 있는 역할이고, 쥐들이 좋은 자극에 노출 되면 CRF 세포 활성도가 감소하는 점도 혁신적인 패러다임의 전환이다”라고 말했다.
연구팀은 생명과학과 김대수 교수 연구팀과의 협력으로 빛을 이용해 특정 세포의 활성을 조절할 수 있는 광유전학을 적용했다. 이를 통해 CRF 세포를 자극해 인위적으로 특정 환경을 싫어하거나 좋아하게 만들 수 있음을 확인했다. 이 결과는 CRF 세포의 활성도가 대상에 대한 선호도 판단에 중요한 역할을 할 수 있다는 것을 증명했다.
김진은 연구원은 “시상하부에서 다양한 세포와 복잡하게 얽힌 CRF 세포의 활성도를 측정하기 위해 칼슘이미징이라는 새 기술을 도입함으로써 기존 기술적 한계를 극복했다”라며 “CRF 호르몬의 아미노산 서열이 밝혀진 이래 40여 년 동안 느린 내분비 조절 기능만으로 알고 있던 CRF의 역할에 대한 이해를 새 기술을 통해 넓혔다는 의의가 있다”라고 말했다.
이번 연구 결과는 호르몬 방출을 통해 시상하부-뇌하수체-부신 축(HPA axis)을 조절한다는 CRF의 기존 기능을 넘어, CRF 세포가 다양한 감각적 자극에 대한 긍정 또는 부정적 판단을 통해 적절한 행동 반응을 조절하는 역할을 할 수 있음을 시사한다.
서성배 교수는 “우울증, 불안증, 외상후 스트레스 장애 등의 질환이 스트레스와 관련이 높다는 사실을 밝혔다”라며 “CRF 세포 활성도를 생쥐를 통해 실시간 측정함으로써 우울증 치료제, 약물의 효과를 시험하는 데 적용할 수 있을 것이다”라고 말했다.
이번 연구는 KAIST 신임교원 정착 연구비, KAIST 석박사 모험연구 사업, 포스코 청암재단 포스코 사이언스 펠로우십의 지원을 통해 수행됐다.
□ 그림 설명
그림1. 광유전학을 통한 시상하부 CRF 세포의 활성도 인위적 조절
그림2. 시상하부 CRF 세포의 양방향성의 활성도와 인비보 칼슘이미징모식도 (위) 시각적 위협, 공격성이 있는 쥐로부터의 위협 (나쁜 자극)과 음식, 새끼쥐 (좋은 자극)에 이의한 시상하부 CRF 세포의 활성화 혹은 억제에 대한 예시. (아래)
2019.04.18 조회수 18111