%EA%B8%88%EC%86%8D%EC%9D%B4%EC%98%A8
-
 알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19392
알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19392 -
 박현규 교수 DNA 활성 조절 가능한 스위치 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 스위치를 켜고 끄듯이 DNA 내부의 핵산중합효소 활성을 조절하는 기술을 개발했다.
이 기술은 수은, 은 등의 금속이온을 스위치로 사용해 DNA 압타머를 조절함으로써 DNA 압타머와 결합돼 있는 핵산중합효소의 활성을 조절하는 원리이다.
이번 연구는 영국왕립화학회가 발행하는 ‘케미컬커뮤니케이션(Chemical communications)’ 4월호에 게재됐고, 중요성을 인정받아 표지 논문으로 선정됐다.
핵산과 금속이온의 상호작용을 이용해 효소 활성을 조절하는 여러 연구들이 수행되고 있다. 하지만 이 연구들은 금속이온에 의해 반응이 진행되고 나면 다시 반응을 되돌릴 수 없어 가역적으로 시스템을 구현해야 하는 분자스위치, 논리게이트 등에 사용이 어렵다는 한계를 갖는다.
핵산중합효소는 핵산의 복제를 돕는 효소로 DNA 압타머와 결합해 있는 상태로는 별다른 역할을 수행할 수 없다. 따라서 특정 외부적 자극을 통해 DNA 압타머를 조절해 핵산중합효소를 활성화시켜야 한다.
연구팀은 문제 해결을 위해 핵산중합효소와 상호작용을 하는 DNA 압타머가 특정 금속이온에 반응하도록 염기서열을 조작했다. 그리고 수은 및 은 등의 금속이온을 도입해 핵산중합효소와 DNA 압타머의 결합을 조절함으로써 중합효소의 활성을 조절 가능하게 만들었다.
연구팀은 이 기술을 기반으로 금속이온에 의해 시스템을 조절할 수 있는 분자 수준의 스위치를 개발했다. 기존 기술의 한계였던 비가역성 문제를 해결해 핵산중합효소의 활성을 가역적으로 조절할 수 있는 것이다.
연구팀은 이를 통해 향후 DNA기반의 분자회로 및 신호전달체계의 원천기술이 될 수 있을 것으로 기대된다고 밝혔다.
박 교수는 “이번 연구에서 개발된 기술은 중합효소 외에 다양한 효소 활성의 가역적 조절에 응용될 수 있다”며 “이를 통해 다양한 분자 스위치의 개발이 가능해질 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 압타머와 금속이온의 상호작용에 의하 가역적으로 조절되는 중합효소 활성 모식도
2016.05.03 조회수 12005
박현규 교수 DNA 활성 조절 가능한 스위치 개발
〈 박 현 규 교수 〉
우리 대학 생명화학공학과 박현규 교수 연구팀이 스위치를 켜고 끄듯이 DNA 내부의 핵산중합효소 활성을 조절하는 기술을 개발했다.
이 기술은 수은, 은 등의 금속이온을 스위치로 사용해 DNA 압타머를 조절함으로써 DNA 압타머와 결합돼 있는 핵산중합효소의 활성을 조절하는 원리이다.
이번 연구는 영국왕립화학회가 발행하는 ‘케미컬커뮤니케이션(Chemical communications)’ 4월호에 게재됐고, 중요성을 인정받아 표지 논문으로 선정됐다.
핵산과 금속이온의 상호작용을 이용해 효소 활성을 조절하는 여러 연구들이 수행되고 있다. 하지만 이 연구들은 금속이온에 의해 반응이 진행되고 나면 다시 반응을 되돌릴 수 없어 가역적으로 시스템을 구현해야 하는 분자스위치, 논리게이트 등에 사용이 어렵다는 한계를 갖는다.
핵산중합효소는 핵산의 복제를 돕는 효소로 DNA 압타머와 결합해 있는 상태로는 별다른 역할을 수행할 수 없다. 따라서 특정 외부적 자극을 통해 DNA 압타머를 조절해 핵산중합효소를 활성화시켜야 한다.
연구팀은 문제 해결을 위해 핵산중합효소와 상호작용을 하는 DNA 압타머가 특정 금속이온에 반응하도록 염기서열을 조작했다. 그리고 수은 및 은 등의 금속이온을 도입해 핵산중합효소와 DNA 압타머의 결합을 조절함으로써 중합효소의 활성을 조절 가능하게 만들었다.
연구팀은 이 기술을 기반으로 금속이온에 의해 시스템을 조절할 수 있는 분자 수준의 스위치를 개발했다. 기존 기술의 한계였던 비가역성 문제를 해결해 핵산중합효소의 활성을 가역적으로 조절할 수 있는 것이다.
연구팀은 이를 통해 향후 DNA기반의 분자회로 및 신호전달체계의 원천기술이 될 수 있을 것으로 기대된다고 밝혔다.
박 교수는 “이번 연구에서 개발된 기술은 중합효소 외에 다양한 효소 활성의 가역적 조절에 응용될 수 있다”며 “이를 통해 다양한 분자 스위치의 개발이 가능해질 것으로 기대된다”고 말했다.
이번 연구는 미래창조과학부가 시행하는 글로벌프론티어사업(바이오나노헬스가드연구단)과 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 압타머와 금속이온의 상호작용에 의하 가역적으로 조절되는 중합효소 활성 모식도
2016.05.03 조회수 12005 -
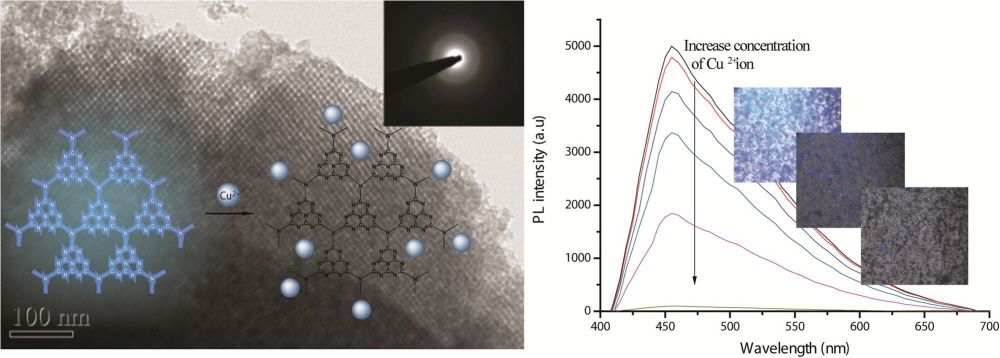 금속이온 감지 고감도 센서 개발 길 열어
- 카본 나이트라이드에 3차원 입방체형태의 나노구조 유도- 화학분야 세계적 학술지 ‘앙게반테 케미誌’ 12월호 게재
우리학교 생명화학공학과 홍원희 교수팀이 나노구조를 갖는 카본 나이트라이드를 이용해 다른 물질의 도움 없이 금속이온을 손쉽게 감지할 수 있는 고감도 센서 개발을 위한 원천기술을 확보했다고 27일 밝혔다.
금속이온을 측정하기 위해서는 원자 흡수 분광도법과 유도결합 플라즈마 질량분석기를 이용하는 방법 등이 있다. 이들은 거대한 장비를 이용해야 하기 때문에 휴대성이 떨어진다.
이 휴대성 문제를 해결하기 위해 많은 연구들이 진행되고 있는 데, 대부분 양자점(quantum dot)을 이용하거나 형광단(fluorophore)을 이용하는 센서로 금속이온 감지를 위해 복잡한 접합과정을 거쳐야 한다. 또한, 양자점은 그 자체가 중금속으로 이루어져 있어 독성이 있으며, 형광단을 이용한 센서는 수용액에서의 용해도가 낮아 적용하는 데 한계가 있다.
연구팀은 고유의 발광성을 가지는 카본 나이트라이드(graphitic carbon nitride)에 3차원 입방체 형태의 나노구조를 유도해 본연의 광학적 성질을 조절함으로써 독성이 없고 별도의 접합이 필요 없는 효율적인 센서를 개발했다.
특히, 이 센서는 기존의 휴대용 센서를 목적으로 개발된 물질보다 감도가 10배 이상 뛰어나, 장비 휴대가 불가능한 원자 흡수 분광도법과 유도결합 플라즈마 질량분석기를 이용하는 방법과 유사한 감도를 나타낸다.
이번 연구성과를 기반으로 나노구조를 가지는 카본 나이트라이드를 이용해 폐수에 존재하는 금속 이온의 초고감도 감지도 가능하게 됨으로써, 주변 환경이 금속 이온에 의해 얼마나 노출되어 있는지 혹은 오염되어 있는지를 손쉽게 알 수 있다.
또한, 카본 나이트라이드의 생체 적합성을 이용해 몸속의 혈액 내에 존재하는 금속 이온의 농도까지 쉽고 간단하게 감지 가능한 센서를 구현할 수 있으며, 나노 크기의 카본 나이트라이드 입자를 이용해 체내의 질병치료를 위한 약물 전달 시스템에 적용하고자 약물 전달체로의 활용이 가능할 것으로 기대된다.
홍원희 교수는 “이번 연구는 카본 나이트라이드 관련 연구가 한 걸음 더 나아가 나노구조 유도를 통한 다양한 성질을 복합적으로 이용해 이온 또는 생체 분자 등 여러 가지 물질을 감지하는 센서로 널리 활용될 수 있는 원천기술이다”라고 말했다.
한편, 이번 연구는 교육과학기술부에서 시행하는 미래기반기술개발사업의 지원을 받아 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적 학술지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’지 12월호에 게재됐다.
2011.01.27 조회수 19925
금속이온 감지 고감도 센서 개발 길 열어
- 카본 나이트라이드에 3차원 입방체형태의 나노구조 유도- 화학분야 세계적 학술지 ‘앙게반테 케미誌’ 12월호 게재
우리학교 생명화학공학과 홍원희 교수팀이 나노구조를 갖는 카본 나이트라이드를 이용해 다른 물질의 도움 없이 금속이온을 손쉽게 감지할 수 있는 고감도 센서 개발을 위한 원천기술을 확보했다고 27일 밝혔다.
금속이온을 측정하기 위해서는 원자 흡수 분광도법과 유도결합 플라즈마 질량분석기를 이용하는 방법 등이 있다. 이들은 거대한 장비를 이용해야 하기 때문에 휴대성이 떨어진다.
이 휴대성 문제를 해결하기 위해 많은 연구들이 진행되고 있는 데, 대부분 양자점(quantum dot)을 이용하거나 형광단(fluorophore)을 이용하는 센서로 금속이온 감지를 위해 복잡한 접합과정을 거쳐야 한다. 또한, 양자점은 그 자체가 중금속으로 이루어져 있어 독성이 있으며, 형광단을 이용한 센서는 수용액에서의 용해도가 낮아 적용하는 데 한계가 있다.
연구팀은 고유의 발광성을 가지는 카본 나이트라이드(graphitic carbon nitride)에 3차원 입방체 형태의 나노구조를 유도해 본연의 광학적 성질을 조절함으로써 독성이 없고 별도의 접합이 필요 없는 효율적인 센서를 개발했다.
특히, 이 센서는 기존의 휴대용 센서를 목적으로 개발된 물질보다 감도가 10배 이상 뛰어나, 장비 휴대가 불가능한 원자 흡수 분광도법과 유도결합 플라즈마 질량분석기를 이용하는 방법과 유사한 감도를 나타낸다.
이번 연구성과를 기반으로 나노구조를 가지는 카본 나이트라이드를 이용해 폐수에 존재하는 금속 이온의 초고감도 감지도 가능하게 됨으로써, 주변 환경이 금속 이온에 의해 얼마나 노출되어 있는지 혹은 오염되어 있는지를 손쉽게 알 수 있다.
또한, 카본 나이트라이드의 생체 적합성을 이용해 몸속의 혈액 내에 존재하는 금속 이온의 농도까지 쉽고 간단하게 감지 가능한 센서를 구현할 수 있으며, 나노 크기의 카본 나이트라이드 입자를 이용해 체내의 질병치료를 위한 약물 전달 시스템에 적용하고자 약물 전달체로의 활용이 가능할 것으로 기대된다.
홍원희 교수는 “이번 연구는 카본 나이트라이드 관련 연구가 한 걸음 더 나아가 나노구조 유도를 통한 다양한 성질을 복합적으로 이용해 이온 또는 생체 분자 등 여러 가지 물질을 감지하는 센서로 널리 활용될 수 있는 원천기술이다”라고 말했다.
한편, 이번 연구는 교육과학기술부에서 시행하는 미래기반기술개발사업의 지원을 받아 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적 학술지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’지 12월호에 게재됐다.
2011.01.27 조회수 19925 -
 핵산중합효소의 비정상적인 활성 유도 규명
- 금속이온의 고감도 검출 및 새로운 유전자 분석기술로 적용 가능- 화학분야 세계적 학술지 ‘앙게반테 케미誌’12월호 표지논문 선정
우리학교 생명화학공학과 박현규 교수가 핵산중합효소의 비정상적인 활성을 금속이온을 통해 조절하고 이를 이용해 바이오 컴퓨터를 포함하는 미래 바이오 전자 분야의 핵심기술인 로직 게이트를 구현하는 기술을 개발했다고 23일 밝혔다.
DNA를 새롭게 생성해 증폭시키는 효소인 핵산중합효소는 증폭 대상인 목적 DNA와 프라이머(primer)의 염기쌍이 서로 상보적인 짝(A와 T, C와 G)을 이룰 경우에만 가능하다고 알려져 왔었다.
박 교수는 이러한 기존의 개념을 뛰어넘어 특정 금속이 있을 경우에는 상보적인 염기쌍이 아닌 T-T 및 C-C 염기쌍으로부터도 핵산중합효소의 활성을 유도해 핵산을 증폭할 수 있다는 사실을 규명해냈다.
이는 수은 및 은 이온과의 결합을 통해 안정화 된 비 상보적인 T-T와 C-C 염기쌍을 상보적인 염기쌍으로 인식하는 핵산중합효소의 착각 현상에 기인한 것으로, 박 교수는 이를 ‘중합효소 활성 착오(Illusionary polymerase activity)’로 묘사했다.
연구팀은 이 현상을 기반으로 바이오 컴퓨터 등 초고성능 메모리를 가능하게 하는 미래 바이오전자 구현을 위한 핵심기술인 로직게이트를 구현했다.
박현규 교수는 “이번 연구는 기존에 연구되어온 금속 이온과 핵산의 상호작용연구에서 한 걸음 더 나아가 이를 효소활성 유도와 연관시킨 최초의 시도로써, 금속이온의 초고감도 검출 및 새로운 단일염기다형성(single nucleotide polymorphism) 유전자 분석 기술로 적용될 수 있다”고 말했다.
특히, “기존 핵산 기반 기술들과 비교해 비용이 저렴하고 간단한 시스템 디자인을 통해 정확한 로직 게이트 구현이 가능함으로써 분자 수준의 전자소자 연구에 큰 진보를 가져왔다”고 덧붙였다.
한편, 이번 연구는 한국연구재단(이사장 박찬모)이 시행하는 ‘중견연구자지원사업(도약연구)’의 지원을 받아 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적인 학술지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’ 12월호(12월 10일자) 표지논문으로 선정됐다.
2010.12.23 조회수 16961
핵산중합효소의 비정상적인 활성 유도 규명
- 금속이온의 고감도 검출 및 새로운 유전자 분석기술로 적용 가능- 화학분야 세계적 학술지 ‘앙게반테 케미誌’12월호 표지논문 선정
우리학교 생명화학공학과 박현규 교수가 핵산중합효소의 비정상적인 활성을 금속이온을 통해 조절하고 이를 이용해 바이오 컴퓨터를 포함하는 미래 바이오 전자 분야의 핵심기술인 로직 게이트를 구현하는 기술을 개발했다고 23일 밝혔다.
DNA를 새롭게 생성해 증폭시키는 효소인 핵산중합효소는 증폭 대상인 목적 DNA와 프라이머(primer)의 염기쌍이 서로 상보적인 짝(A와 T, C와 G)을 이룰 경우에만 가능하다고 알려져 왔었다.
박 교수는 이러한 기존의 개념을 뛰어넘어 특정 금속이 있을 경우에는 상보적인 염기쌍이 아닌 T-T 및 C-C 염기쌍으로부터도 핵산중합효소의 활성을 유도해 핵산을 증폭할 수 있다는 사실을 규명해냈다.
이는 수은 및 은 이온과의 결합을 통해 안정화 된 비 상보적인 T-T와 C-C 염기쌍을 상보적인 염기쌍으로 인식하는 핵산중합효소의 착각 현상에 기인한 것으로, 박 교수는 이를 ‘중합효소 활성 착오(Illusionary polymerase activity)’로 묘사했다.
연구팀은 이 현상을 기반으로 바이오 컴퓨터 등 초고성능 메모리를 가능하게 하는 미래 바이오전자 구현을 위한 핵심기술인 로직게이트를 구현했다.
박현규 교수는 “이번 연구는 기존에 연구되어온 금속 이온과 핵산의 상호작용연구에서 한 걸음 더 나아가 이를 효소활성 유도와 연관시킨 최초의 시도로써, 금속이온의 초고감도 검출 및 새로운 단일염기다형성(single nucleotide polymorphism) 유전자 분석 기술로 적용될 수 있다”고 말했다.
특히, “기존 핵산 기반 기술들과 비교해 비용이 저렴하고 간단한 시스템 디자인을 통해 정확한 로직 게이트 구현이 가능함으로써 분자 수준의 전자소자 연구에 큰 진보를 가져왔다”고 덧붙였다.
한편, 이번 연구는 한국연구재단(이사장 박찬모)이 시행하는 ‘중견연구자지원사업(도약연구)’의 지원을 받아 수행됐으며, 연구의 중요성을 인정받아 화학 분야의 세계적인 학술지인 ‘앙게반테 케미(Angewandte Chemie International Edition)’ 12월호(12월 10일자) 표지논문으로 선정됐다.
2010.12.23 조회수 16961