%EC%84%AC%EC%9C%A0%EC%95%84%EC%84%B8%ED%8F%AC
-
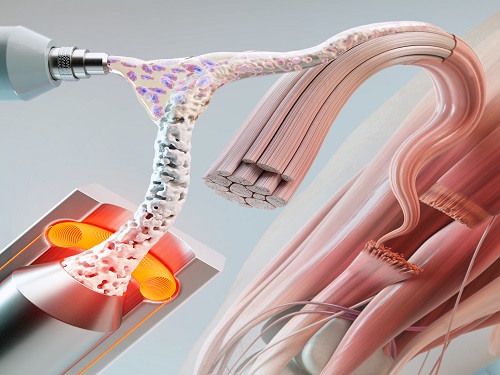 인공근육 재생을 위한 세포기반 3D 파이버 구조체 개발
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 연세대학교, MIT 공동 연구팀과 함께 광섬유 제작 방법을 이용해 근육 및 혈관, 신경조직을 재생시키기 위한 맞춤형 3D 구조체(세포 기반 인공근육)를 개발했다고 19일 밝혔다.
외상 및 종양 절제 후에 발생하는 근육 손실은 장기적으로 환자의 움직임을 제한하는 가장 큰 원인 중의 하나다. 현재 치료를 위해 이식 기반의 수술법이 시행되고 있으나, 이는 조직을 제공한 부위에 문제를 일으킬 여지가 있을 뿐만 아니라, 이식한 부위에서도 근육의 효과적인 재생력 및 기능성이 충분히 나타나지 않는 문제점을 가지고 있다. 이에 대한 대안으로 손상 부위에 세포를 직접 이식해 골격근(skeletal muscle)의 재생을 유도하는 연구가 진행되고 있지만, 현재의 기술로는 세포의 장기 생존율 및 기능성이 많이 떨어져 실제 임상에 적용하기 어려운 상황이다.
연구팀은 문제 해결을 위해, 섬유아세포(fibroblast)를 리프로그래밍(direct reprogramming)해 유도 근육전구세포(induced myogenic progenitor cells, iMPCs)로 바꾸는 방법을 사용했다. 또한, 세포의 효과적인 분화 및 성장을 위해서는 이상적인 기계적/생화학적 마이크로환경을 제공해야 하므로, 연구팀은 이를 적절한 인공/자연 고분자의 조합을 통한 하이브리드 3D 구조체를 제공하는 방법을 통해 해결했다.
구조체 제작을 위해 첫 번째로 이용한 재료는 우수한 생체적합성 및 강도를 가진 PCL(polycarpolactone) 고분자다. 연구팀은 주로 광섬유를 제작하는데 사용되는 열 인발 공정(thermal drawing process, TDP) 및 다공성 구조 형성을 위한 염침출법(salt leaching)을 이용해, 파이버 기반의 3D PCL 구조체를 제작하는데 성공했다. 해당 공정은 구조체의 사이즈, 강도, 다공성을 자유롭게 조절할 수 있으면서도 구조체의 대량생산을 가능하게 한다는 장점이 있다. 두 번째 재료는 탈세포화(de-cellularization) 과정을 통해 만든 세포외기질(extracellular matrix, ECM)로써, 연구진은 두 재료의 적절한 조합을 통해 이식한 세포에게 최적의 분화 환경을 제공하는데 성공했다.
그 결과, 연구팀은 생체 외(in vitro) 및 생체 내(in vivo) 모델에서 근육 세포의 분화 및 형성이 촉진될 뿐만 아니라, 근육 이외에 주변 신경 및 혈관 분포율이 증가하는 것을 확인했다. 또한 연구팀은 마우스를 대상으로 한 체적 근육 손실 모델에서, 개발한 구조체와 세포를 함께 이식했을 경우 세포만을 이식했을 때에 비해 재생된 근육의 능력이 비약적으로 상승함을 확인했다.
연구를 주도한 박성준 교수는 "이번 연구는 향후 근육 이외에도 다양한 조직의 재생을 위한 맞춤형 3D 구조체를 대량생산 할 수 있는 새로운 방법을 개발했다는 데에 의의가 있다. 이후 본 기술이 여러 가지 생체재료 및 줄기세포 기술과 결합할 경우, 조직 공학 및 인공근육 개발 분야에서 큰 시너지를 낼 수 있으리라 기대한다.ˮ 라고 말했다.
이번 연구결과는 국제 학술지 `어드벤스드 머터리얼즈(Advanced Materials)' 2021년 2월 19일 자에 출판됐다. (논문명: Functional skeletal muscle regeneration with thermally drawn porous fibers and reprogrammed muscle progenitors for volumetric muscle injury)
2021.02.22 조회수 93671
인공근육 재생을 위한 세포기반 3D 파이버 구조체 개발
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 연세대학교, MIT 공동 연구팀과 함께 광섬유 제작 방법을 이용해 근육 및 혈관, 신경조직을 재생시키기 위한 맞춤형 3D 구조체(세포 기반 인공근육)를 개발했다고 19일 밝혔다.
외상 및 종양 절제 후에 발생하는 근육 손실은 장기적으로 환자의 움직임을 제한하는 가장 큰 원인 중의 하나다. 현재 치료를 위해 이식 기반의 수술법이 시행되고 있으나, 이는 조직을 제공한 부위에 문제를 일으킬 여지가 있을 뿐만 아니라, 이식한 부위에서도 근육의 효과적인 재생력 및 기능성이 충분히 나타나지 않는 문제점을 가지고 있다. 이에 대한 대안으로 손상 부위에 세포를 직접 이식해 골격근(skeletal muscle)의 재생을 유도하는 연구가 진행되고 있지만, 현재의 기술로는 세포의 장기 생존율 및 기능성이 많이 떨어져 실제 임상에 적용하기 어려운 상황이다.
연구팀은 문제 해결을 위해, 섬유아세포(fibroblast)를 리프로그래밍(direct reprogramming)해 유도 근육전구세포(induced myogenic progenitor cells, iMPCs)로 바꾸는 방법을 사용했다. 또한, 세포의 효과적인 분화 및 성장을 위해서는 이상적인 기계적/생화학적 마이크로환경을 제공해야 하므로, 연구팀은 이를 적절한 인공/자연 고분자의 조합을 통한 하이브리드 3D 구조체를 제공하는 방법을 통해 해결했다.
구조체 제작을 위해 첫 번째로 이용한 재료는 우수한 생체적합성 및 강도를 가진 PCL(polycarpolactone) 고분자다. 연구팀은 주로 광섬유를 제작하는데 사용되는 열 인발 공정(thermal drawing process, TDP) 및 다공성 구조 형성을 위한 염침출법(salt leaching)을 이용해, 파이버 기반의 3D PCL 구조체를 제작하는데 성공했다. 해당 공정은 구조체의 사이즈, 강도, 다공성을 자유롭게 조절할 수 있으면서도 구조체의 대량생산을 가능하게 한다는 장점이 있다. 두 번째 재료는 탈세포화(de-cellularization) 과정을 통해 만든 세포외기질(extracellular matrix, ECM)로써, 연구진은 두 재료의 적절한 조합을 통해 이식한 세포에게 최적의 분화 환경을 제공하는데 성공했다.
그 결과, 연구팀은 생체 외(in vitro) 및 생체 내(in vivo) 모델에서 근육 세포의 분화 및 형성이 촉진될 뿐만 아니라, 근육 이외에 주변 신경 및 혈관 분포율이 증가하는 것을 확인했다. 또한 연구팀은 마우스를 대상으로 한 체적 근육 손실 모델에서, 개발한 구조체와 세포를 함께 이식했을 경우 세포만을 이식했을 때에 비해 재생된 근육의 능력이 비약적으로 상승함을 확인했다.
연구를 주도한 박성준 교수는 "이번 연구는 향후 근육 이외에도 다양한 조직의 재생을 위한 맞춤형 3D 구조체를 대량생산 할 수 있는 새로운 방법을 개발했다는 데에 의의가 있다. 이후 본 기술이 여러 가지 생체재료 및 줄기세포 기술과 결합할 경우, 조직 공학 및 인공근육 개발 분야에서 큰 시너지를 낼 수 있으리라 기대한다.ˮ 라고 말했다.
이번 연구결과는 국제 학술지 `어드벤스드 머터리얼즈(Advanced Materials)' 2021년 2월 19일 자에 출판됐다. (논문명: Functional skeletal muscle regeneration with thermally drawn porous fibers and reprogrammed muscle progenitors for volumetric muscle injury)
2021.02.22 조회수 93671 -
 노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26 조회수 48639
노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26 조회수 48639 -
 조광현 교수, 섬유아세포 과활성 유발 분자피드백 회로 규명
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 삼성병원 김석형 교수 연구팀과 공동연구를 통해 섬유증 및 암 악성화의 원인이 되는 섬유아세포 과활성을 유발하는 분자피드백 회로를 최초로 규명했다.
신동관 박사와 안수균 학생 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 1일자 온라인 판에 게재됐다.
( https://www.nature.com/articles/s41467-018-05274-6 )
인간의 섬유아세포는 대부분의 정상조직에 비활성화된 상태로 존재하다가 상처회복을 위해 필요할 때 급진적으로 활성화된다. 하지만 이러한 급진적 활성화가 유발되는 원리는 아직 밝혀지지 않았다.
조광현 교수 연구팀은 삼성병원 김석형 교수팀과 공동연구를 통해 Twist1, Prrx1, TNC 분자들이 연쇄적으로 활성을 유발하는 양성피드백회로를 구성함으로서 그와 같은 급진적인 섬유아세포의 활성을 유발한다는 것을 분자생물학실험과 수학모델링, 컴퓨터시뮬레이션 분석, 그리고 동물실험과 임상데이터 분석을 통해 밝혔다.
활성화된 섬유아세포는 상처가 치유된 뒤 다시 비활성화된 상태로 전환돼야 하는데 이 때 피드백회로가 계속 작동하면 섬유증의 발생이나 암 악성화의 원인이 된다.
따라서 이번에 밝혀낸 Twist1-Prrx1-TNC 분자피드백회로는 섬유증과 암의 새로운 치료 타겟으로 활용될 수 있을 것으로 기대된다.
□ 그림 설명
그림1. 섬유아세포의 급진적 활성화를 유발하는 Twist1-Prrx1-TNC 분자피드백회로 규명 과정
그림2. 정상적인 섬유아세포의 활성화 조절과 피드백회로의 비가역적 활성화에 따른 비정상적인 섬유아세포 활성화 조절과정의 비교
2018.08.10 조회수 13660
조광현 교수, 섬유아세포 과활성 유발 분자피드백 회로 규명
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 삼성병원 김석형 교수 연구팀과 공동연구를 통해 섬유증 및 암 악성화의 원인이 되는 섬유아세포 과활성을 유발하는 분자피드백 회로를 최초로 규명했다.
신동관 박사와 안수균 학생 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 1일자 온라인 판에 게재됐다.
( https://www.nature.com/articles/s41467-018-05274-6 )
인간의 섬유아세포는 대부분의 정상조직에 비활성화된 상태로 존재하다가 상처회복을 위해 필요할 때 급진적으로 활성화된다. 하지만 이러한 급진적 활성화가 유발되는 원리는 아직 밝혀지지 않았다.
조광현 교수 연구팀은 삼성병원 김석형 교수팀과 공동연구를 통해 Twist1, Prrx1, TNC 분자들이 연쇄적으로 활성을 유발하는 양성피드백회로를 구성함으로서 그와 같은 급진적인 섬유아세포의 활성을 유발한다는 것을 분자생물학실험과 수학모델링, 컴퓨터시뮬레이션 분석, 그리고 동물실험과 임상데이터 분석을 통해 밝혔다.
활성화된 섬유아세포는 상처가 치유된 뒤 다시 비활성화된 상태로 전환돼야 하는데 이 때 피드백회로가 계속 작동하면 섬유증의 발생이나 암 악성화의 원인이 된다.
따라서 이번에 밝혀낸 Twist1-Prrx1-TNC 분자피드백회로는 섬유증과 암의 새로운 치료 타겟으로 활용될 수 있을 것으로 기대된다.
□ 그림 설명
그림1. 섬유아세포의 급진적 활성화를 유발하는 Twist1-Prrx1-TNC 분자피드백회로 규명 과정
그림2. 정상적인 섬유아세포의 활성화 조절과 피드백회로의 비가역적 활성화에 따른 비정상적인 섬유아세포 활성화 조절과정의 비교
2018.08.10 조회수 13660