%EC%96%B5%EC%A0%9C%EC%84%B1
-
 신경세포의 흥분성 증가로 인한 뇌 질환 기제 규명
관련 유튜브 영상 링크 : https://www.youtube.com/watch?v=dwV_Xs7tHEY&t=13s
우리 연구진이 뇌 신경세포의 흥분과 억제 불균형을 일으키는 새로운 기전을 규명했다. 이는 발작과 같은 다양한 뇌 신경질환의 원인과 연결되며, 뇌 질환 치료에 활용이 기대된다.
우리 대학 생명과학과 정원석 교수와 박정주 박사과정 연구팀이 억제성 시냅스가 *미세아교세포에 의해 제거되는 분자 기전을 처음으로 밝히고, 이 현상이 과도하게 일어날 때 신경세포의 흥분성 증가로 발작과 같은 뇌 질환이 일어날 수 있음을 증명해 국제학술지 `엠보저널(EMBO Journal)'에 공개했다고 2일 밝혔다.
☞ 미세아교세포(microgila): 뇌에서 면역기능을 담당하는 신경세포의 일종이다. 뇌와 척추 전역에 분포돼 있으며, 정상적인 뇌 기능을 수행하도록 핵심적인 역할을 한다.
*시냅스는 뇌 발달 및 학습 시에 생성과 제거가 반복되는 변화를 겪는다. 정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포와 미세아교세포가 신경세포의 불필요한 시냅스를 잡아먹어 제거할 수 있음을 밝힌 바 있다. 하지만, 이 과정에서 어떤 물질이 특정 시냅스를 표지해 교세포들로 하여금 제거하도록 유도하는지는 알려지지 않았다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
연구팀은 포스파티딜세린 (phosphatidylserine)이라는 세포막에 존재하는 인지질 중의 하나가 죽어가는 세포 표면에 선택적으로 표지돼 면역세포에 의해 세포를 잡아먹도록 유도한다는 사실에 착안했다. 죽어가는 세포가 제거되는 분자 기전이 시냅스만이 선택적으로 제거되는 현상에도 응용될 수 있을 것이라 예상한 것이다.
이 가정을 증명하기 위해 연구팀은 포스파티딜세린을 신경세포 표면에 인위적으로 노출한 후, 특정 시냅스가 교세포에 의해 잡아먹힐 수 있는지 연구했다.
먼저 연구팀은 포스파티딜세린을 항상 세포 표면으로부터 안으로 지속적으로 불러들여 정상 세포막에서 이들을 노출되지 않도록 막고 있는 플립파아제(Flippase)라는 단백질의 기능을 신경세포에서만 억제할 수 있는 실험용 쥐 모델을 제작했다.
그 결과 놀랍게도 신경세포의 세포체 주변의 표면에서만 선택적으로 포스파티딜세린이 표지됨을 발견했고 이로 인해 세포막이나 흥분성 시냅스의 손상 없이 억제성 시냅스만이 선택적으로 감소함을 발견했다. 그뿐만 아니라 해당 쥐 모델은 청각을 담당하는 뇌 지역에서 흥분-억제 균형이 깨져서 소리로 인해 촉발되는 특이한 발작 증세를 일으킴을 확인했다.
더 나아가 연구팀은 미세아교세포를 인위적으로 제거하거나 미세아교세포에 존재하는 특정 포식 수용체를 제거했을 때, 신경세포의 표면에 포스파티딜세린이 표지되었을지라도 과도한 억제성 시냅스 감소와 발작 증세가 방지될 수 있음을 발견했다.
이로써 신경세포체 주변 세포막에 포스파티딜세린이 표지되는 것이 미세아교세포가 포식 수용체를 통해 억제성 시냅스만을 선택적으로 먹는 기전으로 쓰일 수 있음을 최초로 규명한 것이다.
연구팀의 이 같은 발견은 흥분성 및 억제성 시냅스가 서로 다른 기전을 통해 미세아교세포에 의해 제거될 수 있음을 처음으로 제시한 것이며, 미세아교세포에 의한 과도한 억제성 시냅스 제거 기전이 뇌 신경세포의 흥분-억제 불균형 발생의 새로운 원인이 될 수 있음을 증명한 것이다.
연구팀 관계자는 "비정상적인 억제성 시냅스 수 변화는 발작, 자폐 스펙트럼 장애, 조현병, 치매 등과 같은 다양한 뇌 질환의 유병률과 연관성이 높다ˮ며 "뇌에서의 흥분-억제 균형이 깨져서 일어나는 다양한 뇌 신경질환에서 미세아교세포가 억제성 시냅스를 먹는 현상을 조절하는 것이 이들 질환을 치료하는 새로운 전략이 될 것이다ˮ고 말했다.
우리 대학 생명과학과 박정주 박사과정이 제1 저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 `엠보저널(EMBO Journal)'에 지난 5월 20일 字 공개됐다. (논문명: Microglial MERTK eliminates phosphatidylserine-displaying inhibitory post-synapses)
한편, 이번 연구는 삼성미래기술육성재단의 도움을 받아 진행됐다.
2021.06.03 조회수 60933
신경세포의 흥분성 증가로 인한 뇌 질환 기제 규명
관련 유튜브 영상 링크 : https://www.youtube.com/watch?v=dwV_Xs7tHEY&t=13s
우리 연구진이 뇌 신경세포의 흥분과 억제 불균형을 일으키는 새로운 기전을 규명했다. 이는 발작과 같은 다양한 뇌 신경질환의 원인과 연결되며, 뇌 질환 치료에 활용이 기대된다.
우리 대학 생명과학과 정원석 교수와 박정주 박사과정 연구팀이 억제성 시냅스가 *미세아교세포에 의해 제거되는 분자 기전을 처음으로 밝히고, 이 현상이 과도하게 일어날 때 신경세포의 흥분성 증가로 발작과 같은 뇌 질환이 일어날 수 있음을 증명해 국제학술지 `엠보저널(EMBO Journal)'에 공개했다고 2일 밝혔다.
☞ 미세아교세포(microgila): 뇌에서 면역기능을 담당하는 신경세포의 일종이다. 뇌와 척추 전역에 분포돼 있으며, 정상적인 뇌 기능을 수행하도록 핵심적인 역할을 한다.
*시냅스는 뇌 발달 및 학습 시에 생성과 제거가 반복되는 변화를 겪는다. 정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포와 미세아교세포가 신경세포의 불필요한 시냅스를 잡아먹어 제거할 수 있음을 밝힌 바 있다. 하지만, 이 과정에서 어떤 물질이 특정 시냅스를 표지해 교세포들로 하여금 제거하도록 유도하는지는 알려지지 않았다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
연구팀은 포스파티딜세린 (phosphatidylserine)이라는 세포막에 존재하는 인지질 중의 하나가 죽어가는 세포 표면에 선택적으로 표지돼 면역세포에 의해 세포를 잡아먹도록 유도한다는 사실에 착안했다. 죽어가는 세포가 제거되는 분자 기전이 시냅스만이 선택적으로 제거되는 현상에도 응용될 수 있을 것이라 예상한 것이다.
이 가정을 증명하기 위해 연구팀은 포스파티딜세린을 신경세포 표면에 인위적으로 노출한 후, 특정 시냅스가 교세포에 의해 잡아먹힐 수 있는지 연구했다.
먼저 연구팀은 포스파티딜세린을 항상 세포 표면으로부터 안으로 지속적으로 불러들여 정상 세포막에서 이들을 노출되지 않도록 막고 있는 플립파아제(Flippase)라는 단백질의 기능을 신경세포에서만 억제할 수 있는 실험용 쥐 모델을 제작했다.
그 결과 놀랍게도 신경세포의 세포체 주변의 표면에서만 선택적으로 포스파티딜세린이 표지됨을 발견했고 이로 인해 세포막이나 흥분성 시냅스의 손상 없이 억제성 시냅스만이 선택적으로 감소함을 발견했다. 그뿐만 아니라 해당 쥐 모델은 청각을 담당하는 뇌 지역에서 흥분-억제 균형이 깨져서 소리로 인해 촉발되는 특이한 발작 증세를 일으킴을 확인했다.
더 나아가 연구팀은 미세아교세포를 인위적으로 제거하거나 미세아교세포에 존재하는 특정 포식 수용체를 제거했을 때, 신경세포의 표면에 포스파티딜세린이 표지되었을지라도 과도한 억제성 시냅스 감소와 발작 증세가 방지될 수 있음을 발견했다.
이로써 신경세포체 주변 세포막에 포스파티딜세린이 표지되는 것이 미세아교세포가 포식 수용체를 통해 억제성 시냅스만을 선택적으로 먹는 기전으로 쓰일 수 있음을 최초로 규명한 것이다.
연구팀의 이 같은 발견은 흥분성 및 억제성 시냅스가 서로 다른 기전을 통해 미세아교세포에 의해 제거될 수 있음을 처음으로 제시한 것이며, 미세아교세포에 의한 과도한 억제성 시냅스 제거 기전이 뇌 신경세포의 흥분-억제 불균형 발생의 새로운 원인이 될 수 있음을 증명한 것이다.
연구팀 관계자는 "비정상적인 억제성 시냅스 수 변화는 발작, 자폐 스펙트럼 장애, 조현병, 치매 등과 같은 다양한 뇌 질환의 유병률과 연관성이 높다ˮ며 "뇌에서의 흥분-억제 균형이 깨져서 일어나는 다양한 뇌 신경질환에서 미세아교세포가 억제성 시냅스를 먹는 현상을 조절하는 것이 이들 질환을 치료하는 새로운 전략이 될 것이다ˮ고 말했다.
우리 대학 생명과학과 박정주 박사과정이 제1 저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 `엠보저널(EMBO Journal)'에 지난 5월 20일 字 공개됐다. (논문명: Microglial MERTK eliminates phosphatidylserine-displaying inhibitory post-synapses)
한편, 이번 연구는 삼성미래기술육성재단의 도움을 받아 진행됐다.
2021.06.03 조회수 60933 -
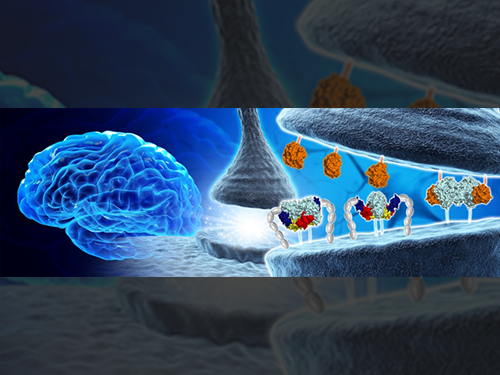 김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 22076
김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 22076