-
 정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
2025.07.03
조회수 421
-
 간 조직 속 노화 신호 미리 잡아 질병 예측한다
노화나 만성 질환은 장기간에 걸쳐 미세한 조직 변화가 서서히 축적되는 과정을 거치기 때문에, 장기 내 이러한 변화를 정량적으로 파악하고, 이를 질병 발병의 초기 신호와 연결하는 데에는 여전히 한계가 있다. 이에 우리 연구진이 조직 안에서 처음 문제가 생기는 국소적인 변화를 정확히 포착해, 질병을 더 빠르게 발견하고 예측하며, 맞춤형 치료 타깃을 설정하는 데 큰 도움이 될 플랫폼 기술을 개발하는 데 성공했다.
우리 대학 의과학대학원 박종은 교수, 한국생명공학연구원(KRIBB, 원장 권석윤) 노화융합연구단 김천아 박사 공동 연구팀이 노화 간 조직 내에서 국소적으로 발생하는 섬유화된 미세환경을 포착하고 이를 *단일세포 전사체 수준으로 정밀 분석*할 수 있는 ‘파이니-시퀀싱(FiNi-seq, Fibrotic Niche enrichment sequencing)’기술을 개발했다고 12일 밝혔다.
*단일세포 전사체 분석: 세포 하나하나가 어떤 유전자를 얼마나 활발히 사용하고 있는지를 측정하는 방법으로 세포별 병든 세포의 정체와 기능을 파악할 수 있게 해줌
연구진은 노화된 간 조직에서 조직 분해 저항성이 높은 영역을 물리적 성질을 통해 선별하는 방법을 통해, 재생이 지연되고 섬유화가 축적되는 초기 노화 미세환경을 선택적으로 농축하는 방법을 개발했다.
이 과정에서 기존의 단일세포 분석 기술로는 포착하기 어려웠던 섬유화 관련 혈관내피세포와 면역과 상호작용을 하는 섬유아세포, PD-1 고발현 CD8 T세포 등 면역 탈진세포를 고해상도로 확인할 수 있었다.
특히 연구진은 ‘FiNi-seq’ 기술을 통해 노화 간 조직 내 섬유화 부위에서 관찰되는 특정 세포들이 분비 인자를 통해 주변 환경을 이차적으로 노화시키고, 이로 인해 노화된 환경이 확장된다는 것을 확인했다.
또한, 혈관내피세포가 조직 고유의 정체성을 상실하고 선천면역 반응을 유도해 면역세포 유입을 촉진하는 메커니즘도 규명했다. 공간 전사체 분석을 통해 면역세포와 상호작용을 하는 섬유아세포의 공간적 분포를 정량화하고, 이들이 조직 재생, 염증 반응의 유도, 만성 섬유화로의 이행에 관여함을 밝혔다.
연구팀은 전사체와 후성유전체 정보를 얻어내는 멀티-오믹스* 데이터를 통합 분석해 노화된 간 조직의 미세환경과 이의 공간적 이질성을 정밀하게 해석했으며, 이러한 변화들이 간 내 혈관 구조와 어떻게 연결되는지 확인했다.
*멀티-오믹스(multi-omics): 유전자, 단백질, 대사물질, 세포 정보 등 생물체 내 다양한 생체 정보를 통합적으로 분석하는 방법
이번에 개발된 ‘FiNi-seq’ 기술은 섬유화를 유발하는 노화 과정을 포함해 대부분의 만성 간질환에서 병태생리적 신호를 고해상도로 포착하는 데 유용한 플랫폼으로 기대된다.
제1 저자인 의과학대학원 탁권용 박사는 서울성모병원 소화기내과의 간 전문의로, 의사과학자 양성 사업의 지원을 받아 우리 대학 의과학대학원에서 박사 학위를 수행하며 만성 간질환에서 가장 중요한 임상 예후 지표인 섬유화의 진행을 조기에 진단하고 치료할 수 있는 기반을 마련하기 위해 이번 연구를 설계했다. 공동 제 1 저자인 의과학대학원 박명선 박사과정생은 FiNi-seq 기술의 기술적 구현을, KRIBB 노화융합연구단의 김주연 박사과정생은 노화 조직의 이미징 분석을 담당하여 연구에 핵심적 역할을 수행했다.
KRIBB 김천아 박사는 “이번 연구를 통해 노화 간 조직에서 관찰되는 섬유화된 미세환경의 세포 구성과 공간적 특성을 단일세포 수준에서 정밀하게 규명할 수 있었다”고 말했다.
의과학대학원 박종은 교수는 “노화 및 만성질환 초기 단계에서 발생하는 섬세한 변화를 조기에 포착할 수 있는 분석 기술로서, 향후 효과적인 치료 지점을 찾는데 큰 역할을 할 수 있을 것으로 기대된다. 또한, 다양한 간질환 모델뿐만 아니라 폐, 신장 등 다른 장기의 만성 질환 연구로 확장해서 진행할 예정이다”라고 밝혔다.
이 연구는 의과학대학원 탁권용 박사, KRIBB 박사과정 김주연 연구원, 우리 대학 박사과정 박명선 학생이 제1 공동저자로 국제 학술지 ‘네이처 에이징(Nature Aging)’ 2025년 5월 5일 자에 게재됐다.
※논문제목: Quasi-spatial single-cell transcriptome based on physical tissue properties defines early aging associated niche in liver
※DOI: https://doi.org/10.1038/s43587-025-00857-7
이번 연구는 한국연구재단, 한국보건산업진흥원(KHIDI), 한국생명공학연구원KRIBB, KIST, 포스코사이언스펠로우십, 융합형의사과학자 양성사업 등 국내 여러 기관의 지원을 받아 수행됐다.
간 조직 속 노화 신호 미리 잡아 질병 예측한다
노화나 만성 질환은 장기간에 걸쳐 미세한 조직 변화가 서서히 축적되는 과정을 거치기 때문에, 장기 내 이러한 변화를 정량적으로 파악하고, 이를 질병 발병의 초기 신호와 연결하는 데에는 여전히 한계가 있다. 이에 우리 연구진이 조직 안에서 처음 문제가 생기는 국소적인 변화를 정확히 포착해, 질병을 더 빠르게 발견하고 예측하며, 맞춤형 치료 타깃을 설정하는 데 큰 도움이 될 플랫폼 기술을 개발하는 데 성공했다.
우리 대학 의과학대학원 박종은 교수, 한국생명공학연구원(KRIBB, 원장 권석윤) 노화융합연구단 김천아 박사 공동 연구팀이 노화 간 조직 내에서 국소적으로 발생하는 섬유화된 미세환경을 포착하고 이를 *단일세포 전사체 수준으로 정밀 분석*할 수 있는 ‘파이니-시퀀싱(FiNi-seq, Fibrotic Niche enrichment sequencing)’기술을 개발했다고 12일 밝혔다.
*단일세포 전사체 분석: 세포 하나하나가 어떤 유전자를 얼마나 활발히 사용하고 있는지를 측정하는 방법으로 세포별 병든 세포의 정체와 기능을 파악할 수 있게 해줌
연구진은 노화된 간 조직에서 조직 분해 저항성이 높은 영역을 물리적 성질을 통해 선별하는 방법을 통해, 재생이 지연되고 섬유화가 축적되는 초기 노화 미세환경을 선택적으로 농축하는 방법을 개발했다.
이 과정에서 기존의 단일세포 분석 기술로는 포착하기 어려웠던 섬유화 관련 혈관내피세포와 면역과 상호작용을 하는 섬유아세포, PD-1 고발현 CD8 T세포 등 면역 탈진세포를 고해상도로 확인할 수 있었다.
특히 연구진은 ‘FiNi-seq’ 기술을 통해 노화 간 조직 내 섬유화 부위에서 관찰되는 특정 세포들이 분비 인자를 통해 주변 환경을 이차적으로 노화시키고, 이로 인해 노화된 환경이 확장된다는 것을 확인했다.
또한, 혈관내피세포가 조직 고유의 정체성을 상실하고 선천면역 반응을 유도해 면역세포 유입을 촉진하는 메커니즘도 규명했다. 공간 전사체 분석을 통해 면역세포와 상호작용을 하는 섬유아세포의 공간적 분포를 정량화하고, 이들이 조직 재생, 염증 반응의 유도, 만성 섬유화로의 이행에 관여함을 밝혔다.
연구팀은 전사체와 후성유전체 정보를 얻어내는 멀티-오믹스* 데이터를 통합 분석해 노화된 간 조직의 미세환경과 이의 공간적 이질성을 정밀하게 해석했으며, 이러한 변화들이 간 내 혈관 구조와 어떻게 연결되는지 확인했다.
*멀티-오믹스(multi-omics): 유전자, 단백질, 대사물질, 세포 정보 등 생물체 내 다양한 생체 정보를 통합적으로 분석하는 방법
이번에 개발된 ‘FiNi-seq’ 기술은 섬유화를 유발하는 노화 과정을 포함해 대부분의 만성 간질환에서 병태생리적 신호를 고해상도로 포착하는 데 유용한 플랫폼으로 기대된다.
제1 저자인 의과학대학원 탁권용 박사는 서울성모병원 소화기내과의 간 전문의로, 의사과학자 양성 사업의 지원을 받아 우리 대학 의과학대학원에서 박사 학위를 수행하며 만성 간질환에서 가장 중요한 임상 예후 지표인 섬유화의 진행을 조기에 진단하고 치료할 수 있는 기반을 마련하기 위해 이번 연구를 설계했다. 공동 제 1 저자인 의과학대학원 박명선 박사과정생은 FiNi-seq 기술의 기술적 구현을, KRIBB 노화융합연구단의 김주연 박사과정생은 노화 조직의 이미징 분석을 담당하여 연구에 핵심적 역할을 수행했다.
KRIBB 김천아 박사는 “이번 연구를 통해 노화 간 조직에서 관찰되는 섬유화된 미세환경의 세포 구성과 공간적 특성을 단일세포 수준에서 정밀하게 규명할 수 있었다”고 말했다.
의과학대학원 박종은 교수는 “노화 및 만성질환 초기 단계에서 발생하는 섬세한 변화를 조기에 포착할 수 있는 분석 기술로서, 향후 효과적인 치료 지점을 찾는데 큰 역할을 할 수 있을 것으로 기대된다. 또한, 다양한 간질환 모델뿐만 아니라 폐, 신장 등 다른 장기의 만성 질환 연구로 확장해서 진행할 예정이다”라고 밝혔다.
이 연구는 의과학대학원 탁권용 박사, KRIBB 박사과정 김주연 연구원, 우리 대학 박사과정 박명선 학생이 제1 공동저자로 국제 학술지 ‘네이처 에이징(Nature Aging)’ 2025년 5월 5일 자에 게재됐다.
※논문제목: Quasi-spatial single-cell transcriptome based on physical tissue properties defines early aging associated niche in liver
※DOI: https://doi.org/10.1038/s43587-025-00857-7
이번 연구는 한국연구재단, 한국보건산업진흥원(KHIDI), 한국생명공학연구원KRIBB, KIST, 포스코사이언스펠로우십, 융합형의사과학자 양성사업 등 국내 여러 기관의 지원을 받아 수행됐다.
2025.06.12
조회수 1351
-
 세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
2024.05.22
조회수 7938
-
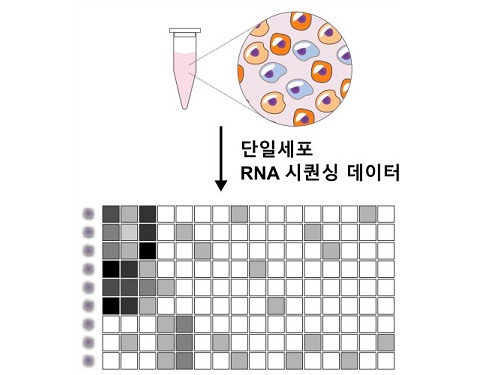 개인 맞춤형 정밀 의학 정확도 높일 ‘렌즈’ 개발
평균이 아닌 개인차를 고려하는 정밀 의학 시대가 열렸다. 사람마다 다른 유전적 특징을 알아내는 기술이 비약적으로 발전한 덕분이다. 더 빠르고, 정확하게 전사체를 해독할 수 있는 새로운 도구가 개발됐다. 우리 대학 수리과학과 김재경 교수(IBS 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 전사체 분석 빅데이터에서 유용한 생물학적 정보만 골라내는 새로운 도구인 ‘scLENS(single-cell Low-dimension Embedding using Effective Noise Subtraction)’를 개발했다.
단일세포 전사체 분석은 최근 생물학, 신약 개발, 임상 연구 등 여러 분야에서 주목받는 도구다. 개별 세포 단위에서 유전적 변화를 확인할 수 있기 때문이다. 가령, 단일세포 전사체 분석을 이용하면 암 조직 내 수십 가지 종류의 세포를 구분하고, 유전적 변이가 발생한 세포만 표적하는 정밀 치료가 가능해진다.
단일세포 전사체 분석 기술이 임상에 광범위하게 이용되려면, 도출되는 빅데이터에서 유용한 생물학적 신호를 찾아내는 효율적인 분석 도구 개발이 선행돼야 한다. 단일세포 전사체 분석은 수백~수천 개에 이르는 개별 세포의 수만 개에 이르는 다양한 유전자 발현량을 측정하기 때문에 데이터 용량이 수~수십 GB에 달한다. 이 방대한 데이터 중 생물학적으로 유용한 신호는 3% 내외에 불과하다.
이 방대하고 노이즈(잡신호)가 많은 데이터에서 유용한 생물학적 신호를 골라내기 위해 지금까지 여러 데이터 처리 도구가 개발됐다. 하지만 기존 도구는 사용자가 생물학적 신호와 노이즈의 ‘경계선’을 직접 설정해야 해서 주관이 개입됐다. 즉, 분석가에 따라 결과가 크게 달라지고, 정확도가 떨어진다는 한계가 있었다.
우선, 연구진은 기존 분석 도구들이 부정확한 근본적인 원인을 규명하고 해결책을 제시했다. 사용자가 노이즈의 임계값을 결정하는 데이터 전처리 방식 자체가 생물학적 신호를 왜곡시킨다는 것을 규명하고, 왜곡 없는 새로운 전처리 방식을 개발했다. 나아가 연구진은 수학적 방법론인 ‘랜덤 행렬 이론’을 이용해 사용자의 주관적 선택 없이 자동으로 단일세포 전사체 분석 데이터에서 신호와 노이즈를 구별하는 프로그램인 ‘scLENS’를 개발했다.
제1 저자인 김현 연구원은 “scLENS는 사용자의 선택 없이 데이터에 내재된 구조만을 이용해 자동으로 신호와 노이즈를 구별하기 때문에 사용자 편향성 문제를 원천 차단할 수 있다”며 “연구자들의 노동집약적인 신호 선택 과정을 없애면서도 분석 정확성은 높였다”고 설명했다.
이어 연구진은 기존 개발된 11가지 데이터 분석 프로그램과 scLENS의 상대적 성능을 비교했다. 이를 통해 scLENS가 다른 모든 프로그램보다 우수한 성능을 보인다는 점을 확인할 수 있었다. 널리 쓰이는 프로그램인 ‘Seurat’과 비교했을 때 scLENS는 세포 그룹화 성능이 약 10% 이상 우수하며, 데이터에 내재된 국소 구조를 43% 더 효과적으로 포착하는 것으로 나타났다.
특히, scLENS는 기존 프로그램보다 많은 계산을 하지만 메모리 사용 최적화를 통해 10만 개의 세포와 2만 개의 유전자로 이뤄진 대규모 데이터를 3시간 만에 분석하는 경쟁력 있는 분석 속도를 보였다.
연구를 이끈 김재경 CI는 “지난 십여 년간 단일세포 전사체를 분석할 수 있는 실험 기술의 비약적인 발전했지만, 데이터 분석 방법의 한계로 인해 큰 비용과 시간을 투자해 얻은 데이터를 최대한 활용하지 못하는 경우가 많았다”며 “기초 수학 이론이 생명과학 연구의 혁신을 견인하고, 감춰졌던 생명의 비밀을 빠르고 정확하게 밝히는 데 쓰일 수 있음을 보여주는 연구”라고 말했다.
연구결과는 4월 27일(한국시간) 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 16.6)’ 온라인판에 실렸다.
개인 맞춤형 정밀 의학 정확도 높일 ‘렌즈’ 개발
평균이 아닌 개인차를 고려하는 정밀 의학 시대가 열렸다. 사람마다 다른 유전적 특징을 알아내는 기술이 비약적으로 발전한 덕분이다. 더 빠르고, 정확하게 전사체를 해독할 수 있는 새로운 도구가 개발됐다. 우리 대학 수리과학과 김재경 교수(IBS 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 전사체 분석 빅데이터에서 유용한 생물학적 정보만 골라내는 새로운 도구인 ‘scLENS(single-cell Low-dimension Embedding using Effective Noise Subtraction)’를 개발했다.
단일세포 전사체 분석은 최근 생물학, 신약 개발, 임상 연구 등 여러 분야에서 주목받는 도구다. 개별 세포 단위에서 유전적 변화를 확인할 수 있기 때문이다. 가령, 단일세포 전사체 분석을 이용하면 암 조직 내 수십 가지 종류의 세포를 구분하고, 유전적 변이가 발생한 세포만 표적하는 정밀 치료가 가능해진다.
단일세포 전사체 분석 기술이 임상에 광범위하게 이용되려면, 도출되는 빅데이터에서 유용한 생물학적 신호를 찾아내는 효율적인 분석 도구 개발이 선행돼야 한다. 단일세포 전사체 분석은 수백~수천 개에 이르는 개별 세포의 수만 개에 이르는 다양한 유전자 발현량을 측정하기 때문에 데이터 용량이 수~수십 GB에 달한다. 이 방대한 데이터 중 생물학적으로 유용한 신호는 3% 내외에 불과하다.
이 방대하고 노이즈(잡신호)가 많은 데이터에서 유용한 생물학적 신호를 골라내기 위해 지금까지 여러 데이터 처리 도구가 개발됐다. 하지만 기존 도구는 사용자가 생물학적 신호와 노이즈의 ‘경계선’을 직접 설정해야 해서 주관이 개입됐다. 즉, 분석가에 따라 결과가 크게 달라지고, 정확도가 떨어진다는 한계가 있었다.
우선, 연구진은 기존 분석 도구들이 부정확한 근본적인 원인을 규명하고 해결책을 제시했다. 사용자가 노이즈의 임계값을 결정하는 데이터 전처리 방식 자체가 생물학적 신호를 왜곡시킨다는 것을 규명하고, 왜곡 없는 새로운 전처리 방식을 개발했다. 나아가 연구진은 수학적 방법론인 ‘랜덤 행렬 이론’을 이용해 사용자의 주관적 선택 없이 자동으로 단일세포 전사체 분석 데이터에서 신호와 노이즈를 구별하는 프로그램인 ‘scLENS’를 개발했다.
제1 저자인 김현 연구원은 “scLENS는 사용자의 선택 없이 데이터에 내재된 구조만을 이용해 자동으로 신호와 노이즈를 구별하기 때문에 사용자 편향성 문제를 원천 차단할 수 있다”며 “연구자들의 노동집약적인 신호 선택 과정을 없애면서도 분석 정확성은 높였다”고 설명했다.
이어 연구진은 기존 개발된 11가지 데이터 분석 프로그램과 scLENS의 상대적 성능을 비교했다. 이를 통해 scLENS가 다른 모든 프로그램보다 우수한 성능을 보인다는 점을 확인할 수 있었다. 널리 쓰이는 프로그램인 ‘Seurat’과 비교했을 때 scLENS는 세포 그룹화 성능이 약 10% 이상 우수하며, 데이터에 내재된 국소 구조를 43% 더 효과적으로 포착하는 것으로 나타났다.
특히, scLENS는 기존 프로그램보다 많은 계산을 하지만 메모리 사용 최적화를 통해 10만 개의 세포와 2만 개의 유전자로 이뤄진 대규모 데이터를 3시간 만에 분석하는 경쟁력 있는 분석 속도를 보였다.
연구를 이끈 김재경 CI는 “지난 십여 년간 단일세포 전사체를 분석할 수 있는 실험 기술의 비약적인 발전했지만, 데이터 분석 방법의 한계로 인해 큰 비용과 시간을 투자해 얻은 데이터를 최대한 활용하지 못하는 경우가 많았다”며 “기초 수학 이론이 생명과학 연구의 혁신을 견인하고, 감춰졌던 생명의 비밀을 빠르고 정확하게 밝히는 데 쓰일 수 있음을 보여주는 연구”라고 말했다.
연구결과는 4월 27일(한국시간) 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 16.6)’ 온라인판에 실렸다.
2024.05.09
조회수 7693
-
 원하는 색깔의 마이크로 LED 전사 기술 개발
기존 OLED 등과 비해 전기적·광학적 특성이 우수한 마이크로 LED는 머리카락 두께인 100마이크로미터(μm) 이하 크기의 무기물 LED 칩을 활용하는 차세대 디스플레이용 광원이다. 마이크로 LED의 상용화를 위해선 성장 기판에 배열된 대량의 마이크로 LED 칩을 최종 기판의 정확한 위치에 원하는 배열로 옮기는 ‘전사 공정’이 가장 중요한 핵심기술이지만, 기존 전사 기술들은 별도의 접착제 사용, 정렬 오차, 낮은 수율, 칩 손상 등으로 마이크로 LED 상용화에 많은 어려움이 존재했다.
우리 대학 신소재공학과 이건재 교수 연구팀이 마이크로진공 흡입력을 조절해 대량의 마이크로 LED 칩을 색깔별 원하는 칩들만 선택적으로 전사하는 기술을 개발했다고 19일 밝혔다.
이 교수팀은 레이저빔 조사시 물질 특성을 조정하여 식각하는 레이저 유도 에칭(Laser-induced etching, LIE) 기술을 활용해 미세 관통홀을 유리 기판에 초당 7,000개 속도로 형성했고, 이를 진공 채널에 연결해 미세진공 흡입력을 발생시켜 마이크로 LED를 전사하는 데 성공했다. 이 기술은 기존 전사 기술 대비 뛰어난 접착력 전환성을 달성하였으며, 다수의 진공 채널별 독립적인 진공 조절을 통해 대량의 마이크로 LED 칩을 선택적으로 전사하였다. 또한 다양한 재료, 크기, 모양, 두께를 지닌 초소형 반도체 칩들을 칩 손상 없이 임의의 기판에 높은 수율로 전사할 수 있었다.
이건재 교수는 “이번에 개발된 마이크로진공 전사 기술은 가파르게 성장하는 마이크로 LED 시장에서 높은 생산 원가를 절감하고 중저가 마이크로 LED 제품 양산화의 핵심 기술로 활용될 것이 기대된다”면서, “현재 얇은 핀으로 칩을 들어 올리는 이젝터 시스템을 적용해 대량의 상용 마이크로 LED를 전사하고, 이를 통해 차세대 디스플레이(대형 TV, 유연․신축성 기기 등) 뿐만 아니라 광-바이오 융합형 미용 면발광 패치 상용화를 진행 중이다”라고 말했다.
한편 이번 연구는 웨어러블플랫폼 소재기술 센터, 중견연구자지원사업, 소부장 전략협력 기술개발사업의 지원을 받아 수행됐으며, 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 11월 26일 자 출판됐다.
원하는 색깔의 마이크로 LED 전사 기술 개발
기존 OLED 등과 비해 전기적·광학적 특성이 우수한 마이크로 LED는 머리카락 두께인 100마이크로미터(μm) 이하 크기의 무기물 LED 칩을 활용하는 차세대 디스플레이용 광원이다. 마이크로 LED의 상용화를 위해선 성장 기판에 배열된 대량의 마이크로 LED 칩을 최종 기판의 정확한 위치에 원하는 배열로 옮기는 ‘전사 공정’이 가장 중요한 핵심기술이지만, 기존 전사 기술들은 별도의 접착제 사용, 정렬 오차, 낮은 수율, 칩 손상 등으로 마이크로 LED 상용화에 많은 어려움이 존재했다.
우리 대학 신소재공학과 이건재 교수 연구팀이 마이크로진공 흡입력을 조절해 대량의 마이크로 LED 칩을 색깔별 원하는 칩들만 선택적으로 전사하는 기술을 개발했다고 19일 밝혔다.
이 교수팀은 레이저빔 조사시 물질 특성을 조정하여 식각하는 레이저 유도 에칭(Laser-induced etching, LIE) 기술을 활용해 미세 관통홀을 유리 기판에 초당 7,000개 속도로 형성했고, 이를 진공 채널에 연결해 미세진공 흡입력을 발생시켜 마이크로 LED를 전사하는 데 성공했다. 이 기술은 기존 전사 기술 대비 뛰어난 접착력 전환성을 달성하였으며, 다수의 진공 채널별 독립적인 진공 조절을 통해 대량의 마이크로 LED 칩을 선택적으로 전사하였다. 또한 다양한 재료, 크기, 모양, 두께를 지닌 초소형 반도체 칩들을 칩 손상 없이 임의의 기판에 높은 수율로 전사할 수 있었다.
이건재 교수는 “이번에 개발된 마이크로진공 전사 기술은 가파르게 성장하는 마이크로 LED 시장에서 높은 생산 원가를 절감하고 중저가 마이크로 LED 제품 양산화의 핵심 기술로 활용될 것이 기대된다”면서, “현재 얇은 핀으로 칩을 들어 올리는 이젝터 시스템을 적용해 대량의 상용 마이크로 LED를 전사하고, 이를 통해 차세대 디스플레이(대형 TV, 유연․신축성 기기 등) 뿐만 아니라 광-바이오 융합형 미용 면발광 패치 상용화를 진행 중이다”라고 말했다.
한편 이번 연구는 웨어러블플랫폼 소재기술 센터, 중견연구자지원사업, 소부장 전략협력 기술개발사업의 지원을 받아 수행됐으며, 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 11월 26일 자 출판됐다.
2023.12.19
조회수 9217
-
 RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27
조회수 8936
-
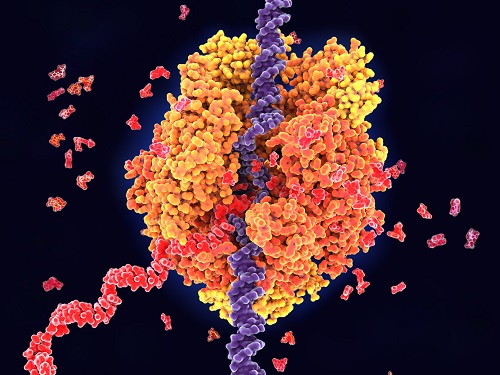 RNA를 통한 유전자 전사 조절 원리 규명
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
RNA를 통한 유전자 전사 조절 원리 규명
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
2022.09.07
조회수 13425
-
 합성생물학 기반 차세대 미생물 대사 조절 밸브 개발
국제 공동연구진이 대장균의 모든 전사종결부위*를 해독하고, 이를 바탕으로 미생물의 대사 경로를 수도꼭지처럼 자유자재로 조절하는 합성생물학** 기반 차세대 대사 조절 밸브 기술을 개발했다.
*전사종결부위: DNA가 암호화하는 정보를 RNA로 전사할 때, RNA 합성이 종결되도록 조절하는 DNA 서열
**합성생물학: 생명현상의 복잡성, 다양성으로 인해 발생하는 낮은 재현성, 예측효율 저하 등의 기존 바이오기술의 문제를 해결하기 위해 생명체의 구성요소를 설계, 제작, 조립하는 공학적 접근방식의 바이오 기술
우리 대학 생명과학과 조병관 교수, 한국생명공학연구원 이승구 박사, 바이오융합연구소 조수형 교수, 미국 캘리포니아대학교 샌디에이고(UCSD) 생명공학과(Bioengineering)의 최동희 박사, 버나드 팔슨(Bernhard Palsson) 교수 국제 공동연구팀이 대장균에 존재하는 1,600여 개의 전사종결부위를 대량으로 해독 및 발굴하고, 이를 기반으로 고부가가치 바이오화합물 생산을 위한 미생물 대사 회로 설계를 가능케 하는 합성생물학 기반 기술을 개발했다고 14일 밝혔다.
전사종결부위는 DNA가 암호화하는 유전 정보가 RNA로 전사될 때, 원하는 유전자만이 정확히 전사되도록 조절하는 역할을 한다. 그 중요성에도 불구하고 기존에는 전사 종결에 관한 데이터의 부족으로, 구체적인 조절 기작에 대한 이해가 부족했다. 연구진은 전사종결부위가 다양한 세기를 가져 인접한 유전자들의 발현을 정교하게 조절한다는 사실을 발견하고, 이를 대사회로 조절에 이용했다.
한편 미생물은 다양한 유용 바이오화합물 생산에 이용되고 있는데, 효율적인 생산을 위해서는 대사 회로의 조절이 필수적이다. 그 이유는 단순히 원하는 물질 생산을 위한 유전자만을 과도하게 발현할 경우, 미생물 생장에 필요한 양분과 에너지까지 소모해 생산에 실패하기 때문이다. 공동연구진은 개발한 전사종결부위를 통해 서로 다른 대사 회로의 세기를 수도꼭지처럼 조절해 대사물질 생산을 최적화할 수 있는 '대사 밸브 기술'을 개발했다.
기존에는 전사의 시작이 되는 프로모터, 번역의 시작이 되는 리보솜 결합 부위를 통해 유전자 발현을 조절했는데, 이에는 수많은 인자가 관여하고 있어 실험 간 편차가 크고, 고가의 화학물질을 요구하는 등 한계를 지니고 있었다. 하지만 연구진이 개발한 대사 밸브는 실험 간 편차를 기존 시스템 대비 최대 75% 억제할 수 있는 것으로 나타났고, 대사 밸브를 이용한 생산 최적화를 통해 유용 대사물질인 비타민 B8의 생산을 최대 11배 증대하는 데 성공했다.
또한 개발된 기술은 미생물의 생장 조건(영양분 및 배양 환경)에 거의 영향을 받지 않는 것으로 나타나 실험실 조건에서 출발해 산업 규모로 확장할 시 부수적인 최적화 과정을 최소화할 수 있고, 목적 화합물에 따라 첨가하는 원료와 배양 조건이 변화해도 조절 기작이 유지되는 것으로 나타났다.
이번 연구 결과는 기존에 알려지지 않았던 전사종결부위의 특성을 규명하고, 이를 대사 조절에 이용한 획기적인 시도로 차세대 대사 조절 합성생물학 기반 기술로 기대받고 있다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 프로그램 및 한국 바이오 그랜드챌린지 프로그램의 지원을 받은 KAIST 조병관 교수 연구진과 한국생명공학연구원이 추진하는 KRIBB 연구 혁신 프로그램(Research Initiative Program)의 지원을 받은 이승구 박사(한국생명공학연구원), 기초과학 연구 프로그램(Basic Science Research Program)의 지원을 받은 KAIST 조수형 교수, 노보 노르디스크 재단(Novo Nordisk Foundation)의 연구지원을 받은 버나드 팔슨(Bernhard Palsson) 교수 연구진의 협업을 통해 수행됐으며, 국제적인 학술지인 `핵산 연구(Nucleic Acids Research, 영향력지수 16.971)' 에 3월 31일 게재됐다.
(논문명 : Synthetic 3'-UTR valves for optimal metabolic flux control in Escherichia coli)
합성생물학 기반 차세대 미생물 대사 조절 밸브 개발
국제 공동연구진이 대장균의 모든 전사종결부위*를 해독하고, 이를 바탕으로 미생물의 대사 경로를 수도꼭지처럼 자유자재로 조절하는 합성생물학** 기반 차세대 대사 조절 밸브 기술을 개발했다.
*전사종결부위: DNA가 암호화하는 정보를 RNA로 전사할 때, RNA 합성이 종결되도록 조절하는 DNA 서열
**합성생물학: 생명현상의 복잡성, 다양성으로 인해 발생하는 낮은 재현성, 예측효율 저하 등의 기존 바이오기술의 문제를 해결하기 위해 생명체의 구성요소를 설계, 제작, 조립하는 공학적 접근방식의 바이오 기술
우리 대학 생명과학과 조병관 교수, 한국생명공학연구원 이승구 박사, 바이오융합연구소 조수형 교수, 미국 캘리포니아대학교 샌디에이고(UCSD) 생명공학과(Bioengineering)의 최동희 박사, 버나드 팔슨(Bernhard Palsson) 교수 국제 공동연구팀이 대장균에 존재하는 1,600여 개의 전사종결부위를 대량으로 해독 및 발굴하고, 이를 기반으로 고부가가치 바이오화합물 생산을 위한 미생물 대사 회로 설계를 가능케 하는 합성생물학 기반 기술을 개발했다고 14일 밝혔다.
전사종결부위는 DNA가 암호화하는 유전 정보가 RNA로 전사될 때, 원하는 유전자만이 정확히 전사되도록 조절하는 역할을 한다. 그 중요성에도 불구하고 기존에는 전사 종결에 관한 데이터의 부족으로, 구체적인 조절 기작에 대한 이해가 부족했다. 연구진은 전사종결부위가 다양한 세기를 가져 인접한 유전자들의 발현을 정교하게 조절한다는 사실을 발견하고, 이를 대사회로 조절에 이용했다.
한편 미생물은 다양한 유용 바이오화합물 생산에 이용되고 있는데, 효율적인 생산을 위해서는 대사 회로의 조절이 필수적이다. 그 이유는 단순히 원하는 물질 생산을 위한 유전자만을 과도하게 발현할 경우, 미생물 생장에 필요한 양분과 에너지까지 소모해 생산에 실패하기 때문이다. 공동연구진은 개발한 전사종결부위를 통해 서로 다른 대사 회로의 세기를 수도꼭지처럼 조절해 대사물질 생산을 최적화할 수 있는 '대사 밸브 기술'을 개발했다.
기존에는 전사의 시작이 되는 프로모터, 번역의 시작이 되는 리보솜 결합 부위를 통해 유전자 발현을 조절했는데, 이에는 수많은 인자가 관여하고 있어 실험 간 편차가 크고, 고가의 화학물질을 요구하는 등 한계를 지니고 있었다. 하지만 연구진이 개발한 대사 밸브는 실험 간 편차를 기존 시스템 대비 최대 75% 억제할 수 있는 것으로 나타났고, 대사 밸브를 이용한 생산 최적화를 통해 유용 대사물질인 비타민 B8의 생산을 최대 11배 증대하는 데 성공했다.
또한 개발된 기술은 미생물의 생장 조건(영양분 및 배양 환경)에 거의 영향을 받지 않는 것으로 나타나 실험실 조건에서 출발해 산업 규모로 확장할 시 부수적인 최적화 과정을 최소화할 수 있고, 목적 화합물에 따라 첨가하는 원료와 배양 조건이 변화해도 조절 기작이 유지되는 것으로 나타났다.
이번 연구 결과는 기존에 알려지지 않았던 전사종결부위의 특성을 규명하고, 이를 대사 조절에 이용한 획기적인 시도로 차세대 대사 조절 합성생물학 기반 기술로 기대받고 있다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 프로그램 및 한국 바이오 그랜드챌린지 프로그램의 지원을 받은 KAIST 조병관 교수 연구진과 한국생명공학연구원이 추진하는 KRIBB 연구 혁신 프로그램(Research Initiative Program)의 지원을 받은 이승구 박사(한국생명공학연구원), 기초과학 연구 프로그램(Basic Science Research Program)의 지원을 받은 KAIST 조수형 교수, 노보 노르디스크 재단(Novo Nordisk Foundation)의 연구지원을 받은 버나드 팔슨(Bernhard Palsson) 교수 연구진의 협업을 통해 수행됐으며, 국제적인 학술지인 `핵산 연구(Nucleic Acids Research, 영향력지수 16.971)' 에 3월 31일 게재됐다.
(논문명 : Synthetic 3'-UTR valves for optimal metabolic flux control in Escherichia coli)
2022.04.17
조회수 13366
-
 RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30
조회수 10748
-
 인공지능 기술을 이용한 유전자 전사인자 예측 시스템 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 미국 캘리포니아대학교 샌디에이고캠퍼스(UCSD) 생명공학과 버나드 팔슨(Bernhard Palsson) 교수 공동연구팀이 인공지능을 이용해 단백질 서열로부터 *전사인자를 예측하는 시스템인 '딥티팩터(DeepTFactor)'를 개발했다고 29일 밝혔다. 이번 연구는 국제학술지인 '미국국립과학원회보(PNAS)'에 12월 28일 字 게재됐다. (논문명: DeepTFactor: A deep learning-based tool for the prediction of transcription factors)
※ 전사인자 (transcription factor) : 유전자의 전사(유전 정보를 복사하는 과정)를 조절하는 단백질. 특정 DNA 서열에 특이적으로 결합해 유전자의 전사를 조절한다.
※ 저자 정보 : 김기배(한국과학기술원, 제1 저자), 예 가오(Ye Gao) (UCSD, 제2 저자), 버나드 팔슨(Bernhard Palsson) (UCSD, 제3 저자), 이상엽(교신저자) 포함 총 4명
전사인자는 특정한 DNA 서열에 특이적으로 결합해 유전자의 전사(유전 정보를 복사하는 과정)를 조절하는 단백질이다. 전사인자로 인한 유전자 전사를 분석함으로써 유기체가 유전적 또는 환경적 변화에 어떻게 반응해 유전자의 발현을 제어하는지 이해할 수 있다. 이러한 점에서 유기체의 전사인자를 찾는 것은 유기체의 전사 조절 시스템 분석을 위한 첫 단계라고 할 수 있다.
지금까지 새로운 전사인자를 찾기 위해서는 이미 알려진 전사인자와의 상동성(유사한 성질)을 분석하거나, 기계학습(머신러닝)과 같은 데이터 기반의 접근 방식을 이용했다. 기존의 기계학습 모델을 이용하기 위해서는 분자의 물리 화학적 특성을 계산하거나, 생물학적 서열의 상동성을 분석하는 등, 해결하고자 하는 문제에 대한 전문 지식에 의존해 모델의 입력값으로 사용할 특징을 찾아내는 과정이 필요하다.
한편, 심층 학습(딥러닝)은 문제 해결을 위한 잠재적인 특징을 내재적으로 학습할 수 있기에 최근 다양한 생물학 분야에서 활용되고 있다. 하지만, 심층 학습을 이용한 예측 시스템의 경우 시스템 내부의 복잡한 연산 때문에 추론 과정을 직접 확인할 수 없는 `블랙박스(black box)'라는 특징을 가지고 있다.
공동연구팀은 심층 학습 기법을 이용해 주어진 단백질 서열이 전사인자인지 예측할 수 있는 시스템인 딥티팩터(DeepTFactor)를 개발했다. 딥티팩터는 단백질 서열로부터 전사인자를 예측하기 위해 세 개의 병렬적인 합성곱 신경망(convolutional neural network)을 이용한다. 공동연구팀은 딥티팩터를 이용해 대장균(Escherichia coli K-12 MG1655)의 전사인자 332개를 예측했으며, 그중 3개의 전사인자의 게놈 전체 결합 위치(genome-wide binding site)를 실험으로 확인함으로써 딥티팩터의 성능을 검증했다.
공동연구팀은 나아가 딥티팩터의 추론 과정을 이해하기 위해 특징 지도 (saliency map) 기반의 심층 학습 모델 해석 방법론을 사용했다. 이를 통해 딥티팩터의 학습 과정에서 전사인자의 DNA의 결합 영역에 대한 정보가 명시적으로 주어지지 않았지만, 내재적으로 이를 학습해 예측에 활용한다는 사실을 확인했다.
연구팀 관계자에 따르면, 특정 생물군의 단백질 서열만을 위해 개발됐던 이전 예측 방법론들과 달리, 딥티팩터는 모든 생물군의 단백질 서열에서 우수한 성능을 보여 다양한 유기체의 전사 시스템 분석에 활용 가능할 것으로 기대된다.
이상엽 특훈교수는 “이번 연구에서 개발한 딥티팩터를 이용해서 새롭게 발견되는 단백질 서열과 아직 특성화되지 않은 수많은 단백질 서열을 높은 처리 능력으로 분석할 수 있게 됐다”며 “이는 유기체의 전자 조절 네트워크 분석을 위한 기초 기술로써 활용 가능할 것”이라고 밝혔다.
한편, 이번 연구는 과기정통부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 지원을 받아 수행됐다.
인공지능 기술을 이용한 유전자 전사인자 예측 시스템 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 미국 캘리포니아대학교 샌디에이고캠퍼스(UCSD) 생명공학과 버나드 팔슨(Bernhard Palsson) 교수 공동연구팀이 인공지능을 이용해 단백질 서열로부터 *전사인자를 예측하는 시스템인 '딥티팩터(DeepTFactor)'를 개발했다고 29일 밝혔다. 이번 연구는 국제학술지인 '미국국립과학원회보(PNAS)'에 12월 28일 字 게재됐다. (논문명: DeepTFactor: A deep learning-based tool for the prediction of transcription factors)
※ 전사인자 (transcription factor) : 유전자의 전사(유전 정보를 복사하는 과정)를 조절하는 단백질. 특정 DNA 서열에 특이적으로 결합해 유전자의 전사를 조절한다.
※ 저자 정보 : 김기배(한국과학기술원, 제1 저자), 예 가오(Ye Gao) (UCSD, 제2 저자), 버나드 팔슨(Bernhard Palsson) (UCSD, 제3 저자), 이상엽(교신저자) 포함 총 4명
전사인자는 특정한 DNA 서열에 특이적으로 결합해 유전자의 전사(유전 정보를 복사하는 과정)를 조절하는 단백질이다. 전사인자로 인한 유전자 전사를 분석함으로써 유기체가 유전적 또는 환경적 변화에 어떻게 반응해 유전자의 발현을 제어하는지 이해할 수 있다. 이러한 점에서 유기체의 전사인자를 찾는 것은 유기체의 전사 조절 시스템 분석을 위한 첫 단계라고 할 수 있다.
지금까지 새로운 전사인자를 찾기 위해서는 이미 알려진 전사인자와의 상동성(유사한 성질)을 분석하거나, 기계학습(머신러닝)과 같은 데이터 기반의 접근 방식을 이용했다. 기존의 기계학습 모델을 이용하기 위해서는 분자의 물리 화학적 특성을 계산하거나, 생물학적 서열의 상동성을 분석하는 등, 해결하고자 하는 문제에 대한 전문 지식에 의존해 모델의 입력값으로 사용할 특징을 찾아내는 과정이 필요하다.
한편, 심층 학습(딥러닝)은 문제 해결을 위한 잠재적인 특징을 내재적으로 학습할 수 있기에 최근 다양한 생물학 분야에서 활용되고 있다. 하지만, 심층 학습을 이용한 예측 시스템의 경우 시스템 내부의 복잡한 연산 때문에 추론 과정을 직접 확인할 수 없는 `블랙박스(black box)'라는 특징을 가지고 있다.
공동연구팀은 심층 학습 기법을 이용해 주어진 단백질 서열이 전사인자인지 예측할 수 있는 시스템인 딥티팩터(DeepTFactor)를 개발했다. 딥티팩터는 단백질 서열로부터 전사인자를 예측하기 위해 세 개의 병렬적인 합성곱 신경망(convolutional neural network)을 이용한다. 공동연구팀은 딥티팩터를 이용해 대장균(Escherichia coli K-12 MG1655)의 전사인자 332개를 예측했으며, 그중 3개의 전사인자의 게놈 전체 결합 위치(genome-wide binding site)를 실험으로 확인함으로써 딥티팩터의 성능을 검증했다.
공동연구팀은 나아가 딥티팩터의 추론 과정을 이해하기 위해 특징 지도 (saliency map) 기반의 심층 학습 모델 해석 방법론을 사용했다. 이를 통해 딥티팩터의 학습 과정에서 전사인자의 DNA의 결합 영역에 대한 정보가 명시적으로 주어지지 않았지만, 내재적으로 이를 학습해 예측에 활용한다는 사실을 확인했다.
연구팀 관계자에 따르면, 특정 생물군의 단백질 서열만을 위해 개발됐던 이전 예측 방법론들과 달리, 딥티팩터는 모든 생물군의 단백질 서열에서 우수한 성능을 보여 다양한 유기체의 전사 시스템 분석에 활용 가능할 것으로 기대된다.
이상엽 특훈교수는 “이번 연구에서 개발한 딥티팩터를 이용해서 새롭게 발견되는 단백질 서열과 아직 특성화되지 않은 수많은 단백질 서열을 높은 처리 능력으로 분석할 수 있게 됐다”며 “이는 유기체의 전자 조절 네트워크 분석을 위한 기초 기술로써 활용 가능할 것”이라고 밝혔다.
한편, 이번 연구는 과기정통부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 지원을 받아 수행됐다.
2020.12.30
조회수 58369
-
 세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28
조회수 52966
-
 노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26
조회수 48623
 정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
2025.07.03 조회수 421
정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
2025.07.03 조회수 421 간 조직 속 노화 신호 미리 잡아 질병 예측한다
노화나 만성 질환은 장기간에 걸쳐 미세한 조직 변화가 서서히 축적되는 과정을 거치기 때문에, 장기 내 이러한 변화를 정량적으로 파악하고, 이를 질병 발병의 초기 신호와 연결하는 데에는 여전히 한계가 있다. 이에 우리 연구진이 조직 안에서 처음 문제가 생기는 국소적인 변화를 정확히 포착해, 질병을 더 빠르게 발견하고 예측하며, 맞춤형 치료 타깃을 설정하는 데 큰 도움이 될 플랫폼 기술을 개발하는 데 성공했다.
우리 대학 의과학대학원 박종은 교수, 한국생명공학연구원(KRIBB, 원장 권석윤) 노화융합연구단 김천아 박사 공동 연구팀이 노화 간 조직 내에서 국소적으로 발생하는 섬유화된 미세환경을 포착하고 이를 *단일세포 전사체 수준으로 정밀 분석*할 수 있는 ‘파이니-시퀀싱(FiNi-seq, Fibrotic Niche enrichment sequencing)’기술을 개발했다고 12일 밝혔다.
*단일세포 전사체 분석: 세포 하나하나가 어떤 유전자를 얼마나 활발히 사용하고 있는지를 측정하는 방법으로 세포별 병든 세포의 정체와 기능을 파악할 수 있게 해줌
연구진은 노화된 간 조직에서 조직 분해 저항성이 높은 영역을 물리적 성질을 통해 선별하는 방법을 통해, 재생이 지연되고 섬유화가 축적되는 초기 노화 미세환경을 선택적으로 농축하는 방법을 개발했다.
이 과정에서 기존의 단일세포 분석 기술로는 포착하기 어려웠던 섬유화 관련 혈관내피세포와 면역과 상호작용을 하는 섬유아세포, PD-1 고발현 CD8 T세포 등 면역 탈진세포를 고해상도로 확인할 수 있었다.
특히 연구진은 ‘FiNi-seq’ 기술을 통해 노화 간 조직 내 섬유화 부위에서 관찰되는 특정 세포들이 분비 인자를 통해 주변 환경을 이차적으로 노화시키고, 이로 인해 노화된 환경이 확장된다는 것을 확인했다.
또한, 혈관내피세포가 조직 고유의 정체성을 상실하고 선천면역 반응을 유도해 면역세포 유입을 촉진하는 메커니즘도 규명했다. 공간 전사체 분석을 통해 면역세포와 상호작용을 하는 섬유아세포의 공간적 분포를 정량화하고, 이들이 조직 재생, 염증 반응의 유도, 만성 섬유화로의 이행에 관여함을 밝혔다.
연구팀은 전사체와 후성유전체 정보를 얻어내는 멀티-오믹스* 데이터를 통합 분석해 노화된 간 조직의 미세환경과 이의 공간적 이질성을 정밀하게 해석했으며, 이러한 변화들이 간 내 혈관 구조와 어떻게 연결되는지 확인했다.
*멀티-오믹스(multi-omics): 유전자, 단백질, 대사물질, 세포 정보 등 생물체 내 다양한 생체 정보를 통합적으로 분석하는 방법
이번에 개발된 ‘FiNi-seq’ 기술은 섬유화를 유발하는 노화 과정을 포함해 대부분의 만성 간질환에서 병태생리적 신호를 고해상도로 포착하는 데 유용한 플랫폼으로 기대된다.
제1 저자인 의과학대학원 탁권용 박사는 서울성모병원 소화기내과의 간 전문의로, 의사과학자 양성 사업의 지원을 받아 우리 대학 의과학대학원에서 박사 학위를 수행하며 만성 간질환에서 가장 중요한 임상 예후 지표인 섬유화의 진행을 조기에 진단하고 치료할 수 있는 기반을 마련하기 위해 이번 연구를 설계했다. 공동 제 1 저자인 의과학대학원 박명선 박사과정생은 FiNi-seq 기술의 기술적 구현을, KRIBB 노화융합연구단의 김주연 박사과정생은 노화 조직의 이미징 분석을 담당하여 연구에 핵심적 역할을 수행했다.
KRIBB 김천아 박사는 “이번 연구를 통해 노화 간 조직에서 관찰되는 섬유화된 미세환경의 세포 구성과 공간적 특성을 단일세포 수준에서 정밀하게 규명할 수 있었다”고 말했다.
의과학대학원 박종은 교수는 “노화 및 만성질환 초기 단계에서 발생하는 섬세한 변화를 조기에 포착할 수 있는 분석 기술로서, 향후 효과적인 치료 지점을 찾는데 큰 역할을 할 수 있을 것으로 기대된다. 또한, 다양한 간질환 모델뿐만 아니라 폐, 신장 등 다른 장기의 만성 질환 연구로 확장해서 진행할 예정이다”라고 밝혔다.
이 연구는 의과학대학원 탁권용 박사, KRIBB 박사과정 김주연 연구원, 우리 대학 박사과정 박명선 학생이 제1 공동저자로 국제 학술지 ‘네이처 에이징(Nature Aging)’ 2025년 5월 5일 자에 게재됐다.
※논문제목: Quasi-spatial single-cell transcriptome based on physical tissue properties defines early aging associated niche in liver
※DOI: https://doi.org/10.1038/s43587-025-00857-7
이번 연구는 한국연구재단, 한국보건산업진흥원(KHIDI), 한국생명공학연구원KRIBB, KIST, 포스코사이언스펠로우십, 융합형의사과학자 양성사업 등 국내 여러 기관의 지원을 받아 수행됐다.
2025.06.12 조회수 1351
간 조직 속 노화 신호 미리 잡아 질병 예측한다
노화나 만성 질환은 장기간에 걸쳐 미세한 조직 변화가 서서히 축적되는 과정을 거치기 때문에, 장기 내 이러한 변화를 정량적으로 파악하고, 이를 질병 발병의 초기 신호와 연결하는 데에는 여전히 한계가 있다. 이에 우리 연구진이 조직 안에서 처음 문제가 생기는 국소적인 변화를 정확히 포착해, 질병을 더 빠르게 발견하고 예측하며, 맞춤형 치료 타깃을 설정하는 데 큰 도움이 될 플랫폼 기술을 개발하는 데 성공했다.
우리 대학 의과학대학원 박종은 교수, 한국생명공학연구원(KRIBB, 원장 권석윤) 노화융합연구단 김천아 박사 공동 연구팀이 노화 간 조직 내에서 국소적으로 발생하는 섬유화된 미세환경을 포착하고 이를 *단일세포 전사체 수준으로 정밀 분석*할 수 있는 ‘파이니-시퀀싱(FiNi-seq, Fibrotic Niche enrichment sequencing)’기술을 개발했다고 12일 밝혔다.
*단일세포 전사체 분석: 세포 하나하나가 어떤 유전자를 얼마나 활발히 사용하고 있는지를 측정하는 방법으로 세포별 병든 세포의 정체와 기능을 파악할 수 있게 해줌
연구진은 노화된 간 조직에서 조직 분해 저항성이 높은 영역을 물리적 성질을 통해 선별하는 방법을 통해, 재생이 지연되고 섬유화가 축적되는 초기 노화 미세환경을 선택적으로 농축하는 방법을 개발했다.
이 과정에서 기존의 단일세포 분석 기술로는 포착하기 어려웠던 섬유화 관련 혈관내피세포와 면역과 상호작용을 하는 섬유아세포, PD-1 고발현 CD8 T세포 등 면역 탈진세포를 고해상도로 확인할 수 있었다.
특히 연구진은 ‘FiNi-seq’ 기술을 통해 노화 간 조직 내 섬유화 부위에서 관찰되는 특정 세포들이 분비 인자를 통해 주변 환경을 이차적으로 노화시키고, 이로 인해 노화된 환경이 확장된다는 것을 확인했다.
또한, 혈관내피세포가 조직 고유의 정체성을 상실하고 선천면역 반응을 유도해 면역세포 유입을 촉진하는 메커니즘도 규명했다. 공간 전사체 분석을 통해 면역세포와 상호작용을 하는 섬유아세포의 공간적 분포를 정량화하고, 이들이 조직 재생, 염증 반응의 유도, 만성 섬유화로의 이행에 관여함을 밝혔다.
연구팀은 전사체와 후성유전체 정보를 얻어내는 멀티-오믹스* 데이터를 통합 분석해 노화된 간 조직의 미세환경과 이의 공간적 이질성을 정밀하게 해석했으며, 이러한 변화들이 간 내 혈관 구조와 어떻게 연결되는지 확인했다.
*멀티-오믹스(multi-omics): 유전자, 단백질, 대사물질, 세포 정보 등 생물체 내 다양한 생체 정보를 통합적으로 분석하는 방법
이번에 개발된 ‘FiNi-seq’ 기술은 섬유화를 유발하는 노화 과정을 포함해 대부분의 만성 간질환에서 병태생리적 신호를 고해상도로 포착하는 데 유용한 플랫폼으로 기대된다.
제1 저자인 의과학대학원 탁권용 박사는 서울성모병원 소화기내과의 간 전문의로, 의사과학자 양성 사업의 지원을 받아 우리 대학 의과학대학원에서 박사 학위를 수행하며 만성 간질환에서 가장 중요한 임상 예후 지표인 섬유화의 진행을 조기에 진단하고 치료할 수 있는 기반을 마련하기 위해 이번 연구를 설계했다. 공동 제 1 저자인 의과학대학원 박명선 박사과정생은 FiNi-seq 기술의 기술적 구현을, KRIBB 노화융합연구단의 김주연 박사과정생은 노화 조직의 이미징 분석을 담당하여 연구에 핵심적 역할을 수행했다.
KRIBB 김천아 박사는 “이번 연구를 통해 노화 간 조직에서 관찰되는 섬유화된 미세환경의 세포 구성과 공간적 특성을 단일세포 수준에서 정밀하게 규명할 수 있었다”고 말했다.
의과학대학원 박종은 교수는 “노화 및 만성질환 초기 단계에서 발생하는 섬세한 변화를 조기에 포착할 수 있는 분석 기술로서, 향후 효과적인 치료 지점을 찾는데 큰 역할을 할 수 있을 것으로 기대된다. 또한, 다양한 간질환 모델뿐만 아니라 폐, 신장 등 다른 장기의 만성 질환 연구로 확장해서 진행할 예정이다”라고 밝혔다.
이 연구는 의과학대학원 탁권용 박사, KRIBB 박사과정 김주연 연구원, 우리 대학 박사과정 박명선 학생이 제1 공동저자로 국제 학술지 ‘네이처 에이징(Nature Aging)’ 2025년 5월 5일 자에 게재됐다.
※논문제목: Quasi-spatial single-cell transcriptome based on physical tissue properties defines early aging associated niche in liver
※DOI: https://doi.org/10.1038/s43587-025-00857-7
이번 연구는 한국연구재단, 한국보건산업진흥원(KHIDI), 한국생명공학연구원KRIBB, KIST, 포스코사이언스펠로우십, 융합형의사과학자 양성사업 등 국내 여러 기관의 지원을 받아 수행됐다.
2025.06.12 조회수 1351 세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
2024.05.22 조회수 7938
세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
2024.05.22 조회수 7938 개인 맞춤형 정밀 의학 정확도 높일 ‘렌즈’ 개발
평균이 아닌 개인차를 고려하는 정밀 의학 시대가 열렸다. 사람마다 다른 유전적 특징을 알아내는 기술이 비약적으로 발전한 덕분이다. 더 빠르고, 정확하게 전사체를 해독할 수 있는 새로운 도구가 개발됐다. 우리 대학 수리과학과 김재경 교수(IBS 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 전사체 분석 빅데이터에서 유용한 생물학적 정보만 골라내는 새로운 도구인 ‘scLENS(single-cell Low-dimension Embedding using Effective Noise Subtraction)’를 개발했다.
단일세포 전사체 분석은 최근 생물학, 신약 개발, 임상 연구 등 여러 분야에서 주목받는 도구다. 개별 세포 단위에서 유전적 변화를 확인할 수 있기 때문이다. 가령, 단일세포 전사체 분석을 이용하면 암 조직 내 수십 가지 종류의 세포를 구분하고, 유전적 변이가 발생한 세포만 표적하는 정밀 치료가 가능해진다.
단일세포 전사체 분석 기술이 임상에 광범위하게 이용되려면, 도출되는 빅데이터에서 유용한 생물학적 신호를 찾아내는 효율적인 분석 도구 개발이 선행돼야 한다. 단일세포 전사체 분석은 수백~수천 개에 이르는 개별 세포의 수만 개에 이르는 다양한 유전자 발현량을 측정하기 때문에 데이터 용량이 수~수십 GB에 달한다. 이 방대한 데이터 중 생물학적으로 유용한 신호는 3% 내외에 불과하다.
이 방대하고 노이즈(잡신호)가 많은 데이터에서 유용한 생물학적 신호를 골라내기 위해 지금까지 여러 데이터 처리 도구가 개발됐다. 하지만 기존 도구는 사용자가 생물학적 신호와 노이즈의 ‘경계선’을 직접 설정해야 해서 주관이 개입됐다. 즉, 분석가에 따라 결과가 크게 달라지고, 정확도가 떨어진다는 한계가 있었다.
우선, 연구진은 기존 분석 도구들이 부정확한 근본적인 원인을 규명하고 해결책을 제시했다. 사용자가 노이즈의 임계값을 결정하는 데이터 전처리 방식 자체가 생물학적 신호를 왜곡시킨다는 것을 규명하고, 왜곡 없는 새로운 전처리 방식을 개발했다. 나아가 연구진은 수학적 방법론인 ‘랜덤 행렬 이론’을 이용해 사용자의 주관적 선택 없이 자동으로 단일세포 전사체 분석 데이터에서 신호와 노이즈를 구별하는 프로그램인 ‘scLENS’를 개발했다.
제1 저자인 김현 연구원은 “scLENS는 사용자의 선택 없이 데이터에 내재된 구조만을 이용해 자동으로 신호와 노이즈를 구별하기 때문에 사용자 편향성 문제를 원천 차단할 수 있다”며 “연구자들의 노동집약적인 신호 선택 과정을 없애면서도 분석 정확성은 높였다”고 설명했다.
이어 연구진은 기존 개발된 11가지 데이터 분석 프로그램과 scLENS의 상대적 성능을 비교했다. 이를 통해 scLENS가 다른 모든 프로그램보다 우수한 성능을 보인다는 점을 확인할 수 있었다. 널리 쓰이는 프로그램인 ‘Seurat’과 비교했을 때 scLENS는 세포 그룹화 성능이 약 10% 이상 우수하며, 데이터에 내재된 국소 구조를 43% 더 효과적으로 포착하는 것으로 나타났다.
특히, scLENS는 기존 프로그램보다 많은 계산을 하지만 메모리 사용 최적화를 통해 10만 개의 세포와 2만 개의 유전자로 이뤄진 대규모 데이터를 3시간 만에 분석하는 경쟁력 있는 분석 속도를 보였다.
연구를 이끈 김재경 CI는 “지난 십여 년간 단일세포 전사체를 분석할 수 있는 실험 기술의 비약적인 발전했지만, 데이터 분석 방법의 한계로 인해 큰 비용과 시간을 투자해 얻은 데이터를 최대한 활용하지 못하는 경우가 많았다”며 “기초 수학 이론이 생명과학 연구의 혁신을 견인하고, 감춰졌던 생명의 비밀을 빠르고 정확하게 밝히는 데 쓰일 수 있음을 보여주는 연구”라고 말했다.
연구결과는 4월 27일(한국시간) 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 16.6)’ 온라인판에 실렸다.
2024.05.09 조회수 7693
개인 맞춤형 정밀 의학 정확도 높일 ‘렌즈’ 개발
평균이 아닌 개인차를 고려하는 정밀 의학 시대가 열렸다. 사람마다 다른 유전적 특징을 알아내는 기술이 비약적으로 발전한 덕분이다. 더 빠르고, 정확하게 전사체를 해독할 수 있는 새로운 도구가 개발됐다. 우리 대학 수리과학과 김재경 교수(IBS 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 전사체 분석 빅데이터에서 유용한 생물학적 정보만 골라내는 새로운 도구인 ‘scLENS(single-cell Low-dimension Embedding using Effective Noise Subtraction)’를 개발했다.
단일세포 전사체 분석은 최근 생물학, 신약 개발, 임상 연구 등 여러 분야에서 주목받는 도구다. 개별 세포 단위에서 유전적 변화를 확인할 수 있기 때문이다. 가령, 단일세포 전사체 분석을 이용하면 암 조직 내 수십 가지 종류의 세포를 구분하고, 유전적 변이가 발생한 세포만 표적하는 정밀 치료가 가능해진다.
단일세포 전사체 분석 기술이 임상에 광범위하게 이용되려면, 도출되는 빅데이터에서 유용한 생물학적 신호를 찾아내는 효율적인 분석 도구 개발이 선행돼야 한다. 단일세포 전사체 분석은 수백~수천 개에 이르는 개별 세포의 수만 개에 이르는 다양한 유전자 발현량을 측정하기 때문에 데이터 용량이 수~수십 GB에 달한다. 이 방대한 데이터 중 생물학적으로 유용한 신호는 3% 내외에 불과하다.
이 방대하고 노이즈(잡신호)가 많은 데이터에서 유용한 생물학적 신호를 골라내기 위해 지금까지 여러 데이터 처리 도구가 개발됐다. 하지만 기존 도구는 사용자가 생물학적 신호와 노이즈의 ‘경계선’을 직접 설정해야 해서 주관이 개입됐다. 즉, 분석가에 따라 결과가 크게 달라지고, 정확도가 떨어진다는 한계가 있었다.
우선, 연구진은 기존 분석 도구들이 부정확한 근본적인 원인을 규명하고 해결책을 제시했다. 사용자가 노이즈의 임계값을 결정하는 데이터 전처리 방식 자체가 생물학적 신호를 왜곡시킨다는 것을 규명하고, 왜곡 없는 새로운 전처리 방식을 개발했다. 나아가 연구진은 수학적 방법론인 ‘랜덤 행렬 이론’을 이용해 사용자의 주관적 선택 없이 자동으로 단일세포 전사체 분석 데이터에서 신호와 노이즈를 구별하는 프로그램인 ‘scLENS’를 개발했다.
제1 저자인 김현 연구원은 “scLENS는 사용자의 선택 없이 데이터에 내재된 구조만을 이용해 자동으로 신호와 노이즈를 구별하기 때문에 사용자 편향성 문제를 원천 차단할 수 있다”며 “연구자들의 노동집약적인 신호 선택 과정을 없애면서도 분석 정확성은 높였다”고 설명했다.
이어 연구진은 기존 개발된 11가지 데이터 분석 프로그램과 scLENS의 상대적 성능을 비교했다. 이를 통해 scLENS가 다른 모든 프로그램보다 우수한 성능을 보인다는 점을 확인할 수 있었다. 널리 쓰이는 프로그램인 ‘Seurat’과 비교했을 때 scLENS는 세포 그룹화 성능이 약 10% 이상 우수하며, 데이터에 내재된 국소 구조를 43% 더 효과적으로 포착하는 것으로 나타났다.
특히, scLENS는 기존 프로그램보다 많은 계산을 하지만 메모리 사용 최적화를 통해 10만 개의 세포와 2만 개의 유전자로 이뤄진 대규모 데이터를 3시간 만에 분석하는 경쟁력 있는 분석 속도를 보였다.
연구를 이끈 김재경 CI는 “지난 십여 년간 단일세포 전사체를 분석할 수 있는 실험 기술의 비약적인 발전했지만, 데이터 분석 방법의 한계로 인해 큰 비용과 시간을 투자해 얻은 데이터를 최대한 활용하지 못하는 경우가 많았다”며 “기초 수학 이론이 생명과학 연구의 혁신을 견인하고, 감춰졌던 생명의 비밀을 빠르고 정확하게 밝히는 데 쓰일 수 있음을 보여주는 연구”라고 말했다.
연구결과는 4월 27일(한국시간) 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 16.6)’ 온라인판에 실렸다.
2024.05.09 조회수 7693 원하는 색깔의 마이크로 LED 전사 기술 개발
기존 OLED 등과 비해 전기적·광학적 특성이 우수한 마이크로 LED는 머리카락 두께인 100마이크로미터(μm) 이하 크기의 무기물 LED 칩을 활용하는 차세대 디스플레이용 광원이다. 마이크로 LED의 상용화를 위해선 성장 기판에 배열된 대량의 마이크로 LED 칩을 최종 기판의 정확한 위치에 원하는 배열로 옮기는 ‘전사 공정’이 가장 중요한 핵심기술이지만, 기존 전사 기술들은 별도의 접착제 사용, 정렬 오차, 낮은 수율, 칩 손상 등으로 마이크로 LED 상용화에 많은 어려움이 존재했다.
우리 대학 신소재공학과 이건재 교수 연구팀이 마이크로진공 흡입력을 조절해 대량의 마이크로 LED 칩을 색깔별 원하는 칩들만 선택적으로 전사하는 기술을 개발했다고 19일 밝혔다.
이 교수팀은 레이저빔 조사시 물질 특성을 조정하여 식각하는 레이저 유도 에칭(Laser-induced etching, LIE) 기술을 활용해 미세 관통홀을 유리 기판에 초당 7,000개 속도로 형성했고, 이를 진공 채널에 연결해 미세진공 흡입력을 발생시켜 마이크로 LED를 전사하는 데 성공했다. 이 기술은 기존 전사 기술 대비 뛰어난 접착력 전환성을 달성하였으며, 다수의 진공 채널별 독립적인 진공 조절을 통해 대량의 마이크로 LED 칩을 선택적으로 전사하였다. 또한 다양한 재료, 크기, 모양, 두께를 지닌 초소형 반도체 칩들을 칩 손상 없이 임의의 기판에 높은 수율로 전사할 수 있었다.
이건재 교수는 “이번에 개발된 마이크로진공 전사 기술은 가파르게 성장하는 마이크로 LED 시장에서 높은 생산 원가를 절감하고 중저가 마이크로 LED 제품 양산화의 핵심 기술로 활용될 것이 기대된다”면서, “현재 얇은 핀으로 칩을 들어 올리는 이젝터 시스템을 적용해 대량의 상용 마이크로 LED를 전사하고, 이를 통해 차세대 디스플레이(대형 TV, 유연․신축성 기기 등) 뿐만 아니라 광-바이오 융합형 미용 면발광 패치 상용화를 진행 중이다”라고 말했다.
한편 이번 연구는 웨어러블플랫폼 소재기술 센터, 중견연구자지원사업, 소부장 전략협력 기술개발사업의 지원을 받아 수행됐으며, 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 11월 26일 자 출판됐다.
2023.12.19 조회수 9217
원하는 색깔의 마이크로 LED 전사 기술 개발
기존 OLED 등과 비해 전기적·광학적 특성이 우수한 마이크로 LED는 머리카락 두께인 100마이크로미터(μm) 이하 크기의 무기물 LED 칩을 활용하는 차세대 디스플레이용 광원이다. 마이크로 LED의 상용화를 위해선 성장 기판에 배열된 대량의 마이크로 LED 칩을 최종 기판의 정확한 위치에 원하는 배열로 옮기는 ‘전사 공정’이 가장 중요한 핵심기술이지만, 기존 전사 기술들은 별도의 접착제 사용, 정렬 오차, 낮은 수율, 칩 손상 등으로 마이크로 LED 상용화에 많은 어려움이 존재했다.
우리 대학 신소재공학과 이건재 교수 연구팀이 마이크로진공 흡입력을 조절해 대량의 마이크로 LED 칩을 색깔별 원하는 칩들만 선택적으로 전사하는 기술을 개발했다고 19일 밝혔다.
이 교수팀은 레이저빔 조사시 물질 특성을 조정하여 식각하는 레이저 유도 에칭(Laser-induced etching, LIE) 기술을 활용해 미세 관통홀을 유리 기판에 초당 7,000개 속도로 형성했고, 이를 진공 채널에 연결해 미세진공 흡입력을 발생시켜 마이크로 LED를 전사하는 데 성공했다. 이 기술은 기존 전사 기술 대비 뛰어난 접착력 전환성을 달성하였으며, 다수의 진공 채널별 독립적인 진공 조절을 통해 대량의 마이크로 LED 칩을 선택적으로 전사하였다. 또한 다양한 재료, 크기, 모양, 두께를 지닌 초소형 반도체 칩들을 칩 손상 없이 임의의 기판에 높은 수율로 전사할 수 있었다.
이건재 교수는 “이번에 개발된 마이크로진공 전사 기술은 가파르게 성장하는 마이크로 LED 시장에서 높은 생산 원가를 절감하고 중저가 마이크로 LED 제품 양산화의 핵심 기술로 활용될 것이 기대된다”면서, “현재 얇은 핀으로 칩을 들어 올리는 이젝터 시스템을 적용해 대량의 상용 마이크로 LED를 전사하고, 이를 통해 차세대 디스플레이(대형 TV, 유연․신축성 기기 등) 뿐만 아니라 광-바이오 융합형 미용 면발광 패치 상용화를 진행 중이다”라고 말했다.
한편 이번 연구는 웨어러블플랫폼 소재기술 센터, 중견연구자지원사업, 소부장 전략협력 기술개발사업의 지원을 받아 수행됐으며, 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 11월 26일 자 출판됐다.
2023.12.19 조회수 9217 RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 8936
RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 8936 RNA를 통한 유전자 전사 조절 원리 규명
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
2022.09.07 조회수 13425
RNA를 통한 유전자 전사 조절 원리 규명
세포가 어떤 유전자를 얼마나 발현하느냐에 따라 그 세포의 모양, 기능, 수명 등이 결정되므로 유전정보를 처음으로 발현하는 RNA 합성효소의 활성은 세포 내에서 매우 중요하게, 또 정교하게 조절된다. 그러나 이러한 유전자 전사(transcription) 조절의 중요성에도 불구하고 RNA 합성효소가 이러한 단백질과 RNA들에 의해서 어떻게 조절되는지 분자적인 수준에서는 잘 알려져 있지 않았다.
☞ 유전자 전사: DNA의 유전정보가 RNA에 옮겨지는 과정을 말한다. 유전정보의 복사물인 RNA는 단백질 합성에 사용된다.
우리 대학 화학과 강진영 교수 연구팀이 RNA를 통한 RNA 합성효소의 조절 메커니즘을 알아내고자 RNA 합성효소와 RNA 합성효소를 조절하는 바이러스 유래 RNA인 *HK022 putRNA의 결합 구조를 초저온 전자현미경(cryo-EM)으로 규명하여 유전자 전사조절의 기초 원리를 규명했다고 7일 밝혔다.
*HK022 putRNA: HK022 박테리오파지(박테리아를 감염시키는 바이러스)의 RNA로 다른 단백질의 도움 없이 해당 RNA를 만든 RNA 중합효소와 결합해 RNA 합성이 계속 되도록 RNA 중합효소를 조절
화학과 황승하 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션즈 (Nature Communications)'에 지난 8월 15일 출판되었다. (논문명: Structural basis of transcriptional regulation by a nascent RNA element, HK022 putRNA).
HK022 putRNA는 RNA 합성효소와 결합해서 RNA 합성이 멈추지 않고 계속 되도록 도와주는 역할을 한다. 이러한 기능을 이해하기 위해서 본 연구팀은 putRNA와 RNA 합성효소의 결합 복합체(put-associated RNA polymerase elongation complex, putEC)의 세 가지 구조를 초저온 전자현미경으로 규명하였다.
이 연구에서는 활성을 가진 putRNA를 제작하기 위해 장애물 단백질을 RNA 합성에 활용하는 방법을 고안하였으며, 초저온 전자현미경 촬영 결과 예상하지 못했던 세 종류의 복합체 – putRNA가 잘 접혀서 RNA 합성효소와 결합하고 있는 putEC, put RNA가 접히지 않은 put-없는 EC, 잘 접힌 putRNA와 시그마 단백질이 함께 RNA 합성효소와 결합하고 있는 시그마* 결합-putEC – 를 발견할 수 있었다. (그림 1)
*시그마: RNA 합성효소가 유전자 RNA 합성을 처음 시작할 때 필요한 단백질로 RNA 합성이 어느 정도 안정화되면 RNA 합성효소에서 떨어진다.
연구팀은 이들 복합체의 구조를 통해 putRNA가 이전 연구에서 예측된 대로 RNA 합성효소와 안정적으로 결합하고 있지만 예측과 달리 예상보다 더 많은 염기쌍(base pair)을 사용해 RNA 이중나선(double helix) 뿐 아니라 삼중나선(triple helix)을 형성하는 것을 확인하였다. 또한, putRNA가 RNA 합성효소와 결합하면 RNA 합성효소가 RNA 합성을 잠시 멈출 때 가지는 구조의 변화를 방해해서 RNA 합성을 지속하도록 한다는 가설을 제시할 수 있었다.
한편, 시그마 단백질(σ70)은 RNA 합성효소가 전사를 시작할 때 필요한 전사 개시인자로, RNA 합성이 안정되면 RNA 합성효소에서 떨어졌다가 특정 DNA 서열(–10-유사 서열)이 있으면 전사 과정 중이라도 다시 RNA 중합효소와 결합해 RNA 합성을 일시적으로 멈추는 것으로 알려져 있다. 이번 연구에서는 예상치 못하게 관찰된 시그마 결합-putEC 구조를 통해 시그마가 RNA 합성효소와 결합하여 RNA 합성이 잠깐 멈추면 putRNA가 더 잘 접힌다는 것을 알 수 있었다.
이 연구의 교신저자인 강진영 교수는 "RNA 합성효소는 세포 내에 저장된 유전 정보를 처음으로 꺼내어 생명활동에 활용하는, 세포 내에서 제일 중요한 단백질 중 하나이다. 그러나 RNA 합성효소의 큰 크기와 다양한 구조 변화 때문에 이전에 주로 활용하던 X-ray 결정학 방식으로는 그 구조를 관찰하기가 어려웠다. 최근 초저온 전자현미경의 발달로 이제야 조금씩 RNA 합성효소의 작동 원리가 알려지고 있는 상황이다. 이번 연구는 이전에 잘 알려지지 않았던, RNA를 통한 전사 조절의 기초적인 원리를 설명한 것으로, RNA를 통한 RNA 합성효소 조절의 다양한 전략을 밝혀줄 시작점이며, 더 나아가 유전자 발현을 조작할 수 있는 RNA의 개발을 도울 수 있는 정보를 제공할 것이라 기대한다.ˮ고 밝혔다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업(우수신진연구)과 원천기술개발사업의 지원을 받아 수행됐다.
2022.09.07 조회수 13425 합성생물학 기반 차세대 미생물 대사 조절 밸브 개발
국제 공동연구진이 대장균의 모든 전사종결부위*를 해독하고, 이를 바탕으로 미생물의 대사 경로를 수도꼭지처럼 자유자재로 조절하는 합성생물학** 기반 차세대 대사 조절 밸브 기술을 개발했다.
*전사종결부위: DNA가 암호화하는 정보를 RNA로 전사할 때, RNA 합성이 종결되도록 조절하는 DNA 서열
**합성생물학: 생명현상의 복잡성, 다양성으로 인해 발생하는 낮은 재현성, 예측효율 저하 등의 기존 바이오기술의 문제를 해결하기 위해 생명체의 구성요소를 설계, 제작, 조립하는 공학적 접근방식의 바이오 기술
우리 대학 생명과학과 조병관 교수, 한국생명공학연구원 이승구 박사, 바이오융합연구소 조수형 교수, 미국 캘리포니아대학교 샌디에이고(UCSD) 생명공학과(Bioengineering)의 최동희 박사, 버나드 팔슨(Bernhard Palsson) 교수 국제 공동연구팀이 대장균에 존재하는 1,600여 개의 전사종결부위를 대량으로 해독 및 발굴하고, 이를 기반으로 고부가가치 바이오화합물 생산을 위한 미생물 대사 회로 설계를 가능케 하는 합성생물학 기반 기술을 개발했다고 14일 밝혔다.
전사종결부위는 DNA가 암호화하는 유전 정보가 RNA로 전사될 때, 원하는 유전자만이 정확히 전사되도록 조절하는 역할을 한다. 그 중요성에도 불구하고 기존에는 전사 종결에 관한 데이터의 부족으로, 구체적인 조절 기작에 대한 이해가 부족했다. 연구진은 전사종결부위가 다양한 세기를 가져 인접한 유전자들의 발현을 정교하게 조절한다는 사실을 발견하고, 이를 대사회로 조절에 이용했다.
한편 미생물은 다양한 유용 바이오화합물 생산에 이용되고 있는데, 효율적인 생산을 위해서는 대사 회로의 조절이 필수적이다. 그 이유는 단순히 원하는 물질 생산을 위한 유전자만을 과도하게 발현할 경우, 미생물 생장에 필요한 양분과 에너지까지 소모해 생산에 실패하기 때문이다. 공동연구진은 개발한 전사종결부위를 통해 서로 다른 대사 회로의 세기를 수도꼭지처럼 조절해 대사물질 생산을 최적화할 수 있는 '대사 밸브 기술'을 개발했다.
기존에는 전사의 시작이 되는 프로모터, 번역의 시작이 되는 리보솜 결합 부위를 통해 유전자 발현을 조절했는데, 이에는 수많은 인자가 관여하고 있어 실험 간 편차가 크고, 고가의 화학물질을 요구하는 등 한계를 지니고 있었다. 하지만 연구진이 개발한 대사 밸브는 실험 간 편차를 기존 시스템 대비 최대 75% 억제할 수 있는 것으로 나타났고, 대사 밸브를 이용한 생산 최적화를 통해 유용 대사물질인 비타민 B8의 생산을 최대 11배 증대하는 데 성공했다.
또한 개발된 기술은 미생물의 생장 조건(영양분 및 배양 환경)에 거의 영향을 받지 않는 것으로 나타나 실험실 조건에서 출발해 산업 규모로 확장할 시 부수적인 최적화 과정을 최소화할 수 있고, 목적 화합물에 따라 첨가하는 원료와 배양 조건이 변화해도 조절 기작이 유지되는 것으로 나타났다.
이번 연구 결과는 기존에 알려지지 않았던 전사종결부위의 특성을 규명하고, 이를 대사 조절에 이용한 획기적인 시도로 차세대 대사 조절 합성생물학 기반 기술로 기대받고 있다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 프로그램 및 한국 바이오 그랜드챌린지 프로그램의 지원을 받은 KAIST 조병관 교수 연구진과 한국생명공학연구원이 추진하는 KRIBB 연구 혁신 프로그램(Research Initiative Program)의 지원을 받은 이승구 박사(한국생명공학연구원), 기초과학 연구 프로그램(Basic Science Research Program)의 지원을 받은 KAIST 조수형 교수, 노보 노르디스크 재단(Novo Nordisk Foundation)의 연구지원을 받은 버나드 팔슨(Bernhard Palsson) 교수 연구진의 협업을 통해 수행됐으며, 국제적인 학술지인 `핵산 연구(Nucleic Acids Research, 영향력지수 16.971)' 에 3월 31일 게재됐다.
(논문명 : Synthetic 3'-UTR valves for optimal metabolic flux control in Escherichia coli)
2022.04.17 조회수 13366
합성생물학 기반 차세대 미생물 대사 조절 밸브 개발
국제 공동연구진이 대장균의 모든 전사종결부위*를 해독하고, 이를 바탕으로 미생물의 대사 경로를 수도꼭지처럼 자유자재로 조절하는 합성생물학** 기반 차세대 대사 조절 밸브 기술을 개발했다.
*전사종결부위: DNA가 암호화하는 정보를 RNA로 전사할 때, RNA 합성이 종결되도록 조절하는 DNA 서열
**합성생물학: 생명현상의 복잡성, 다양성으로 인해 발생하는 낮은 재현성, 예측효율 저하 등의 기존 바이오기술의 문제를 해결하기 위해 생명체의 구성요소를 설계, 제작, 조립하는 공학적 접근방식의 바이오 기술
우리 대학 생명과학과 조병관 교수, 한국생명공학연구원 이승구 박사, 바이오융합연구소 조수형 교수, 미국 캘리포니아대학교 샌디에이고(UCSD) 생명공학과(Bioengineering)의 최동희 박사, 버나드 팔슨(Bernhard Palsson) 교수 국제 공동연구팀이 대장균에 존재하는 1,600여 개의 전사종결부위를 대량으로 해독 및 발굴하고, 이를 기반으로 고부가가치 바이오화합물 생산을 위한 미생물 대사 회로 설계를 가능케 하는 합성생물학 기반 기술을 개발했다고 14일 밝혔다.
전사종결부위는 DNA가 암호화하는 유전 정보가 RNA로 전사될 때, 원하는 유전자만이 정확히 전사되도록 조절하는 역할을 한다. 그 중요성에도 불구하고 기존에는 전사 종결에 관한 데이터의 부족으로, 구체적인 조절 기작에 대한 이해가 부족했다. 연구진은 전사종결부위가 다양한 세기를 가져 인접한 유전자들의 발현을 정교하게 조절한다는 사실을 발견하고, 이를 대사회로 조절에 이용했다.
한편 미생물은 다양한 유용 바이오화합물 생산에 이용되고 있는데, 효율적인 생산을 위해서는 대사 회로의 조절이 필수적이다. 그 이유는 단순히 원하는 물질 생산을 위한 유전자만을 과도하게 발현할 경우, 미생물 생장에 필요한 양분과 에너지까지 소모해 생산에 실패하기 때문이다. 공동연구진은 개발한 전사종결부위를 통해 서로 다른 대사 회로의 세기를 수도꼭지처럼 조절해 대사물질 생산을 최적화할 수 있는 '대사 밸브 기술'을 개발했다.
기존에는 전사의 시작이 되는 프로모터, 번역의 시작이 되는 리보솜 결합 부위를 통해 유전자 발현을 조절했는데, 이에는 수많은 인자가 관여하고 있어 실험 간 편차가 크고, 고가의 화학물질을 요구하는 등 한계를 지니고 있었다. 하지만 연구진이 개발한 대사 밸브는 실험 간 편차를 기존 시스템 대비 최대 75% 억제할 수 있는 것으로 나타났고, 대사 밸브를 이용한 생산 최적화를 통해 유용 대사물질인 비타민 B8의 생산을 최대 11배 증대하는 데 성공했다.
또한 개발된 기술은 미생물의 생장 조건(영양분 및 배양 환경)에 거의 영향을 받지 않는 것으로 나타나 실험실 조건에서 출발해 산업 규모로 확장할 시 부수적인 최적화 과정을 최소화할 수 있고, 목적 화합물에 따라 첨가하는 원료와 배양 조건이 변화해도 조절 기작이 유지되는 것으로 나타났다.
이번 연구 결과는 기존에 알려지지 않았던 전사종결부위의 특성을 규명하고, 이를 대사 조절에 이용한 획기적인 시도로 차세대 대사 조절 합성생물학 기반 기술로 기대받고 있다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 프로그램 및 한국 바이오 그랜드챌린지 프로그램의 지원을 받은 KAIST 조병관 교수 연구진과 한국생명공학연구원이 추진하는 KRIBB 연구 혁신 프로그램(Research Initiative Program)의 지원을 받은 이승구 박사(한국생명공학연구원), 기초과학 연구 프로그램(Basic Science Research Program)의 지원을 받은 KAIST 조수형 교수, 노보 노르디스크 재단(Novo Nordisk Foundation)의 연구지원을 받은 버나드 팔슨(Bernhard Palsson) 교수 연구진의 협업을 통해 수행됐으며, 국제적인 학술지인 `핵산 연구(Nucleic Acids Research, 영향력지수 16.971)' 에 3월 31일 게재됐다.
(논문명 : Synthetic 3'-UTR valves for optimal metabolic flux control in Escherichia coli)
2022.04.17 조회수 13366 RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30 조회수 10748
RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30 조회수 10748 인공지능 기술을 이용한 유전자 전사인자 예측 시스템 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 미국 캘리포니아대학교 샌디에이고캠퍼스(UCSD) 생명공학과 버나드 팔슨(Bernhard Palsson) 교수 공동연구팀이 인공지능을 이용해 단백질 서열로부터 *전사인자를 예측하는 시스템인 '딥티팩터(DeepTFactor)'를 개발했다고 29일 밝혔다. 이번 연구는 국제학술지인 '미국국립과학원회보(PNAS)'에 12월 28일 字 게재됐다. (논문명: DeepTFactor: A deep learning-based tool for the prediction of transcription factors)
※ 전사인자 (transcription factor) : 유전자의 전사(유전 정보를 복사하는 과정)를 조절하는 단백질. 특정 DNA 서열에 특이적으로 결합해 유전자의 전사를 조절한다.
※ 저자 정보 : 김기배(한국과학기술원, 제1 저자), 예 가오(Ye Gao) (UCSD, 제2 저자), 버나드 팔슨(Bernhard Palsson) (UCSD, 제3 저자), 이상엽(교신저자) 포함 총 4명
전사인자는 특정한 DNA 서열에 특이적으로 결합해 유전자의 전사(유전 정보를 복사하는 과정)를 조절하는 단백질이다. 전사인자로 인한 유전자 전사를 분석함으로써 유기체가 유전적 또는 환경적 변화에 어떻게 반응해 유전자의 발현을 제어하는지 이해할 수 있다. 이러한 점에서 유기체의 전사인자를 찾는 것은 유기체의 전사 조절 시스템 분석을 위한 첫 단계라고 할 수 있다.
지금까지 새로운 전사인자를 찾기 위해서는 이미 알려진 전사인자와의 상동성(유사한 성질)을 분석하거나, 기계학습(머신러닝)과 같은 데이터 기반의 접근 방식을 이용했다. 기존의 기계학습 모델을 이용하기 위해서는 분자의 물리 화학적 특성을 계산하거나, 생물학적 서열의 상동성을 분석하는 등, 해결하고자 하는 문제에 대한 전문 지식에 의존해 모델의 입력값으로 사용할 특징을 찾아내는 과정이 필요하다.
한편, 심층 학습(딥러닝)은 문제 해결을 위한 잠재적인 특징을 내재적으로 학습할 수 있기에 최근 다양한 생물학 분야에서 활용되고 있다. 하지만, 심층 학습을 이용한 예측 시스템의 경우 시스템 내부의 복잡한 연산 때문에 추론 과정을 직접 확인할 수 없는 `블랙박스(black box)'라는 특징을 가지고 있다.
공동연구팀은 심층 학습 기법을 이용해 주어진 단백질 서열이 전사인자인지 예측할 수 있는 시스템인 딥티팩터(DeepTFactor)를 개발했다. 딥티팩터는 단백질 서열로부터 전사인자를 예측하기 위해 세 개의 병렬적인 합성곱 신경망(convolutional neural network)을 이용한다. 공동연구팀은 딥티팩터를 이용해 대장균(Escherichia coli K-12 MG1655)의 전사인자 332개를 예측했으며, 그중 3개의 전사인자의 게놈 전체 결합 위치(genome-wide binding site)를 실험으로 확인함으로써 딥티팩터의 성능을 검증했다.
공동연구팀은 나아가 딥티팩터의 추론 과정을 이해하기 위해 특징 지도 (saliency map) 기반의 심층 학습 모델 해석 방법론을 사용했다. 이를 통해 딥티팩터의 학습 과정에서 전사인자의 DNA의 결합 영역에 대한 정보가 명시적으로 주어지지 않았지만, 내재적으로 이를 학습해 예측에 활용한다는 사실을 확인했다.
연구팀 관계자에 따르면, 특정 생물군의 단백질 서열만을 위해 개발됐던 이전 예측 방법론들과 달리, 딥티팩터는 모든 생물군의 단백질 서열에서 우수한 성능을 보여 다양한 유기체의 전사 시스템 분석에 활용 가능할 것으로 기대된다.
이상엽 특훈교수는 “이번 연구에서 개발한 딥티팩터를 이용해서 새롭게 발견되는 단백질 서열과 아직 특성화되지 않은 수많은 단백질 서열을 높은 처리 능력으로 분석할 수 있게 됐다”며 “이는 유기체의 전자 조절 네트워크 분석을 위한 기초 기술로써 활용 가능할 것”이라고 밝혔다.
한편, 이번 연구는 과기정통부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 지원을 받아 수행됐다.
2020.12.30 조회수 58369
인공지능 기술을 이용한 유전자 전사인자 예측 시스템 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 미국 캘리포니아대학교 샌디에이고캠퍼스(UCSD) 생명공학과 버나드 팔슨(Bernhard Palsson) 교수 공동연구팀이 인공지능을 이용해 단백질 서열로부터 *전사인자를 예측하는 시스템인 '딥티팩터(DeepTFactor)'를 개발했다고 29일 밝혔다. 이번 연구는 국제학술지인 '미국국립과학원회보(PNAS)'에 12월 28일 字 게재됐다. (논문명: DeepTFactor: A deep learning-based tool for the prediction of transcription factors)
※ 전사인자 (transcription factor) : 유전자의 전사(유전 정보를 복사하는 과정)를 조절하는 단백질. 특정 DNA 서열에 특이적으로 결합해 유전자의 전사를 조절한다.
※ 저자 정보 : 김기배(한국과학기술원, 제1 저자), 예 가오(Ye Gao) (UCSD, 제2 저자), 버나드 팔슨(Bernhard Palsson) (UCSD, 제3 저자), 이상엽(교신저자) 포함 총 4명
전사인자는 특정한 DNA 서열에 특이적으로 결합해 유전자의 전사(유전 정보를 복사하는 과정)를 조절하는 단백질이다. 전사인자로 인한 유전자 전사를 분석함으로써 유기체가 유전적 또는 환경적 변화에 어떻게 반응해 유전자의 발현을 제어하는지 이해할 수 있다. 이러한 점에서 유기체의 전사인자를 찾는 것은 유기체의 전사 조절 시스템 분석을 위한 첫 단계라고 할 수 있다.
지금까지 새로운 전사인자를 찾기 위해서는 이미 알려진 전사인자와의 상동성(유사한 성질)을 분석하거나, 기계학습(머신러닝)과 같은 데이터 기반의 접근 방식을 이용했다. 기존의 기계학습 모델을 이용하기 위해서는 분자의 물리 화학적 특성을 계산하거나, 생물학적 서열의 상동성을 분석하는 등, 해결하고자 하는 문제에 대한 전문 지식에 의존해 모델의 입력값으로 사용할 특징을 찾아내는 과정이 필요하다.
한편, 심층 학습(딥러닝)은 문제 해결을 위한 잠재적인 특징을 내재적으로 학습할 수 있기에 최근 다양한 생물학 분야에서 활용되고 있다. 하지만, 심층 학습을 이용한 예측 시스템의 경우 시스템 내부의 복잡한 연산 때문에 추론 과정을 직접 확인할 수 없는 `블랙박스(black box)'라는 특징을 가지고 있다.
공동연구팀은 심층 학습 기법을 이용해 주어진 단백질 서열이 전사인자인지 예측할 수 있는 시스템인 딥티팩터(DeepTFactor)를 개발했다. 딥티팩터는 단백질 서열로부터 전사인자를 예측하기 위해 세 개의 병렬적인 합성곱 신경망(convolutional neural network)을 이용한다. 공동연구팀은 딥티팩터를 이용해 대장균(Escherichia coli K-12 MG1655)의 전사인자 332개를 예측했으며, 그중 3개의 전사인자의 게놈 전체 결합 위치(genome-wide binding site)를 실험으로 확인함으로써 딥티팩터의 성능을 검증했다.
공동연구팀은 나아가 딥티팩터의 추론 과정을 이해하기 위해 특징 지도 (saliency map) 기반의 심층 학습 모델 해석 방법론을 사용했다. 이를 통해 딥티팩터의 학습 과정에서 전사인자의 DNA의 결합 영역에 대한 정보가 명시적으로 주어지지 않았지만, 내재적으로 이를 학습해 예측에 활용한다는 사실을 확인했다.
연구팀 관계자에 따르면, 특정 생물군의 단백질 서열만을 위해 개발됐던 이전 예측 방법론들과 달리, 딥티팩터는 모든 생물군의 단백질 서열에서 우수한 성능을 보여 다양한 유기체의 전사 시스템 분석에 활용 가능할 것으로 기대된다.
이상엽 특훈교수는 “이번 연구에서 개발한 딥티팩터를 이용해서 새롭게 발견되는 단백질 서열과 아직 특성화되지 않은 수많은 단백질 서열을 높은 처리 능력으로 분석할 수 있게 됐다”며 “이는 유기체의 전자 조절 네트워크 분석을 위한 기초 기술로써 활용 가능할 것”이라고 밝혔다.
한편, 이번 연구는 과기정통부가 지원하는 기후변화대응기술개발사업의 바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제 지원을 받아 수행됐다.
2020.12.30 조회수 58369 세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28 조회수 52966
세계 최대 규모의 3차원 암 게놈 지도 구축
우리 대학 생명과학과 정인경 교수가 한국생명공학연구원 국가생명연구자원정보센터(KOBIC) 이병욱 박사 연구팀과 공동연구를 통해 전 세계 최대 규모의 3차원 암 게놈 지도 데이터베이스를 구축해 공개했다고 28일 밝혔다. (데이터베이스 주소: 3div.kr)
공동연구팀은 인체 정상 조직과 암 조직, 그리고 다양한 세포주 대상 3차원 게놈 지도를 분석 및 데이터베이스화 해, 약 400여 종 이상의 3차원 인간 게놈 지도를 구축했으며, 이를 통해 암세포에서 빈번하게 발생하는 대규모 유전체 구조 변이(structural variation)의 기능을 해독할 수 있는 신규 전략을 제시했다.
정인경 교수, 이병욱 박사가 공동 교신 저자로 참여한 이번 연구 결과는 국제 학술지 `핵산 연구(Nucleic Acid Research)' 저널 11월 27일 字 온라인판에 게재됐다. (논문명 : 3DIV update for 2021: a comprehensive resource of 3D genome and 3D cancer genome)
현재까지 많은 연구를 통해 암세포 유전체에서 발생하는 돌연변이를 규명해 암의 발병 기전을 이해하려는 시도가 있었다. 최근에는 유전자에서 발생하는 점 돌연변이뿐 아니라 대규모 구조 변이에 관한 연구가 활발하게 이루어지고 있으며, 이들을 활용한 신규 암세포의 특이적 유전자 발현 조절 기전 규명의 중요성이 제시되고 있다.
하지만, 대다수의 구조 변이는 DNA가 단백질을 생성하지 않는 비 전사 지역에 존재해, 1차원적 게놈 서열 분석만으로 이들의 기능을 규명하는 데는 한계가 있었다.
한편 지난 10년간 비약적으로 발전한 3차원 게놈 구조 연구는 비 전사 지역에 존재하는 대규모 구조 변이로 인해 생성되거나 소실되는 염색질 고리 구조(chromatin loop)를 3차원 게놈 구조 해독을 통해 규명하면 유전자 조절 기능을 해독할 수 있다는 모델을 제시하고 있다.
이에 정인경 교수 연구팀은 지금까지 공개된 모든 암 유전체의 3차원 게놈 지도를 확보해 전 세계 최대 규모의 3차원 암 유전체 지도를 작성했다. 그리고 대규모 구조 변이와 3차원 게놈 지도를 연결할 수 있는 분석 도구들을 개발했다. 그 결과 연구팀은 대규모 암 유전체 구조 변이에 따른 3차원 게놈 구조의 변화 그리고 이들의 표적 유전자를 규명할 수 있었다.
공동 교신 저자 이병욱 박사는 "최근 세포 내 3차원 게놈 구조 변화가 다양한 질병, 특히 암의 원인이 된다는 것이 밝혀지고 있는데, 이번 연구를 통해 이를 연구할 수 있는 도구들을 세계 최초로 개발했다ˮ라며 "이번 연구 결과를 활용하면 암의 발병 원리를 이해하고 더 나아가 항암제 개발에도 중요한 정보를 제공할 것으로 기대된다ˮ라고 말했다.
정인경 교수는 "암에서 빈번하게 발생하는 대규모 구조 변이의 기능을 3차원 게놈 구조 해독을 통해 정밀하게 규명 가능함을 보여줬다ˮ라며 "이번 연구 결과는 아직 해독이 완벽하게 이루어지고 있지 않은 암 유전체를 정밀하게 해독하는 기술을 한 단계 더 발전시키는 계기가 될 것이다”라고 말했다.
이번 연구는 한국연구재단 기반산업화 인프라 그리고 서경배과학재단의 지원을 통해 수행됐다.
2020.12.28 조회수 52966 노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26 조회수 48623
노화된 세포를 젊은 세포로 되돌리는 초기 원천기술 개발
우리 연구진이 노화된 세포를 젊은 세포로 되돌리는 역 노화 원천기술을 개발했다. 이를 활용하면 노화 현상을 막고 각종 노인성 질환을 사전 억제할 수 있는 치료제를 개발할 단서를 찾을 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌리는 역 노화의 초기 원천기술을 개발했다고 26일 밝혔다.
조광현 교수팀의 이번 연구 결과는 ㈜아모레퍼시픽 기술연구원과의 산학 공동연구를 통해 최초로 개발된 노화 인공피부 모델에서 이 기술을 적용함으로써 입증하는 데 성공했다.
조 교수팀은 이번 연구를 위해 인간 진피 섬유아세포의 세포노화 신호전달 네트워크의 컴퓨터 모델을 개발한 후 시뮬레이션 분석을 통해 노화된 인간 진피 섬유아세포를 젊은 세포로 되돌리는데 필요한 핵심 인자를 찾아냈다. 이후 노화 인공피부 모델에서 핵심 인자를 조절함으로써 노화된 피부조직에서 감소된 콜라겐의 합성을 증가시키고 재생 능력을 회복시켜 젊은 피부조직의 특성을 보이게 하는 역 노화 기술을 개발했다.
연구팀 관계자는 이러한 역 노화 기술은 노화된 피부 등을 포함한 노화 현상 및 많은 노인성 질환의 발생을 사전에 억제할 수 있도록 근본적인 치료전략을 제시한 것으로 건강 수명을 오랫동안 유지하고 싶은 인류의 꿈을 실현하는데 한 걸음 다가선 결과라고 의미를 부여했다.
바이오및뇌공학과 안수균 박사과정 학생, 강준수 연구원, 이수범 연구원과 ㈜아모레퍼시픽의 바이오사이언스랩이 참여한 이번 연구 결과는 국제저명학술지인 `미국국립과학원회보(PNAS)'에 게재됐다.(논문명: Inhibition of 3-phosphoinositide-dependent protein kinase 1 (PDK1) can revert cellular senescence in human dermal fibroblasts)
현재 널리 연구되고 있는 회춘 전략은 이미 분화된 세포를 역분화시키는 4개의 `OSKM(Oct4, Sox2, Klf4, c-Myc) 야마나카 전사인자'를 일시적으로 발현시켜 후성유전학적 리모델링(epigenetic remodeling)을 일으킴으로써 노화된 세포를 젊은 상태로 되돌리는 부분적 역분화(partial reprogramming) 전략이다.
이 기술은 노화된 세포가 젊은 세포로 되돌아갈 수 있다는 것을 증명했지만 종양의 형성과 암의 진행을 유발하는 부작용이 생긴다. 따라서 이와 같은 부작용을 배제할 수 있는 정교한 제어 전략이 과학 난제로 남아있었다.
조 교수팀은 이러한 난제 해결을 위해 시스템생물학 연구 방법을 통해 노화된 인간 진피 섬유아세포를 정상적인 젊은 세포로 되돌릴 수 있는 핵심 조절인자를 오래전부터 탐구하기 시작했다. 4년에 걸친 연구 끝에 단백질 합성, 세포의 성장 등을 조절하는 mTOR와 면역 물질 사이토카인의 생성에 관여하는 NF-kB를 동시에 제어하고 있는 상위 조절 인자인 `PDK1(3-phosphoinositide-dependent protein kinase 1)'을 찾아냈다.
연구팀은 PDK1을 억제함으로써 노화된 인간 진피 섬유아세포를 다시 정상적인 젊은 세포로 되돌릴 수 있음을 분자 세포실험 및 노화 인공피부 모델 실험을 통해 입증했다. 연구를 통해 노화된 인간 진피 섬유아세포에서 PDK1을 억제했을 때 세포노화 표지 인자들이 사라지고 주변 환경에 적절하게 반응하는 정상 세포로서 기능을 회복하는 현상을 확인했다.
연구 결과 노화된 인간 진피 섬유아세포에서는 PDK1이 mTOR와 NF-kB를 활성화해 노화와 관련된 분비 표현형(SASP: Senescence Associated Secretary Phenotype)을 유발하고 노화 형질을 유지하는 것과 연관돼 있음을 밝혀냈다. 즉, PDK1을 억제함으로써 다시 원래의 정상적인 젊은 세포 상태로 안전하게 되돌릴 수 있음을 증명한 것이다.
조 교수팀이 연구 과정에서 찾아낸 표적 단백질의 활성을 억제할 수 있는 저분자화합물과 관련된 신약개발과 그리고 전임상실험을 통해 노화된 세포의 정상 세포화라는 연구 결과는 새로운 노인성 질환의 치료 기술과 회춘 기술에 관한 연구를 본 궤도에 올려놓은 초석을 다진 획기적인 연구로 평가받고 있다.
실제 ㈜아모레퍼시픽 기술연구원은 이번 연구 결과로부터 동백추출물에서 PDK1 억제 성분을 추출해 노화된 피부의 주름을 개선하는 화장품을 개발중이다.
조광현 교수는 "그동안 비가역적 생명현상이라고 인식돼왔던 노화를 가역화할 가능성을 보여줬다ˮ라며 "이번 연구는 노화를 가역적 생명현상으로 인식하고 이에 적극적으로 대처해 건강 수명을 연장하는 한편 노인성 질환을 예방할 수 있는 새로운 시대의 서막을 열었다ˮ라고 의미를 부여했다.
이번 연구는 조광현 교수 연구팀의 시스템생물학 기반 가역화 기술 개발의 일환으로 이뤄졌으며, 연구팀은 지난 1월 같은 기술을 적용해 대장암세포를 다시 정상 대장 세포로 되돌리는 연구에 성공한 바 있다.
한편 이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 그랜드챌린지 30 (KC30) 프로젝트 및 아모레퍼시픽 R&D 센터의 지원으로 수행됐다.
2020.11.26 조회수 48623