-
 화학과 학부생, 항암치료 앞당길 천연물 합성 연구 1저자
국내 자생 약용식물인 ‘광대싸리’에서 추출된 세큐린진 G는 항암제, 퇴행성 신경질환 치료제 및 마약중독 치료제로 개발 가능한 중요한 세큐리네가 천연물군에 속해 있다. 우리 대학 화학과 학부생이 추진한 연구를 통해 세계 최초로 세큐린진 G의 천연물 전합성*에 성공해 화제다.
*천연물 전합성(Total Synthesis): 쉽게 구할 수 있는 시작 물질로부터 여러 단계의 화학반응을 통해 자연에 존재하는 천연물을 실험실에서 합성하는 연구 분야로 각 단계의 화학반응이 모두 성공적으로 이루어져야 목표 분자를 최종적으로 합성할 수 있어 연구 호흡이 길고 난이도가 높다.
우리 대학은 화학과에 재학 중인 윤태식 학부생이 제1 저자로 참여하고(연구 지도교수: 한순규 교수) 대학원생 멘토인 김태완 대학원생이 공동 저자로 참여한 세큐린진(Securingine) G 전합성 논문이 국제 학술지에 게재됐다고 7일 밝혔다.
한순규 교수 연구팀의 윤태식 학사과정 학생이 주저자로 참여한 논문은 영국 왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 화학학술지‘케미칼 커뮤니케이션즈(Chemical Communications)’에 5월 23일에 실렸다. (논문명: Total Synthesis of (–)-Securingine G)
간단한 화합물에서는 잘 진행되는 반응도 복잡한 구조의 천연물에 도달하는 과정의 전구체에서는 잘 진행되지 않는 경우가 많아 천연물 합성 연구는 고도의 창의력과 화학적 문제해결 능력이 필요하다. 그렇기에 학부생이 주도적으로 천연물 전합성 연구를 진행하는 것은 쉽지 않다.
이번에 세계 최초로 전합성에 성공한 천연물 세큐린진 G는 세큐리네가 천연물군 중 유일하게 피리딘 헤테로고리를 포함하는 물질이다. 피리딘 헤테로고리는 신약 개발에 있어 아주 중요한 역할을 한다. 실제로 지난 2023년 세계적으로 가장 많이 팔린 저분자 약 200종을 조사한 결과 그 중 20%인 40개가 피리딘 헤테로고리를 포함할 정도로 피리딘 골격은 의약적으로 중요하다.
세큐린진 G 합성에 있어 핵심은 어떻게 메니스다우릴라이드*와 피리딘 헤테로고리 사이의 탄소-탄소 결합을 입체 선택적으로 연결하는지였다. 기존에 염기성이 높아 원하는 결합은 이루어지지 않은 점을 착안하여 연구진은 새로운 희토류** 기반 교환 시약을 개발해 염기성 조건에서 문제가 된 부반응을 억제하고 핵심이 되는 탄소-탄소 결합을 성공적으로 형성했다.
*메니스다우릴라이드: 광대싸리나무에서 세큐리네가 천연물을 생합성하는데 쓰이는 핵심 전구체
**희토류(rare earth element): 란타넘족(lanthanide) 원소와 스칸듐(scandium), 이트리움(yttrium)을 포함한 17개의 원소군으로 이차전지, 석유화학 촉매, 반도체용 연마제, 레이저등에 필수적으로 들어가는 대체불가한 화학물질
우리 대학은 학부생들에게 실질적인 실험 및 연구 경험을 쌓을 수 있는 기회를 제공하기 위해 학부생 연구프로그램(URP, Undergraduate Research Program)을 운영하고 있다. URP 프로그램은 연구계획서 작성부터 성과 발표/평가에 이르기까지 전 과정을 통하여 연구수행 역량을 개발할 수 있도록 하는 프로그램이다. 학교는 소정의 연구비 지원 및 학점 연계를 통해 학부생을 지원한다.
화학과 한순규 교수는 “연구 중심 대학을 지향하는 KAIST에서 URP 프로그램은 학부생이 지도교수와 조교의 지도하에 실질적인 연구를 체계적으로 수행해 볼 수 있는 중요한 기회를 제공한다”라며 “이를 통해 첨단 연구와 학부 교육이라는 두 마리 토끼를 모두 잡을 수 있었다”고 밝혔다.
한편 이번 연구는 KAIST URP 프로그램과 한국연구재단의 지원을 받아 수행됐다.
화학과 학부생, 항암치료 앞당길 천연물 합성 연구 1저자
국내 자생 약용식물인 ‘광대싸리’에서 추출된 세큐린진 G는 항암제, 퇴행성 신경질환 치료제 및 마약중독 치료제로 개발 가능한 중요한 세큐리네가 천연물군에 속해 있다. 우리 대학 화학과 학부생이 추진한 연구를 통해 세계 최초로 세큐린진 G의 천연물 전합성*에 성공해 화제다.
*천연물 전합성(Total Synthesis): 쉽게 구할 수 있는 시작 물질로부터 여러 단계의 화학반응을 통해 자연에 존재하는 천연물을 실험실에서 합성하는 연구 분야로 각 단계의 화학반응이 모두 성공적으로 이루어져야 목표 분자를 최종적으로 합성할 수 있어 연구 호흡이 길고 난이도가 높다.
우리 대학은 화학과에 재학 중인 윤태식 학부생이 제1 저자로 참여하고(연구 지도교수: 한순규 교수) 대학원생 멘토인 김태완 대학원생이 공동 저자로 참여한 세큐린진(Securingine) G 전합성 논문이 국제 학술지에 게재됐다고 7일 밝혔다.
한순규 교수 연구팀의 윤태식 학사과정 학생이 주저자로 참여한 논문은 영국 왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 화학학술지‘케미칼 커뮤니케이션즈(Chemical Communications)’에 5월 23일에 실렸다. (논문명: Total Synthesis of (–)-Securingine G)
간단한 화합물에서는 잘 진행되는 반응도 복잡한 구조의 천연물에 도달하는 과정의 전구체에서는 잘 진행되지 않는 경우가 많아 천연물 합성 연구는 고도의 창의력과 화학적 문제해결 능력이 필요하다. 그렇기에 학부생이 주도적으로 천연물 전합성 연구를 진행하는 것은 쉽지 않다.
이번에 세계 최초로 전합성에 성공한 천연물 세큐린진 G는 세큐리네가 천연물군 중 유일하게 피리딘 헤테로고리를 포함하는 물질이다. 피리딘 헤테로고리는 신약 개발에 있어 아주 중요한 역할을 한다. 실제로 지난 2023년 세계적으로 가장 많이 팔린 저분자 약 200종을 조사한 결과 그 중 20%인 40개가 피리딘 헤테로고리를 포함할 정도로 피리딘 골격은 의약적으로 중요하다.
세큐린진 G 합성에 있어 핵심은 어떻게 메니스다우릴라이드*와 피리딘 헤테로고리 사이의 탄소-탄소 결합을 입체 선택적으로 연결하는지였다. 기존에 염기성이 높아 원하는 결합은 이루어지지 않은 점을 착안하여 연구진은 새로운 희토류** 기반 교환 시약을 개발해 염기성 조건에서 문제가 된 부반응을 억제하고 핵심이 되는 탄소-탄소 결합을 성공적으로 형성했다.
*메니스다우릴라이드: 광대싸리나무에서 세큐리네가 천연물을 생합성하는데 쓰이는 핵심 전구체
**희토류(rare earth element): 란타넘족(lanthanide) 원소와 스칸듐(scandium), 이트리움(yttrium)을 포함한 17개의 원소군으로 이차전지, 석유화학 촉매, 반도체용 연마제, 레이저등에 필수적으로 들어가는 대체불가한 화학물질
우리 대학은 학부생들에게 실질적인 실험 및 연구 경험을 쌓을 수 있는 기회를 제공하기 위해 학부생 연구프로그램(URP, Undergraduate Research Program)을 운영하고 있다. URP 프로그램은 연구계획서 작성부터 성과 발표/평가에 이르기까지 전 과정을 통하여 연구수행 역량을 개발할 수 있도록 하는 프로그램이다. 학교는 소정의 연구비 지원 및 학점 연계를 통해 학부생을 지원한다.
화학과 한순규 교수는 “연구 중심 대학을 지향하는 KAIST에서 URP 프로그램은 학부생이 지도교수와 조교의 지도하에 실질적인 연구를 체계적으로 수행해 볼 수 있는 중요한 기회를 제공한다”라며 “이를 통해 첨단 연구와 학부 교육이라는 두 마리 토끼를 모두 잡을 수 있었다”고 밝혔다.
한편 이번 연구는 KAIST URP 프로그램과 한국연구재단의 지원을 받아 수행됐다.
2024.06.07
조회수 8651
-
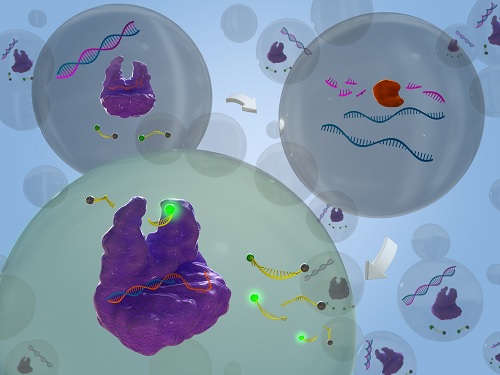 유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14
조회수 13374
 화학과 학부생, 항암치료 앞당길 천연물 합성 연구 1저자
국내 자생 약용식물인 ‘광대싸리’에서 추출된 세큐린진 G는 항암제, 퇴행성 신경질환 치료제 및 마약중독 치료제로 개발 가능한 중요한 세큐리네가 천연물군에 속해 있다. 우리 대학 화학과 학부생이 추진한 연구를 통해 세계 최초로 세큐린진 G의 천연물 전합성*에 성공해 화제다.
*천연물 전합성(Total Synthesis): 쉽게 구할 수 있는 시작 물질로부터 여러 단계의 화학반응을 통해 자연에 존재하는 천연물을 실험실에서 합성하는 연구 분야로 각 단계의 화학반응이 모두 성공적으로 이루어져야 목표 분자를 최종적으로 합성할 수 있어 연구 호흡이 길고 난이도가 높다.
우리 대학은 화학과에 재학 중인 윤태식 학부생이 제1 저자로 참여하고(연구 지도교수: 한순규 교수) 대학원생 멘토인 김태완 대학원생이 공동 저자로 참여한 세큐린진(Securingine) G 전합성 논문이 국제 학술지에 게재됐다고 7일 밝혔다.
한순규 교수 연구팀의 윤태식 학사과정 학생이 주저자로 참여한 논문은 영국 왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 화학학술지‘케미칼 커뮤니케이션즈(Chemical Communications)’에 5월 23일에 실렸다. (논문명: Total Synthesis of (–)-Securingine G)
간단한 화합물에서는 잘 진행되는 반응도 복잡한 구조의 천연물에 도달하는 과정의 전구체에서는 잘 진행되지 않는 경우가 많아 천연물 합성 연구는 고도의 창의력과 화학적 문제해결 능력이 필요하다. 그렇기에 학부생이 주도적으로 천연물 전합성 연구를 진행하는 것은 쉽지 않다.
이번에 세계 최초로 전합성에 성공한 천연물 세큐린진 G는 세큐리네가 천연물군 중 유일하게 피리딘 헤테로고리를 포함하는 물질이다. 피리딘 헤테로고리는 신약 개발에 있어 아주 중요한 역할을 한다. 실제로 지난 2023년 세계적으로 가장 많이 팔린 저분자 약 200종을 조사한 결과 그 중 20%인 40개가 피리딘 헤테로고리를 포함할 정도로 피리딘 골격은 의약적으로 중요하다.
세큐린진 G 합성에 있어 핵심은 어떻게 메니스다우릴라이드*와 피리딘 헤테로고리 사이의 탄소-탄소 결합을 입체 선택적으로 연결하는지였다. 기존에 염기성이 높아 원하는 결합은 이루어지지 않은 점을 착안하여 연구진은 새로운 희토류** 기반 교환 시약을 개발해 염기성 조건에서 문제가 된 부반응을 억제하고 핵심이 되는 탄소-탄소 결합을 성공적으로 형성했다.
*메니스다우릴라이드: 광대싸리나무에서 세큐리네가 천연물을 생합성하는데 쓰이는 핵심 전구체
**희토류(rare earth element): 란타넘족(lanthanide) 원소와 스칸듐(scandium), 이트리움(yttrium)을 포함한 17개의 원소군으로 이차전지, 석유화학 촉매, 반도체용 연마제, 레이저등에 필수적으로 들어가는 대체불가한 화학물질
우리 대학은 학부생들에게 실질적인 실험 및 연구 경험을 쌓을 수 있는 기회를 제공하기 위해 학부생 연구프로그램(URP, Undergraduate Research Program)을 운영하고 있다. URP 프로그램은 연구계획서 작성부터 성과 발표/평가에 이르기까지 전 과정을 통하여 연구수행 역량을 개발할 수 있도록 하는 프로그램이다. 학교는 소정의 연구비 지원 및 학점 연계를 통해 학부생을 지원한다.
화학과 한순규 교수는 “연구 중심 대학을 지향하는 KAIST에서 URP 프로그램은 학부생이 지도교수와 조교의 지도하에 실질적인 연구를 체계적으로 수행해 볼 수 있는 중요한 기회를 제공한다”라며 “이를 통해 첨단 연구와 학부 교육이라는 두 마리 토끼를 모두 잡을 수 있었다”고 밝혔다.
한편 이번 연구는 KAIST URP 프로그램과 한국연구재단의 지원을 받아 수행됐다.
2024.06.07 조회수 8651
화학과 학부생, 항암치료 앞당길 천연물 합성 연구 1저자
국내 자생 약용식물인 ‘광대싸리’에서 추출된 세큐린진 G는 항암제, 퇴행성 신경질환 치료제 및 마약중독 치료제로 개발 가능한 중요한 세큐리네가 천연물군에 속해 있다. 우리 대학 화학과 학부생이 추진한 연구를 통해 세계 최초로 세큐린진 G의 천연물 전합성*에 성공해 화제다.
*천연물 전합성(Total Synthesis): 쉽게 구할 수 있는 시작 물질로부터 여러 단계의 화학반응을 통해 자연에 존재하는 천연물을 실험실에서 합성하는 연구 분야로 각 단계의 화학반응이 모두 성공적으로 이루어져야 목표 분자를 최종적으로 합성할 수 있어 연구 호흡이 길고 난이도가 높다.
우리 대학은 화학과에 재학 중인 윤태식 학부생이 제1 저자로 참여하고(연구 지도교수: 한순규 교수) 대학원생 멘토인 김태완 대학원생이 공동 저자로 참여한 세큐린진(Securingine) G 전합성 논문이 국제 학술지에 게재됐다고 7일 밝혔다.
한순규 교수 연구팀의 윤태식 학사과정 학생이 주저자로 참여한 논문은 영국 왕립화학회(Royal Society of Chemistry)에서 발간하는 국제 화학학술지‘케미칼 커뮤니케이션즈(Chemical Communications)’에 5월 23일에 실렸다. (논문명: Total Synthesis of (–)-Securingine G)
간단한 화합물에서는 잘 진행되는 반응도 복잡한 구조의 천연물에 도달하는 과정의 전구체에서는 잘 진행되지 않는 경우가 많아 천연물 합성 연구는 고도의 창의력과 화학적 문제해결 능력이 필요하다. 그렇기에 학부생이 주도적으로 천연물 전합성 연구를 진행하는 것은 쉽지 않다.
이번에 세계 최초로 전합성에 성공한 천연물 세큐린진 G는 세큐리네가 천연물군 중 유일하게 피리딘 헤테로고리를 포함하는 물질이다. 피리딘 헤테로고리는 신약 개발에 있어 아주 중요한 역할을 한다. 실제로 지난 2023년 세계적으로 가장 많이 팔린 저분자 약 200종을 조사한 결과 그 중 20%인 40개가 피리딘 헤테로고리를 포함할 정도로 피리딘 골격은 의약적으로 중요하다.
세큐린진 G 합성에 있어 핵심은 어떻게 메니스다우릴라이드*와 피리딘 헤테로고리 사이의 탄소-탄소 결합을 입체 선택적으로 연결하는지였다. 기존에 염기성이 높아 원하는 결합은 이루어지지 않은 점을 착안하여 연구진은 새로운 희토류** 기반 교환 시약을 개발해 염기성 조건에서 문제가 된 부반응을 억제하고 핵심이 되는 탄소-탄소 결합을 성공적으로 형성했다.
*메니스다우릴라이드: 광대싸리나무에서 세큐리네가 천연물을 생합성하는데 쓰이는 핵심 전구체
**희토류(rare earth element): 란타넘족(lanthanide) 원소와 스칸듐(scandium), 이트리움(yttrium)을 포함한 17개의 원소군으로 이차전지, 석유화학 촉매, 반도체용 연마제, 레이저등에 필수적으로 들어가는 대체불가한 화학물질
우리 대학은 학부생들에게 실질적인 실험 및 연구 경험을 쌓을 수 있는 기회를 제공하기 위해 학부생 연구프로그램(URP, Undergraduate Research Program)을 운영하고 있다. URP 프로그램은 연구계획서 작성부터 성과 발표/평가에 이르기까지 전 과정을 통하여 연구수행 역량을 개발할 수 있도록 하는 프로그램이다. 학교는 소정의 연구비 지원 및 학점 연계를 통해 학부생을 지원한다.
화학과 한순규 교수는 “연구 중심 대학을 지향하는 KAIST에서 URP 프로그램은 학부생이 지도교수와 조교의 지도하에 실질적인 연구를 체계적으로 수행해 볼 수 있는 중요한 기회를 제공한다”라며 “이를 통해 첨단 연구와 학부 교육이라는 두 마리 토끼를 모두 잡을 수 있었다”고 밝혔다.
한편 이번 연구는 KAIST URP 프로그램과 한국연구재단의 지원을 받아 수행됐다.
2024.06.07 조회수 8651 유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14 조회수 13374
유전자 가위를 이용한 RNA 분해효소 검출 신기술 개발
우리 대학 생명화학공학과 박현규 교수 연구팀이 *크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 *부수적 절단 활성을 활용해 RNA 분해효소를 민감하게 검출해내는 신기술을 개발했다고 14일 밝혔다.
☞ 크리스퍼 카스 시스템 (유전자 가위 기술)
- 크리스퍼 카스 시스템은 박테리아가 바이러스 감염으로부터 자신을 보호하기 위해 진화시킨 적응 면역 시스템이다. 이는 외래 유전자의 정보를 담고있는 가이드RNA와 직접 핵산을 절단하는 카스 단백질로 이루어져 있다. 2020년 제니퍼 다우드나 교수의 연구팀이 크리스퍼 카스9 유전자 가위 시스템을 개발한 공로로 노벨화학상을 수상해 널리 알려졌으며, 높은 표적 특이성과 빠른 역학 덕분에 최근에는 유전체 편집을 넘어 생체물질 검출 및 분자진단 분야에 광범위하게 적용되고 있다.
☞ 부수적 절단 활성
- 카스9 이외에도 Cas12, Cas13 등의 다양한 카스 단백질이 발굴되고 활용되고 있다. 카스12a는 표적 DNA 서열을 인식해 이를 절단하며, 이에 더해 주변의 비표적 단일 가닥 DNA를 무작위하게 절단하는 부수적 절단 활성을 가지고 있다. 이러한 성질은 분자진단 분야에서 활발하게 사용되고 있다.
우리 대학 생명화학공학과 김한솔 박사가 제1 저자로 참여한 이번 연구는 영국왕립화학회가 발행하는 국제 학술지 `케미컬 커뮤니케이션스 (Chemical Communications)'에 2022년도 16호 표지(Back cover) 논문으로 지난달 24일 선정됐다. (논문명: CRISPR/Cas12a collateral cleavage activity for an ultrasensitive assay of RNase H)
RNA 분해효소의 일종인 `리보핵산가수분해효소 H'는 후천성면역결핍증(에이즈)을 일으키는 바이러스인 인간 면역결핍 바이러스(HIV-1) 및 B형 간염 바이러스를 포함한 역전사 바이러스의 역전사효소에서 필수적인 영역으로, 역전사 바이러스의 증식에 관여한다. 따라서 리보핵산가수분해효소 H는 항바이러스제 개발의 중요한 표적으로 알려져 있다. 일반적으로 리보핵산가수분해효소 H의 활성을 검출하기 위해서는 전기영동 또는 고성능 액체크로마토그래피 등의 방식을 사용하고 있지만, 이와 같은 기술들은 낮은 특이도와 민감도, 복잡한 검출 과정, 긴 검출 시간 등의 단점이 있다.
연구팀은 이러한 현행 기술의 한계를 극복하기 위해, 크리스퍼 카스12a (CRISPR-Cas12a) 시스템을 활용해 검출의 민감도를 크게 향상하고 리보핵산가수분해효소 H를 현재 보고된 기술 중 가장 높은 민감도로(검출한계: 0.24 U/L) 1시간 이내에 검출하는 데 성공했다.
연구팀은 리보핵산가수분해효소 H의 기질로 짧은 DNA/RNA 키메라 복합체를 이용해 리보핵산가수분해효소 H의 활성 하에 활성제 DNA (Activator DNA, AD)가 방출되도록 설계했다. Cas12a/crRNA 복합체가 방출된 활성제 DNA를 인식할 시 Cas12a의 부수적 절단 활성을 가동해 주변의 리포터 DNA를 절단해 형광 신호가 발생하도록 설계함으로써, 표적 유전자 돌연변이를 고감도로 매우 정확하게 검출했다. 연구팀은 이 기술을 통해서 암세포의 리보핵산가수분해효소 H 활성도 성공적으로 검출할 수 있었다.
특히 리보핵산가수분해효소 H가 인간 면역결핍 바이러스 증식에 관여한다는 점을 고려할 때, 이번 연구 성과는 에이즈 치료제 개발에 기여할 수 있을 것으로도 기대된다.
박현규 교수는 “이번 기술은 크리스퍼 카스12a (CRISPR-Cas12a) 시스템의 부수적 절단 활성을 활용해 리보핵산가수분해효소 H를 고도로 민감하게 검출함으로써, 항바이러스제의 표적 발굴에 활용될 수 있다”라고 연구의 의의를 설명했다.
한편 이번 연구는 경찰청의 치안과학기술연구개발사업 및 한국연구재단의 중견연구자지원사업과 바이오·의료기술개발사업의 일환으로 수행됐다.
2022.03.14 조회수 13374