-
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18
조회수 4400
-
 가뭄현상이 DNA에 적용되면?
한미 공동연구진이 가뭄이 들면 논바닥이 쩍쩍 갈라지는 현상에 착안해서 물을 품고 있는 DNA 박막 위에 탈수 반응을 일으킬 수 있는 유기 용매를 뿌려 DNA 균열을 원하는 대로 만들어 낼 수 있는 기술을 개발했다. 이를 통해 만들어진 균열 구조 안에 친환경 온열소재, 적외선 발광체 등을 넣어 기능성 바이오 소재를 제작, 스마트 헬스케어 분야에 활용할 수 있을 것으로 보인다.
우리 대학 화학과 윤동기 교수, 기계공학과 유승화 교수, 미국 코넬대 화학공학과 박순모 박사 연구팀이 DNA 박막의 탈수 현상에 기반한 미세구조 균열을 제작했다고 29일 밝혔다.
본래 유전 정보를 저장하는 기능을 하는 DNA는 두 가닥이 서로 꼬여있는 이중나선 사슬 구조, 사슬과 사슬 사이는 2~4 나노미터*(1나노미터는 10억분의 1미터) 주기의 규칙적인 모양을 갖는 등 일반적인 합성 방법으로는 구현하기 힘든 정밀한 구조재료로 구성되어 있다. 이 구조를 변경하기 위해서 DNA를 빌딩블록으로 사용하여 정밀하게 합성하거나 오리가미(종이접기) 기술을 이용해 구현해 왔지만 매우 복잡한 설계과정이 필요하고, 특히 염기서열이 조절된 값비싼 DNA를 이용해야 하는 단점이 있었다.
*수분이 있으면 DNA 사슬 지름이 2 나노미터, 수분이 없으면 4 나노미터가 됨.
연구팀은 이를 극복하기 위해, 연어에서 추출한 DNA 물질을 이용해 기존보다 천 배 이상 저렴한 비용으로 화장용 붓을 이용해 마치 DNA를 수채화 물감과 같이 사용해 그림을 그리듯이 정렬시켰다. 그리고 3D 프린터를 이용해 지름이 2나노미터인 DNA 분자들을 원하는 방향으로 정렬시키면서 말려 얇은 막을 만들었다.
여기에 유기 용매(예: 테트라하이드로퓨란, THF) 방울을 떨어뜨리면 끓는점이 낮은 유기 용매가 DNA내의 수분을 빼앗아 가면서 크랙이 형성되는 현상을 연구팀은 관찰했다. 이때 DNA의 사슬 옆면이 사슬 끝부분에 비해, 물을 상대적으로 많이 포함하고 있어 더 많은 수축이 일어나 결국 DNA 사슬 방향으로 크랙이 형성됐고, DNA 사슬 방향을 원하는 방향으로 조절할 수 있기에 연구팀은 이 크랙도 원하는 방향으로 조절할 수 있는 결과를 얻었다.
연구팀이 개발한 DNA 기반 미세 균열(크랙) 구조 형성 및 제어 기술은 생체 친화적 소재인 DNA로 이루어진 수십-수백 나노미터의 박막에 DNA 사슬방향으로 생긴 크랙(균열)에 다양한 기능성 소재를 채워 넣는 공정이 가능하다. 예로, 온열 소재의 경우 겨울에 따뜻하게 하고 적외선 발광체를 넣으면 탈모나 피부케어 등에 응용되는 등, 생체친화적인 패턴을 바탕으로 기능성을 부여함으로써, 향후 다양한 기능성 바이오 소재 및 헬스케어 분야에 활용될 수 있을 것으로 기대된다.
윤동기 교수는 “DNA 미세 크랙 패터닝은 코끼리 피부가 갈라지는 현상이 체온을 유지하기 위한 한 방법이고, 극심한 가뭄에, 땅이 갈라지는 일은 비가 많이 올 때 더 많은 물을 흡수하기 위함이라는 자연의 현상을 그대로 따라 구현했다”며, “이번 연구는 반도체 패턴만큼이나 작은 DNA 빌딩블록 기반의 미세구조 패턴을 제조한 것으로 환경친화적인 면을 고려할 때 그 의의가 더 크다고 할 수 있다”라고 언급했다.
한편 유승화 교수는 “이번 연구를 통해 DNA 필름의 수축 과정에서 발생하는 균열과 DNA의 배열 패턴 사이의 관계를 고체역학 이론에 기반한 시뮬레이션으로 명확하게 분석하고 예측할 수 있었다”며, “DNA 필름에 국한되지 않은 다양한 이방성 소재에서의 균열 제어와 패터닝 기술 발전에 기여할 수 있는 토대를 마련했다고 생각한다”고 의견을 덧붙였다.
화학과 이소은 석사과정 학생이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘어드밴스드 머터리얼즈 (Advanced Materials)’ 3월 15일 자 온라인 판에 게재됐다. (논문명 : On-demand Crack Formation on DNA Film via Organic Solvent-induced Dehydration)
한편 이번 연구는 과학기술정보통신부-한국연구재단의 멀티스케일 카이랄 구조체 연구센터, 중견연구 과제의 지원을 받아 수행됐다.
가뭄현상이 DNA에 적용되면?
한미 공동연구진이 가뭄이 들면 논바닥이 쩍쩍 갈라지는 현상에 착안해서 물을 품고 있는 DNA 박막 위에 탈수 반응을 일으킬 수 있는 유기 용매를 뿌려 DNA 균열을 원하는 대로 만들어 낼 수 있는 기술을 개발했다. 이를 통해 만들어진 균열 구조 안에 친환경 온열소재, 적외선 발광체 등을 넣어 기능성 바이오 소재를 제작, 스마트 헬스케어 분야에 활용할 수 있을 것으로 보인다.
우리 대학 화학과 윤동기 교수, 기계공학과 유승화 교수, 미국 코넬대 화학공학과 박순모 박사 연구팀이 DNA 박막의 탈수 현상에 기반한 미세구조 균열을 제작했다고 29일 밝혔다.
본래 유전 정보를 저장하는 기능을 하는 DNA는 두 가닥이 서로 꼬여있는 이중나선 사슬 구조, 사슬과 사슬 사이는 2~4 나노미터*(1나노미터는 10억분의 1미터) 주기의 규칙적인 모양을 갖는 등 일반적인 합성 방법으로는 구현하기 힘든 정밀한 구조재료로 구성되어 있다. 이 구조를 변경하기 위해서 DNA를 빌딩블록으로 사용하여 정밀하게 합성하거나 오리가미(종이접기) 기술을 이용해 구현해 왔지만 매우 복잡한 설계과정이 필요하고, 특히 염기서열이 조절된 값비싼 DNA를 이용해야 하는 단점이 있었다.
*수분이 있으면 DNA 사슬 지름이 2 나노미터, 수분이 없으면 4 나노미터가 됨.
연구팀은 이를 극복하기 위해, 연어에서 추출한 DNA 물질을 이용해 기존보다 천 배 이상 저렴한 비용으로 화장용 붓을 이용해 마치 DNA를 수채화 물감과 같이 사용해 그림을 그리듯이 정렬시켰다. 그리고 3D 프린터를 이용해 지름이 2나노미터인 DNA 분자들을 원하는 방향으로 정렬시키면서 말려 얇은 막을 만들었다.
여기에 유기 용매(예: 테트라하이드로퓨란, THF) 방울을 떨어뜨리면 끓는점이 낮은 유기 용매가 DNA내의 수분을 빼앗아 가면서 크랙이 형성되는 현상을 연구팀은 관찰했다. 이때 DNA의 사슬 옆면이 사슬 끝부분에 비해, 물을 상대적으로 많이 포함하고 있어 더 많은 수축이 일어나 결국 DNA 사슬 방향으로 크랙이 형성됐고, DNA 사슬 방향을 원하는 방향으로 조절할 수 있기에 연구팀은 이 크랙도 원하는 방향으로 조절할 수 있는 결과를 얻었다.
연구팀이 개발한 DNA 기반 미세 균열(크랙) 구조 형성 및 제어 기술은 생체 친화적 소재인 DNA로 이루어진 수십-수백 나노미터의 박막에 DNA 사슬방향으로 생긴 크랙(균열)에 다양한 기능성 소재를 채워 넣는 공정이 가능하다. 예로, 온열 소재의 경우 겨울에 따뜻하게 하고 적외선 발광체를 넣으면 탈모나 피부케어 등에 응용되는 등, 생체친화적인 패턴을 바탕으로 기능성을 부여함으로써, 향후 다양한 기능성 바이오 소재 및 헬스케어 분야에 활용될 수 있을 것으로 기대된다.
윤동기 교수는 “DNA 미세 크랙 패터닝은 코끼리 피부가 갈라지는 현상이 체온을 유지하기 위한 한 방법이고, 극심한 가뭄에, 땅이 갈라지는 일은 비가 많이 올 때 더 많은 물을 흡수하기 위함이라는 자연의 현상을 그대로 따라 구현했다”며, “이번 연구는 반도체 패턴만큼이나 작은 DNA 빌딩블록 기반의 미세구조 패턴을 제조한 것으로 환경친화적인 면을 고려할 때 그 의의가 더 크다고 할 수 있다”라고 언급했다.
한편 유승화 교수는 “이번 연구를 통해 DNA 필름의 수축 과정에서 발생하는 균열과 DNA의 배열 패턴 사이의 관계를 고체역학 이론에 기반한 시뮬레이션으로 명확하게 분석하고 예측할 수 있었다”며, “DNA 필름에 국한되지 않은 다양한 이방성 소재에서의 균열 제어와 패터닝 기술 발전에 기여할 수 있는 토대를 마련했다고 생각한다”고 의견을 덧붙였다.
화학과 이소은 석사과정 학생이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘어드밴스드 머터리얼즈 (Advanced Materials)’ 3월 15일 자 온라인 판에 게재됐다. (논문명 : On-demand Crack Formation on DNA Film via Organic Solvent-induced Dehydration)
한편 이번 연구는 과학기술정보통신부-한국연구재단의 멀티스케일 카이랄 구조체 연구센터, 중견연구 과제의 지원을 받아 수행됐다.
2024.03.29
조회수 7026
-
 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15
조회수 7036
-
 연어 DNA를 활용해서도 위조방지 가능
30년이 걸린 천경자 화백의 미인도 관련 위작 스캔들을 보면 알 수 있듯이, 복제방지 분야에 문외한일 가능성이 큰 예술창작자에게 추가적인 짐을 지우고 있다. 이를 해결하기 위한 전자적 방식보다는 광학적 방식으로 예술가에게 친화적인 방식인 브러시로 바르는 즉시 형성되는 물리적 복제 방지 기능(PUF)의 위조 방지 플랫폼 기술이 필요하다.
우리 대학 화학과 윤동기 교수 연구팀이 연성 소재(Soft material)의 자기조립(Self-assembly) 시 발생하는 무작위 패턴을 이용해 보안․인증 원천기술을 개발했다고 23일 밝혔다.
최근 사물인터넷의 발달로 다양한 전자기기 및 서비스가 인터넷으로 연결되어 신기능 창출이 가능하게 되는 동시에 개인의 프라이버시를 침해하는 위조 기술도 발달되어 그 피해를 입는 사례가 빈번하게 보고되고 있다. 그에 따라 더욱 강력하고 높은 보안성을 갖춘 위조 방지 기술에 대한 요구가 꾸준히 증가하고 있다.
연구팀이 개발한 이번 연구는 두 종류의 연성 소재가 자기조립되는 과정에서 자발적으로 발생하는 무작위 패턴을 활용해 사람의 지문과 같이 복제 불가능한 보안 기능을 할 수 있다는 것으로, 보안 분야의 전문가가 아니라도 마치 그림을 그리듯이 위조 방지 기술을 구현할 수 있다는 측면에서 큰 의의를 갖는다. 연구팀은 두 가지 방법을 개발했다.
첫 번째 방법은 액정물질을 이용한 것이다. 액정물질이 패턴 기판 속에 갇혀있을 때, 자발적으로 구조체의 대칭 파괴가 발생해 미로와 같은 구조체가 형성된다(그림 1). 오른쪽으로 트인 구조를 0(파랑), 왼쪽으로 트인 구조를 1(빨강)으로 정의하면, 이를 머신러닝을 이용한 객체 인식을 통해 디지털 코드(0과 1)로 변환돼 지문과 같은 역할을 할 수 있다고 연구팀은 확인했다. 본 연구의 경우 기존의 복잡한 반도체 패턴이 필요하지 않고, 핸드폰 카메라 정도의 해상도로 관찰할 수 있기에 비전문가도 사용할 수 있는 획기적인 기술이다. 이들은 기존의 반도체 칩을 이용한 방법에 비해 쉽게 정보를 재구성할 수 있다는 특이점을 가지고 있다.
두 번째 방법은 연어에서 추출한 DNA를 이용한 것이다. 추출된 DNA를 물에 녹여 붓으로 바르게 되면 좌굴 불안정성(Buckling instability)이 발생해 얼룩말의 무늬와 같은 무작위 패턴을 형성하게 된다. 이때, 무작위한 패턴들은 지문의 특징인 능선 끝 (Ridge Ending)과 분기점 (Bifurcation)이 나타나며 이 또한, 0, 혹은 1로 정의하여, 머신러닝을 통해 디지털화를 할 수 있다. 연구팀은 기존에 널리 사용되고 있는 지문 인식 기술을 이 패턴에 적용해 인공지문과 같이 사용했다. 이 방법은 쉽게 붓으로 제작 가능하며 다양한 색을 혼입시킬 수 있으므로 새로운 보안 잉크로 사용될 수 있다.
연구팀이 개발한 보안기술은 간단한 유기 물질만 사용하고 공정이 단순해 저비용으로 쉽게 보안 코드를 제작할 수 있다. 또한, 제조자의 목적에 따라 원하는 모양 및 크기대로 만들 수 있을 뿐만 아니라 같은 방법으로 제작하더라도 형성되는 무작위 패턴은 모두 다르므로 높은 보안 기능을 가능하게 함으로써 무궁무진한 시장성과 잠재력을 가지고 있다.
윤동기 교수는 “이번 연구들은 자기조립 시 발생하는 자연의 무작위성을 있는 그대로 받아들여 제조자조차 복제할 수 없는 인간의 지문과 같은 역할을 하는 패턴을 제작한 것ˮ이라며, “이러한 아이디어는 자연계에 존재하는 수많은 무작위성을 보안 시스템에 적용할 수 있는 기술의 초석이 될 수 있다ˮ고 설명했다.
한편, 두 연구는 모두 국제 학술지 어드밴스드 머터리얼즈(Advanced Materials)에 “1Planar Spin Glass with Topologically-Protected Mazes in the Liquid Crystal Targeting for Reconfigurable Micro Security Media”와 “2Paintable Physical Unclonable Function Using DNA”의 이름으로 5월 6일과 5일 자에 각각 게재됐다.
1박건형, 최윤석, 권석준*, 윤동기* / 2박순모†, 박건형†, 윤동기* : 공동 제1 저자, * 교신저자.
한편 이번 연구는 과학기술정보통신부-한국연구재단의 지원을 받은 멀티스케일 카이랄 구조체 연구센터, BRIDGE융합연구개발사업, 함께달리기사업, 삼성미래기술육성사업 등의 지원을 받아 수행됐다.
연어 DNA를 활용해서도 위조방지 가능
30년이 걸린 천경자 화백의 미인도 관련 위작 스캔들을 보면 알 수 있듯이, 복제방지 분야에 문외한일 가능성이 큰 예술창작자에게 추가적인 짐을 지우고 있다. 이를 해결하기 위한 전자적 방식보다는 광학적 방식으로 예술가에게 친화적인 방식인 브러시로 바르는 즉시 형성되는 물리적 복제 방지 기능(PUF)의 위조 방지 플랫폼 기술이 필요하다.
우리 대학 화학과 윤동기 교수 연구팀이 연성 소재(Soft material)의 자기조립(Self-assembly) 시 발생하는 무작위 패턴을 이용해 보안․인증 원천기술을 개발했다고 23일 밝혔다.
최근 사물인터넷의 발달로 다양한 전자기기 및 서비스가 인터넷으로 연결되어 신기능 창출이 가능하게 되는 동시에 개인의 프라이버시를 침해하는 위조 기술도 발달되어 그 피해를 입는 사례가 빈번하게 보고되고 있다. 그에 따라 더욱 강력하고 높은 보안성을 갖춘 위조 방지 기술에 대한 요구가 꾸준히 증가하고 있다.
연구팀이 개발한 이번 연구는 두 종류의 연성 소재가 자기조립되는 과정에서 자발적으로 발생하는 무작위 패턴을 활용해 사람의 지문과 같이 복제 불가능한 보안 기능을 할 수 있다는 것으로, 보안 분야의 전문가가 아니라도 마치 그림을 그리듯이 위조 방지 기술을 구현할 수 있다는 측면에서 큰 의의를 갖는다. 연구팀은 두 가지 방법을 개발했다.
첫 번째 방법은 액정물질을 이용한 것이다. 액정물질이 패턴 기판 속에 갇혀있을 때, 자발적으로 구조체의 대칭 파괴가 발생해 미로와 같은 구조체가 형성된다(그림 1). 오른쪽으로 트인 구조를 0(파랑), 왼쪽으로 트인 구조를 1(빨강)으로 정의하면, 이를 머신러닝을 이용한 객체 인식을 통해 디지털 코드(0과 1)로 변환돼 지문과 같은 역할을 할 수 있다고 연구팀은 확인했다. 본 연구의 경우 기존의 복잡한 반도체 패턴이 필요하지 않고, 핸드폰 카메라 정도의 해상도로 관찰할 수 있기에 비전문가도 사용할 수 있는 획기적인 기술이다. 이들은 기존의 반도체 칩을 이용한 방법에 비해 쉽게 정보를 재구성할 수 있다는 특이점을 가지고 있다.
두 번째 방법은 연어에서 추출한 DNA를 이용한 것이다. 추출된 DNA를 물에 녹여 붓으로 바르게 되면 좌굴 불안정성(Buckling instability)이 발생해 얼룩말의 무늬와 같은 무작위 패턴을 형성하게 된다. 이때, 무작위한 패턴들은 지문의 특징인 능선 끝 (Ridge Ending)과 분기점 (Bifurcation)이 나타나며 이 또한, 0, 혹은 1로 정의하여, 머신러닝을 통해 디지털화를 할 수 있다. 연구팀은 기존에 널리 사용되고 있는 지문 인식 기술을 이 패턴에 적용해 인공지문과 같이 사용했다. 이 방법은 쉽게 붓으로 제작 가능하며 다양한 색을 혼입시킬 수 있으므로 새로운 보안 잉크로 사용될 수 있다.
연구팀이 개발한 보안기술은 간단한 유기 물질만 사용하고 공정이 단순해 저비용으로 쉽게 보안 코드를 제작할 수 있다. 또한, 제조자의 목적에 따라 원하는 모양 및 크기대로 만들 수 있을 뿐만 아니라 같은 방법으로 제작하더라도 형성되는 무작위 패턴은 모두 다르므로 높은 보안 기능을 가능하게 함으로써 무궁무진한 시장성과 잠재력을 가지고 있다.
윤동기 교수는 “이번 연구들은 자기조립 시 발생하는 자연의 무작위성을 있는 그대로 받아들여 제조자조차 복제할 수 없는 인간의 지문과 같은 역할을 하는 패턴을 제작한 것ˮ이라며, “이러한 아이디어는 자연계에 존재하는 수많은 무작위성을 보안 시스템에 적용할 수 있는 기술의 초석이 될 수 있다ˮ고 설명했다.
한편, 두 연구는 모두 국제 학술지 어드밴스드 머터리얼즈(Advanced Materials)에 “1Planar Spin Glass with Topologically-Protected Mazes in the Liquid Crystal Targeting for Reconfigurable Micro Security Media”와 “2Paintable Physical Unclonable Function Using DNA”의 이름으로 5월 6일과 5일 자에 각각 게재됐다.
1박건형, 최윤석, 권석준*, 윤동기* / 2박순모†, 박건형†, 윤동기* : 공동 제1 저자, * 교신저자.
한편 이번 연구는 과학기술정보통신부-한국연구재단의 지원을 받은 멀티스케일 카이랄 구조체 연구센터, BRIDGE융합연구개발사업, 함께달리기사업, 삼성미래기술육성사업 등의 지원을 받아 수행됐다.
2023.05.23
조회수 10775
-
 정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
2023.05.15
조회수 9159
-
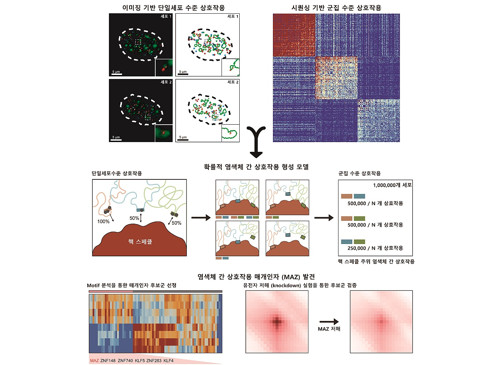 암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10
조회수 7851
-
 RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27
조회수 8782
-
 RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30
조회수 10650
-
 진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25
조회수 17367
-
 박수형 교수, 중증열성혈소판감소증후군 예방 백신 개발
〈 박수형 교수 〉
우리 대학 의과학대학원 박수형 교수 연구팀이 일명 살인진드기병으로 불리는 중증열성혈소판감소증후군(SFTS) 바이러스 감염을 예방하는 백신을 개발했다.
충북대학교 의과대학 최영기 교수와 진원생명과학(주)이 함께 참여한 공동 연구팀은 개발한 백신이 감염 동물모델 실험을 통해 중증열성혈소판감소증후군 바이러스 감염을 완벽하게 억제할 수 있음을 증명했다.
이번 연구를 통해 예방 백신 도출 및 검증 성과뿐 아니라 면역학적 관점에서 백신의 감염 예방 효능을 극대화할 수 있는 항원을 제시함으로써, 추후 중증열성혈소판감소증후군 바이러스에 대한 대응 전략 확립 및 연구에 기여할 것으로 기대된다.
곽정은 박사과정과 충북대학교 김영일 박사가 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 23일 자 온라인판에 게재됐다. (논문명 : Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets)
흔히 살인진드기병으로 알려진 SFTS는 SFTS 바이러스에 감염된 매개 진드기에 물려 발생하는 신종 감염병으로, 최근 발생 빈도 및 지역의 확산으로 WHO에서도 주의해야 할 10대 신, 변종 바이러스 감염병으로 지정한 질병이다.
일반적으로 6~14일의 잠복기 후 고열(38∼40℃)이 3~10일 이어지고, 혈소판 감소 및 백혈구 감소와 구토, 설사 등 소화기 증상이 발생하며, 일부 사례에서는 중증으로 진행돼 사망에 이르기도 한다.
2013년에 한국에서 처음으로 환자가 발생한 이래 발생 건수가 매년 꾸준히 증가하고 있지만, 진드기 접촉 최소화를 통한 예방이 제시될 뿐 현재까지 예방 백신이 개발되지 않았다.
연구팀은 31종의 서로 다른 SFTS 바이러스의 유전자 서열로부터 공통 서열을 도출해 백신 항원을 설계하고, 진원생명과학의 플랫폼을 이용해 DNA 백신을 제작했다.
DNA 백신 기술은 기존 백신과 달리 바이러스 자체가 아닌 유전자만을 사용해 안전하고 기존 백신 대비 광범위한 면역 반응을 유도할 수 있다는 장점이 있다.
연구팀은 감염 동물모델인 패럿에서 백신이 감염을 완벽하게 억제하며 소화기 증상, 혈소판 및 백혈구 감소, 고열, 간 수치 상승 등 감염 환자에서 발생하는 임상 증상들 역시 관찰되지 않음을 확인했다.
특히 연구팀은 해당 바이러스의 전체 유전자에 대한 5종의 백신을 구상해 SFTS 예방 백신 개발에 대한 전략적 접근법을 제시했다.
연구팀은 수동전달 기법(passive transfer)을 통해 바이러스의 당단백질에 대한 항체 면역 반응이 감염억제에 주요한 역할을 함을 규명했다. 또한, 비-당단백질에 대한 T세포 면역 반응 역시 감염 예방에 기여할 수 있음을 밝혔다.
박 교수는 “이번 연구는 SFTS 바이러스 감염을 완벽하게 방어할 수 있는 백신을 최초로 개발하고, 생쥐 모델이 아닌 환자의 임상 증상과 같게 발생하는 패럿 동물모델에서 완벽한 방어효능을 증명했다는 중요한 의의가 있다”라고 말했다.
최 교수는 “이번 SFTS 바이러스 백신 개발 연구 성과는 국제적으로 SFTS 백신 개발을 위한 기술적 우위를 확보했다는 중요한 의의가 있으며, 연구결과를 바탕으로 지속적인 연구를 통해 SFTS 바이러스 백신의 상용화에 기여할 수 있을 것이다”라고 말했다.
향후 임상개발은 이번 연구에 함께 참여한 DNA 백신 개발 전문기업인 진원생명과학(주)을 통해 진행할 계획이다.
이번 연구는 보건복지부 감염병위기대응기술개발사업의 지원을 받아 수행됐다.
박수형 교수, 중증열성혈소판감소증후군 예방 백신 개발
〈 박수형 교수 〉
우리 대학 의과학대학원 박수형 교수 연구팀이 일명 살인진드기병으로 불리는 중증열성혈소판감소증후군(SFTS) 바이러스 감염을 예방하는 백신을 개발했다.
충북대학교 의과대학 최영기 교수와 진원생명과학(주)이 함께 참여한 공동 연구팀은 개발한 백신이 감염 동물모델 실험을 통해 중증열성혈소판감소증후군 바이러스 감염을 완벽하게 억제할 수 있음을 증명했다.
이번 연구를 통해 예방 백신 도출 및 검증 성과뿐 아니라 면역학적 관점에서 백신의 감염 예방 효능을 극대화할 수 있는 항원을 제시함으로써, 추후 중증열성혈소판감소증후군 바이러스에 대한 대응 전략 확립 및 연구에 기여할 것으로 기대된다.
곽정은 박사과정과 충북대학교 김영일 박사가 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 23일 자 온라인판에 게재됐다. (논문명 : Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets)
흔히 살인진드기병으로 알려진 SFTS는 SFTS 바이러스에 감염된 매개 진드기에 물려 발생하는 신종 감염병으로, 최근 발생 빈도 및 지역의 확산으로 WHO에서도 주의해야 할 10대 신, 변종 바이러스 감염병으로 지정한 질병이다.
일반적으로 6~14일의 잠복기 후 고열(38∼40℃)이 3~10일 이어지고, 혈소판 감소 및 백혈구 감소와 구토, 설사 등 소화기 증상이 발생하며, 일부 사례에서는 중증으로 진행돼 사망에 이르기도 한다.
2013년에 한국에서 처음으로 환자가 발생한 이래 발생 건수가 매년 꾸준히 증가하고 있지만, 진드기 접촉 최소화를 통한 예방이 제시될 뿐 현재까지 예방 백신이 개발되지 않았다.
연구팀은 31종의 서로 다른 SFTS 바이러스의 유전자 서열로부터 공통 서열을 도출해 백신 항원을 설계하고, 진원생명과학의 플랫폼을 이용해 DNA 백신을 제작했다.
DNA 백신 기술은 기존 백신과 달리 바이러스 자체가 아닌 유전자만을 사용해 안전하고 기존 백신 대비 광범위한 면역 반응을 유도할 수 있다는 장점이 있다.
연구팀은 감염 동물모델인 패럿에서 백신이 감염을 완벽하게 억제하며 소화기 증상, 혈소판 및 백혈구 감소, 고열, 간 수치 상승 등 감염 환자에서 발생하는 임상 증상들 역시 관찰되지 않음을 확인했다.
특히 연구팀은 해당 바이러스의 전체 유전자에 대한 5종의 백신을 구상해 SFTS 예방 백신 개발에 대한 전략적 접근법을 제시했다.
연구팀은 수동전달 기법(passive transfer)을 통해 바이러스의 당단백질에 대한 항체 면역 반응이 감염억제에 주요한 역할을 함을 규명했다. 또한, 비-당단백질에 대한 T세포 면역 반응 역시 감염 예방에 기여할 수 있음을 밝혔다.
박 교수는 “이번 연구는 SFTS 바이러스 감염을 완벽하게 방어할 수 있는 백신을 최초로 개발하고, 생쥐 모델이 아닌 환자의 임상 증상과 같게 발생하는 패럿 동물모델에서 완벽한 방어효능을 증명했다는 중요한 의의가 있다”라고 말했다.
최 교수는 “이번 SFTS 바이러스 백신 개발 연구 성과는 국제적으로 SFTS 백신 개발을 위한 기술적 우위를 확보했다는 중요한 의의가 있으며, 연구결과를 바탕으로 지속적인 연구를 통해 SFTS 바이러스 백신의 상용화에 기여할 수 있을 것이다”라고 말했다.
향후 임상개발은 이번 연구에 함께 참여한 DNA 백신 개발 전문기업인 진원생명과학(주)을 통해 진행할 계획이다.
이번 연구는 보건복지부 감염병위기대응기술개발사업의 지원을 받아 수행됐다.
2019.08.28
조회수 18590
-
 윤동기 , 김형수 교수, DNA 마이크로패치 제작 기술 개발
〈 윤동기 교수, 김형수 교수, 박순모 연구원 〉
우리 대학 화학과/나노과학기술대학원 윤동기, 기계공학과 김형수 교수 공동 연구팀이 마이크로 크기의 DNA 2차원 마이크로패치 구조체를 제작하고 이를 제어, 응용하는 기술을 개발했다.
윤 교수 연구팀은 커피가 종이에 떨어지고 물이 마르면 동그랗게 환 모양이 생기는 이른바 ‘커피링 효과’라 불리는 현상을 DNA 수용액에 적용해 세계 최초로 DNA 기반의 마이크로패치를 제작했다.
차윤정 박사, 박순모 박사과정 학생이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 7일 자 온라인판에 게재됐다. (논문명 : Microstructure arrays of DNA using topographic control)
유전 정보를 저장하는 기능을 하는 DNA는 이중나선 구조와 나노미터 주기의 규칙적인 모양을 가져 소재 분야에서 일반적인 합성방법으로는 구현하기 힘든 정밀한 구조재료이다. 정밀한 DNA 합성과 오리가미(Origami) 기술을 이용해 스마일 패치(smile patch) 등의 재미있는 모양을 구현해 왔지만, 재료의 가격이 높아 실제 응용에 어려움을 겪었다.
윤 교수 연구팀은 이를 극복하기 위해 연어에서 추출한 DNA 물질을 이용해 기존보다 1천 배 이상 저렴한 비용으로 잘 정렬된 뜨개질(knit) 혹은 아이스크림콘 모양의 기존에 없던 마이크로패치 구조체를 대면적에서 구현했다.
연구팀은 DNA가 물에 녹으면 마치 물풀과 끈적끈적해지면서 서로 적당한 힘으로 끌어당기며 일정한 방향으로 정렬하는 액정상(liquid crystal phase)을 보인다는 점에 주목했다.
액정 표시장치(LC display 혹은 LCD)에서 액정분자들이 전기장을 통해 방향성이 제어되는 것처럼 수용액 상태의 DNA 액정상이 두 기판 사이에서 문질러지며 물의 증발이 이뤄질 때 DNA 나노 구조체들이 원하는 방향으로 정렬하게 된다. 과일 잼을 식빵에 바르면 과일 알맹이(pulp)가 한 방향으로 잘 펴 발라지면서 마르는 현상과 유사하다.
연구팀은 DNA가 한 방향으로 문질러져서 마를 때 바닥에 평평한 기판 대신 일정한 모양을 갖는 수 마이크론 크기의 기둥(혹은 요철)들이 있는 기판을 사용하면 2차원의 뜨개질 모양, 아이스크림콘 모양 등 좀 더 흥미로운 들을 제작할 수 있음을 확인했다.
또한, 금 나노막대와 같은 플라즈몬 공명(plasmon resonance)을 나타내는 소재와 결합해 디스플레이 소자에 응용을 시도했다. 플라스몬 공명은 금속으로 만들어진 기판에 빛을 쪼일 때 그 표면 위에서 전자가 일정하게 진동하면서 자신의 에너지와 일치하는 빛에만 반응하는 현상으로 특정한 색만 반사하여 선명도와 표현력을 높이는 데 사용된다.
이 방식에서 가장 중요한 점은 어떤 방향으로 금 나노막대가 정렬하는지를 나타내는 배향(orientation)이다. 즉 막대들이 한 방향으로 나란히 정렬될 때 광학·전기 특성이 극대화된다. 윤 교수 연구팀은 이러한 점에 착안해 DNA 마이크로패치를 일종의 틀로 삼아 금 나노막대들을 독특한 형태로 배향하고 플라즈몬 컬러 기판을 제작하는 데 성공했다.
연구팀이 개발한 DNA 2차원 마이크로패치 제작 기술은 DNA를 구조재료 및 전자소재로써 활용할 수 있는 단서를 마련했을 뿐 아니라 증발 현상과 DNA 액정물질이 접목될 때 나타나는 독특한 형태의 복잡한 분자 거동 해석에 대한 단서를 제공할 것으로 기대된다.
윤 교수는 “연구를 통해 밝힌 것처럼 DNA가 금 나노막대와 같은 광학 소재와 복합체를 쉽게 만들 수 있는 만큼, 자연계에 무한히 존재하는 DNA를 디스플레이 관련 분야의 신소재로서 응용할 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 과학기술정보통신부-한국연구재단의 전략과제, 멀티스케일 카이랄 구조체 연구센터, 미래유망 융합기술 파이오니아사업과 신진연구 과제의 지원을 받아 수행됐다.
□ 그림 설명
그림1. DNA 분자 배향 모식도
그림2. DNA-금 막대 입자 복합체의 배향 양상과 나타나는 플라즈모닉 광학 현상
윤동기 , 김형수 교수, DNA 마이크로패치 제작 기술 개발
〈 윤동기 교수, 김형수 교수, 박순모 연구원 〉
우리 대학 화학과/나노과학기술대학원 윤동기, 기계공학과 김형수 교수 공동 연구팀이 마이크로 크기의 DNA 2차원 마이크로패치 구조체를 제작하고 이를 제어, 응용하는 기술을 개발했다.
윤 교수 연구팀은 커피가 종이에 떨어지고 물이 마르면 동그랗게 환 모양이 생기는 이른바 ‘커피링 효과’라 불리는 현상을 DNA 수용액에 적용해 세계 최초로 DNA 기반의 마이크로패치를 제작했다.
차윤정 박사, 박순모 박사과정 학생이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 7일 자 온라인판에 게재됐다. (논문명 : Microstructure arrays of DNA using topographic control)
유전 정보를 저장하는 기능을 하는 DNA는 이중나선 구조와 나노미터 주기의 규칙적인 모양을 가져 소재 분야에서 일반적인 합성방법으로는 구현하기 힘든 정밀한 구조재료이다. 정밀한 DNA 합성과 오리가미(Origami) 기술을 이용해 스마일 패치(smile patch) 등의 재미있는 모양을 구현해 왔지만, 재료의 가격이 높아 실제 응용에 어려움을 겪었다.
윤 교수 연구팀은 이를 극복하기 위해 연어에서 추출한 DNA 물질을 이용해 기존보다 1천 배 이상 저렴한 비용으로 잘 정렬된 뜨개질(knit) 혹은 아이스크림콘 모양의 기존에 없던 마이크로패치 구조체를 대면적에서 구현했다.
연구팀은 DNA가 물에 녹으면 마치 물풀과 끈적끈적해지면서 서로 적당한 힘으로 끌어당기며 일정한 방향으로 정렬하는 액정상(liquid crystal phase)을 보인다는 점에 주목했다.
액정 표시장치(LC display 혹은 LCD)에서 액정분자들이 전기장을 통해 방향성이 제어되는 것처럼 수용액 상태의 DNA 액정상이 두 기판 사이에서 문질러지며 물의 증발이 이뤄질 때 DNA 나노 구조체들이 원하는 방향으로 정렬하게 된다. 과일 잼을 식빵에 바르면 과일 알맹이(pulp)가 한 방향으로 잘 펴 발라지면서 마르는 현상과 유사하다.
연구팀은 DNA가 한 방향으로 문질러져서 마를 때 바닥에 평평한 기판 대신 일정한 모양을 갖는 수 마이크론 크기의 기둥(혹은 요철)들이 있는 기판을 사용하면 2차원의 뜨개질 모양, 아이스크림콘 모양 등 좀 더 흥미로운 들을 제작할 수 있음을 확인했다.
또한, 금 나노막대와 같은 플라즈몬 공명(plasmon resonance)을 나타내는 소재와 결합해 디스플레이 소자에 응용을 시도했다. 플라스몬 공명은 금속으로 만들어진 기판에 빛을 쪼일 때 그 표면 위에서 전자가 일정하게 진동하면서 자신의 에너지와 일치하는 빛에만 반응하는 현상으로 특정한 색만 반사하여 선명도와 표현력을 높이는 데 사용된다.
이 방식에서 가장 중요한 점은 어떤 방향으로 금 나노막대가 정렬하는지를 나타내는 배향(orientation)이다. 즉 막대들이 한 방향으로 나란히 정렬될 때 광학·전기 특성이 극대화된다. 윤 교수 연구팀은 이러한 점에 착안해 DNA 마이크로패치를 일종의 틀로 삼아 금 나노막대들을 독특한 형태로 배향하고 플라즈몬 컬러 기판을 제작하는 데 성공했다.
연구팀이 개발한 DNA 2차원 마이크로패치 제작 기술은 DNA를 구조재료 및 전자소재로써 활용할 수 있는 단서를 마련했을 뿐 아니라 증발 현상과 DNA 액정물질이 접목될 때 나타나는 독특한 형태의 복잡한 분자 거동 해석에 대한 단서를 제공할 것으로 기대된다.
윤 교수는 “연구를 통해 밝힌 것처럼 DNA가 금 나노막대와 같은 광학 소재와 복합체를 쉽게 만들 수 있는 만큼, 자연계에 무한히 존재하는 DNA를 디스플레이 관련 분야의 신소재로서 응용할 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 과학기술정보통신부-한국연구재단의 전략과제, 멀티스케일 카이랄 구조체 연구센터, 미래유망 융합기술 파이오니아사업과 신진연구 과제의 지원을 받아 수행됐다.
□ 그림 설명
그림1. DNA 분자 배향 모식도
그림2. DNA-금 막대 입자 복합체의 배향 양상과 나타나는 플라즈모닉 광학 현상
2019.06.18
조회수 22680
-
 주영석 교수, 흡연과 무관한 폐암유발 돌연변이 유년기부터 발생 사실 밝혀
〈 주영석 교수 〉
우리 대학 의과학대학원 주영석 교수와 서울대학교 의과대학(학장 신찬수) 흉부외과 김영태 교수 공동 연구팀이 폐암을 일으키는 융합유전자 유전체 돌연변이의 생성 원리를 규명했다.
이번 연구는 흡연과 무관한 환경에서도 융합유전자로 인해 폐 선암이 발생할 수 있다는 사실을 밝힌 것으로, 비흡연자의 폐암 발생 원인 규명과 더불어 정밀치료 시스템을 구축하는 데 적용 가능할 것으로 기대된다.
우리 대학 출신 이준구 박사(現 하버드 의과대학 박사후연구원)와 박성열 박사과정이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’ 5월 30일 자 온라인판에 게재됐다. (논문명 : Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma) 또한, 이번 연구에는 하버드 의과대학, 한국과학기술정보연구원, 국립암센터 연구자들도 함께 참여했다.
흡연은 폐 선암의 가장 큰 발병 인자로 잘 알려졌지만 암 융합유전자 돌연변이, 즉 ALK, RET, ROS1 등에 의한 암 발생은 대부분 비흡연자에게서 발견된다. 융합유전자로 인한 환자는 전체 폐 선암 환자의 10% 정도를 차지하고 있지만, 이 돌연변이의 생성과정에 대해서는 알려진 것이 거의 없었다.
이전까지의 폐 선암 유전체 연구는 주로 유전자 지역을 규명하는 ‘엑솜 서열분석 기법’이 사용됐으나 연구팀은 유전자 간 부분들을 총망라해 분석하는‘전장 유전체 서열분석 기법’을 대규모로 적용했다.
연구팀은 138개의 폐 선암(lung adenocarcinoma) 사례의 전장 유전체 서열 데이터(whole-genome sequencing)를 생성 및 분석해 암세포에 존재하는 다양한 양상의 유전체 돌연변이를 찾아냈다. 특히 흡연과 무관한 폐암의 직접적 원인인 융합유전자를 생성하는 유전체 구조 변이의 특성을 집중적으로 규명했다.
유전체에 발생하는 구조적 변이는 DNA의 두 부위가 절단된 후 서로 연결되는 단순 구조 변이와 DNA가 많은 조각으로 동시에 파쇄된 후 복잡하게 서로 재조합되는 복잡 구조 변이로 나눌 수 있다.
복잡 구조 변이는 암세포에서 많이 발견된다. DNA의 수백 부위 이상이 동시에 절단된 후 상당 부분 소실되고 일부가 다시 연결되는 ‘염색체 산산조각(chromothripsis)’ 현상이 대표적 사례이다. 연구팀은 70% 이상의 융합유전자가‘유전체 산산조각 (chromothripsis)’ 현상 등 복잡 구조 돌연변이에 의해 생성됨을 확인했다.
또한, 연구팀은 정밀 유전체 분석을 통해 복잡 구조 돌연변이가 폐암이 진단되기 수십 년 전의 어린 나이에도 이미 발생할 수 있다는 사실을 발견했다.
세포의 유전체는 노화에 따라 비교적 일정한 속도로 점돌연변이가 쌓이는데 연구팀은 이를 이용하여 마치 지질학의 연대측정과 비슷한 원리로 특정 구조 변이의 발생 시점을 통계적으로 추정할 수 있는 기술을 개발했다. 이 기술을 통해 융합유전자 발생은 폐암을 진단받기 수십 년 전, 심지어는 10대 이전의 유년기에도 발생할 수 있다는 사실을 확인했다.
이는 암을 일으키는 융합유전자 돌연변이가 흡연과 큰 관련 없이 정상 세포에서 발생할 수 있음을 명확히 보여주는 사례이며, 단일 세포가 암 발생 돌연변이를 획득한 후에도 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적될 필요가 있음을 뜻한다.
연구팀의 이번 연구는 흡연과 무관한 폐암 발생 과정에 대한 지식을 한 단계 확장했다는 의의가 있다. 향후 폐암의 예방, 선별검사 정밀치료 시스템 구축에 이바지할 수 있을 것으로 기대된다.
연구팀은 한국과학기술정보연구원의 슈퍼컴퓨터 5호기 누리온 시스템을 통해 유전체 빅데이터의 신속한 정밀 분석을 수행했다. 슈퍼컴퓨터 5호기는 향후 타 유전체 빅데이터 연구자들에게도 활용 가능할 것으로 보인다.
주영석 교수는 “암유전체 전장서열 빅데이터를 통해 폐암을 발생시키는 첫 돌연변이의 양상을 규명했으며, 정상 폐 세포에서 흡연과 무관하게 이들 복잡 구조변이를 일으키는 분자 기전의 이해가 다음 연구의 핵심이 될 것이다”라고 말했다.
서울대학교 의과대학 김영태 교수는 “2012년 폐 선암의 KIF5B-RET 융합유전자 최초 발견으로 시작된 본 폐암 연구팀이 융합유전자의 생성과정부터 임상적 의미까지 집대성했다는 것이 이번 연구의 중요한 성과이다”라고 말했다.
이번 연구는 한국연구재단, 보건복지부 포스트게놈 다부처유전체사업/세계선도의과학자 육성사업, 서경배 과학재단 및 서울대학교 의과대학 교실지정기부금의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 흡연과 무관한 폐암에서 융합유전자에 의한 발암기전
그림2. 폐선암에서 관찰되는 다양한 복잡 구조 변이의 특성
그림3. 어린 나이에 생긴 융합유전자의 예시
주영석 교수, 흡연과 무관한 폐암유발 돌연변이 유년기부터 발생 사실 밝혀
〈 주영석 교수 〉
우리 대학 의과학대학원 주영석 교수와 서울대학교 의과대학(학장 신찬수) 흉부외과 김영태 교수 공동 연구팀이 폐암을 일으키는 융합유전자 유전체 돌연변이의 생성 원리를 규명했다.
이번 연구는 흡연과 무관한 환경에서도 융합유전자로 인해 폐 선암이 발생할 수 있다는 사실을 밝힌 것으로, 비흡연자의 폐암 발생 원인 규명과 더불어 정밀치료 시스템을 구축하는 데 적용 가능할 것으로 기대된다.
우리 대학 출신 이준구 박사(現 하버드 의과대학 박사후연구원)와 박성열 박사과정이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’ 5월 30일 자 온라인판에 게재됐다. (논문명 : Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma) 또한, 이번 연구에는 하버드 의과대학, 한국과학기술정보연구원, 국립암센터 연구자들도 함께 참여했다.
흡연은 폐 선암의 가장 큰 발병 인자로 잘 알려졌지만 암 융합유전자 돌연변이, 즉 ALK, RET, ROS1 등에 의한 암 발생은 대부분 비흡연자에게서 발견된다. 융합유전자로 인한 환자는 전체 폐 선암 환자의 10% 정도를 차지하고 있지만, 이 돌연변이의 생성과정에 대해서는 알려진 것이 거의 없었다.
이전까지의 폐 선암 유전체 연구는 주로 유전자 지역을 규명하는 ‘엑솜 서열분석 기법’이 사용됐으나 연구팀은 유전자 간 부분들을 총망라해 분석하는‘전장 유전체 서열분석 기법’을 대규모로 적용했다.
연구팀은 138개의 폐 선암(lung adenocarcinoma) 사례의 전장 유전체 서열 데이터(whole-genome sequencing)를 생성 및 분석해 암세포에 존재하는 다양한 양상의 유전체 돌연변이를 찾아냈다. 특히 흡연과 무관한 폐암의 직접적 원인인 융합유전자를 생성하는 유전체 구조 변이의 특성을 집중적으로 규명했다.
유전체에 발생하는 구조적 변이는 DNA의 두 부위가 절단된 후 서로 연결되는 단순 구조 변이와 DNA가 많은 조각으로 동시에 파쇄된 후 복잡하게 서로 재조합되는 복잡 구조 변이로 나눌 수 있다.
복잡 구조 변이는 암세포에서 많이 발견된다. DNA의 수백 부위 이상이 동시에 절단된 후 상당 부분 소실되고 일부가 다시 연결되는 ‘염색체 산산조각(chromothripsis)’ 현상이 대표적 사례이다. 연구팀은 70% 이상의 융합유전자가‘유전체 산산조각 (chromothripsis)’ 현상 등 복잡 구조 돌연변이에 의해 생성됨을 확인했다.
또한, 연구팀은 정밀 유전체 분석을 통해 복잡 구조 돌연변이가 폐암이 진단되기 수십 년 전의 어린 나이에도 이미 발생할 수 있다는 사실을 발견했다.
세포의 유전체는 노화에 따라 비교적 일정한 속도로 점돌연변이가 쌓이는데 연구팀은 이를 이용하여 마치 지질학의 연대측정과 비슷한 원리로 특정 구조 변이의 발생 시점을 통계적으로 추정할 수 있는 기술을 개발했다. 이 기술을 통해 융합유전자 발생은 폐암을 진단받기 수십 년 전, 심지어는 10대 이전의 유년기에도 발생할 수 있다는 사실을 확인했다.
이는 암을 일으키는 융합유전자 돌연변이가 흡연과 큰 관련 없이 정상 세포에서 발생할 수 있음을 명확히 보여주는 사례이며, 단일 세포가 암 발생 돌연변이를 획득한 후에도 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적될 필요가 있음을 뜻한다.
연구팀의 이번 연구는 흡연과 무관한 폐암 발생 과정에 대한 지식을 한 단계 확장했다는 의의가 있다. 향후 폐암의 예방, 선별검사 정밀치료 시스템 구축에 이바지할 수 있을 것으로 기대된다.
연구팀은 한국과학기술정보연구원의 슈퍼컴퓨터 5호기 누리온 시스템을 통해 유전체 빅데이터의 신속한 정밀 분석을 수행했다. 슈퍼컴퓨터 5호기는 향후 타 유전체 빅데이터 연구자들에게도 활용 가능할 것으로 보인다.
주영석 교수는 “암유전체 전장서열 빅데이터를 통해 폐암을 발생시키는 첫 돌연변이의 양상을 규명했으며, 정상 폐 세포에서 흡연과 무관하게 이들 복잡 구조변이를 일으키는 분자 기전의 이해가 다음 연구의 핵심이 될 것이다”라고 말했다.
서울대학교 의과대학 김영태 교수는 “2012년 폐 선암의 KIF5B-RET 융합유전자 최초 발견으로 시작된 본 폐암 연구팀이 융합유전자의 생성과정부터 임상적 의미까지 집대성했다는 것이 이번 연구의 중요한 성과이다”라고 말했다.
이번 연구는 한국연구재단, 보건복지부 포스트게놈 다부처유전체사업/세계선도의과학자 육성사업, 서경배 과학재단 및 서울대학교 의과대학 교실지정기부금의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 흡연과 무관한 폐암에서 융합유전자에 의한 발암기전
그림2. 폐선암에서 관찰되는 다양한 복잡 구조 변이의 특성
그림3. 어린 나이에 생긴 융합유전자의 예시
2019.06.03
조회수 24867
 원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4400
원형 RNA로 특정 유전자 표적 치료한다
코로나19를 계기로 활발히 연구되는 RNA 백신의 효율을 극대화하고자, RNA의 안정성에 관한 연구가 활발히 이뤄지고 있다. 우리 연구진은 생체내 DNA에서 만들어지는 안정한 형태인 동그란 원형 RNA가 세포 내에서 특정 유전자의 발현을 억제할 수 있다는 것을 밝히고, 원형 RNA를 이용한 새로운 형태의 질병치료법을 제시했다.
우리 대학 생명과학과 김윤기 교수 연구팀이 원형 RNA를 이용하여 세포 내 특정 mRNA*의 안정성 조절할 수 있는 새로운 형태의 유전자 발현 조절 기전을 규명했다고 18일 밝혔다.
*mRNA: 메신저 RNA는 단백질을 합성할 수 있는 유전정보를 담아서 이를 전달하는 역할
세포 내에 보존되는 유전정보는 DNA에서 RNA, RNA에서 단백질로 이어지는 중심원리(central dogma)에 의해 조절돼 그 기능이 나타나게 된다. 이 과정에서 세포는 최종적으로 생성되는 단백질의 품질을 엄격히 통제하기 위해 mRNA의 양과 질을 끊임없이 관리한다. 가장 대표적인 mRNA 품질 관리 기전은 ‘논센스 돌연변이 매개 mRNA 분해’다.
김윤기 교수 연구팀은 논센스 돌연변이 매개 mRNA 분해(nonsense-mediated mRNA decay; 이하 NMD)가 원형 RNA (circular RNA)에 의해 유도될 수 있음을 밝혔다. 특히, 해당 기전을 활용해 표적 유전자의 발현을 인위적으로 억제할 수 있음을 규명했다.
DNA에서 만들어진 RNA는 스플라이싱(splicing)* 과정을 통해 성숙되고, 그 결과 성숙된 형태의 선형 RNA가 생성된다. 또한, 최근에 밝혀진 스플라이싱의 또 다른 방법인 백스플라이싱(back-splicing)**을 통해 동그란 형태의 원형 RNA가 생성될 수 있다. 이렇게 생성된 원형 RNA는 세포 내에서 보다 더 안정적으로 존재할 수 있다. 연구팀은 이렇게 형성된 원형 RNA가 특정 mRNA에 결합할 경우, mRNA를 빠르게 분해한다는 것을 밝혔다.
*스플라이싱: DNA에서 갓 만들어진 mRNA 전구체는 인트론(intron)과 액손(exon)으로 구성되어 있다. 스플라이싱 과정을 통해 인트론은 제거되고, 액손만 남은 성숙한 mRNA가 생성된다.
**백스플라이싱: 스플라이싱 과정 동안, 아래쪽 염기서열이 위쪽 염기서열과 연결되는 변형된 형태의 스플라이싱으로서, 일반적인 스플라이싱 대비 염기서열이 거꾸로 연결되기 때문에 백스플라이싱이라고 부른다.
김윤기 교수는 “ 이번 연구를 통해 원형 RNA에 의해 유도되는 표적 유전자 발현을 억제하는 새로운 메커니즘을 밝혀냈다. 또한 인위적으로 제작된 원형 RNA를 이용해 세포 내 특정 mRNA의 양을 조절할 수 있으며, 해당 기능을 인위적으로 조절할 수 있음을 증명했다”고 말했다.
이어 김 교수는 “이 연구 결과는 다양한 질병 치료제 개발에 활용될 수 있을 것으로 기대되며, 교원창업기업인 원형 RNA 플랫폼 개발 회사 라이보텍(주)(대표 김윤기)과 공동연구 및 기술이전을 통해 질병치료제 개발을 가속화 할 계획이다.”고 강조했다.
생명과학과 부성호 박사와 고려대학교 신민경 박사과정생이 공동 제1 저자로 참여한 이번 연구는 12월 11일 자 국제전문학술지 ‘몰레큘러 셀(Molecular Cell)’에 온라인으로 발표됐다. (논문명 : Circular RNAs trigger nonsense-mediated mRNA decay, DOI : 10.1016/j.molcel.2024.11.022)
한편 이번 연구는 한국연구재단의 글로벌리더사업 지원을 받아 수행됐다. 또한, 부성호 박사는 KAIST 장영실 펠로우쉽 지원을 일부 받아 연구를 수행했다.
2024.12.18 조회수 4400 가뭄현상이 DNA에 적용되면?
한미 공동연구진이 가뭄이 들면 논바닥이 쩍쩍 갈라지는 현상에 착안해서 물을 품고 있는 DNA 박막 위에 탈수 반응을 일으킬 수 있는 유기 용매를 뿌려 DNA 균열을 원하는 대로 만들어 낼 수 있는 기술을 개발했다. 이를 통해 만들어진 균열 구조 안에 친환경 온열소재, 적외선 발광체 등을 넣어 기능성 바이오 소재를 제작, 스마트 헬스케어 분야에 활용할 수 있을 것으로 보인다.
우리 대학 화학과 윤동기 교수, 기계공학과 유승화 교수, 미국 코넬대 화학공학과 박순모 박사 연구팀이 DNA 박막의 탈수 현상에 기반한 미세구조 균열을 제작했다고 29일 밝혔다.
본래 유전 정보를 저장하는 기능을 하는 DNA는 두 가닥이 서로 꼬여있는 이중나선 사슬 구조, 사슬과 사슬 사이는 2~4 나노미터*(1나노미터는 10억분의 1미터) 주기의 규칙적인 모양을 갖는 등 일반적인 합성 방법으로는 구현하기 힘든 정밀한 구조재료로 구성되어 있다. 이 구조를 변경하기 위해서 DNA를 빌딩블록으로 사용하여 정밀하게 합성하거나 오리가미(종이접기) 기술을 이용해 구현해 왔지만 매우 복잡한 설계과정이 필요하고, 특히 염기서열이 조절된 값비싼 DNA를 이용해야 하는 단점이 있었다.
*수분이 있으면 DNA 사슬 지름이 2 나노미터, 수분이 없으면 4 나노미터가 됨.
연구팀은 이를 극복하기 위해, 연어에서 추출한 DNA 물질을 이용해 기존보다 천 배 이상 저렴한 비용으로 화장용 붓을 이용해 마치 DNA를 수채화 물감과 같이 사용해 그림을 그리듯이 정렬시켰다. 그리고 3D 프린터를 이용해 지름이 2나노미터인 DNA 분자들을 원하는 방향으로 정렬시키면서 말려 얇은 막을 만들었다.
여기에 유기 용매(예: 테트라하이드로퓨란, THF) 방울을 떨어뜨리면 끓는점이 낮은 유기 용매가 DNA내의 수분을 빼앗아 가면서 크랙이 형성되는 현상을 연구팀은 관찰했다. 이때 DNA의 사슬 옆면이 사슬 끝부분에 비해, 물을 상대적으로 많이 포함하고 있어 더 많은 수축이 일어나 결국 DNA 사슬 방향으로 크랙이 형성됐고, DNA 사슬 방향을 원하는 방향으로 조절할 수 있기에 연구팀은 이 크랙도 원하는 방향으로 조절할 수 있는 결과를 얻었다.
연구팀이 개발한 DNA 기반 미세 균열(크랙) 구조 형성 및 제어 기술은 생체 친화적 소재인 DNA로 이루어진 수십-수백 나노미터의 박막에 DNA 사슬방향으로 생긴 크랙(균열)에 다양한 기능성 소재를 채워 넣는 공정이 가능하다. 예로, 온열 소재의 경우 겨울에 따뜻하게 하고 적외선 발광체를 넣으면 탈모나 피부케어 등에 응용되는 등, 생체친화적인 패턴을 바탕으로 기능성을 부여함으로써, 향후 다양한 기능성 바이오 소재 및 헬스케어 분야에 활용될 수 있을 것으로 기대된다.
윤동기 교수는 “DNA 미세 크랙 패터닝은 코끼리 피부가 갈라지는 현상이 체온을 유지하기 위한 한 방법이고, 극심한 가뭄에, 땅이 갈라지는 일은 비가 많이 올 때 더 많은 물을 흡수하기 위함이라는 자연의 현상을 그대로 따라 구현했다”며, “이번 연구는 반도체 패턴만큼이나 작은 DNA 빌딩블록 기반의 미세구조 패턴을 제조한 것으로 환경친화적인 면을 고려할 때 그 의의가 더 크다고 할 수 있다”라고 언급했다.
한편 유승화 교수는 “이번 연구를 통해 DNA 필름의 수축 과정에서 발생하는 균열과 DNA의 배열 패턴 사이의 관계를 고체역학 이론에 기반한 시뮬레이션으로 명확하게 분석하고 예측할 수 있었다”며, “DNA 필름에 국한되지 않은 다양한 이방성 소재에서의 균열 제어와 패터닝 기술 발전에 기여할 수 있는 토대를 마련했다고 생각한다”고 의견을 덧붙였다.
화학과 이소은 석사과정 학생이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘어드밴스드 머터리얼즈 (Advanced Materials)’ 3월 15일 자 온라인 판에 게재됐다. (논문명 : On-demand Crack Formation on DNA Film via Organic Solvent-induced Dehydration)
한편 이번 연구는 과학기술정보통신부-한국연구재단의 멀티스케일 카이랄 구조체 연구센터, 중견연구 과제의 지원을 받아 수행됐다.
2024.03.29 조회수 7026
가뭄현상이 DNA에 적용되면?
한미 공동연구진이 가뭄이 들면 논바닥이 쩍쩍 갈라지는 현상에 착안해서 물을 품고 있는 DNA 박막 위에 탈수 반응을 일으킬 수 있는 유기 용매를 뿌려 DNA 균열을 원하는 대로 만들어 낼 수 있는 기술을 개발했다. 이를 통해 만들어진 균열 구조 안에 친환경 온열소재, 적외선 발광체 등을 넣어 기능성 바이오 소재를 제작, 스마트 헬스케어 분야에 활용할 수 있을 것으로 보인다.
우리 대학 화학과 윤동기 교수, 기계공학과 유승화 교수, 미국 코넬대 화학공학과 박순모 박사 연구팀이 DNA 박막의 탈수 현상에 기반한 미세구조 균열을 제작했다고 29일 밝혔다.
본래 유전 정보를 저장하는 기능을 하는 DNA는 두 가닥이 서로 꼬여있는 이중나선 사슬 구조, 사슬과 사슬 사이는 2~4 나노미터*(1나노미터는 10억분의 1미터) 주기의 규칙적인 모양을 갖는 등 일반적인 합성 방법으로는 구현하기 힘든 정밀한 구조재료로 구성되어 있다. 이 구조를 변경하기 위해서 DNA를 빌딩블록으로 사용하여 정밀하게 합성하거나 오리가미(종이접기) 기술을 이용해 구현해 왔지만 매우 복잡한 설계과정이 필요하고, 특히 염기서열이 조절된 값비싼 DNA를 이용해야 하는 단점이 있었다.
*수분이 있으면 DNA 사슬 지름이 2 나노미터, 수분이 없으면 4 나노미터가 됨.
연구팀은 이를 극복하기 위해, 연어에서 추출한 DNA 물질을 이용해 기존보다 천 배 이상 저렴한 비용으로 화장용 붓을 이용해 마치 DNA를 수채화 물감과 같이 사용해 그림을 그리듯이 정렬시켰다. 그리고 3D 프린터를 이용해 지름이 2나노미터인 DNA 분자들을 원하는 방향으로 정렬시키면서 말려 얇은 막을 만들었다.
여기에 유기 용매(예: 테트라하이드로퓨란, THF) 방울을 떨어뜨리면 끓는점이 낮은 유기 용매가 DNA내의 수분을 빼앗아 가면서 크랙이 형성되는 현상을 연구팀은 관찰했다. 이때 DNA의 사슬 옆면이 사슬 끝부분에 비해, 물을 상대적으로 많이 포함하고 있어 더 많은 수축이 일어나 결국 DNA 사슬 방향으로 크랙이 형성됐고, DNA 사슬 방향을 원하는 방향으로 조절할 수 있기에 연구팀은 이 크랙도 원하는 방향으로 조절할 수 있는 결과를 얻었다.
연구팀이 개발한 DNA 기반 미세 균열(크랙) 구조 형성 및 제어 기술은 생체 친화적 소재인 DNA로 이루어진 수십-수백 나노미터의 박막에 DNA 사슬방향으로 생긴 크랙(균열)에 다양한 기능성 소재를 채워 넣는 공정이 가능하다. 예로, 온열 소재의 경우 겨울에 따뜻하게 하고 적외선 발광체를 넣으면 탈모나 피부케어 등에 응용되는 등, 생체친화적인 패턴을 바탕으로 기능성을 부여함으로써, 향후 다양한 기능성 바이오 소재 및 헬스케어 분야에 활용될 수 있을 것으로 기대된다.
윤동기 교수는 “DNA 미세 크랙 패터닝은 코끼리 피부가 갈라지는 현상이 체온을 유지하기 위한 한 방법이고, 극심한 가뭄에, 땅이 갈라지는 일은 비가 많이 올 때 더 많은 물을 흡수하기 위함이라는 자연의 현상을 그대로 따라 구현했다”며, “이번 연구는 반도체 패턴만큼이나 작은 DNA 빌딩블록 기반의 미세구조 패턴을 제조한 것으로 환경친화적인 면을 고려할 때 그 의의가 더 크다고 할 수 있다”라고 언급했다.
한편 유승화 교수는 “이번 연구를 통해 DNA 필름의 수축 과정에서 발생하는 균열과 DNA의 배열 패턴 사이의 관계를 고체역학 이론에 기반한 시뮬레이션으로 명확하게 분석하고 예측할 수 있었다”며, “DNA 필름에 국한되지 않은 다양한 이방성 소재에서의 균열 제어와 패터닝 기술 발전에 기여할 수 있는 토대를 마련했다고 생각한다”고 의견을 덧붙였다.
화학과 이소은 석사과정 학생이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘어드밴스드 머터리얼즈 (Advanced Materials)’ 3월 15일 자 온라인 판에 게재됐다. (논문명 : On-demand Crack Formation on DNA Film via Organic Solvent-induced Dehydration)
한편 이번 연구는 과학기술정보통신부-한국연구재단의 멀티스케일 카이랄 구조체 연구센터, 중견연구 과제의 지원을 받아 수행됐다.
2024.03.29 조회수 7026 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7036
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7036 연어 DNA를 활용해서도 위조방지 가능
30년이 걸린 천경자 화백의 미인도 관련 위작 스캔들을 보면 알 수 있듯이, 복제방지 분야에 문외한일 가능성이 큰 예술창작자에게 추가적인 짐을 지우고 있다. 이를 해결하기 위한 전자적 방식보다는 광학적 방식으로 예술가에게 친화적인 방식인 브러시로 바르는 즉시 형성되는 물리적 복제 방지 기능(PUF)의 위조 방지 플랫폼 기술이 필요하다.
우리 대학 화학과 윤동기 교수 연구팀이 연성 소재(Soft material)의 자기조립(Self-assembly) 시 발생하는 무작위 패턴을 이용해 보안․인증 원천기술을 개발했다고 23일 밝혔다.
최근 사물인터넷의 발달로 다양한 전자기기 및 서비스가 인터넷으로 연결되어 신기능 창출이 가능하게 되는 동시에 개인의 프라이버시를 침해하는 위조 기술도 발달되어 그 피해를 입는 사례가 빈번하게 보고되고 있다. 그에 따라 더욱 강력하고 높은 보안성을 갖춘 위조 방지 기술에 대한 요구가 꾸준히 증가하고 있다.
연구팀이 개발한 이번 연구는 두 종류의 연성 소재가 자기조립되는 과정에서 자발적으로 발생하는 무작위 패턴을 활용해 사람의 지문과 같이 복제 불가능한 보안 기능을 할 수 있다는 것으로, 보안 분야의 전문가가 아니라도 마치 그림을 그리듯이 위조 방지 기술을 구현할 수 있다는 측면에서 큰 의의를 갖는다. 연구팀은 두 가지 방법을 개발했다.
첫 번째 방법은 액정물질을 이용한 것이다. 액정물질이 패턴 기판 속에 갇혀있을 때, 자발적으로 구조체의 대칭 파괴가 발생해 미로와 같은 구조체가 형성된다(그림 1). 오른쪽으로 트인 구조를 0(파랑), 왼쪽으로 트인 구조를 1(빨강)으로 정의하면, 이를 머신러닝을 이용한 객체 인식을 통해 디지털 코드(0과 1)로 변환돼 지문과 같은 역할을 할 수 있다고 연구팀은 확인했다. 본 연구의 경우 기존의 복잡한 반도체 패턴이 필요하지 않고, 핸드폰 카메라 정도의 해상도로 관찰할 수 있기에 비전문가도 사용할 수 있는 획기적인 기술이다. 이들은 기존의 반도체 칩을 이용한 방법에 비해 쉽게 정보를 재구성할 수 있다는 특이점을 가지고 있다.
두 번째 방법은 연어에서 추출한 DNA를 이용한 것이다. 추출된 DNA를 물에 녹여 붓으로 바르게 되면 좌굴 불안정성(Buckling instability)이 발생해 얼룩말의 무늬와 같은 무작위 패턴을 형성하게 된다. 이때, 무작위한 패턴들은 지문의 특징인 능선 끝 (Ridge Ending)과 분기점 (Bifurcation)이 나타나며 이 또한, 0, 혹은 1로 정의하여, 머신러닝을 통해 디지털화를 할 수 있다. 연구팀은 기존에 널리 사용되고 있는 지문 인식 기술을 이 패턴에 적용해 인공지문과 같이 사용했다. 이 방법은 쉽게 붓으로 제작 가능하며 다양한 색을 혼입시킬 수 있으므로 새로운 보안 잉크로 사용될 수 있다.
연구팀이 개발한 보안기술은 간단한 유기 물질만 사용하고 공정이 단순해 저비용으로 쉽게 보안 코드를 제작할 수 있다. 또한, 제조자의 목적에 따라 원하는 모양 및 크기대로 만들 수 있을 뿐만 아니라 같은 방법으로 제작하더라도 형성되는 무작위 패턴은 모두 다르므로 높은 보안 기능을 가능하게 함으로써 무궁무진한 시장성과 잠재력을 가지고 있다.
윤동기 교수는 “이번 연구들은 자기조립 시 발생하는 자연의 무작위성을 있는 그대로 받아들여 제조자조차 복제할 수 없는 인간의 지문과 같은 역할을 하는 패턴을 제작한 것ˮ이라며, “이러한 아이디어는 자연계에 존재하는 수많은 무작위성을 보안 시스템에 적용할 수 있는 기술의 초석이 될 수 있다ˮ고 설명했다.
한편, 두 연구는 모두 국제 학술지 어드밴스드 머터리얼즈(Advanced Materials)에 “1Planar Spin Glass with Topologically-Protected Mazes in the Liquid Crystal Targeting for Reconfigurable Micro Security Media”와 “2Paintable Physical Unclonable Function Using DNA”의 이름으로 5월 6일과 5일 자에 각각 게재됐다.
1박건형, 최윤석, 권석준*, 윤동기* / 2박순모†, 박건형†, 윤동기* : 공동 제1 저자, * 교신저자.
한편 이번 연구는 과학기술정보통신부-한국연구재단의 지원을 받은 멀티스케일 카이랄 구조체 연구센터, BRIDGE융합연구개발사업, 함께달리기사업, 삼성미래기술육성사업 등의 지원을 받아 수행됐다.
2023.05.23 조회수 10775
연어 DNA를 활용해서도 위조방지 가능
30년이 걸린 천경자 화백의 미인도 관련 위작 스캔들을 보면 알 수 있듯이, 복제방지 분야에 문외한일 가능성이 큰 예술창작자에게 추가적인 짐을 지우고 있다. 이를 해결하기 위한 전자적 방식보다는 광학적 방식으로 예술가에게 친화적인 방식인 브러시로 바르는 즉시 형성되는 물리적 복제 방지 기능(PUF)의 위조 방지 플랫폼 기술이 필요하다.
우리 대학 화학과 윤동기 교수 연구팀이 연성 소재(Soft material)의 자기조립(Self-assembly) 시 발생하는 무작위 패턴을 이용해 보안․인증 원천기술을 개발했다고 23일 밝혔다.
최근 사물인터넷의 발달로 다양한 전자기기 및 서비스가 인터넷으로 연결되어 신기능 창출이 가능하게 되는 동시에 개인의 프라이버시를 침해하는 위조 기술도 발달되어 그 피해를 입는 사례가 빈번하게 보고되고 있다. 그에 따라 더욱 강력하고 높은 보안성을 갖춘 위조 방지 기술에 대한 요구가 꾸준히 증가하고 있다.
연구팀이 개발한 이번 연구는 두 종류의 연성 소재가 자기조립되는 과정에서 자발적으로 발생하는 무작위 패턴을 활용해 사람의 지문과 같이 복제 불가능한 보안 기능을 할 수 있다는 것으로, 보안 분야의 전문가가 아니라도 마치 그림을 그리듯이 위조 방지 기술을 구현할 수 있다는 측면에서 큰 의의를 갖는다. 연구팀은 두 가지 방법을 개발했다.
첫 번째 방법은 액정물질을 이용한 것이다. 액정물질이 패턴 기판 속에 갇혀있을 때, 자발적으로 구조체의 대칭 파괴가 발생해 미로와 같은 구조체가 형성된다(그림 1). 오른쪽으로 트인 구조를 0(파랑), 왼쪽으로 트인 구조를 1(빨강)으로 정의하면, 이를 머신러닝을 이용한 객체 인식을 통해 디지털 코드(0과 1)로 변환돼 지문과 같은 역할을 할 수 있다고 연구팀은 확인했다. 본 연구의 경우 기존의 복잡한 반도체 패턴이 필요하지 않고, 핸드폰 카메라 정도의 해상도로 관찰할 수 있기에 비전문가도 사용할 수 있는 획기적인 기술이다. 이들은 기존의 반도체 칩을 이용한 방법에 비해 쉽게 정보를 재구성할 수 있다는 특이점을 가지고 있다.
두 번째 방법은 연어에서 추출한 DNA를 이용한 것이다. 추출된 DNA를 물에 녹여 붓으로 바르게 되면 좌굴 불안정성(Buckling instability)이 발생해 얼룩말의 무늬와 같은 무작위 패턴을 형성하게 된다. 이때, 무작위한 패턴들은 지문의 특징인 능선 끝 (Ridge Ending)과 분기점 (Bifurcation)이 나타나며 이 또한, 0, 혹은 1로 정의하여, 머신러닝을 통해 디지털화를 할 수 있다. 연구팀은 기존에 널리 사용되고 있는 지문 인식 기술을 이 패턴에 적용해 인공지문과 같이 사용했다. 이 방법은 쉽게 붓으로 제작 가능하며 다양한 색을 혼입시킬 수 있으므로 새로운 보안 잉크로 사용될 수 있다.
연구팀이 개발한 보안기술은 간단한 유기 물질만 사용하고 공정이 단순해 저비용으로 쉽게 보안 코드를 제작할 수 있다. 또한, 제조자의 목적에 따라 원하는 모양 및 크기대로 만들 수 있을 뿐만 아니라 같은 방법으로 제작하더라도 형성되는 무작위 패턴은 모두 다르므로 높은 보안 기능을 가능하게 함으로써 무궁무진한 시장성과 잠재력을 가지고 있다.
윤동기 교수는 “이번 연구들은 자기조립 시 발생하는 자연의 무작위성을 있는 그대로 받아들여 제조자조차 복제할 수 없는 인간의 지문과 같은 역할을 하는 패턴을 제작한 것ˮ이라며, “이러한 아이디어는 자연계에 존재하는 수많은 무작위성을 보안 시스템에 적용할 수 있는 기술의 초석이 될 수 있다ˮ고 설명했다.
한편, 두 연구는 모두 국제 학술지 어드밴스드 머터리얼즈(Advanced Materials)에 “1Planar Spin Glass with Topologically-Protected Mazes in the Liquid Crystal Targeting for Reconfigurable Micro Security Media”와 “2Paintable Physical Unclonable Function Using DNA”의 이름으로 5월 6일과 5일 자에 각각 게재됐다.
1박건형, 최윤석, 권석준*, 윤동기* / 2박순모†, 박건형†, 윤동기* : 공동 제1 저자, * 교신저자.
한편 이번 연구는 과학기술정보통신부-한국연구재단의 지원을 받은 멀티스케일 카이랄 구조체 연구센터, BRIDGE융합연구개발사업, 함께달리기사업, 삼성미래기술육성사업 등의 지원을 받아 수행됐다.
2023.05.23 조회수 10775 정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
2023.05.15 조회수 9159
정크 DNA가 노화와 발암에 관여한다
인간 유전체 중 일반적인 단백질 생성 유전자는 전체 염기서열의 1% 정도에 불과하며 나머지 99%의 유전체 영역은 그 기능이 뚜렷하게 알려지지 않아 ‘쓸모없는 DNA’라는 뜻으로 ‘정크 DNA’라고 불리고 있다. 정크 DNA 가운데 약 1/6을 차지하는 L1 점핑 유전자는 활성화될 경우 세포의 유전정보를 파괴하거나 교란하는 역할을 할 수 있어 사람의 진화 과정에서 불활성화(화석화) 됐다고 알려져 있었다. 하지만 이번 연구에서 L1 점핑 유전자가 활성화되며, 노화와 발암 과정에 연관이 있음을 처음 확인하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 서울대학교병원 외과 김민정 교수, 고려대학교 의과대학 권현우 교수팀과의 공동연구로 ‘L1 점핑 유전자’의 활성화에 의한 사람 대장 상피 세포의 유전체 파괴 현상을 규명했다고 15일 밝혔다.
의과학대학원 남창현 박사과정과 육정환 박사(現 서울대병원 내과 임상조교수)가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처(Nature)' 5월 10일 字 온라인판(영국 현지시간)에 게재됐다 (논문명 : Widespread somatic L1 retrotransposition in normal colorectal epithelium). 이번 연구에는 한국과학기술정보연구원 (KISTI), 서울대학교병원 내과, 연세대학교 의과대학, 서울시립대학교, 및 KAIST 교원창업기업 지놈인사이트(Genome Insight)의 연구자들도 참여했다.
우리 몸에서 L1 점핑 유전자의 활성화는 유전체 서열의 ‘파괴적 혁신’을 일으킬 수 있기 때문에 인간 종의 진화 과정을 촉진하였다고 알려져 있으나, 사람 개개인의 입장에서는 L1 점핑 유전자의 활성화가 세포 유전체의 파괴 및 암 등 질병 발생을 촉진하여 생존에 불리하기 때문에 현생 인류에서 대다수의 L1 점핑 유전자는 불활성화(화석화)된 것으로 여겨졌다.
이번 연구는 이러한 일반적인 믿음과는 달리 L1 점핑 유전자의 일부는 아직도 특정 조직에서 활성화될 수 있고, 노화 과정에서 이들이 유전체 돌연변이를 빈번하게 생성하고 있음을 명확하게 규명하여, 세포의 노화 및 암 발생 과정을 이해하는 새로운 관점을 제시한 것으로 평가된다.
연구팀은 28명의 개인의 피부(섬유아세포), 혈액 및 대장 상피 조직에서 확보한 총 899개 단일세포의 전장 유전체(whole-genome sequencing) 서열을 생명정보학 기법으로 분석했다. L1 점핑 유전자에 의한 돌연변이의 빈도는 세포 종류에 따라 큰 차이를 보였으며 노화된 대장 상피세포에서 주로 발견됐다. 연구팀은 L1 점핑 유전자의 활성화에 의한 대장 상피세포의 유전체 돌연변이가 태어나기 전 배아 발생단계에서부터 평생에 걸쳐서 지속적으로 일어나고 있음을 확인했다. 연구에 따르면 40세가 된 개인의 대장 상피 세포들은 평균적으로 1개 이상의 L1 점핑 유전자에 의한 돌연변이를 갖게 된다.
연구팀은 L1 점핑 유전자 활성화 기전을 추적하기 위해 DNA 뿐만 아니라 후성 유전체 (DNA 메틸레이션) 서열을 함께 확인하였다. L1 점핑 유전자가 활성화된 세포에서는 후성 유전체의 불안정성이 발견되어 후성 유전체의 변화가 L1 점핑 유전자의 활성을 조절하는 스위치임을 확인하였다. 연구팀은 세포들의 배아발생과정을 추적하여, 이러한 후성 유전체 불안정성의 대다수가 초기 배아 발생과정에 형성되었음을 제시하였다.
이번 연구는 향후 더 많은 조직에서 L1 점핑유전자 활성화에 의한 노화 및 발암 과정을 확인하고 이의 활성화를 억제하여 인체 노화 및 질환 발생을 제어하는 기술개발에 이바지할 수 있을 것으로 연구팀은 기대했다.
의과학대학원 주영석 교수는 "전장유전체 및 생명정보학의 광범위한 적용을 통해 그동안 규명하기 어려웠던 L1 점핑 유전자에 의한 생명현상을 확인한 대표적인 연구ˮ라며 “이번 연구는 DNA 돌연변이가 암이나 질환을 갖고 있는 세포의 전유물이 아니며, 인간의 정상 세포의 노화과정에서 세포 자체의 불안정성에 의해 끊임없이 돌연변이가 생성되고 있음을 보여준다”라고 말했다.
서울대학교병원 외과 김민정 교수는 "임상현장에서 체계적으로 확보한 사람 유래 조직이 실제 인간에서 일어나는 질병 과정을 발견하는 데 큰 역할을 할 수 있음을 보여주는 사례ˮ라며 "향후 임상 및 기초의학의 밀접한 공동연구가 필요하다ˮ라고 말했다.
고려대학교 의과대학 핵의학과 권현우 교수는 “그동안 연구팀에서 고도화한 단일세포 유전체 기술이 큰 결실을 맺게 되어 기쁘다”라며 “앞으로 지속적으로 단일세포 유전체 기술을 선도할 수 있도록 매진할 것”이라고 말했다.
한편 이번 연구는 한국연구재단 리더연구, 한국연구재단 생애첫연구, 한국보건산업진흥원 융합형 의사과학자 양성 지원 사업, 서경배과학재단 신진과학자 연구지원 프로그램의 지원을 받아 수행됐다.
2023.05.15 조회수 9159 암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 7851
암, 노화 등에 미치는 게놈 3차 구조의 신규 원리 발견
3차원 게놈 구조 연구를 통해, 세포핵 내 게놈이 계층적인 구조로 이루어져 있으며 각 구조가 다양한 유전자 발현 조절에 관여한다는 것이 알려져 있다. 또한 이러한 게놈 3차 구조는 암, 노화 등 다양한 복합질환에서 질환 특이적 유전자 발현과 밀접한 연관이 있음이 최근 밝혀지고 있다. 하지만 기존 게놈 3차 구조는 비교적 관찰이 쉬운 염색체 내 상호작용에 대부분 국한되어 있었고, 더 큰 범위에서의 염색체 간 상호작용에 대해서는 관찰 실험 기법의 한계로 인해 연구가 거의 진행되지 않았다.
우리 대학은 생명과학과 정인경 교수 연구팀이 서울대학교 기계공학부 신용대 교수 연구팀, 부산대학교 최정모 교수 연구팀과의 공동연구를 통해 세포핵 내 3차원 게놈 구조 신규 생성 원리와 이를 조절하는 매개 인자를 발견했다고 10일(월) 밝혔다.
생명과학과 주재건 석박사통합과정과 서울대학교 조성현 연구원이 주도한 이번 연구에서 연구팀은 행렬 분해 기법이란 분석 기법을 활용하여 게놈 3차 구조 데이터로부터 염색체 간 상호작용 정보를 효과적으로 추출할 수 있는 신규 기계 학습 알고리즘을 개발했으며, 이를 DNA 이미징 기법을 통해 검증했다.
연구팀은 해당 분석 알고리즘을 이용해 여러 세포주의 염색체 간 상호작용 정보를 추출 및 분석했고, 핵 스페클(핵 내 존재하는 막이 없는 구조체) 주위에 위치한 염색체 간 상호작용이 여러 세포에서 공통적으로 보존됨을 관찰했다. 또한 연구팀은 단백질 인식 염기서열(DNA motif) 분석을 통해 스페클 주위 염색체 간 상호작용이 MAZ 단백질에 의해 매개됨을 최초로 발견했다.
또한, 연구팀은 단일세포 수준에서 염색체 간 상호작용이 세포마다 다르게 발생한다는 사실을 발견하였다. 연구팀은 염색체 간 상호작용이 기존에 알려져 있던 것과 달리 고정되어 있지 않으며, 핵체와 게놈 지역 사이의 개별 상호작용을 통해 확률적으로 결정된다는 내용을 제시하여 염색체 간 상호작용의 원리를 최초로 규명하였다.
이번 연구 결과는 국제 학술지, `핵산 연구(Nucleic acids research, IF=19.16)'에 4월 5일자 출판됐다. (논문제목: Probabilistic establishment of speckle-associated inter-chromosomal interactions)
이번 연구는 기존에 알려지지 않았던 염색체 간 상호작용의 형성 원리와 매개 인자인 MAZ 단백질의 역할을 밝힘으로써 더 큰 범위에서의 게놈 3차 구조에 대한 근본적인 원리 규명 단서를 제공했다는 점에서 큰 의의가 있다.
이번 연구를 주도한 우리 대학 주재건 석박사통합과정은 "그동안 실험 기법의 한계로 인해 가려져 있었던 염색체 간 상호작용 형성 원리를 밝혀낸 연구이다”라고 설명하였다. 우리 대학 정인경 교수는 “향후 게놈 3차 구조에 따른 유전자 발현 조절 분야와 암 질환 등에서 빈번하게 보고되고 있는 염색체 변이 원인 규명 등에서 핵체 (nuclear body)와 게놈 간 상호작용의 중요성을 이해할 수 있을 것으로 기대되는 성과ˮ 라고 연구 결과를 소개했다.
한편 이번 연구는 서경배과학재단, 삼성미래기술육성재단과 과학기술정보통신부의 지원을 받아 수행됐다.
2023.04.10 조회수 7851 RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 8782
RNA 합성에서 ‘기다림의 미학’ 규명
DNA에서 RNA를 생성하는 과정을 마무리 짓는 전사종결인자가 단백질 로(이하 Rho)이다. 일반 단백질이 작용물질에 미리 붙어 있으면 반응이 빨리 된다는 통념과 다르게 RNA 중합효소에 붙어 기다리는 Rho는 중합효소가 오래 멈출수록 종결 효율이 높아진다는 유의미한 결과가 발표되었다. 이번 연구 결과를 통해 자연에서 기다림의 미학이 증명된 것이다.
우리 대학 생명과학과 강창원 명예교수(KAIST 줄기세포연구센터 고문)와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 화학과 강진영 교수, 우리 대학 생명과학과 서연수 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 동역학적 특성을 발견했으며 그런 특성이 유전자 발현 조절에 미치는 생물학적 기능을 규명했다고 27일 밝혔다.
공동 연구팀은 세균의 전사 종결에 단백질 Rho가 관여하는 분자기작에 관해 작년에 국제학술지 네이처 커뮤니케이션즈(Nature Communications)에 발표한 바에 따르면, Rho가 중합효소에 미리 결합해 RNA의 특수부위를 기다린 후 중합효소‧DNA‧RNA의 전사 복합체를 해체하는 방식과 Rho가 RNA에 먼저 결합해 중합효소를 쫓아간 후 복합체를 해체하는 방식, 쫓아간 후 RNA만 방출하고 중합효소가 DNA에 남는 방식 등 세 갈래로 나뉘어 진행된다. (아래 그림 참조)
그런데 흥미롭게도 세 갈래 진행하는 속도가 기존 통념과는 다른 새로운 사실을 발견했다. 기존에는 Rho가 RNA에 붙어 중합효소를 쫓아가서 끝내는 방식과 비교하면 Rho가 중합효소에 미리 붙어 기다렸다가 끝내는 방식이 쫓아가는 시간이 들지 않기 때문에 더 빠를 것으로 인식되어 왔다. 하지만 공동 연구팀의 연구 결과는 기다려서 끝내는 방식이 오히려 더 느렸다. 그런데 느린 기다림 방식은 중합효소의 멈춤 시간이 길수록 종결 효율이 높고 상황에 따라 달라질 수 있는 반면에 쫓아가는 빠른 방식은 종결 효율이 중합효소 멈춘 시간과 상관이 없으며 상황에 따라 변화의 여지도 없다는 사실을 새롭게 밝혔다.
RNA가 방출되는 전사 종결이 일어나려면 RNA의 연장 합성이 일단 멈춰야 한다. 종결이 더디게 일어나려면 멈춤이 오래 유지되어야 하므로 전사 멈춤 시간과 전사 종결 효율의 상관관계를 이번 공동 연구에서 분석했다. 연구 결과, 기다려서 전사의 세 갈래 끝내기 방식이 진행하는 속도가 제각각 다를 뿐 아니라 그 조절 양상도 다르다는 것을 처음으로 규명한 것이다.
생물물리학 분야 첨단 기술인 단일분자 실험을 수행한 서울대 물리천문학부 송은호 박사과정 대학원생이 제1 저자로 참여한 이번 논문(제목: Transcriptional pause extension benefits the stand-by rather than catch-up Rho-dependent termination)은 저명 국제학술지 핵산연구(Nucleic Acids Research, 최근 영향지수 = 19.160)에 지난 2월 10일 자 게재됐다. KAIST 팔린다 무나싱하 박사, KAIST 황승하 박사과정 대학원생도 참여해 저자가 총 7명이다.
송은호 제1 저자는 "기존 통념과 상반된 결과를 처음 발견했을 때 당황스러웠지만 데이터를 꾸준히 쌓아가고 적절한 통계 모델을 통해서 그 결과를 검증해냈을 때 뿌듯했고, 또 이 발견의 생물학적 역할을 규명했을 때 더욱 기뻤다ˮ며 "항생제 개발 등에 중요한 단서를 줄 것이다ˮ라고 연구의 의의를 설명했다.
이번 공동 연구에는 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현을 탐구하는 생명과학자, 중합체 구조를 분석하는 화학자가 두루 참여했다. 다양한 분야의 전공자가 꾸준히 협업하는 다학제 기초과학 연구의 우수 사례이며, 이번 연구는 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업의 지원을 받았고, 논문게재비는 KAIST에서 지원했다.
2023.02.27 조회수 8782 RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30 조회수 10650
RNA 합성의 세 갈래 끝내기 제시
우리 대학 생명과학과 강창원 명예교수와 서울대학교 물리천문학부 홍성철 교수의 공동 연구팀이 우리 대학 생명과학과 서연수 교수, 우리 대학 화학과 강진영 교수 연구팀과 협업 연구를 통해 RNA 합성 종결인자의 작동원리에 관한 여러 오래된 논쟁을 한꺼번에 잠재울 수 있는 ‘세 갈래 끝내기’를 제시했다고 30일 밝혔다.
유전자가 발현되는 첫 단계는 유전자 DNA에 맞춰 RNA 중합효소가 RNA를 합성함으로써 유전정보가 DNA 거푸집에서 RNA 생산물로 복사되는 이른바 전사 과정이다. 이 전사가 어떻게 마무리되는지를 연구하면서, RNA 합성을 끝내게 하는 대장균 전사종결인자 단백질의 작동원리를 규명해, 지난 30년 가까이 여러 학설이 대립해 온 논란에 종지부를 찍을 전망이다.
전사 과정에서 중합효소에 거푸집 DNA와 생산물 RNA가 함께 붙어있는 전사 복합체로부터 RNA가 분리되는 종결 단계에 이르기 전에 종결인자가 RNA의 특정 위치에 있는 종결 신호에 먼저 붙은 후 앞서 있는 중합효소를 ‘쫓아가서’ 전사를 종결한다는 작동원리가 1977년에 처음 제시됐다.
이와 다르게, 종결인자가 중합효소에 미리 붙어있다가 RNA 종결 신호를 ‘기다려서’ 전사를 끝낸다는 원리가 1994년에 제안돼 그 후 지금까지 28년 동안 종결 준비 단계에 관해서 두 학설이 맞서 왔는데, 이번 연구에서 둘 다 실제 일어난다는 것이 확증됐다. 즉, 종결인자가 쫓아가기도 하고 기다리기도 하는데, 서로 배타적이지 않고 함께 공존한다는 점이 새롭다.
그 외에, 생산물 RNA가 분리되는 종결 방식에 관해서도 학설이 분분했다. 예를 들어, 종결인자가 전사 복합체에 있는 RNA를 잡아당겨 벗겨내는 방식으로 분리한다는 주장이 2002년에 나왔고, 이에 반해, 종결인자가 중합효소를 밀어냄으로써 RNA가 분리된다는 설이 2006년에 제안돼 대립했다.
또한, 전사 종결로 RNA가 분리된 후 결과적으로, DNA는 중합효소에 남아서 곧장 재사용돼 쉽게 전사를 다시 시작할 수 있기도 하고, 그렇지 않으면 RNA와 동시에 DNA마저 중합효소에서 떨어져서 전사 복합체가 일시에 무너져 재사용이 지체되기도 한다는 것이 강창원‧홍성철 공동 연구팀에 의해 근래 2020년에 밝혀지기도 했다.
이번 연구에서, 준비에 관한 2가지, 방식 2가지, 결과 2가지 학설이 모두 실제 확증됐다. 그렇다면 준비-방식-결과의 조합으로 총 2×2×2, 즉 8가지가 가능한데, 실제로는 일부가 밀접하게 연계돼서 3가지 조합만이 실행된다고 밝혀졌다. 그래서 ‘세 갈래 끝내기’라고 명명됐다. 더욱이, 각 갈래의 진행 속도가 서로 달라서 세 차례의 기회가 있는 셈이다.
첫 기회의 갈래에서, 쫓아가는 종결인자가 전사 복합체에서 RNA를 잡아당겨 떼어내고 DNA는 중합효소에 남겨두는 방식의 종결을 수행한다. 이것에 실패하면, 쫓아가는 종결인자가 중합효소를 밀어내서 DNA와 RNA 둘 다 떨어뜨리는 종결을 진행하는데, 이 경우가 가장 흔하다. 마지막에, 기다리는 종결인자가 중합효소를 밀쳐내서 모두 갈라놓는 종결을 단행한다.
기다리는 종결인자가 쫓아가는 종결인자보다 중합효소와 먼저 만나기 때문에 더 빠르게 더 일찍 작동하리라고 전문가들이 추정해왔는데, 실제로는 놀랍게도 기다리는 종결인자가 더 느려서 맨 마지막 기회를 얻는 것으로 드러났다. 이 세 갈래의 진행 순서는 서로 다른 염기서열의 여러 종결자 DNA에서 바뀌지 않는다는 것도 확인했다.
공동 연구팀은 이번 연구에서 거푸집 DNA와 생산물 RNA에 각기 다른 형광물질을 붙인 후 중합효소, DNA, RNA 셋이 결합한 전사 복합체가 어떻게 변하는지를 낱개로 실시간 관찰하는 생물리학적 연구기법을 창안하고, 기존에 제안됐던 여러 작동원리를 검증하는 실험을 여러 가지 수행했다.
특히, 종결인자가 어떻게 전사 종결을 유도하는지 보기 위해, 종결인자가 RNA 종결 신호에 먼저 붙은 후 중합효소를 쫓아가서 끝내는 것을 측정하거나, 그렇지 않고 종결인자가 중합효소에 미리 붙어있다가 종결 신호를 기다려서 끝내는 것을 측정하는 분별 계측법을 독창적으로 개발했다.
첨단 기술인 단일분자 실험을 전담한 서울대 물리천문학부 송은호 박사과정 학생이 제1 저자로 참여한 논문(제목: Rho-dependent transcription termination proceeds via three routes)이 저명 국제학술지 네이처 커뮤니케이션스(Nature Communications)에 올해 3월 29일 字 게재됐다. 서울대 엄희수 박사, 우리 대학 팔린다 무나싱하 박사, 우리 대학 황승하 대학원생도 참여하여 저자가 총 8명이다.
이번 공동 연구에 단일분자 형광 기술을 구사하는 물리학자, 유전자 발현이라는 기본적 생명현상을 탐구하는 생명과학자, 중합효소나 종결인자와 같은 단백질의 구조를 규명하는 화학자가 두루 참가했다. 다양한 분야의 전공자가 협업한 다학제 기초연구의 우수 사례이며, 한국연구재단 중견연구자지원사업, KAIST 고위험‧고성과 연구사업 등의 지원을 받았다.
송은호 제1 저자는 "어느 학설이 맞는지를 검증하기 위해, DNA의 한 곳에서 종결하는 종결자의 경우 작동이 단순명료하리라 짐작하고 첫 실험 대상으로 삼았는데, 뜻밖에 여러 작동원리가 모두 관찰됐고 세 갈래로 복잡했다”라며 “여러 곳에서 종결하는 다른 종결자 DNA의 경우 오히려 세 갈래가 다 보이지 않기도 해 첫 선택에 운이 따랐던 것 같다”고 말했다.
2022.03.30 조회수 10650 진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25 조회수 17367
진원생명과학(주)과의 공동 연구로 C형간염 DNA백신 면역증강 효과 확인
의과학대학원 신의철 교수 연구팀이 기존 치료법이 모두 실패한 만성 C형간염 환자를 대상으로 DNA백신(GLS-6150)을 접종해 심각한 부작용 없이 매우 안전하면서도 C형간염 바이러스에 대한 T세포 면역반응을 높인다는 사실을 임상연구를 통해 밝혔다.
세브란스병원 소화기내과 안상훈 교수, 부산대학교병원 소화기내과 허정 교수, 진원생명과학과 공동으로 진행한 이번 연구에서는 특히 IFNL3라는 사이토카인 면역증강물질 유전자를 백신에 포함했다. 이를 통해 면역반응을 억제하는 조절 T세포(Treg)를 감소시키면서 C형간염 바이러스 면역반응의 핵심 역할을 하는 세포독성 T세포의 기능을 강화할 수 있음을 밝혀냈다.
신의철 교수, 세브란스병원 안상훈 교수, 부산대학교병원 허정 교수가 공동 교신저자로 참여한 이번 연구결과는 간 연구 분야의 국제적 전문 학술지인 ‘저널 오브 헤파톨로지(Journal of Hepatology)’ 2월 20일 자 온라인판에 게재됐다.(논문명: IFNL3-adjuvanted HCV DNA vaccine reduces regulatory T-cell frequency and increases virus-specific T-cell response)
이번 연구를 통해 만성 C형간염 환자, 특히 항바이러스제를 이용하여 치료받은 완치자의 HCV 재감염을 예방하고 만성 C형간염 고위험군의 HCV 감염을 예방하는 백신의 개발 가능성을 확인했다.
이번 임상연구는 지난 2013년 10월 식약처의 임상승인을 받아 세브란스병원과 부산대학교병원에서 기존치료법에 모두 실패한 만성 C형간염 환자 18명을 대상으로 DNA 백신(GLS-6150)의 안전성, 내약성 및 면역원성을 평가하기 위한 다기관·공개·용량 증량·1상 임상시험으로 수행됐다. 이 중 14명을 대상으로 2014년 9월 식약처로부터 추가 임상승인을 받아 2016년에 1상 임상연구를 모두 완료했다. (Clinicaltrials.gov 번호: NCT02027116)
해당 연구팀은 항바이러스제로 치료된 만성 C형간염 완치자를 대상으로 DNA 백신(GLS-6150)의 안전성과 내약성 및 면역원성을 평가하는 임상연구의 승인을 2018년 2월 식약처로부터 받아 현재 세브란스병원과 부산대학교병원에서 세 번째 1상 임상연구를 수행하고 있다. (Clinicaltrials.gov 번호: NCT03674125)
신의철 교수는“이번 연구를 통해 지난 30여 년 동안 실패했던 C형간염 예방백신 개발의 새로운 가능성을 발견했다”라며 “예방백신을 성공적으로 개발하면 가까운 미래에 C형간염 바이러스를 지구상에서 사라지게 할 수도 있을 것이다”라고 말했다.
이번 연구는 진원생명과학(주)의 지원을 받아 C형간염 DNA백신(GLS-6150)을 사용했다.
2020.03.25 조회수 17367 박수형 교수, 중증열성혈소판감소증후군 예방 백신 개발
〈 박수형 교수 〉
우리 대학 의과학대학원 박수형 교수 연구팀이 일명 살인진드기병으로 불리는 중증열성혈소판감소증후군(SFTS) 바이러스 감염을 예방하는 백신을 개발했다.
충북대학교 의과대학 최영기 교수와 진원생명과학(주)이 함께 참여한 공동 연구팀은 개발한 백신이 감염 동물모델 실험을 통해 중증열성혈소판감소증후군 바이러스 감염을 완벽하게 억제할 수 있음을 증명했다.
이번 연구를 통해 예방 백신 도출 및 검증 성과뿐 아니라 면역학적 관점에서 백신의 감염 예방 효능을 극대화할 수 있는 항원을 제시함으로써, 추후 중증열성혈소판감소증후군 바이러스에 대한 대응 전략 확립 및 연구에 기여할 것으로 기대된다.
곽정은 박사과정과 충북대학교 김영일 박사가 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 23일 자 온라인판에 게재됐다. (논문명 : Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets)
흔히 살인진드기병으로 알려진 SFTS는 SFTS 바이러스에 감염된 매개 진드기에 물려 발생하는 신종 감염병으로, 최근 발생 빈도 및 지역의 확산으로 WHO에서도 주의해야 할 10대 신, 변종 바이러스 감염병으로 지정한 질병이다.
일반적으로 6~14일의 잠복기 후 고열(38∼40℃)이 3~10일 이어지고, 혈소판 감소 및 백혈구 감소와 구토, 설사 등 소화기 증상이 발생하며, 일부 사례에서는 중증으로 진행돼 사망에 이르기도 한다.
2013년에 한국에서 처음으로 환자가 발생한 이래 발생 건수가 매년 꾸준히 증가하고 있지만, 진드기 접촉 최소화를 통한 예방이 제시될 뿐 현재까지 예방 백신이 개발되지 않았다.
연구팀은 31종의 서로 다른 SFTS 바이러스의 유전자 서열로부터 공통 서열을 도출해 백신 항원을 설계하고, 진원생명과학의 플랫폼을 이용해 DNA 백신을 제작했다.
DNA 백신 기술은 기존 백신과 달리 바이러스 자체가 아닌 유전자만을 사용해 안전하고 기존 백신 대비 광범위한 면역 반응을 유도할 수 있다는 장점이 있다.
연구팀은 감염 동물모델인 패럿에서 백신이 감염을 완벽하게 억제하며 소화기 증상, 혈소판 및 백혈구 감소, 고열, 간 수치 상승 등 감염 환자에서 발생하는 임상 증상들 역시 관찰되지 않음을 확인했다.
특히 연구팀은 해당 바이러스의 전체 유전자에 대한 5종의 백신을 구상해 SFTS 예방 백신 개발에 대한 전략적 접근법을 제시했다.
연구팀은 수동전달 기법(passive transfer)을 통해 바이러스의 당단백질에 대한 항체 면역 반응이 감염억제에 주요한 역할을 함을 규명했다. 또한, 비-당단백질에 대한 T세포 면역 반응 역시 감염 예방에 기여할 수 있음을 밝혔다.
박 교수는 “이번 연구는 SFTS 바이러스 감염을 완벽하게 방어할 수 있는 백신을 최초로 개발하고, 생쥐 모델이 아닌 환자의 임상 증상과 같게 발생하는 패럿 동물모델에서 완벽한 방어효능을 증명했다는 중요한 의의가 있다”라고 말했다.
최 교수는 “이번 SFTS 바이러스 백신 개발 연구 성과는 국제적으로 SFTS 백신 개발을 위한 기술적 우위를 확보했다는 중요한 의의가 있으며, 연구결과를 바탕으로 지속적인 연구를 통해 SFTS 바이러스 백신의 상용화에 기여할 수 있을 것이다”라고 말했다.
향후 임상개발은 이번 연구에 함께 참여한 DNA 백신 개발 전문기업인 진원생명과학(주)을 통해 진행할 계획이다.
이번 연구는 보건복지부 감염병위기대응기술개발사업의 지원을 받아 수행됐다.
2019.08.28 조회수 18590
박수형 교수, 중증열성혈소판감소증후군 예방 백신 개발
〈 박수형 교수 〉
우리 대학 의과학대학원 박수형 교수 연구팀이 일명 살인진드기병으로 불리는 중증열성혈소판감소증후군(SFTS) 바이러스 감염을 예방하는 백신을 개발했다.
충북대학교 의과대학 최영기 교수와 진원생명과학(주)이 함께 참여한 공동 연구팀은 개발한 백신이 감염 동물모델 실험을 통해 중증열성혈소판감소증후군 바이러스 감염을 완벽하게 억제할 수 있음을 증명했다.
이번 연구를 통해 예방 백신 도출 및 검증 성과뿐 아니라 면역학적 관점에서 백신의 감염 예방 효능을 극대화할 수 있는 항원을 제시함으로써, 추후 중증열성혈소판감소증후군 바이러스에 대한 대응 전략 확립 및 연구에 기여할 것으로 기대된다.
곽정은 박사과정과 충북대학교 김영일 박사가 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 23일 자 온라인판에 게재됐다. (논문명 : Development of a SFTSV DNA vaccine that confers complete protection against lethal infection in ferrets)
흔히 살인진드기병으로 알려진 SFTS는 SFTS 바이러스에 감염된 매개 진드기에 물려 발생하는 신종 감염병으로, 최근 발생 빈도 및 지역의 확산으로 WHO에서도 주의해야 할 10대 신, 변종 바이러스 감염병으로 지정한 질병이다.
일반적으로 6~14일의 잠복기 후 고열(38∼40℃)이 3~10일 이어지고, 혈소판 감소 및 백혈구 감소와 구토, 설사 등 소화기 증상이 발생하며, 일부 사례에서는 중증으로 진행돼 사망에 이르기도 한다.
2013년에 한국에서 처음으로 환자가 발생한 이래 발생 건수가 매년 꾸준히 증가하고 있지만, 진드기 접촉 최소화를 통한 예방이 제시될 뿐 현재까지 예방 백신이 개발되지 않았다.
연구팀은 31종의 서로 다른 SFTS 바이러스의 유전자 서열로부터 공통 서열을 도출해 백신 항원을 설계하고, 진원생명과학의 플랫폼을 이용해 DNA 백신을 제작했다.
DNA 백신 기술은 기존 백신과 달리 바이러스 자체가 아닌 유전자만을 사용해 안전하고 기존 백신 대비 광범위한 면역 반응을 유도할 수 있다는 장점이 있다.
연구팀은 감염 동물모델인 패럿에서 백신이 감염을 완벽하게 억제하며 소화기 증상, 혈소판 및 백혈구 감소, 고열, 간 수치 상승 등 감염 환자에서 발생하는 임상 증상들 역시 관찰되지 않음을 확인했다.
특히 연구팀은 해당 바이러스의 전체 유전자에 대한 5종의 백신을 구상해 SFTS 예방 백신 개발에 대한 전략적 접근법을 제시했다.
연구팀은 수동전달 기법(passive transfer)을 통해 바이러스의 당단백질에 대한 항체 면역 반응이 감염억제에 주요한 역할을 함을 규명했다. 또한, 비-당단백질에 대한 T세포 면역 반응 역시 감염 예방에 기여할 수 있음을 밝혔다.
박 교수는 “이번 연구는 SFTS 바이러스 감염을 완벽하게 방어할 수 있는 백신을 최초로 개발하고, 생쥐 모델이 아닌 환자의 임상 증상과 같게 발생하는 패럿 동물모델에서 완벽한 방어효능을 증명했다는 중요한 의의가 있다”라고 말했다.
최 교수는 “이번 SFTS 바이러스 백신 개발 연구 성과는 국제적으로 SFTS 백신 개발을 위한 기술적 우위를 확보했다는 중요한 의의가 있으며, 연구결과를 바탕으로 지속적인 연구를 통해 SFTS 바이러스 백신의 상용화에 기여할 수 있을 것이다”라고 말했다.
향후 임상개발은 이번 연구에 함께 참여한 DNA 백신 개발 전문기업인 진원생명과학(주)을 통해 진행할 계획이다.
이번 연구는 보건복지부 감염병위기대응기술개발사업의 지원을 받아 수행됐다.
2019.08.28 조회수 18590 윤동기 , 김형수 교수, DNA 마이크로패치 제작 기술 개발
〈 윤동기 교수, 김형수 교수, 박순모 연구원 〉
우리 대학 화학과/나노과학기술대학원 윤동기, 기계공학과 김형수 교수 공동 연구팀이 마이크로 크기의 DNA 2차원 마이크로패치 구조체를 제작하고 이를 제어, 응용하는 기술을 개발했다.
윤 교수 연구팀은 커피가 종이에 떨어지고 물이 마르면 동그랗게 환 모양이 생기는 이른바 ‘커피링 효과’라 불리는 현상을 DNA 수용액에 적용해 세계 최초로 DNA 기반의 마이크로패치를 제작했다.
차윤정 박사, 박순모 박사과정 학생이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 7일 자 온라인판에 게재됐다. (논문명 : Microstructure arrays of DNA using topographic control)
유전 정보를 저장하는 기능을 하는 DNA는 이중나선 구조와 나노미터 주기의 규칙적인 모양을 가져 소재 분야에서 일반적인 합성방법으로는 구현하기 힘든 정밀한 구조재료이다. 정밀한 DNA 합성과 오리가미(Origami) 기술을 이용해 스마일 패치(smile patch) 등의 재미있는 모양을 구현해 왔지만, 재료의 가격이 높아 실제 응용에 어려움을 겪었다.
윤 교수 연구팀은 이를 극복하기 위해 연어에서 추출한 DNA 물질을 이용해 기존보다 1천 배 이상 저렴한 비용으로 잘 정렬된 뜨개질(knit) 혹은 아이스크림콘 모양의 기존에 없던 마이크로패치 구조체를 대면적에서 구현했다.
연구팀은 DNA가 물에 녹으면 마치 물풀과 끈적끈적해지면서 서로 적당한 힘으로 끌어당기며 일정한 방향으로 정렬하는 액정상(liquid crystal phase)을 보인다는 점에 주목했다.
액정 표시장치(LC display 혹은 LCD)에서 액정분자들이 전기장을 통해 방향성이 제어되는 것처럼 수용액 상태의 DNA 액정상이 두 기판 사이에서 문질러지며 물의 증발이 이뤄질 때 DNA 나노 구조체들이 원하는 방향으로 정렬하게 된다. 과일 잼을 식빵에 바르면 과일 알맹이(pulp)가 한 방향으로 잘 펴 발라지면서 마르는 현상과 유사하다.
연구팀은 DNA가 한 방향으로 문질러져서 마를 때 바닥에 평평한 기판 대신 일정한 모양을 갖는 수 마이크론 크기의 기둥(혹은 요철)들이 있는 기판을 사용하면 2차원의 뜨개질 모양, 아이스크림콘 모양 등 좀 더 흥미로운 들을 제작할 수 있음을 확인했다.
또한, 금 나노막대와 같은 플라즈몬 공명(plasmon resonance)을 나타내는 소재와 결합해 디스플레이 소자에 응용을 시도했다. 플라스몬 공명은 금속으로 만들어진 기판에 빛을 쪼일 때 그 표면 위에서 전자가 일정하게 진동하면서 자신의 에너지와 일치하는 빛에만 반응하는 현상으로 특정한 색만 반사하여 선명도와 표현력을 높이는 데 사용된다.
이 방식에서 가장 중요한 점은 어떤 방향으로 금 나노막대가 정렬하는지를 나타내는 배향(orientation)이다. 즉 막대들이 한 방향으로 나란히 정렬될 때 광학·전기 특성이 극대화된다. 윤 교수 연구팀은 이러한 점에 착안해 DNA 마이크로패치를 일종의 틀로 삼아 금 나노막대들을 독특한 형태로 배향하고 플라즈몬 컬러 기판을 제작하는 데 성공했다.
연구팀이 개발한 DNA 2차원 마이크로패치 제작 기술은 DNA를 구조재료 및 전자소재로써 활용할 수 있는 단서를 마련했을 뿐 아니라 증발 현상과 DNA 액정물질이 접목될 때 나타나는 독특한 형태의 복잡한 분자 거동 해석에 대한 단서를 제공할 것으로 기대된다.
윤 교수는 “연구를 통해 밝힌 것처럼 DNA가 금 나노막대와 같은 광학 소재와 복합체를 쉽게 만들 수 있는 만큼, 자연계에 무한히 존재하는 DNA를 디스플레이 관련 분야의 신소재로서 응용할 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 과학기술정보통신부-한국연구재단의 전략과제, 멀티스케일 카이랄 구조체 연구센터, 미래유망 융합기술 파이오니아사업과 신진연구 과제의 지원을 받아 수행됐다.
□ 그림 설명
그림1. DNA 분자 배향 모식도
그림2. DNA-금 막대 입자 복합체의 배향 양상과 나타나는 플라즈모닉 광학 현상
2019.06.18 조회수 22680
윤동기 , 김형수 교수, DNA 마이크로패치 제작 기술 개발
〈 윤동기 교수, 김형수 교수, 박순모 연구원 〉
우리 대학 화학과/나노과학기술대학원 윤동기, 기계공학과 김형수 교수 공동 연구팀이 마이크로 크기의 DNA 2차원 마이크로패치 구조체를 제작하고 이를 제어, 응용하는 기술을 개발했다.
윤 교수 연구팀은 커피가 종이에 떨어지고 물이 마르면 동그랗게 환 모양이 생기는 이른바 ‘커피링 효과’라 불리는 현상을 DNA 수용액에 적용해 세계 최초로 DNA 기반의 마이크로패치를 제작했다.
차윤정 박사, 박순모 박사과정 학생이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 7일 자 온라인판에 게재됐다. (논문명 : Microstructure arrays of DNA using topographic control)
유전 정보를 저장하는 기능을 하는 DNA는 이중나선 구조와 나노미터 주기의 규칙적인 모양을 가져 소재 분야에서 일반적인 합성방법으로는 구현하기 힘든 정밀한 구조재료이다. 정밀한 DNA 합성과 오리가미(Origami) 기술을 이용해 스마일 패치(smile patch) 등의 재미있는 모양을 구현해 왔지만, 재료의 가격이 높아 실제 응용에 어려움을 겪었다.
윤 교수 연구팀은 이를 극복하기 위해 연어에서 추출한 DNA 물질을 이용해 기존보다 1천 배 이상 저렴한 비용으로 잘 정렬된 뜨개질(knit) 혹은 아이스크림콘 모양의 기존에 없던 마이크로패치 구조체를 대면적에서 구현했다.
연구팀은 DNA가 물에 녹으면 마치 물풀과 끈적끈적해지면서 서로 적당한 힘으로 끌어당기며 일정한 방향으로 정렬하는 액정상(liquid crystal phase)을 보인다는 점에 주목했다.
액정 표시장치(LC display 혹은 LCD)에서 액정분자들이 전기장을 통해 방향성이 제어되는 것처럼 수용액 상태의 DNA 액정상이 두 기판 사이에서 문질러지며 물의 증발이 이뤄질 때 DNA 나노 구조체들이 원하는 방향으로 정렬하게 된다. 과일 잼을 식빵에 바르면 과일 알맹이(pulp)가 한 방향으로 잘 펴 발라지면서 마르는 현상과 유사하다.
연구팀은 DNA가 한 방향으로 문질러져서 마를 때 바닥에 평평한 기판 대신 일정한 모양을 갖는 수 마이크론 크기의 기둥(혹은 요철)들이 있는 기판을 사용하면 2차원의 뜨개질 모양, 아이스크림콘 모양 등 좀 더 흥미로운 들을 제작할 수 있음을 확인했다.
또한, 금 나노막대와 같은 플라즈몬 공명(plasmon resonance)을 나타내는 소재와 결합해 디스플레이 소자에 응용을 시도했다. 플라스몬 공명은 금속으로 만들어진 기판에 빛을 쪼일 때 그 표면 위에서 전자가 일정하게 진동하면서 자신의 에너지와 일치하는 빛에만 반응하는 현상으로 특정한 색만 반사하여 선명도와 표현력을 높이는 데 사용된다.
이 방식에서 가장 중요한 점은 어떤 방향으로 금 나노막대가 정렬하는지를 나타내는 배향(orientation)이다. 즉 막대들이 한 방향으로 나란히 정렬될 때 광학·전기 특성이 극대화된다. 윤 교수 연구팀은 이러한 점에 착안해 DNA 마이크로패치를 일종의 틀로 삼아 금 나노막대들을 독특한 형태로 배향하고 플라즈몬 컬러 기판을 제작하는 데 성공했다.
연구팀이 개발한 DNA 2차원 마이크로패치 제작 기술은 DNA를 구조재료 및 전자소재로써 활용할 수 있는 단서를 마련했을 뿐 아니라 증발 현상과 DNA 액정물질이 접목될 때 나타나는 독특한 형태의 복잡한 분자 거동 해석에 대한 단서를 제공할 것으로 기대된다.
윤 교수는 “연구를 통해 밝힌 것처럼 DNA가 금 나노막대와 같은 광학 소재와 복합체를 쉽게 만들 수 있는 만큼, 자연계에 무한히 존재하는 DNA를 디스플레이 관련 분야의 신소재로서 응용할 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 과학기술정보통신부-한국연구재단의 전략과제, 멀티스케일 카이랄 구조체 연구센터, 미래유망 융합기술 파이오니아사업과 신진연구 과제의 지원을 받아 수행됐다.
□ 그림 설명
그림1. DNA 분자 배향 모식도
그림2. DNA-금 막대 입자 복합체의 배향 양상과 나타나는 플라즈모닉 광학 현상
2019.06.18 조회수 22680 주영석 교수, 흡연과 무관한 폐암유발 돌연변이 유년기부터 발생 사실 밝혀
〈 주영석 교수 〉
우리 대학 의과학대학원 주영석 교수와 서울대학교 의과대학(학장 신찬수) 흉부외과 김영태 교수 공동 연구팀이 폐암을 일으키는 융합유전자 유전체 돌연변이의 생성 원리를 규명했다.
이번 연구는 흡연과 무관한 환경에서도 융합유전자로 인해 폐 선암이 발생할 수 있다는 사실을 밝힌 것으로, 비흡연자의 폐암 발생 원인 규명과 더불어 정밀치료 시스템을 구축하는 데 적용 가능할 것으로 기대된다.
우리 대학 출신 이준구 박사(現 하버드 의과대학 박사후연구원)와 박성열 박사과정이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’ 5월 30일 자 온라인판에 게재됐다. (논문명 : Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma) 또한, 이번 연구에는 하버드 의과대학, 한국과학기술정보연구원, 국립암센터 연구자들도 함께 참여했다.
흡연은 폐 선암의 가장 큰 발병 인자로 잘 알려졌지만 암 융합유전자 돌연변이, 즉 ALK, RET, ROS1 등에 의한 암 발생은 대부분 비흡연자에게서 발견된다. 융합유전자로 인한 환자는 전체 폐 선암 환자의 10% 정도를 차지하고 있지만, 이 돌연변이의 생성과정에 대해서는 알려진 것이 거의 없었다.
이전까지의 폐 선암 유전체 연구는 주로 유전자 지역을 규명하는 ‘엑솜 서열분석 기법’이 사용됐으나 연구팀은 유전자 간 부분들을 총망라해 분석하는‘전장 유전체 서열분석 기법’을 대규모로 적용했다.
연구팀은 138개의 폐 선암(lung adenocarcinoma) 사례의 전장 유전체 서열 데이터(whole-genome sequencing)를 생성 및 분석해 암세포에 존재하는 다양한 양상의 유전체 돌연변이를 찾아냈다. 특히 흡연과 무관한 폐암의 직접적 원인인 융합유전자를 생성하는 유전체 구조 변이의 특성을 집중적으로 규명했다.
유전체에 발생하는 구조적 변이는 DNA의 두 부위가 절단된 후 서로 연결되는 단순 구조 변이와 DNA가 많은 조각으로 동시에 파쇄된 후 복잡하게 서로 재조합되는 복잡 구조 변이로 나눌 수 있다.
복잡 구조 변이는 암세포에서 많이 발견된다. DNA의 수백 부위 이상이 동시에 절단된 후 상당 부분 소실되고 일부가 다시 연결되는 ‘염색체 산산조각(chromothripsis)’ 현상이 대표적 사례이다. 연구팀은 70% 이상의 융합유전자가‘유전체 산산조각 (chromothripsis)’ 현상 등 복잡 구조 돌연변이에 의해 생성됨을 확인했다.
또한, 연구팀은 정밀 유전체 분석을 통해 복잡 구조 돌연변이가 폐암이 진단되기 수십 년 전의 어린 나이에도 이미 발생할 수 있다는 사실을 발견했다.
세포의 유전체는 노화에 따라 비교적 일정한 속도로 점돌연변이가 쌓이는데 연구팀은 이를 이용하여 마치 지질학의 연대측정과 비슷한 원리로 특정 구조 변이의 발생 시점을 통계적으로 추정할 수 있는 기술을 개발했다. 이 기술을 통해 융합유전자 발생은 폐암을 진단받기 수십 년 전, 심지어는 10대 이전의 유년기에도 발생할 수 있다는 사실을 확인했다.
이는 암을 일으키는 융합유전자 돌연변이가 흡연과 큰 관련 없이 정상 세포에서 발생할 수 있음을 명확히 보여주는 사례이며, 단일 세포가 암 발생 돌연변이를 획득한 후에도 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적될 필요가 있음을 뜻한다.
연구팀의 이번 연구는 흡연과 무관한 폐암 발생 과정에 대한 지식을 한 단계 확장했다는 의의가 있다. 향후 폐암의 예방, 선별검사 정밀치료 시스템 구축에 이바지할 수 있을 것으로 기대된다.
연구팀은 한국과학기술정보연구원의 슈퍼컴퓨터 5호기 누리온 시스템을 통해 유전체 빅데이터의 신속한 정밀 분석을 수행했다. 슈퍼컴퓨터 5호기는 향후 타 유전체 빅데이터 연구자들에게도 활용 가능할 것으로 보인다.
주영석 교수는 “암유전체 전장서열 빅데이터를 통해 폐암을 발생시키는 첫 돌연변이의 양상을 규명했으며, 정상 폐 세포에서 흡연과 무관하게 이들 복잡 구조변이를 일으키는 분자 기전의 이해가 다음 연구의 핵심이 될 것이다”라고 말했다.
서울대학교 의과대학 김영태 교수는 “2012년 폐 선암의 KIF5B-RET 융합유전자 최초 발견으로 시작된 본 폐암 연구팀이 융합유전자의 생성과정부터 임상적 의미까지 집대성했다는 것이 이번 연구의 중요한 성과이다”라고 말했다.
이번 연구는 한국연구재단, 보건복지부 포스트게놈 다부처유전체사업/세계선도의과학자 육성사업, 서경배 과학재단 및 서울대학교 의과대학 교실지정기부금의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 흡연과 무관한 폐암에서 융합유전자에 의한 발암기전
그림2. 폐선암에서 관찰되는 다양한 복잡 구조 변이의 특성
그림3. 어린 나이에 생긴 융합유전자의 예시
2019.06.03 조회수 24867
주영석 교수, 흡연과 무관한 폐암유발 돌연변이 유년기부터 발생 사실 밝혀
〈 주영석 교수 〉
우리 대학 의과학대학원 주영석 교수와 서울대학교 의과대학(학장 신찬수) 흉부외과 김영태 교수 공동 연구팀이 폐암을 일으키는 융합유전자 유전체 돌연변이의 생성 원리를 규명했다.
이번 연구는 흡연과 무관한 환경에서도 융합유전자로 인해 폐 선암이 발생할 수 있다는 사실을 밝힌 것으로, 비흡연자의 폐암 발생 원인 규명과 더불어 정밀치료 시스템을 구축하는 데 적용 가능할 것으로 기대된다.
우리 대학 출신 이준구 박사(現 하버드 의과대학 박사후연구원)와 박성열 박사과정이 공동 1 저자로 참여한 이번 연구는 국제 학술지 ‘셀(Cell)’ 5월 30일 자 온라인판에 게재됐다. (논문명 : Tracing Oncogene Rearrangements in the Mutational History of Lung Adenocarcinoma) 또한, 이번 연구에는 하버드 의과대학, 한국과학기술정보연구원, 국립암센터 연구자들도 함께 참여했다.
흡연은 폐 선암의 가장 큰 발병 인자로 잘 알려졌지만 암 융합유전자 돌연변이, 즉 ALK, RET, ROS1 등에 의한 암 발생은 대부분 비흡연자에게서 발견된다. 융합유전자로 인한 환자는 전체 폐 선암 환자의 10% 정도를 차지하고 있지만, 이 돌연변이의 생성과정에 대해서는 알려진 것이 거의 없었다.
이전까지의 폐 선암 유전체 연구는 주로 유전자 지역을 규명하는 ‘엑솜 서열분석 기법’이 사용됐으나 연구팀은 유전자 간 부분들을 총망라해 분석하는‘전장 유전체 서열분석 기법’을 대규모로 적용했다.
연구팀은 138개의 폐 선암(lung adenocarcinoma) 사례의 전장 유전체 서열 데이터(whole-genome sequencing)를 생성 및 분석해 암세포에 존재하는 다양한 양상의 유전체 돌연변이를 찾아냈다. 특히 흡연과 무관한 폐암의 직접적 원인인 융합유전자를 생성하는 유전체 구조 변이의 특성을 집중적으로 규명했다.
유전체에 발생하는 구조적 변이는 DNA의 두 부위가 절단된 후 서로 연결되는 단순 구조 변이와 DNA가 많은 조각으로 동시에 파쇄된 후 복잡하게 서로 재조합되는 복잡 구조 변이로 나눌 수 있다.
복잡 구조 변이는 암세포에서 많이 발견된다. DNA의 수백 부위 이상이 동시에 절단된 후 상당 부분 소실되고 일부가 다시 연결되는 ‘염색체 산산조각(chromothripsis)’ 현상이 대표적 사례이다. 연구팀은 70% 이상의 융합유전자가‘유전체 산산조각 (chromothripsis)’ 현상 등 복잡 구조 돌연변이에 의해 생성됨을 확인했다.
또한, 연구팀은 정밀 유전체 분석을 통해 복잡 구조 돌연변이가 폐암이 진단되기 수십 년 전의 어린 나이에도 이미 발생할 수 있다는 사실을 발견했다.
세포의 유전체는 노화에 따라 비교적 일정한 속도로 점돌연변이가 쌓이는데 연구팀은 이를 이용하여 마치 지질학의 연대측정과 비슷한 원리로 특정 구조 변이의 발생 시점을 통계적으로 추정할 수 있는 기술을 개발했다. 이 기술을 통해 융합유전자 발생은 폐암을 진단받기 수십 년 전, 심지어는 10대 이전의 유년기에도 발생할 수 있다는 사실을 확인했다.
이는 암을 일으키는 융합유전자 돌연변이가 흡연과 큰 관련 없이 정상 세포에서 발생할 수 있음을 명확히 보여주는 사례이며, 단일 세포가 암 발생 돌연변이를 획득한 후에도 실제 암세포로 발현되기 위해서는 추가적인 요인들이 오랜 기간 누적될 필요가 있음을 뜻한다.
연구팀의 이번 연구는 흡연과 무관한 폐암 발생 과정에 대한 지식을 한 단계 확장했다는 의의가 있다. 향후 폐암의 예방, 선별검사 정밀치료 시스템 구축에 이바지할 수 있을 것으로 기대된다.
연구팀은 한국과학기술정보연구원의 슈퍼컴퓨터 5호기 누리온 시스템을 통해 유전체 빅데이터의 신속한 정밀 분석을 수행했다. 슈퍼컴퓨터 5호기는 향후 타 유전체 빅데이터 연구자들에게도 활용 가능할 것으로 보인다.
주영석 교수는 “암유전체 전장서열 빅데이터를 통해 폐암을 발생시키는 첫 돌연변이의 양상을 규명했으며, 정상 폐 세포에서 흡연과 무관하게 이들 복잡 구조변이를 일으키는 분자 기전의 이해가 다음 연구의 핵심이 될 것이다”라고 말했다.
서울대학교 의과대학 김영태 교수는 “2012년 폐 선암의 KIF5B-RET 융합유전자 최초 발견으로 시작된 본 폐암 연구팀이 융합유전자의 생성과정부터 임상적 의미까지 집대성했다는 것이 이번 연구의 중요한 성과이다”라고 말했다.
이번 연구는 한국연구재단, 보건복지부 포스트게놈 다부처유전체사업/세계선도의과학자 육성사업, 서경배 과학재단 및 서울대학교 의과대학 교실지정기부금의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 흡연과 무관한 폐암에서 융합유전자에 의한 발암기전
그림2. 폐선암에서 관찰되는 다양한 복잡 구조 변이의 특성
그림3. 어린 나이에 생긴 융합유전자의 예시
2019.06.03 조회수 24867