%EA%B9%80%EC%9D%80%EC%A4%80
-
 자폐증에 관여하는 새로운 유전자 및 발병원인 첫 발견
김은준 교수
- 세계 최고 Nature지 발표,“자폐증의 유전요인과 새로운 치료법 제시”-
국내 연구진이 자폐증의 유전적 요인과 발병원인을 규명하고, 약물 부작용도 줄일 수 있는 새로운 자폐 치료법을 제시하였다.
서울대 강봉균 교수(50세), 연세대 이민구 교수(47세) 및 KAIST 김은준 교수(47세)가 주도하고, 원혜정, 이혜련, 지헌영, 마원, 김재익 박사(이상 제1저자)와 KAIST 김대수 교수 및 경북대 배용철, 이경민 교수 연구팀이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 리더연구자지원사업(창의적연구)과 선도연구센터지원사업(SRC)의 지원으로 수행되었다.
연구결과는 세계 최고 권위의 과학전문지인 ‘네이처(Nature)’지 6월 14일자에 게재되었고, 연구의 중요성을 인정받아 ‘Nature Reviews Drug Discovery’ 7월호에도 소개될 예정이다.
(논문명 : Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function)
연구팀은 시냅스 단백질을 만드는 유전자(생크2, Shank2)가 결핍되면 자폐와 비슷한 증상이 나타난다는 사실을 동물실험(생쥐)을 통해 발견하였다. 이것은 생크2 유전자의 결손이 자폐와 관련된다는 최근 임상결과와 함께, 생크2 유전자의 결손이 자폐를 유도한다는 직접적인 증거가 되어 의미가 크다.
자폐증은 △사회성 결핍 △반복행동 △정신지체 △불안 △과잉행동 등을 동반하는 뇌 발달 장애로, 전 세계 인구의 1~2%인 약 1억명이 증상을 보이는 심각한 뇌 질환이다. 특히 최근 연구결과(미국 워싱턴대)에 따르면, 자폐계 질환을 앓는 젊은 성인 3명 중 1명이 직장생활에 적응하지 못하거나 대학에 진학하지 못하는 등 다른 장애보다 훨씬 위중한 것으로 알려졌다. 그러나 지금까지 이를 효과적으로 치료할 수 있는 약물이 개발되지 못했고, 현재 반복행동만을 경감시키는 수준에 머무르고 있다.
연구팀은 생크2가 결손된 생쥐에서 사회성 결핍, 인지학습기능 저하, 반복행동 및 과잉행동과 같은 자폐와 비슷한 증상들이 나타난 것을 확인하였다. 또한 연구팀은 생크2가 결손된 생쥐는 NMDA(N-메칠 D-아스파르트산염) 수용체에 의한 신경전달이 감소하였고, 해마*에서의 시냅스 가소성** 등도 손상되었음을 관찰하였다.
*) 해마(Hippocampus) : 대뇌의 양쪽 측두엽에 존재. 일화, 의미 기억 등 인지기능 담당
**) 가소성(plasticity) : 기억, 학습 등 뇌 기능의 유연한 적응능력으로, 비교적 짧은 기간 내에 가해진 자극으로 뇌에 장기적인 변화가 생겨, 자극이 제거된 후에도 그 변화가 지속되는 것
특히 연구팀은 특정 수용체(mGluR5, 대사성 글루타민산염 수용체5)를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 것이 기존의 NMDA 수용체를 직접 자극하는 것보다 사회성 행동을 완전히 회복시킨다는 사실도 확인하였다. 이것은 NMDA 수용체를 직접 자극하기 위해 사용하는 약물의 부작용을 줄일 수 있는 새로운 자폐증 치료법으로 평가된다.
연구팀은 NMDA 수용체의 기능을 직접적으로 회복시키는 약물을 사용하면, 생크2가 결손된 생쥐에서 나타나는 NMDA 수용체 신경전달 이상과 사회성 결핍이 부분적으로(약 50%) 회복된다는 사실을 관찰하였다.
또한 연구팀은 mGluR5 수용체를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 약물(CDPPB)을 사용하면, 생크2가 결손된 생쥐의 해마에서의 시냅스 가소성 손상이 회복되고, NMDA 수용체에 의한 신경전달 등도 정상화되며, 사회성 결핍도 NMDA 수용체에 직접 작용하는 약물보다 더욱 효과적으로 회복되는 사실을 발견하였다.
강봉균 교수는 “생크2 유전자 결손으로 인한 NMDA 수용체의 기능 저하가 자폐증을 일으키는 새로운 원인임을 밝힌 의미 있는 연구”라고 연구의의를 밝혔다.
또한 이민구 교수는 “신경조직에서 생크2 유전자의 생리적 역할을 새롭게 규명한 연구로서, 국내 각 분야의 전문가들이 협력하여 우수한 성과를 거둔 대표적인 사례가 될 것”이라고 연구결과를 평가하였다.
아울러 김은준 교수는 "반복행동뿐만 아니라 자폐증의 주요한 증상인 사회성 결핍도 약물을 통해 충분히 개선할 수 있다는 사실을 새롭게 증명한 연구로, 자폐 치료의 새로운 가능성을 열었다”고 밝혔다.
2012.06.14 조회수 15858
자폐증에 관여하는 새로운 유전자 및 발병원인 첫 발견
김은준 교수
- 세계 최고 Nature지 발표,“자폐증의 유전요인과 새로운 치료법 제시”-
국내 연구진이 자폐증의 유전적 요인과 발병원인을 규명하고, 약물 부작용도 줄일 수 있는 새로운 자폐 치료법을 제시하였다.
서울대 강봉균 교수(50세), 연세대 이민구 교수(47세) 및 KAIST 김은준 교수(47세)가 주도하고, 원혜정, 이혜련, 지헌영, 마원, 김재익 박사(이상 제1저자)와 KAIST 김대수 교수 및 경북대 배용철, 이경민 교수 연구팀이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 리더연구자지원사업(창의적연구)과 선도연구센터지원사업(SRC)의 지원으로 수행되었다.
연구결과는 세계 최고 권위의 과학전문지인 ‘네이처(Nature)’지 6월 14일자에 게재되었고, 연구의 중요성을 인정받아 ‘Nature Reviews Drug Discovery’ 7월호에도 소개될 예정이다.
(논문명 : Autistic-like social behaviour in Shank2-mutant mice improved by restoring NMDA receptor function)
연구팀은 시냅스 단백질을 만드는 유전자(생크2, Shank2)가 결핍되면 자폐와 비슷한 증상이 나타난다는 사실을 동물실험(생쥐)을 통해 발견하였다. 이것은 생크2 유전자의 결손이 자폐와 관련된다는 최근 임상결과와 함께, 생크2 유전자의 결손이 자폐를 유도한다는 직접적인 증거가 되어 의미가 크다.
자폐증은 △사회성 결핍 △반복행동 △정신지체 △불안 △과잉행동 등을 동반하는 뇌 발달 장애로, 전 세계 인구의 1~2%인 약 1억명이 증상을 보이는 심각한 뇌 질환이다. 특히 최근 연구결과(미국 워싱턴대)에 따르면, 자폐계 질환을 앓는 젊은 성인 3명 중 1명이 직장생활에 적응하지 못하거나 대학에 진학하지 못하는 등 다른 장애보다 훨씬 위중한 것으로 알려졌다. 그러나 지금까지 이를 효과적으로 치료할 수 있는 약물이 개발되지 못했고, 현재 반복행동만을 경감시키는 수준에 머무르고 있다.
연구팀은 생크2가 결손된 생쥐에서 사회성 결핍, 인지학습기능 저하, 반복행동 및 과잉행동과 같은 자폐와 비슷한 증상들이 나타난 것을 확인하였다. 또한 연구팀은 생크2가 결손된 생쥐는 NMDA(N-메칠 D-아스파르트산염) 수용체에 의한 신경전달이 감소하였고, 해마*에서의 시냅스 가소성** 등도 손상되었음을 관찰하였다.
*) 해마(Hippocampus) : 대뇌의 양쪽 측두엽에 존재. 일화, 의미 기억 등 인지기능 담당
**) 가소성(plasticity) : 기억, 학습 등 뇌 기능의 유연한 적응능력으로, 비교적 짧은 기간 내에 가해진 자극으로 뇌에 장기적인 변화가 생겨, 자극이 제거된 후에도 그 변화가 지속되는 것
특히 연구팀은 특정 수용체(mGluR5, 대사성 글루타민산염 수용체5)를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 것이 기존의 NMDA 수용체를 직접 자극하는 것보다 사회성 행동을 완전히 회복시킨다는 사실도 확인하였다. 이것은 NMDA 수용체를 직접 자극하기 위해 사용하는 약물의 부작용을 줄일 수 있는 새로운 자폐증 치료법으로 평가된다.
연구팀은 NMDA 수용체의 기능을 직접적으로 회복시키는 약물을 사용하면, 생크2가 결손된 생쥐에서 나타나는 NMDA 수용체 신경전달 이상과 사회성 결핍이 부분적으로(약 50%) 회복된다는 사실을 관찰하였다.
또한 연구팀은 mGluR5 수용체를 자극하여 NMDA 수용체의 기능을 간접적으로 회복시키는 약물(CDPPB)을 사용하면, 생크2가 결손된 생쥐의 해마에서의 시냅스 가소성 손상이 회복되고, NMDA 수용체에 의한 신경전달 등도 정상화되며, 사회성 결핍도 NMDA 수용체에 직접 작용하는 약물보다 더욱 효과적으로 회복되는 사실을 발견하였다.
강봉균 교수는 “생크2 유전자 결손으로 인한 NMDA 수용체의 기능 저하가 자폐증을 일으키는 새로운 원인임을 밝힌 의미 있는 연구”라고 연구의의를 밝혔다.
또한 이민구 교수는 “신경조직에서 생크2 유전자의 생리적 역할을 새롭게 규명한 연구로서, 국내 각 분야의 전문가들이 협력하여 우수한 성과를 거둔 대표적인 사례가 될 것”이라고 연구결과를 평가하였다.
아울러 김은준 교수는 "반복행동뿐만 아니라 자폐증의 주요한 증상인 사회성 결핍도 약물을 통해 충분히 개선할 수 있다는 사실을 새롭게 증명한 연구로, 자폐 치료의 새로운 가능성을 열었다”고 밝혔다.
2012.06.14 조회수 15858 -
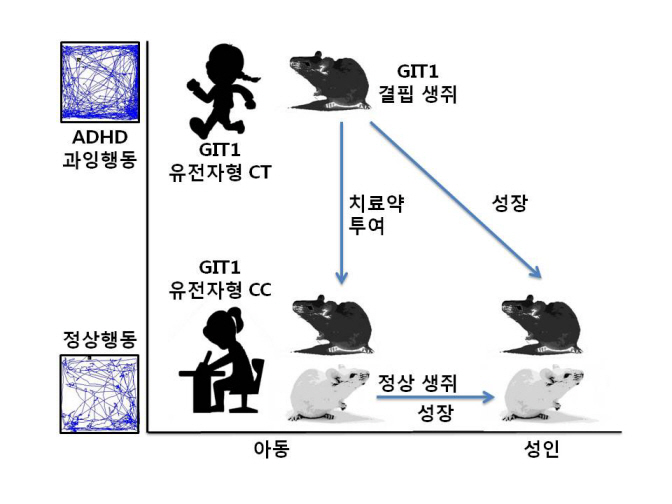 주의력결핍 과잉행동장애의 유전적 요인 규명
- 네이처 메디신 온라인 판에 4월 18일 게재
- “새로운 주의력결핍 과잉행동장애 치료법 개발의 가능성 열어”
우리학교 생명과학과 김은준 교수와 강창원 교수의 공동연구팀이 주의력결핍 과잉행동장애(ADHD)가 뇌의 신경 시냅스 단백질(GIT1)이 부족해서 발생한다는 것을 세계 최초로 밝혔다.
전 세계 취학아동의 5% 정도가 겪고 있는 ADHD(Attention Deficit Hyperactivity Disorder)는 주의가 산만하고 지나친 행동을 하면서 충동적 성향을 보이는 성장기 아동의 뇌 발달 장애다.
연구팀은 이 증상이 있는 아동들과 없는 아동들의 유전자형을 비교하는 유전역학 연구를 통해 GIT1 유전자의 염기 한 개가 달라서, 이 단백질이 적게 만들어지는 아동들에서 ADHD의 발병 빈도가 현저히 높다는 것을 발견했다.
또한, 생쥐 실험에서 GIT1의 유전자를 제거해 이 단백질을 합성하지 못하게 하면 ADHD 증상을 보인다는 것을 동물행동 분석 및 신경과학 실험을 통해 밝힘으로써 GIT1과 ADHD의 인과관계를 뒷받침했다.
GIT1 결핍 생쥐들이 사람의 ADHD처럼 과잉행동을 보이고, 학습능력이 떨어지며 비정상적인 특이 뇌파를 내는 것을 확인한 것이다. 아울러 이런 생쥐에 ADHD 치료약을 투여하면 ADHD 증상들이 사라지는 것도 확인됐다.
ADHD 아동이 성인이 되면 과잉행동이 없어지는데, GIT1 결핍 생쥐도 2개월째에는 보이던 과잉행동이 7개월(사람의 20-30세에 해당)이 되면 사라지는 것을 확인했다.
KAIST 생명과학과 김은준 교수는 “신경세포를 흥분시키는 기작과 진정시키는 기작이 균형을 이뤄야 하는데, GIT1이 부족하면 진정 기작이 취약해서 과잉행동을 억제하지 못하는 것으로 추정한다”고 말했다.
또한, 같은 학과의 강창원 교수는 “이번 연구 성과는 ADHD 발병기작을 연구하거나 신약을 개발하는 데 GIT1 결핍 생쥐를 모델생물로 사용할 수 있게 돼 새로운 ADHD 치료법 개발의 가능성을 열었다는 평가를 받고 있다”고 말했다.
이번 연구 성과는 의약학계 세계 최고 학술지인 네이처 메디신(Nature Medicine, Impact Factor 27.136)의 4월 18일자 온라인 판에 게재됐다. 특히, 이 학술지에 게재된 논문 중 그 중요성을 인정받아 전 세계 언론에 특별히 소개됐다.
한편, 이번 연구는 한국연구재단의 창의적연구진흥사업을 수행하는 김은준 교수 연구실의 원혜정, 마원 박사과정 학생과 핵심연구지원사업을 수행하는 강창원 교수 연구실의 김은진 박사가 주도했다.
이외에도 김대수(KAIST 생명과학과), 정재승(KAIST 바이오및뇌공학과), 조수철, 김재원(서울대병원 소아정신과), 최세영(서울대 치대 생리학교실) 교수의 연구팀들이 참여했으며, 신경생물학, 유전체학, 신경유전학, 신경생리학, 뇌공학, 소아정신과 등 여러 분야 전문가들이 협업해 성공한 모범적 사례다.
※ 그림 설명
GIT1 결핍 생쥐가 ADHD 아동처럼 어려서는 과잉행동을 보이다가 성장하면 정상이 되고, ADHD 치료약을 투여해도 정상이 된다.
2011.04.18 조회수 20009
주의력결핍 과잉행동장애의 유전적 요인 규명
- 네이처 메디신 온라인 판에 4월 18일 게재
- “새로운 주의력결핍 과잉행동장애 치료법 개발의 가능성 열어”
우리학교 생명과학과 김은준 교수와 강창원 교수의 공동연구팀이 주의력결핍 과잉행동장애(ADHD)가 뇌의 신경 시냅스 단백질(GIT1)이 부족해서 발생한다는 것을 세계 최초로 밝혔다.
전 세계 취학아동의 5% 정도가 겪고 있는 ADHD(Attention Deficit Hyperactivity Disorder)는 주의가 산만하고 지나친 행동을 하면서 충동적 성향을 보이는 성장기 아동의 뇌 발달 장애다.
연구팀은 이 증상이 있는 아동들과 없는 아동들의 유전자형을 비교하는 유전역학 연구를 통해 GIT1 유전자의 염기 한 개가 달라서, 이 단백질이 적게 만들어지는 아동들에서 ADHD의 발병 빈도가 현저히 높다는 것을 발견했다.
또한, 생쥐 실험에서 GIT1의 유전자를 제거해 이 단백질을 합성하지 못하게 하면 ADHD 증상을 보인다는 것을 동물행동 분석 및 신경과학 실험을 통해 밝힘으로써 GIT1과 ADHD의 인과관계를 뒷받침했다.
GIT1 결핍 생쥐들이 사람의 ADHD처럼 과잉행동을 보이고, 학습능력이 떨어지며 비정상적인 특이 뇌파를 내는 것을 확인한 것이다. 아울러 이런 생쥐에 ADHD 치료약을 투여하면 ADHD 증상들이 사라지는 것도 확인됐다.
ADHD 아동이 성인이 되면 과잉행동이 없어지는데, GIT1 결핍 생쥐도 2개월째에는 보이던 과잉행동이 7개월(사람의 20-30세에 해당)이 되면 사라지는 것을 확인했다.
KAIST 생명과학과 김은준 교수는 “신경세포를 흥분시키는 기작과 진정시키는 기작이 균형을 이뤄야 하는데, GIT1이 부족하면 진정 기작이 취약해서 과잉행동을 억제하지 못하는 것으로 추정한다”고 말했다.
또한, 같은 학과의 강창원 교수는 “이번 연구 성과는 ADHD 발병기작을 연구하거나 신약을 개발하는 데 GIT1 결핍 생쥐를 모델생물로 사용할 수 있게 돼 새로운 ADHD 치료법 개발의 가능성을 열었다는 평가를 받고 있다”고 말했다.
이번 연구 성과는 의약학계 세계 최고 학술지인 네이처 메디신(Nature Medicine, Impact Factor 27.136)의 4월 18일자 온라인 판에 게재됐다. 특히, 이 학술지에 게재된 논문 중 그 중요성을 인정받아 전 세계 언론에 특별히 소개됐다.
한편, 이번 연구는 한국연구재단의 창의적연구진흥사업을 수행하는 김은준 교수 연구실의 원혜정, 마원 박사과정 학생과 핵심연구지원사업을 수행하는 강창원 교수 연구실의 김은진 박사가 주도했다.
이외에도 김대수(KAIST 생명과학과), 정재승(KAIST 바이오및뇌공학과), 조수철, 김재원(서울대병원 소아정신과), 최세영(서울대 치대 생리학교실) 교수의 연구팀들이 참여했으며, 신경생물학, 유전체학, 신경유전학, 신경생리학, 뇌공학, 소아정신과 등 여러 분야 전문가들이 협업해 성공한 모범적 사례다.
※ 그림 설명
GIT1 결핍 생쥐가 ADHD 아동처럼 어려서는 과잉행동을 보이다가 성장하면 정상이 되고, ADHD 치료약을 투여해도 정상이 된다.
2011.04.18 조회수 20009 -
 김은준교수팀, 시냅스 생성 단백질 발견
- 흥분성 시냅스 생성 촉진하는 새로운 단백질‘엔지엘’발견
- 정신분열증을 비롯한 다양한 뇌질환 발병 원리 추정 가능
- 네이처 뉴로사이언스誌 9월호 게재
사람의 뇌에서 시냅스의 생성을 촉진하는 새로운 단백질이 국내 연구진에 의해 발견됐다.
KAIST(총장 서남표) 생명과학과 김은준(金恩俊, 42 / 시냅스생성 창의연구단 단장) 교수팀이 ‘엔지엘(NGL)’ 단백질이 흥분성 시냅스의 생성에 관여한다는 새로운 사실을 발견, 오는 18일 발표되는 신경과학 권위지인 ‘네이처 뉴로사이언스誌(Nature Neuroscience)" 9월호에 게재된다고 밝혔다.
金 교수팀은 後시냅스에 위치한 ‘엔지엘’이란 막단백질이 前시냅스의 네트린지(netrin-G)라는 다른 막단백질과 연결되면서 가교 역할을 하여 새로운 시냅스 생성을 촉진하는 것을 발견했다.
‘엔지엘’은 뉴로리긴(neuoroligin)에 이어 세계에서 두 번째로 새롭게 발견된 시냅스 가교 단백질이다. 이 새로운 단백질의 발견으로 시냅스 생성 원리와 다양한 뇌질환 발병 원인을 추정할 수 있게 되었다.
우리 뇌는 약 1000억개 이상의 신경세포와 각 세포당 1만 여개의 시냅스로 신경회로망을 구성하고 있다. 시냅스는 신경세포 사이에 신경전달이 일어나는 장소다. 시냅스의 생성은 신경회로의 생성으로 연결되고, 신경회로는 정상적인 뇌발달이나 뇌기능뿐만 아니라 다양한 뇌질환과도 관련이 깊다.
金 교수는 “엔지엘과 연결되어 있는 네트린지(netrin-G)가 정신분열증 (schizophrenia)과 관련이 있고, 엔지엘과 비슷한 기능을 가진 다른 시냅스 가교 단백질인 뉴로리긴이 정신지체(mental retardation) 및 자폐증(autism)과 관련이 깊은 만큼, 엔지엘도 정신분열증을 비롯한 다양한 뇌질환과 관련이 있을 것으로 보인다"라고 말했다.
<첨부사진 설명>
■ 사진 1: 엔지엘의 시냅스 생성 능력 확인 실험 1
표면에 엔지엘을 발현하고 있는 일반세포(녹색)와 신경세포를 섞어 준다. 축색돌기(axon)가 약 10시 방향에서 가운데 위치해 있는 엔지엘(일반세포)쪽으로 뻗어 나오다가 엔지엘을 만나게 되는데, 이 때 엔지엘은 접촉하는 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 前시냅스의 형성 여부는 시냅신(Synapsin)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
- 그림a-b : 엔지엘에 의한 시냅스 형성
- 그림c-d : 시냅스 생성능력이 소멸된 변형 엔지엘은 시냅스 생성 못함
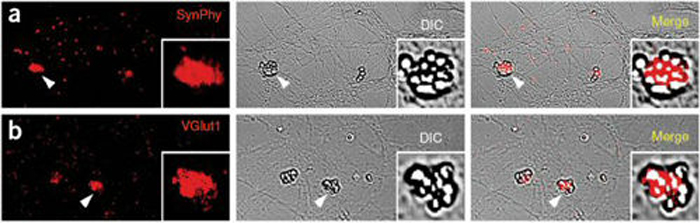
■ 사진 2: 엔지엘의 시냅스 생성 능력 확인 실험 2
표면에 엔지엘을 코팅시킨 구슬을 신경세포 위에 뿌려주면 구슬이 신경세포의 축색돌기와 접촉하게 된다(구슬들은 가운데 패널의 위상차 이미지에서 명확히 보임). 이때 엔지엘은 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 전시냅스의 형성 여부는 시냅토파이진(SynPhy; a 패널) 또는 비글룻(VGlut1; b패널)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
2006.09.19 조회수 19074
김은준교수팀, 시냅스 생성 단백질 발견
- 흥분성 시냅스 생성 촉진하는 새로운 단백질‘엔지엘’발견
- 정신분열증을 비롯한 다양한 뇌질환 발병 원리 추정 가능
- 네이처 뉴로사이언스誌 9월호 게재
사람의 뇌에서 시냅스의 생성을 촉진하는 새로운 단백질이 국내 연구진에 의해 발견됐다.
KAIST(총장 서남표) 생명과학과 김은준(金恩俊, 42 / 시냅스생성 창의연구단 단장) 교수팀이 ‘엔지엘(NGL)’ 단백질이 흥분성 시냅스의 생성에 관여한다는 새로운 사실을 발견, 오는 18일 발표되는 신경과학 권위지인 ‘네이처 뉴로사이언스誌(Nature Neuroscience)" 9월호에 게재된다고 밝혔다.
金 교수팀은 後시냅스에 위치한 ‘엔지엘’이란 막단백질이 前시냅스의 네트린지(netrin-G)라는 다른 막단백질과 연결되면서 가교 역할을 하여 새로운 시냅스 생성을 촉진하는 것을 발견했다.
‘엔지엘’은 뉴로리긴(neuoroligin)에 이어 세계에서 두 번째로 새롭게 발견된 시냅스 가교 단백질이다. 이 새로운 단백질의 발견으로 시냅스 생성 원리와 다양한 뇌질환 발병 원인을 추정할 수 있게 되었다.
우리 뇌는 약 1000억개 이상의 신경세포와 각 세포당 1만 여개의 시냅스로 신경회로망을 구성하고 있다. 시냅스는 신경세포 사이에 신경전달이 일어나는 장소다. 시냅스의 생성은 신경회로의 생성으로 연결되고, 신경회로는 정상적인 뇌발달이나 뇌기능뿐만 아니라 다양한 뇌질환과도 관련이 깊다.
金 교수는 “엔지엘과 연결되어 있는 네트린지(netrin-G)가 정신분열증 (schizophrenia)과 관련이 있고, 엔지엘과 비슷한 기능을 가진 다른 시냅스 가교 단백질인 뉴로리긴이 정신지체(mental retardation) 및 자폐증(autism)과 관련이 깊은 만큼, 엔지엘도 정신분열증을 비롯한 다양한 뇌질환과 관련이 있을 것으로 보인다"라고 말했다.
<첨부사진 설명>
■ 사진 1: 엔지엘의 시냅스 생성 능력 확인 실험 1
표면에 엔지엘을 발현하고 있는 일반세포(녹색)와 신경세포를 섞어 준다. 축색돌기(axon)가 약 10시 방향에서 가운데 위치해 있는 엔지엘(일반세포)쪽으로 뻗어 나오다가 엔지엘을 만나게 되는데, 이 때 엔지엘은 접촉하는 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 前시냅스의 형성 여부는 시냅신(Synapsin)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
- 그림a-b : 엔지엘에 의한 시냅스 형성
- 그림c-d : 시냅스 생성능력이 소멸된 변형 엔지엘은 시냅스 생성 못함
■ 사진 2: 엔지엘의 시냅스 생성 능력 확인 실험 2
표면에 엔지엘을 코팅시킨 구슬을 신경세포 위에 뿌려주면 구슬이 신경세포의 축색돌기와 접촉하게 된다(구슬들은 가운데 패널의 위상차 이미지에서 명확히 보임). 이때 엔지엘은 축색돌기 안에 前시냅스(붉은색)의 형성을 유도한다. 전시냅스의 형성 여부는 시냅토파이진(SynPhy; a 패널) 또는 비글룻(VGlut1; b패널)이라는 前시냅스 단백질의 형광 염색(붉은색)으로 알 수 있다.
2006.09.19 조회수 19074