%EB%B0%95%EC%A0%9C%EA%B7%A0
-
 종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.07.16 조회수 6238
종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.07.16 조회수 6238 -
 맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. 우리 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
우리 대학 바이오및뇌공학과 김휘수 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재됐다.(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array) 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의 “핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)” 세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.06.27 조회수 5908
맞춤형 종양 모델 구축 스페로이드 플랫폼 개발
세포들이 뭉쳐 생성된 구형 집합체인 스페로이드(spheroid)의 제작 기술은 현재 단일 조건의 스페로이드를 대규모로 생성하는 것까지는 가능하나, 체내 조직의 기능을 모사할 수 있는 최적의 크기 및 세포 조성 범위의 탐색이 어렵고, 다중 약물 스크리닝에 적합하지 않다는 문제가 있었다. 우리 연구진이 단 3번의 세포 주입으로 10가지 세포 조성을 갖는 100개의 스페로이드를 제작하고, 25가지 약물 조합을 동시에 처리할 수 있는 플랫폼을 구축하는 데 성공했다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 다양한 스페로이드 어레이(배열)를 맞춤형으로 손쉽게 제작하고 이를 구획화해 다중 시약 처리를 수행할 수 있는 조립형 마이크로어레이 플랫폼을 개발했다고 27일 밝혔다.
기존 단일 조건의 스페로이드를 대규모로 제작하는 방법은 다중 약물 스크리닝이 어렵고, 다중 약물 스크리닝이 가능한 방법은 대규모 제작이 어려워, 두 가지 장점을 동시에 만족하는 플랫폼이 개발되지 않은 실정이었다.
* 다중 약물 스크리닝: 암 치료의 식별 및 약물 안전성 평가를 위해 약물의 종류, 농도 등 다양한 실험 조건 변화에 따른 세포 및 조직의 반응을 평가하는 방법
연구팀은 조립식 플랫폼의 핵심기술인 행잉드롭 마이크로어레이*, 그래디언트(gradient) 블록**, 오목 기둥 마이크로어레이***를 개발하고, 이들의 조립 방식에 따라 달라지는 여러 가지 스페로이드 어레이 기반 종양 모델의 제작 방법과 분석 방법을 발표했다.
* 행잉드롭 마이크로어레이: 고드름과 같이 표면에 매달린 형태의 물방울을 의미하는 행잉드롭 내에 세포가 존재하면 중력에 의해 세포들이 응집되어 스페로이드가 만들어짐. 행잉드롭 마이크로어레이는 바닥 면에 구멍이 2차원으로 배열되어, 단 한 번의 세포 혼합용액 주입으로 행잉드롭을 어레이 형태로 형성할 수 있어, 균일한 스페로이드 어레이를 제작할 수 있음
** 그래디언트 블록: 경사면을 가지는 블록으로, 행잉드롭 마이크로어레이와 조립하게 되면 각각의 어레이 구멍에 가라앉는 세포의 수가 선형으로 변화하게 되어 이를 통해 크기가 규칙적으로 변화하는 스페로이드 어레이를 제작할 수 있음
***오목 기둥 마이크로어레이: 행잉드롭과 접촉하여 스페로이드를 기둥 상부에 안착시켜 회수할 수 있는 구조를 갖고 있어, 스페로이드 어레이를 개별적으로 분리하고 이동시킬 수 있음
연구팀은 10가지의 다른 세포 조성을 가지며, 조성 별로 10개의 스페로이드가 존재하는, 총 100개의 삼중 배양 스페로이드로 구성된 어레이를 단 세 번의 세포 혼합용액 주입으로 생성시키는데 성공했다.
또한 연구팀은 행잉드롭 마이크로어레이와 오목 기둥 마이크로어레이의 조립을 통해 대규모로 생성된 스페로이드를 작은물방울 형태로 각각 분리하고, 구획화된 행잉드롭 마이크로어레이로 옮겨 스페로이드 어레이를 구획화시키는 방법을 새롭게 선보였다. 이를 통해 스페로이드 어레이의 순차적 다중 시약 처리 및 일괄적 형광 염색이 가능하게 되어 스페로이드 분석 및 실험 과정이 획기적으로 개선됐다.
연구를 주도한 박제균 교수는 “이번 연구는 다양한 크기와 조성을 갖는 스페로이드 어레이를 대규모로 제작하고, 원하는 대로 이동시켜 일괄 또는 다중 시약 처리가 가능한 고효율 스크리닝 플랫폼의 개발 성과”임을 강조하며, “간단하면서도 우수한 편의성을 갖춘 플랫폼이기에, 향후 다른 연구자들도 스페로이드 및 오가노이드의 크기와 조성에 따른 변화 연구와 다양한 세포 조성으로 이루어진 복잡한 스페로이드, 오가노이드 어레이를 이용한 고효율 약물 스크리닝 등에 활용할 수 있을 것”이라고 말했다.
우리 대학 바이오및뇌공학과 김휘수 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)’에 2024년 5월 30일 자로 온라인판에 게재됐다.(https://doi.org/10.1002/adhm.202400501. 논문명: Reconfigurable Hanging Drop Microarray Platform for On-demand Preparation and Analysis of Spheroid Array) 또한 상기 논문은 와일리-VCH(Wiley-VCH) 출판사의 “핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)” 세션에도 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.06.27 조회수 5908 -
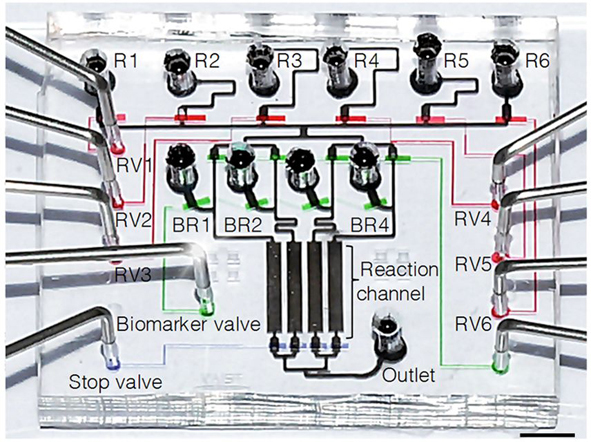 박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
2010.05.10 조회수 21675
박제균 교수, 개인 맞춤형 항암치료 원천기반기술 개발
- 극소량의 암 조직으로 다양한 암 판별 물질을 동시에 검사할 수 있는 기술 개발 -
유방암을 비롯한 현대인의 각종 암을 개인별 특성에 맞게 맞춤형 항암 치료할 수 있는 원천기반기술이 국내 연구진에 의해 개발되었다.
우리대학 바이오 및 뇌공학과 박제균 교수 연구팀과 고려대 안암병원 유방센터 이은숙 교수 연구팀이 주도한 이번 연구는 교육과학기술부(장관 안병만)와 한국연구재단(이사장 박찬모)이 추진하는 중견연구자지원 사업(도약연구), 바이오전자사업 및 고려대 학술연구비의 지원을 받아 수행되었고, 연구 결과는 국제적으로 저명한 온라인 오픈액세스 과학 전문지인 “플로스원(PLoS ONE)” 최신호(5월 3일자)에 게재되었다.
연구팀은 극소량의 암 조직만으로도 다양한 암 판별 물질(종양 표지자, 바이오마커)을 동시에 검사할 수 있는 기술(미세유체기술을 이용한 면역 조직화학법과 랩온어칩)을 개발하는데 성공하였다.
암 진단과 치료를 위한 필수검사는 암 조직을 떼어내 암 여부를 판별하는 물질인 표지자 4개를 모두 검사해야만 최종적으로 판단할 수 있는데,기존의 검사는 떼어낸 암 조직 하나에 1개의 표지자밖에 검출하지 못해, 많은 암 조직을 떼어내야 하기 때문에 불편하고, 검사가 하나씩 순차적으로 이루어지기 때문에 검사 시차가 달라, 정확한 검사가 어려워 검사비용과 시간이 늘어나 환자의 부담이 컸었다. 그러나 연구팀이 개발한 기술을 이용하면, 하나의 작은 암 조직만으로도 한 번에 최대 20여개의 표지자까지 동시에 검사할 수 있어, 비용을 1/200로 절감하고, 분석시간도 1/10로 단축하는 등 획기적인 기술로 평가된다.
특히 이번 연구결과는 동물이 아닌 인간의 암 조직을 직접 이용한 임상실험을 통해 증명한 최초의 사례로 그 의미가 크다.
연구팀은 유방암 환자 115명의 실제 암 조직을 가지고 복잡한 실험을 하나의 칩 위에서 간단히 구현할 수 있는 기술(랩온어칩 기술)을 이용해 임상 실험한 결과, 기존 검사결과와 최대 98%까지 일치하는 등 검사의 정확도를 입증하였다.
고려대 이은숙 교수는 “미세바늘로 추출한 소량의 조직만으로도 다양한 검사가 가능하고 객관적으로 판독할 수 있다”면서, “검사에 필요한 비용과 시간을 상당부분 줄일 수 있을 뿐만 아니라, 초기 정밀검진이 가능하여, 향후 개인 맞춤형 항암치료에 크게 기여할 것으로 기대된다” 라고 강조하였다.
또한 바이오공학, 병리학 및 종양학 등 공학과 의학이 융합된 학제적 연구성과로, 향후 사업화를 통한 경제적 부가가치도 클 것으로 기대된다.
현재 이 기술은 특허협력조약(Patent Cooperation Treaty, PCT)의 특허 1건을 포함해 국내 특허 6건을 출원하였고, 종양분석과 조직시료 검사에 활용되는 기반기술로, 개인 맞춤형 항암제 효력 테스트용 랩온어칩 등 사업화를 위한 후속연구가 활발히 진행되고 있다.
특히 조직병리, 암 진단, 질병의 경과예측 등 의학뿐만 아니라, 바이오 마커 개발 등 생명공학에도 응용될 것으로 기대하고 있다.
우리대학 박제균 교수는 “이번 연구성과로 지금까지 분석할 수 없었던 매우 작은 조직도 쉽고 빠르게 검사할 수 있게 되어 정확한 진단을 통한 치료가 가능하게 되었다”면서, “개인별 맞춤형 항암치료의 대중화를 통해 우리나라 보건의료의 선진화에 크게 기여할 것”이라고 연구 의의를 밝혔다.
한편, 제1저자인 우리대학 김민석 박사는 이번 연구성과로, 제16회 삼성 휴먼테크 논문 대상에서 금상을, 교육과학기술부가 후원하는 젊은 파스퇴르상에서 대상을 수상하는 영예를 안았다.
[그림. 암 조직 시료 상부에 올려지게 되는 투명한 플라스틱으로 이루어진 랩온어칩의 구조]
2010.05.10 조회수 21675 -
 초고감도 나노바이오센서 원천기술 개발
KAIST 바이오시스템학과 박제균(朴濟均, 42) 교수팀이 나노자성입자를 이용 단백질, DNA 등의 생체분자(生體分子)를 초고감도로 검출할 수 있는 바이오센서 기술 개발에 성공했다.
이 기술은 나노(10억분의 일)그램 이하 수준으로 존재하는 극미량 물질을 검출할 수 있는 새로운 센서기술로 특정 자기장(磁氣場)하에서 생체분자의 정량적 및 고감도 분석이 가능하다.
황사 알레르기 등 많은 질환의 표지가 되는 생체분자들은 일반적으로 극미량 만으로도 인체에 심각한 영향을 미치기 때문에 이를 검출할 수 있는 센서기술은 차세대 나노바이오기술의 핵심분야에 속한다.
기존의 바이오센서 기술은 극미량 검출에는 본질적인 한계가 있는데 이번에 개발된 나노입자를 이용한 극미량 검출기술은 그러한 한계를 뛰어넘은 새로운 원천기술로서 향후 바이오센서, 랩온어칩(Lab on a chip, 손톱만한 크기의 칩으로 실험실에서 할 수 있는 연구를 수행할 수 있도록 만든 장치)개발 등에 크게 기여할 것으로 보인다.
이 연구결과는 최근 나노바이오분야의 세계적인 학술지인“랩온어칩”誌 인터넷 판에 발표되었고, 관련기술은 현재 특허 출원중에 있다.
2005.05.20 조회수 23868
초고감도 나노바이오센서 원천기술 개발
KAIST 바이오시스템학과 박제균(朴濟均, 42) 교수팀이 나노자성입자를 이용 단백질, DNA 등의 생체분자(生體分子)를 초고감도로 검출할 수 있는 바이오센서 기술 개발에 성공했다.
이 기술은 나노(10억분의 일)그램 이하 수준으로 존재하는 극미량 물질을 검출할 수 있는 새로운 센서기술로 특정 자기장(磁氣場)하에서 생체분자의 정량적 및 고감도 분석이 가능하다.
황사 알레르기 등 많은 질환의 표지가 되는 생체분자들은 일반적으로 극미량 만으로도 인체에 심각한 영향을 미치기 때문에 이를 검출할 수 있는 센서기술은 차세대 나노바이오기술의 핵심분야에 속한다.
기존의 바이오센서 기술은 극미량 검출에는 본질적인 한계가 있는데 이번에 개발된 나노입자를 이용한 극미량 검출기술은 그러한 한계를 뛰어넘은 새로운 원천기술로서 향후 바이오센서, 랩온어칩(Lab on a chip, 손톱만한 크기의 칩으로 실험실에서 할 수 있는 연구를 수행할 수 있도록 만든 장치)개발 등에 크게 기여할 것으로 보인다.
이 연구결과는 최근 나노바이오분야의 세계적인 학술지인“랩온어칩”誌 인터넷 판에 발표되었고, 관련기술은 현재 특허 출원중에 있다.
2005.05.20 조회수 23868