
〈 허 원 도 교수 〉
우리 대학 생명과학과 허원도 교수 연구팀이 막으로 이루어진 세포내 소기관들의 이동을 빛으로 자유롭게 제어하는데 성공했다. 이로써 세포내 물질 수송의 단계별 메커니즘을 규명해 암과 신경질환 치료에 새로운 해법을 제시할 수 있을 것으로 기대된다.
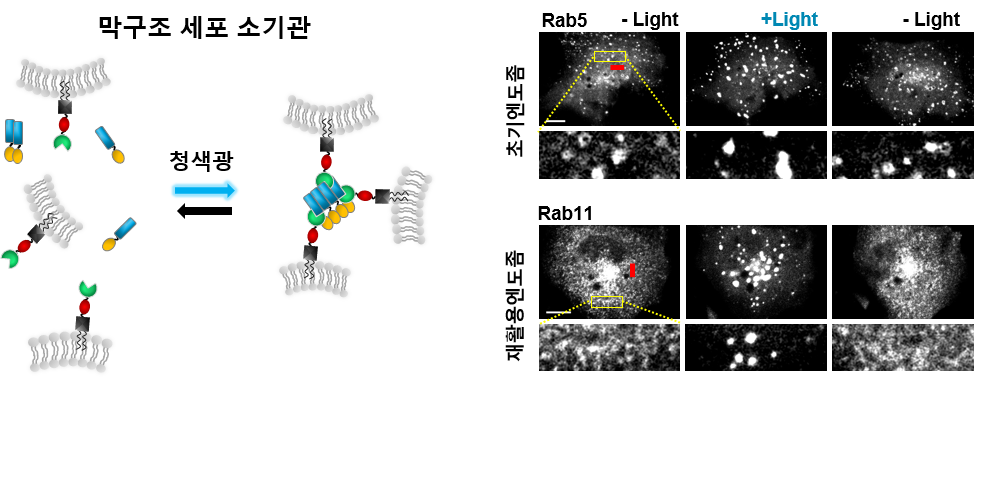
연구팀은 세포내 물질 수송을 조절하는 새로운 광유전학 기술인 생체막 올가미(IM-LARIAT; Light-Activated Reversible Inhibition by Assembled Trap of Intracellular Membrane) 기술을 개발했다.
세포 내에는 엔도좀(endosome)이나 리소좀(lysosome), 엑소좀(exosome) 등 막으로 이루어진 다양한 막 구조 세포 소기관2)(intracellular membranes)들이 존재한다. 막 구조 세포 소기관들은 세포의 성장과 분열에 밀접한 세포의 기본 기능인 물질 수송과 물질 분비, 신호전달과정 등에 관여한다.
세포내 물질 수송은 매우 역동적으로 움직이는 세포 소기관들에 의해 이루어지는데, 복잡한 움직임을 제어할 방법이 거의 없어 세포 관련 연구가 제한돼 왔다.
이에 허원도 교수는 생체막 올가미 기술을 개발, 빛을 통해 세포 소기관들의 이동을 원하는 때, 원하는 위치에서 일시 정지시켜 세포 소기관들의 이동 메커니즘을 실시간으로 연구하는데 성공했다.
허원도 교수팀은 청색 빛에 반응하는 식물의 청색광 수용 단백질에, 세포 소기관들의 생체막에 존재하는 랩 단백질(Rab small GTPase)을 결합시킨 융합단백질을 개발했다. 이 융합단백질을 실험동물의 암세포와 신경세포에 발현시킨 뒤 청색 빛을 비춘 결과, 많은 막 구조 세포 소기관들이 서로 응집하여 이동이 일시 정지되는 현상을 확인했다.
특히 생체막 올가미 기술을 신경세포에 적용, 엔도좀들의 이동을 일시 정지 시켜, 뇌 신경 세포 성장원추(growth cone)의 성장을 제어하는데 성공했다. 청색 빛을 비추자 일시적으로 성장이 멈췄던 신경세포가, 빛을 끄자 다시 빠르게 자라나는 것을 추가로 확인했다.
이번 연구는 약물이나 전기 자극이 아닌 빛을 비추는 비 침습적(non-invasive) 방식을 고안, 최소 자극으로 막 구조 세포 소기관들의 이동을 제어할 수 있게 된 데 의의가 있다. 신경세포의 분화 및 암세포의 물질 수송을 빛으로 정지시킬 수 있는 생체막 올가미 기술을 응용하면, 다양한 암과 신경질환의 치료 해법을 제시할 수 있을 것으로 기대된다.
허원도 교수는 “이번 연구는 살아있는 세포내에 존재하는 다양한 세포 소기관들을 빛으로 제어한 연구로, 적외선이나 소형 광원을 이용한 생체막 관련 질환 치료법이나 신경세포재생연구로 발전시킬 수 있을 것”이라며 “특히 뇌 신경세포 내 소기관들의 이동과 물질 수송 연구는 기억과 학습 관련 연구 분야에도 새 장을 열어줄 것”이라고 말했다.
이번 연구결과는 생명과학 분야 세계적 학술지인 네이처 케미컬 바이올로지(Nature Chemical Biology, IF 12.996) 온라인판 4월 12일자에 게재됐다.
허원도 교수는 지난 3년 동안 유명학술지에 독자적으로 개발한 광유전학기술들을 연속적으로 발표하고 있으며 현재 수편의 논문들도 해외유명저널에서 심사 중이다. 2014년에 Nature Methods, Nature Communications, Cell 자매지인 Chemistry & Biology 표지논문으로 발표를 시작했다. 2015년 Nature Biotechnology 표지논문에 이어, 이번에는 Nature Chemical Biology에 발표하는 등 세계적으로 광유전학분야를 선도하고 있다.
□ 그림 설명
그림1. 세포 내 물질 수송의 과정
-
연구 정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다. 단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다. 제1 저자인 김현 선임연구원은
2025-07-03 -
연구 6만 편 논문 대신할 ‘한번의 실험’으로 약물 저해효과 정확 예측
기존 신약 개발에서는 수많은 농도 조건에서 반복 실험을 거쳐 약물 간 상호작용을 분석하고, 저해상수를 추정하는 방식이 사용돼 왔다. 이 방법은 지금까지 6만 편 이상의 논문에 활용될 만큼 널리 쓰였다. 그런데 최근, 학부생이 제 1저자로 참여한 국내 연구진이 단 하나의 저해제 농도만으로 저해상수를 정확히 추정할 수 있는 획기적인 분석법을 제안해 주목을 받고 있다. 우리 대학 수리과학과 김재경 교수 연구팀(IBS 의생명 수학 그룹 CI)이 충남대(총장 김정겸) 약대 김상겸 교수팀과 기초과학연구원(원장 노도영, IBS) 의생명수학그룹과 공동연구를 통해, 단 하나의 실험으로 약물 저해 효과*를 예측할 수 있다고 26일 밝혔다. *약물 저해 효과: 한 약물이 특정 효소의 작용을 억제함으로써 다른 약물의 대사(분해 및 처리 과정) 또는 생리학적 효과에 영향을 주는 현상 공동 연구팀은 수학적 모델링과 오차 지형 분석을 통해 정확도 향상에 기여하지 않는 저해제 농도를 제거하고, 단
2025-06-16 -
연구 21개 화학반응 동시 분석..AI 신약 개발 판 바꾼다
임산부의 입덧 완화 목적으로 사용됐던 약물인 탈리도마이드(Thalidomide)는 생체 내에서는 광학 이성질체*의 특성으로 한쪽 이성질체는 진정 효과를 나타내지만, 다른 쪽은 기형 유발이라는 심각한 부작용을 일으킨다. 이런 예처럼, 신약 개발에서는 원하는 광학 이성질체만을 선택적으로 합성하는 정밀 유기합성 기술이 중요하다. 하지만, 여러 반응물을 동시에 분석하는 것 자체가 어려웠던 기존 방식을 극복하고, 우리 연구진이 세계 최초로 21종의 반응물을 동시에 정밀 분석하는 기술을 개발해, AI와 로봇을 활용하는 신약 개발에 획기적인 기여가 기대된다. *광학 이성질체: 동일한 화학식을 가지며 거울상 관계에 있으면서 서로 겹칠 수 없는 비대칭 구조로 존재하는 분자 쌍을 말한다. 이는 왼손과 오른손처럼 형태는 유사하지만 포개어지지 않는 관계와 유사하다. 우리 대학 화학과 김현우 교수 연구팀이 인공지능 기반 자율합성* 시대에 적합한 혁신적인 광학이성질체 분석 기술을 개발했다고 16일
2025-06-16 -
연구 간 조직 속 노화 신호 미리 잡아 질병 예측한다
노화나 만성 질환은 장기간에 걸쳐 미세한 조직 변화가 서서히 축적되는 과정을 거치기 때문에, 장기 내 이러한 변화를 정량적으로 파악하고, 이를 질병 발병의 초기 신호와 연결하는 데에는 여전히 한계가 있다. 이에 우리 연구진이 조직 안에서 처음 문제가 생기는 국소적인 변화를 정확히 포착해, 질병을 더 빠르게 발견하고 예측하며, 맞춤형 치료 타깃을 설정하는 데 큰 도움이 될 플랫폼 기술을 개발하는 데 성공했다. 우리 대학 의과학대학원 박종은 교수, 한국생명공학연구원(KRIBB, 원장 권석윤) 노화융합연구단 김천아 박사 공동 연구팀이 노화 간 조직 내에서 국소적으로 발생하는 섬유화된 미세환경을 포착하고 이를 *단일세포 전사체 수준으로 정밀 분석*할 수 있는 ‘파이니-시퀀싱(FiNi-seq, Fibrotic Niche enrichment sequencing)’기술을 개발했다고 12일 밝혔다. *단일세포 전사체 분석: 세포 하나하나가 어떤 유전자를 얼마나 활발히
2025-06-12 -
연구 세계 최초 유전자 가위로 원하는 RNA ‘콕’ 집어 변형 성공
RNA 유전자 가위는 코로나바이러스와 같은 바이러스의 RNA를 제거하여 감염을 억제하거나 질병 원인 유전자 발현을 조절할 수 있어, 부작용이 적은 차세대 유전자 치료제로 크게 주목받고 있다. 우리 연구진은 세포 내 존재하는 수많은 RNA(유전 정보를 전달하고 단백질을 만드는 데 중요한 역할을 하는 분자) 중에서 원하는 RNA만을 정확하게 찾아서 아세틸화(화학 변형)할 수 있는 기술을 세계 최초로 개발했고, 이는 RNA 기반 치료의 새 장을 열 수 있는 핵심 기술이 될 것으로 기대된다. 우리 대학 생명과학과 허원도 석좌교수 연구팀이 최근 유전자 조절 및 RNA 기반 기술 분야에서 각광받는 RNA 유전자 가위 시스템(CRISPR-Cas13)을 이용해 우리 몸 안의 특정한 RNA에 아세틸화를 가할 수 있는 혁신적 기술을 개발했다고 10일 밝혔다. RNA는 ‘화학 변형(chemical modification)’이란 과정을 통해 그 특성과 기능이 변화할 수 있
2025-06-10