%EC%8B%A0%EA%B2%BD%EC%84%B8%ED%8F%AC
-
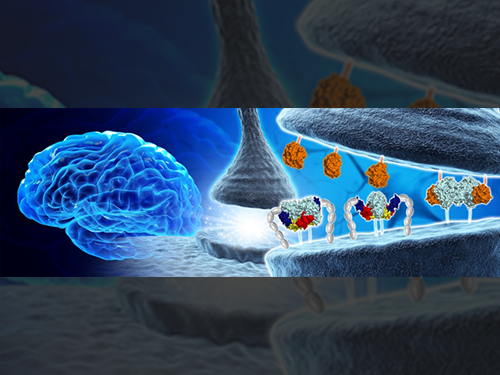 김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 21646
김호민 교수, 뇌의 시냅스 구조 및 기능 조절 단백질 구조 규명
< 김 호 민 교수 〉
우리 대학 의과학대학원 김호민 교수와 DGIST 고재원 교수 공동 연구팀이 신경세포 연결을 조절하는 핵심단백질인 MDGA1의 3차원 구조를 최초로 규명해 시냅스 발달을 조절하는 원리를 제시했다.
이번 연구 내용은 신경생물학 분야 국제학술지 ‘뉴런(Neuron)’ 6월 21일자 Issue Highlight에 게재됐다.
뇌는 많은 신경세포로 이뤄져 있고 두 신경세포가 연접하면서 형성되는 시냅스라는 구조를 통해 신호를 전달하면서 그 기능을 수행한다.
대표적인 시냅스 접착 단백질로 알려진 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)은 상호작용을 통해 흥분성 시냅스(excitatory synapse)와 억제성 시냅스(inhibitory synapse)의 발달 및 기능을 유지한다.
연구팀은 뉴롤리진(Neuroligin)과 뉴렉신(Neurexin)의 결합을 조절하는 MDGA1의 3차원 구조와 억제성시냅스(inhibitory synapse)의 형성을 저해하는 원리를 최초로 규명했다.
김 교수는 “단백질 구조생물학과 신경생물학의 유기적인 협력 연구를 통해 시냅스 발달 조절에 핵심적인 MDGA1의 구조와 작용 메커니즘을 규명했다는데 의미가 있다”며 “시냅스 단백질들의 기능 이상으로 나타나는 다양한 뇌정신질환의 발병 메커니즘을 폭넓게 이해하는 밑거름이 될 것이다. 향후 뇌신경·뇌정신질환 치료제 개발에 활용될 수 있을 것으로 기대된다.”고 말했다.
이번 연구는 미래창조과학부 기초연구지원사업(개인연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 시냅스 조절하는 핵심단백질 구조 최초 규명
그림2. 시냅스 단백질 MDGA1에 의해 조절되는 억제성 시냅스 형성 분자 메커니즘
2017.07.11 조회수 21646 -
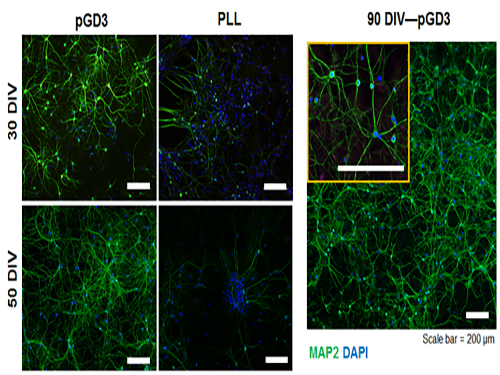 전상용, 임성갑 교수, 신경세포의 안정적 배양 가능한 플랫폼 개발
우리 대학 생명과학과 전상용 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 신경세포를 장기적, 안정적으로 배양할 수 있는 아세틸콜린 유사 고분자 박막 소재를 개발했다.
특히 이 연구는 KAIST의 ‘학부생 연구 참여 프로그램(URP : Undergraduate research program)’을 통해 유승윤 학부생이 참여해 더욱 큰 의미를 갖는다.
유승윤 학부생을 포함해 백지응 박사과정, 최민석 박사가 공동 1저자로 참여한 이번 연구 성과는 나노분야 학술지 ‘에이시에스 나노(ACS Nano)’ 10월 28일자 온라인 판에 게재됐다.
신경세포는 알츠하이머, 파킨슨병, 헌팅턴병 등의 신경퇴행성 질환 및 신경 기반 바이오센서 등 전반적인 신경관련 응용연구에 꼭 필요한 요소이다.
대부분의 신경 질환이 노인성, 퇴행성이기 때문에 신경세포가 오래됐을 때 어떤 현상이 발생하는지 관찰할 수 있어야 한다. 하지만 신경세포는 장기 배양이 어려워 퇴행 상태가 되기 전에 세포가 죽게 돼 관찰이 어려웠다.
기존에는 특정 수용성 고분자(PLL)를 배양접시 위에 코팅하는 방법을 통해 신경세포를 배양했다. 그러나 이 방법은 장기적, 안정적인 세포 배양이 불가능하기 때문에 신경세포를 안정적으로 장기 배양할 수 있는 새로운 플랫폼이 필요하다.
연구팀은 문제 해결을 위해 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용했다. iCVD는 기체 상태의 반응물을 이용해 고분자를 박막 형태로 합성하는 방법으로, 기존 세포 배양 기판 위에 손쉽게 얇고 안정적인 박막을 형성시킬 수 있다.
연구팀은 이러한 기체상 공정의 장점을 이용해 신경세포를 장기적으로 배양할 수 있는 기능을 가진 공중합체 고분자 박막을 합성하는 데 성공했다. 새로 합성된 이 고분자 박막은 신경전달물질로 알려진 아세틸콜린과 유사한 물질로 이뤄져 있다.
또한 신경세포가 고분자 박막에서 배양될 수 있는 최적화된 조건을 발견했고, 이 조건에서 생존에 관여하는 여러 신경관련 유전자를 확인했다.
연구팀은 생명과학과 손종우 교수 연구팀의 도움을 통해 새로 배양된 신경세포가 기존의 신경세포보다 전기생리학적 측면 및 신경전달 기능적 측면에서 안정화됨을 확인했다.
연구팀은 “신경세포를 장기적으로 배양할 수 있는 이 기술은 향후 신경세포를 이용한 바이오센서와 신경세포 칩 개발의 핵심 소재로 활용될 것이다”며 “다양한 신경 관련 질병의 원리를 이해할 수 있는 역할을 할 것으로 기대된다”고 말했다.
이번 연구는 한국보건산업진흥원과 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 본 연구에서 개발된 표면(pGD3) 및 폴리라이신 코팅 위에서 장시간 배양된 신경세포
그림2. 신경전달물질 유사 작용기를 도입한 표면 형성 과정
2016.11.17 조회수 26129
전상용, 임성갑 교수, 신경세포의 안정적 배양 가능한 플랫폼 개발
우리 대학 생명과학과 전상용 교수와 생명화학공학과 임성갑 교수 공동 연구팀이 신경세포를 장기적, 안정적으로 배양할 수 있는 아세틸콜린 유사 고분자 박막 소재를 개발했다.
특히 이 연구는 KAIST의 ‘학부생 연구 참여 프로그램(URP : Undergraduate research program)’을 통해 유승윤 학부생이 참여해 더욱 큰 의미를 갖는다.
유승윤 학부생을 포함해 백지응 박사과정, 최민석 박사가 공동 1저자로 참여한 이번 연구 성과는 나노분야 학술지 ‘에이시에스 나노(ACS Nano)’ 10월 28일자 온라인 판에 게재됐다.
신경세포는 알츠하이머, 파킨슨병, 헌팅턴병 등의 신경퇴행성 질환 및 신경 기반 바이오센서 등 전반적인 신경관련 응용연구에 꼭 필요한 요소이다.
대부분의 신경 질환이 노인성, 퇴행성이기 때문에 신경세포가 오래됐을 때 어떤 현상이 발생하는지 관찰할 수 있어야 한다. 하지만 신경세포는 장기 배양이 어려워 퇴행 상태가 되기 전에 세포가 죽게 돼 관찰이 어려웠다.
기존에는 특정 수용성 고분자(PLL)를 배양접시 위에 코팅하는 방법을 통해 신경세포를 배양했다. 그러나 이 방법은 장기적, 안정적인 세포 배양이 불가능하기 때문에 신경세포를 안정적으로 장기 배양할 수 있는 새로운 플랫폼이 필요하다.
연구팀은 문제 해결을 위해 ‘개시제를 이용한 화학 기상 증착법(iCVD : initiated chemical vapor deposition)’을 이용했다. iCVD는 기체 상태의 반응물을 이용해 고분자를 박막 형태로 합성하는 방법으로, 기존 세포 배양 기판 위에 손쉽게 얇고 안정적인 박막을 형성시킬 수 있다.
연구팀은 이러한 기체상 공정의 장점을 이용해 신경세포를 장기적으로 배양할 수 있는 기능을 가진 공중합체 고분자 박막을 합성하는 데 성공했다. 새로 합성된 이 고분자 박막은 신경전달물질로 알려진 아세틸콜린과 유사한 물질로 이뤄져 있다.
또한 신경세포가 고분자 박막에서 배양될 수 있는 최적화된 조건을 발견했고, 이 조건에서 생존에 관여하는 여러 신경관련 유전자를 확인했다.
연구팀은 생명과학과 손종우 교수 연구팀의 도움을 통해 새로 배양된 신경세포가 기존의 신경세포보다 전기생리학적 측면 및 신경전달 기능적 측면에서 안정화됨을 확인했다.
연구팀은 “신경세포를 장기적으로 배양할 수 있는 이 기술은 향후 신경세포를 이용한 바이오센서와 신경세포 칩 개발의 핵심 소재로 활용될 것이다”며 “다양한 신경 관련 질병의 원리를 이해할 수 있는 역할을 할 것으로 기대된다”고 말했다.
이번 연구는 한국보건산업진흥원과 한국연구재단의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 본 연구에서 개발된 표면(pGD3) 및 폴리라이신 코팅 위에서 장시간 배양된 신경세포
그림2. 신경전달물질 유사 작용기를 도입한 표면 형성 과정
2016.11.17 조회수 26129 -
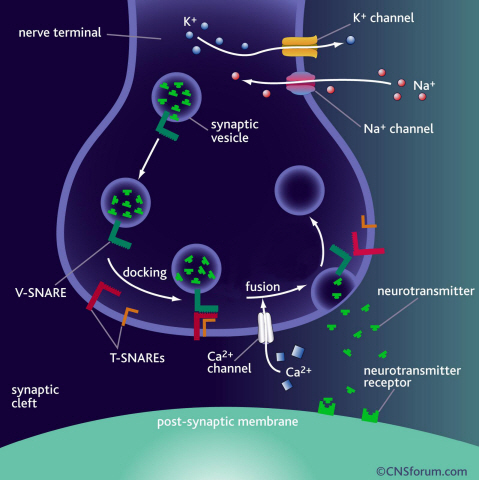 뇌신경전달 단백질의 구조와 작동원리 규명
- 생체막 융합 단백질의 구조변화 실시간 측정 -- 퇴행성 뇌질환 연구에 실마리 제공 -
우리 학교 물리학과 윤태영 교수 연구팀이 자기력 나노집게를 이용해 뇌신경세포사이의 신경물질전달에 가장 중추적인 역할을 하는 스네어(SNARE) 단백질의 숨겨진 구조와 작동원리를 단분자 수준에서 밝히는데 성공했다.
스네어 단백질의 세포막 융합기능은 알츠하이머병 같은 퇴행성 뇌질환이나 신경질환과 밀접하게 연관되어 있어 이 같은 질병의 예방과 치료법 개발에 새로운 실마리가 될 것으로 기대된다.
뇌의 신경전달은 신경세포 말단 시냅스에서 신경전달물질을 저장하는 포낭 주머니가 세포막에 융합되면서 일어난다. 이 과정에서 스네어 단백질은 신경전달물질 분출에 가장 핵심적인 역할을 하는 세포막 융합 단백질이다.
지금까지 학계에서는 스네어 단백질이 신경물질을 주고받는 과정을 조절할 것이라고 추정해 왔지만 그 구조와 기능을 명확하게 밝혀내지 못했다.
연구팀은 자기력 나노집게를 이용해 피코 뉴턴(pN, 1조분의 1뉴턴) 수준의 힘으로 단백질 하나를 정교하게 당겼다 놓으면서 나노 미터수준의 물리적 변화를 실시간으로 측정하는 실험기법을 개발했다.
이를 통해 스네어 단백질에 숨겨진 중간구조가 존재하며, 이 구조에 대한 정밀한 측정결과 중간상태가 어떤 구조를 갖는지 정확하게 예측했다.
이와 함께 생체막 사이에 있는 스네어 단백질의 중간구조가 생체막이 서로 밀어내는 힘을 견디고 유지하면서 신경물질을 주고받는 과정을 조절하는 역할을 할 수 있음을 밝혔다.
윤태영 교수는 “생체단백질이 갖는 숨겨진 구조와 작동원리를 힘을 정교하게 조절하는 실험만으로 직접 관찰하는 것과 동일한 획기적 연구 결과를 일궈냈다”며 “이 기술은 생물학의 연구대상을 물리학적인 방법 연구하는데 매우 중요한 기술로 향후 학제적 융합연구에 매우 중요한 기반이 될 것”이라고 말했다.
한편, 이번 연구는 KAIST 물리학과 윤태영 교수와 김기범 연구교수의 주도 아래 KIST 의공학연구소 신연균 교수와 공동연구로 진행됐고, KAIST 물리학과 조용훈 교수, 민두영 박사과정, KIAS 계산과학부 현창봉 교수가 참여했으며, 이번 세계적 과학학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 4월 16일자에 게재됐다.
(a) 뇌의 신경전달은 신경세포 말단 시냅스에서 신경전달물질을 저장하는 포낭 주머니가 세포막에 융합되면서 일어난다. 이 과정에서 스네어 단백질은 신경전달물질 분출에 핵심적인 역할을 한다.
(b) 자기력 나노집게를 이용하여 단분자 수준에서 단백질 구조 변화를 실시간으로 측정방법의 개략도. 피코 뉴톤(pN) 수준의 힘으로 단백질 하나를 정교하게 당겼다 놓으면서 나노 미터수준의 물리적 변화를 실시간으로 측정하여 생체막 융합 단백질의 숨겨진 중간구조와 작동원리를 단분자 수준에서 관찰한다.
2013.05.09 조회수 19204
뇌신경전달 단백질의 구조와 작동원리 규명
- 생체막 융합 단백질의 구조변화 실시간 측정 -- 퇴행성 뇌질환 연구에 실마리 제공 -
우리 학교 물리학과 윤태영 교수 연구팀이 자기력 나노집게를 이용해 뇌신경세포사이의 신경물질전달에 가장 중추적인 역할을 하는 스네어(SNARE) 단백질의 숨겨진 구조와 작동원리를 단분자 수준에서 밝히는데 성공했다.
스네어 단백질의 세포막 융합기능은 알츠하이머병 같은 퇴행성 뇌질환이나 신경질환과 밀접하게 연관되어 있어 이 같은 질병의 예방과 치료법 개발에 새로운 실마리가 될 것으로 기대된다.
뇌의 신경전달은 신경세포 말단 시냅스에서 신경전달물질을 저장하는 포낭 주머니가 세포막에 융합되면서 일어난다. 이 과정에서 스네어 단백질은 신경전달물질 분출에 가장 핵심적인 역할을 하는 세포막 융합 단백질이다.
지금까지 학계에서는 스네어 단백질이 신경물질을 주고받는 과정을 조절할 것이라고 추정해 왔지만 그 구조와 기능을 명확하게 밝혀내지 못했다.
연구팀은 자기력 나노집게를 이용해 피코 뉴턴(pN, 1조분의 1뉴턴) 수준의 힘으로 단백질 하나를 정교하게 당겼다 놓으면서 나노 미터수준의 물리적 변화를 실시간으로 측정하는 실험기법을 개발했다.
이를 통해 스네어 단백질에 숨겨진 중간구조가 존재하며, 이 구조에 대한 정밀한 측정결과 중간상태가 어떤 구조를 갖는지 정확하게 예측했다.
이와 함께 생체막 사이에 있는 스네어 단백질의 중간구조가 생체막이 서로 밀어내는 힘을 견디고 유지하면서 신경물질을 주고받는 과정을 조절하는 역할을 할 수 있음을 밝혔다.
윤태영 교수는 “생체단백질이 갖는 숨겨진 구조와 작동원리를 힘을 정교하게 조절하는 실험만으로 직접 관찰하는 것과 동일한 획기적 연구 결과를 일궈냈다”며 “이 기술은 생물학의 연구대상을 물리학적인 방법 연구하는데 매우 중요한 기술로 향후 학제적 융합연구에 매우 중요한 기반이 될 것”이라고 말했다.
한편, 이번 연구는 KAIST 물리학과 윤태영 교수와 김기범 연구교수의 주도 아래 KIST 의공학연구소 신연균 교수와 공동연구로 진행됐고, KAIST 물리학과 조용훈 교수, 민두영 박사과정, KIAS 계산과학부 현창봉 교수가 참여했으며, 이번 세계적 과학학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 4월 16일자에 게재됐다.
(a) 뇌의 신경전달은 신경세포 말단 시냅스에서 신경전달물질을 저장하는 포낭 주머니가 세포막에 융합되면서 일어난다. 이 과정에서 스네어 단백질은 신경전달물질 분출에 핵심적인 역할을 한다.
(b) 자기력 나노집게를 이용하여 단분자 수준에서 단백질 구조 변화를 실시간으로 측정방법의 개략도. 피코 뉴톤(pN) 수준의 힘으로 단백질 하나를 정교하게 당겼다 놓으면서 나노 미터수준의 물리적 변화를 실시간으로 측정하여 생체막 융합 단백질의 숨겨진 중간구조와 작동원리를 단분자 수준에서 관찰한다.
2013.05.09 조회수 19204 -
 생명과학과 김재섭 교수팀, '생체시계 뇌신경망 교신 유전자'세계최초로 밝혀
2만5천여 종의 형질전환 초파리 이용, 새로운 생체시계 유전자 발견
수면장애, 생체리듬 장애로 인한 각종 생리질환 치료법 개발 활로 열어
우리 몸은 하루 24시간의 시각 주기를 기억해서 현재 시각이 아침인지 저녁인지 혹은 낮인지 밤인지를 스스로 아는 능력이 있다. 한국에 살던 사람이 미국에 가면 한국에서 기억된 시각주기 때문에 처음 며칠 동안은 밤에는 깨어 있다가 낮이 되면 졸리고 하는 것이 그 일예이다. 우리 몸이 이렇게 하루 24시간 주기의 시간 흐름을 아는 것은 대뇌 아래 시상하부에 존재하는 일부 신경세포가 시계의 기능을 하기 때문인데, 이 시계를 “생체시계”라고 부른다. 정상적으로 생활하던 사람을 하루 종일 어두운 곳에 두어도 아침 시간이 되면 잠에서 깨고, 끼니마다 배가 고파지며, 또 밤 시간이 되면 잠을 자는 이유도 이 생체시계 때문이다.
생체시계의 역할은 시상하부에 위치한 수십 개의 신경세포가 담당한다. 이 생체시계 신경세포 각각의 내부에서 작동하는 유전자들은 그 동안 잘 알려져 있었다. 그러나 정작 각각의 생체시계 신경세포가 어떻게 서로 교신하여 하나의 완벽하고 정교한 생체시계 신경망을 이루어 우리 몸의 시간을 지배하는 지는 베일에 쌓여 있었다. KAIST 생명과학과 김재섭(金在燮, 42) 교수팀이 바이오벤처 제넥셀과의 공동연구로 이번에 그 베일을 세계 최초로 벗겼다.
金 교수팀은 제넥셀이 구축한 2만5천여 종의 형질전환 초파리를 이용, 새로운 생체시계 유전자를 발견하였으며, 그 이름을 “한(Han)"이라고 명명하였다. 金 교수팀에 따르면 “한” 유전자로부터 만들어지는 단백질은 "피디에프(PDF)"라는 리간드 단백질의 수용체로 작용하며, 생체시계 신경 세포들의 표면에 존재한다. 생체시계 신경세포 중에서 마스터(master) 생체시계 신경세포가 하루 24시간의 주기에 따라 각기 다른 양의 “피디에프”를 분비한다. 그러면 뇌의 다른 부위에 존재하는 생체시계 신경세포들은 표면에 있는 “한” 수용체 단백질을 통해 이 신호를 받아서 자기의 생체시계 작동을 마스터 신경세포의 생체시계 시각과 동조화 시킨다. 이렇게 해서 생체시계 신경망을 담당하는 모든 신경세포들 안에 있는 생체시계는 동일한 시각으로 맞춰지게 된다. 즉, “피디에프”와 “한” 단백질을 이용한 생체시계 신경세포들 사이의 교신이 정확하게 이뤄져 생체시계의 시각 결정을 담당하는 모든 신경세포가 특정 시간을 모두 동일한 시간으로 인식하여 일사 분란하게 몸을 조절하는 것이다. 金 교수팀의 이번 연구결과는 뉴론(Neuron)誌 10월호(10.20 발행)에 게재된다. 뉴론誌는 셀지의 자매지로서 네이처 뉴로사이언스와 쌍벽을 이루는 신경과학 분야의 최고 권위지다.
김재섭 교수는 "학문적으로는 생체시계를 담당하는 뇌신경들이 어떻게 서로 교신 하는 지를 알 수 있게 되었으며, 의학적으로는 수면 장애와 생체리듬 장애로 인한 각종 생리 질환 치료법 개발에 새로운 길을 열게 되었다"고 이번 연구 성과의 의의를 밝혔다.
2005.10.20 조회수 21260
생명과학과 김재섭 교수팀, '생체시계 뇌신경망 교신 유전자'세계최초로 밝혀
2만5천여 종의 형질전환 초파리 이용, 새로운 생체시계 유전자 발견
수면장애, 생체리듬 장애로 인한 각종 생리질환 치료법 개발 활로 열어
우리 몸은 하루 24시간의 시각 주기를 기억해서 현재 시각이 아침인지 저녁인지 혹은 낮인지 밤인지를 스스로 아는 능력이 있다. 한국에 살던 사람이 미국에 가면 한국에서 기억된 시각주기 때문에 처음 며칠 동안은 밤에는 깨어 있다가 낮이 되면 졸리고 하는 것이 그 일예이다. 우리 몸이 이렇게 하루 24시간 주기의 시간 흐름을 아는 것은 대뇌 아래 시상하부에 존재하는 일부 신경세포가 시계의 기능을 하기 때문인데, 이 시계를 “생체시계”라고 부른다. 정상적으로 생활하던 사람을 하루 종일 어두운 곳에 두어도 아침 시간이 되면 잠에서 깨고, 끼니마다 배가 고파지며, 또 밤 시간이 되면 잠을 자는 이유도 이 생체시계 때문이다.
생체시계의 역할은 시상하부에 위치한 수십 개의 신경세포가 담당한다. 이 생체시계 신경세포 각각의 내부에서 작동하는 유전자들은 그 동안 잘 알려져 있었다. 그러나 정작 각각의 생체시계 신경세포가 어떻게 서로 교신하여 하나의 완벽하고 정교한 생체시계 신경망을 이루어 우리 몸의 시간을 지배하는 지는 베일에 쌓여 있었다. KAIST 생명과학과 김재섭(金在燮, 42) 교수팀이 바이오벤처 제넥셀과의 공동연구로 이번에 그 베일을 세계 최초로 벗겼다.
金 교수팀은 제넥셀이 구축한 2만5천여 종의 형질전환 초파리를 이용, 새로운 생체시계 유전자를 발견하였으며, 그 이름을 “한(Han)"이라고 명명하였다. 金 교수팀에 따르면 “한” 유전자로부터 만들어지는 단백질은 "피디에프(PDF)"라는 리간드 단백질의 수용체로 작용하며, 생체시계 신경 세포들의 표면에 존재한다. 생체시계 신경세포 중에서 마스터(master) 생체시계 신경세포가 하루 24시간의 주기에 따라 각기 다른 양의 “피디에프”를 분비한다. 그러면 뇌의 다른 부위에 존재하는 생체시계 신경세포들은 표면에 있는 “한” 수용체 단백질을 통해 이 신호를 받아서 자기의 생체시계 작동을 마스터 신경세포의 생체시계 시각과 동조화 시킨다. 이렇게 해서 생체시계 신경망을 담당하는 모든 신경세포들 안에 있는 생체시계는 동일한 시각으로 맞춰지게 된다. 즉, “피디에프”와 “한” 단백질을 이용한 생체시계 신경세포들 사이의 교신이 정확하게 이뤄져 생체시계의 시각 결정을 담당하는 모든 신경세포가 특정 시간을 모두 동일한 시간으로 인식하여 일사 분란하게 몸을 조절하는 것이다. 金 교수팀의 이번 연구결과는 뉴론(Neuron)誌 10월호(10.20 발행)에 게재된다. 뉴론誌는 셀지의 자매지로서 네이처 뉴로사이언스와 쌍벽을 이루는 신경과학 분야의 최고 권위지다.
김재섭 교수는 "학문적으로는 생체시계를 담당하는 뇌신경들이 어떻게 서로 교신 하는 지를 알 수 있게 되었으며, 의학적으로는 수면 장애와 생체리듬 장애로 인한 각종 생리 질환 치료법 개발에 새로운 길을 열게 되었다"고 이번 연구 성과의 의의를 밝혔다.
2005.10.20 조회수 21260 -
 뇌신경 보호유전자 세계 첫 발견
KAIST 생명과학과 김재섭 교수(43세)팀은 지나친 자극으로부터 신경세포를 보호하는 유전자를 세계 최초로 발견하고, 이 유전자를 열병을 뜻하는 파이렉시아(Pyrexia)라고 명명했다.
이 유전자는 채널 단백질을 만들며, 이 채널은 섭씨 39도 이상의 고온에 의해 작동된다. 특히 이제까지 온도에 의해 작동되는 채널 단백질들은 여러 종류 발견되었으나, 자극으로부터 신경을 보호하는 채널은 파이렉시아가 처음이다. 이 유전자는 신경세포가 고온에 대해 과민하게 흥분하여 스트레스성 반응을 보이고 이로 인해 기능이 손상되는 것을 방지한다.
또한 이 유전자의 기능이 약화되면 섭씨 40도 고온에서 수분 내에 신경기능이 마비되지만, 이 유전자의 기능이 강화되면 이러한 고온에서도 신경세포의 기능이 손상되지 않고 정상적으로 작동한다.
KAIST 김재섭 교수는 "파이렉시아 채널을 인위적으로 작동시키는 약(화합물)을 개발할 경우, 상습적 마약 복용 등으로 신경이 과도하게 자극되어 뇌기능이 손상되는 것을 방지할 수 있는 획기적인 길이 열릴 것이다"라고 말하면서 "이번 연구 결과는 독감을 비롯한 각종 열병에 의해 의식을 잃거나 뇌기능이 영구하게 손상되는 것도 방지할 수 있는 길을 열었다"며 그 의미를 밝혔다.
한편, 이 연구 결과는 미국에 국제특허 출원되었으며, 세계 최고의 유전학 및 인간질병 유전자 권위지인 네이처 제네틱스 (Nature Genetics) 3월호에 논문으로 계제될 예정이다. 또한 네이처 제네틱스는 이 발견의 중요성을 감안하여 이 논문을 1월 31일자로 인터넷 (http://www.nature.com/ng/)에 먼저 공개했다.
이 유전자는 KAIST 생명과학과와 제넥셀(주)가 공동으로 2003년에 완성한 세계 최초의 형질전환초파리 게놈검색시스템을 활용하여 발굴되었으며, KAIST 생명과학과와 제넥셀(주)는 "형질전환초파리 게놈검색시스템"을 활용하여 파이렉시아 이외에도 여러 종류의 인간질병 및 신경관련 유전자를 발굴하여 연구에 박차를 가하고 있다.
2005.01.31 조회수 24835
뇌신경 보호유전자 세계 첫 발견
KAIST 생명과학과 김재섭 교수(43세)팀은 지나친 자극으로부터 신경세포를 보호하는 유전자를 세계 최초로 발견하고, 이 유전자를 열병을 뜻하는 파이렉시아(Pyrexia)라고 명명했다.
이 유전자는 채널 단백질을 만들며, 이 채널은 섭씨 39도 이상의 고온에 의해 작동된다. 특히 이제까지 온도에 의해 작동되는 채널 단백질들은 여러 종류 발견되었으나, 자극으로부터 신경을 보호하는 채널은 파이렉시아가 처음이다. 이 유전자는 신경세포가 고온에 대해 과민하게 흥분하여 스트레스성 반응을 보이고 이로 인해 기능이 손상되는 것을 방지한다.
또한 이 유전자의 기능이 약화되면 섭씨 40도 고온에서 수분 내에 신경기능이 마비되지만, 이 유전자의 기능이 강화되면 이러한 고온에서도 신경세포의 기능이 손상되지 않고 정상적으로 작동한다.
KAIST 김재섭 교수는 "파이렉시아 채널을 인위적으로 작동시키는 약(화합물)을 개발할 경우, 상습적 마약 복용 등으로 신경이 과도하게 자극되어 뇌기능이 손상되는 것을 방지할 수 있는 획기적인 길이 열릴 것이다"라고 말하면서 "이번 연구 결과는 독감을 비롯한 각종 열병에 의해 의식을 잃거나 뇌기능이 영구하게 손상되는 것도 방지할 수 있는 길을 열었다"며 그 의미를 밝혔다.
한편, 이 연구 결과는 미국에 국제특허 출원되었으며, 세계 최고의 유전학 및 인간질병 유전자 권위지인 네이처 제네틱스 (Nature Genetics) 3월호에 논문으로 계제될 예정이다. 또한 네이처 제네틱스는 이 발견의 중요성을 감안하여 이 논문을 1월 31일자로 인터넷 (http://www.nature.com/ng/)에 먼저 공개했다.
이 유전자는 KAIST 생명과학과와 제넥셀(주)가 공동으로 2003년에 완성한 세계 최초의 형질전환초파리 게놈검색시스템을 활용하여 발굴되었으며, KAIST 생명과학과와 제넥셀(주)는 "형질전환초파리 게놈검색시스템"을 활용하여 파이렉시아 이외에도 여러 종류의 인간질병 및 신경관련 유전자를 발굴하여 연구에 박차를 가하고 있다.
2005.01.31 조회수 24835