-
 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08
조회수 5329
-
 종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.07.16
조회수 6231
-
 암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2024.06.03
조회수 7245
-
 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08
조회수 9556
-
 암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18
조회수 7185
-
 해킹 공격 막는 암호 반도체 최초 개발
사물인터넷(IoT), 자율 주행 등 5G/6G 시대 소자 또는 기기 간의 상호 정보 교환이 급증함에 따라 해킹 공격이 고도화되고 있다. 이에 따라, 기기에서 데이터를 안전하게 전송하기 위해서는 보안 기능 강화가 필수적이다.
우리 대학 전기및전자공학부 최양규 교수와 류승탁 교수 공동연구팀이 ‘해킹 막는 세계 최초 보안용 암호 반도체’를 개발하는 데 성공했다고 29일 밝혔다.
연구팀은 100% 실리콘 호환 공정으로 제작된 핀펫(FinFET) 기반 보안용 암호반도체 크립토그래픽 트랜지스터(cryptographic transistor, 이하 크립토리스터(cryptoristor))를 세계 최초로 개발했다. 이는 트랜지스터 하나로 이루어진 독창적 구조를 갖고 있을 뿐만 아니라, 동작 방식 또한 독특해 유일무이한 특성을 구비한 난수발생기다.
인공지능 등의 모든 보안 환경에서 가장 중요한 요소는 난수발생기이다. 가장 널리 사용되는 보안 칩인 ‘고급 암호화 표준(advanced encryption standard, AES)’에서 난수발생기는 핵심 요소로, AES 보안 칩 전체 면적의 약 75%, 에너지 소모의 85% 이상을 차지한다. 따라서, 모바일 혹은 사물인터넷(IoT)에 탑재가 가능한 저전력/초소형 난수발생기 개발이 시급하다.
기존의 난수발생기는 전력 소모가 매우 크고 실리콘 CMOS 공정과의 호환성이 떨어진다는 단점이 있고, 회로 기반의 난수발생기들은 점유 면적이 매우 크다는 단점이 있다.
연구팀은 기존 세계 최고 수준 연구 대비 전력 소모와 점유 면적 모두 수천 배 이상 작은 암호 반도체인 단일 소자 기반의 크립토리스터(cryptoristor)를 개발했다. 절연층이 실리콘 하부에 형성되어 있는 실리콘 온 인슐레이터(Silicon-on-Insulator, SOI) 기판 위에 제작된 핀펫(FinFET)이 가지는 내재적인 전위 불안정성을 이용해 무작위적으로 0과 1을 예측 불가능하게 내보내는 난수발생기를 개발했다.
다시 설명하면, 보통 모바일 기기 등에서 정보를 교환할 때 데이터를 암호화하는 알고리즘에는 해커가 암호화한 알고리즘을 예측할 수 없도록 하는 것이 중요하다. 이에 무작위의 0과 1이 난수이며 0과 1의 배열이 매번 다른 결과가 나오게 하여 예측 불가능성을 가지도록 함으로써 공격자가 예측하지 못하도록 차단하는 방식이다.
특히, 크립토리스터 기반 난수발생기 연구는 국제적으로도 구현한 사례가 없는 세계 최초의 연구이면서, 기존 논리 연산용 또는 메모리용 소자와 동일한 구조의 트랜지스터이기 때문에, 현재 반도체 설비를 이용한 양산 공정으로 100% 제작이 가능하며 저비용으로 빠르게 대량생산이 가능하다는 점에서 의미가 크다.
연구를 주도한 김승일 박사과정은 개발된 “암호 반도체로서 초소형/저전력 난수발생기는 특유의 예측 불가능성으로 인해 보안 기능을 강화해 칩 또는 칩 간의 통신 보안으로 안전한 초연결성을 지원할 수 있고, 특히 기존 연구 대비 에너지, 집적도, 비용 측면에서 탁월한 장점을 갖고 있어 사물인터넷(IoT) 기기 환경에 적합하다”고 연구의 의의를 설명했다.
전기및전자공학부 김승일 박사과정이 제1 저자, 유형진 석사가 공저자로 참여한 이번 연구는 국제학술지 ‘사이언스(Science)’의 자매지인 ‘사이언스 어드밴시스(Science Advances)’ 2024년 2월 온라인판에 정식 출판됐다. (논문명 : Cryptographic transistor for true random number generator with low power consumption)
한편 이번 연구는 한국연구재단 차세대지능형반도체기술개발사업, 국가반도체연구실지원핵심기술개발사업의 지원을 받아 수행됐다.
해킹 공격 막는 암호 반도체 최초 개발
사물인터넷(IoT), 자율 주행 등 5G/6G 시대 소자 또는 기기 간의 상호 정보 교환이 급증함에 따라 해킹 공격이 고도화되고 있다. 이에 따라, 기기에서 데이터를 안전하게 전송하기 위해서는 보안 기능 강화가 필수적이다.
우리 대학 전기및전자공학부 최양규 교수와 류승탁 교수 공동연구팀이 ‘해킹 막는 세계 최초 보안용 암호 반도체’를 개발하는 데 성공했다고 29일 밝혔다.
연구팀은 100% 실리콘 호환 공정으로 제작된 핀펫(FinFET) 기반 보안용 암호반도체 크립토그래픽 트랜지스터(cryptographic transistor, 이하 크립토리스터(cryptoristor))를 세계 최초로 개발했다. 이는 트랜지스터 하나로 이루어진 독창적 구조를 갖고 있을 뿐만 아니라, 동작 방식 또한 독특해 유일무이한 특성을 구비한 난수발생기다.
인공지능 등의 모든 보안 환경에서 가장 중요한 요소는 난수발생기이다. 가장 널리 사용되는 보안 칩인 ‘고급 암호화 표준(advanced encryption standard, AES)’에서 난수발생기는 핵심 요소로, AES 보안 칩 전체 면적의 약 75%, 에너지 소모의 85% 이상을 차지한다. 따라서, 모바일 혹은 사물인터넷(IoT)에 탑재가 가능한 저전력/초소형 난수발생기 개발이 시급하다.
기존의 난수발생기는 전력 소모가 매우 크고 실리콘 CMOS 공정과의 호환성이 떨어진다는 단점이 있고, 회로 기반의 난수발생기들은 점유 면적이 매우 크다는 단점이 있다.
연구팀은 기존 세계 최고 수준 연구 대비 전력 소모와 점유 면적 모두 수천 배 이상 작은 암호 반도체인 단일 소자 기반의 크립토리스터(cryptoristor)를 개발했다. 절연층이 실리콘 하부에 형성되어 있는 실리콘 온 인슐레이터(Silicon-on-Insulator, SOI) 기판 위에 제작된 핀펫(FinFET)이 가지는 내재적인 전위 불안정성을 이용해 무작위적으로 0과 1을 예측 불가능하게 내보내는 난수발생기를 개발했다.
다시 설명하면, 보통 모바일 기기 등에서 정보를 교환할 때 데이터를 암호화하는 알고리즘에는 해커가 암호화한 알고리즘을 예측할 수 없도록 하는 것이 중요하다. 이에 무작위의 0과 1이 난수이며 0과 1의 배열이 매번 다른 결과가 나오게 하여 예측 불가능성을 가지도록 함으로써 공격자가 예측하지 못하도록 차단하는 방식이다.
특히, 크립토리스터 기반 난수발생기 연구는 국제적으로도 구현한 사례가 없는 세계 최초의 연구이면서, 기존 논리 연산용 또는 메모리용 소자와 동일한 구조의 트랜지스터이기 때문에, 현재 반도체 설비를 이용한 양산 공정으로 100% 제작이 가능하며 저비용으로 빠르게 대량생산이 가능하다는 점에서 의미가 크다.
연구를 주도한 김승일 박사과정은 개발된 “암호 반도체로서 초소형/저전력 난수발생기는 특유의 예측 불가능성으로 인해 보안 기능을 강화해 칩 또는 칩 간의 통신 보안으로 안전한 초연결성을 지원할 수 있고, 특히 기존 연구 대비 에너지, 집적도, 비용 측면에서 탁월한 장점을 갖고 있어 사물인터넷(IoT) 기기 환경에 적합하다”고 연구의 의의를 설명했다.
전기및전자공학부 김승일 박사과정이 제1 저자, 유형진 석사가 공저자로 참여한 이번 연구는 국제학술지 ‘사이언스(Science)’의 자매지인 ‘사이언스 어드밴시스(Science Advances)’ 2024년 2월 온라인판에 정식 출판됐다. (논문명 : Cryptographic transistor for true random number generator with low power consumption)
한편 이번 연구는 한국연구재단 차세대지능형반도체기술개발사업, 국가반도체연구실지원핵심기술개발사업의 지원을 받아 수행됐다.
2024.02.29
조회수 8951
-
 흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2024.02.21
조회수 6184
-
 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15
조회수 7032
-
 항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17
조회수 5956
-
 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24
조회수 8527
-
 면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22
조회수 8286
-
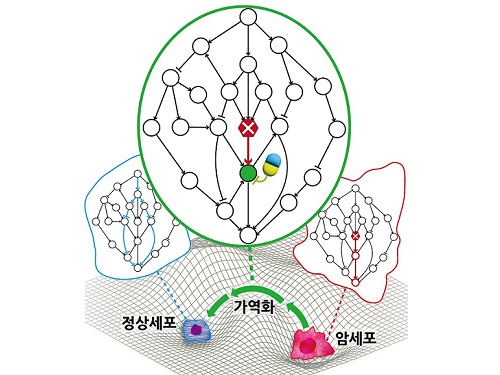 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08
조회수 10383
 간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5329
간암 종양 미세환경에서 항암면역세포 억제 기전 규명
우리 대학 의과학대학원 정원일 교수 연구팀이 종양 관련 대식세포(Tumor-associated macrophage; TAM)와 간 성상세포(Hepatic stellate cell; HSC)의 대사성 상호작용을 통한 세포독성 CD8+ T세포의 증식 억제를 간암 병인 기전으로 규명하고 이를 새로운 간암 치료 표적으로 제시했다고 8일 밝혔다.
정원일 교수 연구팀은 대식세포 침윤에 중요한 역할을 하는 신호 전달 분자인 CX3CR1 케모카인을 발현하는 특정 종양 관련 대식세포가 섬유화로 진행된 암 주변 조직 내로 이동해 활성화된 간 성상세포와 상호작용함을 확인했다. 이때, 활성화된 간 성상세포에서 분비되는 레티노익산이 종양 관련 대식세포의 아르기나아제 1(Arginase-1, 이하 Arg1) 발현을 유도해 아르기닌의 대사를 촉진함으로 세포독성 CD8+ T세포의 증식이 억제되며 간암 발병이 촉진됨을 밝혔다.
특히, 간암 환자의 간 조직을 이용한 단일세포 유전체 분석에서 종양 미세환경 내 CX3CR1과 Arg1을 발현하는 특정 대식세포 군집을 발견하고, 해당 특성을 가진 대식세포들은 활성화된 간 성상세포와 근접해 있음을 확인했다. 특히 CX3CR1이 결손된 쥐에 발암물질(diethylnitrosamine, DEN)을 이용해 간암을 유발했을 때, 암 주변 조직으로 이주한 종양 관련 대식세포의 수가 감소하고 종양의 발생 또한 눈에 띄게 감소한 것을 연구팀은 확인했다.
암 발병 시 종양 미세환경 내에는 다양한 면역세포들이 존재하고 있고, 특히 세포독성 CD8+ T세포는 항암 면역반응을 일으켜 종양 발생을 억제한다. 그러나 CD8+ T세포의 증식에 필요한 아르기닌이 대식세포의 Arg1으로 인해 고갈되면 CD8+ T세포 군집 감소와 이에 따른 항암 면역반응 감소로 종양 발생이 유도된다. 이러한 대식세포의 Arg1 발현은 근접해 있는 간 성상세포 유래 레티노익산으로 유도되며, 쥐의 간 성상세포 내 레티놀 대사를 억제했을 시 간암이 호전된 것을 연구팀은 확인했다.
연구팀은 이번 연구를 통해 간암 종양 미세환경 내 면역세포와 비실질 세포인 간 성상세포의 상호작용 기전을 대사적 측면에서 최초로 밝히고, 이를 억제했을 시 간암이 호전됨을 통해 간암 치료의 새로운 전략으로 제시했다.
의과학대학원 정종민 박사와 최성은 박사과정이 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 ‘간학 (Hepatology)’ 7월 19일 자 온라인판에 출판됐다. (논문명: CX3CR1+ macrophages interact with hepatic stellate cells to promote hepatocellular carcinoma through CD8+ T cell suppression)
한편 이번 연구는 과학기술정보통신부의 재원으로 한국연구재단 리더연구 (2021R1A2C3004589) 및 바이오·의료기술개발사업(2022M3A9B6017654, RS-2023-00223831)의 지원으로 수행됐다.
2024.08.08 조회수 5329 종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.07.16 조회수 6231
종양모델 칩으로 다조건 항암제 동시 평가
실제 인체에 항암제가 투여되면 약물 분자는 혈류를 따라 수송된다. 이 약물 분자들은 혈관 벽을 투과하고 확산한다. 확산한 분자는 종양 덩어리 내부까지 점차 침투해 약물 효능이 나타나게 된다. 우리 연구진이 바이오프린팅 기술로 36가지의 종양 미세환경을 유체채널 내부에 모사하여 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는데 성공하여 화제다.
우리 대학 바이오및뇌공학과 박제균 교수 연구팀이 기존 바이오프린팅* 및 랩온어칩** 기술의 한계점을 극복하고 장점을 극대화하여 복잡한 종양 미세환경이 구현된 랩온어칩을 개발하여 여러 분석 변수가 반영된 약물 스크리닝을 수행하는 데 성공했다고 16일 밝혔다.
* 바이오프린팅(bioprinting): 세포와 생체재료로 구성된 바이오 잉크를 활용하여 생체조직 및 기관과 유사한 기능적 구조물을 제작하는 3D 프린팅 기술
** 랩온어칩(lab-on-a-chip): “칩 위의 실험실”이란 개념을 갖고 있으며 각종 시료분석에 필요한 전처리, 분리, 희석, 혼합, 반응, 검출 기능 등을 미세유체 회로로 이루어진 채널 내에서 일괄적으로 수행할 수 있도록 만들어진 미세유체 소자 및 시스템
바이오프린팅은 조직이나 장기의 복잡한 형상과 조성을 체외환경에서 재현할 수 있는 생체모사 기술이지만, 제작된 생체모델의 배양 환경 제어와 분석이 어렵다. 반면, 랩온어칩은 미세 유체채널 내에서의 유체 제어 기술에 기반해 배양 환경의 정교한 제어와 다양한 분석 수행이 가능하지만, 미세한 유체 통로 내부에 생체 환경을 모사하는 데 한계가 있었다.
연구진은 바이오프린팅 기술로 서로 다른 조성으로 구성된 총 36개의 종양 모델을 랩온어칩 내에 형성한 후, 동일한 소자 내에서 12가지 실험 조건에 따른 항암제 효능을 동시에 평가하는 데 성공했다.
연구팀은 바이오프린팅의 우수한 공간적 자유도와 다양한 생체재료를 활용할 수 있다는 장점을 이용해, 세 가지 서로 다른 조성으로 이루어진 36개의 종양 모델을 하나의 미세 유체소자에 집적시켰다. 세포를 유동 배양해 물질 수송에 핵심 구조물인 혈관 벽과 종양 덩어리를 모사하여 네 가지 농도의 항암제를 종양 모델에 유입함으로써, 하나의 소자에서 12가지 실험 조건의 약물 평가를 수행했다.
또한 연구팀은 혈관 벽에 의해 약물 분자의 수송이 저해되고 종양 덩어리 내부까지 침투되는 현상을 관찰할 수 있었고, 체내 수송 과정을 모사하지 못했던 기존 종양 모델과 약물 효능에 큰 차이를 보인다는 것을 확인했다.
이처럼 바이오프린팅-랩온어칩 통합기술을 활용해 모델 복잡성, 모델 수, 모델 처리량 등 다양한 변수를 고려한 체외 종양 모델을 제작할 수 있었고, 더욱 신뢰성 있는 약물 평가를 수행할 수 있었다.
연구를 주도한 박제균 교수는 “바이오프린팅과 랩온어칩의 통합기술로 제작된 미세 유체 세포배양 및 분석 플랫폼의 개발에 따른 신뢰성 있는 약물 평가 모델에 대한 성과”임을 강조하며, “향후 다양한 조직 및 장기 특성을 모사하고 생물학적 분석과 약물 효능 평가를 고효율로 수행할 수 있는 동물실험 대체용 차세대 체외 세포배양 및 분석 기술로 활용될 수 있을 것”이라고 말했다.
바이오및뇌공학과 이기현 박사가 제1 저자로 참여한 이번 연구 결과는 국제 학술지 '어드밴스드 헬스케어 머티리얼즈(Advanced Healthcare Materials)'에 2024년 6월 3일 자로 온라인판에 게재됐다.
(https://doi.org/10.1002/adhm.202303716. 논문명: Bioprinted multi-composition array mimicking tumor microenvironment to evaluate drug efficacy with multivariable analysis).
또한, 이번 논문은 와일리-VCH(Wiley-VCH) 출판사의 ‘핫 토픽: 종양과 암(Hot Topic: Tumors and Cancer)’세션과 ‘핫 토픽: 미세유체공학(Hot Topic: Microfluidics)’세션에 동시 선정됐다.
한편 이번 연구는 한국연구재단 기초연구사업(중견연구)의 지원을 받아 수행됐다.
2024.07.16 조회수 6231 암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2024.06.03 조회수 7245
암세포 약물반응 예측 ‘그레이박스’ 개발
지난 수십 년간 많은 의생명과학자의 집중적인 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 이처럼 암 치료가 난해한 이유는 환자마다 암 발생의 원인이 되는 유전자 돌연변이와 그로 인한 유전자 네트워크 변형이 서로 달라서 전통적인 실험생물학 접근만으로 표적치료를 적용하는 데에는 본질적인 한계가 있기 때문이다. 한편 딥러닝과 같은 소위 블랙박스(black-box) 방식의 인공지능 기술을 활용해 실험을 대체하고 데이터 학습을 통해 약물 반응을 예측할 수 있으나 이에 대한 생물학적 근거를 설명할 수 없어 결과를 신뢰하기 어려웠다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 인공지능과 시스템생물학을 융합해 암세포의 약물 반응 예측 및 메커니즘 분석을 동시에 이룰 수 있는 새로운 개념의 ‘그레이박스’ 기술을 개발했다고 3일 밝혔다.
조광현 교수 연구팀은 높은 예측 성능을 보이지만 그 근거를 알 수 없어 블랙박스로 불리는 딥러닝과 복잡한 대규모 모델의 경우 예측 성능의 한계를 지니지만 예측 결과에 대한 상세한 근거를 제시할 수 있어서 화이트박스로 불리는 시스템생물학 기술을 융합함으로써 두 기술의 한계를 동시에 극복할 수 있는 소위 ‘그레이박스’ 기술을 착안했다.
연구팀은 다양한 암종의 돌연변이 및 표적항암제 타겟 유전자 정보를 집대성해 분자 조절 네트워크 모델을 구축함으로써 여러 암종과 항암제의 약물 반응 예측에 활용될 수 있는 범용적 골격 모델을 우선 정립했다. 특히 다양한 암종에서 돌연변이가 빈번하게 발생하는 유전자들을 중심으로 전암(pan-cancer) 유전자 네트워크를 제작했고 표적항암제별 약물 반응과 관련된 돌연변이 및 연관 유전자들로 구성된 부분네트워크(sub-network)를 추출함으로써 약물 반응 예측을 위한 시스템생물학 모델을 제작했다.
연구팀은 이렇게 제작된 모델의 매개변수를 딥러닝 블랙박스 최적화기를 통해 결정하는 방식으로 트라메티닙, 아파티닙, 팔보시클립 세 개의 표적항암제 및 대장암, 유방암, 위암 세 개의 암종에 대한 그레이박스 모델을 구축했다. 완성된 모델의 약물 반응 컴퓨터시뮬레이션 결과는 각 암종별 약물반응의 민감도 차이를 보이는 세포주(cancer cell lines) 실험을 통해 비교 검증됐다.
특히 개발된 모델은 미국 국립암연구소(National Cancer Institute)의 돌연변이 정보 기반 약물 반응 예측으로는 동일한 반응을 보일 것으로 예상된 암세포주들이 실제로는 서로 다른 약물 반응을 보일 수 있다는 것을 정확히 예측했으며, 약물 반응의 차이가 발생하는 원인 또한 세포 주별 분자 네트워크 동역학의 차이로 상세히 설명할 수 있었다.
이번 연구 성과는 학습에 의한 시뮬레이션 모델 최적화를 통해 블랙박스 모델인 인공지능 기술의 높은 예측력과 화이트박스 모델인 시스템생물학 기술의 해석력을 동시에 달성한 새로운 약물 반응 예측 기술 개발이어서 그 의미가 크다. 특히, 발생 원인이 이질적이고 복잡한 네트워크 질환인 암에 대해 범용적으로 활용가능한 약물 반응 예측 원천기술이므로 향후 기술 고도화를 통해 다양한 종류의 암종 및 환자 맞춤형 치료 전략 제시에 활용될 수 있을 것으로 기대된다.
조광현 교수는 "인공지능 기술의 높은 예측력과 시스템생물학 기술의 우수한 해석력을 동시에 갖춘 새로운 융합원천기술로서 향후 고도화를 통해 신약 개발 산업의 활용이 기대된다ˮ고 말했다.
바이오및뇌공학과 김윤성 박사, 한영현 박사 등이 참여한 이번 연구 결과는 셀 프레스(Cell Press)에서 출간하는 국제저널 `셀 리포트 메소드(Cell Reports Methods)' 5월 20일 字 표지논문으로 출판됐다. (논문명: A grey box framework that optimizes a white box logical model using a black box optimizer for simulating cellular responses to perturbations)
논문링크: https://www.cell.com/cell-reports-methods/fulltext/S2667-2375(24)00117-6
한편 이번 연구는 삼성미래기술육성사업 및 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2024.06.03 조회수 7245 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9556
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9556 암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7185
암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7185 해킹 공격 막는 암호 반도체 최초 개발
사물인터넷(IoT), 자율 주행 등 5G/6G 시대 소자 또는 기기 간의 상호 정보 교환이 급증함에 따라 해킹 공격이 고도화되고 있다. 이에 따라, 기기에서 데이터를 안전하게 전송하기 위해서는 보안 기능 강화가 필수적이다.
우리 대학 전기및전자공학부 최양규 교수와 류승탁 교수 공동연구팀이 ‘해킹 막는 세계 최초 보안용 암호 반도체’를 개발하는 데 성공했다고 29일 밝혔다.
연구팀은 100% 실리콘 호환 공정으로 제작된 핀펫(FinFET) 기반 보안용 암호반도체 크립토그래픽 트랜지스터(cryptographic transistor, 이하 크립토리스터(cryptoristor))를 세계 최초로 개발했다. 이는 트랜지스터 하나로 이루어진 독창적 구조를 갖고 있을 뿐만 아니라, 동작 방식 또한 독특해 유일무이한 특성을 구비한 난수발생기다.
인공지능 등의 모든 보안 환경에서 가장 중요한 요소는 난수발생기이다. 가장 널리 사용되는 보안 칩인 ‘고급 암호화 표준(advanced encryption standard, AES)’에서 난수발생기는 핵심 요소로, AES 보안 칩 전체 면적의 약 75%, 에너지 소모의 85% 이상을 차지한다. 따라서, 모바일 혹은 사물인터넷(IoT)에 탑재가 가능한 저전력/초소형 난수발생기 개발이 시급하다.
기존의 난수발생기는 전력 소모가 매우 크고 실리콘 CMOS 공정과의 호환성이 떨어진다는 단점이 있고, 회로 기반의 난수발생기들은 점유 면적이 매우 크다는 단점이 있다.
연구팀은 기존 세계 최고 수준 연구 대비 전력 소모와 점유 면적 모두 수천 배 이상 작은 암호 반도체인 단일 소자 기반의 크립토리스터(cryptoristor)를 개발했다. 절연층이 실리콘 하부에 형성되어 있는 실리콘 온 인슐레이터(Silicon-on-Insulator, SOI) 기판 위에 제작된 핀펫(FinFET)이 가지는 내재적인 전위 불안정성을 이용해 무작위적으로 0과 1을 예측 불가능하게 내보내는 난수발생기를 개발했다.
다시 설명하면, 보통 모바일 기기 등에서 정보를 교환할 때 데이터를 암호화하는 알고리즘에는 해커가 암호화한 알고리즘을 예측할 수 없도록 하는 것이 중요하다. 이에 무작위의 0과 1이 난수이며 0과 1의 배열이 매번 다른 결과가 나오게 하여 예측 불가능성을 가지도록 함으로써 공격자가 예측하지 못하도록 차단하는 방식이다.
특히, 크립토리스터 기반 난수발생기 연구는 국제적으로도 구현한 사례가 없는 세계 최초의 연구이면서, 기존 논리 연산용 또는 메모리용 소자와 동일한 구조의 트랜지스터이기 때문에, 현재 반도체 설비를 이용한 양산 공정으로 100% 제작이 가능하며 저비용으로 빠르게 대량생산이 가능하다는 점에서 의미가 크다.
연구를 주도한 김승일 박사과정은 개발된 “암호 반도체로서 초소형/저전력 난수발생기는 특유의 예측 불가능성으로 인해 보안 기능을 강화해 칩 또는 칩 간의 통신 보안으로 안전한 초연결성을 지원할 수 있고, 특히 기존 연구 대비 에너지, 집적도, 비용 측면에서 탁월한 장점을 갖고 있어 사물인터넷(IoT) 기기 환경에 적합하다”고 연구의 의의를 설명했다.
전기및전자공학부 김승일 박사과정이 제1 저자, 유형진 석사가 공저자로 참여한 이번 연구는 국제학술지 ‘사이언스(Science)’의 자매지인 ‘사이언스 어드밴시스(Science Advances)’ 2024년 2월 온라인판에 정식 출판됐다. (논문명 : Cryptographic transistor for true random number generator with low power consumption)
한편 이번 연구는 한국연구재단 차세대지능형반도체기술개발사업, 국가반도체연구실지원핵심기술개발사업의 지원을 받아 수행됐다.
2024.02.29 조회수 8951
해킹 공격 막는 암호 반도체 최초 개발
사물인터넷(IoT), 자율 주행 등 5G/6G 시대 소자 또는 기기 간의 상호 정보 교환이 급증함에 따라 해킹 공격이 고도화되고 있다. 이에 따라, 기기에서 데이터를 안전하게 전송하기 위해서는 보안 기능 강화가 필수적이다.
우리 대학 전기및전자공학부 최양규 교수와 류승탁 교수 공동연구팀이 ‘해킹 막는 세계 최초 보안용 암호 반도체’를 개발하는 데 성공했다고 29일 밝혔다.
연구팀은 100% 실리콘 호환 공정으로 제작된 핀펫(FinFET) 기반 보안용 암호반도체 크립토그래픽 트랜지스터(cryptographic transistor, 이하 크립토리스터(cryptoristor))를 세계 최초로 개발했다. 이는 트랜지스터 하나로 이루어진 독창적 구조를 갖고 있을 뿐만 아니라, 동작 방식 또한 독특해 유일무이한 특성을 구비한 난수발생기다.
인공지능 등의 모든 보안 환경에서 가장 중요한 요소는 난수발생기이다. 가장 널리 사용되는 보안 칩인 ‘고급 암호화 표준(advanced encryption standard, AES)’에서 난수발생기는 핵심 요소로, AES 보안 칩 전체 면적의 약 75%, 에너지 소모의 85% 이상을 차지한다. 따라서, 모바일 혹은 사물인터넷(IoT)에 탑재가 가능한 저전력/초소형 난수발생기 개발이 시급하다.
기존의 난수발생기는 전력 소모가 매우 크고 실리콘 CMOS 공정과의 호환성이 떨어진다는 단점이 있고, 회로 기반의 난수발생기들은 점유 면적이 매우 크다는 단점이 있다.
연구팀은 기존 세계 최고 수준 연구 대비 전력 소모와 점유 면적 모두 수천 배 이상 작은 암호 반도체인 단일 소자 기반의 크립토리스터(cryptoristor)를 개발했다. 절연층이 실리콘 하부에 형성되어 있는 실리콘 온 인슐레이터(Silicon-on-Insulator, SOI) 기판 위에 제작된 핀펫(FinFET)이 가지는 내재적인 전위 불안정성을 이용해 무작위적으로 0과 1을 예측 불가능하게 내보내는 난수발생기를 개발했다.
다시 설명하면, 보통 모바일 기기 등에서 정보를 교환할 때 데이터를 암호화하는 알고리즘에는 해커가 암호화한 알고리즘을 예측할 수 없도록 하는 것이 중요하다. 이에 무작위의 0과 1이 난수이며 0과 1의 배열이 매번 다른 결과가 나오게 하여 예측 불가능성을 가지도록 함으로써 공격자가 예측하지 못하도록 차단하는 방식이다.
특히, 크립토리스터 기반 난수발생기 연구는 국제적으로도 구현한 사례가 없는 세계 최초의 연구이면서, 기존 논리 연산용 또는 메모리용 소자와 동일한 구조의 트랜지스터이기 때문에, 현재 반도체 설비를 이용한 양산 공정으로 100% 제작이 가능하며 저비용으로 빠르게 대량생산이 가능하다는 점에서 의미가 크다.
연구를 주도한 김승일 박사과정은 개발된 “암호 반도체로서 초소형/저전력 난수발생기는 특유의 예측 불가능성으로 인해 보안 기능을 강화해 칩 또는 칩 간의 통신 보안으로 안전한 초연결성을 지원할 수 있고, 특히 기존 연구 대비 에너지, 집적도, 비용 측면에서 탁월한 장점을 갖고 있어 사물인터넷(IoT) 기기 환경에 적합하다”고 연구의 의의를 설명했다.
전기및전자공학부 김승일 박사과정이 제1 저자, 유형진 석사가 공저자로 참여한 이번 연구는 국제학술지 ‘사이언스(Science)’의 자매지인 ‘사이언스 어드밴시스(Science Advances)’ 2024년 2월 온라인판에 정식 출판됐다. (논문명 : Cryptographic transistor for true random number generator with low power consumption)
한편 이번 연구는 한국연구재단 차세대지능형반도체기술개발사업, 국가반도체연구실지원핵심기술개발사업의 지원을 받아 수행됐다.
2024.02.29 조회수 8951 흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2024.02.21 조회수 6184
흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2024.02.21 조회수 6184 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7032
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7032 항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17 조회수 5956
항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17 조회수 5956 인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 8527
인공지능 기반 대장암 3차원 게놈 지도 최초 해독
세계 최초로 예전에 비해 최대 규모로 한국인 대장암 환자 3차원 게놈 지도를 작성하여 화제다.
우리 대학 생명과학과 정인경 교수 연구팀이 서울대학교 암연구소 김태유 교수 연구팀과의 공동연구를 통해 인공지능 기반 알고리즘을 활용, 한국인 대장암 환자의 3차원 게놈 지도를 최초로 제시했으며 이를 토대로 암 세포 특이적인 유전자 조절 기전을 통해 특정 종양유전자들이 과발현되는 현상을 규명했다고 24일 밝혔다.
1차원적 게놈 서열 분석에 기반한 현재의 암 유전체 연구는 종양유전자들의 과발현 기작을 설명하는데 한계가 있었다. 하지만 3차원 공간상에 게놈이 어떻게 배열되는지를 분석하는 3차원 게놈 (3D genome) 구조 연구는 이러한 한계를 극복 가능케 하고 있다. 본 연구에서는 정상 세포에서는 존재하지 않는 암 세포 특이적 염색질 고리(chromatin loop) 구조가 유전자 발현 촉진 인자인 인핸서와 종양유전자 사이의 상호작용을 형성하여 과발현을 유도하는 인핸서 납치(enhancer-hijacking) 현상에 초점을 두어 연구하였다.
우리 대학 생명과학과 김규광 박사과정이 주도한 이번 연구는 게놈간의 공간상 상호작용을 측정할 수 있는 대용량 염색체 구조 포착 Hi-C (High-throughput Chromosome Conformation Capture) 실험 기법을 활용하여 대장암 3차원 게놈 지도를 작성하고 대장암 특이적 3차원 게놈 변화를 환자 개개인별로 분석할 수 있는 인공지능 기반 알고리즘을 개발했다. 그 결과 공동연구팀은 광범위한 규모의 3차원 게놈 구조 변화와 이로 인한 다양한 종양유전자의 활성화를 확인했다.
연구팀은 이번 연구를 통해 암 특이적 3차원 게놈 구조의 변화로 인한 종양유전자 활성 기작을 명확히 제시하였으며 이로 인한 환자 예후와 약물 반응 등 임상적인 특성과의 연관성까지 제시해 맞춤 치료 원천기술 확보에 기여했다.
지금까지 암 세포주에 대한 3차원 게놈 구조 연구는 일부 보고 되었으나, 대규모 환자 암조직에 대한 연구는 조직 내 세포 이질성, 종양 순도, 암세포 이질성 등의 문제로 인한 정밀 암 특이적 3차원 게놈 구조 분석의 한계로 수행되지 못하였다.
반면에 이번 연구에서 연구팀은 AI 기반 알고리즘으로 환자 개인 종양 조직으로부터 얻어진 복잡한 신호를 해석할 수 있었으며 그 결과 최대 규모인 환자 40명의 종양 조직과 인접한 정상 대장 조직을 사용해 3차원 게놈 지도를 작성할 수 있었다. 또한 DNA 서열정보를 보여주는 전장유전체 지도의 경우 다양한 인종에 대해 생산되고 있고 한국인의 전장유전체 지도 또한 개발되었으나 한국인 3차원 게놈 지도, 특히 종양 조직에 대한 3차원 게놈 지도는 이번 연구에서 최초로 제시됐다.
이번 연구 결과는 국제 학술지, `셀 리포츠(Cell Reports, IF=9.995)'에 7월 13일 자로 출판됐다. (논문명: Spatial and clonality-resolved 3D cancer genome alterations reveal enhancer-hijacking as a potential prognostic marker for colorectal cancer)
서울대학교병원 혈액종양내과 김태유 교수는 “이러한 결과는 개별 암 환자들마다 서로 다르게 나타나는 종양 이질성을 이해하는 데 매우 중요한 요소가 될 수 있으며, 이를 이용한 환자 맞춤형 치료 연구의 시발점이 될 것이다”라고 말했다. 생명과학과 정인경 교수는 “기존의 점돌연변이나 유전체 변이만으로는 설명이 어려운 암 유전체를 3차원 게놈 구조 관점에서 재해독하고 신규 암 타겟을 발굴할 수 있는 수 있는 새로운 접근법을 제시했다”라고 밝혔다.
한편 이번 연구는 과학기술정보통신부와 서경배과학재단의 지원을 받아 수행됐다.
2023.07.24 조회수 8527 면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 8286
면역항암치료 부작용 인공지능으로 예측
면역항암치료는 환자의 면역 시스템을 활성화해 암을 치료하는 혁신적인 3세대 항암 치료 방법으로 알려져 있다. 하지만 면역항암 치료제는 면역활성화에 의해 기존 항암제와는 구분되는 자가면역질환과 유사한 부작용을 유발할 수 있다는 새로운 문제가 제기됐다. 이러한 부작용은 심각한 경우 환자를 죽음에까지 이르게 할 수 있기에 부작용에 대한 연구가 절실한 상황에 놓여있다.
우리 대학 바이오및뇌공학과 최정균 교수팀과 서울아산병원 종양내과 박숙련 교수팀은 면역항암제 치료를 받은 고형암 환자에 대한 대규모 전향적 코호트를 구축하고, 다차원적 분석을 통해 면역항암제 부작용의 위험요인을 규명했다고 22일 밝혔다. 또한 인공지능 딥러닝을 이용해 치료 전 환자에게서 부작용이 나타날지를 예측할 수 있는 모델까지도 개발했다고 알렸다.
기존의 관련 연구들은 소규모로 진행이 되거나, 적은 수의 지표로 국한된 범위에 대해서만 행해졌다. 또한 수행된 연구들은 면역 관련 부작용을 위해 디자인된 연구 설계가 아닌, 다른 목적을 위해 모집된 환자군을 모아 수행하는 후향적 연구 설계로 진행됐다는 한계점이 있었다.
연구팀은 이러한 한계점을 극복하기 위해, 서울아산병원을 필두로 국내 9개 기관과 협력하여 면역 관련 부작용의 포괄적인 위험요인을 밝히기 위한 대규모 전향적 코호트를 구축했다. 또한 환자의 유전체, 전사체, 혈액 지표 등 폭넓은 범위에서 면역 관련 부작용에 대한 위험요인을 밝혀냄으로써, 궁극적으로는 치료 전 미리 환자가 면역항암치료에 대한 부작용을 보일지 알아낼 수 있는 딥러닝 예측 모델을 개발했다. 해당 연구 결과는 다양한 고형암 환자의 임상데이터와 혈액 유전체 데이터에 기반했기에, 향후 환자의 암종과 상관없이 폭넓게 적용될 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 성창환 박사(現 : 서울아산병원 핵의학과)와 안진현 박사과정이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이처 캔서(Nature Cancer)’ 에 게재됐다. (논문명 : Integrative analysis of risk factors for immune-related adverse events of checkpoint blockade therapy in cancer).
이번 연구에는 고려대학교 안암병원, 인제대학교 해운대백병원, 국립암센터, 서울삼성병원, 분당서울대학교병원, 고려대학교 구로병원, 연세대학교 세브란스병원, 서울대학교병원의 연구자들도 참여했다.
최정균 교수는 “이번 연구를 통해 면역항암 치료의 아킬레스건이라고 할 수 있는 면역관련 부작용에 대한 폭넓은 분석과 예측모델의 제시를 통해 향후 전세계 연구진이 사용할 수 있는 대규모 면역관련 부작용 리소스를 제공할 수 있을 것이라 기대한다”라고 말했다.
임상연구를 총괄한 서울아산병원 박숙련 교수는 “현재 면역항암제가 임상에서 광범위하게 사용되고 있고 그 치료 영역을 완치적 세팅으로까지 확장하고 있어 치료 효과뿐 아니라 환자 안전성이 더욱 중요한데 그동안 치료 부작용을 예측할 수 있는 좋은 지표가 없던 상황에서, 이번 연구 결과는 개별 환자의 임상데이터와 유전체 데이터에 기반해 면역항암제의 부작용 발생을 예측할 수 있어 암 환자의 정밀 의료 치료를 실현할 수 있는 기반이 될 것으로 기대한다”고 전했다.
이번 연구는 과학기술정보통신부 인공지능 신약개발 플랫폼 구축 사업의 지원을 받아 수행됐다.
2023.06.22 조회수 8286 암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10383
암세포를 정상세포로 되돌리는 치료원리 최초 규명
지난 수십 년간 많은 의생명과학자들의 집중적인 암 연구에도 불구하고 여전히 국내 사망원인 1위는 암이다. 현재의 암 치료가 한계를 갖는 본질적인 이유는 모든 치료방식이 암세포의 사멸만을 목표로 하여서 결국 암세포의 내성 획득으로 인한 암의 재발 및 정상세포 사멸로 인한 부작용을 피할 수 없기 때문이다. 이에 암세포를 특정한 상황에서 정상세포 또는 정상과 유사한 세포로 되돌릴 수 있는 암가역화(cancer reversion) 현상에 기반한 새로운 항암 치료기술이 제시되었으나, 아직 실제적인 개발은 거의 시도되지 못했다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 암세포를 죽이지 않고 성질만을 변환시켜 정상세포로 되돌릴 수 있는 암 가역화의 근본적인 원리를 규명하는 데 성공했다고 8일 밝혔다.
조광현 교수 연구팀은 정상세포가 외부자극에 부합하는 세포반응을 일으키는 것과 달리 암세포는 외부자극을 무시한 채 통제불능의 세포분열 반응만을 일으킨다는 것에 주목하였다. 컴퓨터 시뮬레이션 분석을 통해 특정 조건에서 유전자 돌연변이에 의해 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복(가역화)될 수 있음을 발견했으며, 분자세포실험을 통해 이와 같은 입출력 관계의 회복이 실제 암세포에서 나타난다는 것을 입증했다.
우리 대학 주재일 박사, 박화정 박사가 참여한 이번 연구결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 6월 2일 字 온라인판 논문으로 출판됐다. (논문명: Normalizing input-output relationships of cancer networks for reversion therapy)
조광현 교수 연구팀은 암세포의 왜곡된 입출력 관계가 정상세포의 정상적인 입출력 관계로 회복될 수 있는 이유는 생명체의 오랜 진화과정에서 획득된 세포내 유전자 조절 네트워크의 견실성(robustness)과 중복성(redundancy)에 기인한다는 것을 규명했다. 또한 암 가역화를 위한 조절 타겟으로 유력한 유전자들이 존재한다는 것을 발견했고 이 유전자들을 조절하면 실제로 암세포의 왜곡된 입출력 관계가 정상적인 입출력 관계로 회복된다는 것을 암세포 분자세포실험을 통해 증명했다.
이번 연구성과는 실제 암세포가 정상세포로 가역화 될 수 있는 현상이 우연한 것이 아니며, 암세포 가역화를 유도할 수 있는 타겟을 체계적으로 탐색하고 이를 조절하는 약물을 개발함으로써 혁신 항암제의 개발이 가능함을 보여준 것이어서 그 의미가 크다.
조광현 교수는 "현행 항암치료의 한계를 극복할 수 있는 새로운 암 가역치료 전략에 대한 근본적인 원리를 밝히는 데 성공함으로써 암 환자의 예후와 삶의 질을 모두 증진시킬 수 있는 혁신 신약 개발의 가능성을 높이게 되었다ˮ라고 말했다.
조광현 교수 연구팀은 암세포를 정상세포로 되돌리는 가역치료 개념을 최초로 제시한 뒤 2020년 1월에 대장암세포를 정상 대장세포로 되돌리는 연구결과를 발표했고, 2022년 1월에는 가장 악성인 유방암세포를 호르몬 치료가 가능한 유방암세포로 리프로그래밍하는 연구에 성공한 바 있다. 그리고 2023년 1월에는 전이 능력을 획득한 폐암 세포를 전이 능력이 제거되고 약물 반응성이 증진된 세포 상태로 되돌리는 가역화 연구에 성공한 바 있다. 하지만 이와 같은 성과들은 서로 다른 암종에서 개별적으로 연구되어진 사례연구였기 때문에, 어떠한 공통된 원리로 암가역화가 여러 암종에서 발생가능한지는 밝히지 못했다. 이번 연구 결과는 이러한 암가역화의 보편적인 원리와 진화적 기원을 밝힌 최초의 연구다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 등의 지원으로 수행됐다.
2023.06.08 조회수 10383