-
 양자점 기반 단파장 초고속 양자 광원 개발
- 나노 오벨리스크 구조 위에 양자점을 형성해 고효율 단광자 광원 개발 -- 단파장 가시광선 대역에서 작동하는 초고속 반도체 양자 광원 연구 -
우리 학교 물리학과 조용훈 교수팀은 오벨리스크 모양의 나노 구조물을 만들고 꼭대기 부분에 높은 신뢰도를 갖는 반도체 단일 양자점을 형성해 초고속 고효율 단광자 방출을 구현하는데 성공했다.
연구결과는 네이처(Nature)가 발행하는 "사이언티픽 리포트(Scientific Reports)" 7월 5일자 온라인판에 게재됐다.
반도체 양자점은 전자를 수 나노미터 크기에 3차원적으로 구속해 불연속적인 에너지 준위를 갖는 원자와 유사한 특성을 나타낸다. 이 성질을 이용하면 차세대 양자정보 통신, 양자 암호의 핵심 구성 요소인 양자광원을 개발할 수 있다.
특히, 반도체 양자점의 경우 높은 구동 온도, 안정성, 빠른 광자 방출, 전류 구동 가능성과 같은 많은 장점을 가지고 있어 차세대 핵심 기술 중 하나로 꼽히고 있다.
그러나 기존의 자발 형성 양자점의 경우, 평면 구조 안에 양자점들이 높은 밀도로 묻혀 있어 단일 양자점 하나의 특성을 파악하기 어렵고 광자 방출 효율이 매우 제한돼 있는 한계가 있다. 또 구성하는 층 사이의 응력으로 인한 내부 전기장 효과 때문에 전자와 정공 사이의 재결합이 어려워 내부 양자 효율이 낮은 문제가 있었다.조 교수 연구팀은 단파장의 빛을 내는 넓은 띠구조를 갖는 질화물 반도체를 이용해 오벨리스크 형태(뾰족한 팁 모양)의 나노 구조를 제작했다. 그 위에 얇은 활성층 구조를 다시 성장해 나노 팁 끝에 단일 양자점을 위치시키는데 성공해 스펙트럼 폭이 매우 작은 에너지 준위에서 발생하는 초고속 단광자 특성을 확인했다.
이 같은 독특한 나노 구조를 활용하면, 패터닝 등의 공정 없이도 단일 양자구조를 얻기가 쉽고, 양자점에서 생성된 빛이 외부로 쉽게 빠져나올 수 있다는 장점이 있다.
이와 함께 연구팀은 박막 형태와는 달리 오벨리스크 형태의 나노구조의 경우 응력을 크게 감소시켜 내부 전기장 효과도 상쇄돼 내부 양자 효율이 크게 증가하는 현상을 밝혔다.
이번에 개발된 양자광원은 발광파장이 기존 장파장 적외선 대역이 아닌 단파장 가시광(400nm) 대역이기 때문에 자유 공간에서의 통신에 사용이 가능하고 광자 검출 효율이 높은 가시광 대역의 검출기를 사용할 수 있다.
조용훈 교수는 “기존의 양자점 성장 방식과는 달리 비교적 쉽게 단일 양자점을 형성하여 제어할 수 있고, 이를 통해 매우 빠른 단일 광자 생성이 가능해 실용적인 양자광원 개발에 기여할 수 있을 것으로 기대된다”며 “오벨리스크 형태 나노구조의 특성 상 손쉽게 분리 및 다른 기판과의 결합이 가능해 단일 칩 양자 광소자 제작에도 활용될 수 있다”고 말했다.
KAIST 물리학과 조용훈 교수 지도아래 김제형(제1저자), 고영호(제2저자) 박사과정 학생이 주도적으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업 및 WCU 사업의 지원으로 수행됐다.
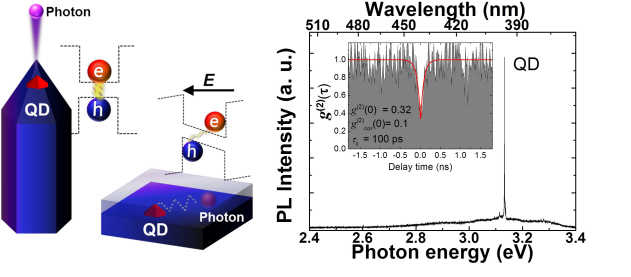
그림1. (왼쪽) 프랑스 파리에 위치한 오벨리스크 사진. (오른쪽) 제작된 오벨리스크형 나노 구조의 전자현미경 이미지.
그림2. (왼쪽) 오벨리스크형 나노구조와 기존 평면 박막 구조에 내재된 양자점을 비교한 개념도. (오른쪽) 오벨리스크 나노구조 끝에 형성된 단일 양자점에서 방출되는 좁은 선폭의 스펙트럼과 광원의 양자화 정도와 빠른 단광자 방출 속도를 나타내는 2차 광자 상관 관계 그래프.
양자점 기반 단파장 초고속 양자 광원 개발
- 나노 오벨리스크 구조 위에 양자점을 형성해 고효율 단광자 광원 개발 -- 단파장 가시광선 대역에서 작동하는 초고속 반도체 양자 광원 연구 -
우리 학교 물리학과 조용훈 교수팀은 오벨리스크 모양의 나노 구조물을 만들고 꼭대기 부분에 높은 신뢰도를 갖는 반도체 단일 양자점을 형성해 초고속 고효율 단광자 방출을 구현하는데 성공했다.
연구결과는 네이처(Nature)가 발행하는 "사이언티픽 리포트(Scientific Reports)" 7월 5일자 온라인판에 게재됐다.
반도체 양자점은 전자를 수 나노미터 크기에 3차원적으로 구속해 불연속적인 에너지 준위를 갖는 원자와 유사한 특성을 나타낸다. 이 성질을 이용하면 차세대 양자정보 통신, 양자 암호의 핵심 구성 요소인 양자광원을 개발할 수 있다.
특히, 반도체 양자점의 경우 높은 구동 온도, 안정성, 빠른 광자 방출, 전류 구동 가능성과 같은 많은 장점을 가지고 있어 차세대 핵심 기술 중 하나로 꼽히고 있다.
그러나 기존의 자발 형성 양자점의 경우, 평면 구조 안에 양자점들이 높은 밀도로 묻혀 있어 단일 양자점 하나의 특성을 파악하기 어렵고 광자 방출 효율이 매우 제한돼 있는 한계가 있다. 또 구성하는 층 사이의 응력으로 인한 내부 전기장 효과 때문에 전자와 정공 사이의 재결합이 어려워 내부 양자 효율이 낮은 문제가 있었다.조 교수 연구팀은 단파장의 빛을 내는 넓은 띠구조를 갖는 질화물 반도체를 이용해 오벨리스크 형태(뾰족한 팁 모양)의 나노 구조를 제작했다. 그 위에 얇은 활성층 구조를 다시 성장해 나노 팁 끝에 단일 양자점을 위치시키는데 성공해 스펙트럼 폭이 매우 작은 에너지 준위에서 발생하는 초고속 단광자 특성을 확인했다.
이 같은 독특한 나노 구조를 활용하면, 패터닝 등의 공정 없이도 단일 양자구조를 얻기가 쉽고, 양자점에서 생성된 빛이 외부로 쉽게 빠져나올 수 있다는 장점이 있다.
이와 함께 연구팀은 박막 형태와는 달리 오벨리스크 형태의 나노구조의 경우 응력을 크게 감소시켜 내부 전기장 효과도 상쇄돼 내부 양자 효율이 크게 증가하는 현상을 밝혔다.
이번에 개발된 양자광원은 발광파장이 기존 장파장 적외선 대역이 아닌 단파장 가시광(400nm) 대역이기 때문에 자유 공간에서의 통신에 사용이 가능하고 광자 검출 효율이 높은 가시광 대역의 검출기를 사용할 수 있다.
조용훈 교수는 “기존의 양자점 성장 방식과는 달리 비교적 쉽게 단일 양자점을 형성하여 제어할 수 있고, 이를 통해 매우 빠른 단일 광자 생성이 가능해 실용적인 양자광원 개발에 기여할 수 있을 것으로 기대된다”며 “오벨리스크 형태 나노구조의 특성 상 손쉽게 분리 및 다른 기판과의 결합이 가능해 단일 칩 양자 광소자 제작에도 활용될 수 있다”고 말했다.
KAIST 물리학과 조용훈 교수 지도아래 김제형(제1저자), 고영호(제2저자) 박사과정 학생이 주도적으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업 및 WCU 사업의 지원으로 수행됐다.
그림1. (왼쪽) 프랑스 파리에 위치한 오벨리스크 사진. (오른쪽) 제작된 오벨리스크형 나노 구조의 전자현미경 이미지.
그림2. (왼쪽) 오벨리스크형 나노구조와 기존 평면 박막 구조에 내재된 양자점을 비교한 개념도. (오른쪽) 오벨리스크 나노구조 끝에 형성된 단일 양자점에서 방출되는 좁은 선폭의 스펙트럼과 광원의 양자화 정도와 빠른 단광자 방출 속도를 나타내는 2차 광자 상관 관계 그래프.
2013.07.22
조회수 19974
-
 손상된 DNA의 돌연변이 유발 메커니즘 규명
- DNA 손상을 용인하는 특수 복제효소 Rev1의 조절 메커니즘 밝혀 -- “암 치료 및 예방에 크게 기여할 것” -
우리 학교 화학과 최병석 교수는 생체정보를 저장하는 DNA가 손상돼 회복하고 복제하는 과정에서 돌연변이가 발생하는 메커니즘을 규명했다.
연구결과는 분자세포생물학분야 세계적 학술지 ‘분자세포생물학(Journal of Molecular Cell Biology)’ 6월호 표지논문으로 실렸다.
산업의 급격한 발전으로 현대인들의 유전자는 예전에 비해 훨씬 다양하게 위협받고 있다. 오존층의 파괴로 인해 자외선에 그대로 노출되는 것은 물론 담배연기를 비롯한 수많은 발암물질의 공격은 우리 몸속의 DNA를 손상시킨다.
하루에도 수 만 번 끊임없이 일어나는 DNA의 손상을 효과적으로 회복시켜주지 못하면 암 등 치명적인 질병이 발생한다.
손상된 DNA가 회복반응에 의해 복구되지 않은 상태에서 자기복제가 일어나면 정상적인 복제를 담당하는 폴리머라제는 손상부위에 도달하면 DNA 합성을 정지하게 되고 세포의 죽음을 초래 한다.
인체는 이 같은 비상사태를 맞이해 복제담당 폴리머라제를 잠깐 쉬게 하고 손상된 DNA 부위를 그냥 지나치는 능력이 있는 특수한 복구담당 폴리머라제들을 동원해 손상부위를 통과하고 DNA 합성을 다시 시작한다.
이때 DNA는 많은 오류가 발생돼 심각한 돌연변이를 유발시킨다. 즉, 열악한 상황에 놓인 세포가 복제를 진행하지 못해 죽음을 맞기 보다는 생존을 위해 매우 부정확한 DNA 복제일지라도 선수를 교체하면서까지 복제를 진행하게 된다.
지금까지 학계에서는 Rev1 단백질이 이러한 과정을 조절할 것이라고 추정해 왔지만 그 구조와 기능은 명확하게 밝혀내지 못했다.
연구팀은 핵자기공명 분광법(NMR)과 X-ray를 이용해 DNA 복제과정에서 중추적인 역할을 하는 단백질(Polκ과 Rev1, Rev1과 Rev3/Rev7) 각각의 복합구조를 밝혀냈다.
이를 통해 ▲DNA가 손상 시 돌연변이가 유발되는 메커니즘 ▲DNA 복제효소간의 상호작용 ▲손상부위를 통과한 합성된 DNA가 더 연장되는 메커니즘을 분자수준에서 규명했다.
암의 직접적인 발병 원인이 DNA의 손상인 만큼 이에 대한 메커니즘을 밝혀내고 응용하면 개인별로 암의 원인을 제거할 수 있어 부작용 없는 맞춤형 항암제를 개발할 수 있을 것으로 전망된다.
최병석 교수는 이번 연구에 대해 “판코니 빈혈 환자들에게 암이 많이 발생되는 문제를 조사해보니 DNA복제 시 회복 기능이 고장 나 있더라”며 “손상된 DNA의 회복과 복제 과정에 대한 메커니즘 규명을 통해 암을 예방하고 치료하는데 크게 기여할 것”이라고 말했다.
이번 연구는 KAIST 화학과 최병석 교수와 류디난 박사의 주도로 수행됐고, KAIST 화학과 이지오 교수, 고준상 박사, 임경은 박사과정, 기초과학지원연구원 류경석 박사와 황정미 박사가 참여했다.
그림1. Polκ/Rev1/Rev7/Rev3 단백질 복합체 구조
그림2. Rev1, Polκ와 Rev7와 Rev3를 상호형질 주입된 세포의 공초점 현미경 영상
그림3. 논문표지
손상된 DNA의 돌연변이 유발 메커니즘 규명
- DNA 손상을 용인하는 특수 복제효소 Rev1의 조절 메커니즘 밝혀 -- “암 치료 및 예방에 크게 기여할 것” -
우리 학교 화학과 최병석 교수는 생체정보를 저장하는 DNA가 손상돼 회복하고 복제하는 과정에서 돌연변이가 발생하는 메커니즘을 규명했다.
연구결과는 분자세포생물학분야 세계적 학술지 ‘분자세포생물학(Journal of Molecular Cell Biology)’ 6월호 표지논문으로 실렸다.
산업의 급격한 발전으로 현대인들의 유전자는 예전에 비해 훨씬 다양하게 위협받고 있다. 오존층의 파괴로 인해 자외선에 그대로 노출되는 것은 물론 담배연기를 비롯한 수많은 발암물질의 공격은 우리 몸속의 DNA를 손상시킨다.
하루에도 수 만 번 끊임없이 일어나는 DNA의 손상을 효과적으로 회복시켜주지 못하면 암 등 치명적인 질병이 발생한다.
손상된 DNA가 회복반응에 의해 복구되지 않은 상태에서 자기복제가 일어나면 정상적인 복제를 담당하는 폴리머라제는 손상부위에 도달하면 DNA 합성을 정지하게 되고 세포의 죽음을 초래 한다.
인체는 이 같은 비상사태를 맞이해 복제담당 폴리머라제를 잠깐 쉬게 하고 손상된 DNA 부위를 그냥 지나치는 능력이 있는 특수한 복구담당 폴리머라제들을 동원해 손상부위를 통과하고 DNA 합성을 다시 시작한다.
이때 DNA는 많은 오류가 발생돼 심각한 돌연변이를 유발시킨다. 즉, 열악한 상황에 놓인 세포가 복제를 진행하지 못해 죽음을 맞기 보다는 생존을 위해 매우 부정확한 DNA 복제일지라도 선수를 교체하면서까지 복제를 진행하게 된다.
지금까지 학계에서는 Rev1 단백질이 이러한 과정을 조절할 것이라고 추정해 왔지만 그 구조와 기능은 명확하게 밝혀내지 못했다.
연구팀은 핵자기공명 분광법(NMR)과 X-ray를 이용해 DNA 복제과정에서 중추적인 역할을 하는 단백질(Polκ과 Rev1, Rev1과 Rev3/Rev7) 각각의 복합구조를 밝혀냈다.
이를 통해 ▲DNA가 손상 시 돌연변이가 유발되는 메커니즘 ▲DNA 복제효소간의 상호작용 ▲손상부위를 통과한 합성된 DNA가 더 연장되는 메커니즘을 분자수준에서 규명했다.
암의 직접적인 발병 원인이 DNA의 손상인 만큼 이에 대한 메커니즘을 밝혀내고 응용하면 개인별로 암의 원인을 제거할 수 있어 부작용 없는 맞춤형 항암제를 개발할 수 있을 것으로 전망된다.
최병석 교수는 이번 연구에 대해 “판코니 빈혈 환자들에게 암이 많이 발생되는 문제를 조사해보니 DNA복제 시 회복 기능이 고장 나 있더라”며 “손상된 DNA의 회복과 복제 과정에 대한 메커니즘 규명을 통해 암을 예방하고 치료하는데 크게 기여할 것”이라고 말했다.
이번 연구는 KAIST 화학과 최병석 교수와 류디난 박사의 주도로 수행됐고, KAIST 화학과 이지오 교수, 고준상 박사, 임경은 박사과정, 기초과학지원연구원 류경석 박사와 황정미 박사가 참여했다.
그림1. Polκ/Rev1/Rev7/Rev3 단백질 복합체 구조
그림2. Rev1, Polκ와 Rev7와 Rev3를 상호형질 주입된 세포의 공초점 현미경 영상
그림3. 논문표지
2013.06.03
조회수 20140
-
 호흡 분석해 질병 진단한다!
- 나노섬유 형상 120ppb급 당뇨병 진단센서 개발 -- 음주 측정하듯 후~ 불면 질병 진단할 수 있어 -
우리 학교 신소재공학과 김일두 교수 연구팀이 인간이 호흡하면서 배출하는 아세톤 가스를 분석해 당뇨병 여부를 파악할 수 있는 날숨진단센서를 개발했다.
연구 결과는 신소재 응용분야 세계적 학술지 ‘어드밴스드 펑셔널 머티리얼스(Advanced Functional Materials)’ 5월 20일자 표지논문으로 게재됐다.
인간이 숨을 쉬면서 내뿜는 아세톤, 톨루엔, 일산화질소 및 암모니아와 같은 휘발성 유기화합물 가스는 각각 당뇨병, 폐암, 천식 및 신장병의 생체표식인자(바이오마커)로 알려져 있다.
당뇨병의 경우 일반적으로 정상인은 900ppb(parts per billion), 당뇨환자는 1800ppb의 아세톤 가스를 날숨으로 내뿜는다. 따라서 날숨 속 아세톤 가스의 농도 차이를 정밀하게 분석하면 당뇨병을 조기에 진단할 수 있고 발병 후 관리를 쉽게 할 수 있다.
연구팀은 얇은 껍질이 겹겹이 둘러싸인 다공성 산화주석(SnO2) 센서소재에 백금 나노입자 촉매가 균일하게 도포된 1차원 나노섬유를 대량 제조하는 기술을 개발했다. 이 소재의 표면에 아세톤 가스가 흡착될 때 전기저항 값이 변화하는 120ppb급 아세톤 농도 검출용 센서에 적용해 날숨진단센서를 개발했다. 개발한 나노섬유 센서는 1000ppb급 아세톤 농도에서 소재의 저항 값이 최대 6배 증가해 당뇨병을 진단할 수 있음이 입증됐다.
이와 함께 7.6초의 매우 빠른 아세톤 센서 반응속도를 나타내 실시간 모니터링이 가능해져 상용화에 대한 기대를 높였으며, 전기방사 기술로 제조해 나노섬유형상을 쉽게 빠르게 대량생산할 수 있는 게 큰 장점이다.
연구팀이 개발한 날숨진단센서는 사람의 호흡가스 속에 포함된 다양한 휘발성 유기화합물의 농도를 정밀하게 분석할 수 있다. 따라서 당뇨병은 물론 향후 폐암, 신장병 등의 질병을 조기에 진단하는데 활용될 수 있을 것으로 기대된다.
김일두 교수는 이번 연구에 대해 “ppb급 농도의 날숨 휘발성 유기화합물 가스를 실시간으로 정밀하게 진단하는 나노섬유 센서를 당뇨병 또는 폐암 진단용 감지소재로 이용하면 다양한 질병을 조기에 검출하고 관리하는 일이 가능해질 것”이라고 말했다.
김 교수는 향후 다양한 촉매와 금속산화물 나노섬유의 조합을 통해 많은 종류의 날숨가스를 동시에 정확하게 진단하는 센서 어레이(array)를 개발해 상용화를 앞당길 계획이다.
미래창조과학부 글로벌프린티어사업 스마트 IT 융합시스템 연구단의 지원을 받은 이번 연구는 KAIST 신소재공학과 신정우 학부생(2월 졸업), 최선진 박사과정 학생, 박종욱 교수, 고려대학교 신소재공학과 이종흔 교수가 참여했다.
그림1. 날숨진단센서 어레이(우측)와 날숨진단센서 크기 비교(좌측 상단)
그림2. 나노섬유 센서들이 어레이로 구성된 당뇨진단 센서 이미지
그림3. 날숨 가스들을 분석하는 질병진단 분석기의 소형화 및 실시간 분석
그림4. 주석산화물 나노섬유를 이용한 당뇨진단 센서 이미지
호흡 분석해 질병 진단한다!
- 나노섬유 형상 120ppb급 당뇨병 진단센서 개발 -- 음주 측정하듯 후~ 불면 질병 진단할 수 있어 -
우리 학교 신소재공학과 김일두 교수 연구팀이 인간이 호흡하면서 배출하는 아세톤 가스를 분석해 당뇨병 여부를 파악할 수 있는 날숨진단센서를 개발했다.
연구 결과는 신소재 응용분야 세계적 학술지 ‘어드밴스드 펑셔널 머티리얼스(Advanced Functional Materials)’ 5월 20일자 표지논문으로 게재됐다.
인간이 숨을 쉬면서 내뿜는 아세톤, 톨루엔, 일산화질소 및 암모니아와 같은 휘발성 유기화합물 가스는 각각 당뇨병, 폐암, 천식 및 신장병의 생체표식인자(바이오마커)로 알려져 있다.
당뇨병의 경우 일반적으로 정상인은 900ppb(parts per billion), 당뇨환자는 1800ppb의 아세톤 가스를 날숨으로 내뿜는다. 따라서 날숨 속 아세톤 가스의 농도 차이를 정밀하게 분석하면 당뇨병을 조기에 진단할 수 있고 발병 후 관리를 쉽게 할 수 있다.
연구팀은 얇은 껍질이 겹겹이 둘러싸인 다공성 산화주석(SnO2) 센서소재에 백금 나노입자 촉매가 균일하게 도포된 1차원 나노섬유를 대량 제조하는 기술을 개발했다. 이 소재의 표면에 아세톤 가스가 흡착될 때 전기저항 값이 변화하는 120ppb급 아세톤 농도 검출용 센서에 적용해 날숨진단센서를 개발했다. 개발한 나노섬유 센서는 1000ppb급 아세톤 농도에서 소재의 저항 값이 최대 6배 증가해 당뇨병을 진단할 수 있음이 입증됐다.
이와 함께 7.6초의 매우 빠른 아세톤 센서 반응속도를 나타내 실시간 모니터링이 가능해져 상용화에 대한 기대를 높였으며, 전기방사 기술로 제조해 나노섬유형상을 쉽게 빠르게 대량생산할 수 있는 게 큰 장점이다.
연구팀이 개발한 날숨진단센서는 사람의 호흡가스 속에 포함된 다양한 휘발성 유기화합물의 농도를 정밀하게 분석할 수 있다. 따라서 당뇨병은 물론 향후 폐암, 신장병 등의 질병을 조기에 진단하는데 활용될 수 있을 것으로 기대된다.
김일두 교수는 이번 연구에 대해 “ppb급 농도의 날숨 휘발성 유기화합물 가스를 실시간으로 정밀하게 진단하는 나노섬유 센서를 당뇨병 또는 폐암 진단용 감지소재로 이용하면 다양한 질병을 조기에 검출하고 관리하는 일이 가능해질 것”이라고 말했다.
김 교수는 향후 다양한 촉매와 금속산화물 나노섬유의 조합을 통해 많은 종류의 날숨가스를 동시에 정확하게 진단하는 센서 어레이(array)를 개발해 상용화를 앞당길 계획이다.
미래창조과학부 글로벌프린티어사업 스마트 IT 융합시스템 연구단의 지원을 받은 이번 연구는 KAIST 신소재공학과 신정우 학부생(2월 졸업), 최선진 박사과정 학생, 박종욱 교수, 고려대학교 신소재공학과 이종흔 교수가 참여했다.
그림1. 날숨진단센서 어레이(우측)와 날숨진단센서 크기 비교(좌측 상단)
그림2. 나노섬유 센서들이 어레이로 구성된 당뇨진단 센서 이미지
그림3. 날숨 가스들을 분석하는 질병진단 분석기의 소형화 및 실시간 분석
그림4. 주석산화물 나노섬유를 이용한 당뇨진단 센서 이미지
2013.05.30
조회수 25227
-
 깨지지 않는 스마트폰 화면 나온다!
- 유리섬유직물 적용한 고강도 플라스틱 디스플레이 기판 개발 -
- “기존 유리 기판 대체 가능해 일대 혁신 가져올 것” -
깨지지 않는 핸드폰 화면을 구현하고, 대화면 TV의 무거운 유리 기판 대신 가벼운 플라스틱 필름을 사용할 수 있는 길이 열렸다.
KAIST IT융합연구소 윤춘섭 교수(물리학과) 연구팀이 깨지기 쉬운 디스플레이 유리 기판을 대체할 수 있는 고강도 플라스틱 기판 원천기술을 개발했다.
윤 교수팀이 유리섬유직물을 무색투명 폴리이미드 필름에 함침시켜 만든 플라스틱 기판은 고내열, 고투명, 고유연, 고내화학, 고인장강도 특성을 갖고 있다. 소재는 플라스틱 필름의 장점인 유연성을 갖고 있으면서도 인장강도는 일반 유리보다 세 배 크고 강화유리와 비슷하다. 또 유리처럼 무색투명하고, 450℃까지 내열성을 가지며, 열팽창률은 기존 플라스틱 열팽창률의 10∼20%에 불과하다.
유리 기판은 표면이 매끄러울 뿐만 아니라 디스플레이 기판의 조건인 고내열, 고투명, 고내화학, 고인장강도 특성을 모두 가지고 있어 지금까지 핸드폰 화면, TV, 컴퓨터 모니터 등 거의 모든 디스플레이에 사용돼 왔다. 그러나 유리 기판은 무겁고 깨지기 쉬운 단점이 있어 최근 유리 기판을 대체할 목적으로 열적, 화학적 안정성이 우수한 플라스틱 재질의 무색투명 폴리이미드 필름이 활발하게 연구되고 있다.
그러나 무색투명 폴리이미드 필름은 내열성 및 기계적 강도가 충분하지 못하기 때문에 이를 보강하기 위해 유리섬유직물을 폴리이미드 필름에 함침시키면 필름의 표면 거칠기 및 광 투과도 조건이 악화되는 문제가 발생해 실용화되지 못하고 있다. 이는 유리섬유직물을 폴리이미드 전구체 용액에 함침시킬 때 용매가 증발하며 0.4µm(마이크로미터) 내외의 표면 거칠기가 발생하고, 무색투명 폴리이미드 필름과 유리섬유직물의 굴절률 불일치로 인한 광 산란이 심하게 발생하기 때문이다.
윤 교수팀은 투명 폴리이미드 필름의 굴절률을 유리섬유직물의 굴절률과 소수 네 자리까지 일치시키는 방법과, 필름의 표면 거칠기를 수 nm 수준으로 평탄화 시키는 핵심기술을 개발해 이 문제를 해결했다. 그 결과 110µm 두께의 유리섬유직물 함침 무색투명 폴리이미드 필름 기판에서 11ppm/℃의 열팽창률, 0.9nm의 표면 거칠기, 250MPa의 인장강도, 2mm의 굽힘곡률반경, 90%의 광 투과도를 달성했다.
윤춘섭 교수는 “개발된 기판은 기존 디스플레이의 유리 기판을 대체할 수 있고, 플렉서블 디스플레이 기판으로도 사용할 수 있다”며 “핸드폰 화면이 깨지는 문제점을 근본적으로 해결하고, 대면적 TV의 무게 및 두께를 획기적으로 줄일 수 있으며, 디스플레이 생산에 롤투롤 공정을 적용할 수 있어 디스플레이 산업에 일대 혁신을 가져올 수 있을 것”이라고 전망했다.
한편, 2008년부터 5년간 지식경제부의 ‘모바일 플렉시블 입출력 플랫폼 개발사업’의 지원으로 개발된 이 기술은 총 3건의 특허출원을 마치고 관련기업과 기술 이전을 협의 중이다.
그림1. 유리섬유직물의 굴절률이 무색투명 폴리이미드 필름의 굴절률과 일치된 경우의 필름 투명도(좌측)와 일치되지 않는 경우(우측). 좌측의 글자는 선명하게 보이는 반면 우측의 글자는 뿌옇게 보인다.
그림2. 개발한 유리직물섬유 사진
깨지지 않는 스마트폰 화면 나온다!
- 유리섬유직물 적용한 고강도 플라스틱 디스플레이 기판 개발 -
- “기존 유리 기판 대체 가능해 일대 혁신 가져올 것” -
깨지지 않는 핸드폰 화면을 구현하고, 대화면 TV의 무거운 유리 기판 대신 가벼운 플라스틱 필름을 사용할 수 있는 길이 열렸다.
KAIST IT융합연구소 윤춘섭 교수(물리학과) 연구팀이 깨지기 쉬운 디스플레이 유리 기판을 대체할 수 있는 고강도 플라스틱 기판 원천기술을 개발했다.
윤 교수팀이 유리섬유직물을 무색투명 폴리이미드 필름에 함침시켜 만든 플라스틱 기판은 고내열, 고투명, 고유연, 고내화학, 고인장강도 특성을 갖고 있다. 소재는 플라스틱 필름의 장점인 유연성을 갖고 있으면서도 인장강도는 일반 유리보다 세 배 크고 강화유리와 비슷하다. 또 유리처럼 무색투명하고, 450℃까지 내열성을 가지며, 열팽창률은 기존 플라스틱 열팽창률의 10∼20%에 불과하다.
유리 기판은 표면이 매끄러울 뿐만 아니라 디스플레이 기판의 조건인 고내열, 고투명, 고내화학, 고인장강도 특성을 모두 가지고 있어 지금까지 핸드폰 화면, TV, 컴퓨터 모니터 등 거의 모든 디스플레이에 사용돼 왔다. 그러나 유리 기판은 무겁고 깨지기 쉬운 단점이 있어 최근 유리 기판을 대체할 목적으로 열적, 화학적 안정성이 우수한 플라스틱 재질의 무색투명 폴리이미드 필름이 활발하게 연구되고 있다.
그러나 무색투명 폴리이미드 필름은 내열성 및 기계적 강도가 충분하지 못하기 때문에 이를 보강하기 위해 유리섬유직물을 폴리이미드 필름에 함침시키면 필름의 표면 거칠기 및 광 투과도 조건이 악화되는 문제가 발생해 실용화되지 못하고 있다. 이는 유리섬유직물을 폴리이미드 전구체 용액에 함침시킬 때 용매가 증발하며 0.4µm(마이크로미터) 내외의 표면 거칠기가 발생하고, 무색투명 폴리이미드 필름과 유리섬유직물의 굴절률 불일치로 인한 광 산란이 심하게 발생하기 때문이다.
윤 교수팀은 투명 폴리이미드 필름의 굴절률을 유리섬유직물의 굴절률과 소수 네 자리까지 일치시키는 방법과, 필름의 표면 거칠기를 수 nm 수준으로 평탄화 시키는 핵심기술을 개발해 이 문제를 해결했다. 그 결과 110µm 두께의 유리섬유직물 함침 무색투명 폴리이미드 필름 기판에서 11ppm/℃의 열팽창률, 0.9nm의 표면 거칠기, 250MPa의 인장강도, 2mm의 굽힘곡률반경, 90%의 광 투과도를 달성했다.
윤춘섭 교수는 “개발된 기판은 기존 디스플레이의 유리 기판을 대체할 수 있고, 플렉서블 디스플레이 기판으로도 사용할 수 있다”며 “핸드폰 화면이 깨지는 문제점을 근본적으로 해결하고, 대면적 TV의 무게 및 두께를 획기적으로 줄일 수 있으며, 디스플레이 생산에 롤투롤 공정을 적용할 수 있어 디스플레이 산업에 일대 혁신을 가져올 수 있을 것”이라고 전망했다.
한편, 2008년부터 5년간 지식경제부의 ‘모바일 플렉시블 입출력 플랫폼 개발사업’의 지원으로 개발된 이 기술은 총 3건의 특허출원을 마치고 관련기업과 기술 이전을 협의 중이다.
그림1. 유리섬유직물의 굴절률이 무색투명 폴리이미드 필름의 굴절률과 일치된 경우의 필름 투명도(좌측)와 일치되지 않는 경우(우측). 좌측의 글자는 선명하게 보이는 반면 우측의 글자는 뿌옇게 보인다.
그림2. 개발한 유리직물섬유 사진
2013.05.14
조회수 20046
-
 휘어지는 대용량 반도체 원천기술 개발
- KAIST 김상욱 교수, 세계 최고의‘분자조립’기술력 활용해 휘어지는 대용량 반도체 원천기술 확보 -
우리 학교 신소재공학과 김상욱 교수 연구팀이 원하는 형태로 분자가 스스로 배열하는 ‘분자조립’ 기술을 활용해 유연한 그래핀 기판 위에 양산중인 반도체 패턴의 최고 수준인 20nm(나노미터)급 초미세 패턴을 구현하는데 성공했다.
이번 기술 개발로 향후 유연하게 휘어지면서도 많은 양의 데이터를 저장할 수 있는 반도체를 구현할 수 있어 고성능 플렉시블 전자기기 개발에 도움이 될 것으로 학계는 기대하고 있다.
이와 함께 연성소재의 특성을 이용해 초미세 패턴을 형성하기 어려운 3차원 굴곡진 기판에서도 자유롭게 구현하는데 성공, 다양한 응용소자에 활용할 수 있는 것은 물론 화학 반응으로 물질을 섞어주기만 하면 원하는 형태로 스스로 배열해 고가의 장비가 필요하지 않아 반도체 제작비용이 훨씬 저렴해질 것으로 전망된다.
이번 연구의 핵심 기술인 ‘분자조립’이란 플라스틱, 액정, 생체분자 등과 같이 딱딱하지 않고 유연한 연성소재의 고분자를 원하는 형태로 스스로 배열하게 해 기존에 만들기 어려웠던 작은 나노구조물을 효율적으로 만드는 기술이다. 마치 물과 기름이 서로 섞이지 않는 것과 같이 서로 다른 두 고분자가 상분리되어 섞이지 않는다는 점을 이용하는 것이다.
연구팀은 기계적 물성이 우수하고 원하는 기판에 쉽게 옮길 수 있는 그래핀 위에 ‘블록공중합체’라는 분자조립기술을 통해 초미세 패턴을 형성한 후, 이를 3차원 기판 혹은 PET(폴리에틸렌테레프탈레이트), PDMS(폴리디멜틸실론산) 등과 같은 플렉시블 기판에 옮겨 자유롭게 3차원 혹은 플렉시블 기판에 구조물을 구현했다.
김상욱 교수는 이번 연구에 대해 “지금까지 발표된 휘어지는 반도체는 온도에 취약한 플라스틱 기판을 사용해 극한 공정조건을 극복해낼 수 없어 상용화에 어려움이 많았다”며 “이번 기술은 기계적 물성이 우수한 그래핀을 회로 기판으로 적용하는 데 성공한 획기적인 연구성과”라고 말했다.
김 교수는 이어 “이번 연구에 대해 세계적으로 많은 관심을 받아 3월 20일 열리는 미국 물리학회에서 초청 강연을 할 예정”이라며 “이번에 개발한 원천기술을 바탕으로 후속 연구를 진행해 반도체 회로와 같이 복잡한 회로의 설계에 도전할 것”이라고 포부를 밝혔다.
한편, 교육과학기술부 글로벌프론티어사업 다차원 스마트 IT 융합시스템 연구단의 지원을 받아 수행된 이번 연구결과는 재료분야 세계적 학술지 ‘어드밴스드 머터리얼스(Advanced Materials)’ 3월 6일자에 실렸다.
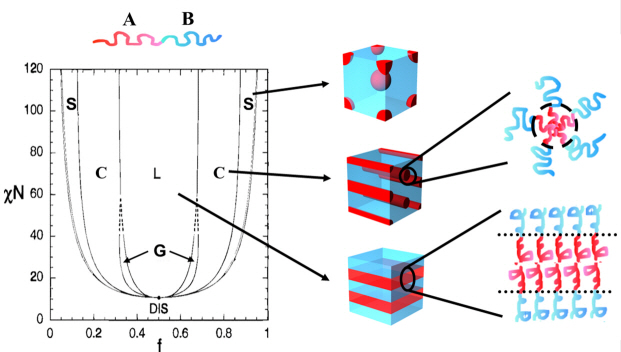
그림1. 제작공정
1. 스핀 코딩이라는 도포법을 사용해 그래핀 박막을 형성
2. 그래핀 박막 위에 블록공중합체를 형성
3. 블록공중합체을 식각 또는 패턴 전사법을 통해 나노 구조를 형성4. 그래핀을 전사층으로 활용해 다양한 기판에 나노 구조를 형성
그림2. 블록공중합체 분자조립기술
블록공중합체 분자조립기술은 물과 기름이 서로 섞이지 않은 것과 같이 서로 다른 두 고분자가 섞이지 않는다는 점을 이용한 기술이다. 물과 기름의 경우, 서로 섞이려고 하지 않는 물질이기 때문에, 물과 기름은 혼합하게 되면, 물을 물끼리 어울려 덩어리 지고, 기름은 기름끼리 어물려 덩어리가 지게 된다. 하지만, 물과 기름이 서로 떨어질 수 없게끔 결합이 되어 있다고 가정하면, 다른 현상이 예상된다. 동일하게 물은 물끼리 있으려 하고 기름은 기름끼리 있으려고 하지만, 물 옆에는 결합된 기름이 있게 된다. 따라서 물과 기름의 거대한 두 덩이리가 형성되는 것이 아니라, 매우 미세하게 물과 기름이 번갈아가면서 형성되게 된다. 동일하게 블록공중합체에서는 화학적으로 서로 다른 고분자가 공유 결합이라는 쉽게 깨지지 않은 결합을 통해 연결되어 있다., 따라서, 결합된 물과 기름에서와 동일하게 미세한 크기의 상분리가 일어나게 된다. 이러한 구조의 크기는 대개 고분자의 크기에 의해 결정되면, 머리카락 크기의 1/10000 수준으로 매우 미세하며 주기적인 패턴을 형성하게 된다. 패턴의 형태는 서로 다른 고분자의 비율에 따라 구, 원통형, 판형 등으로 나타난다.
그림3. 플렉시블 기판 상에 옮겨진 금 나노 구조체
휘어지는 대용량 반도체 원천기술 개발
- KAIST 김상욱 교수, 세계 최고의‘분자조립’기술력 활용해 휘어지는 대용량 반도체 원천기술 확보 -
우리 학교 신소재공학과 김상욱 교수 연구팀이 원하는 형태로 분자가 스스로 배열하는 ‘분자조립’ 기술을 활용해 유연한 그래핀 기판 위에 양산중인 반도체 패턴의 최고 수준인 20nm(나노미터)급 초미세 패턴을 구현하는데 성공했다.
이번 기술 개발로 향후 유연하게 휘어지면서도 많은 양의 데이터를 저장할 수 있는 반도체를 구현할 수 있어 고성능 플렉시블 전자기기 개발에 도움이 될 것으로 학계는 기대하고 있다.
이와 함께 연성소재의 특성을 이용해 초미세 패턴을 형성하기 어려운 3차원 굴곡진 기판에서도 자유롭게 구현하는데 성공, 다양한 응용소자에 활용할 수 있는 것은 물론 화학 반응으로 물질을 섞어주기만 하면 원하는 형태로 스스로 배열해 고가의 장비가 필요하지 않아 반도체 제작비용이 훨씬 저렴해질 것으로 전망된다.
이번 연구의 핵심 기술인 ‘분자조립’이란 플라스틱, 액정, 생체분자 등과 같이 딱딱하지 않고 유연한 연성소재의 고분자를 원하는 형태로 스스로 배열하게 해 기존에 만들기 어려웠던 작은 나노구조물을 효율적으로 만드는 기술이다. 마치 물과 기름이 서로 섞이지 않는 것과 같이 서로 다른 두 고분자가 상분리되어 섞이지 않는다는 점을 이용하는 것이다.
연구팀은 기계적 물성이 우수하고 원하는 기판에 쉽게 옮길 수 있는 그래핀 위에 ‘블록공중합체’라는 분자조립기술을 통해 초미세 패턴을 형성한 후, 이를 3차원 기판 혹은 PET(폴리에틸렌테레프탈레이트), PDMS(폴리디멜틸실론산) 등과 같은 플렉시블 기판에 옮겨 자유롭게 3차원 혹은 플렉시블 기판에 구조물을 구현했다.
김상욱 교수는 이번 연구에 대해 “지금까지 발표된 휘어지는 반도체는 온도에 취약한 플라스틱 기판을 사용해 극한 공정조건을 극복해낼 수 없어 상용화에 어려움이 많았다”며 “이번 기술은 기계적 물성이 우수한 그래핀을 회로 기판으로 적용하는 데 성공한 획기적인 연구성과”라고 말했다.
김 교수는 이어 “이번 연구에 대해 세계적으로 많은 관심을 받아 3월 20일 열리는 미국 물리학회에서 초청 강연을 할 예정”이라며 “이번에 개발한 원천기술을 바탕으로 후속 연구를 진행해 반도체 회로와 같이 복잡한 회로의 설계에 도전할 것”이라고 포부를 밝혔다.
한편, 교육과학기술부 글로벌프론티어사업 다차원 스마트 IT 융합시스템 연구단의 지원을 받아 수행된 이번 연구결과는 재료분야 세계적 학술지 ‘어드밴스드 머터리얼스(Advanced Materials)’ 3월 6일자에 실렸다.
그림1. 제작공정
1. 스핀 코딩이라는 도포법을 사용해 그래핀 박막을 형성
2. 그래핀 박막 위에 블록공중합체를 형성
3. 블록공중합체을 식각 또는 패턴 전사법을 통해 나노 구조를 형성4. 그래핀을 전사층으로 활용해 다양한 기판에 나노 구조를 형성
그림2. 블록공중합체 분자조립기술
블록공중합체 분자조립기술은 물과 기름이 서로 섞이지 않은 것과 같이 서로 다른 두 고분자가 섞이지 않는다는 점을 이용한 기술이다. 물과 기름의 경우, 서로 섞이려고 하지 않는 물질이기 때문에, 물과 기름은 혼합하게 되면, 물을 물끼리 어울려 덩어리 지고, 기름은 기름끼리 어물려 덩어리가 지게 된다. 하지만, 물과 기름이 서로 떨어질 수 없게끔 결합이 되어 있다고 가정하면, 다른 현상이 예상된다. 동일하게 물은 물끼리 있으려 하고 기름은 기름끼리 있으려고 하지만, 물 옆에는 결합된 기름이 있게 된다. 따라서 물과 기름의 거대한 두 덩이리가 형성되는 것이 아니라, 매우 미세하게 물과 기름이 번갈아가면서 형성되게 된다. 동일하게 블록공중합체에서는 화학적으로 서로 다른 고분자가 공유 결합이라는 쉽게 깨지지 않은 결합을 통해 연결되어 있다., 따라서, 결합된 물과 기름에서와 동일하게 미세한 크기의 상분리가 일어나게 된다. 이러한 구조의 크기는 대개 고분자의 크기에 의해 결정되면, 머리카락 크기의 1/10000 수준으로 매우 미세하며 주기적인 패턴을 형성하게 된다. 패턴의 형태는 서로 다른 고분자의 비율에 따라 구, 원통형, 판형 등으로 나타난다.
그림3. 플렉시블 기판 상에 옮겨진 금 나노 구조체
2013.03.12
조회수 18814
-
 합성 조절 RNA를 이용한 세포공장 기술 개발
- 네이쳐 바이오테크놀로지 온라인판 게재.“화학 산업을 대체할 생물 산업 발전의 새로운 전략으로 기대” -
우리 학교 생명화학공학과 이상엽 특훈교수팀이 합성 조절 RNA 기술을 활용하여 세포공장*을 효율적이고 대규모로 구현하게 하는 새로운 기술을 개발했다. * 세포공장(Biofactory) : 세포의 유전자를 조작하여 원하는 화합물을 대량으로 생산하도록 만드는 미생물 기반의 생산 시스템
화석연료 고갈과 석유화학제품 사용에 의한 환경오염 등 인류가 직면한 문제를 해결하기 위해 친환경적이고 지속가능한 바이오산업이 대두되고 있으며 특히 바이오에너지, 의약품, 친환경 소재 등을 생산할 수 있는 세포공장 개발기술이 전 세계적으로 주목받고 있다.
우수한 세포공장 개발을 위해서는 원하는 화합물을 생산하는 유전자 선별과 높은 생산 효율의 미생물을 찾는 과정이 병행되어야 하나 기존의 연구방식은 미생물의 유전자를 하나씩 조작하여 복잡하고 많은 시간이 소요되는 문제가 있었다.
우리 학교 나도균 박사와 유승민 박사가 참여한 이상엽 특훈교수 연구팀은 위와 같은 기술적 한계를 극복하기 위해 합성 조절 RNA를 제작하고 이를 활용하는 새로운 기술을 개발하였다.
특히 합성 조절 RNA를 이용한 이 기술은 기존 방식과 달리 균주 특이성이 없어 수개월이 소요되던 실험을 수일로 단축시킬 수 있어 획기적이다.
연구팀은 합성 조절 RNA 기술을 활용하여 의약 화합물의 전구체로 사용되는 타이로신(tyrosine)*과 다양한 석유화학 제품에 활용되는 카다베린(cadaverine)** 생산에 도입하여 세계 최고의 수율로 생산(각 21.9g/L, 12.6g/L)하는 세포공장을 개발하는데 성공하였다.
* 타이로신(tyrosine) : 스트레스를 다스리고 집중력 향상 효과가 있는 아미노산 ** 카다베린(cadaverine) : 폴리우레탄 등 다양한 석유화학 제품에 활용되는 기반물질
이상엽 교수는 “합성 조절 RNA기술로 다양한 물질을 생산하는 세포공장 개발이 활발해 질 것이며 석유에너지로 대표되는 화학 산업이 바이오 산업으로 변해 가는데 촉매제 역할을 할 것으로 기대된다”라고 연구 의의를 밝혔다.“
이번 연구는 글로벌프론티어사업(지능형 바이오 시스템 설계 및 합성 연구단(단장 김선창))의 지원으로 수행되었으며 연구결과는 세계적 학술지인 네이처 바이오테크놀로지 온라인 판에 1월 20일 게재되었다.
합성 조절 RNA를 이용한 세포공장 기술 개발
- 네이쳐 바이오테크놀로지 온라인판 게재.“화학 산업을 대체할 생물 산업 발전의 새로운 전략으로 기대” -
우리 학교 생명화학공학과 이상엽 특훈교수팀이 합성 조절 RNA 기술을 활용하여 세포공장*을 효율적이고 대규모로 구현하게 하는 새로운 기술을 개발했다. * 세포공장(Biofactory) : 세포의 유전자를 조작하여 원하는 화합물을 대량으로 생산하도록 만드는 미생물 기반의 생산 시스템
화석연료 고갈과 석유화학제품 사용에 의한 환경오염 등 인류가 직면한 문제를 해결하기 위해 친환경적이고 지속가능한 바이오산업이 대두되고 있으며 특히 바이오에너지, 의약품, 친환경 소재 등을 생산할 수 있는 세포공장 개발기술이 전 세계적으로 주목받고 있다.
우수한 세포공장 개발을 위해서는 원하는 화합물을 생산하는 유전자 선별과 높은 생산 효율의 미생물을 찾는 과정이 병행되어야 하나 기존의 연구방식은 미생물의 유전자를 하나씩 조작하여 복잡하고 많은 시간이 소요되는 문제가 있었다.
우리 학교 나도균 박사와 유승민 박사가 참여한 이상엽 특훈교수 연구팀은 위와 같은 기술적 한계를 극복하기 위해 합성 조절 RNA를 제작하고 이를 활용하는 새로운 기술을 개발하였다.
특히 합성 조절 RNA를 이용한 이 기술은 기존 방식과 달리 균주 특이성이 없어 수개월이 소요되던 실험을 수일로 단축시킬 수 있어 획기적이다.
연구팀은 합성 조절 RNA 기술을 활용하여 의약 화합물의 전구체로 사용되는 타이로신(tyrosine)*과 다양한 석유화학 제품에 활용되는 카다베린(cadaverine)** 생산에 도입하여 세계 최고의 수율로 생산(각 21.9g/L, 12.6g/L)하는 세포공장을 개발하는데 성공하였다.
* 타이로신(tyrosine) : 스트레스를 다스리고 집중력 향상 효과가 있는 아미노산 ** 카다베린(cadaverine) : 폴리우레탄 등 다양한 석유화학 제품에 활용되는 기반물질
이상엽 교수는 “합성 조절 RNA기술로 다양한 물질을 생산하는 세포공장 개발이 활발해 질 것이며 석유에너지로 대표되는 화학 산업이 바이오 산업으로 변해 가는데 촉매제 역할을 할 것으로 기대된다”라고 연구 의의를 밝혔다.“
이번 연구는 글로벌프론티어사업(지능형 바이오 시스템 설계 및 합성 연구단(단장 김선창))의 지원으로 수행되었으며 연구결과는 세계적 학술지인 네이처 바이오테크놀로지 온라인 판에 1월 20일 게재되었다.
2013.01.21
조회수 19543
-
 나노촉매의 활성도를 효과적으로 높일 수 있는 원리 규명
박정영 교수
- Nano Letters 발표,“활성도는 높이고 소모는 줄이는 신개념 촉매물질 개발 가능”-
나노촉매*에 산화막을 형성하여 활성도를 자유자재로 제어할 수 있는 기술이 국내 연구진에 의해 개발됨에 따라, 활성도를 극대화하고 소모를 최소화하는 새로운 촉매물질 개발에 가능성이 열렸다.
* 나노촉매(Nanocatalysts) : 표면적이 높은 산화물 지지체에 나노미터(10억분의 1미터) 크기의 금속입자가 분산되어 있는 구조로, 표면에서 기체 반응을 원활하게 하는 재료
우리 학교 EEWS대학원 박정영 교수(42세)가 주도하고 캄란 카디르 박사과정생(Kamran Qadir, 제1저자), 울산과기대 주상훈 교수, 한양대 문봉진 교수 및 UC버클리대 가보 소모자이 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약연구)과 WCU육성사업 및 지식경제부 둥의 지원으로 수행되었고, 나노분야의 권위 있는 학술지인 ‘Nano Letters’ 온라인 속보(10월 15일)에 게재되었다.(논문명: Intrinsic Relation between Catalytic Activity of CO Oxidation on Ru Nanoparticles and Ru Oxides Uncovered with Ambient Pressure XPS)
우리가 일상생활에서 사용하고 있는 제품의 대부분(80% 이상)은 촉매를 이용해 만들어질 정도로, 촉매는 우리 생활에서 꼭 필요하고 중요한 물질이다.
특히 전 세계 연구자들은 인류가 직면한 중요 이슈인 에너지문제와 환경문제 등을 근본적으로 해결하기 위해 친환경적인 화학공정에 사용될 새로운 나노촉매 물질을 집중적으로 개발하고 있다.
현재 실생활에서 주로 사용되는 촉매는 나노입자와 산화물로 이루어져 있다. 그 중 나노입자는 촉매의 표면적을 최대한 넓혀 촉매의 활성도를 높이는 역할을 한다.
활성도가 높은 촉매를 효과적으로 제조하기 위해서는 나노입자의 표면 산화막이 중요한 요인으로 알려져 왔다. 그러나 이를 과학적으로 입증하기 위해서는 촉매가 반응하는 환경에서 나노입자의 산화상태를 정확히 측정해야 하지만, 그 동안 많은 분석이 진공에서 이루어져와서 이를 정확히 보여주기가 힘들었다. 즉 촉매가 반응하는 환경에서 측정이 이루어지기 위해서는 상압측정이 필요하다. 최근에 개발된 상압 엑스선 광전자 분광법으로 이러한 상압에서 표면의 성분과 산화상태의 연구가 가능하게 되었다.
지금까지 연구자들이 무엇 때문에 정확히 측정하지 못했을까요?
박정영 교수 연구팀은 상압 엑스선 광전자 분광법*으로 나노입자의 산화상태를 촉매환경에서 측정하는데 성공하였다.
* 엑스선 광전자 분광법(X-ray Photoelectron Spectroscopy) : 엑스선을 물질에 쬐었을 때 나오는 광전자의 운동에너지를 조사하여 물질의 성분과 산화상태 등을 연구하는 표면분석법
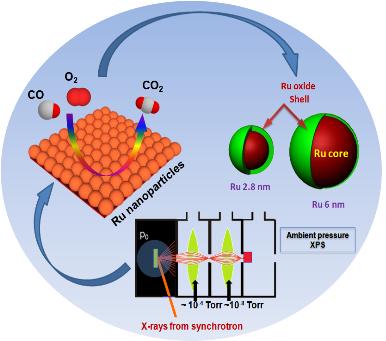
박 교수팀은 2.8나노미터와 6나노미터 크기의 루테늄 나노입자 2개를 콜로이드 합성법*으로 제작하고, 랭뮤르 블라짓 기법**으로 나노입자 한 층을 표면에 증착시켰다. 연구팀은 나노입자의 산화상태를 온도와 압력을 바꿔가며 측정하였고, 크기가 큰 루테늄 나노입자가 얇은 산화막을 가진다는 결과를 도출하였다.
* 콜로이드 합성법 : 금속염과 안정제가 함께 용해되어 있는 용매에 환원제를 투입 또는 혼합하여 나노입자를 제작하는 방법. 제작 과정의 여러 인자를 바꿈으로써 입자의 크기와 모양, 성분의 제어가 가능하다.
* * 랭뮤르 블라짓(Langmuir-Blodgett) 기법 : 금속나노입자를 단층으로 제작하는 기법. 나노입자가 용액 위에 떠 있을때, 표면압력을 조절하여 나노입자 사이의 평균 간격을 조절할 수 있다.
또한 연구팀은 측정결과를 바탕으로 산화상태가 촉매의 활성도에 미치는 영향을 확인하여, 크기가 큰 루테늄 나노입자의 얇은 산화막이 촉매의 활성도를 높일 수 있고, 산화상태를 바꾸면 활성도도 제어할 수 있다는 사실을 입증하였다.
박정영 교수는 “나노입자의 산화막이 촉매환경에서 만들어지고 촉매활성도에도 직접적인 관계가 있음을 규명한 이번 연구는 활성도가 높은 촉매물질을 만드는데 응용되어 환경오염에 주요한 원인이 될 수 있는 촉매물질의 소모를 획기적으로 줄이는데 기여할 것으로 기대한다”고 연구의의를 밝혔다.
루테늄(Ru) 나노입자의 촉매환경 도중 산화상태조사 : 루테늄 나노입자에서 일어나는 촉매반응 (일산화탄소 산화반응)을 보여줌 (왼쪽). 방사광 가속기에 설치된 상압 엑스선 광전자 분광법을 이용하여 촉매환경에서 루테늄 나노입자의 산화상태가 분석이 됨 (아래). 루테늄 나노입자의 산화막의 두께가 나노입자의 크기에 관계가 되고 이는 촉매의 활성도에 직접적으로 영향을 줌 (오른쪽)
나노촉매의 활성도를 효과적으로 높일 수 있는 원리 규명
박정영 교수
- Nano Letters 발표,“활성도는 높이고 소모는 줄이는 신개념 촉매물질 개발 가능”-
나노촉매*에 산화막을 형성하여 활성도를 자유자재로 제어할 수 있는 기술이 국내 연구진에 의해 개발됨에 따라, 활성도를 극대화하고 소모를 최소화하는 새로운 촉매물질 개발에 가능성이 열렸다.
* 나노촉매(Nanocatalysts) : 표면적이 높은 산화물 지지체에 나노미터(10억분의 1미터) 크기의 금속입자가 분산되어 있는 구조로, 표면에서 기체 반응을 원활하게 하는 재료
우리 학교 EEWS대학원 박정영 교수(42세)가 주도하고 캄란 카디르 박사과정생(Kamran Qadir, 제1저자), 울산과기대 주상훈 교수, 한양대 문봉진 교수 및 UC버클리대 가보 소모자이 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약연구)과 WCU육성사업 및 지식경제부 둥의 지원으로 수행되었고, 나노분야의 권위 있는 학술지인 ‘Nano Letters’ 온라인 속보(10월 15일)에 게재되었다.(논문명: Intrinsic Relation between Catalytic Activity of CO Oxidation on Ru Nanoparticles and Ru Oxides Uncovered with Ambient Pressure XPS)
우리가 일상생활에서 사용하고 있는 제품의 대부분(80% 이상)은 촉매를 이용해 만들어질 정도로, 촉매는 우리 생활에서 꼭 필요하고 중요한 물질이다.
특히 전 세계 연구자들은 인류가 직면한 중요 이슈인 에너지문제와 환경문제 등을 근본적으로 해결하기 위해 친환경적인 화학공정에 사용될 새로운 나노촉매 물질을 집중적으로 개발하고 있다.
현재 실생활에서 주로 사용되는 촉매는 나노입자와 산화물로 이루어져 있다. 그 중 나노입자는 촉매의 표면적을 최대한 넓혀 촉매의 활성도를 높이는 역할을 한다.
활성도가 높은 촉매를 효과적으로 제조하기 위해서는 나노입자의 표면 산화막이 중요한 요인으로 알려져 왔다. 그러나 이를 과학적으로 입증하기 위해서는 촉매가 반응하는 환경에서 나노입자의 산화상태를 정확히 측정해야 하지만, 그 동안 많은 분석이 진공에서 이루어져와서 이를 정확히 보여주기가 힘들었다. 즉 촉매가 반응하는 환경에서 측정이 이루어지기 위해서는 상압측정이 필요하다. 최근에 개발된 상압 엑스선 광전자 분광법으로 이러한 상압에서 표면의 성분과 산화상태의 연구가 가능하게 되었다.
지금까지 연구자들이 무엇 때문에 정확히 측정하지 못했을까요?
박정영 교수 연구팀은 상압 엑스선 광전자 분광법*으로 나노입자의 산화상태를 촉매환경에서 측정하는데 성공하였다.
* 엑스선 광전자 분광법(X-ray Photoelectron Spectroscopy) : 엑스선을 물질에 쬐었을 때 나오는 광전자의 운동에너지를 조사하여 물질의 성분과 산화상태 등을 연구하는 표면분석법
박 교수팀은 2.8나노미터와 6나노미터 크기의 루테늄 나노입자 2개를 콜로이드 합성법*으로 제작하고, 랭뮤르 블라짓 기법**으로 나노입자 한 층을 표면에 증착시켰다. 연구팀은 나노입자의 산화상태를 온도와 압력을 바꿔가며 측정하였고, 크기가 큰 루테늄 나노입자가 얇은 산화막을 가진다는 결과를 도출하였다.
* 콜로이드 합성법 : 금속염과 안정제가 함께 용해되어 있는 용매에 환원제를 투입 또는 혼합하여 나노입자를 제작하는 방법. 제작 과정의 여러 인자를 바꿈으로써 입자의 크기와 모양, 성분의 제어가 가능하다.
* * 랭뮤르 블라짓(Langmuir-Blodgett) 기법 : 금속나노입자를 단층으로 제작하는 기법. 나노입자가 용액 위에 떠 있을때, 표면압력을 조절하여 나노입자 사이의 평균 간격을 조절할 수 있다.
또한 연구팀은 측정결과를 바탕으로 산화상태가 촉매의 활성도에 미치는 영향을 확인하여, 크기가 큰 루테늄 나노입자의 얇은 산화막이 촉매의 활성도를 높일 수 있고, 산화상태를 바꾸면 활성도도 제어할 수 있다는 사실을 입증하였다.
박정영 교수는 “나노입자의 산화막이 촉매환경에서 만들어지고 촉매활성도에도 직접적인 관계가 있음을 규명한 이번 연구는 활성도가 높은 촉매물질을 만드는데 응용되어 환경오염에 주요한 원인이 될 수 있는 촉매물질의 소모를 획기적으로 줄이는데 기여할 것으로 기대한다”고 연구의의를 밝혔다.
루테늄(Ru) 나노입자의 촉매환경 도중 산화상태조사 : 루테늄 나노입자에서 일어나는 촉매반응 (일산화탄소 산화반응)을 보여줌 (왼쪽). 방사광 가속기에 설치된 상압 엑스선 광전자 분광법을 이용하여 촉매환경에서 루테늄 나노입자의 산화상태가 분석이 됨 (아래). 루테늄 나노입자의 산화막의 두께가 나노입자의 크기에 관계가 되고 이는 촉매의 활성도에 직접적으로 영향을 줌 (오른쪽)
2012.11.08
조회수 23082
-
 노화를 억제하면서 건강히 장수할 수 있도록 돕는 新물질 발견
김대수 교수
- PLoS One 발표,“암, 치매 및 파킨슨병 예방․치료에 한걸음 다가가”-
노화를 억제하면서 건강히 오래살 수 있도록 돕는 새로운 물질이 국내 연구진에 의해 발견됨에 따라, 건강한 삶을 오래 유지하고 싶은 인류의 꿈에 한걸음 다가서게 되었다.
우리 학교 생명과학과 김대수 교수(43세) 연구팀과 충남대 의과대학 및 산업체와의 공동연구로 진행된 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(전략연구)의 지원으로 수행되었고, 생물학 분야의 권위 있는 학술지인 ‘플로스 원(PLoS One)’ 최신호(10월 11일자)에 게재되었다.(논문명: Beta-lapachone, a modulator of NAD metabolism, prevents health declines in aged mice)
사람이 건강하게 오래 살 수 있는 효과적인 방법은 식사량을 줄이거나(小食) 달리기와 같은 유산소운동을 하는 것이다.
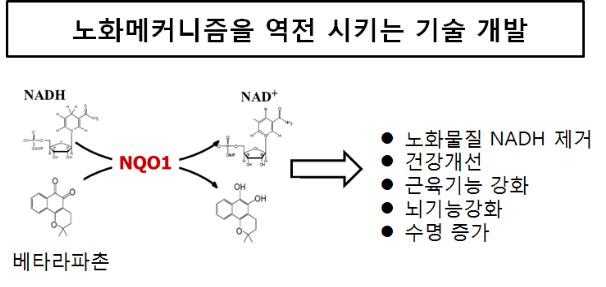
김대수 교수 연구팀은 우선 소식이나 유산소운동이 보조효소(NAD+*)를 증가시켜 세포의 노화를 억제한다는 점에 착안하였다. 연구팀은 천연화합물(베타-라파촌)로 효소(NQO1)를 활성화시키면, 적게 먹거나 별도의 운동을 하지 않아도 NAD+의 양이 증가됨을 규명하였다.
*) NAD+(니코틴아미드 디욱시뉴클레오타이드) : 이 보조효소가 세포내에서 증가하면 노화방지 효과가 있는 것으로 알려져 있음
**) 베타-라파촌(beta-lapachon) : 라파초 나무, 단삼 등 식물에 고농도로 함유된 천연화합물
또한 이미 노화가 진행된 생쥐들에게 베타-라파촌을 사료에 섞여 먹인 결과, 3개월이 경과되면 운동기능과 뇌기능이 모두 향상되어 건강하게 오래살 수 있음을 확인하였다. 특히 베타-라파촌은 동․서양에서 오랜 기간 사용해 온 약초의 주성분으로 만들어져, 머지않아 쉽게 상용화할 수 있는 것이 특징이다.
김대수 교수는 “지금까지 노화를 억제하는 약물들이 다수 개발되었지만, 사람에게 적용하는데 한계가 있었다. 우리 연구팀이 찾아낸 새로운 물질은 소식이나 운동으로 나타나는 효과를 그대로 모방하여 밝혀낸 것으로서, 향후 암, 치매 및 파킨슨병과 같은 노인성 질환을 예방하고 치료하는데 크게 기여할 것으로 기대한다”고 연구의의를 밝혔다.
노화를 억제하면서 건강히 장수할 수 있도록 돕는 新물질 발견
김대수 교수
- PLoS One 발표,“암, 치매 및 파킨슨병 예방․치료에 한걸음 다가가”-
노화를 억제하면서 건강히 오래살 수 있도록 돕는 새로운 물질이 국내 연구진에 의해 발견됨에 따라, 건강한 삶을 오래 유지하고 싶은 인류의 꿈에 한걸음 다가서게 되었다.
우리 학교 생명과학과 김대수 교수(43세) 연구팀과 충남대 의과대학 및 산업체와의 공동연구로 진행된 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(전략연구)의 지원으로 수행되었고, 생물학 분야의 권위 있는 학술지인 ‘플로스 원(PLoS One)’ 최신호(10월 11일자)에 게재되었다.(논문명: Beta-lapachone, a modulator of NAD metabolism, prevents health declines in aged mice)
사람이 건강하게 오래 살 수 있는 효과적인 방법은 식사량을 줄이거나(小食) 달리기와 같은 유산소운동을 하는 것이다.
김대수 교수 연구팀은 우선 소식이나 유산소운동이 보조효소(NAD+*)를 증가시켜 세포의 노화를 억제한다는 점에 착안하였다. 연구팀은 천연화합물(베타-라파촌)로 효소(NQO1)를 활성화시키면, 적게 먹거나 별도의 운동을 하지 않아도 NAD+의 양이 증가됨을 규명하였다.
*) NAD+(니코틴아미드 디욱시뉴클레오타이드) : 이 보조효소가 세포내에서 증가하면 노화방지 효과가 있는 것으로 알려져 있음
**) 베타-라파촌(beta-lapachon) : 라파초 나무, 단삼 등 식물에 고농도로 함유된 천연화합물
또한 이미 노화가 진행된 생쥐들에게 베타-라파촌을 사료에 섞여 먹인 결과, 3개월이 경과되면 운동기능과 뇌기능이 모두 향상되어 건강하게 오래살 수 있음을 확인하였다. 특히 베타-라파촌은 동․서양에서 오랜 기간 사용해 온 약초의 주성분으로 만들어져, 머지않아 쉽게 상용화할 수 있는 것이 특징이다.
김대수 교수는 “지금까지 노화를 억제하는 약물들이 다수 개발되었지만, 사람에게 적용하는데 한계가 있었다. 우리 연구팀이 찾아낸 새로운 물질은 소식이나 운동으로 나타나는 효과를 그대로 모방하여 밝혀낸 것으로서, 향후 암, 치매 및 파킨슨병과 같은 노인성 질환을 예방하고 치료하는데 크게 기여할 것으로 기대한다”고 연구의의를 밝혔다.
2012.10.24
조회수 22527
-
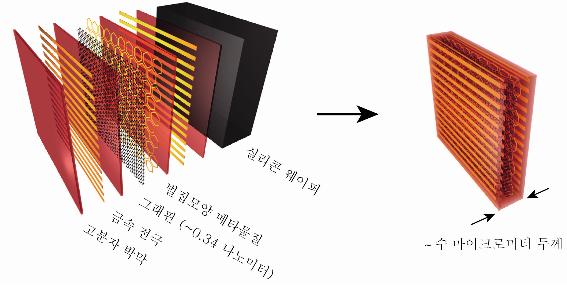 나노미터보다 얇은 두께에서 빛을 자유자재로 제어하다
민범기 교수
- Nature Materials 발표,“그래핀과 자체 개발한 메타물질 결합, 다양한 광소자 개발 가능”
자연에 존재하는 2차원 물질인 그래핀*과 국내 연구진이 자체 개발한 인공적인 2차원 메타물질**을 결합해 빛의 투과도를 효과적으로 제어할 수 있다는 사실이 밝혀짐에 따라, 광메모리 등 다양한 그래핀 광소자*** 개발의 전망이 밝아졌다.
* 그래핀(Graphene) : 탄소원자가 육각형 벌집모양을 이루는 2차원 평면에 펼쳐진 얇은 막 구조
** 메타물질(Metamaterials) : 자연계에 없는 특성을 갖도록 고안된 빛의 파장보다 훨씬 작은 인공 원자로 구성된 물질
*** 광소자(Optical Devices) : 빛의 생성, 검출, 변조 및 제어 등을 할 수 있는 소자
우리 학교 기계공학전공 민범기 교수(39세), 이승훈 박사생(제1저자, 30세), ETRI 최무한 박사(제1저자, 41세) 및 김튼튼 박사(제1저자, 31세)가 주도하고, 이승섭 교수, 최성율 교수, ETRI 최춘기 박사, 미국 UC버클리대 샹장(Xiang Zhang) 교수 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △중견연구자지원사업(전략연구) △일반연구자지원사업(기본연구) △선도연구센터지원사업(SRC) 등의 지원으로 수행되었다.
연구결과는 세계 최고 과학전문지 ‘네이처’ 의 자매지로서 재료과학분야의 권위 있는 학술지인 ‘Nature Materials’ 최신 온라인 판(9월 30일자)에 게재되었다.
(논문명: Switching terahertz waves with gate-controlled active graphene metamaterials)
그래핀은 여러 우수한 물리적 특성으로 인해 2004년 영국의 가임 교수와 노보셀로프 교수(2010년 노벨물리학상 수상)가 발견한 이래, 지금까지 전 세계 연구자들이 주목하는 ‘꿈의 신소재’이다.
특히 그래핀은 고유의 전자구조로 인해 근적외선과 가시광선의 약 2.3%의 빛을 흡수하는 것으로 알려져 투명전극으로 응용될 수 있다. 투명전극은 LCD, OLED 등 평판 디스플레이, 스마트폰 등에 사용되는 터치스크린이나 태양전지 개발에 매우 중요한 전자부품 중 하나이다.
지금까지 전 세계 연구자들은 그래핀의 전기적 특성을 극대화해 반도체와 투명전극 등을 개발하고자 노력하였다. 반면에 그래핀이 지닌 놀라운 특성 중 하나인 광학적 투과도는 전기적인 방법으로 제어하는데 한계가 있고, 데이터를 빛으로 주고받을 때 광변조의 폭도 좁아 광변조기나 광소자로 응용되기에 제약이 있어 연구자들의 큰 주목을 받지 못했다.
민범기 교수 연구팀은 파장의 백만분의 1인 얇은 두께(0.34 나노미터)의 그래핀과 메타물질을 결합함으로써 빛의 투과도를 효과적으로 제어하여 그래핀만 사용했을 때보다 수십 배 이상 광변조의 폭을 높일 수 있음을 증명하였다.
특히 민 교수팀이 개발한 ‘그래핀 메타물질’은 매우 얇고 잘 휘어지는 고분자 기판 안에 그래핀과 메타물질(금으로 된 벌집모양의 인공원자) 및 전극이 집적화되어 전기를 이용해 빛의 투과도를 제어할 수 있다.
또한 연구팀의 그래핀 메타물질은 투과되는 빛의 세기와 위상을 효과적으로 제어할 수 있을 뿐만 아니라, 전기적 이력현상을 이용해 빛의 투과도를 기억하여 그래핀 광메모리 소자로 응용 될 수 있음을 실험적으로 증명하였다.
민 교수팀은 지난해 자연계에 존재하지 않는 굴절률 높은 메타물질을 제작하여 ‘네이처’에 발표하였는데, 이번 연구는 연구팀이 만든 메타물질의 특성을 그래핀과 접목하여 광학적 특성을 능동적으로 조절할 수 있음을 검증하였다는 점에서 의미가 크다.
민범기 교수는 “이번 연구는 10억분의 1미터인 나노미터보다 얇은 두께에서 빛을 효과적으로 조절할 수 있어 손톱보다 작은 초소형 광변조기나 광메모리 소자를 개발할 수 있는 가능성을 열었다”고 연구의의를 밝혔다.
그림 1. 그래핀 메타물질의 제작도
그림 2. 그래핀 메타물질의 개념도(왼쪽)와 제작된 소자의 현미경 사진(오른쪽)
나노미터보다 얇은 두께에서 빛을 자유자재로 제어하다
민범기 교수
- Nature Materials 발표,“그래핀과 자체 개발한 메타물질 결합, 다양한 광소자 개발 가능”
자연에 존재하는 2차원 물질인 그래핀*과 국내 연구진이 자체 개발한 인공적인 2차원 메타물질**을 결합해 빛의 투과도를 효과적으로 제어할 수 있다는 사실이 밝혀짐에 따라, 광메모리 등 다양한 그래핀 광소자*** 개발의 전망이 밝아졌다.
* 그래핀(Graphene) : 탄소원자가 육각형 벌집모양을 이루는 2차원 평면에 펼쳐진 얇은 막 구조
** 메타물질(Metamaterials) : 자연계에 없는 특성을 갖도록 고안된 빛의 파장보다 훨씬 작은 인공 원자로 구성된 물질
*** 광소자(Optical Devices) : 빛의 생성, 검출, 변조 및 제어 등을 할 수 있는 소자
우리 학교 기계공학전공 민범기 교수(39세), 이승훈 박사생(제1저자, 30세), ETRI 최무한 박사(제1저자, 41세) 및 김튼튼 박사(제1저자, 31세)가 주도하고, 이승섭 교수, 최성율 교수, ETRI 최춘기 박사, 미국 UC버클리대 샹장(Xiang Zhang) 교수 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △중견연구자지원사업(전략연구) △일반연구자지원사업(기본연구) △선도연구센터지원사업(SRC) 등의 지원으로 수행되었다.
연구결과는 세계 최고 과학전문지 ‘네이처’ 의 자매지로서 재료과학분야의 권위 있는 학술지인 ‘Nature Materials’ 최신 온라인 판(9월 30일자)에 게재되었다.
(논문명: Switching terahertz waves with gate-controlled active graphene metamaterials)
그래핀은 여러 우수한 물리적 특성으로 인해 2004년 영국의 가임 교수와 노보셀로프 교수(2010년 노벨물리학상 수상)가 발견한 이래, 지금까지 전 세계 연구자들이 주목하는 ‘꿈의 신소재’이다.
특히 그래핀은 고유의 전자구조로 인해 근적외선과 가시광선의 약 2.3%의 빛을 흡수하는 것으로 알려져 투명전극으로 응용될 수 있다. 투명전극은 LCD, OLED 등 평판 디스플레이, 스마트폰 등에 사용되는 터치스크린이나 태양전지 개발에 매우 중요한 전자부품 중 하나이다.
지금까지 전 세계 연구자들은 그래핀의 전기적 특성을 극대화해 반도체와 투명전극 등을 개발하고자 노력하였다. 반면에 그래핀이 지닌 놀라운 특성 중 하나인 광학적 투과도는 전기적인 방법으로 제어하는데 한계가 있고, 데이터를 빛으로 주고받을 때 광변조의 폭도 좁아 광변조기나 광소자로 응용되기에 제약이 있어 연구자들의 큰 주목을 받지 못했다.
민범기 교수 연구팀은 파장의 백만분의 1인 얇은 두께(0.34 나노미터)의 그래핀과 메타물질을 결합함으로써 빛의 투과도를 효과적으로 제어하여 그래핀만 사용했을 때보다 수십 배 이상 광변조의 폭을 높일 수 있음을 증명하였다.
특히 민 교수팀이 개발한 ‘그래핀 메타물질’은 매우 얇고 잘 휘어지는 고분자 기판 안에 그래핀과 메타물질(금으로 된 벌집모양의 인공원자) 및 전극이 집적화되어 전기를 이용해 빛의 투과도를 제어할 수 있다.
또한 연구팀의 그래핀 메타물질은 투과되는 빛의 세기와 위상을 효과적으로 제어할 수 있을 뿐만 아니라, 전기적 이력현상을 이용해 빛의 투과도를 기억하여 그래핀 광메모리 소자로 응용 될 수 있음을 실험적으로 증명하였다.
민 교수팀은 지난해 자연계에 존재하지 않는 굴절률 높은 메타물질을 제작하여 ‘네이처’에 발표하였는데, 이번 연구는 연구팀이 만든 메타물질의 특성을 그래핀과 접목하여 광학적 특성을 능동적으로 조절할 수 있음을 검증하였다는 점에서 의미가 크다.
민범기 교수는 “이번 연구는 10억분의 1미터인 나노미터보다 얇은 두께에서 빛을 효과적으로 조절할 수 있어 손톱보다 작은 초소형 광변조기나 광메모리 소자를 개발할 수 있는 가능성을 열었다”고 연구의의를 밝혔다.
그림 1. 그래핀 메타물질의 제작도
그림 2. 그래핀 메타물질의 개념도(왼쪽)와 제작된 소자의 현미경 사진(오른쪽)
2012.10.17
조회수 18294
-
 휘어지는 고성능 배터리 제작기술 개발
- 플렉시블 OLED 디스플레이와 배터리의 완전 결합길 열려 -
휘어지는 디스플레이의 에너지원으로 반드시 필요한 고효율 유연 배터리를 KAIST 연구진이 세계 최초로 개발하는데 성공했다.
우리 학교 신소재공학과 이건재 교수팀이 유연한 고효율 배터리를 개발하는데 성공, 이 연구결과가 재료분야 세계적 학술지인 ‘나노 레터스(Nano Letters)’ 8월호 온라인판에 실렸으며, 미국 화학학회 뉴스레터인 C&EN(Chemical & Engineering News)에도 (8월 10일자) 특집으로 보도됐다.
얇고 가벼우면서도 유연한 디스플레이로의 혁신적인 기술 발전을 위해서는 필연적으로 휘어지며 충전밀도가 높고, 폭발위험이 극히 적은 고성능 유연 고상배터리의 개발이 요구돼 왔다.
그러나 고효율 배터리를 만드는 소재 중 산화물 양극재료는 고온의 열처리가 필요하기 때문에 플라스틱 기판위에서는 구현할 수 없을 뿐만 아니라 고온 열처리 없이 분말 형태로 만들 경우에는 충전밀도가 매우 낮다는 문제점이 있었다.
이번에 개발한 고성능 유연 고상배터리는 리튬코발트산화물(LiCoO2) 양극재료를 운모 희생기판에서 4㎛(머리카락의 약 10분의 1 두께) 정도인 박막형태로 고온 성장시켜 만든 후, 기판으로 쓰인 딱딱한 희생기판을 제거해 얇은 배터리 부분만 남긴 후 유연한 기판위에 전사해 완성했다.
이 교수 연구팀이 개발에 성공한 유연 배터리는 휘어지더라도 전압이 3.9~4.2V로 거의 변하지 않고, 충·방전 10,000번(방전심도 80%) 정도의 안정적 작동과 함께 2200㎼h/㎤의 높은 에너지밀도(패키징 포함)를 지닌 게 큰 특징이다.
이번 연구를 주도한 구민 박사는 “충전밀도가 높은 박막형태의 고효율 유연 배터리는 완전한 형태의 유연 전자 제품를 만드는 데 획기적인 역할을 할 것”이라고 말했다.
이건재 교수 연구팀은 현재 대량생산을 위한 레이저 리프트 오프(Laser lift-off) 기술과 충전용량을 높이기 위해 삼차원으로 적층하는 후속 연구를 진행 중인데, 이들 연구가 끝나는 대로 상용화 수준의 유연 배터리가 나올 것으로 이 교수 연구팀은 예상하고 있다.
한편, 이번 연구결과는 지난 13일부터 일주일간 미국에서 열린 세계적인 국제학회인 국제광자공학회(SPIE)에서 이건재 교수가 기조강연으로 발표했으며, 국내외에서 다수의 특허를 등록하거나 출원했다.
<동영상 설명>http://www.youtube.com/watch?v=Sh-SkpCZ4AE&feature=player_embedded굽힘 상태에서 상용 블루 LED를 켜며 전압특성이 유지되는 유연 배터리 모습
그림1. 연구팀이 이번에 개발한 유연한 배터리와 기존의 휘어지는 OLED를 결합해 만든 최초의 완전한 플렉시블 디스플레이
그림2. 연구팀이 개발한 플렉시블 배터리와 결합된 디스플레이의 구조
그림3. 연구팀이 개발한 휘어지는 배터리가 LED를 켜고 있다. 휘어져도 전압이 떨어지지 않아 안정적이다.
그림4. 휘어지는 고효율 배터리 제작공정. (g)운모를 제거하고 나서 (h)폴리머 기판으로 옮긴 후 (i)폴리머로 감싸는 공정이 연구팀의 독자기술이다.
그림5. 이건재 교수 연구팀이 유연배터리를 희생기판에서 레이저로 제거하는 연구를 수행하고 있다.
휘어지는 고성능 배터리 제작기술 개발
- 플렉시블 OLED 디스플레이와 배터리의 완전 결합길 열려 -
휘어지는 디스플레이의 에너지원으로 반드시 필요한 고효율 유연 배터리를 KAIST 연구진이 세계 최초로 개발하는데 성공했다.
우리 학교 신소재공학과 이건재 교수팀이 유연한 고효율 배터리를 개발하는데 성공, 이 연구결과가 재료분야 세계적 학술지인 ‘나노 레터스(Nano Letters)’ 8월호 온라인판에 실렸으며, 미국 화학학회 뉴스레터인 C&EN(Chemical & Engineering News)에도 (8월 10일자) 특집으로 보도됐다.
얇고 가벼우면서도 유연한 디스플레이로의 혁신적인 기술 발전을 위해서는 필연적으로 휘어지며 충전밀도가 높고, 폭발위험이 극히 적은 고성능 유연 고상배터리의 개발이 요구돼 왔다.
그러나 고효율 배터리를 만드는 소재 중 산화물 양극재료는 고온의 열처리가 필요하기 때문에 플라스틱 기판위에서는 구현할 수 없을 뿐만 아니라 고온 열처리 없이 분말 형태로 만들 경우에는 충전밀도가 매우 낮다는 문제점이 있었다.
이번에 개발한 고성능 유연 고상배터리는 리튬코발트산화물(LiCoO2) 양극재료를 운모 희생기판에서 4㎛(머리카락의 약 10분의 1 두께) 정도인 박막형태로 고온 성장시켜 만든 후, 기판으로 쓰인 딱딱한 희생기판을 제거해 얇은 배터리 부분만 남긴 후 유연한 기판위에 전사해 완성했다.
이 교수 연구팀이 개발에 성공한 유연 배터리는 휘어지더라도 전압이 3.9~4.2V로 거의 변하지 않고, 충·방전 10,000번(방전심도 80%) 정도의 안정적 작동과 함께 2200㎼h/㎤의 높은 에너지밀도(패키징 포함)를 지닌 게 큰 특징이다.
이번 연구를 주도한 구민 박사는 “충전밀도가 높은 박막형태의 고효율 유연 배터리는 완전한 형태의 유연 전자 제품를 만드는 데 획기적인 역할을 할 것”이라고 말했다.
이건재 교수 연구팀은 현재 대량생산을 위한 레이저 리프트 오프(Laser lift-off) 기술과 충전용량을 높이기 위해 삼차원으로 적층하는 후속 연구를 진행 중인데, 이들 연구가 끝나는 대로 상용화 수준의 유연 배터리가 나올 것으로 이 교수 연구팀은 예상하고 있다.
한편, 이번 연구결과는 지난 13일부터 일주일간 미국에서 열린 세계적인 국제학회인 국제광자공학회(SPIE)에서 이건재 교수가 기조강연으로 발표했으며, 국내외에서 다수의 특허를 등록하거나 출원했다.
<동영상 설명>http://www.youtube.com/watch?v=Sh-SkpCZ4AE&feature=player_embedded굽힘 상태에서 상용 블루 LED를 켜며 전압특성이 유지되는 유연 배터리 모습
그림1. 연구팀이 이번에 개발한 유연한 배터리와 기존의 휘어지는 OLED를 결합해 만든 최초의 완전한 플렉시블 디스플레이
그림2. 연구팀이 개발한 플렉시블 배터리와 결합된 디스플레이의 구조
그림3. 연구팀이 개발한 휘어지는 배터리가 LED를 켜고 있다. 휘어져도 전압이 떨어지지 않아 안정적이다.
그림4. 휘어지는 고효율 배터리 제작공정. (g)운모를 제거하고 나서 (h)폴리머 기판으로 옮긴 후 (i)폴리머로 감싸는 공정이 연구팀의 독자기술이다.
그림5. 이건재 교수 연구팀이 유연배터리를 희생기판에서 레이저로 제거하는 연구를 수행하고 있다.
2012.08.21
조회수 19942
-
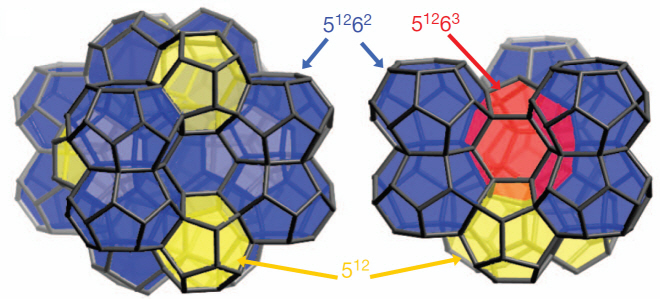 연성물질의 메조포러스 준결정 개발・분석 성공
오사무 테라사키 교수
- 네이처(Nature)지 7월 19일자 실려 -
메조포러스(mesoporous) 준결정(quaicrystal) 구조에 대한 의문이 우리 대학 연구진에 의해 보다 명확하게 풀렸다.
우리 학교 EEWS(책임교수 강정구) 대학원 소속 오사무 테라사키(Osamu Terasaki) 교수 연구팀이 불규칙적인 입자구조를 가지고 있는 준결정 메조포러스 실리카(quasicrystalline mesoporous silica) 합성에 성공하고 준결정 성장 과정을 분석하는 새로운 방법을 개발했다.
연구팀이 제시한 이론은 연성물질인 교질(micelles) 입자 형성 시 불규칙하게 나타나는 준결정 현상을 과학적으로 규명하는 토대를 만들었다. 세계적인 학술지 ‘네이처(Nature)’는 7월호(19일자)에 테라사키(Terasaki) 교수 연구팀의 논문을 게재했다.
과학자들은 그 동안 연성물질(solidified version of soft matter systems)에서 발견되는 메조포러스 준결정 구조를 체계적으로 설명하는데 많은 어려움을 겪어왔다. 하지만, 이번 연구를 통해 얻은 연성물질 내 준결정 성장에 대한 이론적인 근거는 앞으로 이 분야에 대한 연구를 촉진시켜 나노 구조를 가진 신소재 물질 개발에 박차를 가할 것으로 예측된다.
연성물질의 메조포러스 준결정은 높은 대칭균형(high symmetry)과 나노 스케일(nano scale)보다 더 큰 특성적 크기(large characteristic length scale)를 가지고 있어 광학적 특성을 자유자재로 조절할 수 있는 물질을 구현할 수 있다.
이를 활용하면 태양광을 사용하는 친환경적 에너지 저장 및 변환 기술 개발에 응용되어 지속가능한 에너지의 저장, 사용 및 재생산 기술 발전에 큰 도움을 줄 것으로 예상된다.
테라사키 교수 연구팀은 메조포러스 준결정 실리카 합성에 성공하고 투과전자현미경(Transmission Electron Microscopy)을 통해 실리카 입자 중앙에 12각형 기둥 모양의 순결정이 형성되어 있으며, 전자회절 무늬에서(electron diffraction pattern) 12각형의 회전대칭 무늬(rotational symmetry)가 순결정 주위에 형성되는 것을 증명하였다.
준결정(quasicrystal)은 준주기적 결정(quasiperiodic crystal)의 줄임말로서 금속 같은 일정한 규칙으로 배열된 결정 물질과 유리와 같은 비결정 물질의 중간 성질을 가지는 제 3의 고체(solid)로 최근 발견되었으며 2011년에는 노벨화학상이 이 분야 연구에 수여되기도 했다.
많은 양의 기공(porous)을 지닌 다공성 물질을 준결정으로 제조 하게 되면 기공들의 결정 구조를 ‘타일을 붙이듯(tiling)’ 원하는 방식대로 디자인 하고 성질을 조절하게 되어 다양한 분야에 필요한 새로운 소재를 개발하고 생산할 수 있게 된다.
테라사키 교수는 “높은 대칭성(high symmetry)을 가지는 준결정의 발견은 물질의 광학적 성질을 쉽게 조절해 가시광 영역대의 포토닉 크리스탈을 구현할 수 있다”며 “물질의 광학적 에너지 흡수를 조절 할 수 있는 이 기술은 향후 에너지 저장(energy harvesting)의 핵심기술이 될 수도 있을 것이다”라고 말했다.
이번 연구는 KAIST EEWS 대학원의 오사무 테라사키 교수와 스웨덴 스톡홀름(Stockholm University) 대학과 공동으로 수행되었다.(끝)
그림 1. 물질에서의 원자 배열 방법에 따라 구분되는 결정, 준결정과 비결정을 나타낸 모식도. 일반적으로는 원자가 일정한 패턴을 가지고 배열되어 있는 것을 결정, 그렇지 않은 것을 비결정이라고 하였으나, 준결정은 결정에서의 원자배열을 가지지는 않지만 정돈 되어 있는 구조이다. 투과전자현미경에서의 회절무늬를 보고 준결정을 판단할 수 있다.
그림 2. 메조포러스 실리카 준결정의 실제 모양과 원자 배열을 나타내는 투과전자현미경 이미지. 투과전자현미경으로부터 메조포러스 실리카가 12각형 기둥 모양을 하고 있음을 알 수 있으며(왼쪽 위의 이미지), 이는 투과전자현미경의 회절무늬에서도 나타난다(왼쪽 아래 이미지). 고배율의 투과전자현미경은 메조포러스 실리카의 실제 구조를 나타내고 있다(오른쪽).
그림 3. 메조포러스 실리카 준결정의 결정구조를 3차원 모델로 나타낸 모식도. 각각 다른 세 가지 다각형이 서로 정돈되어 결합해 메조포러스 준결정을 구성한다.
연성물질의 메조포러스 준결정 개발・분석 성공
오사무 테라사키 교수
- 네이처(Nature)지 7월 19일자 실려 -
메조포러스(mesoporous) 준결정(quaicrystal) 구조에 대한 의문이 우리 대학 연구진에 의해 보다 명확하게 풀렸다.
우리 학교 EEWS(책임교수 강정구) 대학원 소속 오사무 테라사키(Osamu Terasaki) 교수 연구팀이 불규칙적인 입자구조를 가지고 있는 준결정 메조포러스 실리카(quasicrystalline mesoporous silica) 합성에 성공하고 준결정 성장 과정을 분석하는 새로운 방법을 개발했다.
연구팀이 제시한 이론은 연성물질인 교질(micelles) 입자 형성 시 불규칙하게 나타나는 준결정 현상을 과학적으로 규명하는 토대를 만들었다. 세계적인 학술지 ‘네이처(Nature)’는 7월호(19일자)에 테라사키(Terasaki) 교수 연구팀의 논문을 게재했다.
과학자들은 그 동안 연성물질(solidified version of soft matter systems)에서 발견되는 메조포러스 준결정 구조를 체계적으로 설명하는데 많은 어려움을 겪어왔다. 하지만, 이번 연구를 통해 얻은 연성물질 내 준결정 성장에 대한 이론적인 근거는 앞으로 이 분야에 대한 연구를 촉진시켜 나노 구조를 가진 신소재 물질 개발에 박차를 가할 것으로 예측된다.
연성물질의 메조포러스 준결정은 높은 대칭균형(high symmetry)과 나노 스케일(nano scale)보다 더 큰 특성적 크기(large characteristic length scale)를 가지고 있어 광학적 특성을 자유자재로 조절할 수 있는 물질을 구현할 수 있다.
이를 활용하면 태양광을 사용하는 친환경적 에너지 저장 및 변환 기술 개발에 응용되어 지속가능한 에너지의 저장, 사용 및 재생산 기술 발전에 큰 도움을 줄 것으로 예상된다.
테라사키 교수 연구팀은 메조포러스 준결정 실리카 합성에 성공하고 투과전자현미경(Transmission Electron Microscopy)을 통해 실리카 입자 중앙에 12각형 기둥 모양의 순결정이 형성되어 있으며, 전자회절 무늬에서(electron diffraction pattern) 12각형의 회전대칭 무늬(rotational symmetry)가 순결정 주위에 형성되는 것을 증명하였다.
준결정(quasicrystal)은 준주기적 결정(quasiperiodic crystal)의 줄임말로서 금속 같은 일정한 규칙으로 배열된 결정 물질과 유리와 같은 비결정 물질의 중간 성질을 가지는 제 3의 고체(solid)로 최근 발견되었으며 2011년에는 노벨화학상이 이 분야 연구에 수여되기도 했다.
많은 양의 기공(porous)을 지닌 다공성 물질을 준결정으로 제조 하게 되면 기공들의 결정 구조를 ‘타일을 붙이듯(tiling)’ 원하는 방식대로 디자인 하고 성질을 조절하게 되어 다양한 분야에 필요한 새로운 소재를 개발하고 생산할 수 있게 된다.
테라사키 교수는 “높은 대칭성(high symmetry)을 가지는 준결정의 발견은 물질의 광학적 성질을 쉽게 조절해 가시광 영역대의 포토닉 크리스탈을 구현할 수 있다”며 “물질의 광학적 에너지 흡수를 조절 할 수 있는 이 기술은 향후 에너지 저장(energy harvesting)의 핵심기술이 될 수도 있을 것이다”라고 말했다.
이번 연구는 KAIST EEWS 대학원의 오사무 테라사키 교수와 스웨덴 스톡홀름(Stockholm University) 대학과 공동으로 수행되었다.(끝)
그림 1. 물질에서의 원자 배열 방법에 따라 구분되는 결정, 준결정과 비결정을 나타낸 모식도. 일반적으로는 원자가 일정한 패턴을 가지고 배열되어 있는 것을 결정, 그렇지 않은 것을 비결정이라고 하였으나, 준결정은 결정에서의 원자배열을 가지지는 않지만 정돈 되어 있는 구조이다. 투과전자현미경에서의 회절무늬를 보고 준결정을 판단할 수 있다.
그림 2. 메조포러스 실리카 준결정의 실제 모양과 원자 배열을 나타내는 투과전자현미경 이미지. 투과전자현미경으로부터 메조포러스 실리카가 12각형 기둥 모양을 하고 있음을 알 수 있으며(왼쪽 위의 이미지), 이는 투과전자현미경의 회절무늬에서도 나타난다(왼쪽 아래 이미지). 고배율의 투과전자현미경은 메조포러스 실리카의 실제 구조를 나타내고 있다(오른쪽).
그림 3. 메조포러스 실리카 준결정의 결정구조를 3차원 모델로 나타낸 모식도. 각각 다른 세 가지 다각형이 서로 정돈되어 결합해 메조포러스 준결정을 구성한다.
2012.07.24
조회수 22638
-
 시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12
조회수 26644
 양자점 기반 단파장 초고속 양자 광원 개발
- 나노 오벨리스크 구조 위에 양자점을 형성해 고효율 단광자 광원 개발 -- 단파장 가시광선 대역에서 작동하는 초고속 반도체 양자 광원 연구 -
우리 학교 물리학과 조용훈 교수팀은 오벨리스크 모양의 나노 구조물을 만들고 꼭대기 부분에 높은 신뢰도를 갖는 반도체 단일 양자점을 형성해 초고속 고효율 단광자 방출을 구현하는데 성공했다.
연구결과는 네이처(Nature)가 발행하는 "사이언티픽 리포트(Scientific Reports)" 7월 5일자 온라인판에 게재됐다.
반도체 양자점은 전자를 수 나노미터 크기에 3차원적으로 구속해 불연속적인 에너지 준위를 갖는 원자와 유사한 특성을 나타낸다. 이 성질을 이용하면 차세대 양자정보 통신, 양자 암호의 핵심 구성 요소인 양자광원을 개발할 수 있다.
특히, 반도체 양자점의 경우 높은 구동 온도, 안정성, 빠른 광자 방출, 전류 구동 가능성과 같은 많은 장점을 가지고 있어 차세대 핵심 기술 중 하나로 꼽히고 있다.
그러나 기존의 자발 형성 양자점의 경우, 평면 구조 안에 양자점들이 높은 밀도로 묻혀 있어 단일 양자점 하나의 특성을 파악하기 어렵고 광자 방출 효율이 매우 제한돼 있는 한계가 있다. 또 구성하는 층 사이의 응력으로 인한 내부 전기장 효과 때문에 전자와 정공 사이의 재결합이 어려워 내부 양자 효율이 낮은 문제가 있었다.조 교수 연구팀은 단파장의 빛을 내는 넓은 띠구조를 갖는 질화물 반도체를 이용해 오벨리스크 형태(뾰족한 팁 모양)의 나노 구조를 제작했다. 그 위에 얇은 활성층 구조를 다시 성장해 나노 팁 끝에 단일 양자점을 위치시키는데 성공해 스펙트럼 폭이 매우 작은 에너지 준위에서 발생하는 초고속 단광자 특성을 확인했다.
이 같은 독특한 나노 구조를 활용하면, 패터닝 등의 공정 없이도 단일 양자구조를 얻기가 쉽고, 양자점에서 생성된 빛이 외부로 쉽게 빠져나올 수 있다는 장점이 있다.
이와 함께 연구팀은 박막 형태와는 달리 오벨리스크 형태의 나노구조의 경우 응력을 크게 감소시켜 내부 전기장 효과도 상쇄돼 내부 양자 효율이 크게 증가하는 현상을 밝혔다.
이번에 개발된 양자광원은 발광파장이 기존 장파장 적외선 대역이 아닌 단파장 가시광(400nm) 대역이기 때문에 자유 공간에서의 통신에 사용이 가능하고 광자 검출 효율이 높은 가시광 대역의 검출기를 사용할 수 있다.
조용훈 교수는 “기존의 양자점 성장 방식과는 달리 비교적 쉽게 단일 양자점을 형성하여 제어할 수 있고, 이를 통해 매우 빠른 단일 광자 생성이 가능해 실용적인 양자광원 개발에 기여할 수 있을 것으로 기대된다”며 “오벨리스크 형태 나노구조의 특성 상 손쉽게 분리 및 다른 기판과의 결합이 가능해 단일 칩 양자 광소자 제작에도 활용될 수 있다”고 말했다.
KAIST 물리학과 조용훈 교수 지도아래 김제형(제1저자), 고영호(제2저자) 박사과정 학생이 주도적으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업 및 WCU 사업의 지원으로 수행됐다.
그림1. (왼쪽) 프랑스 파리에 위치한 오벨리스크 사진. (오른쪽) 제작된 오벨리스크형 나노 구조의 전자현미경 이미지.
그림2. (왼쪽) 오벨리스크형 나노구조와 기존 평면 박막 구조에 내재된 양자점을 비교한 개념도. (오른쪽) 오벨리스크 나노구조 끝에 형성된 단일 양자점에서 방출되는 좁은 선폭의 스펙트럼과 광원의 양자화 정도와 빠른 단광자 방출 속도를 나타내는 2차 광자 상관 관계 그래프.
2013.07.22 조회수 19974
양자점 기반 단파장 초고속 양자 광원 개발
- 나노 오벨리스크 구조 위에 양자점을 형성해 고효율 단광자 광원 개발 -- 단파장 가시광선 대역에서 작동하는 초고속 반도체 양자 광원 연구 -
우리 학교 물리학과 조용훈 교수팀은 오벨리스크 모양의 나노 구조물을 만들고 꼭대기 부분에 높은 신뢰도를 갖는 반도체 단일 양자점을 형성해 초고속 고효율 단광자 방출을 구현하는데 성공했다.
연구결과는 네이처(Nature)가 발행하는 "사이언티픽 리포트(Scientific Reports)" 7월 5일자 온라인판에 게재됐다.
반도체 양자점은 전자를 수 나노미터 크기에 3차원적으로 구속해 불연속적인 에너지 준위를 갖는 원자와 유사한 특성을 나타낸다. 이 성질을 이용하면 차세대 양자정보 통신, 양자 암호의 핵심 구성 요소인 양자광원을 개발할 수 있다.
특히, 반도체 양자점의 경우 높은 구동 온도, 안정성, 빠른 광자 방출, 전류 구동 가능성과 같은 많은 장점을 가지고 있어 차세대 핵심 기술 중 하나로 꼽히고 있다.
그러나 기존의 자발 형성 양자점의 경우, 평면 구조 안에 양자점들이 높은 밀도로 묻혀 있어 단일 양자점 하나의 특성을 파악하기 어렵고 광자 방출 효율이 매우 제한돼 있는 한계가 있다. 또 구성하는 층 사이의 응력으로 인한 내부 전기장 효과 때문에 전자와 정공 사이의 재결합이 어려워 내부 양자 효율이 낮은 문제가 있었다.조 교수 연구팀은 단파장의 빛을 내는 넓은 띠구조를 갖는 질화물 반도체를 이용해 오벨리스크 형태(뾰족한 팁 모양)의 나노 구조를 제작했다. 그 위에 얇은 활성층 구조를 다시 성장해 나노 팁 끝에 단일 양자점을 위치시키는데 성공해 스펙트럼 폭이 매우 작은 에너지 준위에서 발생하는 초고속 단광자 특성을 확인했다.
이 같은 독특한 나노 구조를 활용하면, 패터닝 등의 공정 없이도 단일 양자구조를 얻기가 쉽고, 양자점에서 생성된 빛이 외부로 쉽게 빠져나올 수 있다는 장점이 있다.
이와 함께 연구팀은 박막 형태와는 달리 오벨리스크 형태의 나노구조의 경우 응력을 크게 감소시켜 내부 전기장 효과도 상쇄돼 내부 양자 효율이 크게 증가하는 현상을 밝혔다.
이번에 개발된 양자광원은 발광파장이 기존 장파장 적외선 대역이 아닌 단파장 가시광(400nm) 대역이기 때문에 자유 공간에서의 통신에 사용이 가능하고 광자 검출 효율이 높은 가시광 대역의 검출기를 사용할 수 있다.
조용훈 교수는 “기존의 양자점 성장 방식과는 달리 비교적 쉽게 단일 양자점을 형성하여 제어할 수 있고, 이를 통해 매우 빠른 단일 광자 생성이 가능해 실용적인 양자광원 개발에 기여할 수 있을 것으로 기대된다”며 “오벨리스크 형태 나노구조의 특성 상 손쉽게 분리 및 다른 기판과의 결합이 가능해 단일 칩 양자 광소자 제작에도 활용될 수 있다”고 말했다.
KAIST 물리학과 조용훈 교수 지도아래 김제형(제1저자), 고영호(제2저자) 박사과정 학생이 주도적으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업 및 WCU 사업의 지원으로 수행됐다.
그림1. (왼쪽) 프랑스 파리에 위치한 오벨리스크 사진. (오른쪽) 제작된 오벨리스크형 나노 구조의 전자현미경 이미지.
그림2. (왼쪽) 오벨리스크형 나노구조와 기존 평면 박막 구조에 내재된 양자점을 비교한 개념도. (오른쪽) 오벨리스크 나노구조 끝에 형성된 단일 양자점에서 방출되는 좁은 선폭의 스펙트럼과 광원의 양자화 정도와 빠른 단광자 방출 속도를 나타내는 2차 광자 상관 관계 그래프.
2013.07.22 조회수 19974 손상된 DNA의 돌연변이 유발 메커니즘 규명
- DNA 손상을 용인하는 특수 복제효소 Rev1의 조절 메커니즘 밝혀 -- “암 치료 및 예방에 크게 기여할 것” -
우리 학교 화학과 최병석 교수는 생체정보를 저장하는 DNA가 손상돼 회복하고 복제하는 과정에서 돌연변이가 발생하는 메커니즘을 규명했다.
연구결과는 분자세포생물학분야 세계적 학술지 ‘분자세포생물학(Journal of Molecular Cell Biology)’ 6월호 표지논문으로 실렸다.
산업의 급격한 발전으로 현대인들의 유전자는 예전에 비해 훨씬 다양하게 위협받고 있다. 오존층의 파괴로 인해 자외선에 그대로 노출되는 것은 물론 담배연기를 비롯한 수많은 발암물질의 공격은 우리 몸속의 DNA를 손상시킨다.
하루에도 수 만 번 끊임없이 일어나는 DNA의 손상을 효과적으로 회복시켜주지 못하면 암 등 치명적인 질병이 발생한다.
손상된 DNA가 회복반응에 의해 복구되지 않은 상태에서 자기복제가 일어나면 정상적인 복제를 담당하는 폴리머라제는 손상부위에 도달하면 DNA 합성을 정지하게 되고 세포의 죽음을 초래 한다.
인체는 이 같은 비상사태를 맞이해 복제담당 폴리머라제를 잠깐 쉬게 하고 손상된 DNA 부위를 그냥 지나치는 능력이 있는 특수한 복구담당 폴리머라제들을 동원해 손상부위를 통과하고 DNA 합성을 다시 시작한다.
이때 DNA는 많은 오류가 발생돼 심각한 돌연변이를 유발시킨다. 즉, 열악한 상황에 놓인 세포가 복제를 진행하지 못해 죽음을 맞기 보다는 생존을 위해 매우 부정확한 DNA 복제일지라도 선수를 교체하면서까지 복제를 진행하게 된다.
지금까지 학계에서는 Rev1 단백질이 이러한 과정을 조절할 것이라고 추정해 왔지만 그 구조와 기능은 명확하게 밝혀내지 못했다.
연구팀은 핵자기공명 분광법(NMR)과 X-ray를 이용해 DNA 복제과정에서 중추적인 역할을 하는 단백질(Polκ과 Rev1, Rev1과 Rev3/Rev7) 각각의 복합구조를 밝혀냈다.
이를 통해 ▲DNA가 손상 시 돌연변이가 유발되는 메커니즘 ▲DNA 복제효소간의 상호작용 ▲손상부위를 통과한 합성된 DNA가 더 연장되는 메커니즘을 분자수준에서 규명했다.
암의 직접적인 발병 원인이 DNA의 손상인 만큼 이에 대한 메커니즘을 밝혀내고 응용하면 개인별로 암의 원인을 제거할 수 있어 부작용 없는 맞춤형 항암제를 개발할 수 있을 것으로 전망된다.
최병석 교수는 이번 연구에 대해 “판코니 빈혈 환자들에게 암이 많이 발생되는 문제를 조사해보니 DNA복제 시 회복 기능이 고장 나 있더라”며 “손상된 DNA의 회복과 복제 과정에 대한 메커니즘 규명을 통해 암을 예방하고 치료하는데 크게 기여할 것”이라고 말했다.
이번 연구는 KAIST 화학과 최병석 교수와 류디난 박사의 주도로 수행됐고, KAIST 화학과 이지오 교수, 고준상 박사, 임경은 박사과정, 기초과학지원연구원 류경석 박사와 황정미 박사가 참여했다.
그림1. Polκ/Rev1/Rev7/Rev3 단백질 복합체 구조
그림2. Rev1, Polκ와 Rev7와 Rev3를 상호형질 주입된 세포의 공초점 현미경 영상
그림3. 논문표지
2013.06.03 조회수 20140
손상된 DNA의 돌연변이 유발 메커니즘 규명
- DNA 손상을 용인하는 특수 복제효소 Rev1의 조절 메커니즘 밝혀 -- “암 치료 및 예방에 크게 기여할 것” -
우리 학교 화학과 최병석 교수는 생체정보를 저장하는 DNA가 손상돼 회복하고 복제하는 과정에서 돌연변이가 발생하는 메커니즘을 규명했다.
연구결과는 분자세포생물학분야 세계적 학술지 ‘분자세포생물학(Journal of Molecular Cell Biology)’ 6월호 표지논문으로 실렸다.
산업의 급격한 발전으로 현대인들의 유전자는 예전에 비해 훨씬 다양하게 위협받고 있다. 오존층의 파괴로 인해 자외선에 그대로 노출되는 것은 물론 담배연기를 비롯한 수많은 발암물질의 공격은 우리 몸속의 DNA를 손상시킨다.
하루에도 수 만 번 끊임없이 일어나는 DNA의 손상을 효과적으로 회복시켜주지 못하면 암 등 치명적인 질병이 발생한다.
손상된 DNA가 회복반응에 의해 복구되지 않은 상태에서 자기복제가 일어나면 정상적인 복제를 담당하는 폴리머라제는 손상부위에 도달하면 DNA 합성을 정지하게 되고 세포의 죽음을 초래 한다.
인체는 이 같은 비상사태를 맞이해 복제담당 폴리머라제를 잠깐 쉬게 하고 손상된 DNA 부위를 그냥 지나치는 능력이 있는 특수한 복구담당 폴리머라제들을 동원해 손상부위를 통과하고 DNA 합성을 다시 시작한다.
이때 DNA는 많은 오류가 발생돼 심각한 돌연변이를 유발시킨다. 즉, 열악한 상황에 놓인 세포가 복제를 진행하지 못해 죽음을 맞기 보다는 생존을 위해 매우 부정확한 DNA 복제일지라도 선수를 교체하면서까지 복제를 진행하게 된다.
지금까지 학계에서는 Rev1 단백질이 이러한 과정을 조절할 것이라고 추정해 왔지만 그 구조와 기능은 명확하게 밝혀내지 못했다.
연구팀은 핵자기공명 분광법(NMR)과 X-ray를 이용해 DNA 복제과정에서 중추적인 역할을 하는 단백질(Polκ과 Rev1, Rev1과 Rev3/Rev7) 각각의 복합구조를 밝혀냈다.
이를 통해 ▲DNA가 손상 시 돌연변이가 유발되는 메커니즘 ▲DNA 복제효소간의 상호작용 ▲손상부위를 통과한 합성된 DNA가 더 연장되는 메커니즘을 분자수준에서 규명했다.
암의 직접적인 발병 원인이 DNA의 손상인 만큼 이에 대한 메커니즘을 밝혀내고 응용하면 개인별로 암의 원인을 제거할 수 있어 부작용 없는 맞춤형 항암제를 개발할 수 있을 것으로 전망된다.
최병석 교수는 이번 연구에 대해 “판코니 빈혈 환자들에게 암이 많이 발생되는 문제를 조사해보니 DNA복제 시 회복 기능이 고장 나 있더라”며 “손상된 DNA의 회복과 복제 과정에 대한 메커니즘 규명을 통해 암을 예방하고 치료하는데 크게 기여할 것”이라고 말했다.
이번 연구는 KAIST 화학과 최병석 교수와 류디난 박사의 주도로 수행됐고, KAIST 화학과 이지오 교수, 고준상 박사, 임경은 박사과정, 기초과학지원연구원 류경석 박사와 황정미 박사가 참여했다.
그림1. Polκ/Rev1/Rev7/Rev3 단백질 복합체 구조
그림2. Rev1, Polκ와 Rev7와 Rev3를 상호형질 주입된 세포의 공초점 현미경 영상
그림3. 논문표지
2013.06.03 조회수 20140 호흡 분석해 질병 진단한다!
- 나노섬유 형상 120ppb급 당뇨병 진단센서 개발 -- 음주 측정하듯 후~ 불면 질병 진단할 수 있어 -
우리 학교 신소재공학과 김일두 교수 연구팀이 인간이 호흡하면서 배출하는 아세톤 가스를 분석해 당뇨병 여부를 파악할 수 있는 날숨진단센서를 개발했다.
연구 결과는 신소재 응용분야 세계적 학술지 ‘어드밴스드 펑셔널 머티리얼스(Advanced Functional Materials)’ 5월 20일자 표지논문으로 게재됐다.
인간이 숨을 쉬면서 내뿜는 아세톤, 톨루엔, 일산화질소 및 암모니아와 같은 휘발성 유기화합물 가스는 각각 당뇨병, 폐암, 천식 및 신장병의 생체표식인자(바이오마커)로 알려져 있다.
당뇨병의 경우 일반적으로 정상인은 900ppb(parts per billion), 당뇨환자는 1800ppb의 아세톤 가스를 날숨으로 내뿜는다. 따라서 날숨 속 아세톤 가스의 농도 차이를 정밀하게 분석하면 당뇨병을 조기에 진단할 수 있고 발병 후 관리를 쉽게 할 수 있다.
연구팀은 얇은 껍질이 겹겹이 둘러싸인 다공성 산화주석(SnO2) 센서소재에 백금 나노입자 촉매가 균일하게 도포된 1차원 나노섬유를 대량 제조하는 기술을 개발했다. 이 소재의 표면에 아세톤 가스가 흡착될 때 전기저항 값이 변화하는 120ppb급 아세톤 농도 검출용 센서에 적용해 날숨진단센서를 개발했다. 개발한 나노섬유 센서는 1000ppb급 아세톤 농도에서 소재의 저항 값이 최대 6배 증가해 당뇨병을 진단할 수 있음이 입증됐다.
이와 함께 7.6초의 매우 빠른 아세톤 센서 반응속도를 나타내 실시간 모니터링이 가능해져 상용화에 대한 기대를 높였으며, 전기방사 기술로 제조해 나노섬유형상을 쉽게 빠르게 대량생산할 수 있는 게 큰 장점이다.
연구팀이 개발한 날숨진단센서는 사람의 호흡가스 속에 포함된 다양한 휘발성 유기화합물의 농도를 정밀하게 분석할 수 있다. 따라서 당뇨병은 물론 향후 폐암, 신장병 등의 질병을 조기에 진단하는데 활용될 수 있을 것으로 기대된다.
김일두 교수는 이번 연구에 대해 “ppb급 농도의 날숨 휘발성 유기화합물 가스를 실시간으로 정밀하게 진단하는 나노섬유 센서를 당뇨병 또는 폐암 진단용 감지소재로 이용하면 다양한 질병을 조기에 검출하고 관리하는 일이 가능해질 것”이라고 말했다.
김 교수는 향후 다양한 촉매와 금속산화물 나노섬유의 조합을 통해 많은 종류의 날숨가스를 동시에 정확하게 진단하는 센서 어레이(array)를 개발해 상용화를 앞당길 계획이다.
미래창조과학부 글로벌프린티어사업 스마트 IT 융합시스템 연구단의 지원을 받은 이번 연구는 KAIST 신소재공학과 신정우 학부생(2월 졸업), 최선진 박사과정 학생, 박종욱 교수, 고려대학교 신소재공학과 이종흔 교수가 참여했다.
그림1. 날숨진단센서 어레이(우측)와 날숨진단센서 크기 비교(좌측 상단)
그림2. 나노섬유 센서들이 어레이로 구성된 당뇨진단 센서 이미지
그림3. 날숨 가스들을 분석하는 질병진단 분석기의 소형화 및 실시간 분석
그림4. 주석산화물 나노섬유를 이용한 당뇨진단 센서 이미지
2013.05.30 조회수 25227
호흡 분석해 질병 진단한다!
- 나노섬유 형상 120ppb급 당뇨병 진단센서 개발 -- 음주 측정하듯 후~ 불면 질병 진단할 수 있어 -
우리 학교 신소재공학과 김일두 교수 연구팀이 인간이 호흡하면서 배출하는 아세톤 가스를 분석해 당뇨병 여부를 파악할 수 있는 날숨진단센서를 개발했다.
연구 결과는 신소재 응용분야 세계적 학술지 ‘어드밴스드 펑셔널 머티리얼스(Advanced Functional Materials)’ 5월 20일자 표지논문으로 게재됐다.
인간이 숨을 쉬면서 내뿜는 아세톤, 톨루엔, 일산화질소 및 암모니아와 같은 휘발성 유기화합물 가스는 각각 당뇨병, 폐암, 천식 및 신장병의 생체표식인자(바이오마커)로 알려져 있다.
당뇨병의 경우 일반적으로 정상인은 900ppb(parts per billion), 당뇨환자는 1800ppb의 아세톤 가스를 날숨으로 내뿜는다. 따라서 날숨 속 아세톤 가스의 농도 차이를 정밀하게 분석하면 당뇨병을 조기에 진단할 수 있고 발병 후 관리를 쉽게 할 수 있다.
연구팀은 얇은 껍질이 겹겹이 둘러싸인 다공성 산화주석(SnO2) 센서소재에 백금 나노입자 촉매가 균일하게 도포된 1차원 나노섬유를 대량 제조하는 기술을 개발했다. 이 소재의 표면에 아세톤 가스가 흡착될 때 전기저항 값이 변화하는 120ppb급 아세톤 농도 검출용 센서에 적용해 날숨진단센서를 개발했다. 개발한 나노섬유 센서는 1000ppb급 아세톤 농도에서 소재의 저항 값이 최대 6배 증가해 당뇨병을 진단할 수 있음이 입증됐다.
이와 함께 7.6초의 매우 빠른 아세톤 센서 반응속도를 나타내 실시간 모니터링이 가능해져 상용화에 대한 기대를 높였으며, 전기방사 기술로 제조해 나노섬유형상을 쉽게 빠르게 대량생산할 수 있는 게 큰 장점이다.
연구팀이 개발한 날숨진단센서는 사람의 호흡가스 속에 포함된 다양한 휘발성 유기화합물의 농도를 정밀하게 분석할 수 있다. 따라서 당뇨병은 물론 향후 폐암, 신장병 등의 질병을 조기에 진단하는데 활용될 수 있을 것으로 기대된다.
김일두 교수는 이번 연구에 대해 “ppb급 농도의 날숨 휘발성 유기화합물 가스를 실시간으로 정밀하게 진단하는 나노섬유 센서를 당뇨병 또는 폐암 진단용 감지소재로 이용하면 다양한 질병을 조기에 검출하고 관리하는 일이 가능해질 것”이라고 말했다.
김 교수는 향후 다양한 촉매와 금속산화물 나노섬유의 조합을 통해 많은 종류의 날숨가스를 동시에 정확하게 진단하는 센서 어레이(array)를 개발해 상용화를 앞당길 계획이다.
미래창조과학부 글로벌프린티어사업 스마트 IT 융합시스템 연구단의 지원을 받은 이번 연구는 KAIST 신소재공학과 신정우 학부생(2월 졸업), 최선진 박사과정 학생, 박종욱 교수, 고려대학교 신소재공학과 이종흔 교수가 참여했다.
그림1. 날숨진단센서 어레이(우측)와 날숨진단센서 크기 비교(좌측 상단)
그림2. 나노섬유 센서들이 어레이로 구성된 당뇨진단 센서 이미지
그림3. 날숨 가스들을 분석하는 질병진단 분석기의 소형화 및 실시간 분석
그림4. 주석산화물 나노섬유를 이용한 당뇨진단 센서 이미지
2013.05.30 조회수 25227 깨지지 않는 스마트폰 화면 나온다!
- 유리섬유직물 적용한 고강도 플라스틱 디스플레이 기판 개발 -
- “기존 유리 기판 대체 가능해 일대 혁신 가져올 것” -
깨지지 않는 핸드폰 화면을 구현하고, 대화면 TV의 무거운 유리 기판 대신 가벼운 플라스틱 필름을 사용할 수 있는 길이 열렸다.
KAIST IT융합연구소 윤춘섭 교수(물리학과) 연구팀이 깨지기 쉬운 디스플레이 유리 기판을 대체할 수 있는 고강도 플라스틱 기판 원천기술을 개발했다.
윤 교수팀이 유리섬유직물을 무색투명 폴리이미드 필름에 함침시켜 만든 플라스틱 기판은 고내열, 고투명, 고유연, 고내화학, 고인장강도 특성을 갖고 있다. 소재는 플라스틱 필름의 장점인 유연성을 갖고 있으면서도 인장강도는 일반 유리보다 세 배 크고 강화유리와 비슷하다. 또 유리처럼 무색투명하고, 450℃까지 내열성을 가지며, 열팽창률은 기존 플라스틱 열팽창률의 10∼20%에 불과하다.
유리 기판은 표면이 매끄러울 뿐만 아니라 디스플레이 기판의 조건인 고내열, 고투명, 고내화학, 고인장강도 특성을 모두 가지고 있어 지금까지 핸드폰 화면, TV, 컴퓨터 모니터 등 거의 모든 디스플레이에 사용돼 왔다. 그러나 유리 기판은 무겁고 깨지기 쉬운 단점이 있어 최근 유리 기판을 대체할 목적으로 열적, 화학적 안정성이 우수한 플라스틱 재질의 무색투명 폴리이미드 필름이 활발하게 연구되고 있다.
그러나 무색투명 폴리이미드 필름은 내열성 및 기계적 강도가 충분하지 못하기 때문에 이를 보강하기 위해 유리섬유직물을 폴리이미드 필름에 함침시키면 필름의 표면 거칠기 및 광 투과도 조건이 악화되는 문제가 발생해 실용화되지 못하고 있다. 이는 유리섬유직물을 폴리이미드 전구체 용액에 함침시킬 때 용매가 증발하며 0.4µm(마이크로미터) 내외의 표면 거칠기가 발생하고, 무색투명 폴리이미드 필름과 유리섬유직물의 굴절률 불일치로 인한 광 산란이 심하게 발생하기 때문이다.
윤 교수팀은 투명 폴리이미드 필름의 굴절률을 유리섬유직물의 굴절률과 소수 네 자리까지 일치시키는 방법과, 필름의 표면 거칠기를 수 nm 수준으로 평탄화 시키는 핵심기술을 개발해 이 문제를 해결했다. 그 결과 110µm 두께의 유리섬유직물 함침 무색투명 폴리이미드 필름 기판에서 11ppm/℃의 열팽창률, 0.9nm의 표면 거칠기, 250MPa의 인장강도, 2mm의 굽힘곡률반경, 90%의 광 투과도를 달성했다.
윤춘섭 교수는 “개발된 기판은 기존 디스플레이의 유리 기판을 대체할 수 있고, 플렉서블 디스플레이 기판으로도 사용할 수 있다”며 “핸드폰 화면이 깨지는 문제점을 근본적으로 해결하고, 대면적 TV의 무게 및 두께를 획기적으로 줄일 수 있으며, 디스플레이 생산에 롤투롤 공정을 적용할 수 있어 디스플레이 산업에 일대 혁신을 가져올 수 있을 것”이라고 전망했다.
한편, 2008년부터 5년간 지식경제부의 ‘모바일 플렉시블 입출력 플랫폼 개발사업’의 지원으로 개발된 이 기술은 총 3건의 특허출원을 마치고 관련기업과 기술 이전을 협의 중이다.
그림1. 유리섬유직물의 굴절률이 무색투명 폴리이미드 필름의 굴절률과 일치된 경우의 필름 투명도(좌측)와 일치되지 않는 경우(우측). 좌측의 글자는 선명하게 보이는 반면 우측의 글자는 뿌옇게 보인다.
그림2. 개발한 유리직물섬유 사진
2013.05.14 조회수 20046
깨지지 않는 스마트폰 화면 나온다!
- 유리섬유직물 적용한 고강도 플라스틱 디스플레이 기판 개발 -
- “기존 유리 기판 대체 가능해 일대 혁신 가져올 것” -
깨지지 않는 핸드폰 화면을 구현하고, 대화면 TV의 무거운 유리 기판 대신 가벼운 플라스틱 필름을 사용할 수 있는 길이 열렸다.
KAIST IT융합연구소 윤춘섭 교수(물리학과) 연구팀이 깨지기 쉬운 디스플레이 유리 기판을 대체할 수 있는 고강도 플라스틱 기판 원천기술을 개발했다.
윤 교수팀이 유리섬유직물을 무색투명 폴리이미드 필름에 함침시켜 만든 플라스틱 기판은 고내열, 고투명, 고유연, 고내화학, 고인장강도 특성을 갖고 있다. 소재는 플라스틱 필름의 장점인 유연성을 갖고 있으면서도 인장강도는 일반 유리보다 세 배 크고 강화유리와 비슷하다. 또 유리처럼 무색투명하고, 450℃까지 내열성을 가지며, 열팽창률은 기존 플라스틱 열팽창률의 10∼20%에 불과하다.
유리 기판은 표면이 매끄러울 뿐만 아니라 디스플레이 기판의 조건인 고내열, 고투명, 고내화학, 고인장강도 특성을 모두 가지고 있어 지금까지 핸드폰 화면, TV, 컴퓨터 모니터 등 거의 모든 디스플레이에 사용돼 왔다. 그러나 유리 기판은 무겁고 깨지기 쉬운 단점이 있어 최근 유리 기판을 대체할 목적으로 열적, 화학적 안정성이 우수한 플라스틱 재질의 무색투명 폴리이미드 필름이 활발하게 연구되고 있다.
그러나 무색투명 폴리이미드 필름은 내열성 및 기계적 강도가 충분하지 못하기 때문에 이를 보강하기 위해 유리섬유직물을 폴리이미드 필름에 함침시키면 필름의 표면 거칠기 및 광 투과도 조건이 악화되는 문제가 발생해 실용화되지 못하고 있다. 이는 유리섬유직물을 폴리이미드 전구체 용액에 함침시킬 때 용매가 증발하며 0.4µm(마이크로미터) 내외의 표면 거칠기가 발생하고, 무색투명 폴리이미드 필름과 유리섬유직물의 굴절률 불일치로 인한 광 산란이 심하게 발생하기 때문이다.
윤 교수팀은 투명 폴리이미드 필름의 굴절률을 유리섬유직물의 굴절률과 소수 네 자리까지 일치시키는 방법과, 필름의 표면 거칠기를 수 nm 수준으로 평탄화 시키는 핵심기술을 개발해 이 문제를 해결했다. 그 결과 110µm 두께의 유리섬유직물 함침 무색투명 폴리이미드 필름 기판에서 11ppm/℃의 열팽창률, 0.9nm의 표면 거칠기, 250MPa의 인장강도, 2mm의 굽힘곡률반경, 90%의 광 투과도를 달성했다.
윤춘섭 교수는 “개발된 기판은 기존 디스플레이의 유리 기판을 대체할 수 있고, 플렉서블 디스플레이 기판으로도 사용할 수 있다”며 “핸드폰 화면이 깨지는 문제점을 근본적으로 해결하고, 대면적 TV의 무게 및 두께를 획기적으로 줄일 수 있으며, 디스플레이 생산에 롤투롤 공정을 적용할 수 있어 디스플레이 산업에 일대 혁신을 가져올 수 있을 것”이라고 전망했다.
한편, 2008년부터 5년간 지식경제부의 ‘모바일 플렉시블 입출력 플랫폼 개발사업’의 지원으로 개발된 이 기술은 총 3건의 특허출원을 마치고 관련기업과 기술 이전을 협의 중이다.
그림1. 유리섬유직물의 굴절률이 무색투명 폴리이미드 필름의 굴절률과 일치된 경우의 필름 투명도(좌측)와 일치되지 않는 경우(우측). 좌측의 글자는 선명하게 보이는 반면 우측의 글자는 뿌옇게 보인다.
그림2. 개발한 유리직물섬유 사진
2013.05.14 조회수 20046 휘어지는 대용량 반도체 원천기술 개발
- KAIST 김상욱 교수, 세계 최고의‘분자조립’기술력 활용해 휘어지는 대용량 반도체 원천기술 확보 -
우리 학교 신소재공학과 김상욱 교수 연구팀이 원하는 형태로 분자가 스스로 배열하는 ‘분자조립’ 기술을 활용해 유연한 그래핀 기판 위에 양산중인 반도체 패턴의 최고 수준인 20nm(나노미터)급 초미세 패턴을 구현하는데 성공했다.
이번 기술 개발로 향후 유연하게 휘어지면서도 많은 양의 데이터를 저장할 수 있는 반도체를 구현할 수 있어 고성능 플렉시블 전자기기 개발에 도움이 될 것으로 학계는 기대하고 있다.
이와 함께 연성소재의 특성을 이용해 초미세 패턴을 형성하기 어려운 3차원 굴곡진 기판에서도 자유롭게 구현하는데 성공, 다양한 응용소자에 활용할 수 있는 것은 물론 화학 반응으로 물질을 섞어주기만 하면 원하는 형태로 스스로 배열해 고가의 장비가 필요하지 않아 반도체 제작비용이 훨씬 저렴해질 것으로 전망된다.
이번 연구의 핵심 기술인 ‘분자조립’이란 플라스틱, 액정, 생체분자 등과 같이 딱딱하지 않고 유연한 연성소재의 고분자를 원하는 형태로 스스로 배열하게 해 기존에 만들기 어려웠던 작은 나노구조물을 효율적으로 만드는 기술이다. 마치 물과 기름이 서로 섞이지 않는 것과 같이 서로 다른 두 고분자가 상분리되어 섞이지 않는다는 점을 이용하는 것이다.
연구팀은 기계적 물성이 우수하고 원하는 기판에 쉽게 옮길 수 있는 그래핀 위에 ‘블록공중합체’라는 분자조립기술을 통해 초미세 패턴을 형성한 후, 이를 3차원 기판 혹은 PET(폴리에틸렌테레프탈레이트), PDMS(폴리디멜틸실론산) 등과 같은 플렉시블 기판에 옮겨 자유롭게 3차원 혹은 플렉시블 기판에 구조물을 구현했다.
김상욱 교수는 이번 연구에 대해 “지금까지 발표된 휘어지는 반도체는 온도에 취약한 플라스틱 기판을 사용해 극한 공정조건을 극복해낼 수 없어 상용화에 어려움이 많았다”며 “이번 기술은 기계적 물성이 우수한 그래핀을 회로 기판으로 적용하는 데 성공한 획기적인 연구성과”라고 말했다.
김 교수는 이어 “이번 연구에 대해 세계적으로 많은 관심을 받아 3월 20일 열리는 미국 물리학회에서 초청 강연을 할 예정”이라며 “이번에 개발한 원천기술을 바탕으로 후속 연구를 진행해 반도체 회로와 같이 복잡한 회로의 설계에 도전할 것”이라고 포부를 밝혔다.
한편, 교육과학기술부 글로벌프론티어사업 다차원 스마트 IT 융합시스템 연구단의 지원을 받아 수행된 이번 연구결과는 재료분야 세계적 학술지 ‘어드밴스드 머터리얼스(Advanced Materials)’ 3월 6일자에 실렸다.
그림1. 제작공정
1. 스핀 코딩이라는 도포법을 사용해 그래핀 박막을 형성
2. 그래핀 박막 위에 블록공중합체를 형성
3. 블록공중합체을 식각 또는 패턴 전사법을 통해 나노 구조를 형성4. 그래핀을 전사층으로 활용해 다양한 기판에 나노 구조를 형성
그림2. 블록공중합체 분자조립기술
블록공중합체 분자조립기술은 물과 기름이 서로 섞이지 않은 것과 같이 서로 다른 두 고분자가 섞이지 않는다는 점을 이용한 기술이다. 물과 기름의 경우, 서로 섞이려고 하지 않는 물질이기 때문에, 물과 기름은 혼합하게 되면, 물을 물끼리 어울려 덩어리 지고, 기름은 기름끼리 어물려 덩어리가 지게 된다. 하지만, 물과 기름이 서로 떨어질 수 없게끔 결합이 되어 있다고 가정하면, 다른 현상이 예상된다. 동일하게 물은 물끼리 있으려 하고 기름은 기름끼리 있으려고 하지만, 물 옆에는 결합된 기름이 있게 된다. 따라서 물과 기름의 거대한 두 덩이리가 형성되는 것이 아니라, 매우 미세하게 물과 기름이 번갈아가면서 형성되게 된다. 동일하게 블록공중합체에서는 화학적으로 서로 다른 고분자가 공유 결합이라는 쉽게 깨지지 않은 결합을 통해 연결되어 있다., 따라서, 결합된 물과 기름에서와 동일하게 미세한 크기의 상분리가 일어나게 된다. 이러한 구조의 크기는 대개 고분자의 크기에 의해 결정되면, 머리카락 크기의 1/10000 수준으로 매우 미세하며 주기적인 패턴을 형성하게 된다. 패턴의 형태는 서로 다른 고분자의 비율에 따라 구, 원통형, 판형 등으로 나타난다.
그림3. 플렉시블 기판 상에 옮겨진 금 나노 구조체
2013.03.12 조회수 18814
휘어지는 대용량 반도체 원천기술 개발
- KAIST 김상욱 교수, 세계 최고의‘분자조립’기술력 활용해 휘어지는 대용량 반도체 원천기술 확보 -
우리 학교 신소재공학과 김상욱 교수 연구팀이 원하는 형태로 분자가 스스로 배열하는 ‘분자조립’ 기술을 활용해 유연한 그래핀 기판 위에 양산중인 반도체 패턴의 최고 수준인 20nm(나노미터)급 초미세 패턴을 구현하는데 성공했다.
이번 기술 개발로 향후 유연하게 휘어지면서도 많은 양의 데이터를 저장할 수 있는 반도체를 구현할 수 있어 고성능 플렉시블 전자기기 개발에 도움이 될 것으로 학계는 기대하고 있다.
이와 함께 연성소재의 특성을 이용해 초미세 패턴을 형성하기 어려운 3차원 굴곡진 기판에서도 자유롭게 구현하는데 성공, 다양한 응용소자에 활용할 수 있는 것은 물론 화학 반응으로 물질을 섞어주기만 하면 원하는 형태로 스스로 배열해 고가의 장비가 필요하지 않아 반도체 제작비용이 훨씬 저렴해질 것으로 전망된다.
이번 연구의 핵심 기술인 ‘분자조립’이란 플라스틱, 액정, 생체분자 등과 같이 딱딱하지 않고 유연한 연성소재의 고분자를 원하는 형태로 스스로 배열하게 해 기존에 만들기 어려웠던 작은 나노구조물을 효율적으로 만드는 기술이다. 마치 물과 기름이 서로 섞이지 않는 것과 같이 서로 다른 두 고분자가 상분리되어 섞이지 않는다는 점을 이용하는 것이다.
연구팀은 기계적 물성이 우수하고 원하는 기판에 쉽게 옮길 수 있는 그래핀 위에 ‘블록공중합체’라는 분자조립기술을 통해 초미세 패턴을 형성한 후, 이를 3차원 기판 혹은 PET(폴리에틸렌테레프탈레이트), PDMS(폴리디멜틸실론산) 등과 같은 플렉시블 기판에 옮겨 자유롭게 3차원 혹은 플렉시블 기판에 구조물을 구현했다.
김상욱 교수는 이번 연구에 대해 “지금까지 발표된 휘어지는 반도체는 온도에 취약한 플라스틱 기판을 사용해 극한 공정조건을 극복해낼 수 없어 상용화에 어려움이 많았다”며 “이번 기술은 기계적 물성이 우수한 그래핀을 회로 기판으로 적용하는 데 성공한 획기적인 연구성과”라고 말했다.
김 교수는 이어 “이번 연구에 대해 세계적으로 많은 관심을 받아 3월 20일 열리는 미국 물리학회에서 초청 강연을 할 예정”이라며 “이번에 개발한 원천기술을 바탕으로 후속 연구를 진행해 반도체 회로와 같이 복잡한 회로의 설계에 도전할 것”이라고 포부를 밝혔다.
한편, 교육과학기술부 글로벌프론티어사업 다차원 스마트 IT 융합시스템 연구단의 지원을 받아 수행된 이번 연구결과는 재료분야 세계적 학술지 ‘어드밴스드 머터리얼스(Advanced Materials)’ 3월 6일자에 실렸다.
그림1. 제작공정
1. 스핀 코딩이라는 도포법을 사용해 그래핀 박막을 형성
2. 그래핀 박막 위에 블록공중합체를 형성
3. 블록공중합체을 식각 또는 패턴 전사법을 통해 나노 구조를 형성4. 그래핀을 전사층으로 활용해 다양한 기판에 나노 구조를 형성
그림2. 블록공중합체 분자조립기술
블록공중합체 분자조립기술은 물과 기름이 서로 섞이지 않은 것과 같이 서로 다른 두 고분자가 섞이지 않는다는 점을 이용한 기술이다. 물과 기름의 경우, 서로 섞이려고 하지 않는 물질이기 때문에, 물과 기름은 혼합하게 되면, 물을 물끼리 어울려 덩어리 지고, 기름은 기름끼리 어물려 덩어리가 지게 된다. 하지만, 물과 기름이 서로 떨어질 수 없게끔 결합이 되어 있다고 가정하면, 다른 현상이 예상된다. 동일하게 물은 물끼리 있으려 하고 기름은 기름끼리 있으려고 하지만, 물 옆에는 결합된 기름이 있게 된다. 따라서 물과 기름의 거대한 두 덩이리가 형성되는 것이 아니라, 매우 미세하게 물과 기름이 번갈아가면서 형성되게 된다. 동일하게 블록공중합체에서는 화학적으로 서로 다른 고분자가 공유 결합이라는 쉽게 깨지지 않은 결합을 통해 연결되어 있다., 따라서, 결합된 물과 기름에서와 동일하게 미세한 크기의 상분리가 일어나게 된다. 이러한 구조의 크기는 대개 고분자의 크기에 의해 결정되면, 머리카락 크기의 1/10000 수준으로 매우 미세하며 주기적인 패턴을 형성하게 된다. 패턴의 형태는 서로 다른 고분자의 비율에 따라 구, 원통형, 판형 등으로 나타난다.
그림3. 플렉시블 기판 상에 옮겨진 금 나노 구조체
2013.03.12 조회수 18814 합성 조절 RNA를 이용한 세포공장 기술 개발
- 네이쳐 바이오테크놀로지 온라인판 게재.“화학 산업을 대체할 생물 산업 발전의 새로운 전략으로 기대” -
우리 학교 생명화학공학과 이상엽 특훈교수팀이 합성 조절 RNA 기술을 활용하여 세포공장*을 효율적이고 대규모로 구현하게 하는 새로운 기술을 개발했다. * 세포공장(Biofactory) : 세포의 유전자를 조작하여 원하는 화합물을 대량으로 생산하도록 만드는 미생물 기반의 생산 시스템
화석연료 고갈과 석유화학제품 사용에 의한 환경오염 등 인류가 직면한 문제를 해결하기 위해 친환경적이고 지속가능한 바이오산업이 대두되고 있으며 특히 바이오에너지, 의약품, 친환경 소재 등을 생산할 수 있는 세포공장 개발기술이 전 세계적으로 주목받고 있다.
우수한 세포공장 개발을 위해서는 원하는 화합물을 생산하는 유전자 선별과 높은 생산 효율의 미생물을 찾는 과정이 병행되어야 하나 기존의 연구방식은 미생물의 유전자를 하나씩 조작하여 복잡하고 많은 시간이 소요되는 문제가 있었다.
우리 학교 나도균 박사와 유승민 박사가 참여한 이상엽 특훈교수 연구팀은 위와 같은 기술적 한계를 극복하기 위해 합성 조절 RNA를 제작하고 이를 활용하는 새로운 기술을 개발하였다.
특히 합성 조절 RNA를 이용한 이 기술은 기존 방식과 달리 균주 특이성이 없어 수개월이 소요되던 실험을 수일로 단축시킬 수 있어 획기적이다.
연구팀은 합성 조절 RNA 기술을 활용하여 의약 화합물의 전구체로 사용되는 타이로신(tyrosine)*과 다양한 석유화학 제품에 활용되는 카다베린(cadaverine)** 생산에 도입하여 세계 최고의 수율로 생산(각 21.9g/L, 12.6g/L)하는 세포공장을 개발하는데 성공하였다.
* 타이로신(tyrosine) : 스트레스를 다스리고 집중력 향상 효과가 있는 아미노산 ** 카다베린(cadaverine) : 폴리우레탄 등 다양한 석유화학 제품에 활용되는 기반물질
이상엽 교수는 “합성 조절 RNA기술로 다양한 물질을 생산하는 세포공장 개발이 활발해 질 것이며 석유에너지로 대표되는 화학 산업이 바이오 산업으로 변해 가는데 촉매제 역할을 할 것으로 기대된다”라고 연구 의의를 밝혔다.“
이번 연구는 글로벌프론티어사업(지능형 바이오 시스템 설계 및 합성 연구단(단장 김선창))의 지원으로 수행되었으며 연구결과는 세계적 학술지인 네이처 바이오테크놀로지 온라인 판에 1월 20일 게재되었다.
2013.01.21 조회수 19543
합성 조절 RNA를 이용한 세포공장 기술 개발
- 네이쳐 바이오테크놀로지 온라인판 게재.“화학 산업을 대체할 생물 산업 발전의 새로운 전략으로 기대” -
우리 학교 생명화학공학과 이상엽 특훈교수팀이 합성 조절 RNA 기술을 활용하여 세포공장*을 효율적이고 대규모로 구현하게 하는 새로운 기술을 개발했다. * 세포공장(Biofactory) : 세포의 유전자를 조작하여 원하는 화합물을 대량으로 생산하도록 만드는 미생물 기반의 생산 시스템
화석연료 고갈과 석유화학제품 사용에 의한 환경오염 등 인류가 직면한 문제를 해결하기 위해 친환경적이고 지속가능한 바이오산업이 대두되고 있으며 특히 바이오에너지, 의약품, 친환경 소재 등을 생산할 수 있는 세포공장 개발기술이 전 세계적으로 주목받고 있다.
우수한 세포공장 개발을 위해서는 원하는 화합물을 생산하는 유전자 선별과 높은 생산 효율의 미생물을 찾는 과정이 병행되어야 하나 기존의 연구방식은 미생물의 유전자를 하나씩 조작하여 복잡하고 많은 시간이 소요되는 문제가 있었다.
우리 학교 나도균 박사와 유승민 박사가 참여한 이상엽 특훈교수 연구팀은 위와 같은 기술적 한계를 극복하기 위해 합성 조절 RNA를 제작하고 이를 활용하는 새로운 기술을 개발하였다.
특히 합성 조절 RNA를 이용한 이 기술은 기존 방식과 달리 균주 특이성이 없어 수개월이 소요되던 실험을 수일로 단축시킬 수 있어 획기적이다.
연구팀은 합성 조절 RNA 기술을 활용하여 의약 화합물의 전구체로 사용되는 타이로신(tyrosine)*과 다양한 석유화학 제품에 활용되는 카다베린(cadaverine)** 생산에 도입하여 세계 최고의 수율로 생산(각 21.9g/L, 12.6g/L)하는 세포공장을 개발하는데 성공하였다.
* 타이로신(tyrosine) : 스트레스를 다스리고 집중력 향상 효과가 있는 아미노산 ** 카다베린(cadaverine) : 폴리우레탄 등 다양한 석유화학 제품에 활용되는 기반물질
이상엽 교수는 “합성 조절 RNA기술로 다양한 물질을 생산하는 세포공장 개발이 활발해 질 것이며 석유에너지로 대표되는 화학 산업이 바이오 산업으로 변해 가는데 촉매제 역할을 할 것으로 기대된다”라고 연구 의의를 밝혔다.“
이번 연구는 글로벌프론티어사업(지능형 바이오 시스템 설계 및 합성 연구단(단장 김선창))의 지원으로 수행되었으며 연구결과는 세계적 학술지인 네이처 바이오테크놀로지 온라인 판에 1월 20일 게재되었다.
2013.01.21 조회수 19543 나노촉매의 활성도를 효과적으로 높일 수 있는 원리 규명
박정영 교수
- Nano Letters 발표,“활성도는 높이고 소모는 줄이는 신개념 촉매물질 개발 가능”-
나노촉매*에 산화막을 형성하여 활성도를 자유자재로 제어할 수 있는 기술이 국내 연구진에 의해 개발됨에 따라, 활성도를 극대화하고 소모를 최소화하는 새로운 촉매물질 개발에 가능성이 열렸다.
* 나노촉매(Nanocatalysts) : 표면적이 높은 산화물 지지체에 나노미터(10억분의 1미터) 크기의 금속입자가 분산되어 있는 구조로, 표면에서 기체 반응을 원활하게 하는 재료
우리 학교 EEWS대학원 박정영 교수(42세)가 주도하고 캄란 카디르 박사과정생(Kamran Qadir, 제1저자), 울산과기대 주상훈 교수, 한양대 문봉진 교수 및 UC버클리대 가보 소모자이 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약연구)과 WCU육성사업 및 지식경제부 둥의 지원으로 수행되었고, 나노분야의 권위 있는 학술지인 ‘Nano Letters’ 온라인 속보(10월 15일)에 게재되었다.(논문명: Intrinsic Relation between Catalytic Activity of CO Oxidation on Ru Nanoparticles and Ru Oxides Uncovered with Ambient Pressure XPS)
우리가 일상생활에서 사용하고 있는 제품의 대부분(80% 이상)은 촉매를 이용해 만들어질 정도로, 촉매는 우리 생활에서 꼭 필요하고 중요한 물질이다.
특히 전 세계 연구자들은 인류가 직면한 중요 이슈인 에너지문제와 환경문제 등을 근본적으로 해결하기 위해 친환경적인 화학공정에 사용될 새로운 나노촉매 물질을 집중적으로 개발하고 있다.
현재 실생활에서 주로 사용되는 촉매는 나노입자와 산화물로 이루어져 있다. 그 중 나노입자는 촉매의 표면적을 최대한 넓혀 촉매의 활성도를 높이는 역할을 한다.
활성도가 높은 촉매를 효과적으로 제조하기 위해서는 나노입자의 표면 산화막이 중요한 요인으로 알려져 왔다. 그러나 이를 과학적으로 입증하기 위해서는 촉매가 반응하는 환경에서 나노입자의 산화상태를 정확히 측정해야 하지만, 그 동안 많은 분석이 진공에서 이루어져와서 이를 정확히 보여주기가 힘들었다. 즉 촉매가 반응하는 환경에서 측정이 이루어지기 위해서는 상압측정이 필요하다. 최근에 개발된 상압 엑스선 광전자 분광법으로 이러한 상압에서 표면의 성분과 산화상태의 연구가 가능하게 되었다.
지금까지 연구자들이 무엇 때문에 정확히 측정하지 못했을까요?
박정영 교수 연구팀은 상압 엑스선 광전자 분광법*으로 나노입자의 산화상태를 촉매환경에서 측정하는데 성공하였다.
* 엑스선 광전자 분광법(X-ray Photoelectron Spectroscopy) : 엑스선을 물질에 쬐었을 때 나오는 광전자의 운동에너지를 조사하여 물질의 성분과 산화상태 등을 연구하는 표면분석법
박 교수팀은 2.8나노미터와 6나노미터 크기의 루테늄 나노입자 2개를 콜로이드 합성법*으로 제작하고, 랭뮤르 블라짓 기법**으로 나노입자 한 층을 표면에 증착시켰다. 연구팀은 나노입자의 산화상태를 온도와 압력을 바꿔가며 측정하였고, 크기가 큰 루테늄 나노입자가 얇은 산화막을 가진다는 결과를 도출하였다.
* 콜로이드 합성법 : 금속염과 안정제가 함께 용해되어 있는 용매에 환원제를 투입 또는 혼합하여 나노입자를 제작하는 방법. 제작 과정의 여러 인자를 바꿈으로써 입자의 크기와 모양, 성분의 제어가 가능하다.
* * 랭뮤르 블라짓(Langmuir-Blodgett) 기법 : 금속나노입자를 단층으로 제작하는 기법. 나노입자가 용액 위에 떠 있을때, 표면압력을 조절하여 나노입자 사이의 평균 간격을 조절할 수 있다.
또한 연구팀은 측정결과를 바탕으로 산화상태가 촉매의 활성도에 미치는 영향을 확인하여, 크기가 큰 루테늄 나노입자의 얇은 산화막이 촉매의 활성도를 높일 수 있고, 산화상태를 바꾸면 활성도도 제어할 수 있다는 사실을 입증하였다.
박정영 교수는 “나노입자의 산화막이 촉매환경에서 만들어지고 촉매활성도에도 직접적인 관계가 있음을 규명한 이번 연구는 활성도가 높은 촉매물질을 만드는데 응용되어 환경오염에 주요한 원인이 될 수 있는 촉매물질의 소모를 획기적으로 줄이는데 기여할 것으로 기대한다”고 연구의의를 밝혔다.
루테늄(Ru) 나노입자의 촉매환경 도중 산화상태조사 : 루테늄 나노입자에서 일어나는 촉매반응 (일산화탄소 산화반응)을 보여줌 (왼쪽). 방사광 가속기에 설치된 상압 엑스선 광전자 분광법을 이용하여 촉매환경에서 루테늄 나노입자의 산화상태가 분석이 됨 (아래). 루테늄 나노입자의 산화막의 두께가 나노입자의 크기에 관계가 되고 이는 촉매의 활성도에 직접적으로 영향을 줌 (오른쪽)
2012.11.08 조회수 23082
나노촉매의 활성도를 효과적으로 높일 수 있는 원리 규명
박정영 교수
- Nano Letters 발표,“활성도는 높이고 소모는 줄이는 신개념 촉매물질 개발 가능”-
나노촉매*에 산화막을 형성하여 활성도를 자유자재로 제어할 수 있는 기술이 국내 연구진에 의해 개발됨에 따라, 활성도를 극대화하고 소모를 최소화하는 새로운 촉매물질 개발에 가능성이 열렸다.
* 나노촉매(Nanocatalysts) : 표면적이 높은 산화물 지지체에 나노미터(10억분의 1미터) 크기의 금속입자가 분산되어 있는 구조로, 표면에서 기체 반응을 원활하게 하는 재료
우리 학교 EEWS대학원 박정영 교수(42세)가 주도하고 캄란 카디르 박사과정생(Kamran Qadir, 제1저자), 울산과기대 주상훈 교수, 한양대 문봉진 교수 및 UC버클리대 가보 소모자이 교수가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약연구)과 WCU육성사업 및 지식경제부 둥의 지원으로 수행되었고, 나노분야의 권위 있는 학술지인 ‘Nano Letters’ 온라인 속보(10월 15일)에 게재되었다.(논문명: Intrinsic Relation between Catalytic Activity of CO Oxidation on Ru Nanoparticles and Ru Oxides Uncovered with Ambient Pressure XPS)
우리가 일상생활에서 사용하고 있는 제품의 대부분(80% 이상)은 촉매를 이용해 만들어질 정도로, 촉매는 우리 생활에서 꼭 필요하고 중요한 물질이다.
특히 전 세계 연구자들은 인류가 직면한 중요 이슈인 에너지문제와 환경문제 등을 근본적으로 해결하기 위해 친환경적인 화학공정에 사용될 새로운 나노촉매 물질을 집중적으로 개발하고 있다.
현재 실생활에서 주로 사용되는 촉매는 나노입자와 산화물로 이루어져 있다. 그 중 나노입자는 촉매의 표면적을 최대한 넓혀 촉매의 활성도를 높이는 역할을 한다.
활성도가 높은 촉매를 효과적으로 제조하기 위해서는 나노입자의 표면 산화막이 중요한 요인으로 알려져 왔다. 그러나 이를 과학적으로 입증하기 위해서는 촉매가 반응하는 환경에서 나노입자의 산화상태를 정확히 측정해야 하지만, 그 동안 많은 분석이 진공에서 이루어져와서 이를 정확히 보여주기가 힘들었다. 즉 촉매가 반응하는 환경에서 측정이 이루어지기 위해서는 상압측정이 필요하다. 최근에 개발된 상압 엑스선 광전자 분광법으로 이러한 상압에서 표면의 성분과 산화상태의 연구가 가능하게 되었다.
지금까지 연구자들이 무엇 때문에 정확히 측정하지 못했을까요?
박정영 교수 연구팀은 상압 엑스선 광전자 분광법*으로 나노입자의 산화상태를 촉매환경에서 측정하는데 성공하였다.
* 엑스선 광전자 분광법(X-ray Photoelectron Spectroscopy) : 엑스선을 물질에 쬐었을 때 나오는 광전자의 운동에너지를 조사하여 물질의 성분과 산화상태 등을 연구하는 표면분석법
박 교수팀은 2.8나노미터와 6나노미터 크기의 루테늄 나노입자 2개를 콜로이드 합성법*으로 제작하고, 랭뮤르 블라짓 기법**으로 나노입자 한 층을 표면에 증착시켰다. 연구팀은 나노입자의 산화상태를 온도와 압력을 바꿔가며 측정하였고, 크기가 큰 루테늄 나노입자가 얇은 산화막을 가진다는 결과를 도출하였다.
* 콜로이드 합성법 : 금속염과 안정제가 함께 용해되어 있는 용매에 환원제를 투입 또는 혼합하여 나노입자를 제작하는 방법. 제작 과정의 여러 인자를 바꿈으로써 입자의 크기와 모양, 성분의 제어가 가능하다.
* * 랭뮤르 블라짓(Langmuir-Blodgett) 기법 : 금속나노입자를 단층으로 제작하는 기법. 나노입자가 용액 위에 떠 있을때, 표면압력을 조절하여 나노입자 사이의 평균 간격을 조절할 수 있다.
또한 연구팀은 측정결과를 바탕으로 산화상태가 촉매의 활성도에 미치는 영향을 확인하여, 크기가 큰 루테늄 나노입자의 얇은 산화막이 촉매의 활성도를 높일 수 있고, 산화상태를 바꾸면 활성도도 제어할 수 있다는 사실을 입증하였다.
박정영 교수는 “나노입자의 산화막이 촉매환경에서 만들어지고 촉매활성도에도 직접적인 관계가 있음을 규명한 이번 연구는 활성도가 높은 촉매물질을 만드는데 응용되어 환경오염에 주요한 원인이 될 수 있는 촉매물질의 소모를 획기적으로 줄이는데 기여할 것으로 기대한다”고 연구의의를 밝혔다.
루테늄(Ru) 나노입자의 촉매환경 도중 산화상태조사 : 루테늄 나노입자에서 일어나는 촉매반응 (일산화탄소 산화반응)을 보여줌 (왼쪽). 방사광 가속기에 설치된 상압 엑스선 광전자 분광법을 이용하여 촉매환경에서 루테늄 나노입자의 산화상태가 분석이 됨 (아래). 루테늄 나노입자의 산화막의 두께가 나노입자의 크기에 관계가 되고 이는 촉매의 활성도에 직접적으로 영향을 줌 (오른쪽)
2012.11.08 조회수 23082 노화를 억제하면서 건강히 장수할 수 있도록 돕는 新물질 발견
김대수 교수
- PLoS One 발표,“암, 치매 및 파킨슨병 예방․치료에 한걸음 다가가”-
노화를 억제하면서 건강히 오래살 수 있도록 돕는 새로운 물질이 국내 연구진에 의해 발견됨에 따라, 건강한 삶을 오래 유지하고 싶은 인류의 꿈에 한걸음 다가서게 되었다.
우리 학교 생명과학과 김대수 교수(43세) 연구팀과 충남대 의과대학 및 산업체와의 공동연구로 진행된 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(전략연구)의 지원으로 수행되었고, 생물학 분야의 권위 있는 학술지인 ‘플로스 원(PLoS One)’ 최신호(10월 11일자)에 게재되었다.(논문명: Beta-lapachone, a modulator of NAD metabolism, prevents health declines in aged mice)
사람이 건강하게 오래 살 수 있는 효과적인 방법은 식사량을 줄이거나(小食) 달리기와 같은 유산소운동을 하는 것이다.
김대수 교수 연구팀은 우선 소식이나 유산소운동이 보조효소(NAD+*)를 증가시켜 세포의 노화를 억제한다는 점에 착안하였다. 연구팀은 천연화합물(베타-라파촌)로 효소(NQO1)를 활성화시키면, 적게 먹거나 별도의 운동을 하지 않아도 NAD+의 양이 증가됨을 규명하였다.
*) NAD+(니코틴아미드 디욱시뉴클레오타이드) : 이 보조효소가 세포내에서 증가하면 노화방지 효과가 있는 것으로 알려져 있음
**) 베타-라파촌(beta-lapachon) : 라파초 나무, 단삼 등 식물에 고농도로 함유된 천연화합물
또한 이미 노화가 진행된 생쥐들에게 베타-라파촌을 사료에 섞여 먹인 결과, 3개월이 경과되면 운동기능과 뇌기능이 모두 향상되어 건강하게 오래살 수 있음을 확인하였다. 특히 베타-라파촌은 동․서양에서 오랜 기간 사용해 온 약초의 주성분으로 만들어져, 머지않아 쉽게 상용화할 수 있는 것이 특징이다.
김대수 교수는 “지금까지 노화를 억제하는 약물들이 다수 개발되었지만, 사람에게 적용하는데 한계가 있었다. 우리 연구팀이 찾아낸 새로운 물질은 소식이나 운동으로 나타나는 효과를 그대로 모방하여 밝혀낸 것으로서, 향후 암, 치매 및 파킨슨병과 같은 노인성 질환을 예방하고 치료하는데 크게 기여할 것으로 기대한다”고 연구의의를 밝혔다.
2012.10.24 조회수 22527
노화를 억제하면서 건강히 장수할 수 있도록 돕는 新물질 발견
김대수 교수
- PLoS One 발표,“암, 치매 및 파킨슨병 예방․치료에 한걸음 다가가”-
노화를 억제하면서 건강히 오래살 수 있도록 돕는 새로운 물질이 국내 연구진에 의해 발견됨에 따라, 건강한 삶을 오래 유지하고 싶은 인류의 꿈에 한걸음 다가서게 되었다.
우리 학교 생명과학과 김대수 교수(43세) 연구팀과 충남대 의과대학 및 산업체와의 공동연구로 진행된 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(전략연구)의 지원으로 수행되었고, 생물학 분야의 권위 있는 학술지인 ‘플로스 원(PLoS One)’ 최신호(10월 11일자)에 게재되었다.(논문명: Beta-lapachone, a modulator of NAD metabolism, prevents health declines in aged mice)
사람이 건강하게 오래 살 수 있는 효과적인 방법은 식사량을 줄이거나(小食) 달리기와 같은 유산소운동을 하는 것이다.
김대수 교수 연구팀은 우선 소식이나 유산소운동이 보조효소(NAD+*)를 증가시켜 세포의 노화를 억제한다는 점에 착안하였다. 연구팀은 천연화합물(베타-라파촌)로 효소(NQO1)를 활성화시키면, 적게 먹거나 별도의 운동을 하지 않아도 NAD+의 양이 증가됨을 규명하였다.
*) NAD+(니코틴아미드 디욱시뉴클레오타이드) : 이 보조효소가 세포내에서 증가하면 노화방지 효과가 있는 것으로 알려져 있음
**) 베타-라파촌(beta-lapachon) : 라파초 나무, 단삼 등 식물에 고농도로 함유된 천연화합물
또한 이미 노화가 진행된 생쥐들에게 베타-라파촌을 사료에 섞여 먹인 결과, 3개월이 경과되면 운동기능과 뇌기능이 모두 향상되어 건강하게 오래살 수 있음을 확인하였다. 특히 베타-라파촌은 동․서양에서 오랜 기간 사용해 온 약초의 주성분으로 만들어져, 머지않아 쉽게 상용화할 수 있는 것이 특징이다.
김대수 교수는 “지금까지 노화를 억제하는 약물들이 다수 개발되었지만, 사람에게 적용하는데 한계가 있었다. 우리 연구팀이 찾아낸 새로운 물질은 소식이나 운동으로 나타나는 효과를 그대로 모방하여 밝혀낸 것으로서, 향후 암, 치매 및 파킨슨병과 같은 노인성 질환을 예방하고 치료하는데 크게 기여할 것으로 기대한다”고 연구의의를 밝혔다.
2012.10.24 조회수 22527 나노미터보다 얇은 두께에서 빛을 자유자재로 제어하다
민범기 교수
- Nature Materials 발표,“그래핀과 자체 개발한 메타물질 결합, 다양한 광소자 개발 가능”
자연에 존재하는 2차원 물질인 그래핀*과 국내 연구진이 자체 개발한 인공적인 2차원 메타물질**을 결합해 빛의 투과도를 효과적으로 제어할 수 있다는 사실이 밝혀짐에 따라, 광메모리 등 다양한 그래핀 광소자*** 개발의 전망이 밝아졌다.
* 그래핀(Graphene) : 탄소원자가 육각형 벌집모양을 이루는 2차원 평면에 펼쳐진 얇은 막 구조
** 메타물질(Metamaterials) : 자연계에 없는 특성을 갖도록 고안된 빛의 파장보다 훨씬 작은 인공 원자로 구성된 물질
*** 광소자(Optical Devices) : 빛의 생성, 검출, 변조 및 제어 등을 할 수 있는 소자
우리 학교 기계공학전공 민범기 교수(39세), 이승훈 박사생(제1저자, 30세), ETRI 최무한 박사(제1저자, 41세) 및 김튼튼 박사(제1저자, 31세)가 주도하고, 이승섭 교수, 최성율 교수, ETRI 최춘기 박사, 미국 UC버클리대 샹장(Xiang Zhang) 교수 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △중견연구자지원사업(전략연구) △일반연구자지원사업(기본연구) △선도연구센터지원사업(SRC) 등의 지원으로 수행되었다.
연구결과는 세계 최고 과학전문지 ‘네이처’ 의 자매지로서 재료과학분야의 권위 있는 학술지인 ‘Nature Materials’ 최신 온라인 판(9월 30일자)에 게재되었다.
(논문명: Switching terahertz waves with gate-controlled active graphene metamaterials)
그래핀은 여러 우수한 물리적 특성으로 인해 2004년 영국의 가임 교수와 노보셀로프 교수(2010년 노벨물리학상 수상)가 발견한 이래, 지금까지 전 세계 연구자들이 주목하는 ‘꿈의 신소재’이다.
특히 그래핀은 고유의 전자구조로 인해 근적외선과 가시광선의 약 2.3%의 빛을 흡수하는 것으로 알려져 투명전극으로 응용될 수 있다. 투명전극은 LCD, OLED 등 평판 디스플레이, 스마트폰 등에 사용되는 터치스크린이나 태양전지 개발에 매우 중요한 전자부품 중 하나이다.
지금까지 전 세계 연구자들은 그래핀의 전기적 특성을 극대화해 반도체와 투명전극 등을 개발하고자 노력하였다. 반면에 그래핀이 지닌 놀라운 특성 중 하나인 광학적 투과도는 전기적인 방법으로 제어하는데 한계가 있고, 데이터를 빛으로 주고받을 때 광변조의 폭도 좁아 광변조기나 광소자로 응용되기에 제약이 있어 연구자들의 큰 주목을 받지 못했다.
민범기 교수 연구팀은 파장의 백만분의 1인 얇은 두께(0.34 나노미터)의 그래핀과 메타물질을 결합함으로써 빛의 투과도를 효과적으로 제어하여 그래핀만 사용했을 때보다 수십 배 이상 광변조의 폭을 높일 수 있음을 증명하였다.
특히 민 교수팀이 개발한 ‘그래핀 메타물질’은 매우 얇고 잘 휘어지는 고분자 기판 안에 그래핀과 메타물질(금으로 된 벌집모양의 인공원자) 및 전극이 집적화되어 전기를 이용해 빛의 투과도를 제어할 수 있다.
또한 연구팀의 그래핀 메타물질은 투과되는 빛의 세기와 위상을 효과적으로 제어할 수 있을 뿐만 아니라, 전기적 이력현상을 이용해 빛의 투과도를 기억하여 그래핀 광메모리 소자로 응용 될 수 있음을 실험적으로 증명하였다.
민 교수팀은 지난해 자연계에 존재하지 않는 굴절률 높은 메타물질을 제작하여 ‘네이처’에 발표하였는데, 이번 연구는 연구팀이 만든 메타물질의 특성을 그래핀과 접목하여 광학적 특성을 능동적으로 조절할 수 있음을 검증하였다는 점에서 의미가 크다.
민범기 교수는 “이번 연구는 10억분의 1미터인 나노미터보다 얇은 두께에서 빛을 효과적으로 조절할 수 있어 손톱보다 작은 초소형 광변조기나 광메모리 소자를 개발할 수 있는 가능성을 열었다”고 연구의의를 밝혔다.
그림 1. 그래핀 메타물질의 제작도
그림 2. 그래핀 메타물질의 개념도(왼쪽)와 제작된 소자의 현미경 사진(오른쪽)
2012.10.17 조회수 18294
나노미터보다 얇은 두께에서 빛을 자유자재로 제어하다
민범기 교수
- Nature Materials 발표,“그래핀과 자체 개발한 메타물질 결합, 다양한 광소자 개발 가능”
자연에 존재하는 2차원 물질인 그래핀*과 국내 연구진이 자체 개발한 인공적인 2차원 메타물질**을 결합해 빛의 투과도를 효과적으로 제어할 수 있다는 사실이 밝혀짐에 따라, 광메모리 등 다양한 그래핀 광소자*** 개발의 전망이 밝아졌다.
* 그래핀(Graphene) : 탄소원자가 육각형 벌집모양을 이루는 2차원 평면에 펼쳐진 얇은 막 구조
** 메타물질(Metamaterials) : 자연계에 없는 특성을 갖도록 고안된 빛의 파장보다 훨씬 작은 인공 원자로 구성된 물질
*** 광소자(Optical Devices) : 빛의 생성, 검출, 변조 및 제어 등을 할 수 있는 소자
우리 학교 기계공학전공 민범기 교수(39세), 이승훈 박사생(제1저자, 30세), ETRI 최무한 박사(제1저자, 41세) 및 김튼튼 박사(제1저자, 31세)가 주도하고, 이승섭 교수, 최성율 교수, ETRI 최춘기 박사, 미국 UC버클리대 샹장(Xiang Zhang) 교수 등이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 △중견연구자지원사업(전략연구) △일반연구자지원사업(기본연구) △선도연구센터지원사업(SRC) 등의 지원으로 수행되었다.
연구결과는 세계 최고 과학전문지 ‘네이처’ 의 자매지로서 재료과학분야의 권위 있는 학술지인 ‘Nature Materials’ 최신 온라인 판(9월 30일자)에 게재되었다.
(논문명: Switching terahertz waves with gate-controlled active graphene metamaterials)
그래핀은 여러 우수한 물리적 특성으로 인해 2004년 영국의 가임 교수와 노보셀로프 교수(2010년 노벨물리학상 수상)가 발견한 이래, 지금까지 전 세계 연구자들이 주목하는 ‘꿈의 신소재’이다.
특히 그래핀은 고유의 전자구조로 인해 근적외선과 가시광선의 약 2.3%의 빛을 흡수하는 것으로 알려져 투명전극으로 응용될 수 있다. 투명전극은 LCD, OLED 등 평판 디스플레이, 스마트폰 등에 사용되는 터치스크린이나 태양전지 개발에 매우 중요한 전자부품 중 하나이다.
지금까지 전 세계 연구자들은 그래핀의 전기적 특성을 극대화해 반도체와 투명전극 등을 개발하고자 노력하였다. 반면에 그래핀이 지닌 놀라운 특성 중 하나인 광학적 투과도는 전기적인 방법으로 제어하는데 한계가 있고, 데이터를 빛으로 주고받을 때 광변조의 폭도 좁아 광변조기나 광소자로 응용되기에 제약이 있어 연구자들의 큰 주목을 받지 못했다.
민범기 교수 연구팀은 파장의 백만분의 1인 얇은 두께(0.34 나노미터)의 그래핀과 메타물질을 결합함으로써 빛의 투과도를 효과적으로 제어하여 그래핀만 사용했을 때보다 수십 배 이상 광변조의 폭을 높일 수 있음을 증명하였다.
특히 민 교수팀이 개발한 ‘그래핀 메타물질’은 매우 얇고 잘 휘어지는 고분자 기판 안에 그래핀과 메타물질(금으로 된 벌집모양의 인공원자) 및 전극이 집적화되어 전기를 이용해 빛의 투과도를 제어할 수 있다.
또한 연구팀의 그래핀 메타물질은 투과되는 빛의 세기와 위상을 효과적으로 제어할 수 있을 뿐만 아니라, 전기적 이력현상을 이용해 빛의 투과도를 기억하여 그래핀 광메모리 소자로 응용 될 수 있음을 실험적으로 증명하였다.
민 교수팀은 지난해 자연계에 존재하지 않는 굴절률 높은 메타물질을 제작하여 ‘네이처’에 발표하였는데, 이번 연구는 연구팀이 만든 메타물질의 특성을 그래핀과 접목하여 광학적 특성을 능동적으로 조절할 수 있음을 검증하였다는 점에서 의미가 크다.
민범기 교수는 “이번 연구는 10억분의 1미터인 나노미터보다 얇은 두께에서 빛을 효과적으로 조절할 수 있어 손톱보다 작은 초소형 광변조기나 광메모리 소자를 개발할 수 있는 가능성을 열었다”고 연구의의를 밝혔다.
그림 1. 그래핀 메타물질의 제작도
그림 2. 그래핀 메타물질의 개념도(왼쪽)와 제작된 소자의 현미경 사진(오른쪽)
2012.10.17 조회수 18294 휘어지는 고성능 배터리 제작기술 개발
- 플렉시블 OLED 디스플레이와 배터리의 완전 결합길 열려 -
휘어지는 디스플레이의 에너지원으로 반드시 필요한 고효율 유연 배터리를 KAIST 연구진이 세계 최초로 개발하는데 성공했다.
우리 학교 신소재공학과 이건재 교수팀이 유연한 고효율 배터리를 개발하는데 성공, 이 연구결과가 재료분야 세계적 학술지인 ‘나노 레터스(Nano Letters)’ 8월호 온라인판에 실렸으며, 미국 화학학회 뉴스레터인 C&EN(Chemical & Engineering News)에도 (8월 10일자) 특집으로 보도됐다.
얇고 가벼우면서도 유연한 디스플레이로의 혁신적인 기술 발전을 위해서는 필연적으로 휘어지며 충전밀도가 높고, 폭발위험이 극히 적은 고성능 유연 고상배터리의 개발이 요구돼 왔다.
그러나 고효율 배터리를 만드는 소재 중 산화물 양극재료는 고온의 열처리가 필요하기 때문에 플라스틱 기판위에서는 구현할 수 없을 뿐만 아니라 고온 열처리 없이 분말 형태로 만들 경우에는 충전밀도가 매우 낮다는 문제점이 있었다.
이번에 개발한 고성능 유연 고상배터리는 리튬코발트산화물(LiCoO2) 양극재료를 운모 희생기판에서 4㎛(머리카락의 약 10분의 1 두께) 정도인 박막형태로 고온 성장시켜 만든 후, 기판으로 쓰인 딱딱한 희생기판을 제거해 얇은 배터리 부분만 남긴 후 유연한 기판위에 전사해 완성했다.
이 교수 연구팀이 개발에 성공한 유연 배터리는 휘어지더라도 전압이 3.9~4.2V로 거의 변하지 않고, 충·방전 10,000번(방전심도 80%) 정도의 안정적 작동과 함께 2200㎼h/㎤의 높은 에너지밀도(패키징 포함)를 지닌 게 큰 특징이다.
이번 연구를 주도한 구민 박사는 “충전밀도가 높은 박막형태의 고효율 유연 배터리는 완전한 형태의 유연 전자 제품를 만드는 데 획기적인 역할을 할 것”이라고 말했다.
이건재 교수 연구팀은 현재 대량생산을 위한 레이저 리프트 오프(Laser lift-off) 기술과 충전용량을 높이기 위해 삼차원으로 적층하는 후속 연구를 진행 중인데, 이들 연구가 끝나는 대로 상용화 수준의 유연 배터리가 나올 것으로 이 교수 연구팀은 예상하고 있다.
한편, 이번 연구결과는 지난 13일부터 일주일간 미국에서 열린 세계적인 국제학회인 국제광자공학회(SPIE)에서 이건재 교수가 기조강연으로 발표했으며, 국내외에서 다수의 특허를 등록하거나 출원했다.
<동영상 설명>http://www.youtube.com/watch?v=Sh-SkpCZ4AE&feature=player_embedded굽힘 상태에서 상용 블루 LED를 켜며 전압특성이 유지되는 유연 배터리 모습
그림1. 연구팀이 이번에 개발한 유연한 배터리와 기존의 휘어지는 OLED를 결합해 만든 최초의 완전한 플렉시블 디스플레이
그림2. 연구팀이 개발한 플렉시블 배터리와 결합된 디스플레이의 구조
그림3. 연구팀이 개발한 휘어지는 배터리가 LED를 켜고 있다. 휘어져도 전압이 떨어지지 않아 안정적이다.
그림4. 휘어지는 고효율 배터리 제작공정. (g)운모를 제거하고 나서 (h)폴리머 기판으로 옮긴 후 (i)폴리머로 감싸는 공정이 연구팀의 독자기술이다.
그림5. 이건재 교수 연구팀이 유연배터리를 희생기판에서 레이저로 제거하는 연구를 수행하고 있다.
2012.08.21 조회수 19942
휘어지는 고성능 배터리 제작기술 개발
- 플렉시블 OLED 디스플레이와 배터리의 완전 결합길 열려 -
휘어지는 디스플레이의 에너지원으로 반드시 필요한 고효율 유연 배터리를 KAIST 연구진이 세계 최초로 개발하는데 성공했다.
우리 학교 신소재공학과 이건재 교수팀이 유연한 고효율 배터리를 개발하는데 성공, 이 연구결과가 재료분야 세계적 학술지인 ‘나노 레터스(Nano Letters)’ 8월호 온라인판에 실렸으며, 미국 화학학회 뉴스레터인 C&EN(Chemical & Engineering News)에도 (8월 10일자) 특집으로 보도됐다.
얇고 가벼우면서도 유연한 디스플레이로의 혁신적인 기술 발전을 위해서는 필연적으로 휘어지며 충전밀도가 높고, 폭발위험이 극히 적은 고성능 유연 고상배터리의 개발이 요구돼 왔다.
그러나 고효율 배터리를 만드는 소재 중 산화물 양극재료는 고온의 열처리가 필요하기 때문에 플라스틱 기판위에서는 구현할 수 없을 뿐만 아니라 고온 열처리 없이 분말 형태로 만들 경우에는 충전밀도가 매우 낮다는 문제점이 있었다.
이번에 개발한 고성능 유연 고상배터리는 리튬코발트산화물(LiCoO2) 양극재료를 운모 희생기판에서 4㎛(머리카락의 약 10분의 1 두께) 정도인 박막형태로 고온 성장시켜 만든 후, 기판으로 쓰인 딱딱한 희생기판을 제거해 얇은 배터리 부분만 남긴 후 유연한 기판위에 전사해 완성했다.
이 교수 연구팀이 개발에 성공한 유연 배터리는 휘어지더라도 전압이 3.9~4.2V로 거의 변하지 않고, 충·방전 10,000번(방전심도 80%) 정도의 안정적 작동과 함께 2200㎼h/㎤의 높은 에너지밀도(패키징 포함)를 지닌 게 큰 특징이다.
이번 연구를 주도한 구민 박사는 “충전밀도가 높은 박막형태의 고효율 유연 배터리는 완전한 형태의 유연 전자 제품를 만드는 데 획기적인 역할을 할 것”이라고 말했다.
이건재 교수 연구팀은 현재 대량생산을 위한 레이저 리프트 오프(Laser lift-off) 기술과 충전용량을 높이기 위해 삼차원으로 적층하는 후속 연구를 진행 중인데, 이들 연구가 끝나는 대로 상용화 수준의 유연 배터리가 나올 것으로 이 교수 연구팀은 예상하고 있다.
한편, 이번 연구결과는 지난 13일부터 일주일간 미국에서 열린 세계적인 국제학회인 국제광자공학회(SPIE)에서 이건재 교수가 기조강연으로 발표했으며, 국내외에서 다수의 특허를 등록하거나 출원했다.
<동영상 설명>http://www.youtube.com/watch?v=Sh-SkpCZ4AE&feature=player_embedded굽힘 상태에서 상용 블루 LED를 켜며 전압특성이 유지되는 유연 배터리 모습
그림1. 연구팀이 이번에 개발한 유연한 배터리와 기존의 휘어지는 OLED를 결합해 만든 최초의 완전한 플렉시블 디스플레이
그림2. 연구팀이 개발한 플렉시블 배터리와 결합된 디스플레이의 구조
그림3. 연구팀이 개발한 휘어지는 배터리가 LED를 켜고 있다. 휘어져도 전압이 떨어지지 않아 안정적이다.
그림4. 휘어지는 고효율 배터리 제작공정. (g)운모를 제거하고 나서 (h)폴리머 기판으로 옮긴 후 (i)폴리머로 감싸는 공정이 연구팀의 독자기술이다.
그림5. 이건재 교수 연구팀이 유연배터리를 희생기판에서 레이저로 제거하는 연구를 수행하고 있다.
2012.08.21 조회수 19942 연성물질의 메조포러스 준결정 개발・분석 성공
오사무 테라사키 교수
- 네이처(Nature)지 7월 19일자 실려 -
메조포러스(mesoporous) 준결정(quaicrystal) 구조에 대한 의문이 우리 대학 연구진에 의해 보다 명확하게 풀렸다.
우리 학교 EEWS(책임교수 강정구) 대학원 소속 오사무 테라사키(Osamu Terasaki) 교수 연구팀이 불규칙적인 입자구조를 가지고 있는 준결정 메조포러스 실리카(quasicrystalline mesoporous silica) 합성에 성공하고 준결정 성장 과정을 분석하는 새로운 방법을 개발했다.
연구팀이 제시한 이론은 연성물질인 교질(micelles) 입자 형성 시 불규칙하게 나타나는 준결정 현상을 과학적으로 규명하는 토대를 만들었다. 세계적인 학술지 ‘네이처(Nature)’는 7월호(19일자)에 테라사키(Terasaki) 교수 연구팀의 논문을 게재했다.
과학자들은 그 동안 연성물질(solidified version of soft matter systems)에서 발견되는 메조포러스 준결정 구조를 체계적으로 설명하는데 많은 어려움을 겪어왔다. 하지만, 이번 연구를 통해 얻은 연성물질 내 준결정 성장에 대한 이론적인 근거는 앞으로 이 분야에 대한 연구를 촉진시켜 나노 구조를 가진 신소재 물질 개발에 박차를 가할 것으로 예측된다.
연성물질의 메조포러스 준결정은 높은 대칭균형(high symmetry)과 나노 스케일(nano scale)보다 더 큰 특성적 크기(large characteristic length scale)를 가지고 있어 광학적 특성을 자유자재로 조절할 수 있는 물질을 구현할 수 있다.
이를 활용하면 태양광을 사용하는 친환경적 에너지 저장 및 변환 기술 개발에 응용되어 지속가능한 에너지의 저장, 사용 및 재생산 기술 발전에 큰 도움을 줄 것으로 예상된다.
테라사키 교수 연구팀은 메조포러스 준결정 실리카 합성에 성공하고 투과전자현미경(Transmission Electron Microscopy)을 통해 실리카 입자 중앙에 12각형 기둥 모양의 순결정이 형성되어 있으며, 전자회절 무늬에서(electron diffraction pattern) 12각형의 회전대칭 무늬(rotational symmetry)가 순결정 주위에 형성되는 것을 증명하였다.
준결정(quasicrystal)은 준주기적 결정(quasiperiodic crystal)의 줄임말로서 금속 같은 일정한 규칙으로 배열된 결정 물질과 유리와 같은 비결정 물질의 중간 성질을 가지는 제 3의 고체(solid)로 최근 발견되었으며 2011년에는 노벨화학상이 이 분야 연구에 수여되기도 했다.
많은 양의 기공(porous)을 지닌 다공성 물질을 준결정으로 제조 하게 되면 기공들의 결정 구조를 ‘타일을 붙이듯(tiling)’ 원하는 방식대로 디자인 하고 성질을 조절하게 되어 다양한 분야에 필요한 새로운 소재를 개발하고 생산할 수 있게 된다.
테라사키 교수는 “높은 대칭성(high symmetry)을 가지는 준결정의 발견은 물질의 광학적 성질을 쉽게 조절해 가시광 영역대의 포토닉 크리스탈을 구현할 수 있다”며 “물질의 광학적 에너지 흡수를 조절 할 수 있는 이 기술은 향후 에너지 저장(energy harvesting)의 핵심기술이 될 수도 있을 것이다”라고 말했다.
이번 연구는 KAIST EEWS 대학원의 오사무 테라사키 교수와 스웨덴 스톡홀름(Stockholm University) 대학과 공동으로 수행되었다.(끝)
그림 1. 물질에서의 원자 배열 방법에 따라 구분되는 결정, 준결정과 비결정을 나타낸 모식도. 일반적으로는 원자가 일정한 패턴을 가지고 배열되어 있는 것을 결정, 그렇지 않은 것을 비결정이라고 하였으나, 준결정은 결정에서의 원자배열을 가지지는 않지만 정돈 되어 있는 구조이다. 투과전자현미경에서의 회절무늬를 보고 준결정을 판단할 수 있다.
그림 2. 메조포러스 실리카 준결정의 실제 모양과 원자 배열을 나타내는 투과전자현미경 이미지. 투과전자현미경으로부터 메조포러스 실리카가 12각형 기둥 모양을 하고 있음을 알 수 있으며(왼쪽 위의 이미지), 이는 투과전자현미경의 회절무늬에서도 나타난다(왼쪽 아래 이미지). 고배율의 투과전자현미경은 메조포러스 실리카의 실제 구조를 나타내고 있다(오른쪽).
그림 3. 메조포러스 실리카 준결정의 결정구조를 3차원 모델로 나타낸 모식도. 각각 다른 세 가지 다각형이 서로 정돈되어 결합해 메조포러스 준결정을 구성한다.
2012.07.24 조회수 22638
연성물질의 메조포러스 준결정 개발・분석 성공
오사무 테라사키 교수
- 네이처(Nature)지 7월 19일자 실려 -
메조포러스(mesoporous) 준결정(quaicrystal) 구조에 대한 의문이 우리 대학 연구진에 의해 보다 명확하게 풀렸다.
우리 학교 EEWS(책임교수 강정구) 대학원 소속 오사무 테라사키(Osamu Terasaki) 교수 연구팀이 불규칙적인 입자구조를 가지고 있는 준결정 메조포러스 실리카(quasicrystalline mesoporous silica) 합성에 성공하고 준결정 성장 과정을 분석하는 새로운 방법을 개발했다.
연구팀이 제시한 이론은 연성물질인 교질(micelles) 입자 형성 시 불규칙하게 나타나는 준결정 현상을 과학적으로 규명하는 토대를 만들었다. 세계적인 학술지 ‘네이처(Nature)’는 7월호(19일자)에 테라사키(Terasaki) 교수 연구팀의 논문을 게재했다.
과학자들은 그 동안 연성물질(solidified version of soft matter systems)에서 발견되는 메조포러스 준결정 구조를 체계적으로 설명하는데 많은 어려움을 겪어왔다. 하지만, 이번 연구를 통해 얻은 연성물질 내 준결정 성장에 대한 이론적인 근거는 앞으로 이 분야에 대한 연구를 촉진시켜 나노 구조를 가진 신소재 물질 개발에 박차를 가할 것으로 예측된다.
연성물질의 메조포러스 준결정은 높은 대칭균형(high symmetry)과 나노 스케일(nano scale)보다 더 큰 특성적 크기(large characteristic length scale)를 가지고 있어 광학적 특성을 자유자재로 조절할 수 있는 물질을 구현할 수 있다.
이를 활용하면 태양광을 사용하는 친환경적 에너지 저장 및 변환 기술 개발에 응용되어 지속가능한 에너지의 저장, 사용 및 재생산 기술 발전에 큰 도움을 줄 것으로 예상된다.
테라사키 교수 연구팀은 메조포러스 준결정 실리카 합성에 성공하고 투과전자현미경(Transmission Electron Microscopy)을 통해 실리카 입자 중앙에 12각형 기둥 모양의 순결정이 형성되어 있으며, 전자회절 무늬에서(electron diffraction pattern) 12각형의 회전대칭 무늬(rotational symmetry)가 순결정 주위에 형성되는 것을 증명하였다.
준결정(quasicrystal)은 준주기적 결정(quasiperiodic crystal)의 줄임말로서 금속 같은 일정한 규칙으로 배열된 결정 물질과 유리와 같은 비결정 물질의 중간 성질을 가지는 제 3의 고체(solid)로 최근 발견되었으며 2011년에는 노벨화학상이 이 분야 연구에 수여되기도 했다.
많은 양의 기공(porous)을 지닌 다공성 물질을 준결정으로 제조 하게 되면 기공들의 결정 구조를 ‘타일을 붙이듯(tiling)’ 원하는 방식대로 디자인 하고 성질을 조절하게 되어 다양한 분야에 필요한 새로운 소재를 개발하고 생산할 수 있게 된다.
테라사키 교수는 “높은 대칭성(high symmetry)을 가지는 준결정의 발견은 물질의 광학적 성질을 쉽게 조절해 가시광 영역대의 포토닉 크리스탈을 구현할 수 있다”며 “물질의 광학적 에너지 흡수를 조절 할 수 있는 이 기술은 향후 에너지 저장(energy harvesting)의 핵심기술이 될 수도 있을 것이다”라고 말했다.
이번 연구는 KAIST EEWS 대학원의 오사무 테라사키 교수와 스웨덴 스톡홀름(Stockholm University) 대학과 공동으로 수행되었다.(끝)
그림 1. 물질에서의 원자 배열 방법에 따라 구분되는 결정, 준결정과 비결정을 나타낸 모식도. 일반적으로는 원자가 일정한 패턴을 가지고 배열되어 있는 것을 결정, 그렇지 않은 것을 비결정이라고 하였으나, 준결정은 결정에서의 원자배열을 가지지는 않지만 정돈 되어 있는 구조이다. 투과전자현미경에서의 회절무늬를 보고 준결정을 판단할 수 있다.
그림 2. 메조포러스 실리카 준결정의 실제 모양과 원자 배열을 나타내는 투과전자현미경 이미지. 투과전자현미경으로부터 메조포러스 실리카가 12각형 기둥 모양을 하고 있음을 알 수 있으며(왼쪽 위의 이미지), 이는 투과전자현미경의 회절무늬에서도 나타난다(왼쪽 아래 이미지). 고배율의 투과전자현미경은 메조포러스 실리카의 실제 구조를 나타내고 있다(오른쪽).
그림 3. 메조포러스 실리카 준결정의 결정구조를 3차원 모델로 나타낸 모식도. 각각 다른 세 가지 다각형이 서로 정돈되어 결합해 메조포러스 준결정을 구성한다.
2012.07.24 조회수 22638 시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12 조회수 26644
시스템생물학 연구로 표적항암제 내성 원리 규명
- 분자세포생물학지 발표, “표적항암제 내성 극복 및 암 생존률 향상 위한 단초 마련”-
최근 항암치료법으로 주목 받고 있는 표적항암제(멕 억제제, MEK inhibitor)의 근본적인 내성 원리가 국내 연구진에 의해 밝혀져, 향후 항암제 내성을 극복하고 암 생존률을 높일 수 있는 토대를 마련하였다. 특히 이번 연구는 IT와 BT의 융합연구인 시스템생물학 연구로 이루어졌다는 점에서 큰 의미가 있다.
우리 학교 조광현 교수가 주도하고 원재경 박사과정생, 신성영 박사, 이종훈 박사과정생, 허원도 교수 및 양희원 박사가 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 이승종)이 추진하는 중견연구자지원사업(도약/도전연구)과 기초연구실사업 및 WCU(세계수준의 연구중심대학) 육성사업의 지원으로 수행되었다.
연구결과는 분자세포생물학 분야의 권위 있는 학술지인 ‘분자세포생물학지(Journal of Molecular Cell Biology, IF=13.4)’의 표지논문으로 선정되어 6월 1일자에 게재되었다. (논문명: The cross regulation between ERK and PI3K signaling pathways determines the tumoricidal efficacy of MEK inhibitor)
표적항암제는 종양세포 속에 있는 특정 신호전달경로의 분자를 목표(target)로 하는데, 최근 폐암, 유방암 등 일부 종양에서 기존 항암제와 달리 부작용이 적고 임상효능이 높아 전 세계 과학자들로부터 큰 주목을 받고 있다. 특히 표적항암제는 개인 맞춤형 항암치료제로 개발될 수 있어 기대를 모으고 있다.
그러나 실제 임상 또는 전(前)임상 단계에서 많은 표적항암제의 내성이 관찰되어, 결국 신약개발로 이어지지 못하는 경우가 많다. 또한 효능은 있더라도 생존율이 낮거나 재발하는 경우가 빈번한 것으로 알려졌다.
대표적인 종양세포 신호전달경로인 어크(ERK) 신호전달경로는 대부분의 종양에서 활성화되는 경로인데, 특히 피부암이나 갑상선암은 이 경로에 있는 물질(비라프, BRAF)의 변이로 활성화되어서 암으로 발전하는 사례가 많다.
이 경우 어크 신호전달경로를 표적으로 하는 멕 억제제가 효과적인 치료법으로 알려져 있지만, 결국 내성이 발생하여 암이 다시 진행된다.
조광현 교수가 이끈 융합 연구팀은 어크 신호전달경로를 표적으로 하는 멕 억제제에 대한 내성과 그 근본원리를 수학모형과 대규모 컴퓨터 시뮬레이션을 이용해 분석하고, 그 결과를 분자생물학실험과 바이오이미징*기술을 통해 검증하였다. *) 바이오이미징 : 세포 또는 분자 수준에서 일어나는 현상을 영상으로 확인하는 기술
조 교수팀은 종양의 다양한 변이조건을 컴퓨터 시뮬레이션과 실험을 수행한 결과, 멕 억제제를 사용하면 어크 신호전달은 줄어들지만, 또 다른 신호전달경로(PI3K로의 우회 신호전달경로)가 활성화되어 멕 억제제의 효과가 반감됨을 입증하였다.
또한 이러한 반응이 신호전달 물질간의 복잡한 상호작용과 피드백으로 이루어진 네트워크 구조에서 비롯되었음을 밝히고, 그 원인이 되는 핵심 회로를 규명하여 이를 억제하는 다른 표적약물을 멕 억제제와 조합함으로써 표적항암제의 효과를 증진시킬 수 있음을 제시하였다.
조광현 교수는 “이번 연구는 멕 억제제에 대한 약물저항성의 원인을 시스템 차원에서 규명한 첫 사례로, 약물이 세포의 신호전달경로에 미치는 영향을 컴퓨터 시뮬레이션으로 예측함으로써 표적항암제의 내성을 극복할 수 있음을 보여주었다. 또한 신호전달 네트워크에 대한 기초연구가 실제 임상의 약물 사용에 어떻게 적용될 수 있는지와 표적항암물질의 저항성에 대한 근본원리를 이해하고, 그 극복방안을 찾아내는 새로운 융합연구 플랫폼을 제시한 것으로 평가받고 있다”고 연구의의를 밝혔다.
2012.06.12 조회수 26644