-
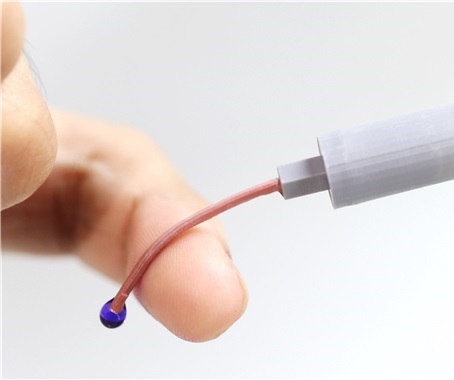 부드러워져 재사용 불가능한 주사바늘 개발
정맥주사는 혈관에 약물을 직접 주입하는 방법으로 신속한 효과를 유도하고 지속적인 약물 투여를 통한 치료가 가능해 범세계적으로 환자치료에 통용되고 있다. 하지만 금속이나 플라스틱 등 딱딱한 소재로 제작된 주사바늘은 부드러운 생체조직에 손상과 염증을 발생시킬 수 있다. 또한 비용 절감을 위한 비윤리적 주사바늘 재사용을 가능하게 하며, 이는 인체면역 결핍 바이러스(HIV), B형/C형 간염 바이러스 등 심각한 혈액 매개 질환 감염을 초래하기도 한다. 이는 전 세계적인 문제이며, 감염관리의 중요성으로 인해 세계보건기구(WHO)는 재사용이 불가능한 스마트 주사기 개발과 사용을 장려하고 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 의과학대학원 정원일 교수 연구팀과 공동 연구를 통해 환자 건강증진 및 의료진 안전을 도모할 수 있는 가변 강성 정맥 주사바늘을 개발하는 데 성공했다고 13일 밝혔다.
이번에 개발된 기술은 체온에 의해 주사바늘이 유연해지는 특성을 통해 정맥에 약물 주입 중 주사 삽입 부위의 자유로운 움직임을 보장함과 동시에 주사바늘에 의한 혈관 벽 손상 방지를 도모할 수 있을 것으로 예상된다. 또한 사용 후 찔림 사고나 비윤리적 주사기 재사용에 따른 혈액 매개 질환 감염 문제를 예방할 수 있을 것이라 기대된다.
전기및전자공학부 카렌-크리스티안 아그노(Karen-Christian Agno) 박사과정 연구원과 의과학대학원 양경모 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)' 10월 30일 字에 게재됐다. (논문명 : A temperature-responsive intravenous needle that irreversibly softens on insertion)
연구팀은 액체금속의 일종인 갈륨(Gallium)을 이용하여 주사바늘 구조를 만들고 이를 생체적합성 폴리머로 코팅해 가변 강성 정맥 주사바늘을 제작했다. 딱딱한 상태의 주사바늘은 상용 정맥 카테터와 비슷한 수준의 생체조직 관통력을 갖는다. 하지만 체내 삽입 후, 갈륨의 액체화로 인해 조직과 같이 부드러운 상태로 변해 혈관 손상 없이 안정적인 약물 전달이 가능하다. 한 번 사용한 주사바늘은 갈륨의 과냉각 현상에 의해 상온에서도 부드러운 상태를 유지해 바늘 찔림 사고나 재사용 문제를 원천적으로 방지할 수 있다.
연구팀은 개발된 정맥 주사바늘의 약물 전달 기능과 생체적합성을 검증하고자 실험 쥐를 대상으로 동물실험을 진행했다. 이식된 가변 강성 정맥 주사바늘은 딱딱한 상용 금속 바늘이나 플라스틱 카테터에 비해 훨씬 낮은 염증 반응을 보여 연구팀은 우수한 생체적합성을 확인했다. 또한 상용 주사바늘과 같이 안정적으로 약물을 전달할 수 있음을 확인했다.
아울러 가변 강성 정맥 주사바늘은 박막형 온도 센서를 탑재할 수 있도록 디자인됐다. 이를 통해 실시간으로 환자의 심부체온을 모니터링하는 것이 가능하며, 또한 잘못된 주사바늘 위치로 인한 혈관이 아닌 다른 조직으로의 약물 누수 감지도 가능해 환자에게 더 나은 의료서비스를 제공할 수 있다.
이번 연구를 주도한 정재웅 교수는 "개발된 가변 강성 정맥 주사바늘은 기존의 딱딱한 의료용 바늘로 인한 문제를 극복해 환자와 의료진 모두의 안전을 보장하고, 주사바늘 재사용으로 인한 감염 문제를 해결할 수 있다는 점에서 가치가 매우 크다”라고 말했다.
한편 이번 연구는 한국연구재단이 추진하는 중견연구자지원사업, 생체신호센서융합기술개발사업, 리더연구자지원사업의 지원을 받아 수행됐다.
부드러워져 재사용 불가능한 주사바늘 개발
정맥주사는 혈관에 약물을 직접 주입하는 방법으로 신속한 효과를 유도하고 지속적인 약물 투여를 통한 치료가 가능해 범세계적으로 환자치료에 통용되고 있다. 하지만 금속이나 플라스틱 등 딱딱한 소재로 제작된 주사바늘은 부드러운 생체조직에 손상과 염증을 발생시킬 수 있다. 또한 비용 절감을 위한 비윤리적 주사바늘 재사용을 가능하게 하며, 이는 인체면역 결핍 바이러스(HIV), B형/C형 간염 바이러스 등 심각한 혈액 매개 질환 감염을 초래하기도 한다. 이는 전 세계적인 문제이며, 감염관리의 중요성으로 인해 세계보건기구(WHO)는 재사용이 불가능한 스마트 주사기 개발과 사용을 장려하고 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 의과학대학원 정원일 교수 연구팀과 공동 연구를 통해 환자 건강증진 및 의료진 안전을 도모할 수 있는 가변 강성 정맥 주사바늘을 개발하는 데 성공했다고 13일 밝혔다.
이번에 개발된 기술은 체온에 의해 주사바늘이 유연해지는 특성을 통해 정맥에 약물 주입 중 주사 삽입 부위의 자유로운 움직임을 보장함과 동시에 주사바늘에 의한 혈관 벽 손상 방지를 도모할 수 있을 것으로 예상된다. 또한 사용 후 찔림 사고나 비윤리적 주사기 재사용에 따른 혈액 매개 질환 감염 문제를 예방할 수 있을 것이라 기대된다.
전기및전자공학부 카렌-크리스티안 아그노(Karen-Christian Agno) 박사과정 연구원과 의과학대학원 양경모 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)' 10월 30일 字에 게재됐다. (논문명 : A temperature-responsive intravenous needle that irreversibly softens on insertion)
연구팀은 액체금속의 일종인 갈륨(Gallium)을 이용하여 주사바늘 구조를 만들고 이를 생체적합성 폴리머로 코팅해 가변 강성 정맥 주사바늘을 제작했다. 딱딱한 상태의 주사바늘은 상용 정맥 카테터와 비슷한 수준의 생체조직 관통력을 갖는다. 하지만 체내 삽입 후, 갈륨의 액체화로 인해 조직과 같이 부드러운 상태로 변해 혈관 손상 없이 안정적인 약물 전달이 가능하다. 한 번 사용한 주사바늘은 갈륨의 과냉각 현상에 의해 상온에서도 부드러운 상태를 유지해 바늘 찔림 사고나 재사용 문제를 원천적으로 방지할 수 있다.
연구팀은 개발된 정맥 주사바늘의 약물 전달 기능과 생체적합성을 검증하고자 실험 쥐를 대상으로 동물실험을 진행했다. 이식된 가변 강성 정맥 주사바늘은 딱딱한 상용 금속 바늘이나 플라스틱 카테터에 비해 훨씬 낮은 염증 반응을 보여 연구팀은 우수한 생체적합성을 확인했다. 또한 상용 주사바늘과 같이 안정적으로 약물을 전달할 수 있음을 확인했다.
아울러 가변 강성 정맥 주사바늘은 박막형 온도 센서를 탑재할 수 있도록 디자인됐다. 이를 통해 실시간으로 환자의 심부체온을 모니터링하는 것이 가능하며, 또한 잘못된 주사바늘 위치로 인한 혈관이 아닌 다른 조직으로의 약물 누수 감지도 가능해 환자에게 더 나은 의료서비스를 제공할 수 있다.
이번 연구를 주도한 정재웅 교수는 "개발된 가변 강성 정맥 주사바늘은 기존의 딱딱한 의료용 바늘로 인한 문제를 극복해 환자와 의료진 모두의 안전을 보장하고, 주사바늘 재사용으로 인한 감염 문제를 해결할 수 있다는 점에서 가치가 매우 크다”라고 말했다.
한편 이번 연구는 한국연구재단이 추진하는 중견연구자지원사업, 생체신호센서융합기술개발사업, 리더연구자지원사업의 지원을 받아 수행됐다.
2023.11.13
조회수 11168
-
 고성능 비 백금계 연료전지 촉매 개발
연료전지는 부산물로 물 만을 배출하는 친환경적인 에너지 변환 장치로, 다양한 연료전지 중 양성자 교환막 연료전지(PEMFC)는 수송용 및 발전용 연료전지로 현재 상용화가 진행 중이다. 다만 연료전지의 촉매로 사용되는 백금 촉매는 자원의 희소성으로 인한 높은 가격 때문에 대량 생산 및 전 세계적인 보급에 문제점을 갖고 있었다.
우리 대학 생명화학공학과 이진우 교수 연구팀이 국민대학교 장세근 교수 연구팀, 서강대학교 백서인 교수 연구팀과 공동연구를 통해 비백금계 촉매 기반 고 전력밀도의 양성자 교환막 연료전지를 개발했다고 7일 밝혔다.
상대적으로 다른 비 백금계 촉매들에 비해 좋은 성능을 가진다고 알려져 백금을 대체하고 기존 연료전지 비용을 줄이기 위한 가장 유력한 후보 물질로 주목받아 온 M-N-C계 촉매는 PEMFC 연료전지에서 높은 전력밀도를 구현하는 데는 많은 한계가 있었다.
이진우 연구팀은 기존 백금 촉매를 대체할 수 있는 비 백금계 Fe-N-C 촉매의 높은 성능을 구현해 매우 뛰어난 가격 경쟁력과 높은 전력밀도의 연료전지 성능을 달성했다.
연구팀은 M-N-C 촉매 중 하나인 Fe-N-C 촉매 나노입자의 활성점 주변의 결함 정도를 조절하여 높은 성능의 Fe-N-C 촉매를 합성했다. 탄소 기반의 물질을 특정 양의 이산화탄소(CO2)를 흘려주면서 열처리를 진행하는 이산화탄소 활성화 방법을 통해 탄소 기반 촉매 내부의 결함 정도를 미세 조정했고 그에 따른 최적화된 촉매가 활성화되는 것을 확인했다.
연구팀은 결과적으로 적절한 결함을 가질 때 철 단일원자 활성점의 전자구조가 최적화되면서 결함을 만들지 않은 기존 Fe-N-C 촉매에 비해 매우 우수한 전기화학적 성능을 제공하는 것을 확인해 결함과 활성점의 성능 상관관계에 대하여 규명했다.
연구팀이 개발을 한 최적화된 Fe-N-C촉매는 PEMFC 연료전지에서 기존에 개발이 된 Fe-N-C촉매보다 44% 향상된 높은 전력 밀도를 보였으며 현재 사용이 되고 있는 백금 촉매를 대체를 할 수 있음을 PEMFC단전지에서 보여주었다.
연구팀이 개발한 비 백금계 Fe-N-C촉매는 높은 전기화학적 특성으로 기존의 백금 촉매 대체를 통해 연료전지의 스택 가격 감소와 그에 따른 상용화에 이바지할 수 있을 것으로 기대된다.
KAIST 생명화학공학과 이승엽 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 머티리얼스 (Advanced materials)' 10월 13일 온라인으로 게재됐다. (논문명: Insight into Defect Engineering of Atomically Dispersed Iron Electrocatalysts for High-Performance Proton Exchange Membrane Fuel Cell)
이진우 교수는 "비 백금계 Fe-N-C 촉매의 결함과 성능의 관계를 밝히고 결함 조절을 통해서 백금을 전혀 사용하지 않고 높은 전력밀도의 양성자 교환막 연료전지를 개발한 것은 큰 의미가 있으며 개발된 촉매 및 합성 방법은 향후 다양한 종류의 연료전지에서 귀금속인 백금을 대체하여 적용할 수 있을 것으로 기대된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업과 한국전력 사외공모 기초연구지원사업의 지원을 받아 수행됐다.
고성능 비 백금계 연료전지 촉매 개발
연료전지는 부산물로 물 만을 배출하는 친환경적인 에너지 변환 장치로, 다양한 연료전지 중 양성자 교환막 연료전지(PEMFC)는 수송용 및 발전용 연료전지로 현재 상용화가 진행 중이다. 다만 연료전지의 촉매로 사용되는 백금 촉매는 자원의 희소성으로 인한 높은 가격 때문에 대량 생산 및 전 세계적인 보급에 문제점을 갖고 있었다.
우리 대학 생명화학공학과 이진우 교수 연구팀이 국민대학교 장세근 교수 연구팀, 서강대학교 백서인 교수 연구팀과 공동연구를 통해 비백금계 촉매 기반 고 전력밀도의 양성자 교환막 연료전지를 개발했다고 7일 밝혔다.
상대적으로 다른 비 백금계 촉매들에 비해 좋은 성능을 가진다고 알려져 백금을 대체하고 기존 연료전지 비용을 줄이기 위한 가장 유력한 후보 물질로 주목받아 온 M-N-C계 촉매는 PEMFC 연료전지에서 높은 전력밀도를 구현하는 데는 많은 한계가 있었다.
이진우 연구팀은 기존 백금 촉매를 대체할 수 있는 비 백금계 Fe-N-C 촉매의 높은 성능을 구현해 매우 뛰어난 가격 경쟁력과 높은 전력밀도의 연료전지 성능을 달성했다.
연구팀은 M-N-C 촉매 중 하나인 Fe-N-C 촉매 나노입자의 활성점 주변의 결함 정도를 조절하여 높은 성능의 Fe-N-C 촉매를 합성했다. 탄소 기반의 물질을 특정 양의 이산화탄소(CO2)를 흘려주면서 열처리를 진행하는 이산화탄소 활성화 방법을 통해 탄소 기반 촉매 내부의 결함 정도를 미세 조정했고 그에 따른 최적화된 촉매가 활성화되는 것을 확인했다.
연구팀은 결과적으로 적절한 결함을 가질 때 철 단일원자 활성점의 전자구조가 최적화되면서 결함을 만들지 않은 기존 Fe-N-C 촉매에 비해 매우 우수한 전기화학적 성능을 제공하는 것을 확인해 결함과 활성점의 성능 상관관계에 대하여 규명했다.
연구팀이 개발을 한 최적화된 Fe-N-C촉매는 PEMFC 연료전지에서 기존에 개발이 된 Fe-N-C촉매보다 44% 향상된 높은 전력 밀도를 보였으며 현재 사용이 되고 있는 백금 촉매를 대체를 할 수 있음을 PEMFC단전지에서 보여주었다.
연구팀이 개발한 비 백금계 Fe-N-C촉매는 높은 전기화학적 특성으로 기존의 백금 촉매 대체를 통해 연료전지의 스택 가격 감소와 그에 따른 상용화에 이바지할 수 있을 것으로 기대된다.
KAIST 생명화학공학과 이승엽 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 머티리얼스 (Advanced materials)' 10월 13일 온라인으로 게재됐다. (논문명: Insight into Defect Engineering of Atomically Dispersed Iron Electrocatalysts for High-Performance Proton Exchange Membrane Fuel Cell)
이진우 교수는 "비 백금계 Fe-N-C 촉매의 결함과 성능의 관계를 밝히고 결함 조절을 통해서 백금을 전혀 사용하지 않고 높은 전력밀도의 양성자 교환막 연료전지를 개발한 것은 큰 의미가 있으며 개발된 촉매 및 합성 방법은 향후 다양한 종류의 연료전지에서 귀금속인 백금을 대체하여 적용할 수 있을 것으로 기대된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업과 한국전력 사외공모 기초연구지원사업의 지원을 받아 수행됐다.
2023.11.07
조회수 8076
-
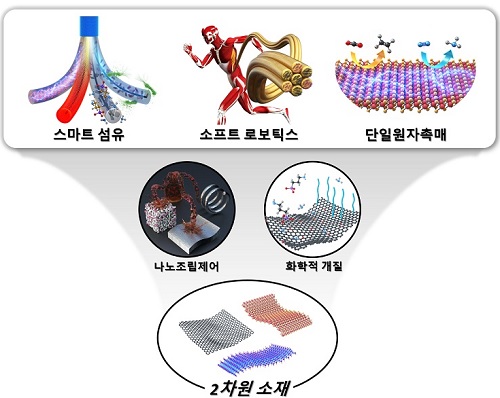 포스트 AI 시대 핵심 신소재는?
우리 대학 신소재공학과 김상욱 교수 연구팀이 인공지능(Artificial Intelligence, 이하 AI)이 불러온 4차 산업혁명 이후를 뜻하는 포스트 AI시대의 핵심 신소재를 전망하는 초청논문을 발표했다고 6일 밝혔다.
대화형 AI인 `챗GPT(ChatGPT)'가 월간 사용자 1억 명을 두 달 만에 달성하는 등 AI는 우리 생활에 한층 가까이 다가왔다. 4차 산업혁명의 핵심 기술인 AI는 인간의 지능을 모사해 데이터를 학습하고 이에 따라 합리적인 의사결정을 내릴 수 있다. 단순 반복적인 작업을 대체하는데 머물렀던 과거 인공지능 기술들과 달리, 더욱 어렵고 복잡한 작업을 효율적으로 수행할 수 있어 의료, 자율 주행 자동차, 로보틱스 등의 분야에서 새로운 기술 혁신을 이루고 있다.
최근에는 사물인터넷(IoT) 기술의 발전과 함께 현실 세계의 다양한 사물과 개체들이 인터넷을 통해 연결된 초연결 시대가 도래하고 있다. 포스트 AI 시대에는 AI가 다양한 기기들과 결합해 우리 주변의 정보를 항상 받아들이고 이에 따라 최적의 의사결정을 하며 이를 현실적으로 실물세계에 구현하는 사이버세계와 현실세계가 하나로 융합되는 시대가 될 것으로 전망되고 있다.
포스트 AI 시대가 다가옴에 따라 웨어러블 장치를 위한 스마트 섬유, 소프트 로보틱스를 위한 인공근육, 환경친화적인 에너지 생산효율을 극대화할 수 있는 단일원자촉매등 AI의 한계를 보조하고 보완할 수 있는 신소재의 혁신이 더욱 중요해지고 있으며, 무엇보다 실용적인 기술의 확보가 시급하다.
김상욱 교수 연구팀은 스마트 섬유 개발의 원천소재인 그래핀 산화물 액정성을 세계 최초로 발견하였고, 소프트 로보틱스 분야에 새로운 돌파구를 마련한 헤라클레스 인공 근육 개발 그리고 세계 최초로 단일원자촉매를 발견하는 등 미래 신소재분야에서 혁신적인 연구를 수행해 온 공로를 인정받아 세계적인 학술지 `어드밴스드 머티리얼스 (Advanced Materials)' 명예의 전당(Hall of Fame) 특집 리뷰논문을 게재했다.
`어드밴스드 머티리얼스' 명예의 전당 초청논문은 신소재 분야의 세계적인 석학들을 매우 엄격한 기준에 따라 선정하여 그 미래 연구방향을 소개하는 권위 있는 특집 논문이다.
김상욱 교수는 "인공지능이 이끄는 4차 산업혁명 이후의 포스트 AI 시대는 신소재 기반의 사물 혁신이 중요해질 것인데 그래핀과 같은 2차원 소재가 매우 중요한 역할을 할 것으로 기대된다ˮ고 밝혔다.
KAIST 응용과학연구소 이강산 박사가 제1 저자로 참여하고 KAIST 신소재공학과 수치스라 파드마잔 사시카라(Suchithra Padmajan Sasikala) 연구교수와 경희대학교 정보디스플레이학과 임준원 교수가 공동 교신저자로 참여한 이번 연구는 한국연구재단의 리더 연구자 지원사업인 다차원 나노 조립제어 창의연구단의 지원을 받아 수행됐다.
*논문명: 2D Materials Beyond Post-AI Era: Smart Fibers, Soft Robotics And Single Atom Catalysts
포스트 AI 시대 핵심 신소재는?
우리 대학 신소재공학과 김상욱 교수 연구팀이 인공지능(Artificial Intelligence, 이하 AI)이 불러온 4차 산업혁명 이후를 뜻하는 포스트 AI시대의 핵심 신소재를 전망하는 초청논문을 발표했다고 6일 밝혔다.
대화형 AI인 `챗GPT(ChatGPT)'가 월간 사용자 1억 명을 두 달 만에 달성하는 등 AI는 우리 생활에 한층 가까이 다가왔다. 4차 산업혁명의 핵심 기술인 AI는 인간의 지능을 모사해 데이터를 학습하고 이에 따라 합리적인 의사결정을 내릴 수 있다. 단순 반복적인 작업을 대체하는데 머물렀던 과거 인공지능 기술들과 달리, 더욱 어렵고 복잡한 작업을 효율적으로 수행할 수 있어 의료, 자율 주행 자동차, 로보틱스 등의 분야에서 새로운 기술 혁신을 이루고 있다.
최근에는 사물인터넷(IoT) 기술의 발전과 함께 현실 세계의 다양한 사물과 개체들이 인터넷을 통해 연결된 초연결 시대가 도래하고 있다. 포스트 AI 시대에는 AI가 다양한 기기들과 결합해 우리 주변의 정보를 항상 받아들이고 이에 따라 최적의 의사결정을 하며 이를 현실적으로 실물세계에 구현하는 사이버세계와 현실세계가 하나로 융합되는 시대가 될 것으로 전망되고 있다.
포스트 AI 시대가 다가옴에 따라 웨어러블 장치를 위한 스마트 섬유, 소프트 로보틱스를 위한 인공근육, 환경친화적인 에너지 생산효율을 극대화할 수 있는 단일원자촉매등 AI의 한계를 보조하고 보완할 수 있는 신소재의 혁신이 더욱 중요해지고 있으며, 무엇보다 실용적인 기술의 확보가 시급하다.
김상욱 교수 연구팀은 스마트 섬유 개발의 원천소재인 그래핀 산화물 액정성을 세계 최초로 발견하였고, 소프트 로보틱스 분야에 새로운 돌파구를 마련한 헤라클레스 인공 근육 개발 그리고 세계 최초로 단일원자촉매를 발견하는 등 미래 신소재분야에서 혁신적인 연구를 수행해 온 공로를 인정받아 세계적인 학술지 `어드밴스드 머티리얼스 (Advanced Materials)' 명예의 전당(Hall of Fame) 특집 리뷰논문을 게재했다.
`어드밴스드 머티리얼스' 명예의 전당 초청논문은 신소재 분야의 세계적인 석학들을 매우 엄격한 기준에 따라 선정하여 그 미래 연구방향을 소개하는 권위 있는 특집 논문이다.
김상욱 교수는 "인공지능이 이끄는 4차 산업혁명 이후의 포스트 AI 시대는 신소재 기반의 사물 혁신이 중요해질 것인데 그래핀과 같은 2차원 소재가 매우 중요한 역할을 할 것으로 기대된다ˮ고 밝혔다.
KAIST 응용과학연구소 이강산 박사가 제1 저자로 참여하고 KAIST 신소재공학과 수치스라 파드마잔 사시카라(Suchithra Padmajan Sasikala) 연구교수와 경희대학교 정보디스플레이학과 임준원 교수가 공동 교신저자로 참여한 이번 연구는 한국연구재단의 리더 연구자 지원사업인 다차원 나노 조립제어 창의연구단의 지원을 받아 수행됐다.
*논문명: 2D Materials Beyond Post-AI Era: Smart Fibers, Soft Robotics And Single Atom Catalysts
2023.11.06
조회수 10233
-
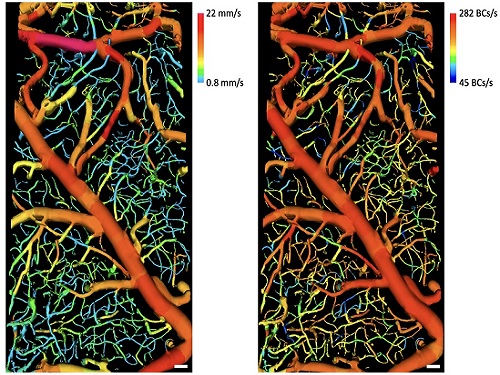 조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.11.01
조회수 5277
-
 변화된 데이터에서 인공지능 공정성 찾아내다
인공지능 기술이 사회 전반에 걸쳐 광범위하게 활용되며 인간의 삶에 많은 영향을 미치고 있다. 최근 인공지능의 긍정적인 효과 이면에 범죄자의 재범 예측을 위해 머신러닝 학습에 사용되는 콤파스(COMPAS) 시스템을 기반으로 학습된 모델이 인종 별로 서로 다른 재범 확률을 부여할 수 있다는 심각한 편향성이 관찰되었다. 이 밖에도 채용, 대출 시스템 등 사회의 중요 영역에서 인공지능의 다양한 편향성 문제가 밝혀지며, 공정성(fairness)을 고려한 머신러닝 학습의 필요성이 커지고 있다.
우리 대학 전기및전자공학부 황의종 교수 연구팀이 학습 상황과 달라진 새로운 분포의 테스트 데이터에 대해서도 편향되지 않은 판단을 내리도록 돕는 새로운 모델 훈련 기술을 개발했다고 30일 밝혔다.
최근 전 세계의 연구자들이 인공지능의 공정성을 높이기 위한 다양한 학습 방법론을 제안하고 있지만, 대부분의 연구는 인공지능 모델을 훈련시킬 때 사용되는 데이터와 실제 테스트 상황에서 사용될 데이터가 같은 분포를 갖는다고 가정한다. 하지만 실제 상황에서는 이러한 가정이 대체로 성립하지 않으며, 최근 다양한 어플리케이션에서 학습 데이터와 테스트 데이터 내의 편향 패턴이 크게 변화할 수 있음이 관측되고 있다.
이때, 테스트 환경에서 데이터의 정답 레이블과 특정 그룹 정보 간의 편향 패턴이 변경되면, 사전에 공정하게 학습되었던 인공지능 모델의 공정성이 직접적인 영향을 받고 다시금 악화된 편향성을 가질 수 있다. 일례로 과거에 특정 인종 위주로 채용하던 기관이 이제는 인종에 관계없이 채용한다면, 과거의 데이터를 기반으로 공정하게 학습된 인공지능 채용 모델이 현대의 데이터에는 오히려 불공정한 판단을 내릴 수 있다.
연구팀은 이러한 문제를 해결하기 위해, 먼저 `상관관계 변화(correlation shifts)' 개념을 도입해 기존의 공정성을 위한 학습 알고리즘들이 가지는 정확성과 공정성 성능에 대한 근본적인 한계를 이론적으로 분석했다. 예를 들어 특정 인종만 주로 채용한 과거 데이터의 경우 인종과 채용의 상관관계가 강해서 아무리 공정한 모델을 학습을 시켜도 현재의 약한 상관관계를 반영하는 정확하면서도 공정한 채용 예측을 하기가 근본적으로 어려운 것이다. 이러한 이론적인 분석을 바탕으로, 새로운 학습 데이터 샘플링 기법을 제안해 테스트 시에 데이터의 편향 패턴이 변화해도 모델을 공정하게 학습할 수 있도록 하는 새로운 학습 프레임워크를 제안했다. 이는 과거 데이터에서 우세하였던 특정 인종 데이터를 상대적으로 줄임으로써 채용과의 상관관계를 낮출 수 있다.
제안된 기법의 주요 이점은 데이터 전처리만 하기 때문에 기존에 제안된 알고리즘 기반 공정한 학습 기법을 그대로 활용하면서 개선할 수 있다는 것이다. 즉 이미 사용되고 있는 공정한 학습 알고리즘이 위에서 설명한 상관관계 변화에 취약하다면 제안된 기법을 함께 사용해서 해결할 수 있다.
제1 저자인 전기및전자공학부 노유지 박사과정 학생은 "이번 연구를 통해 인공지능 기술의 실제 적용 환경에서, 모델이 더욱 신뢰 가능하고 공정한 판단을 하도록 도울 것으로 기대한다ˮ고 밝혔다.
연구팀을 지도한 황의종 교수는 "기존 인공지능이 변화하는 데이터에 대해서도 공정성이 저하되지 않도록 하는 데 도움이 되기를 기대한다ˮ고 말했다.
이번 연구에는 노유지 박사과정이 제1 저자, 황의종 교수(KAIST)가 교신 저자, 서창호 교수(KAIST)와 이강욱 교수(위스콘신-매디슨 대학)가 공동 저자로 참여했다. 이번 연구는 지난 7월 미국 하와이에서 열린 머신러닝 최고권위 국제학술 대회인 `국제 머신러닝 학회 International Conference on Machine Learning (ICML)'에서 발표됐다. (논문명 : Improving Fair Training under Correlation Shifts)
한편, 이 기술은 정보통신기획평가원의 지원을 받은 `강건하고 공정하며 확장가능한 데이터 중심의 연속 학습' 과제 (2022-0-00157)와 한국연구재단 지원을 받은 `데이터 중심의 신뢰 가능한 인공지능' 과제의 성과다.
변화된 데이터에서 인공지능 공정성 찾아내다
인공지능 기술이 사회 전반에 걸쳐 광범위하게 활용되며 인간의 삶에 많은 영향을 미치고 있다. 최근 인공지능의 긍정적인 효과 이면에 범죄자의 재범 예측을 위해 머신러닝 학습에 사용되는 콤파스(COMPAS) 시스템을 기반으로 학습된 모델이 인종 별로 서로 다른 재범 확률을 부여할 수 있다는 심각한 편향성이 관찰되었다. 이 밖에도 채용, 대출 시스템 등 사회의 중요 영역에서 인공지능의 다양한 편향성 문제가 밝혀지며, 공정성(fairness)을 고려한 머신러닝 학습의 필요성이 커지고 있다.
우리 대학 전기및전자공학부 황의종 교수 연구팀이 학습 상황과 달라진 새로운 분포의 테스트 데이터에 대해서도 편향되지 않은 판단을 내리도록 돕는 새로운 모델 훈련 기술을 개발했다고 30일 밝혔다.
최근 전 세계의 연구자들이 인공지능의 공정성을 높이기 위한 다양한 학습 방법론을 제안하고 있지만, 대부분의 연구는 인공지능 모델을 훈련시킬 때 사용되는 데이터와 실제 테스트 상황에서 사용될 데이터가 같은 분포를 갖는다고 가정한다. 하지만 실제 상황에서는 이러한 가정이 대체로 성립하지 않으며, 최근 다양한 어플리케이션에서 학습 데이터와 테스트 데이터 내의 편향 패턴이 크게 변화할 수 있음이 관측되고 있다.
이때, 테스트 환경에서 데이터의 정답 레이블과 특정 그룹 정보 간의 편향 패턴이 변경되면, 사전에 공정하게 학습되었던 인공지능 모델의 공정성이 직접적인 영향을 받고 다시금 악화된 편향성을 가질 수 있다. 일례로 과거에 특정 인종 위주로 채용하던 기관이 이제는 인종에 관계없이 채용한다면, 과거의 데이터를 기반으로 공정하게 학습된 인공지능 채용 모델이 현대의 데이터에는 오히려 불공정한 판단을 내릴 수 있다.
연구팀은 이러한 문제를 해결하기 위해, 먼저 `상관관계 변화(correlation shifts)' 개념을 도입해 기존의 공정성을 위한 학습 알고리즘들이 가지는 정확성과 공정성 성능에 대한 근본적인 한계를 이론적으로 분석했다. 예를 들어 특정 인종만 주로 채용한 과거 데이터의 경우 인종과 채용의 상관관계가 강해서 아무리 공정한 모델을 학습을 시켜도 현재의 약한 상관관계를 반영하는 정확하면서도 공정한 채용 예측을 하기가 근본적으로 어려운 것이다. 이러한 이론적인 분석을 바탕으로, 새로운 학습 데이터 샘플링 기법을 제안해 테스트 시에 데이터의 편향 패턴이 변화해도 모델을 공정하게 학습할 수 있도록 하는 새로운 학습 프레임워크를 제안했다. 이는 과거 데이터에서 우세하였던 특정 인종 데이터를 상대적으로 줄임으로써 채용과의 상관관계를 낮출 수 있다.
제안된 기법의 주요 이점은 데이터 전처리만 하기 때문에 기존에 제안된 알고리즘 기반 공정한 학습 기법을 그대로 활용하면서 개선할 수 있다는 것이다. 즉 이미 사용되고 있는 공정한 학습 알고리즘이 위에서 설명한 상관관계 변화에 취약하다면 제안된 기법을 함께 사용해서 해결할 수 있다.
제1 저자인 전기및전자공학부 노유지 박사과정 학생은 "이번 연구를 통해 인공지능 기술의 실제 적용 환경에서, 모델이 더욱 신뢰 가능하고 공정한 판단을 하도록 도울 것으로 기대한다ˮ고 밝혔다.
연구팀을 지도한 황의종 교수는 "기존 인공지능이 변화하는 데이터에 대해서도 공정성이 저하되지 않도록 하는 데 도움이 되기를 기대한다ˮ고 말했다.
이번 연구에는 노유지 박사과정이 제1 저자, 황의종 교수(KAIST)가 교신 저자, 서창호 교수(KAIST)와 이강욱 교수(위스콘신-매디슨 대학)가 공동 저자로 참여했다. 이번 연구는 지난 7월 미국 하와이에서 열린 머신러닝 최고권위 국제학술 대회인 `국제 머신러닝 학회 International Conference on Machine Learning (ICML)'에서 발표됐다. (논문명 : Improving Fair Training under Correlation Shifts)
한편, 이 기술은 정보통신기획평가원의 지원을 받은 `강건하고 공정하며 확장가능한 데이터 중심의 연속 학습' 과제 (2022-0-00157)와 한국연구재단 지원을 받은 `데이터 중심의 신뢰 가능한 인공지능' 과제의 성과다.
2023.10.30
조회수 8120
-
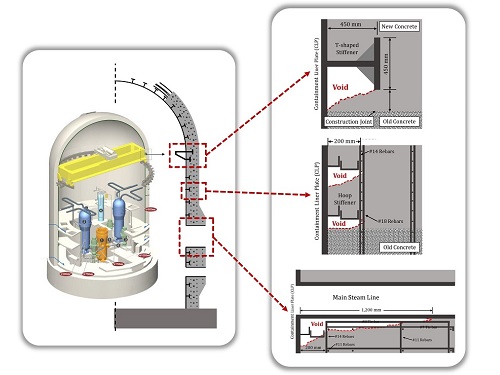 한빛원전의 시공 불량 문제를 해결하기 위한 시뮬레이션 개발
후쿠시마 사고 이후 원전 안전 및 관리에 대한 관심이 집중되고 있다. 한국에서는 2017년 6월경 한빛원전의 원자로 격납건물의 콘크리트 벽 속에서 대규모 공극이 발견되었다. 원자로 격납건물은 원전 사고 발생 시 방사능 유출을 막아주는 최후의 보루이기 때문에, 이러한 콘크리트 공극으로 인한 원전의 안전상 우려가 큰 상황이다.
국내 연구진들은 원자로 격납건물 시공시 콘크리트 다짐 및 채움 불량으로 인하여 격납로 내 콘크리트에 공극이 발생한 것으로 추정하고 있다. 원자로 격납건물은 일반 콘크리트 구조물과 달리 매우 높은 밀도의 철근 보강이 필요하기 때문에, 콘크리트 타설 시 진동 다짐기가 진입하지 못하는 구역이 존재할 가능성이 높아서 콘크리트 공동에 대한 위험성이 높다. 하지만 돔 형태의 벽체 내부를 감싼 6 mm 두께의 철판(콘크리트 라이너 플레이트, CLP)이 영구 거푸집으로 활용되기 때문에 내부 공동에 대한 육안 검사가 불가능하다는 점에서 공극 발생 여부의 발견에 대한 어려움이 있다.
우리 대학 건설및환경공학과 김재홍 교수 연구팀은 이러한 문제를 해결하기 위하여 콘크리트의 유동성과 다짐 불량으로 인해 발생하는 공동을 억제할 수 있는 시공 시뮬레이션 기법을 개발했다.
연구팀에서 제안한 콘크리트 유동 시뮬레이션 기법은 콘크리트의 레올로지와 진동다짐의 영향 반경을 고려하여 콘크리트 공동 발생 예상 부위를 예측하는 기술이다. 연구팀은 이번 연구를 통해 콘크리트 진동다짐의 영향 반경(감쇠계수)을 직접 측정하여 굳지 않은 콘크리트 내부의 진동 에너지 밀도 분포를 제시했다. 이어서, 진동 에너지에 따른 콘크리트의 Vibrorheology를 정량적으로 측정하여, 굳지 않은 콘크리트의 항복응력 감소를 정량적으로 모델링하여 시공 시뮬레이션을 가능하게 하였다.
새로 제안된 시공 시뮬레이션 기법은 기존 콘크리트 유동해석으로는 고려할 수 없었던 격납건물 내부 보강재의 형상과 크기, 콘크리트 레올로지, 그리고 진동다짐의 진폭과 진동수까지 고려하여 콘크리트의 채움성을 평가할 수 있게 되었다. 연구팀은 향후 보강 연구를 진행해 3D 프린팅 콘크리트의 레올로지 제어, 프리캐스트 콘크리트의 품질 관리 등에도 해당 기술을 활용할 계획이다.
이번 연구는 한국수력원자력(주)와 한국연구재단의 과학기술분야 기초연구사업의 지원으로 수행되었으며, 건설공학 분야에서 권위 있는 학술지인 ACI Materials Journal, Cement and Concrete Research 등에 출판되었다.
(논문명: (1) Quantitative evaluation of energy transfer of a concrete vibrator. (2) Flow simulation of fresh concrete accounting for vibrating compaction.)
한빛원전의 시공 불량 문제를 해결하기 위한 시뮬레이션 개발
후쿠시마 사고 이후 원전 안전 및 관리에 대한 관심이 집중되고 있다. 한국에서는 2017년 6월경 한빛원전의 원자로 격납건물의 콘크리트 벽 속에서 대규모 공극이 발견되었다. 원자로 격납건물은 원전 사고 발생 시 방사능 유출을 막아주는 최후의 보루이기 때문에, 이러한 콘크리트 공극으로 인한 원전의 안전상 우려가 큰 상황이다.
국내 연구진들은 원자로 격납건물 시공시 콘크리트 다짐 및 채움 불량으로 인하여 격납로 내 콘크리트에 공극이 발생한 것으로 추정하고 있다. 원자로 격납건물은 일반 콘크리트 구조물과 달리 매우 높은 밀도의 철근 보강이 필요하기 때문에, 콘크리트 타설 시 진동 다짐기가 진입하지 못하는 구역이 존재할 가능성이 높아서 콘크리트 공동에 대한 위험성이 높다. 하지만 돔 형태의 벽체 내부를 감싼 6 mm 두께의 철판(콘크리트 라이너 플레이트, CLP)이 영구 거푸집으로 활용되기 때문에 내부 공동에 대한 육안 검사가 불가능하다는 점에서 공극 발생 여부의 발견에 대한 어려움이 있다.
우리 대학 건설및환경공학과 김재홍 교수 연구팀은 이러한 문제를 해결하기 위하여 콘크리트의 유동성과 다짐 불량으로 인해 발생하는 공동을 억제할 수 있는 시공 시뮬레이션 기법을 개발했다.
연구팀에서 제안한 콘크리트 유동 시뮬레이션 기법은 콘크리트의 레올로지와 진동다짐의 영향 반경을 고려하여 콘크리트 공동 발생 예상 부위를 예측하는 기술이다. 연구팀은 이번 연구를 통해 콘크리트 진동다짐의 영향 반경(감쇠계수)을 직접 측정하여 굳지 않은 콘크리트 내부의 진동 에너지 밀도 분포를 제시했다. 이어서, 진동 에너지에 따른 콘크리트의 Vibrorheology를 정량적으로 측정하여, 굳지 않은 콘크리트의 항복응력 감소를 정량적으로 모델링하여 시공 시뮬레이션을 가능하게 하였다.
새로 제안된 시공 시뮬레이션 기법은 기존 콘크리트 유동해석으로는 고려할 수 없었던 격납건물 내부 보강재의 형상과 크기, 콘크리트 레올로지, 그리고 진동다짐의 진폭과 진동수까지 고려하여 콘크리트의 채움성을 평가할 수 있게 되었다. 연구팀은 향후 보강 연구를 진행해 3D 프린팅 콘크리트의 레올로지 제어, 프리캐스트 콘크리트의 품질 관리 등에도 해당 기술을 활용할 계획이다.
이번 연구는 한국수력원자력(주)와 한국연구재단의 과학기술분야 기초연구사업의 지원으로 수행되었으며, 건설공학 분야에서 권위 있는 학술지인 ACI Materials Journal, Cement and Concrete Research 등에 출판되었다.
(논문명: (1) Quantitative evaluation of energy transfer of a concrete vibrator. (2) Flow simulation of fresh concrete accounting for vibrating compaction.)
2023.10.24
조회수 7619
-
 천 배 축소된 분광기로 과일 당도 정밀 측정
눈으로 보기에 잘 익은 사과의 당도를 휴대용 분광기로 정확하게 예측이 가능한 기술이 개발됐다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 가시광선 및 근적외선 분광을 바탕으로 현장 진단에 적합한 고해상도의 휴대용 분광 센서를 개발하는 데 성공했다고 24일 밝혔다.
물질이 반사 또는 흡수하는 빛의 파장 분포를 통해 고유의 성분을 분석할 수 있다는 면에서 분광측정은 다양한 응용 분야에서 비파괴 시료 분석에 활발히 사용되고 있다. 기존 상용분광기는 실시간 성분분석을 제공하지만, 시스템의 크기가 커서 휴대용이나 현장 진단에 활용하는데 한계가 존재한다.
최근 마이크로나노공정 기술의 발전으로 소형 분광센서가 개발돼 품질 평가, 환경 모니터링, 위약 진단 및 헬스케어 등에서 활용되고 있다. 하지만 현재의 소형 분광센서들은 내부 광부품들의 간소화를 거치며 광학 성능이 크게 저하돼 시료 분석의 정확도를 낮추고 있으며, 여전히 광학 성능이 저하되지 않으면서 동시에 크기를 줄이는 데 어려움을 겪고 있다.
연구팀은 수 밀리미터 두께의 분광기 내로 들어온 가시광선이 석영(Quartz) 속에 제작된 회절판을 거치며 짧은 거리에서 넓게 분산시키는 형태인 고체잠입회절판구조를 최초로 제안하였다. 또한, 회절판과 굴절률이 유사한 렌즈를 접합하여 분산된 빛이 이미지센서에 평면 초점을 맺히도록 설계하여 가시광선 전 영역에서 균일한 분광분해능을 갖도록 제작하였다. 연구팀이 제작한 마이크로분광기 모듈은 8 mm × 12.5 mm × 15 mm의 크기를 가지고, 이는 기존 상용분광기를 1천 배 이상 축소시킨 성과이다. 또한, 상용분광기의 성능과 비슷한 평균 5.8 nm의 고해상도 및 작동 파장 범위 내 76% 이상의 고감도를 나타낸다.
연구팀은 마이크로분광기 모듈의 응용예시를 실험적으로 검증하기 위해 휴대용 분광 센서를 설계·제작하고, 분광 응용 분야 중 가장 대표적인 사례인 과일의 품질 검증을 진행했다. 제작한 마이크로분광기와 백색 LED 등을 결합한 분광 센서는 과일의 표면에 부착하여 손쉽게 분광 신호를 획득했다. 또한, 분광 신호의 형태를 분석하여 과일의 성숙도를 예측해 실제 성숙도와 비교하고, 0.91 이상의 높은 상관계수로 신뢰도 높은 예측 모델을 정립했다.
이를 통해 기존 소형 분광기에서 발생했던 광학 성능의 저하를 고체잠입회절판구조의 마이크로분광기를 이용해 해결하고, 연구팀은 휴대용 분광 센서의 현장 진단에 활용 가능함을 확인했다.
정기훈 교수는 “이 초박형 및 고해상도의 마이크로분광기는 식음료 품질검사는 물론 현장형 검사/진단이 필요한 농수산물·헬스케어 분야뿐만 아니라 고속 품질분석이 필요한 제약·바이오·반도체 검사 분야에서 정확하고 비침습적인 분석을 위한 중요한 도구 역할을 수행할 수 있을 것”이라고 연구의 의미를 설명했다.
우리 대학 바이오및뇌공학과 박정우 박사과정이 주도한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스 (Advanced Science)’에 게재됐다. (논문명: 휴대용 가시광선 및 근적외선 분광 응용 분야를 위한 초박형 고체잠입회절판구조 마이크로분광기, Fully Integrated Ultrathin Solid Immersion Grating Microspectrometer for Handheld Visible and Near-Infrared Spectroscopic Applications)
한편 이번 연구는 과학기술정보통신부, 재단법인 범부처전주기의료기기연구개발사업단, ㈜파이퀀트의 지원을 받아 수행됐다.
천 배 축소된 분광기로 과일 당도 정밀 측정
눈으로 보기에 잘 익은 사과의 당도를 휴대용 분광기로 정확하게 예측이 가능한 기술이 개발됐다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 가시광선 및 근적외선 분광을 바탕으로 현장 진단에 적합한 고해상도의 휴대용 분광 센서를 개발하는 데 성공했다고 24일 밝혔다.
물질이 반사 또는 흡수하는 빛의 파장 분포를 통해 고유의 성분을 분석할 수 있다는 면에서 분광측정은 다양한 응용 분야에서 비파괴 시료 분석에 활발히 사용되고 있다. 기존 상용분광기는 실시간 성분분석을 제공하지만, 시스템의 크기가 커서 휴대용이나 현장 진단에 활용하는데 한계가 존재한다.
최근 마이크로나노공정 기술의 발전으로 소형 분광센서가 개발돼 품질 평가, 환경 모니터링, 위약 진단 및 헬스케어 등에서 활용되고 있다. 하지만 현재의 소형 분광센서들은 내부 광부품들의 간소화를 거치며 광학 성능이 크게 저하돼 시료 분석의 정확도를 낮추고 있으며, 여전히 광학 성능이 저하되지 않으면서 동시에 크기를 줄이는 데 어려움을 겪고 있다.
연구팀은 수 밀리미터 두께의 분광기 내로 들어온 가시광선이 석영(Quartz) 속에 제작된 회절판을 거치며 짧은 거리에서 넓게 분산시키는 형태인 고체잠입회절판구조를 최초로 제안하였다. 또한, 회절판과 굴절률이 유사한 렌즈를 접합하여 분산된 빛이 이미지센서에 평면 초점을 맺히도록 설계하여 가시광선 전 영역에서 균일한 분광분해능을 갖도록 제작하였다. 연구팀이 제작한 마이크로분광기 모듈은 8 mm × 12.5 mm × 15 mm의 크기를 가지고, 이는 기존 상용분광기를 1천 배 이상 축소시킨 성과이다. 또한, 상용분광기의 성능과 비슷한 평균 5.8 nm의 고해상도 및 작동 파장 범위 내 76% 이상의 고감도를 나타낸다.
연구팀은 마이크로분광기 모듈의 응용예시를 실험적으로 검증하기 위해 휴대용 분광 센서를 설계·제작하고, 분광 응용 분야 중 가장 대표적인 사례인 과일의 품질 검증을 진행했다. 제작한 마이크로분광기와 백색 LED 등을 결합한 분광 센서는 과일의 표면에 부착하여 손쉽게 분광 신호를 획득했다. 또한, 분광 신호의 형태를 분석하여 과일의 성숙도를 예측해 실제 성숙도와 비교하고, 0.91 이상의 높은 상관계수로 신뢰도 높은 예측 모델을 정립했다.
이를 통해 기존 소형 분광기에서 발생했던 광학 성능의 저하를 고체잠입회절판구조의 마이크로분광기를 이용해 해결하고, 연구팀은 휴대용 분광 센서의 현장 진단에 활용 가능함을 확인했다.
정기훈 교수는 “이 초박형 및 고해상도의 마이크로분광기는 식음료 품질검사는 물론 현장형 검사/진단이 필요한 농수산물·헬스케어 분야뿐만 아니라 고속 품질분석이 필요한 제약·바이오·반도체 검사 분야에서 정확하고 비침습적인 분석을 위한 중요한 도구 역할을 수행할 수 있을 것”이라고 연구의 의미를 설명했다.
우리 대학 바이오및뇌공학과 박정우 박사과정이 주도한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스 (Advanced Science)’에 게재됐다. (논문명: 휴대용 가시광선 및 근적외선 분광 응용 분야를 위한 초박형 고체잠입회절판구조 마이크로분광기, Fully Integrated Ultrathin Solid Immersion Grating Microspectrometer for Handheld Visible and Near-Infrared Spectroscopic Applications)
한편 이번 연구는 과학기술정보통신부, 재단법인 범부처전주기의료기기연구개발사업단, ㈜파이퀀트의 지원을 받아 수행됐다.
2023.10.24
조회수 7089
-
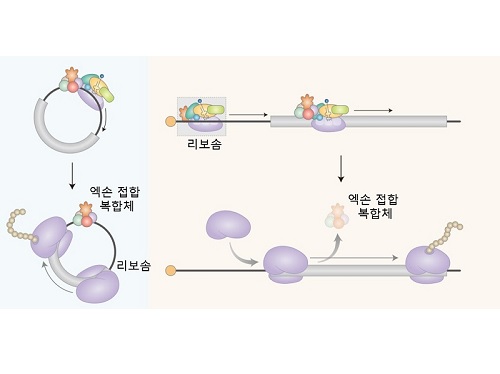 저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24
조회수 7417
-
 카이랄 과학 혁신으로 암질환 치료제부터 인공효소까지
많은 약물은 카이랄 분자로 이루어져 있고 카이랄 분자의 두 거울상(이성질체)은 서로 다른 생물학적 효과를 가질 수 있다. 예를 들면, 하나의 형태는 의학적 효과를 가져올 수 있지만 다른 형태는 독성을 가져올 수 있다. 암 치료 사용 약물은 특정 암세포에만 작용되도록 설계되어 있는데 카이랄성을 활용하면 특정한 형태 약물을 선택적으로 전달할 수 있어 부작용을 줄이고 효과를 극대화할 수 있다. 이런 카이랄성 원리를 통해 암 질환 치료를 위한 약물 전달 등 다양한 분야에서 응용이 가능한 분자과학의 새로운 기술이 개발되었다.
우리 대학 화학과 이희승 교수 연구팀이 원자 수준의 정밀도 로 극미세 나선형 카이랄 통로를 만드는 방법을 발표했다고 19일 밝혔다. 이 통로는 인간 머리카락 직경의 약 5만분의 1에 해당하며, 그 특별한 나선 형태 때문에 특정 분자와만 세밀한 상호작용이 가능하다. 이 기술은 약물의 효율적인 개발부터 첨단 소재 설계에 이르기까지 혁신적인 응용을 가능하게 한다.
연구팀은 자연의 카이랄성 원리에 착안해, 짧은 비천연 펩타이드(아미노산으로 이뤄진 단백질 조각)와 구리 클러스터(다발)를 이용해 규칙적인 나선형 채널을 가진 금속-펩타이드 네트워크를 성공적으로 합성했다. 특히, 연구팀은 카이랄 채널의 세밀한 구조 조절로 이 금속-펩타이드 네트워크가 특정 카이랄성 분자에만 상호작용을 가능하게 만들었으며, 단결정 분석을 통해 이러한 복잡한 상호작용 원리를 명확히 규명했다.
이번 연구에서 연구팀은 기존에 알려진 금속-유기 프레임워크와는 달리, 폴대머(비천연 펩타이드) 기반의 방법을 도입해 3차원 구조 내에서 분자와의 상호작용을 더욱 세밀하게 제어할 수 있는 기술을 선보였다. 이는 분자 공학과 첨단 소재 분야에 새로운 지평을 열 것으로 전망된다.
원자 단위로 정의된 카이랄 채널의 제작은 다양한 분야, 특히 카이랄 촉매, 카이랄 광학센서, 암 질환 치료를 위한 약물 전달 등, 다양한 분야에서의 혁신적인 기술적 발전을 기대하게 한다.
연구를 주도한 이희승 교수는 “이번 연구는 세포막 채널 단백질 또는 효소의 활성부위에서 분자의 기질 특이적 상호작용을 인공적으로 재현하는 노력의 일환으로 시작되었으며, 복잡한 미세 상호작용이 가능하도록 다양한 기능기를 원하는 3차원 위치에 모듈식 치환을 통해 도입할 수 있는 청사진을 제시한 의의가 있다” 고 전하며 “앞으로 약물 전달, 고분자 및 나노기술에 응용이 가능하며 특정 카이랄 반응에 반응하는 인공효소 개발을 위한 핵심 기술로 간주될 것으로 기대된다”며 소감을 밝혔다.
화학과 김재욱 석박사통합과정이 제1 저자로 주도한 이번 연구는 화학소재 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 29.4)' 9월 18일 字 온라인판에 발표됐다.(논문명: Tailoring Enantiomeric Chiral Channels in Metal-Peptide Networks: A Novel Foldamer-Based Approach for Host-Guest Interactions, https://doi.org/10.1002/adma.202305753)
이번 연구는 한국연구재단의 선도연구센터사업(멀티스케일 카이랄구조체 연구센터, CMCA)의 지원으로 진행됐다.
카이랄 과학 혁신으로 암질환 치료제부터 인공효소까지
많은 약물은 카이랄 분자로 이루어져 있고 카이랄 분자의 두 거울상(이성질체)은 서로 다른 생물학적 효과를 가질 수 있다. 예를 들면, 하나의 형태는 의학적 효과를 가져올 수 있지만 다른 형태는 독성을 가져올 수 있다. 암 치료 사용 약물은 특정 암세포에만 작용되도록 설계되어 있는데 카이랄성을 활용하면 특정한 형태 약물을 선택적으로 전달할 수 있어 부작용을 줄이고 효과를 극대화할 수 있다. 이런 카이랄성 원리를 통해 암 질환 치료를 위한 약물 전달 등 다양한 분야에서 응용이 가능한 분자과학의 새로운 기술이 개발되었다.
우리 대학 화학과 이희승 교수 연구팀이 원자 수준의 정밀도 로 극미세 나선형 카이랄 통로를 만드는 방법을 발표했다고 19일 밝혔다. 이 통로는 인간 머리카락 직경의 약 5만분의 1에 해당하며, 그 특별한 나선 형태 때문에 특정 분자와만 세밀한 상호작용이 가능하다. 이 기술은 약물의 효율적인 개발부터 첨단 소재 설계에 이르기까지 혁신적인 응용을 가능하게 한다.
연구팀은 자연의 카이랄성 원리에 착안해, 짧은 비천연 펩타이드(아미노산으로 이뤄진 단백질 조각)와 구리 클러스터(다발)를 이용해 규칙적인 나선형 채널을 가진 금속-펩타이드 네트워크를 성공적으로 합성했다. 특히, 연구팀은 카이랄 채널의 세밀한 구조 조절로 이 금속-펩타이드 네트워크가 특정 카이랄성 분자에만 상호작용을 가능하게 만들었으며, 단결정 분석을 통해 이러한 복잡한 상호작용 원리를 명확히 규명했다.
이번 연구에서 연구팀은 기존에 알려진 금속-유기 프레임워크와는 달리, 폴대머(비천연 펩타이드) 기반의 방법을 도입해 3차원 구조 내에서 분자와의 상호작용을 더욱 세밀하게 제어할 수 있는 기술을 선보였다. 이는 분자 공학과 첨단 소재 분야에 새로운 지평을 열 것으로 전망된다.
원자 단위로 정의된 카이랄 채널의 제작은 다양한 분야, 특히 카이랄 촉매, 카이랄 광학센서, 암 질환 치료를 위한 약물 전달 등, 다양한 분야에서의 혁신적인 기술적 발전을 기대하게 한다.
연구를 주도한 이희승 교수는 “이번 연구는 세포막 채널 단백질 또는 효소의 활성부위에서 분자의 기질 특이적 상호작용을 인공적으로 재현하는 노력의 일환으로 시작되었으며, 복잡한 미세 상호작용이 가능하도록 다양한 기능기를 원하는 3차원 위치에 모듈식 치환을 통해 도입할 수 있는 청사진을 제시한 의의가 있다” 고 전하며 “앞으로 약물 전달, 고분자 및 나노기술에 응용이 가능하며 특정 카이랄 반응에 반응하는 인공효소 개발을 위한 핵심 기술로 간주될 것으로 기대된다”며 소감을 밝혔다.
화학과 김재욱 석박사통합과정이 제1 저자로 주도한 이번 연구는 화학소재 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 29.4)' 9월 18일 字 온라인판에 발표됐다.(논문명: Tailoring Enantiomeric Chiral Channels in Metal-Peptide Networks: A Novel Foldamer-Based Approach for Host-Guest Interactions, https://doi.org/10.1002/adma.202305753)
이번 연구는 한국연구재단의 선도연구센터사업(멀티스케일 카이랄구조체 연구센터, CMCA)의 지원으로 진행됐다.
2023.10.19
조회수 13291
-
 비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12
조회수 7627
-
 손상된 양자얽힘을 되돌리는 기술 개발 성공
현시대 컴퓨터로는 풀기 어려운 문제를 해결하려는 기술이나 고전적으로는 도달할 수 없는 높은 정밀도의 구현, 그리고 원천적으로 해킹이 불가능한 통신 기술들의 공통점은 바로 양자정보 기술을 활용한다는 것이다. 현재 많은 관심을 받고 있는 양자정보 기술의 대부분은 양자얽힘이라는 양자적 특성을 기반으로 한다.
우리 대학 물리학과 라영식 교수 연구팀이 약한 양자측정을 양자얽힘 검증에 도입해 양자얽힘의 직접적 검증을 진행하고, 이 과정에서 손상된 양자얽힘을 되돌림 측정을 이용해 양자얽힘을 원래대로 되돌리는 기술 개발에 성공했다고 10일 밝혔다.
양자얽힘은 고전 물리로 설명될 수 없는 양자 물리의 고유한 특성으로서 서로 멀리 떨어져 있는 두 입자 중 한쪽의 상태가 결정되는 순간 다른 쪽의 상태가 결정되는 독특한 현상을 나타낸다. 양자얽힘의 존재는 양자측정을 사용하여 검증해야 하지만, 이러한 측정 과정 자체가 양자얽힘을 파괴하는 문제가 있어 검증이 완료된 양자얽힘 상태를 차후 양자기술에 활용하는데 어려움이 있었다.
하지만, 연구팀은 이러한 문제를 해결하기 위해 양자얽힘을 완전히 파괴시키지 않는 ‘약한 양자측정’을 도입하여 양자얽힘을 검증하였고, 이 과정에서 손상된 양자얽힘을 ‘되돌림 측정’을 이용해 원상태로 되돌리는 기술을 개발하였다.
‘약한 양자측정’이란 양자상태를 측정할 때 양자상태에 가해지는 변화를 줄이면서도 필요한 정보를 얻어낼 수 있는 양자측정 기술이다. 약한 양자 측정을 양자얽힘 검증에 도입할 경우, 양자얽힘을 완전히 파괴하지 않고도 양자얽힘이 존재하는지 확인할 수 있다.
약한 양자측정 이후 양자상태에 남아 있는 양자얽힘의 양은 원래의 양보다는 적다. 연구진은 ‘되돌림 측정’을 도입해 줄어든 양자얽힘을 원래대로 되돌릴 수 있음을 보였다. 약한 양자측정의 역과정에 해당하는 되돌림 측정은 손상된 양자상태를 일정 확률로 원래대로 되돌려 양자얽힘을 원상태로 복구할 수 있다. 이러한 복구 과정은 앞서 시행한 양자얽힘 검증과 상호 교환 관계가 있어, 연구팀은 두 값을 적절히 조정할 시 양자얽힘의 존재를 검증함과 동시에 되돌려진 양자얽힘을 다시 활용할 수 있음을 보였다.ᅠ
라영식 교수는 "이번 연구를 활용하여 검증된 양자상태를 양자 암호 키 분배, 양자 원격 전송과 같은 다양한 양자 기술 분야에 적용할 수 있을 것ˮ이라고 연구의 의의를 설명했다.
물리학과 김현진 석박사통합과정 학생이 제1 저자로 참여하고 정지혁, 이경준 석박사통합과정 학생이 공동 저자로 참여한 이번 연구는 저명 국제 학술지 `사이언스 어드밴시스(Science Advances)'에 2023년 10월 온라인판으로 정식 출판됐다. (논문명: Recovering quantum entanglement after its certification)
한편 이번 연구는 정보통신기획평가원 (양자인터넷 핵심원천기술 사업, 대학ICT연구센터지원사업)과 한국연구재단 (양자컴퓨팅 기술개발사업, 중견연구자지원사업)의 지원을 받아 수행됐다.
손상된 양자얽힘을 되돌리는 기술 개발 성공
현시대 컴퓨터로는 풀기 어려운 문제를 해결하려는 기술이나 고전적으로는 도달할 수 없는 높은 정밀도의 구현, 그리고 원천적으로 해킹이 불가능한 통신 기술들의 공통점은 바로 양자정보 기술을 활용한다는 것이다. 현재 많은 관심을 받고 있는 양자정보 기술의 대부분은 양자얽힘이라는 양자적 특성을 기반으로 한다.
우리 대학 물리학과 라영식 교수 연구팀이 약한 양자측정을 양자얽힘 검증에 도입해 양자얽힘의 직접적 검증을 진행하고, 이 과정에서 손상된 양자얽힘을 되돌림 측정을 이용해 양자얽힘을 원래대로 되돌리는 기술 개발에 성공했다고 10일 밝혔다.
양자얽힘은 고전 물리로 설명될 수 없는 양자 물리의 고유한 특성으로서 서로 멀리 떨어져 있는 두 입자 중 한쪽의 상태가 결정되는 순간 다른 쪽의 상태가 결정되는 독특한 현상을 나타낸다. 양자얽힘의 존재는 양자측정을 사용하여 검증해야 하지만, 이러한 측정 과정 자체가 양자얽힘을 파괴하는 문제가 있어 검증이 완료된 양자얽힘 상태를 차후 양자기술에 활용하는데 어려움이 있었다.
하지만, 연구팀은 이러한 문제를 해결하기 위해 양자얽힘을 완전히 파괴시키지 않는 ‘약한 양자측정’을 도입하여 양자얽힘을 검증하였고, 이 과정에서 손상된 양자얽힘을 ‘되돌림 측정’을 이용해 원상태로 되돌리는 기술을 개발하였다.
‘약한 양자측정’이란 양자상태를 측정할 때 양자상태에 가해지는 변화를 줄이면서도 필요한 정보를 얻어낼 수 있는 양자측정 기술이다. 약한 양자 측정을 양자얽힘 검증에 도입할 경우, 양자얽힘을 완전히 파괴하지 않고도 양자얽힘이 존재하는지 확인할 수 있다.
약한 양자측정 이후 양자상태에 남아 있는 양자얽힘의 양은 원래의 양보다는 적다. 연구진은 ‘되돌림 측정’을 도입해 줄어든 양자얽힘을 원래대로 되돌릴 수 있음을 보였다. 약한 양자측정의 역과정에 해당하는 되돌림 측정은 손상된 양자상태를 일정 확률로 원래대로 되돌려 양자얽힘을 원상태로 복구할 수 있다. 이러한 복구 과정은 앞서 시행한 양자얽힘 검증과 상호 교환 관계가 있어, 연구팀은 두 값을 적절히 조정할 시 양자얽힘의 존재를 검증함과 동시에 되돌려진 양자얽힘을 다시 활용할 수 있음을 보였다.ᅠ
라영식 교수는 "이번 연구를 활용하여 검증된 양자상태를 양자 암호 키 분배, 양자 원격 전송과 같은 다양한 양자 기술 분야에 적용할 수 있을 것ˮ이라고 연구의 의의를 설명했다.
물리학과 김현진 석박사통합과정 학생이 제1 저자로 참여하고 정지혁, 이경준 석박사통합과정 학생이 공동 저자로 참여한 이번 연구는 저명 국제 학술지 `사이언스 어드밴시스(Science Advances)'에 2023년 10월 온라인판으로 정식 출판됐다. (논문명: Recovering quantum entanglement after its certification)
한편 이번 연구는 정보통신기획평가원 (양자인터넷 핵심원천기술 사업, 대학ICT연구센터지원사업)과 한국연구재단 (양자컴퓨팅 기술개발사업, 중견연구자지원사업)의 지원을 받아 수행됐다.
2023.10.12
조회수 7937
-
 인공지능으로 조현병 원인치료의 실마리 찾다
정신분열증으로도 알려진 조현병은 환청, 환영, 인지장애 등의 증상으로 대표되는 정신질환이다. 국내 연구진이 인공지능을 활용해 그동안 증상 억제만이 가능했던 조현병의 원인을 치료할 수 있는 실마리를 찾았다.
우리 대학 바이오및뇌공학과 이도헌 교수 및 한국한의학연구원(원장 이진용) 공동연구팀이 미국 스탠리 의과학연구소(이하 스탠리연구소) 와의 국제공동연구를 통해 인공지능으로 개인의 유전형과 조현병 사이의 선천적 병리 모델과 조현병 예측 마커를 발굴했다고 27일 밝혔다.
조현병은 2016년 강남역 살인사건, 2019년 진주 방화사건, 2023년 대전 칼부림 사건 등 일부 환자들의 강력범죄와 환자에 대한 사회적 낙인으로 인해 조현병은 심각한 사회적 문제가 되었다. 그러나 이러한 심각성에도 불구하고 조현병의 원인은 명확히 밝혀지지 않아, 리스페리돈(risperidone), 클로자핀(clozapine) 등 항정신병제에 의한 증상의 억제만이 가능한 실정이다.
이도헌 교수 연구팀은 미 스탠리연구소의 다수준 뇌 조직 데이터에 최근 주목받는 인공지능 기술인 `설명가능한 심층학습' 기술을 접목해, 선천적 유전형과 조현병 사이의 병리를 설명하는 인공신경망 모델을 구축했다. 그리고 모델을 해석하여, 선천적 유전형이 유전자·단백질 발현 조절을 통해 뇌의 전전두엽피질, 안와전두엽피질 신경세포의 발생을 변화시켜 조현병 취약성을 결정한다는 사실을 밝혀냈다. 또한, 뇌의 신경세포 밀도를 감소시키는 유전형 조합을 조현병 예측 마커로 제시해, 개인화된 조현병 예측과 세포 치료 등을 통한 조현병 원인치료의 가능성을 열었다.
이도헌 교수는 바이오의료 분야는 `속내를 알 수 없는 인공지능'보다는 `속내를 해석가능한 인공지능'이 꼭 필요한 분야라고 강조하면서, “기존의 인공지능과 비교했을 때 이번 연구에서는 인공신경망의 중간 노드에 유전자 이름, 세포의 상태와 같은 구체적인 생물학적 의미가 부여된 노드를 배치하고 그들간의 연결관계를 기계학습기법으로 분석했다”라고 말했다.
바이오및뇌공학과 이도헌 교수, 조유상 박사(現 한국한의학연구원 선임연구원), 미 스탠리연구소 김상현 박사, 마리 웹스터 박사가 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 세계적 학술지인 `기능유전체학 브리핑(Briefings in Functional Genomics)'지 2023년 9월호에 게재됐다.
인공지능으로 조현병 원인치료의 실마리 찾다
정신분열증으로도 알려진 조현병은 환청, 환영, 인지장애 등의 증상으로 대표되는 정신질환이다. 국내 연구진이 인공지능을 활용해 그동안 증상 억제만이 가능했던 조현병의 원인을 치료할 수 있는 실마리를 찾았다.
우리 대학 바이오및뇌공학과 이도헌 교수 및 한국한의학연구원(원장 이진용) 공동연구팀이 미국 스탠리 의과학연구소(이하 스탠리연구소) 와의 국제공동연구를 통해 인공지능으로 개인의 유전형과 조현병 사이의 선천적 병리 모델과 조현병 예측 마커를 발굴했다고 27일 밝혔다.
조현병은 2016년 강남역 살인사건, 2019년 진주 방화사건, 2023년 대전 칼부림 사건 등 일부 환자들의 강력범죄와 환자에 대한 사회적 낙인으로 인해 조현병은 심각한 사회적 문제가 되었다. 그러나 이러한 심각성에도 불구하고 조현병의 원인은 명확히 밝혀지지 않아, 리스페리돈(risperidone), 클로자핀(clozapine) 등 항정신병제에 의한 증상의 억제만이 가능한 실정이다.
이도헌 교수 연구팀은 미 스탠리연구소의 다수준 뇌 조직 데이터에 최근 주목받는 인공지능 기술인 `설명가능한 심층학습' 기술을 접목해, 선천적 유전형과 조현병 사이의 병리를 설명하는 인공신경망 모델을 구축했다. 그리고 모델을 해석하여, 선천적 유전형이 유전자·단백질 발현 조절을 통해 뇌의 전전두엽피질, 안와전두엽피질 신경세포의 발생을 변화시켜 조현병 취약성을 결정한다는 사실을 밝혀냈다. 또한, 뇌의 신경세포 밀도를 감소시키는 유전형 조합을 조현병 예측 마커로 제시해, 개인화된 조현병 예측과 세포 치료 등을 통한 조현병 원인치료의 가능성을 열었다.
이도헌 교수는 바이오의료 분야는 `속내를 알 수 없는 인공지능'보다는 `속내를 해석가능한 인공지능'이 꼭 필요한 분야라고 강조하면서, “기존의 인공지능과 비교했을 때 이번 연구에서는 인공신경망의 중간 노드에 유전자 이름, 세포의 상태와 같은 구체적인 생물학적 의미가 부여된 노드를 배치하고 그들간의 연결관계를 기계학습기법으로 분석했다”라고 말했다.
바이오및뇌공학과 이도헌 교수, 조유상 박사(現 한국한의학연구원 선임연구원), 미 스탠리연구소 김상현 박사, 마리 웹스터 박사가 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 세계적 학술지인 `기능유전체학 브리핑(Briefings in Functional Genomics)'지 2023년 9월호에 게재됐다.
2023.09.27
조회수 10129
 부드러워져 재사용 불가능한 주사바늘 개발
정맥주사는 혈관에 약물을 직접 주입하는 방법으로 신속한 효과를 유도하고 지속적인 약물 투여를 통한 치료가 가능해 범세계적으로 환자치료에 통용되고 있다. 하지만 금속이나 플라스틱 등 딱딱한 소재로 제작된 주사바늘은 부드러운 생체조직에 손상과 염증을 발생시킬 수 있다. 또한 비용 절감을 위한 비윤리적 주사바늘 재사용을 가능하게 하며, 이는 인체면역 결핍 바이러스(HIV), B형/C형 간염 바이러스 등 심각한 혈액 매개 질환 감염을 초래하기도 한다. 이는 전 세계적인 문제이며, 감염관리의 중요성으로 인해 세계보건기구(WHO)는 재사용이 불가능한 스마트 주사기 개발과 사용을 장려하고 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 의과학대학원 정원일 교수 연구팀과 공동 연구를 통해 환자 건강증진 및 의료진 안전을 도모할 수 있는 가변 강성 정맥 주사바늘을 개발하는 데 성공했다고 13일 밝혔다.
이번에 개발된 기술은 체온에 의해 주사바늘이 유연해지는 특성을 통해 정맥에 약물 주입 중 주사 삽입 부위의 자유로운 움직임을 보장함과 동시에 주사바늘에 의한 혈관 벽 손상 방지를 도모할 수 있을 것으로 예상된다. 또한 사용 후 찔림 사고나 비윤리적 주사기 재사용에 따른 혈액 매개 질환 감염 문제를 예방할 수 있을 것이라 기대된다.
전기및전자공학부 카렌-크리스티안 아그노(Karen-Christian Agno) 박사과정 연구원과 의과학대학원 양경모 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)' 10월 30일 字에 게재됐다. (논문명 : A temperature-responsive intravenous needle that irreversibly softens on insertion)
연구팀은 액체금속의 일종인 갈륨(Gallium)을 이용하여 주사바늘 구조를 만들고 이를 생체적합성 폴리머로 코팅해 가변 강성 정맥 주사바늘을 제작했다. 딱딱한 상태의 주사바늘은 상용 정맥 카테터와 비슷한 수준의 생체조직 관통력을 갖는다. 하지만 체내 삽입 후, 갈륨의 액체화로 인해 조직과 같이 부드러운 상태로 변해 혈관 손상 없이 안정적인 약물 전달이 가능하다. 한 번 사용한 주사바늘은 갈륨의 과냉각 현상에 의해 상온에서도 부드러운 상태를 유지해 바늘 찔림 사고나 재사용 문제를 원천적으로 방지할 수 있다.
연구팀은 개발된 정맥 주사바늘의 약물 전달 기능과 생체적합성을 검증하고자 실험 쥐를 대상으로 동물실험을 진행했다. 이식된 가변 강성 정맥 주사바늘은 딱딱한 상용 금속 바늘이나 플라스틱 카테터에 비해 훨씬 낮은 염증 반응을 보여 연구팀은 우수한 생체적합성을 확인했다. 또한 상용 주사바늘과 같이 안정적으로 약물을 전달할 수 있음을 확인했다.
아울러 가변 강성 정맥 주사바늘은 박막형 온도 센서를 탑재할 수 있도록 디자인됐다. 이를 통해 실시간으로 환자의 심부체온을 모니터링하는 것이 가능하며, 또한 잘못된 주사바늘 위치로 인한 혈관이 아닌 다른 조직으로의 약물 누수 감지도 가능해 환자에게 더 나은 의료서비스를 제공할 수 있다.
이번 연구를 주도한 정재웅 교수는 "개발된 가변 강성 정맥 주사바늘은 기존의 딱딱한 의료용 바늘로 인한 문제를 극복해 환자와 의료진 모두의 안전을 보장하고, 주사바늘 재사용으로 인한 감염 문제를 해결할 수 있다는 점에서 가치가 매우 크다”라고 말했다.
한편 이번 연구는 한국연구재단이 추진하는 중견연구자지원사업, 생체신호센서융합기술개발사업, 리더연구자지원사업의 지원을 받아 수행됐다.
2023.11.13 조회수 11168
부드러워져 재사용 불가능한 주사바늘 개발
정맥주사는 혈관에 약물을 직접 주입하는 방법으로 신속한 효과를 유도하고 지속적인 약물 투여를 통한 치료가 가능해 범세계적으로 환자치료에 통용되고 있다. 하지만 금속이나 플라스틱 등 딱딱한 소재로 제작된 주사바늘은 부드러운 생체조직에 손상과 염증을 발생시킬 수 있다. 또한 비용 절감을 위한 비윤리적 주사바늘 재사용을 가능하게 하며, 이는 인체면역 결핍 바이러스(HIV), B형/C형 간염 바이러스 등 심각한 혈액 매개 질환 감염을 초래하기도 한다. 이는 전 세계적인 문제이며, 감염관리의 중요성으로 인해 세계보건기구(WHO)는 재사용이 불가능한 스마트 주사기 개발과 사용을 장려하고 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 의과학대학원 정원일 교수 연구팀과 공동 연구를 통해 환자 건강증진 및 의료진 안전을 도모할 수 있는 가변 강성 정맥 주사바늘을 개발하는 데 성공했다고 13일 밝혔다.
이번에 개발된 기술은 체온에 의해 주사바늘이 유연해지는 특성을 통해 정맥에 약물 주입 중 주사 삽입 부위의 자유로운 움직임을 보장함과 동시에 주사바늘에 의한 혈관 벽 손상 방지를 도모할 수 있을 것으로 예상된다. 또한 사용 후 찔림 사고나 비윤리적 주사기 재사용에 따른 혈액 매개 질환 감염 문제를 예방할 수 있을 것이라 기대된다.
전기및전자공학부 카렌-크리스티안 아그노(Karen-Christian Agno) 박사과정 연구원과 의과학대학원 양경모 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)' 10월 30일 字에 게재됐다. (논문명 : A temperature-responsive intravenous needle that irreversibly softens on insertion)
연구팀은 액체금속의 일종인 갈륨(Gallium)을 이용하여 주사바늘 구조를 만들고 이를 생체적합성 폴리머로 코팅해 가변 강성 정맥 주사바늘을 제작했다. 딱딱한 상태의 주사바늘은 상용 정맥 카테터와 비슷한 수준의 생체조직 관통력을 갖는다. 하지만 체내 삽입 후, 갈륨의 액체화로 인해 조직과 같이 부드러운 상태로 변해 혈관 손상 없이 안정적인 약물 전달이 가능하다. 한 번 사용한 주사바늘은 갈륨의 과냉각 현상에 의해 상온에서도 부드러운 상태를 유지해 바늘 찔림 사고나 재사용 문제를 원천적으로 방지할 수 있다.
연구팀은 개발된 정맥 주사바늘의 약물 전달 기능과 생체적합성을 검증하고자 실험 쥐를 대상으로 동물실험을 진행했다. 이식된 가변 강성 정맥 주사바늘은 딱딱한 상용 금속 바늘이나 플라스틱 카테터에 비해 훨씬 낮은 염증 반응을 보여 연구팀은 우수한 생체적합성을 확인했다. 또한 상용 주사바늘과 같이 안정적으로 약물을 전달할 수 있음을 확인했다.
아울러 가변 강성 정맥 주사바늘은 박막형 온도 센서를 탑재할 수 있도록 디자인됐다. 이를 통해 실시간으로 환자의 심부체온을 모니터링하는 것이 가능하며, 또한 잘못된 주사바늘 위치로 인한 혈관이 아닌 다른 조직으로의 약물 누수 감지도 가능해 환자에게 더 나은 의료서비스를 제공할 수 있다.
이번 연구를 주도한 정재웅 교수는 "개발된 가변 강성 정맥 주사바늘은 기존의 딱딱한 의료용 바늘로 인한 문제를 극복해 환자와 의료진 모두의 안전을 보장하고, 주사바늘 재사용으로 인한 감염 문제를 해결할 수 있다는 점에서 가치가 매우 크다”라고 말했다.
한편 이번 연구는 한국연구재단이 추진하는 중견연구자지원사업, 생체신호센서융합기술개발사업, 리더연구자지원사업의 지원을 받아 수행됐다.
2023.11.13 조회수 11168 고성능 비 백금계 연료전지 촉매 개발
연료전지는 부산물로 물 만을 배출하는 친환경적인 에너지 변환 장치로, 다양한 연료전지 중 양성자 교환막 연료전지(PEMFC)는 수송용 및 발전용 연료전지로 현재 상용화가 진행 중이다. 다만 연료전지의 촉매로 사용되는 백금 촉매는 자원의 희소성으로 인한 높은 가격 때문에 대량 생산 및 전 세계적인 보급에 문제점을 갖고 있었다.
우리 대학 생명화학공학과 이진우 교수 연구팀이 국민대학교 장세근 교수 연구팀, 서강대학교 백서인 교수 연구팀과 공동연구를 통해 비백금계 촉매 기반 고 전력밀도의 양성자 교환막 연료전지를 개발했다고 7일 밝혔다.
상대적으로 다른 비 백금계 촉매들에 비해 좋은 성능을 가진다고 알려져 백금을 대체하고 기존 연료전지 비용을 줄이기 위한 가장 유력한 후보 물질로 주목받아 온 M-N-C계 촉매는 PEMFC 연료전지에서 높은 전력밀도를 구현하는 데는 많은 한계가 있었다.
이진우 연구팀은 기존 백금 촉매를 대체할 수 있는 비 백금계 Fe-N-C 촉매의 높은 성능을 구현해 매우 뛰어난 가격 경쟁력과 높은 전력밀도의 연료전지 성능을 달성했다.
연구팀은 M-N-C 촉매 중 하나인 Fe-N-C 촉매 나노입자의 활성점 주변의 결함 정도를 조절하여 높은 성능의 Fe-N-C 촉매를 합성했다. 탄소 기반의 물질을 특정 양의 이산화탄소(CO2)를 흘려주면서 열처리를 진행하는 이산화탄소 활성화 방법을 통해 탄소 기반 촉매 내부의 결함 정도를 미세 조정했고 그에 따른 최적화된 촉매가 활성화되는 것을 확인했다.
연구팀은 결과적으로 적절한 결함을 가질 때 철 단일원자 활성점의 전자구조가 최적화되면서 결함을 만들지 않은 기존 Fe-N-C 촉매에 비해 매우 우수한 전기화학적 성능을 제공하는 것을 확인해 결함과 활성점의 성능 상관관계에 대하여 규명했다.
연구팀이 개발을 한 최적화된 Fe-N-C촉매는 PEMFC 연료전지에서 기존에 개발이 된 Fe-N-C촉매보다 44% 향상된 높은 전력 밀도를 보였으며 현재 사용이 되고 있는 백금 촉매를 대체를 할 수 있음을 PEMFC단전지에서 보여주었다.
연구팀이 개발한 비 백금계 Fe-N-C촉매는 높은 전기화학적 특성으로 기존의 백금 촉매 대체를 통해 연료전지의 스택 가격 감소와 그에 따른 상용화에 이바지할 수 있을 것으로 기대된다.
KAIST 생명화학공학과 이승엽 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 머티리얼스 (Advanced materials)' 10월 13일 온라인으로 게재됐다. (논문명: Insight into Defect Engineering of Atomically Dispersed Iron Electrocatalysts for High-Performance Proton Exchange Membrane Fuel Cell)
이진우 교수는 "비 백금계 Fe-N-C 촉매의 결함과 성능의 관계를 밝히고 결함 조절을 통해서 백금을 전혀 사용하지 않고 높은 전력밀도의 양성자 교환막 연료전지를 개발한 것은 큰 의미가 있으며 개발된 촉매 및 합성 방법은 향후 다양한 종류의 연료전지에서 귀금속인 백금을 대체하여 적용할 수 있을 것으로 기대된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업과 한국전력 사외공모 기초연구지원사업의 지원을 받아 수행됐다.
2023.11.07 조회수 8076
고성능 비 백금계 연료전지 촉매 개발
연료전지는 부산물로 물 만을 배출하는 친환경적인 에너지 변환 장치로, 다양한 연료전지 중 양성자 교환막 연료전지(PEMFC)는 수송용 및 발전용 연료전지로 현재 상용화가 진행 중이다. 다만 연료전지의 촉매로 사용되는 백금 촉매는 자원의 희소성으로 인한 높은 가격 때문에 대량 생산 및 전 세계적인 보급에 문제점을 갖고 있었다.
우리 대학 생명화학공학과 이진우 교수 연구팀이 국민대학교 장세근 교수 연구팀, 서강대학교 백서인 교수 연구팀과 공동연구를 통해 비백금계 촉매 기반 고 전력밀도의 양성자 교환막 연료전지를 개발했다고 7일 밝혔다.
상대적으로 다른 비 백금계 촉매들에 비해 좋은 성능을 가진다고 알려져 백금을 대체하고 기존 연료전지 비용을 줄이기 위한 가장 유력한 후보 물질로 주목받아 온 M-N-C계 촉매는 PEMFC 연료전지에서 높은 전력밀도를 구현하는 데는 많은 한계가 있었다.
이진우 연구팀은 기존 백금 촉매를 대체할 수 있는 비 백금계 Fe-N-C 촉매의 높은 성능을 구현해 매우 뛰어난 가격 경쟁력과 높은 전력밀도의 연료전지 성능을 달성했다.
연구팀은 M-N-C 촉매 중 하나인 Fe-N-C 촉매 나노입자의 활성점 주변의 결함 정도를 조절하여 높은 성능의 Fe-N-C 촉매를 합성했다. 탄소 기반의 물질을 특정 양의 이산화탄소(CO2)를 흘려주면서 열처리를 진행하는 이산화탄소 활성화 방법을 통해 탄소 기반 촉매 내부의 결함 정도를 미세 조정했고 그에 따른 최적화된 촉매가 활성화되는 것을 확인했다.
연구팀은 결과적으로 적절한 결함을 가질 때 철 단일원자 활성점의 전자구조가 최적화되면서 결함을 만들지 않은 기존 Fe-N-C 촉매에 비해 매우 우수한 전기화학적 성능을 제공하는 것을 확인해 결함과 활성점의 성능 상관관계에 대하여 규명했다.
연구팀이 개발을 한 최적화된 Fe-N-C촉매는 PEMFC 연료전지에서 기존에 개발이 된 Fe-N-C촉매보다 44% 향상된 높은 전력 밀도를 보였으며 현재 사용이 되고 있는 백금 촉매를 대체를 할 수 있음을 PEMFC단전지에서 보여주었다.
연구팀이 개발한 비 백금계 Fe-N-C촉매는 높은 전기화학적 특성으로 기존의 백금 촉매 대체를 통해 연료전지의 스택 가격 감소와 그에 따른 상용화에 이바지할 수 있을 것으로 기대된다.
KAIST 생명화학공학과 이승엽 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `어드밴스드 머티리얼스 (Advanced materials)' 10월 13일 온라인으로 게재됐다. (논문명: Insight into Defect Engineering of Atomically Dispersed Iron Electrocatalysts for High-Performance Proton Exchange Membrane Fuel Cell)
이진우 교수는 "비 백금계 Fe-N-C 촉매의 결함과 성능의 관계를 밝히고 결함 조절을 통해서 백금을 전혀 사용하지 않고 높은 전력밀도의 양성자 교환막 연료전지를 개발한 것은 큰 의미가 있으며 개발된 촉매 및 합성 방법은 향후 다양한 종류의 연료전지에서 귀금속인 백금을 대체하여 적용할 수 있을 것으로 기대된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업과 한국전력 사외공모 기초연구지원사업의 지원을 받아 수행됐다.
2023.11.07 조회수 8076 포스트 AI 시대 핵심 신소재는?
우리 대학 신소재공학과 김상욱 교수 연구팀이 인공지능(Artificial Intelligence, 이하 AI)이 불러온 4차 산업혁명 이후를 뜻하는 포스트 AI시대의 핵심 신소재를 전망하는 초청논문을 발표했다고 6일 밝혔다.
대화형 AI인 `챗GPT(ChatGPT)'가 월간 사용자 1억 명을 두 달 만에 달성하는 등 AI는 우리 생활에 한층 가까이 다가왔다. 4차 산업혁명의 핵심 기술인 AI는 인간의 지능을 모사해 데이터를 학습하고 이에 따라 합리적인 의사결정을 내릴 수 있다. 단순 반복적인 작업을 대체하는데 머물렀던 과거 인공지능 기술들과 달리, 더욱 어렵고 복잡한 작업을 효율적으로 수행할 수 있어 의료, 자율 주행 자동차, 로보틱스 등의 분야에서 새로운 기술 혁신을 이루고 있다.
최근에는 사물인터넷(IoT) 기술의 발전과 함께 현실 세계의 다양한 사물과 개체들이 인터넷을 통해 연결된 초연결 시대가 도래하고 있다. 포스트 AI 시대에는 AI가 다양한 기기들과 결합해 우리 주변의 정보를 항상 받아들이고 이에 따라 최적의 의사결정을 하며 이를 현실적으로 실물세계에 구현하는 사이버세계와 현실세계가 하나로 융합되는 시대가 될 것으로 전망되고 있다.
포스트 AI 시대가 다가옴에 따라 웨어러블 장치를 위한 스마트 섬유, 소프트 로보틱스를 위한 인공근육, 환경친화적인 에너지 생산효율을 극대화할 수 있는 단일원자촉매등 AI의 한계를 보조하고 보완할 수 있는 신소재의 혁신이 더욱 중요해지고 있으며, 무엇보다 실용적인 기술의 확보가 시급하다.
김상욱 교수 연구팀은 스마트 섬유 개발의 원천소재인 그래핀 산화물 액정성을 세계 최초로 발견하였고, 소프트 로보틱스 분야에 새로운 돌파구를 마련한 헤라클레스 인공 근육 개발 그리고 세계 최초로 단일원자촉매를 발견하는 등 미래 신소재분야에서 혁신적인 연구를 수행해 온 공로를 인정받아 세계적인 학술지 `어드밴스드 머티리얼스 (Advanced Materials)' 명예의 전당(Hall of Fame) 특집 리뷰논문을 게재했다.
`어드밴스드 머티리얼스' 명예의 전당 초청논문은 신소재 분야의 세계적인 석학들을 매우 엄격한 기준에 따라 선정하여 그 미래 연구방향을 소개하는 권위 있는 특집 논문이다.
김상욱 교수는 "인공지능이 이끄는 4차 산업혁명 이후의 포스트 AI 시대는 신소재 기반의 사물 혁신이 중요해질 것인데 그래핀과 같은 2차원 소재가 매우 중요한 역할을 할 것으로 기대된다ˮ고 밝혔다.
KAIST 응용과학연구소 이강산 박사가 제1 저자로 참여하고 KAIST 신소재공학과 수치스라 파드마잔 사시카라(Suchithra Padmajan Sasikala) 연구교수와 경희대학교 정보디스플레이학과 임준원 교수가 공동 교신저자로 참여한 이번 연구는 한국연구재단의 리더 연구자 지원사업인 다차원 나노 조립제어 창의연구단의 지원을 받아 수행됐다.
*논문명: 2D Materials Beyond Post-AI Era: Smart Fibers, Soft Robotics And Single Atom Catalysts
2023.11.06 조회수 10233
포스트 AI 시대 핵심 신소재는?
우리 대학 신소재공학과 김상욱 교수 연구팀이 인공지능(Artificial Intelligence, 이하 AI)이 불러온 4차 산업혁명 이후를 뜻하는 포스트 AI시대의 핵심 신소재를 전망하는 초청논문을 발표했다고 6일 밝혔다.
대화형 AI인 `챗GPT(ChatGPT)'가 월간 사용자 1억 명을 두 달 만에 달성하는 등 AI는 우리 생활에 한층 가까이 다가왔다. 4차 산업혁명의 핵심 기술인 AI는 인간의 지능을 모사해 데이터를 학습하고 이에 따라 합리적인 의사결정을 내릴 수 있다. 단순 반복적인 작업을 대체하는데 머물렀던 과거 인공지능 기술들과 달리, 더욱 어렵고 복잡한 작업을 효율적으로 수행할 수 있어 의료, 자율 주행 자동차, 로보틱스 등의 분야에서 새로운 기술 혁신을 이루고 있다.
최근에는 사물인터넷(IoT) 기술의 발전과 함께 현실 세계의 다양한 사물과 개체들이 인터넷을 통해 연결된 초연결 시대가 도래하고 있다. 포스트 AI 시대에는 AI가 다양한 기기들과 결합해 우리 주변의 정보를 항상 받아들이고 이에 따라 최적의 의사결정을 하며 이를 현실적으로 실물세계에 구현하는 사이버세계와 현실세계가 하나로 융합되는 시대가 될 것으로 전망되고 있다.
포스트 AI 시대가 다가옴에 따라 웨어러블 장치를 위한 스마트 섬유, 소프트 로보틱스를 위한 인공근육, 환경친화적인 에너지 생산효율을 극대화할 수 있는 단일원자촉매등 AI의 한계를 보조하고 보완할 수 있는 신소재의 혁신이 더욱 중요해지고 있으며, 무엇보다 실용적인 기술의 확보가 시급하다.
김상욱 교수 연구팀은 스마트 섬유 개발의 원천소재인 그래핀 산화물 액정성을 세계 최초로 발견하였고, 소프트 로보틱스 분야에 새로운 돌파구를 마련한 헤라클레스 인공 근육 개발 그리고 세계 최초로 단일원자촉매를 발견하는 등 미래 신소재분야에서 혁신적인 연구를 수행해 온 공로를 인정받아 세계적인 학술지 `어드밴스드 머티리얼스 (Advanced Materials)' 명예의 전당(Hall of Fame) 특집 리뷰논문을 게재했다.
`어드밴스드 머티리얼스' 명예의 전당 초청논문은 신소재 분야의 세계적인 석학들을 매우 엄격한 기준에 따라 선정하여 그 미래 연구방향을 소개하는 권위 있는 특집 논문이다.
김상욱 교수는 "인공지능이 이끄는 4차 산업혁명 이후의 포스트 AI 시대는 신소재 기반의 사물 혁신이 중요해질 것인데 그래핀과 같은 2차원 소재가 매우 중요한 역할을 할 것으로 기대된다ˮ고 밝혔다.
KAIST 응용과학연구소 이강산 박사가 제1 저자로 참여하고 KAIST 신소재공학과 수치스라 파드마잔 사시카라(Suchithra Padmajan Sasikala) 연구교수와 경희대학교 정보디스플레이학과 임준원 교수가 공동 교신저자로 참여한 이번 연구는 한국연구재단의 리더 연구자 지원사업인 다차원 나노 조립제어 창의연구단의 지원을 받아 수행됐다.
*논문명: 2D Materials Beyond Post-AI Era: Smart Fibers, Soft Robotics And Single Atom Catalysts
2023.11.06 조회수 10233 조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.11.01 조회수 5277
조영제 없이 흐르는 혈구 3차원 고속촬영 가능
생체 내 미세혈관 안에 흐르는 혈류의 여러 가지 혈류역학 정보는 관련된 장기들의 건강과 밀접하게 연결되어 있어, 이의 정확한 측정과 분석은 여러 질병 연구에 매우 중요하다. 이를 위해 가장 좋은 방법은 다양한 혈관들 안에 흐르는 혈구들을 직접 높은 시간해상도로 이미징하는 것이겠지만, 현재까지는 이러한 기술이 존재하지 않아 혈류속도와 상관관계가 있는 다른 값들을 측정해 간접적으로 유추하거나 일부 혈구들을 형광 염색한 후 주입해 이미징하는 방법 등이 사용되고 있다.
우리 대학 기계공학과/KI헬스사이언스연구소 오왕열 교수 연구팀이 세계 최초로 복잡한 3차원 혈관구조 안에서 흐르는 혈구들을 아무런 조영제 사용 없이 고속으로 이미징하는 기술을 개발했다고 1일 밝혔다.
현미경으로 생체를 이미징하면 혈구뿐만 아니라 조직으로부터도 반사 및 산란된 빛이 많기 때문에 혈구만을 선택적으로 이미징하기는 어렵다. 이번에 개발된 기술은 형광 조영제와 같은 외부 물질을 전혀 사용하지 않고 넓은 3차원 영역에 복잡하게 분포돼있는 다양한 혈관 내에 흐르는 혈구들을 직접 고속으로 이미징해(초당 1,450장의 이미지 획득) 큰 주목을 받고 있다.
오왕열 교수 연구팀은 흐르는 혈구들의 특성을 이용해 고안한 영상처리 방법 개발을 통해 현미경 이미지로부터 흐르는 혈구들만을 영상화하는 데 성공했다. 또한, 공간적으로 상관성이 없는 조명을 사용해 스페클 노이즈(반점 잡음)에 의해 혈구가 보이지 않게 되는 것을 막았으며, 속도가 빠르면서도 각 픽셀이 한 번에 획득할 수 있는 광량이 큰 카메라를 사용해 고속으로 생체 내 깊은 곳에 있는 흐르는 혈구까지 이미징할 수 있게 했다.
오왕열 교수는 “다양한 혈관 안의 혈류속도, 단위 시간당 흐르는 혈구 개수 등은 생체를 이용한 바이오메디컬 연구에서 매우 중요한 정보이기 때문에 오랫동안 많은 연구가 집중돼 왔다. 당연히, 혈관 안에 다양한 속도로 흐르는 혈구를 직접 이미징할 수 있으면 가장 좋겠지만, 그러한 영상 기기나 방법이 존재하지 않아 혈류속도와 관련있는 도플러 신호 등을 측정해 속도를 추산하거나, 혈장 혹은 일부 혈구를 형광 염색해 형광현미경으로 이미징하는 방법이 주로 사용되고 있었다. 새로 개발한 기술은 형광 조영제와 같은 아무런 물질을 생체에 주사하지 않고도, 여러 혈관 안에 흐르는 혈구들만을 고속으로 직접 영상화할 수 있어서, 현장에서의 사용이 매우 편리할 뿐 아니라 정확한 혈류역학 정보를 바로 얻어낼 수 있어, 연구 현장에서 매우 유용하게 사용될 것”이라고 강한 기대를 보였다.
우리 대학 김경환 학생과 박현상 박사가 공동 제1 저자로 참여한 이번 연구 결과는 융합연구분야 선도 저널인 스몰(Small) 10월호에 게재됐다. (논문명: Direct Blood Cell Flow Imaging in Microvascular Networks)
한편 이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2023.11.01 조회수 5277 변화된 데이터에서 인공지능 공정성 찾아내다
인공지능 기술이 사회 전반에 걸쳐 광범위하게 활용되며 인간의 삶에 많은 영향을 미치고 있다. 최근 인공지능의 긍정적인 효과 이면에 범죄자의 재범 예측을 위해 머신러닝 학습에 사용되는 콤파스(COMPAS) 시스템을 기반으로 학습된 모델이 인종 별로 서로 다른 재범 확률을 부여할 수 있다는 심각한 편향성이 관찰되었다. 이 밖에도 채용, 대출 시스템 등 사회의 중요 영역에서 인공지능의 다양한 편향성 문제가 밝혀지며, 공정성(fairness)을 고려한 머신러닝 학습의 필요성이 커지고 있다.
우리 대학 전기및전자공학부 황의종 교수 연구팀이 학습 상황과 달라진 새로운 분포의 테스트 데이터에 대해서도 편향되지 않은 판단을 내리도록 돕는 새로운 모델 훈련 기술을 개발했다고 30일 밝혔다.
최근 전 세계의 연구자들이 인공지능의 공정성을 높이기 위한 다양한 학습 방법론을 제안하고 있지만, 대부분의 연구는 인공지능 모델을 훈련시킬 때 사용되는 데이터와 실제 테스트 상황에서 사용될 데이터가 같은 분포를 갖는다고 가정한다. 하지만 실제 상황에서는 이러한 가정이 대체로 성립하지 않으며, 최근 다양한 어플리케이션에서 학습 데이터와 테스트 데이터 내의 편향 패턴이 크게 변화할 수 있음이 관측되고 있다.
이때, 테스트 환경에서 데이터의 정답 레이블과 특정 그룹 정보 간의 편향 패턴이 변경되면, 사전에 공정하게 학습되었던 인공지능 모델의 공정성이 직접적인 영향을 받고 다시금 악화된 편향성을 가질 수 있다. 일례로 과거에 특정 인종 위주로 채용하던 기관이 이제는 인종에 관계없이 채용한다면, 과거의 데이터를 기반으로 공정하게 학습된 인공지능 채용 모델이 현대의 데이터에는 오히려 불공정한 판단을 내릴 수 있다.
연구팀은 이러한 문제를 해결하기 위해, 먼저 `상관관계 변화(correlation shifts)' 개념을 도입해 기존의 공정성을 위한 학습 알고리즘들이 가지는 정확성과 공정성 성능에 대한 근본적인 한계를 이론적으로 분석했다. 예를 들어 특정 인종만 주로 채용한 과거 데이터의 경우 인종과 채용의 상관관계가 강해서 아무리 공정한 모델을 학습을 시켜도 현재의 약한 상관관계를 반영하는 정확하면서도 공정한 채용 예측을 하기가 근본적으로 어려운 것이다. 이러한 이론적인 분석을 바탕으로, 새로운 학습 데이터 샘플링 기법을 제안해 테스트 시에 데이터의 편향 패턴이 변화해도 모델을 공정하게 학습할 수 있도록 하는 새로운 학습 프레임워크를 제안했다. 이는 과거 데이터에서 우세하였던 특정 인종 데이터를 상대적으로 줄임으로써 채용과의 상관관계를 낮출 수 있다.
제안된 기법의 주요 이점은 데이터 전처리만 하기 때문에 기존에 제안된 알고리즘 기반 공정한 학습 기법을 그대로 활용하면서 개선할 수 있다는 것이다. 즉 이미 사용되고 있는 공정한 학습 알고리즘이 위에서 설명한 상관관계 변화에 취약하다면 제안된 기법을 함께 사용해서 해결할 수 있다.
제1 저자인 전기및전자공학부 노유지 박사과정 학생은 "이번 연구를 통해 인공지능 기술의 실제 적용 환경에서, 모델이 더욱 신뢰 가능하고 공정한 판단을 하도록 도울 것으로 기대한다ˮ고 밝혔다.
연구팀을 지도한 황의종 교수는 "기존 인공지능이 변화하는 데이터에 대해서도 공정성이 저하되지 않도록 하는 데 도움이 되기를 기대한다ˮ고 말했다.
이번 연구에는 노유지 박사과정이 제1 저자, 황의종 교수(KAIST)가 교신 저자, 서창호 교수(KAIST)와 이강욱 교수(위스콘신-매디슨 대학)가 공동 저자로 참여했다. 이번 연구는 지난 7월 미국 하와이에서 열린 머신러닝 최고권위 국제학술 대회인 `국제 머신러닝 학회 International Conference on Machine Learning (ICML)'에서 발표됐다. (논문명 : Improving Fair Training under Correlation Shifts)
한편, 이 기술은 정보통신기획평가원의 지원을 받은 `강건하고 공정하며 확장가능한 데이터 중심의 연속 학습' 과제 (2022-0-00157)와 한국연구재단 지원을 받은 `데이터 중심의 신뢰 가능한 인공지능' 과제의 성과다.
2023.10.30 조회수 8120
변화된 데이터에서 인공지능 공정성 찾아내다
인공지능 기술이 사회 전반에 걸쳐 광범위하게 활용되며 인간의 삶에 많은 영향을 미치고 있다. 최근 인공지능의 긍정적인 효과 이면에 범죄자의 재범 예측을 위해 머신러닝 학습에 사용되는 콤파스(COMPAS) 시스템을 기반으로 학습된 모델이 인종 별로 서로 다른 재범 확률을 부여할 수 있다는 심각한 편향성이 관찰되었다. 이 밖에도 채용, 대출 시스템 등 사회의 중요 영역에서 인공지능의 다양한 편향성 문제가 밝혀지며, 공정성(fairness)을 고려한 머신러닝 학습의 필요성이 커지고 있다.
우리 대학 전기및전자공학부 황의종 교수 연구팀이 학습 상황과 달라진 새로운 분포의 테스트 데이터에 대해서도 편향되지 않은 판단을 내리도록 돕는 새로운 모델 훈련 기술을 개발했다고 30일 밝혔다.
최근 전 세계의 연구자들이 인공지능의 공정성을 높이기 위한 다양한 학습 방법론을 제안하고 있지만, 대부분의 연구는 인공지능 모델을 훈련시킬 때 사용되는 데이터와 실제 테스트 상황에서 사용될 데이터가 같은 분포를 갖는다고 가정한다. 하지만 실제 상황에서는 이러한 가정이 대체로 성립하지 않으며, 최근 다양한 어플리케이션에서 학습 데이터와 테스트 데이터 내의 편향 패턴이 크게 변화할 수 있음이 관측되고 있다.
이때, 테스트 환경에서 데이터의 정답 레이블과 특정 그룹 정보 간의 편향 패턴이 변경되면, 사전에 공정하게 학습되었던 인공지능 모델의 공정성이 직접적인 영향을 받고 다시금 악화된 편향성을 가질 수 있다. 일례로 과거에 특정 인종 위주로 채용하던 기관이 이제는 인종에 관계없이 채용한다면, 과거의 데이터를 기반으로 공정하게 학습된 인공지능 채용 모델이 현대의 데이터에는 오히려 불공정한 판단을 내릴 수 있다.
연구팀은 이러한 문제를 해결하기 위해, 먼저 `상관관계 변화(correlation shifts)' 개념을 도입해 기존의 공정성을 위한 학습 알고리즘들이 가지는 정확성과 공정성 성능에 대한 근본적인 한계를 이론적으로 분석했다. 예를 들어 특정 인종만 주로 채용한 과거 데이터의 경우 인종과 채용의 상관관계가 강해서 아무리 공정한 모델을 학습을 시켜도 현재의 약한 상관관계를 반영하는 정확하면서도 공정한 채용 예측을 하기가 근본적으로 어려운 것이다. 이러한 이론적인 분석을 바탕으로, 새로운 학습 데이터 샘플링 기법을 제안해 테스트 시에 데이터의 편향 패턴이 변화해도 모델을 공정하게 학습할 수 있도록 하는 새로운 학습 프레임워크를 제안했다. 이는 과거 데이터에서 우세하였던 특정 인종 데이터를 상대적으로 줄임으로써 채용과의 상관관계를 낮출 수 있다.
제안된 기법의 주요 이점은 데이터 전처리만 하기 때문에 기존에 제안된 알고리즘 기반 공정한 학습 기법을 그대로 활용하면서 개선할 수 있다는 것이다. 즉 이미 사용되고 있는 공정한 학습 알고리즘이 위에서 설명한 상관관계 변화에 취약하다면 제안된 기법을 함께 사용해서 해결할 수 있다.
제1 저자인 전기및전자공학부 노유지 박사과정 학생은 "이번 연구를 통해 인공지능 기술의 실제 적용 환경에서, 모델이 더욱 신뢰 가능하고 공정한 판단을 하도록 도울 것으로 기대한다ˮ고 밝혔다.
연구팀을 지도한 황의종 교수는 "기존 인공지능이 변화하는 데이터에 대해서도 공정성이 저하되지 않도록 하는 데 도움이 되기를 기대한다ˮ고 말했다.
이번 연구에는 노유지 박사과정이 제1 저자, 황의종 교수(KAIST)가 교신 저자, 서창호 교수(KAIST)와 이강욱 교수(위스콘신-매디슨 대학)가 공동 저자로 참여했다. 이번 연구는 지난 7월 미국 하와이에서 열린 머신러닝 최고권위 국제학술 대회인 `국제 머신러닝 학회 International Conference on Machine Learning (ICML)'에서 발표됐다. (논문명 : Improving Fair Training under Correlation Shifts)
한편, 이 기술은 정보통신기획평가원의 지원을 받은 `강건하고 공정하며 확장가능한 데이터 중심의 연속 학습' 과제 (2022-0-00157)와 한국연구재단 지원을 받은 `데이터 중심의 신뢰 가능한 인공지능' 과제의 성과다.
2023.10.30 조회수 8120 한빛원전의 시공 불량 문제를 해결하기 위한 시뮬레이션 개발
후쿠시마 사고 이후 원전 안전 및 관리에 대한 관심이 집중되고 있다. 한국에서는 2017년 6월경 한빛원전의 원자로 격납건물의 콘크리트 벽 속에서 대규모 공극이 발견되었다. 원자로 격납건물은 원전 사고 발생 시 방사능 유출을 막아주는 최후의 보루이기 때문에, 이러한 콘크리트 공극으로 인한 원전의 안전상 우려가 큰 상황이다.
국내 연구진들은 원자로 격납건물 시공시 콘크리트 다짐 및 채움 불량으로 인하여 격납로 내 콘크리트에 공극이 발생한 것으로 추정하고 있다. 원자로 격납건물은 일반 콘크리트 구조물과 달리 매우 높은 밀도의 철근 보강이 필요하기 때문에, 콘크리트 타설 시 진동 다짐기가 진입하지 못하는 구역이 존재할 가능성이 높아서 콘크리트 공동에 대한 위험성이 높다. 하지만 돔 형태의 벽체 내부를 감싼 6 mm 두께의 철판(콘크리트 라이너 플레이트, CLP)이 영구 거푸집으로 활용되기 때문에 내부 공동에 대한 육안 검사가 불가능하다는 점에서 공극 발생 여부의 발견에 대한 어려움이 있다.
우리 대학 건설및환경공학과 김재홍 교수 연구팀은 이러한 문제를 해결하기 위하여 콘크리트의 유동성과 다짐 불량으로 인해 발생하는 공동을 억제할 수 있는 시공 시뮬레이션 기법을 개발했다.
연구팀에서 제안한 콘크리트 유동 시뮬레이션 기법은 콘크리트의 레올로지와 진동다짐의 영향 반경을 고려하여 콘크리트 공동 발생 예상 부위를 예측하는 기술이다. 연구팀은 이번 연구를 통해 콘크리트 진동다짐의 영향 반경(감쇠계수)을 직접 측정하여 굳지 않은 콘크리트 내부의 진동 에너지 밀도 분포를 제시했다. 이어서, 진동 에너지에 따른 콘크리트의 Vibrorheology를 정량적으로 측정하여, 굳지 않은 콘크리트의 항복응력 감소를 정량적으로 모델링하여 시공 시뮬레이션을 가능하게 하였다.
새로 제안된 시공 시뮬레이션 기법은 기존 콘크리트 유동해석으로는 고려할 수 없었던 격납건물 내부 보강재의 형상과 크기, 콘크리트 레올로지, 그리고 진동다짐의 진폭과 진동수까지 고려하여 콘크리트의 채움성을 평가할 수 있게 되었다. 연구팀은 향후 보강 연구를 진행해 3D 프린팅 콘크리트의 레올로지 제어, 프리캐스트 콘크리트의 품질 관리 등에도 해당 기술을 활용할 계획이다.
이번 연구는 한국수력원자력(주)와 한국연구재단의 과학기술분야 기초연구사업의 지원으로 수행되었으며, 건설공학 분야에서 권위 있는 학술지인 ACI Materials Journal, Cement and Concrete Research 등에 출판되었다.
(논문명: (1) Quantitative evaluation of energy transfer of a concrete vibrator. (2) Flow simulation of fresh concrete accounting for vibrating compaction.)
2023.10.24 조회수 7619
한빛원전의 시공 불량 문제를 해결하기 위한 시뮬레이션 개발
후쿠시마 사고 이후 원전 안전 및 관리에 대한 관심이 집중되고 있다. 한국에서는 2017년 6월경 한빛원전의 원자로 격납건물의 콘크리트 벽 속에서 대규모 공극이 발견되었다. 원자로 격납건물은 원전 사고 발생 시 방사능 유출을 막아주는 최후의 보루이기 때문에, 이러한 콘크리트 공극으로 인한 원전의 안전상 우려가 큰 상황이다.
국내 연구진들은 원자로 격납건물 시공시 콘크리트 다짐 및 채움 불량으로 인하여 격납로 내 콘크리트에 공극이 발생한 것으로 추정하고 있다. 원자로 격납건물은 일반 콘크리트 구조물과 달리 매우 높은 밀도의 철근 보강이 필요하기 때문에, 콘크리트 타설 시 진동 다짐기가 진입하지 못하는 구역이 존재할 가능성이 높아서 콘크리트 공동에 대한 위험성이 높다. 하지만 돔 형태의 벽체 내부를 감싼 6 mm 두께의 철판(콘크리트 라이너 플레이트, CLP)이 영구 거푸집으로 활용되기 때문에 내부 공동에 대한 육안 검사가 불가능하다는 점에서 공극 발생 여부의 발견에 대한 어려움이 있다.
우리 대학 건설및환경공학과 김재홍 교수 연구팀은 이러한 문제를 해결하기 위하여 콘크리트의 유동성과 다짐 불량으로 인해 발생하는 공동을 억제할 수 있는 시공 시뮬레이션 기법을 개발했다.
연구팀에서 제안한 콘크리트 유동 시뮬레이션 기법은 콘크리트의 레올로지와 진동다짐의 영향 반경을 고려하여 콘크리트 공동 발생 예상 부위를 예측하는 기술이다. 연구팀은 이번 연구를 통해 콘크리트 진동다짐의 영향 반경(감쇠계수)을 직접 측정하여 굳지 않은 콘크리트 내부의 진동 에너지 밀도 분포를 제시했다. 이어서, 진동 에너지에 따른 콘크리트의 Vibrorheology를 정량적으로 측정하여, 굳지 않은 콘크리트의 항복응력 감소를 정량적으로 모델링하여 시공 시뮬레이션을 가능하게 하였다.
새로 제안된 시공 시뮬레이션 기법은 기존 콘크리트 유동해석으로는 고려할 수 없었던 격납건물 내부 보강재의 형상과 크기, 콘크리트 레올로지, 그리고 진동다짐의 진폭과 진동수까지 고려하여 콘크리트의 채움성을 평가할 수 있게 되었다. 연구팀은 향후 보강 연구를 진행해 3D 프린팅 콘크리트의 레올로지 제어, 프리캐스트 콘크리트의 품질 관리 등에도 해당 기술을 활용할 계획이다.
이번 연구는 한국수력원자력(주)와 한국연구재단의 과학기술분야 기초연구사업의 지원으로 수행되었으며, 건설공학 분야에서 권위 있는 학술지인 ACI Materials Journal, Cement and Concrete Research 등에 출판되었다.
(논문명: (1) Quantitative evaluation of energy transfer of a concrete vibrator. (2) Flow simulation of fresh concrete accounting for vibrating compaction.)
2023.10.24 조회수 7619 천 배 축소된 분광기로 과일 당도 정밀 측정
눈으로 보기에 잘 익은 사과의 당도를 휴대용 분광기로 정확하게 예측이 가능한 기술이 개발됐다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 가시광선 및 근적외선 분광을 바탕으로 현장 진단에 적합한 고해상도의 휴대용 분광 센서를 개발하는 데 성공했다고 24일 밝혔다.
물질이 반사 또는 흡수하는 빛의 파장 분포를 통해 고유의 성분을 분석할 수 있다는 면에서 분광측정은 다양한 응용 분야에서 비파괴 시료 분석에 활발히 사용되고 있다. 기존 상용분광기는 실시간 성분분석을 제공하지만, 시스템의 크기가 커서 휴대용이나 현장 진단에 활용하는데 한계가 존재한다.
최근 마이크로나노공정 기술의 발전으로 소형 분광센서가 개발돼 품질 평가, 환경 모니터링, 위약 진단 및 헬스케어 등에서 활용되고 있다. 하지만 현재의 소형 분광센서들은 내부 광부품들의 간소화를 거치며 광학 성능이 크게 저하돼 시료 분석의 정확도를 낮추고 있으며, 여전히 광학 성능이 저하되지 않으면서 동시에 크기를 줄이는 데 어려움을 겪고 있다.
연구팀은 수 밀리미터 두께의 분광기 내로 들어온 가시광선이 석영(Quartz) 속에 제작된 회절판을 거치며 짧은 거리에서 넓게 분산시키는 형태인 고체잠입회절판구조를 최초로 제안하였다. 또한, 회절판과 굴절률이 유사한 렌즈를 접합하여 분산된 빛이 이미지센서에 평면 초점을 맺히도록 설계하여 가시광선 전 영역에서 균일한 분광분해능을 갖도록 제작하였다. 연구팀이 제작한 마이크로분광기 모듈은 8 mm × 12.5 mm × 15 mm의 크기를 가지고, 이는 기존 상용분광기를 1천 배 이상 축소시킨 성과이다. 또한, 상용분광기의 성능과 비슷한 평균 5.8 nm의 고해상도 및 작동 파장 범위 내 76% 이상의 고감도를 나타낸다.
연구팀은 마이크로분광기 모듈의 응용예시를 실험적으로 검증하기 위해 휴대용 분광 센서를 설계·제작하고, 분광 응용 분야 중 가장 대표적인 사례인 과일의 품질 검증을 진행했다. 제작한 마이크로분광기와 백색 LED 등을 결합한 분광 센서는 과일의 표면에 부착하여 손쉽게 분광 신호를 획득했다. 또한, 분광 신호의 형태를 분석하여 과일의 성숙도를 예측해 실제 성숙도와 비교하고, 0.91 이상의 높은 상관계수로 신뢰도 높은 예측 모델을 정립했다.
이를 통해 기존 소형 분광기에서 발생했던 광학 성능의 저하를 고체잠입회절판구조의 마이크로분광기를 이용해 해결하고, 연구팀은 휴대용 분광 센서의 현장 진단에 활용 가능함을 확인했다.
정기훈 교수는 “이 초박형 및 고해상도의 마이크로분광기는 식음료 품질검사는 물론 현장형 검사/진단이 필요한 농수산물·헬스케어 분야뿐만 아니라 고속 품질분석이 필요한 제약·바이오·반도체 검사 분야에서 정확하고 비침습적인 분석을 위한 중요한 도구 역할을 수행할 수 있을 것”이라고 연구의 의미를 설명했다.
우리 대학 바이오및뇌공학과 박정우 박사과정이 주도한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스 (Advanced Science)’에 게재됐다. (논문명: 휴대용 가시광선 및 근적외선 분광 응용 분야를 위한 초박형 고체잠입회절판구조 마이크로분광기, Fully Integrated Ultrathin Solid Immersion Grating Microspectrometer for Handheld Visible and Near-Infrared Spectroscopic Applications)
한편 이번 연구는 과학기술정보통신부, 재단법인 범부처전주기의료기기연구개발사업단, ㈜파이퀀트의 지원을 받아 수행됐다.
2023.10.24 조회수 7089
천 배 축소된 분광기로 과일 당도 정밀 측정
눈으로 보기에 잘 익은 사과의 당도를 휴대용 분광기로 정확하게 예측이 가능한 기술이 개발됐다.
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 가시광선 및 근적외선 분광을 바탕으로 현장 진단에 적합한 고해상도의 휴대용 분광 센서를 개발하는 데 성공했다고 24일 밝혔다.
물질이 반사 또는 흡수하는 빛의 파장 분포를 통해 고유의 성분을 분석할 수 있다는 면에서 분광측정은 다양한 응용 분야에서 비파괴 시료 분석에 활발히 사용되고 있다. 기존 상용분광기는 실시간 성분분석을 제공하지만, 시스템의 크기가 커서 휴대용이나 현장 진단에 활용하는데 한계가 존재한다.
최근 마이크로나노공정 기술의 발전으로 소형 분광센서가 개발돼 품질 평가, 환경 모니터링, 위약 진단 및 헬스케어 등에서 활용되고 있다. 하지만 현재의 소형 분광센서들은 내부 광부품들의 간소화를 거치며 광학 성능이 크게 저하돼 시료 분석의 정확도를 낮추고 있으며, 여전히 광학 성능이 저하되지 않으면서 동시에 크기를 줄이는 데 어려움을 겪고 있다.
연구팀은 수 밀리미터 두께의 분광기 내로 들어온 가시광선이 석영(Quartz) 속에 제작된 회절판을 거치며 짧은 거리에서 넓게 분산시키는 형태인 고체잠입회절판구조를 최초로 제안하였다. 또한, 회절판과 굴절률이 유사한 렌즈를 접합하여 분산된 빛이 이미지센서에 평면 초점을 맺히도록 설계하여 가시광선 전 영역에서 균일한 분광분해능을 갖도록 제작하였다. 연구팀이 제작한 마이크로분광기 모듈은 8 mm × 12.5 mm × 15 mm의 크기를 가지고, 이는 기존 상용분광기를 1천 배 이상 축소시킨 성과이다. 또한, 상용분광기의 성능과 비슷한 평균 5.8 nm의 고해상도 및 작동 파장 범위 내 76% 이상의 고감도를 나타낸다.
연구팀은 마이크로분광기 모듈의 응용예시를 실험적으로 검증하기 위해 휴대용 분광 센서를 설계·제작하고, 분광 응용 분야 중 가장 대표적인 사례인 과일의 품질 검증을 진행했다. 제작한 마이크로분광기와 백색 LED 등을 결합한 분광 센서는 과일의 표면에 부착하여 손쉽게 분광 신호를 획득했다. 또한, 분광 신호의 형태를 분석하여 과일의 성숙도를 예측해 실제 성숙도와 비교하고, 0.91 이상의 높은 상관계수로 신뢰도 높은 예측 모델을 정립했다.
이를 통해 기존 소형 분광기에서 발생했던 광학 성능의 저하를 고체잠입회절판구조의 마이크로분광기를 이용해 해결하고, 연구팀은 휴대용 분광 센서의 현장 진단에 활용 가능함을 확인했다.
정기훈 교수는 “이 초박형 및 고해상도의 마이크로분광기는 식음료 품질검사는 물론 현장형 검사/진단이 필요한 농수산물·헬스케어 분야뿐만 아니라 고속 품질분석이 필요한 제약·바이오·반도체 검사 분야에서 정확하고 비침습적인 분석을 위한 중요한 도구 역할을 수행할 수 있을 것”이라고 연구의 의미를 설명했다.
우리 대학 바이오및뇌공학과 박정우 박사과정이 주도한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스 (Advanced Science)’에 게재됐다. (논문명: 휴대용 가시광선 및 근적외선 분광 응용 분야를 위한 초박형 고체잠입회절판구조 마이크로분광기, Fully Integrated Ultrathin Solid Immersion Grating Microspectrometer for Handheld Visible and Near-Infrared Spectroscopic Applications)
한편 이번 연구는 과학기술정보통신부, 재단법인 범부처전주기의료기기연구개발사업단, ㈜파이퀀트의 지원을 받아 수행됐다.
2023.10.24 조회수 7089 저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 7417
저용량 고효율 RNA백신 개발 가능해지다
현재 널리 사용되고 있는 코로나바이러스 mRNA 백신은 선형 형태의 mRNA를 가지고 있어 세포내에서 매우 불안정한 특징이 있다. 반면 원형 형태의 RNA(circular RNA)는 선형 RNA에 비해 매우 안정되기 때문에 수많은 국내외 제약회사에서 RNA 안정성을 높이기 위해 원형 RNA를 개발하고 있는 상황이다. 이에 원형 RNA에서 일어나는 단백질 합성 과정에 대한 연구가 필요한 실정이다.
우리 대학 생명과학과 김윤기 교수 연구팀이 진핵세포 내에서 일어나는 원형 RNA(circular RNA)의 단백질 합성 과정에 대한 새로운 메커니즘을 규명했다고 23일 밝혔다.
분자생물학에서 ‘중심원리(central dogma)’라고 알려진 DNA로부터 시작해 RNA, 단백질로 이어지는 유전정보의 흐름은 다양한 생물학적 기능을 나타내는 중요 원리다. 이때 최종 생산 산물인 단백질은 번역 과정에 의해 생성되며 이와 관련한 메커니즘 연구는 예로부터 활발히 진행돼오고 있었다.
특히 최근에는 mRNA 백신과 관련해 RNA의 안정성과 합성 효율을 극대화할 수 있는 기법에 관해 관심이 쏠리고 있다. 선형 mRNA는 세포내에서 매우 불안정하기 때문에, 항체 생성 효율을 높이기 위해서 부득이 고용량의 mRNA를 접종하고 있는 상황이다. 이러한 고용량 접종은 mRNA에 기인하는 많은 부작용을 초래할 수 있다.
연구팀은 원형 RNA에서 일어나는 새로운 형태의 단백질 번역 과정을 규명하였다. 세포내에서 생성되는 대부분의 원형 RNA는 엑손 접합 복합체 (Exon junction complex; EJC)를 가지고 있음을 밝혔다. 엑손 접합 복합체는 단백질 합성을 담당하는 리보솜을 끌어오는 기능을 수행하는 단백질(eIF3g)과 직접 결합함으로써, 최종적으로 리보솜을 끌어와 단백질 합성을 유도함을 규명하였다.
연구를 주도한 김윤기 교수는 “이번 연구는 안정성이 높은 원형 RNA에서 일어나는 합성 과정을 규명한 데에 연구의 의의가 있으며, 이 작용과정을 이용하여 부작용을 최소화하고, 고안정성 및 고효율 단백질 합성이 가능한 mRNA 백신을 개발할 수 있을 것으로 기대하고 있다”며 소감을 밝혔다. 특히 원형 RNA 기술 상용화를 위해 김윤기 교수는 라이보텍(주) 벤처회사의 공동대표를 맡고 있다.
생명과학과 장지윤, 신민경 박사과정생, 박주리 박사가 공동 제1 저자로 참여한 이번 연구는 세계 최고 수준의 국제 학술지 `핵산 연구 저널지(Nucleic Acids Research)'에 10월 9일 자로 소개됐다. (논문명 : An interaction between eIF4A3 and eIF3g drives the internal initiation of translation).
한편 이번 연구는 한국 연구재단의 지원을 받아 수행됐다.
2023.10.24 조회수 7417 카이랄 과학 혁신으로 암질환 치료제부터 인공효소까지
많은 약물은 카이랄 분자로 이루어져 있고 카이랄 분자의 두 거울상(이성질체)은 서로 다른 생물학적 효과를 가질 수 있다. 예를 들면, 하나의 형태는 의학적 효과를 가져올 수 있지만 다른 형태는 독성을 가져올 수 있다. 암 치료 사용 약물은 특정 암세포에만 작용되도록 설계되어 있는데 카이랄성을 활용하면 특정한 형태 약물을 선택적으로 전달할 수 있어 부작용을 줄이고 효과를 극대화할 수 있다. 이런 카이랄성 원리를 통해 암 질환 치료를 위한 약물 전달 등 다양한 분야에서 응용이 가능한 분자과학의 새로운 기술이 개발되었다.
우리 대학 화학과 이희승 교수 연구팀이 원자 수준의 정밀도 로 극미세 나선형 카이랄 통로를 만드는 방법을 발표했다고 19일 밝혔다. 이 통로는 인간 머리카락 직경의 약 5만분의 1에 해당하며, 그 특별한 나선 형태 때문에 특정 분자와만 세밀한 상호작용이 가능하다. 이 기술은 약물의 효율적인 개발부터 첨단 소재 설계에 이르기까지 혁신적인 응용을 가능하게 한다.
연구팀은 자연의 카이랄성 원리에 착안해, 짧은 비천연 펩타이드(아미노산으로 이뤄진 단백질 조각)와 구리 클러스터(다발)를 이용해 규칙적인 나선형 채널을 가진 금속-펩타이드 네트워크를 성공적으로 합성했다. 특히, 연구팀은 카이랄 채널의 세밀한 구조 조절로 이 금속-펩타이드 네트워크가 특정 카이랄성 분자에만 상호작용을 가능하게 만들었으며, 단결정 분석을 통해 이러한 복잡한 상호작용 원리를 명확히 규명했다.
이번 연구에서 연구팀은 기존에 알려진 금속-유기 프레임워크와는 달리, 폴대머(비천연 펩타이드) 기반의 방법을 도입해 3차원 구조 내에서 분자와의 상호작용을 더욱 세밀하게 제어할 수 있는 기술을 선보였다. 이는 분자 공학과 첨단 소재 분야에 새로운 지평을 열 것으로 전망된다.
원자 단위로 정의된 카이랄 채널의 제작은 다양한 분야, 특히 카이랄 촉매, 카이랄 광학센서, 암 질환 치료를 위한 약물 전달 등, 다양한 분야에서의 혁신적인 기술적 발전을 기대하게 한다.
연구를 주도한 이희승 교수는 “이번 연구는 세포막 채널 단백질 또는 효소의 활성부위에서 분자의 기질 특이적 상호작용을 인공적으로 재현하는 노력의 일환으로 시작되었으며, 복잡한 미세 상호작용이 가능하도록 다양한 기능기를 원하는 3차원 위치에 모듈식 치환을 통해 도입할 수 있는 청사진을 제시한 의의가 있다” 고 전하며 “앞으로 약물 전달, 고분자 및 나노기술에 응용이 가능하며 특정 카이랄 반응에 반응하는 인공효소 개발을 위한 핵심 기술로 간주될 것으로 기대된다”며 소감을 밝혔다.
화학과 김재욱 석박사통합과정이 제1 저자로 주도한 이번 연구는 화학소재 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 29.4)' 9월 18일 字 온라인판에 발표됐다.(논문명: Tailoring Enantiomeric Chiral Channels in Metal-Peptide Networks: A Novel Foldamer-Based Approach for Host-Guest Interactions, https://doi.org/10.1002/adma.202305753)
이번 연구는 한국연구재단의 선도연구센터사업(멀티스케일 카이랄구조체 연구센터, CMCA)의 지원으로 진행됐다.
2023.10.19 조회수 13291
카이랄 과학 혁신으로 암질환 치료제부터 인공효소까지
많은 약물은 카이랄 분자로 이루어져 있고 카이랄 분자의 두 거울상(이성질체)은 서로 다른 생물학적 효과를 가질 수 있다. 예를 들면, 하나의 형태는 의학적 효과를 가져올 수 있지만 다른 형태는 독성을 가져올 수 있다. 암 치료 사용 약물은 특정 암세포에만 작용되도록 설계되어 있는데 카이랄성을 활용하면 특정한 형태 약물을 선택적으로 전달할 수 있어 부작용을 줄이고 효과를 극대화할 수 있다. 이런 카이랄성 원리를 통해 암 질환 치료를 위한 약물 전달 등 다양한 분야에서 응용이 가능한 분자과학의 새로운 기술이 개발되었다.
우리 대학 화학과 이희승 교수 연구팀이 원자 수준의 정밀도 로 극미세 나선형 카이랄 통로를 만드는 방법을 발표했다고 19일 밝혔다. 이 통로는 인간 머리카락 직경의 약 5만분의 1에 해당하며, 그 특별한 나선 형태 때문에 특정 분자와만 세밀한 상호작용이 가능하다. 이 기술은 약물의 효율적인 개발부터 첨단 소재 설계에 이르기까지 혁신적인 응용을 가능하게 한다.
연구팀은 자연의 카이랄성 원리에 착안해, 짧은 비천연 펩타이드(아미노산으로 이뤄진 단백질 조각)와 구리 클러스터(다발)를 이용해 규칙적인 나선형 채널을 가진 금속-펩타이드 네트워크를 성공적으로 합성했다. 특히, 연구팀은 카이랄 채널의 세밀한 구조 조절로 이 금속-펩타이드 네트워크가 특정 카이랄성 분자에만 상호작용을 가능하게 만들었으며, 단결정 분석을 통해 이러한 복잡한 상호작용 원리를 명확히 규명했다.
이번 연구에서 연구팀은 기존에 알려진 금속-유기 프레임워크와는 달리, 폴대머(비천연 펩타이드) 기반의 방법을 도입해 3차원 구조 내에서 분자와의 상호작용을 더욱 세밀하게 제어할 수 있는 기술을 선보였다. 이는 분자 공학과 첨단 소재 분야에 새로운 지평을 열 것으로 전망된다.
원자 단위로 정의된 카이랄 채널의 제작은 다양한 분야, 특히 카이랄 촉매, 카이랄 광학센서, 암 질환 치료를 위한 약물 전달 등, 다양한 분야에서의 혁신적인 기술적 발전을 기대하게 한다.
연구를 주도한 이희승 교수는 “이번 연구는 세포막 채널 단백질 또는 효소의 활성부위에서 분자의 기질 특이적 상호작용을 인공적으로 재현하는 노력의 일환으로 시작되었으며, 복잡한 미세 상호작용이 가능하도록 다양한 기능기를 원하는 3차원 위치에 모듈식 치환을 통해 도입할 수 있는 청사진을 제시한 의의가 있다” 고 전하며 “앞으로 약물 전달, 고분자 및 나노기술에 응용이 가능하며 특정 카이랄 반응에 반응하는 인공효소 개발을 위한 핵심 기술로 간주될 것으로 기대된다”며 소감을 밝혔다.
화학과 김재욱 석박사통합과정이 제1 저자로 주도한 이번 연구는 화학소재 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 29.4)' 9월 18일 字 온라인판에 발표됐다.(논문명: Tailoring Enantiomeric Chiral Channels in Metal-Peptide Networks: A Novel Foldamer-Based Approach for Host-Guest Interactions, https://doi.org/10.1002/adma.202305753)
이번 연구는 한국연구재단의 선도연구센터사업(멀티스케일 카이랄구조체 연구센터, CMCA)의 지원으로 진행됐다.
2023.10.19 조회수 13291 비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12 조회수 7627
비정상 단백질 처리에 관여하는 새로운 인자 발견
우리 대학 생명과학과 김윤기 교수, 조원기 교수 공동연구팀이 비정상 단백질을 처리하기 위해 형성되는 응집체의 형성 경로를 촉진하는 새로운 인자를 규명했다고 밝혔다.
김윤기 교수, 조원기 교수 공동연구팀은 비정상 단백질 처리경로에서 YTHDF2 단백질이 UPF1을 통해 기존에 알려진 CTIF, eEF1A1, 디낵틴1(Dynactin1) 복합체와 상호작용하며, 비정상 단백질을 비정상 단백질 집합소인 애그리좀(aggresome)으로 수송하는 경로를 조절한다고 밝혔다. 비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고, 단백질 품질검증에서 중요한 역할을 한다는 사실을 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
생명과학과 황현정 박사, 박태림 박사과정, 김형인 박사과정이 공동 제1 저자로 참여한 이번 연구는 10월 6일 국제 학술지 `네이처 커뮤니케이션즈(Nature communications)'에 게재됐다.
인간의 몸에서는 다양한 생명 활동을 위해 끊임없이 새로운 단백질이 생성되고 사라진다. 단백질 형성과정에서 정상적인 단백질뿐만 아니라 비정상적인 단백질이 형성되기도 한다. 새롭게 형성되는 단백질의 품질검증은 정상적인 생명 활동에 매우 중요하다. 비정상적인 단백질의 축적은 다양한 질환을 일으킬 수 있다.
비정상 단백질 처리경로는 CTIF, eEF1A1, 디낵틴1 복합체와 UPF1이 관여하며 비정상 단백질을 애그리좀으로 수송한다. 이와 같은 비정상 단백질 응집체는 특히 치매, 파킨슨병 등 퇴행성 신경질환 환자의 뇌에서 많이 발견된다.
mRNA에는 전사 후 변형 과정을 통한 다양한 mRNA 변형이 일어난다. mRNA 변형은 mRNA 품질검증, 단백질 번역 등 다양한 mRNA 대사에 중요하다. 그 중 m6A(N6-메틸아데노신)는 mRNA 내부에 가장 많이 존재하는 mRNA 변형으로 알려져 있다.
m6A는 다양한 인식 단백질에 의해 인식되며, 어떤 단백질에 의해 인식되는가에 따라 다양한 mRNA 대사에 영향을 준다. 그 중 YTHDF2 단백질은 m6A 인식 단백질로써 UPF1과 상호작용하며 RNA 분해경로를 조절한다.
연구팀은 YTHDF2 단백질이 기존 연구에서 밝혀진 mRNA 분해경로뿐만 아니라 비정상 단백질 처리경로를 조절한다는 사실을 밝혔다.
연구 결과, YTHDF2 단백질은 m6A RNA와 독립적으로 비정상 단백질 처리경로에서 애그리좀 형성을 조절했다. 면역 침강반응에서 YTHDF2 단백질은 UPF1과의 상호작용을 통해 CTIF, eEF1A1, 디낵틴1으로 이루어진 복합체에 합류하여 복합체와 모터 단백질 디네인(Dynein) 사이의 상호작용을 조절했다.
복합체와 YTHDF2 단백질이 상호작용하지 못하는 경우 애그리좀이 잘 형성되지 않았으며, 그로 인한 세포 사멸이 촉진됐다. 이는 YTHDF2 단백질이 비정상 단백질 처리경로의 핵심 단백질임을 나타낸다.
또한, 연구팀은 단일입자추적(Single-particle imaging) 기법, 초고해상도 이미징(Super-resolution imaging) 기법을 사용하여 YTHDF2 단백질이 없는 경우 비정상 단백질의 수송 속도가 느려지며, 애그리좀이 비정상적인 형태로 형성된다는 것을 입증했다.
비정상 단백질 처리경로에 관여하는 새로운 인자를 규명하고 기존에 알려져 있던 인자들과의 관계를 밝힘으로써 비정상 단백질에 의해 야기 되는 퇴행성 신경질환의 치료제 개발에 기여할 것으로 기대된다.
한편 이번 연구는 한국연구재단과 서경배과학재단의 지원을 받아 수행됐다.
2023.10.12 조회수 7627 손상된 양자얽힘을 되돌리는 기술 개발 성공
현시대 컴퓨터로는 풀기 어려운 문제를 해결하려는 기술이나 고전적으로는 도달할 수 없는 높은 정밀도의 구현, 그리고 원천적으로 해킹이 불가능한 통신 기술들의 공통점은 바로 양자정보 기술을 활용한다는 것이다. 현재 많은 관심을 받고 있는 양자정보 기술의 대부분은 양자얽힘이라는 양자적 특성을 기반으로 한다.
우리 대학 물리학과 라영식 교수 연구팀이 약한 양자측정을 양자얽힘 검증에 도입해 양자얽힘의 직접적 검증을 진행하고, 이 과정에서 손상된 양자얽힘을 되돌림 측정을 이용해 양자얽힘을 원래대로 되돌리는 기술 개발에 성공했다고 10일 밝혔다.
양자얽힘은 고전 물리로 설명될 수 없는 양자 물리의 고유한 특성으로서 서로 멀리 떨어져 있는 두 입자 중 한쪽의 상태가 결정되는 순간 다른 쪽의 상태가 결정되는 독특한 현상을 나타낸다. 양자얽힘의 존재는 양자측정을 사용하여 검증해야 하지만, 이러한 측정 과정 자체가 양자얽힘을 파괴하는 문제가 있어 검증이 완료된 양자얽힘 상태를 차후 양자기술에 활용하는데 어려움이 있었다.
하지만, 연구팀은 이러한 문제를 해결하기 위해 양자얽힘을 완전히 파괴시키지 않는 ‘약한 양자측정’을 도입하여 양자얽힘을 검증하였고, 이 과정에서 손상된 양자얽힘을 ‘되돌림 측정’을 이용해 원상태로 되돌리는 기술을 개발하였다.
‘약한 양자측정’이란 양자상태를 측정할 때 양자상태에 가해지는 변화를 줄이면서도 필요한 정보를 얻어낼 수 있는 양자측정 기술이다. 약한 양자 측정을 양자얽힘 검증에 도입할 경우, 양자얽힘을 완전히 파괴하지 않고도 양자얽힘이 존재하는지 확인할 수 있다.
약한 양자측정 이후 양자상태에 남아 있는 양자얽힘의 양은 원래의 양보다는 적다. 연구진은 ‘되돌림 측정’을 도입해 줄어든 양자얽힘을 원래대로 되돌릴 수 있음을 보였다. 약한 양자측정의 역과정에 해당하는 되돌림 측정은 손상된 양자상태를 일정 확률로 원래대로 되돌려 양자얽힘을 원상태로 복구할 수 있다. 이러한 복구 과정은 앞서 시행한 양자얽힘 검증과 상호 교환 관계가 있어, 연구팀은 두 값을 적절히 조정할 시 양자얽힘의 존재를 검증함과 동시에 되돌려진 양자얽힘을 다시 활용할 수 있음을 보였다.ᅠ
라영식 교수는 "이번 연구를 활용하여 검증된 양자상태를 양자 암호 키 분배, 양자 원격 전송과 같은 다양한 양자 기술 분야에 적용할 수 있을 것ˮ이라고 연구의 의의를 설명했다.
물리학과 김현진 석박사통합과정 학생이 제1 저자로 참여하고 정지혁, 이경준 석박사통합과정 학생이 공동 저자로 참여한 이번 연구는 저명 국제 학술지 `사이언스 어드밴시스(Science Advances)'에 2023년 10월 온라인판으로 정식 출판됐다. (논문명: Recovering quantum entanglement after its certification)
한편 이번 연구는 정보통신기획평가원 (양자인터넷 핵심원천기술 사업, 대학ICT연구센터지원사업)과 한국연구재단 (양자컴퓨팅 기술개발사업, 중견연구자지원사업)의 지원을 받아 수행됐다.
2023.10.12 조회수 7937
손상된 양자얽힘을 되돌리는 기술 개발 성공
현시대 컴퓨터로는 풀기 어려운 문제를 해결하려는 기술이나 고전적으로는 도달할 수 없는 높은 정밀도의 구현, 그리고 원천적으로 해킹이 불가능한 통신 기술들의 공통점은 바로 양자정보 기술을 활용한다는 것이다. 현재 많은 관심을 받고 있는 양자정보 기술의 대부분은 양자얽힘이라는 양자적 특성을 기반으로 한다.
우리 대학 물리학과 라영식 교수 연구팀이 약한 양자측정을 양자얽힘 검증에 도입해 양자얽힘의 직접적 검증을 진행하고, 이 과정에서 손상된 양자얽힘을 되돌림 측정을 이용해 양자얽힘을 원래대로 되돌리는 기술 개발에 성공했다고 10일 밝혔다.
양자얽힘은 고전 물리로 설명될 수 없는 양자 물리의 고유한 특성으로서 서로 멀리 떨어져 있는 두 입자 중 한쪽의 상태가 결정되는 순간 다른 쪽의 상태가 결정되는 독특한 현상을 나타낸다. 양자얽힘의 존재는 양자측정을 사용하여 검증해야 하지만, 이러한 측정 과정 자체가 양자얽힘을 파괴하는 문제가 있어 검증이 완료된 양자얽힘 상태를 차후 양자기술에 활용하는데 어려움이 있었다.
하지만, 연구팀은 이러한 문제를 해결하기 위해 양자얽힘을 완전히 파괴시키지 않는 ‘약한 양자측정’을 도입하여 양자얽힘을 검증하였고, 이 과정에서 손상된 양자얽힘을 ‘되돌림 측정’을 이용해 원상태로 되돌리는 기술을 개발하였다.
‘약한 양자측정’이란 양자상태를 측정할 때 양자상태에 가해지는 변화를 줄이면서도 필요한 정보를 얻어낼 수 있는 양자측정 기술이다. 약한 양자 측정을 양자얽힘 검증에 도입할 경우, 양자얽힘을 완전히 파괴하지 않고도 양자얽힘이 존재하는지 확인할 수 있다.
약한 양자측정 이후 양자상태에 남아 있는 양자얽힘의 양은 원래의 양보다는 적다. 연구진은 ‘되돌림 측정’을 도입해 줄어든 양자얽힘을 원래대로 되돌릴 수 있음을 보였다. 약한 양자측정의 역과정에 해당하는 되돌림 측정은 손상된 양자상태를 일정 확률로 원래대로 되돌려 양자얽힘을 원상태로 복구할 수 있다. 이러한 복구 과정은 앞서 시행한 양자얽힘 검증과 상호 교환 관계가 있어, 연구팀은 두 값을 적절히 조정할 시 양자얽힘의 존재를 검증함과 동시에 되돌려진 양자얽힘을 다시 활용할 수 있음을 보였다.ᅠ
라영식 교수는 "이번 연구를 활용하여 검증된 양자상태를 양자 암호 키 분배, 양자 원격 전송과 같은 다양한 양자 기술 분야에 적용할 수 있을 것ˮ이라고 연구의 의의를 설명했다.
물리학과 김현진 석박사통합과정 학생이 제1 저자로 참여하고 정지혁, 이경준 석박사통합과정 학생이 공동 저자로 참여한 이번 연구는 저명 국제 학술지 `사이언스 어드밴시스(Science Advances)'에 2023년 10월 온라인판으로 정식 출판됐다. (논문명: Recovering quantum entanglement after its certification)
한편 이번 연구는 정보통신기획평가원 (양자인터넷 핵심원천기술 사업, 대학ICT연구센터지원사업)과 한국연구재단 (양자컴퓨팅 기술개발사업, 중견연구자지원사업)의 지원을 받아 수행됐다.
2023.10.12 조회수 7937 인공지능으로 조현병 원인치료의 실마리 찾다
정신분열증으로도 알려진 조현병은 환청, 환영, 인지장애 등의 증상으로 대표되는 정신질환이다. 국내 연구진이 인공지능을 활용해 그동안 증상 억제만이 가능했던 조현병의 원인을 치료할 수 있는 실마리를 찾았다.
우리 대학 바이오및뇌공학과 이도헌 교수 및 한국한의학연구원(원장 이진용) 공동연구팀이 미국 스탠리 의과학연구소(이하 스탠리연구소) 와의 국제공동연구를 통해 인공지능으로 개인의 유전형과 조현병 사이의 선천적 병리 모델과 조현병 예측 마커를 발굴했다고 27일 밝혔다.
조현병은 2016년 강남역 살인사건, 2019년 진주 방화사건, 2023년 대전 칼부림 사건 등 일부 환자들의 강력범죄와 환자에 대한 사회적 낙인으로 인해 조현병은 심각한 사회적 문제가 되었다. 그러나 이러한 심각성에도 불구하고 조현병의 원인은 명확히 밝혀지지 않아, 리스페리돈(risperidone), 클로자핀(clozapine) 등 항정신병제에 의한 증상의 억제만이 가능한 실정이다.
이도헌 교수 연구팀은 미 스탠리연구소의 다수준 뇌 조직 데이터에 최근 주목받는 인공지능 기술인 `설명가능한 심층학습' 기술을 접목해, 선천적 유전형과 조현병 사이의 병리를 설명하는 인공신경망 모델을 구축했다. 그리고 모델을 해석하여, 선천적 유전형이 유전자·단백질 발현 조절을 통해 뇌의 전전두엽피질, 안와전두엽피질 신경세포의 발생을 변화시켜 조현병 취약성을 결정한다는 사실을 밝혀냈다. 또한, 뇌의 신경세포 밀도를 감소시키는 유전형 조합을 조현병 예측 마커로 제시해, 개인화된 조현병 예측과 세포 치료 등을 통한 조현병 원인치료의 가능성을 열었다.
이도헌 교수는 바이오의료 분야는 `속내를 알 수 없는 인공지능'보다는 `속내를 해석가능한 인공지능'이 꼭 필요한 분야라고 강조하면서, “기존의 인공지능과 비교했을 때 이번 연구에서는 인공신경망의 중간 노드에 유전자 이름, 세포의 상태와 같은 구체적인 생물학적 의미가 부여된 노드를 배치하고 그들간의 연결관계를 기계학습기법으로 분석했다”라고 말했다.
바이오및뇌공학과 이도헌 교수, 조유상 박사(現 한국한의학연구원 선임연구원), 미 스탠리연구소 김상현 박사, 마리 웹스터 박사가 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 세계적 학술지인 `기능유전체학 브리핑(Briefings in Functional Genomics)'지 2023년 9월호에 게재됐다.
2023.09.27 조회수 10129
인공지능으로 조현병 원인치료의 실마리 찾다
정신분열증으로도 알려진 조현병은 환청, 환영, 인지장애 등의 증상으로 대표되는 정신질환이다. 국내 연구진이 인공지능을 활용해 그동안 증상 억제만이 가능했던 조현병의 원인을 치료할 수 있는 실마리를 찾았다.
우리 대학 바이오및뇌공학과 이도헌 교수 및 한국한의학연구원(원장 이진용) 공동연구팀이 미국 스탠리 의과학연구소(이하 스탠리연구소) 와의 국제공동연구를 통해 인공지능으로 개인의 유전형과 조현병 사이의 선천적 병리 모델과 조현병 예측 마커를 발굴했다고 27일 밝혔다.
조현병은 2016년 강남역 살인사건, 2019년 진주 방화사건, 2023년 대전 칼부림 사건 등 일부 환자들의 강력범죄와 환자에 대한 사회적 낙인으로 인해 조현병은 심각한 사회적 문제가 되었다. 그러나 이러한 심각성에도 불구하고 조현병의 원인은 명확히 밝혀지지 않아, 리스페리돈(risperidone), 클로자핀(clozapine) 등 항정신병제에 의한 증상의 억제만이 가능한 실정이다.
이도헌 교수 연구팀은 미 스탠리연구소의 다수준 뇌 조직 데이터에 최근 주목받는 인공지능 기술인 `설명가능한 심층학습' 기술을 접목해, 선천적 유전형과 조현병 사이의 병리를 설명하는 인공신경망 모델을 구축했다. 그리고 모델을 해석하여, 선천적 유전형이 유전자·단백질 발현 조절을 통해 뇌의 전전두엽피질, 안와전두엽피질 신경세포의 발생을 변화시켜 조현병 취약성을 결정한다는 사실을 밝혀냈다. 또한, 뇌의 신경세포 밀도를 감소시키는 유전형 조합을 조현병 예측 마커로 제시해, 개인화된 조현병 예측과 세포 치료 등을 통한 조현병 원인치료의 가능성을 열었다.
이도헌 교수는 바이오의료 분야는 `속내를 알 수 없는 인공지능'보다는 `속내를 해석가능한 인공지능'이 꼭 필요한 분야라고 강조하면서, “기존의 인공지능과 비교했을 때 이번 연구에서는 인공신경망의 중간 노드에 유전자 이름, 세포의 상태와 같은 구체적인 생물학적 의미가 부여된 노드를 배치하고 그들간의 연결관계를 기계학습기법으로 분석했다”라고 말했다.
바이오및뇌공학과 이도헌 교수, 조유상 박사(現 한국한의학연구원 선임연구원), 미 스탠리연구소 김상현 박사, 마리 웹스터 박사가 공동으로 진행한 이번 연구는 영국 옥스퍼드대학교에서 발간하는 세계적 학술지인 `기능유전체학 브리핑(Briefings in Functional Genomics)'지 2023년 9월호에 게재됐다.
2023.09.27 조회수 10129