%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B8%B0%EC%88%A0%EB%8C%80%ED%95%99
-
 극미량 돌연변이 세포로도 뇌질환 발생한다
뇌를 포함한 모든 신체 기관은 세포 분열 과정에서 발생하는 돌연변이(모자이시즘)을 피할 수 없다. 그렇다면 과연 몇 개의 신경세포에 질병 유발 돌연변이가 생겨났을 때부터 전체 뇌신경 회로를 망가트려 뇌 기능 이상을 일으킬 수 있을까?
우리 대학 의과학대학원 이정호 교수팀이 뇌세포 특이적 돌연변이(뇌 체성 모자이시즘)에 의한 소아 난치성 뇌전증 동물 모델과 환자 뇌 조직 연구를 통해 0.1퍼센트 이하 비율의 극미량 돌연변이 신경세포에 의해서도 뇌 전체 기능 이상을 유발해 뇌전증 발작이 발생할 수 있음을 규명했다고 9일 밝혔다.
이를 통해 난치성 뇌전증의 돌연변이 유전자 진단에 있어 새로운 기준을 마련하는 한편, 극미량의 돌연변이 신경세포가 다양한 뇌 질환 유발에 관여할 수 있음을 밝혔다. 이번 연구의 결과는 세계적 신경 의학 학술지 `브레인(Brain)'에 지난 6월 25일 字 게재됐다.
연구팀은 이번 연구에서 과연 얼마나 적은 수의 세포에서 특정 유전자 모자이시즘이 누적됐을 때 이것이 전체 뇌 기능 이상을 유도하는 뇌 질환 발생으로 이어질 것인가라는 질문에 대답하고자, 마우스 질병 모델과 인체 조직을 이용한 중개의학적 연구를 수행했다.
연구팀은 실험용 쥐의 뇌 조직에 뇌전증 유발 체성 모자이시즘*을 최소 수백 개에서 최대 수만 개의 세포에 유발했다. 이때 고작 8천에서 9천 개 수준의 돌연변이 신경세포가 나타날 때부터, 실험용 쥐가 뇌전증 발작을 일으키고, 관련된 병리가 나타남을 관찰했다. 더 나아가, 난치성 뇌전증 환자 뇌 조직에서 대용량 유전정보 증폭 시퀀싱을 수행해(ultra-high depth amplicon sequencing) 정확한 변이 모자이시즘 비율을 측정했고, 최소 0.07%에 이르는 뇌전증 유발 체성 모자이시즘을 관찰했다.
*체성 모자이시즘(Somatic Mosaicism): 하나의 수정란에서 분열 및 분화를 통해 우리 몸을 이루는 약 30조 개의 세포들이 만들어지는 과정에서 세포마다 돌연변이가 발생할 수 있다는 것으로 암의 진화뿐만 아니라 비암성 질환에서도 중요한 질병 원인으로 최근 주목을 받고 있음.
이 발견은 약물 치료에 반응하지 않아 수술에 이르게 되는 난치성 뇌전증의 유전적 정밀 진단에 도움을 줄 수 있으며, 또한 아직 원인이 밝혀지지 않은 수많은 난치성 신경 정신의학적 질환들이 뇌의 발생과 분화 과정에서 일어나는 극소량의 미세 돌연변이들과 밀접한 관련이 있음을 시사한다.
이번 연구는 국소 피질이형성증*의 진단법 향상 및 체성 모자이시즘에 의한 뇌 질환 원인 발견에 있어서 중요한 기초를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜(대표 박철원, 김병태)을 통해 난치성 뇌전증 환자의 체성 모자이시즘 변이를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
*국소 피질이형성증: 뇌 발달 과정 중 대뇌 피질에 국소적으로 신경세포이상이 발생하는 질환으로 기존 항뇌전증 약물에 전혀 반응하지 않는 소아 난치성 뇌전증을 일으키는 가장 중요한 원인으로 알려져 있다.
우리 대학 의과학대학원 졸업생 의사과학자이자 논문의 제1 저자 김진태 박사는 "극미량의 체성 돌연변이라도 뇌의 기능 이상을 유발할 수 있음이 알려졌고, 이를 통해 난치성 뇌전증 등의 유전적 진단과 치료제 개발에 도움이 될 수 있기를 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원 사업의 지원을 받아 수행됐다.
2024.07.09 조회수 5135
극미량 돌연변이 세포로도 뇌질환 발생한다
뇌를 포함한 모든 신체 기관은 세포 분열 과정에서 발생하는 돌연변이(모자이시즘)을 피할 수 없다. 그렇다면 과연 몇 개의 신경세포에 질병 유발 돌연변이가 생겨났을 때부터 전체 뇌신경 회로를 망가트려 뇌 기능 이상을 일으킬 수 있을까?
우리 대학 의과학대학원 이정호 교수팀이 뇌세포 특이적 돌연변이(뇌 체성 모자이시즘)에 의한 소아 난치성 뇌전증 동물 모델과 환자 뇌 조직 연구를 통해 0.1퍼센트 이하 비율의 극미량 돌연변이 신경세포에 의해서도 뇌 전체 기능 이상을 유발해 뇌전증 발작이 발생할 수 있음을 규명했다고 9일 밝혔다.
이를 통해 난치성 뇌전증의 돌연변이 유전자 진단에 있어 새로운 기준을 마련하는 한편, 극미량의 돌연변이 신경세포가 다양한 뇌 질환 유발에 관여할 수 있음을 밝혔다. 이번 연구의 결과는 세계적 신경 의학 학술지 `브레인(Brain)'에 지난 6월 25일 字 게재됐다.
연구팀은 이번 연구에서 과연 얼마나 적은 수의 세포에서 특정 유전자 모자이시즘이 누적됐을 때 이것이 전체 뇌 기능 이상을 유도하는 뇌 질환 발생으로 이어질 것인가라는 질문에 대답하고자, 마우스 질병 모델과 인체 조직을 이용한 중개의학적 연구를 수행했다.
연구팀은 실험용 쥐의 뇌 조직에 뇌전증 유발 체성 모자이시즘*을 최소 수백 개에서 최대 수만 개의 세포에 유발했다. 이때 고작 8천에서 9천 개 수준의 돌연변이 신경세포가 나타날 때부터, 실험용 쥐가 뇌전증 발작을 일으키고, 관련된 병리가 나타남을 관찰했다. 더 나아가, 난치성 뇌전증 환자 뇌 조직에서 대용량 유전정보 증폭 시퀀싱을 수행해(ultra-high depth amplicon sequencing) 정확한 변이 모자이시즘 비율을 측정했고, 최소 0.07%에 이르는 뇌전증 유발 체성 모자이시즘을 관찰했다.
*체성 모자이시즘(Somatic Mosaicism): 하나의 수정란에서 분열 및 분화를 통해 우리 몸을 이루는 약 30조 개의 세포들이 만들어지는 과정에서 세포마다 돌연변이가 발생할 수 있다는 것으로 암의 진화뿐만 아니라 비암성 질환에서도 중요한 질병 원인으로 최근 주목을 받고 있음.
이 발견은 약물 치료에 반응하지 않아 수술에 이르게 되는 난치성 뇌전증의 유전적 정밀 진단에 도움을 줄 수 있으며, 또한 아직 원인이 밝혀지지 않은 수많은 난치성 신경 정신의학적 질환들이 뇌의 발생과 분화 과정에서 일어나는 극소량의 미세 돌연변이들과 밀접한 관련이 있음을 시사한다.
이번 연구는 국소 피질이형성증*의 진단법 향상 및 체성 모자이시즘에 의한 뇌 질환 원인 발견에 있어서 중요한 기초를 마련할 것으로 예상된다. 이번 연구 성과는 KAIST 교원 창업 기업인 소바젠㈜(대표 박철원, 김병태)을 통해 난치성 뇌전증 환자의 체성 모자이시즘 변이를 정밀 타겟하는 혁신 RNA 치료제 개발에 이용될 예정이다.
*국소 피질이형성증: 뇌 발달 과정 중 대뇌 피질에 국소적으로 신경세포이상이 발생하는 질환으로 기존 항뇌전증 약물에 전혀 반응하지 않는 소아 난치성 뇌전증을 일으키는 가장 중요한 원인으로 알려져 있다.
우리 대학 의과학대학원 졸업생 의사과학자이자 논문의 제1 저자 김진태 박사는 "극미량의 체성 돌연변이라도 뇌의 기능 이상을 유발할 수 있음이 알려졌고, 이를 통해 난치성 뇌전증 등의 유전적 진단과 치료제 개발에 도움이 될 수 있기를 바란다ˮ라고 말했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원 사업의 지원을 받아 수행됐다.
2024.07.09 조회수 5135 -
 지방세포 이용해 체중 감소 가능하다
우리 연구진이 지방세포를 지방세포 전 단계인 줄기세포로 변화(탈분화)시키며 지방조직의 물리적인 크기를 줄이는 등 체중을 감소시키고 지방세포의 활성화를 통해 체내 신진에너지 대사 변화를 통해 비만이나 당뇨 등 대사성 질환의 제어 방법을 제시하여 화제다.
의과학대학원 서재명 교수 연구팀과 생명과학과 임대식 교수 연구팀의 공동연구를 통해 대사성 질환의 새로운 치료 전략을 규명했다고 1일 밝혔다.
지방조직은 식사 후 여분의 칼로리를 지방 형태로 저장하는 저장고 역할과 호르몬을 분비하는 내분비기관의 역할을 한다. 이 두 가지의 역할 중 하나라도 이상이 생기면 우리의 대사 체계는 무너지고 당뇨 혹은 비만과 같은 대사질환이 걸리게 된다. 그러나 우리 몸이 이 두 가지의 기능을 조화롭게 관장하는지 분자 수준에서의 기전이 알려지지 않았다.
연구팀은 히포 신호전달체계*의 얍타즈(YAP/TAZ) 단백질에 주목, 이 단백질의 지방세포 관련 기능을 규명했다. 1) 식사 유무에 따라 지방조직 안에 있는 얍타즈 단백질의 활성상태가 변한다는 점, 2) 동 단백질의 활성이 지방조직의 크기를 직접적으로 조절한다는 점 3) 에너지소비 및 포만감을 관장하는 렙틴이라는 호르몬의 생성에 얍타즈가 직접적으로 관여를 한다는 점을 밝혔다.
*히포 신호전달체계: 다세포 생물의 조직, 신체 기관의 크기를 결정하는 데 중요한 역할을 하는 세포 내 신호전달체계임.
특히 생체 내에서 활성화된 얍타즈의 역할을 규명하기 위해 라츠1/라츠2(LATS1/LATS2) 유전자를 생쥐의 지방세포에서 특이적으로 결손시켰는데, 지방세포 안에 있는 얍타즈의 지속적인 활성은 지방세포를 지방세포의 전구체, 즉 줄기세포와 같은 세포로 변화(탈분화)시키며 지방조직의 물리적인 크기를 줄인다는 점을 확인할 수 있었다.
탈분화를 통한 체지방의 감소는 에너지소비에 집중된 갈색지방의 활성화 혹은 운동과 같은 기존의 방법과 차별되는 방법이다. 또한 렙틴이라는 호르몬은 지방세포에서 만들어져 식욕을 억제하고 에너지 소비를 증가시키는 핵심적인 대사체계 조절 호르몬으로 30년 전에 처음으로 유전자 서열이 밝혀졌지만, 어떻게 생성이 되는지 분자 수준에서의 기전이 알려지지 않았다.
이번 연구는 1994년 렙틴의 유전자의 서열이 밝혀진 후 최초로 렙틴 발현의 전사 조절 기전*을 밝혔다는 점에서 세계의 주목을 받고 있다. 금번 연구는 지방세포의 압타즈의 활성 증가를 통해 혁신적인 비만 대사질환 치료제 개발의 새로운 가능성을 제시하였다.
*전사 조절 기전: DNA로부터 RNA를 만들어내는 과정을 조절하는 기전을 의미한다.
우리 대학 의과학대학원/생명과학과 최성우 박사 (현 버클리 캘리포니아 주립대학) 와 생명과학과 강주경 박사가 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 `네이처 대사(Nature Metabolism)' 5월 29일 자 온라인판에 출판됐다. (논문명 : Hippo–YAP/TAZ signalling coordinates adipose plasticity and energy balance by uncoupling leptin expression from fat mass).
한편 이번 연구는 과기정통부 리더연구자 지원사업, 중견연구자 지원사업, 바이오·의료기술개발사업, 해외우수과학자 유치사업, 카이스트 국제공동연구지원사업의 지원으로 수행됐다.
2024.07.01 조회수 5523
지방세포 이용해 체중 감소 가능하다
우리 연구진이 지방세포를 지방세포 전 단계인 줄기세포로 변화(탈분화)시키며 지방조직의 물리적인 크기를 줄이는 등 체중을 감소시키고 지방세포의 활성화를 통해 체내 신진에너지 대사 변화를 통해 비만이나 당뇨 등 대사성 질환의 제어 방법을 제시하여 화제다.
의과학대학원 서재명 교수 연구팀과 생명과학과 임대식 교수 연구팀의 공동연구를 통해 대사성 질환의 새로운 치료 전략을 규명했다고 1일 밝혔다.
지방조직은 식사 후 여분의 칼로리를 지방 형태로 저장하는 저장고 역할과 호르몬을 분비하는 내분비기관의 역할을 한다. 이 두 가지의 역할 중 하나라도 이상이 생기면 우리의 대사 체계는 무너지고 당뇨 혹은 비만과 같은 대사질환이 걸리게 된다. 그러나 우리 몸이 이 두 가지의 기능을 조화롭게 관장하는지 분자 수준에서의 기전이 알려지지 않았다.
연구팀은 히포 신호전달체계*의 얍타즈(YAP/TAZ) 단백질에 주목, 이 단백질의 지방세포 관련 기능을 규명했다. 1) 식사 유무에 따라 지방조직 안에 있는 얍타즈 단백질의 활성상태가 변한다는 점, 2) 동 단백질의 활성이 지방조직의 크기를 직접적으로 조절한다는 점 3) 에너지소비 및 포만감을 관장하는 렙틴이라는 호르몬의 생성에 얍타즈가 직접적으로 관여를 한다는 점을 밝혔다.
*히포 신호전달체계: 다세포 생물의 조직, 신체 기관의 크기를 결정하는 데 중요한 역할을 하는 세포 내 신호전달체계임.
특히 생체 내에서 활성화된 얍타즈의 역할을 규명하기 위해 라츠1/라츠2(LATS1/LATS2) 유전자를 생쥐의 지방세포에서 특이적으로 결손시켰는데, 지방세포 안에 있는 얍타즈의 지속적인 활성은 지방세포를 지방세포의 전구체, 즉 줄기세포와 같은 세포로 변화(탈분화)시키며 지방조직의 물리적인 크기를 줄인다는 점을 확인할 수 있었다.
탈분화를 통한 체지방의 감소는 에너지소비에 집중된 갈색지방의 활성화 혹은 운동과 같은 기존의 방법과 차별되는 방법이다. 또한 렙틴이라는 호르몬은 지방세포에서 만들어져 식욕을 억제하고 에너지 소비를 증가시키는 핵심적인 대사체계 조절 호르몬으로 30년 전에 처음으로 유전자 서열이 밝혀졌지만, 어떻게 생성이 되는지 분자 수준에서의 기전이 알려지지 않았다.
이번 연구는 1994년 렙틴의 유전자의 서열이 밝혀진 후 최초로 렙틴 발현의 전사 조절 기전*을 밝혔다는 점에서 세계의 주목을 받고 있다. 금번 연구는 지방세포의 압타즈의 활성 증가를 통해 혁신적인 비만 대사질환 치료제 개발의 새로운 가능성을 제시하였다.
*전사 조절 기전: DNA로부터 RNA를 만들어내는 과정을 조절하는 기전을 의미한다.
우리 대학 의과학대학원/생명과학과 최성우 박사 (현 버클리 캘리포니아 주립대학) 와 생명과학과 강주경 박사가 공동 제1 저자로 참여한 이번 연구는 세계적인 국제 학술지 `네이처 대사(Nature Metabolism)' 5월 29일 자 온라인판에 출판됐다. (논문명 : Hippo–YAP/TAZ signalling coordinates adipose plasticity and energy balance by uncoupling leptin expression from fat mass).
한편 이번 연구는 과기정통부 리더연구자 지원사업, 중견연구자 지원사업, 바이오·의료기술개발사업, 해외우수과학자 유치사업, 카이스트 국제공동연구지원사업의 지원으로 수행됐다.
2024.07.01 조회수 5523 -
 세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
2024.05.22 조회수 7641
세계 최대 규모 암 데이터베이스 구축하다
디지털 암 정보 축적의 시대에는 데이터 생산을 넘어서, 데이터의 수집 및 관리 방법을 정립하고 거대 규모의 빅 데이터를 운용하는 것이 가장 큰 경쟁력이 될 수 있다. 전략적으로는 정밀 임상 정보와 연계할 수 있는 국내 생산 데이터와 다양성에 대한 이해를 도모할 수 있는 대규모 국제 데이터를 모두 수집해 통합하는 것은 매우 중요한 과제다.
우리 대학 의과학대학원 박종은 교수, 바이오및뇌공학과 최정균 교수 공동 연구팀(제1 저자: 강준호 박사, 이준형 박사)이 세계 최대 규모의 암 조직 단일세포 및 공간전사체* 데이터베이스를 구성하고, 이를 바탕으로 삼성서울병원 이세훈 교수 연구팀과 함께 면역 치료의 예후 예측에 중요한 세포 생태계 타입을 보고했다고 22일 밝혔다.
*단일세포 및 공간전사체: 모든 유전자의 발현 양상을 개별 세포 단위에서 혹은 3차원 조직 구조상에서 분석한 데이터
암은 우리 몸 안에서 스스로 진화하는 특성을 가지고 있어 암 조직 내의 세포 생태계를 구성하는 각 세포의 이질성과 이들의 상호작용을 파악하는 것이 가장 중요하다.
최근 발달하고 있는 단일세포 및 공간 전사체는 미세환경을 구성하는 세포들과 그들의 3차원적 배열 및 상호작용을 정량적으로 측정 및 표현한다는 점에서 미세환경의 이질성 개념을 생태계 수준으로 확장해 디지털 정보의 형태로 저장 및 분석할 수 있게 한다.
연구팀은 암세포 생태계 타입들을 전 암종(pan-cancer) 수준에서 규명하기 위해 약 1,000개의 암 환자 조직 샘플, 500여 명의 정상 조직 샘플에 대한 단일세포 전사체 데이터를 30종 이상의 암종에 대해 수집하여 모든 암에 대한 세포 지도가 총망라된 전 암종 단일세포 지도(pan-cancer single-cell atlas)를 구축했다.
내과 전문의가 포함된 연구진이 직접 데이터를 수집하고, 메타데이터 재처리 및 암종 분류를 진행함으로써 암 조직을 구성하는 100여 개의 세포 상태를 규정하고, 이들의 발생빈도를 바탕으로 각 암종별 조직의 상태를 분류했다. 또한 미국의 암 환자 공공 데이터베이스(TCGA) 등의 대규모 코호트 데이터를 활용해 각 세포 상태가 암 환자의 치료 및 예후에 미치는 영향을 분석했다.
특히 여러 세포 상태 간의 상호작용 분석을 통해서 암세포 생태계 네트워크를 구축하였고, 이 중에서 삼차 림프 구조(tertiary lymphoid structure)* 구성요소를 포함하는 인터페론 연관 생태계가 삼성서울병원 이세훈 교수 연구팀의 폐암 코호트를 포함해 면역관문 억제 치료(immune checkpoint inhibitor)**를 받은 여러 암종들에서 면역관문 억제 치료 반응 예측에 효과적임을 확인했다.
*삼차 림프 구조: 림프절과 유사하지만 건강한 조직에서는 형성되지 않고, 만성염증, 감염, 암 등이 있는 곳에서 면역 세포들이 조직화되어 형성되는 구조물
**면역관문 억제치료: T세포 혹은 암세포에서 발현되는 PD-1/PD-L1, CTLA-4와 같은 면역관문(immune checkpoint)을 차단하여 암세포와 싸우는 면역 반응을 활성화시키는 치료방법
연구를 주도한 박종은 교수는 “이번 연구를 통해 세계 최대 규모의 암 조직 데이터베이스를 구축하였고, 이를 바탕으로 면역 치료의 예후 예측에 중요한 영향을 줄 것이다. 또한 소수의 환자에게 아주 좋은 치료반응을 보이나 일부의 경우 면역 관련 부작용을 나타내는 면역 관문 억제제의 치료 대상군 선정에 큰 도움을 줄 것으로 기대된다.”고 말했다.
이번 연구 결과는 국제 학술지 ‘네이쳐 커뮤니케이션즈(Nature Communications)’ 지에 5월 14일 자 출판됐으며, KAIST 세포 아틀라스 웹 포탈 https://cellatlas.kaist.ac.kr 을 통해 공개되고 있다.
한편 이번 연구는 한국연구재단의 차세대바이오유망범용기술연구지원사업과 우수신진연구사업, 한국보건산업진흥원 연구중심병원 육성사업, 융합형의사과학자양성사업 및 포스코사이언스펠로우십의 지원을 받아 수행됐다.
2024.05.22 조회수 7641 -
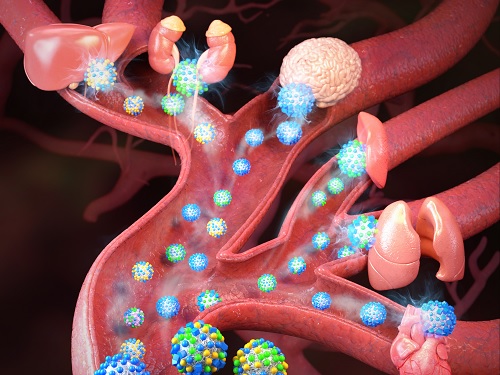 장기 별 직접 약물 전달이 가능해지다
장기 선택적 약물 전달 기술은 치료 효과를 극대화하고 부작용을 최소화할 수 있어 큰 기대를 받고 있다. 그러나 현존하는 기술로는 간, 비장, 폐와 같은 대식세포가 활발히 활동하는 장기에만 약물을 전달하는 것이 가능하나 콩팥, 심장, 뇌와 같은 장기로의 약물 전달은 도전적인 과제로 알려져 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 체내에서 여러 생물학적 상호작용에 관여하는 당질 층을 모방한 인공 탄수화물 나노입자(Glycocalyx-mimicking nanoparticle, GlyNP) 수십 종을 합성하여 이를 다양한 장기로의 특이적 약물 전달과 치료를 가능하게 하는 새로운 나노의약 개발에 성공했다고 3일 밝혔다.
연구팀은 다섯 가지의 단당류 단위체를 기반으로 한 조합적인 패턴을 구현해 ‘인공 탄수화물 나노입자(GlyNP)’ 라이브러리 수십 종을 합성했고, 이를 직접 동물 체내에서 선택성을 평가해 간, 신장, 비장, 폐, 심장, 뇌에 대해 차별화된 선택성을 가지는 인공 탄수화물 나노입자 후보군을 선별했다. 특히, 간, 신장, 비장에 선택성을 가지는 인공 탄수화물 나노입자 후보군은 해당 장기 내에서 각각 간세포, 신장 상피세포, 대식 세포를 표적하는 것을 확인했다.
궁극적으로 각 장기 선택적인 인공 탄수화물 나노입자 후보군을 사용하면 해당 장기에 생긴 질병을 더욱 효과적으로 치료할 수 있음을 보여주며 장기별 맞춤형 치료의 가능성을 보였다.
전상용 교수는 "이번 연구를 통해 개발한 장기 및 세포 선택적인 약물전달시스템을 이용하면 독성을 낮추고 효능을 크게 올릴 수 있어 기존에 가능하지 않았던 장기별 질병 치료에 한 걸음 더 나아갈 수 있을 것이고, 또한, 뇌나 심장과 같이 표적 약물 전달이 어려운 장기들로 기술을 확장해 나갈 것이다”라고 말했다.
생명과학과 김도현 박사과정 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 3월 15일 字 온라인판에 게재됐고 속 표지논문(Inside back cover) 및 화제의 논문(Hot Paper)으로 선정됐다.
(https://doi.org/10.1002/adma.202311283. 논문명: Glycocalyx-Mimicking Nanoparticles with Differential Organ Selectivity for Drug Delivery and Therapy, This article also appears in Hot Topic: Drug Delivery)
또한, 해당 주제는 제30회 삼성휴먼테크논문대상 생명공학 & 생명과학(Bio engineering & Life Science) 분야에서 은상을 수상하며 장기별 맞춤형 치료의 새로운 전략을 제시한 성과로 인정받았다.
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2024.05.03 조회수 9017
장기 별 직접 약물 전달이 가능해지다
장기 선택적 약물 전달 기술은 치료 효과를 극대화하고 부작용을 최소화할 수 있어 큰 기대를 받고 있다. 그러나 현존하는 기술로는 간, 비장, 폐와 같은 대식세포가 활발히 활동하는 장기에만 약물을 전달하는 것이 가능하나 콩팥, 심장, 뇌와 같은 장기로의 약물 전달은 도전적인 과제로 알려져 있다.
우리 대학 생명과학과 전상용 교수와 화학과 이희승 교수 공동연구팀이 체내에서 여러 생물학적 상호작용에 관여하는 당질 층을 모방한 인공 탄수화물 나노입자(Glycocalyx-mimicking nanoparticle, GlyNP) 수십 종을 합성하여 이를 다양한 장기로의 특이적 약물 전달과 치료를 가능하게 하는 새로운 나노의약 개발에 성공했다고 3일 밝혔다.
연구팀은 다섯 가지의 단당류 단위체를 기반으로 한 조합적인 패턴을 구현해 ‘인공 탄수화물 나노입자(GlyNP)’ 라이브러리 수십 종을 합성했고, 이를 직접 동물 체내에서 선택성을 평가해 간, 신장, 비장, 폐, 심장, 뇌에 대해 차별화된 선택성을 가지는 인공 탄수화물 나노입자 후보군을 선별했다. 특히, 간, 신장, 비장에 선택성을 가지는 인공 탄수화물 나노입자 후보군은 해당 장기 내에서 각각 간세포, 신장 상피세포, 대식 세포를 표적하는 것을 확인했다.
궁극적으로 각 장기 선택적인 인공 탄수화물 나노입자 후보군을 사용하면 해당 장기에 생긴 질병을 더욱 효과적으로 치료할 수 있음을 보여주며 장기별 맞춤형 치료의 가능성을 보였다.
전상용 교수는 "이번 연구를 통해 개발한 장기 및 세포 선택적인 약물전달시스템을 이용하면 독성을 낮추고 효능을 크게 올릴 수 있어 기존에 가능하지 않았던 장기별 질병 치료에 한 걸음 더 나아갈 수 있을 것이고, 또한, 뇌나 심장과 같이 표적 약물 전달이 어려운 장기들로 기술을 확장해 나갈 것이다”라고 말했다.
생명과학과 김도현 박사과정 및 황창희 박사가 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 3월 15일 字 온라인판에 게재됐고 속 표지논문(Inside back cover) 및 화제의 논문(Hot Paper)으로 선정됐다.
(https://doi.org/10.1002/adma.202311283. 논문명: Glycocalyx-Mimicking Nanoparticles with Differential Organ Selectivity for Drug Delivery and Therapy, This article also appears in Hot Topic: Drug Delivery)
또한, 해당 주제는 제30회 삼성휴먼테크논문대상 생명공학 & 생명과학(Bio engineering & Life Science) 분야에서 은상을 수상하며 장기별 맞춤형 치료의 새로운 전략을 제시한 성과로 인정받았다.
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2024.05.03 조회수 9017 -
 소금 결핍 시 장에서 섭취 욕구 조절하다
나트륨은 생물이 살아가는 데 필요한 중요한 미량영양소 중 하나로, 수분 균형과 혈압을 조절하며 근육 수축 및 신경세포의 작용전위 생성에 필수적이다. 한국 연구진은 소금 섭취 욕구가 짠맛에만 의존하는 것이 아니라, 체내 나트륨 수준에 따라 결정된다는 새로운 시각을 제시했고 미각 감지 기작과는 다르게 장 감지 기작은 소금 결핍에 의해 활성화된다는 놀라운 사실을 발견했다.
우리 대학 생명과학과 서성배 교수 연구팀이 나트륨이라는 미량영양소에 대한 우리 몸의 새로운 감지 기작과 그 욕구를 조절하는 새로운 메커니즘을 발견했다고 2일 밝혔다.
연구팀은 소금에 대한 미각 감지 기작을 넘어 장내 신경세포가 나트륨에 직접적으로 반응하고 이 반응이 동물의 소금에 대한 섭취 욕구를 조절하는 새로운 감지 기작으로 작용한다는 연구 결과를 밝혔다.
해당 연구에서는 초파리를 이용해 나트륨 결핍 상태에 따른 소금에 대한 선호도가 증가함을 확인했다. 더욱 흥미로운 점은 나트륨에 대한 선호도가 소금에 대한 미각 센서가 작동하지 못하는 ‘Ir76b’ 돌연변이 파리에서도 나트륨 결핍 상태에서 소금을 더 선호한다는 것이다. 이에 연구진은 스크리닝을 통해 나트륨을 직접 인지하는 초파리의 장내 신경세포를 발견했으며, 이 신경세포가 나트륨 결핍에 따라 나트륨에 대한 반응 정도를 다르게 해 초파리의 소금 섭취 욕구를 조절하는 역할을 한다는 것을 규명했다.
연구팀은 장 감지 기작은 소금 결핍에 의해 활성화된다는 놀라운 사실을 발견하며 소금에 대한 섭취 욕구는 모든 생물에 존재하는 것이기에 해당 연구는 곤충뿐 아니라 포유동물과 같은 척추동물에서도 유사한 메커니즘이 존재할 수 있다는 가능성도 제시했다.
나아가 소금에 대한 섭취 욕구를 조절함으로써 이를 통해 소금 과다 섭취로 생기는 고혈압 등의 여러 질병에서 새로운 생리학적 측면에서의 접근 방식을 할 수 있을 것이라 여겨진다.
연구를 주도한 서성배 교수는 “이번 연구는 소금의 짠맛과는 독립적으로 장 신경세포를 통해 선호도가 결정된다는 것을 발견하였고, 나트륨 섭취의 생리적 조절에 대한 새로운 메커니즘을 제공하였다 소금에 대한 섭취욕은 모든 진화 생물에서 보이는 공통적인 특징으로 해당 연구를 통해서 소금에 대한 섭취 욕구를 조절하여 고혈압을 포함한 여러 질병에 생리학적으로 접근할 수 있는 가능성을 보여준 것이라 기대한다.”고 말했다.
생명과학과 김병수 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이쳐 메타볼리즘(Nature Metabolism)’ 4월 3일 자로 온라인판에 게재됐다. (논문명 : Postprandial sodium sensing by enteric neurons in Drosophila).
한편 이번 연구는 한국연구재단, 리더과제 (전 창의과제), 생명과학 프로젝트 지원을 받아 수행됐다.
2024.05.02 조회수 5250
소금 결핍 시 장에서 섭취 욕구 조절하다
나트륨은 생물이 살아가는 데 필요한 중요한 미량영양소 중 하나로, 수분 균형과 혈압을 조절하며 근육 수축 및 신경세포의 작용전위 생성에 필수적이다. 한국 연구진은 소금 섭취 욕구가 짠맛에만 의존하는 것이 아니라, 체내 나트륨 수준에 따라 결정된다는 새로운 시각을 제시했고 미각 감지 기작과는 다르게 장 감지 기작은 소금 결핍에 의해 활성화된다는 놀라운 사실을 발견했다.
우리 대학 생명과학과 서성배 교수 연구팀이 나트륨이라는 미량영양소에 대한 우리 몸의 새로운 감지 기작과 그 욕구를 조절하는 새로운 메커니즘을 발견했다고 2일 밝혔다.
연구팀은 소금에 대한 미각 감지 기작을 넘어 장내 신경세포가 나트륨에 직접적으로 반응하고 이 반응이 동물의 소금에 대한 섭취 욕구를 조절하는 새로운 감지 기작으로 작용한다는 연구 결과를 밝혔다.
해당 연구에서는 초파리를 이용해 나트륨 결핍 상태에 따른 소금에 대한 선호도가 증가함을 확인했다. 더욱 흥미로운 점은 나트륨에 대한 선호도가 소금에 대한 미각 센서가 작동하지 못하는 ‘Ir76b’ 돌연변이 파리에서도 나트륨 결핍 상태에서 소금을 더 선호한다는 것이다. 이에 연구진은 스크리닝을 통해 나트륨을 직접 인지하는 초파리의 장내 신경세포를 발견했으며, 이 신경세포가 나트륨 결핍에 따라 나트륨에 대한 반응 정도를 다르게 해 초파리의 소금 섭취 욕구를 조절하는 역할을 한다는 것을 규명했다.
연구팀은 장 감지 기작은 소금 결핍에 의해 활성화된다는 놀라운 사실을 발견하며 소금에 대한 섭취 욕구는 모든 생물에 존재하는 것이기에 해당 연구는 곤충뿐 아니라 포유동물과 같은 척추동물에서도 유사한 메커니즘이 존재할 수 있다는 가능성도 제시했다.
나아가 소금에 대한 섭취 욕구를 조절함으로써 이를 통해 소금 과다 섭취로 생기는 고혈압 등의 여러 질병에서 새로운 생리학적 측면에서의 접근 방식을 할 수 있을 것이라 여겨진다.
연구를 주도한 서성배 교수는 “이번 연구는 소금의 짠맛과는 독립적으로 장 신경세포를 통해 선호도가 결정된다는 것을 발견하였고, 나트륨 섭취의 생리적 조절에 대한 새로운 메커니즘을 제공하였다 소금에 대한 섭취욕은 모든 진화 생물에서 보이는 공통적인 특징으로 해당 연구를 통해서 소금에 대한 섭취 욕구를 조절하여 고혈압을 포함한 여러 질병에 생리학적으로 접근할 수 있는 가능성을 보여준 것이라 기대한다.”고 말했다.
생명과학과 김병수 박사가 제1 저자로 참여한 이번 연구는 국제 학술지 ‘네이쳐 메타볼리즘(Nature Metabolism)’ 4월 3일 자로 온라인판에 게재됐다. (논문명 : Postprandial sodium sensing by enteric neurons in Drosophila).
한편 이번 연구는 한국연구재단, 리더과제 (전 창의과제), 생명과학 프로젝트 지원을 받아 수행됐다.
2024.05.02 조회수 5250 -
 암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9526
암세포만 골라 유전자 교정 치료하는 신약 개발
최근 크리스퍼(유전자 가위) 기술을 활용한 유전자 교정 치료제 연구가 활발하다. 기존 화학적 항암치료제와는 달리 크리스퍼 기술 기반 유전자 교정 치료제는 질병 표적 유전자를 영구적으로 교정할 수 있어 암 및 유전 질환 치료제로 각광받고 있지만, 생체 내에서 암 조직으로 낮은 전달 효율과 낮은 효능으로 어려움을 겪고 있다.
우리 대학 생명과학과 정현정 교수 연구팀이 크리스퍼 기반 표적 치료제로 항체를 이용한 크리스퍼 단백질을 생체 내 표적 조직에 특이적으로 전달하는 항암 신약을 개발해 암세포 선택적 유전자 교정 및 항암 효능을 보였다고 8일 밝혔다.
유전자 치료에 사용하는 바이러스 기반 전달 방법은 인체 내 면역 부작용, 발암성 등 한계점을 가지고 있다. 이에 선호되는 비 바이러스성 전달 방법으로 단백질 기반의 크리스퍼 기술 전달은 본래의 표적과는 다른 분자를 저해 혹은 활성화하는 효과를 가져오는 오프타깃 효과가 최소화되며 보다 높은 안전성으로 치료제로서 개발이 적합하다. 하지만 크리스퍼 단백질은 분자량이 커서 전달체에 탑재가 어렵고 전달체의 세포 독성 문제 및 낮은 표적 세포로의 전달에 있어 어려움이 있다.
이러한 문제점들을 극복하기 위해 연구팀은 크리스퍼 단백질에 특정 아미노산을 변경시켜 다양한 생체분자를 보다 많이 결합시키고 생체 내 본질적인 생화학 과정을 방해하지 않는 단백질을 개발했다. 연구팀은 기존 비 바이러스성 전달체의 문제 해결 및 표적 세포로의 전달을 위해 개량한 크리스퍼 단백질을 난소암을 표적할 수 있는 항체와 결합함으로써 표적 치료제를 위한 항체 결합 크리스퍼 나노복합체(⍺Her-CrNC, anti-Her2 conjugated CRISPR nanocomplex)를 개발했다.
암세포 표면은 종양 항원(tumor antigen)으로 알려진 항원이 존재한다. 몇몇 종양 항원은 표적이 되어 진단 및 임상시험에 이용되고 있다. 연구팀은 개발한 항체 결합 크리스퍼 나노복합체가 종양 항원을 표적해 난소암세포 및 동물모델에서 암세포 특이적으로 세포 내 전달이 가능하고 세포주기를 관장하는 PLK1* 유전자 교정을 통해 높은 항암효과가 나타남을 확인했다.
* PLK1(polo-like kinase): 세포 분열을 조절하는 인산화효소이며, 암세포 분열과 관련이 깊다고 알려져 있음. 본 연구에서는 PLK1 유전자를 표적하여 암세포 분열을 억제하여 항암 효과를 유도하였음
연구를 주도한 정현정 교수는 “이번 연구는 최초로 크리스퍼 단백질과 항체를 결합해 효과적으로 암세포 특이적 전달 및 항암 효능을 보였다는 점에서 의의가 있다. 아울러, 이번 연구 결과를 기반으로 향후 생체 내 전신 투여를 통한 유전자 교정 치료 및 다양한 암종에 적용할 수 있는 플랫폼 기술로 기대하고 있다”고 말했다.
우리 대학 생명과학과 석박사통합과정 양승주 학생이 제1 저자로 참여한 이번 연구는 국제학술지 `어드밴스드 사이언스(Advanced Science)'에 3월 29일 온라인 게재됐다. (논문명: An Antibody-CRISPR/Cas Conjugate Platform for Target-Specific Delivery and Gene Editing in Cancer)
한편 이번 연구는 과학기술정보통신부와 한국연구재단 및 보건복지부의 지원을 통해 이뤄졌다.
2024.04.08 조회수 9526 -
 비알콜성 지방간염은 이제 MRI로 진단하세요
간 건강을 위협하는 질환인 비알콜성 지방간 질환과 그 진행 형태인 비알콜성 지방간염의 현재 표준 진단 방법은 주로 간 조직을 채취하는 간 생검에 의존하고 있어 환자의 위험 부담이 크며, 질병의 진행 단계를 추적하는 데 어려움이 있었다.
우리 대학 생명과학과 전상용 교수와 바이오및뇌공학과 박성홍 교수 공동연구팀이 활성산소에 반응해 자기공명영상(MRI) 신호가 증강되는 MRI 영상 조영제를 개발했고 한 번의 MRI 촬영으로 손쉽게 비알콜성 지방간염의 진행 정도를 모니터링하고 진단하는 기술을 세계 최초로 개발했다고 2일 밝혔다.
비알콜성 지방간염은 간세포 손상, 염증, 그리고 최종적으로 간경화로 진행될 수 있는 질환으로, 간 내 활성산소 수준의 증가와 밀접한 관련이 있다. 활성산소는 간세포의 산화 스트레스를 유발하고, 비알콜성 지방간염의 진행을 촉진하는 주요 요인 중 하나로 알려져 있다.
이에 착안해 연구팀은 비알콜성 지방간염의 진행을 비침습적으로 모니터링할 수 있는 새로운 방법을 모색하고자 했다. 특히, 간 내 활성산소 양 변화에 반응해 MRI 신호를 강화할 수 있는 망간 이온 결합 빌리루빈 나노입자를 개발하고, 이를 활용하여 비알콜성 지방간염의 진행 상태를 정밀하게 추적할 수 있는 기술을 연구했다.
망간 이온 결합 빌리루빈 나노입자는 간 내 활성산소 증가에 따라 MRI 신호를 증폭했고 연구팀은‘유사 3-구획 모델’을 통해 한 번의 MRI 촬영으로 비알콜성 지방간염의 진행 정도를 결정할 수 있었다. 이를 통해 비알콜성 지방간염의 초기 단계부터 간경화에 이르기까지 간 질환의 진행 상태를 연속적으로 모니터링 할 수 있었다.
연구팀은 다양한 실험을 통해 망간 이온 결합 빌리루빈 나노입자가 간 질환 모델 마우스에서 활성산소 양의 변화에 민감하게 반응해 MRI 신호의 강도를 조절하는 것을 확인했다. 이러한 발견은 간 질환의 진행 상태를 정밀하게 파악할 수 있게 함으로써, 환자 개개인에 맞춘 맞춤형 치료 전략 수립에 크게 기여할 수 있을 것으로 기대된다. 더 나아가, 이 기술은 비침습적이라는 점에서 환자의 부담을 크게 줄여주며, 장기적으로는 간 질환 관리 및 치료의 효율성을 높일 수 있을 것으로 전망된다.
전상용 교수는 “이번 연구를 통해 개발된 새로운 MRI 조영제와 영상해석 모델을 사용함으로써 기존에 표준 진단으로 사용하던 환자들에게 위험한 간 생검을 대체할 수 있을 것으로 기대한다”며, “또한, 병원에서 쉽게 접할 수 있는 대표적인 영상 장비인 MRI로 비알콜성 지방간염의 진행 상태 및 간경화로의 전이되는 단계를 손쉽게 진단할 수 있어 지방간염 약물의 효능을 평가하는 데 필수적인 진단 장비가 될 수 있을 것이므로 효율적인 지방간염 치료제 개발에 기여할 수 있을 것으로 기대한다”라고 말했다.
우리 대학 생명과학과 정원식 박사 및 바이오및뇌공학과 무하메드 아사두딘(Muhammad Asaduddin) 박사가 공동 제1 저자로 참여한 이번 연구는 재료과학 분야 최정상급 학술지인 `어드밴스드 머터리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 온라인판에 지난 3월 9일 字 게재됐다.
(https://doi.org/10.1002/adma.202305830 논문명: Longitudinal Magnetic Resonance Imaging with ROS-Responsive Bilirubin Nanoparticles Enables Monitoring of Non-Alcoholic Steatohepatitis Progression to Cirrhosis).
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 기초연구실지원사업(뇌척수액 순환 기반 뇌인지기능 기초연구실)의 지원을 받아 수행됐다.
2024.04.02 조회수 6935
비알콜성 지방간염은 이제 MRI로 진단하세요
간 건강을 위협하는 질환인 비알콜성 지방간 질환과 그 진행 형태인 비알콜성 지방간염의 현재 표준 진단 방법은 주로 간 조직을 채취하는 간 생검에 의존하고 있어 환자의 위험 부담이 크며, 질병의 진행 단계를 추적하는 데 어려움이 있었다.
우리 대학 생명과학과 전상용 교수와 바이오및뇌공학과 박성홍 교수 공동연구팀이 활성산소에 반응해 자기공명영상(MRI) 신호가 증강되는 MRI 영상 조영제를 개발했고 한 번의 MRI 촬영으로 손쉽게 비알콜성 지방간염의 진행 정도를 모니터링하고 진단하는 기술을 세계 최초로 개발했다고 2일 밝혔다.
비알콜성 지방간염은 간세포 손상, 염증, 그리고 최종적으로 간경화로 진행될 수 있는 질환으로, 간 내 활성산소 수준의 증가와 밀접한 관련이 있다. 활성산소는 간세포의 산화 스트레스를 유발하고, 비알콜성 지방간염의 진행을 촉진하는 주요 요인 중 하나로 알려져 있다.
이에 착안해 연구팀은 비알콜성 지방간염의 진행을 비침습적으로 모니터링할 수 있는 새로운 방법을 모색하고자 했다. 특히, 간 내 활성산소 양 변화에 반응해 MRI 신호를 강화할 수 있는 망간 이온 결합 빌리루빈 나노입자를 개발하고, 이를 활용하여 비알콜성 지방간염의 진행 상태를 정밀하게 추적할 수 있는 기술을 연구했다.
망간 이온 결합 빌리루빈 나노입자는 간 내 활성산소 증가에 따라 MRI 신호를 증폭했고 연구팀은‘유사 3-구획 모델’을 통해 한 번의 MRI 촬영으로 비알콜성 지방간염의 진행 정도를 결정할 수 있었다. 이를 통해 비알콜성 지방간염의 초기 단계부터 간경화에 이르기까지 간 질환의 진행 상태를 연속적으로 모니터링 할 수 있었다.
연구팀은 다양한 실험을 통해 망간 이온 결합 빌리루빈 나노입자가 간 질환 모델 마우스에서 활성산소 양의 변화에 민감하게 반응해 MRI 신호의 강도를 조절하는 것을 확인했다. 이러한 발견은 간 질환의 진행 상태를 정밀하게 파악할 수 있게 함으로써, 환자 개개인에 맞춘 맞춤형 치료 전략 수립에 크게 기여할 수 있을 것으로 기대된다. 더 나아가, 이 기술은 비침습적이라는 점에서 환자의 부담을 크게 줄여주며, 장기적으로는 간 질환 관리 및 치료의 효율성을 높일 수 있을 것으로 전망된다.
전상용 교수는 “이번 연구를 통해 개발된 새로운 MRI 조영제와 영상해석 모델을 사용함으로써 기존에 표준 진단으로 사용하던 환자들에게 위험한 간 생검을 대체할 수 있을 것으로 기대한다”며, “또한, 병원에서 쉽게 접할 수 있는 대표적인 영상 장비인 MRI로 비알콜성 지방간염의 진행 상태 및 간경화로의 전이되는 단계를 손쉽게 진단할 수 있어 지방간염 약물의 효능을 평가하는 데 필수적인 진단 장비가 될 수 있을 것이므로 효율적인 지방간염 치료제 개발에 기여할 수 있을 것으로 기대한다”라고 말했다.
우리 대학 생명과학과 정원식 박사 및 바이오및뇌공학과 무하메드 아사두딘(Muhammad Asaduddin) 박사가 공동 제1 저자로 참여한 이번 연구는 재료과학 분야 최정상급 학술지인 `어드밴스드 머터리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32)' 온라인판에 지난 3월 9일 字 게재됐다.
(https://doi.org/10.1002/adma.202305830 논문명: Longitudinal Magnetic Resonance Imaging with ROS-Responsive Bilirubin Nanoparticles Enables Monitoring of Non-Alcoholic Steatohepatitis Progression to Cirrhosis).
한편 이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 기초연구실지원사업(뇌척수액 순환 기반 뇌인지기능 기초연구실)의 지원을 받아 수행됐다.
2024.04.02 조회수 6935 -
 흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2024.02.21 조회수 6167
흡연과 음주가 구강암 촉진 밝혀
흡연과 음주는 세포에서 활성산소의 부하를 증가시키고 높은 수준의 산화스트레스를 유발한다고 알려져 있다. 하지만 아직 산화스트레스가 구강암의 발달을 촉진하는 구체적인 기전은 명확히 밝혀지지 않았다.
우리 대학 의과학대학원 김준 교수 연구팀이 발암 위험 인자인 흡연과 음주가 구강암의 발생과 성장에 관여하는 새로운 기전을 규명했다고 21일 밝혔다.
연구팀은 이번 연구에서 흡연 및 음주가 직접적인 DNA 손상뿐 아니라 산화스트레스를 통한 전사 조절(발암 유전자의 발현 증가)로 구강암의 증식을 촉진하는 경로를 밝혀서 항암제 개발의 새로운 단서를 확보했다.
연구팀은 구강암 환자에서 특이적으로 높게 발현되는 TM4SF19 (Transmembrane 4 L Six Family Member 19) 단백질에 주목했다. 이 단백질은 산화스트레스에 의해 두 개의 분자가 중합해 형성되는 이합체 물질을 형성해 발암 유전자로 알려진 YAP(yes-associated protein)의 발현을 일시적으로 증가시킴을 구강암 세포주를 이용한 단백질 생화학 실험을 통해 밝혔다. 이 단백질(TM4SF19)은 대부분의 정상 조직에서는 낮게 발현되며, 아직 기능이 알려지지 않은 단백질이다. 구강암 세포에서 이 단백질(TM4SF19)을 억제하면 발암유전자(YAP) 발현이 감소했고, 이는 암세포의 증식과 전이 능력을 저하시키는 효과를 보였다.
의과학대학원 김준 교수는 “이번 연구는 흡연과 음주가 암 발달을 촉진하는 새로운 분자 기전을 규명했을 뿐 아니라 구강암 연구의 새로운 방향을 제시하고 새로운 약물 표적인 단백질(TM4SF19)을 발굴하였다는 점에서 의미가 있다”고 연구의 의의를 설명했다.
KAIST 의과학대학원 졸업생 신은비 박사후연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 ‘미국국립과학원회보(PNAS)’에 2월 5일 자로 게재됐다. (논문명: TM4SF19 controls GABP-dependent YAP transcription in head and neck cancer under oxidative stress conditions)
한편 이번 연구는 한국연구재단 중견연구자지원사업의 지원을 받아 수행됐다.
2024.02.21 조회수 6167 -
 방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7014
방사선 유발 DNA 돌연변이 첫 규명
암은 세계적으로 큰 건강 문제로 인식되고 있으며, 암 치료에 대한 지속적인 연구와 기술 발전이 이루어지고 있다. 암치료의 중요한 방법 중 하나인 방사선 치료는 암 조직을 효과적으로 파괴하거나 성장을 억제하는 데 중요한 역할을 하고 있으나 방사선이 실제로 우리의 세포에 유발하는 돌연변이의 종류와 양에 대한 이해는 아직 미흡한 상태였다. 한국의 의과학자들이 이러한 공백을 메울 수 있는 연구 결과를 발표하였다.
우리 대학 의과학대학원 주영석 교수 연구팀이 동남권원자력의학원 손태건 박사, 서울대학교 의과대학 방사선종양학과 김경수, 장지현 교수팀과의 공동 연구로 방사선이 인간 및 생쥐의 정상 세포에서 만들어내는 DNA 돌연변이의 특성을 명확히 규명해 냈다고 15일 밝혔다.
이번 연구는 방사선 연구 분야에서의 중요한 전환점으로 평가되고 있다. 연구진은 실험실에서 방사선을 조사하여 세포에 돌연변이를 유도한 후, 방사선이 만들어낸 돌연변이를 유전체 서열분석 기술을 통해 규명하는 방식으로 방사선이 유발하는 DNA 돌연변이의 양과 패턴을 정밀하게 이해하는 데 성공하였다.
연구팀은 방사선이 인체에 미치는 영향을 종합적으로 이해하기 위하여 생쥐와 사람의 다양한 장기(위, 소장, 대장, 간, 유방, 폐, 췌장, 나팔관 등)에서 얻은 세포를 다양한 선량의 방사선에 노출하였고, 각각의 세포마다 유도된 돌연변이를 정밀하게 검출하기 위해 세포 하나하나를 오가노이드 세포 배양 기술을 응용하여 증폭하였다. 총 200개의 세포 유전체 서열로부터 방사선 피폭 양에 비례하여 증가하는 특정 패턴의 돌연변이들을 규명하는 데 성공하였다 (그림 1).
본 연구에서 1Gy (그레이)의 방사선량은 매 세포마다 약 14개 내외의 돌연변이를 만들어내는 것으로 나타났다 (그림 2). 우리나라 연간 평균 자연방사선 양 (3.08mSV(시버트))을 감안하면 1Gy는 약 320년의 자연방사선 노출에 해당하는 셈이다. 방사선이 만들어내는 변이의 패턴은 다른 원인에 의한 돌연변이와는 달랐는데, 주로 짧은 염기 결손 (short base deletion)과 소수의 염색체의 역위(inversion), 전위 (translocation), 및 다양한 복잡 구조변이(complex genomic rearrangements)들로 구성되어 있었다 (그림 3). 방사선은 서로 다른 세포 종류에도 모두 비슷한 정도의 돌연변이를 만들어 내는 것으로 밝혀졌다.
의과학대학원 주영석 교수는 이번 연구를 통해 "방사선이 분자 수준에서 세포에 미치는 영향을 명확하게 규명했다"며, "방사선이 우리 세포의 DNA를 얼마나, 어떻게 변화시키는지에 대한 첫 규명"이라고 설명했다.
동남권원자력의학원의 손태건 박사는 "이번 연구를 기반으로 앞으로도 초저선량 및 초고선량 방사선이 인체에 미치는 영향을 연구할 것"이라고 밝혔으며, "안전하면서도 효과적인 방사선 치료 기술을 발전시킬 것"이라고 덧붙였다.
서울대학교 의과대학 방사선종양학과 김경수 교수와 장지현 교수는 “이번 연구를 통해 방사선이 인체 DNA 에 미치는 영향에 대해 정확히 알 수 있는 도구를 가지게 된 것으로 생각한다” 면서 “이번 연구에 쓰인 연구 방법론으로 많은 후속 연구가 나올 수 있기를 기대한다” 고 밝혔다.
의과학대학원 육정환 박사 (現 서울대병원 내과 조교수), 임준오 박사 (現 지놈인사이트), 김태우 박사 (現 Weill Cornell 의과대학 박사후연구과정) 및 서울대학교 의과대학 권현우 박사 (現 고려대학교 의과대학 핵의학과 교수), 김은지 박사 (現 서울대학교 의과대학 방사선종양학과 조교수) 등이 공동 제1저자로 참여한 이번 연구 결과는 국제 학술지 '셀 지노믹스(Cell Genomics)'의 온라인판에 14일 발표되었다. (논문명: Quantitative and qualitative mutational impact of ionizing radiation on normal cells).
이번 연구는 한국연구재단, 과학기술정보통신부 국가R&D사업, 서경배과학재단 신진과학자 연구지원 사업, 고려대학교 안암병원 및 국제 연구비 휴먼 프론티어 사이언스 프로그램(HFSP)의 젊은 연구자 지원사업의 도움으로 수행되었으며, 서울대학교 유전공학연구소, 영국 케임브리지 줄기세포 연구소, 오스트리아 분자생명공학연구소(IMBA) 및 KAIST 교원창업기업 지놈 인사이트의 연구자들도 참여하였다.
2024.02.15 조회수 7014 -
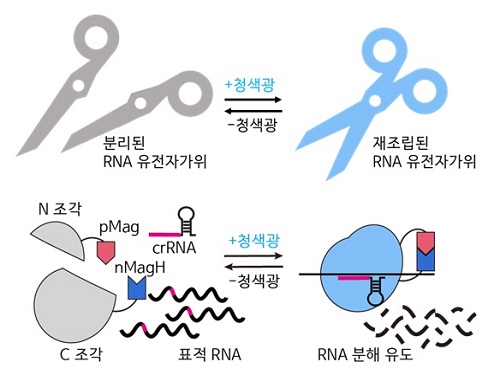 RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 9601
RNA 유전자 가위 정밀제어기술로 유전자 치료 성큼
최근 유전자 치료제 개발에 있어 중요한 역할을 하는 유전자 가위(CRISPR/Cas) 기술은 DNA 편집을 통해 영구적인 치료 효과를 보일 수 있으나, 비표적 효과에 의한 생체 내 부작용에 의한 돌연변이가 발생하였을 때, 대체할 방안이 불명확하다. DNA 편집의 잠재적인 위험성을 극복하여 특이적으로 인식하고 조절할 수 있는 RNA 대상으로 하는 유전자 가위 시스템이 주목받고 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 RNA 유전자 가위 기술 (CRISPR/Cas13)의 활성을 화학 유전학 및 광유전학으로 조절해 시간 및 공간적으로 표적 RNA의 염기 편집을 수행하는 기술을 개발했고, 동물 모델에서의 RNA 염기 편집 효과를 입증했다고 7일 밝혔다.
허원도 교수 연구팀은 구조가 알려지지 않은 단백질의 구조를 재구조화해, 화학적 및 광유전학적으로 조절 가능한 Cas13 단백질 조각을 예측하고 개발하는 데 성공했다. 이를 통해 개발된 에디터 기술로 RNA 분해 및 RNA 염기 편집을 실시간으로 유도할 수 있으며, RNA 염기 편집의 활성을 가역적으로 조절할 수 있음을 확인했다. 또한, 기존 연구자들이 실험에 이용하던 세포모델에서 더 나아가 세계 최초로 실험 쥐 모델에 해당 시스템을 적용해 광유전학적으로 RNA 염기 편집이 효과적으로 일어나는 것을 입증했다.
이번 연구는 유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다. 특히 생체 내 전달 목적으로 주로 사용되는데 연구팀은 RNA 대상 편집 시스템에서 단백질의 상대적으로 큰 크기를 유전체 전달에 있어서 임상적 적용에 한계점을 가지고 있다는 점을 감안하여 DNA 크기 제한을 분할 시스템으로 극복하고, 실험 쥐의 기관 내에서 다양한 모델 시스템 구축을 통해 생체 내 RNA 연구의 적용 범위를 확장할 수 있다.
연구를 주도한 허원도 교수는 “재결합이 가능한 분할 단백질 Cas13 조각을 개발해, 화학적 및 광유전학적으로 특정 시공간에서 정밀하게 조절되는 RNA를 실험적으로 확인했다. 이 기술은 그동안 실험적 한계로 인해 어려웠던 복잡한 RNA 연구를 촉진할 것으로 기대된다.라고 말했다.” 아울러 “유전자 가위 시스템을 활용한 유도 가능한 RNA 조절 시스템 개발로, 질병과 관련된 돌연변이를 표적으로 하는 RNA 기반 치료법의 발전 및 세포 내 RNA 기반 연구의 적용에 기여할 것으로 기대된다”라고 전했다.
우리 대학 생명과학과 유정혜 박사과정이 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 커뮤니케이션즈 (Nature Communications)’ 2024년 1월 22일 字 온라인판에 게재됐다. (논문명: Programmable RNA base editing with photoactivatable CRISPR-Cas13). (Impact Factor: 17.694). (DOI: https://doi.org/10.1038/s41467-024-44867-2)
한편, 이번 연구는 삼성미래기술육성재단과 정부의 재원으로 한국연구재단 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2024.02.07 조회수 9601 -
 지방간 치료제 신약 물질 개발
국내 연구진이 말초조직에 작용하는 비알코올성 지방간질환(NAFLD, Nonalcoholic fatty liver disease) 치료를 위한 신약 후보 물질을 개발하는 데 성공했다. 현재까지 최적의 비알코올성 지방간염(NASH) 치료제가 없는 상황에서 지방간 축적과 간 섬유화를 동시에 억제하면서 안전성이 증명된 치료제 개발이 기대된다.
광주과학기술원(GIST)은 화학과 안진희 교수 연구팀과 우리 대학 의과학대학원 김하일 교수 연구팀이 다년간 기초연구를 통해 질환 특이 단백질(HTR2A)을 억제할 수 있는 신규 화합물을 개발했으며, 안진희 교수의 창업기업인 ㈜제이디바이오사이언스에서 전임상 시험(동물 시험)을 통해 효능과 안전성을 입증하는 데 성공했다고 밝혔다.
비알코올성 지방간 질환의 유병율은 20~30%에 이르고, 지방간염 질환은 전 세계 성인 인구의 5% 이상이 보유하고 있을 정도로 높은 유병률을 보임에도 불구하고 현재까지 제품화된 치료제가 전혀 없다.
비알코올성 지방간질환은 지방간에서 시작해 지방간염, 섬유화, 간경화, 간암으로 진행되는 만성질환이며, 심혈관질환 및 간 관련 합병증 등에 의해 사망률이 증가하므로 발병 초기에 적절한 치료가 필요하다.
GIST와 KAIST 공동 연구팀이 개발한 이 신규 화합물은 지방간염에 치료 효과를 보이는 혁신신약 후보 물질로서, 세로토닌 수용체 단백질(5HT2A)을 억제함으로써 간 내 지방 축적과 간 섬유화를 동시에 억제하는 이중 작용 기전을 갖고 있다.
연구팀은 이 물질이 지방간 동물 및 지방간염 동물 모델에서 간 내 지방 축적으로 발생하는 간 지방증과 간 섬유화*를 동시에 50~70% 가량 억제함으로써 치료 효과가 있는 것을 확인하였다.
* 섬유화(fibrosis): 간의 일부가 굳는 현상으로, 지방간염 개선의 주요 지표로 쓰임
이 물질은 혈액-뇌 장벽(Blood-Brain Barrier) 투과도가 최소화되도록 최적의 극성과 지질친화도를 갖춘 화합물로 설계되어 뇌에 영향을 주지 않아 우울증, 자살 충동 등 중추신경계(CNS) 부작용이 적으며, 뇌 이외의 조직에서는 질환 타겟에 대한 억제력이 우수(IC50*=14 nM)하다고 연구팀은 설명했다. 또한 임상 3상 단계의 경쟁 약물과 효능을 비교해 본 결과, 간섬유화 개선 효능이 월등히 우수한 것으로 나타났다.
* IC50(half maximal inhibitory concentration): 특정 생물학적 또는 생화학적 기능을 50% 억제하는 물질의 농도
전임상 시험에 의해 얻은 약리작용 데이터를 토대로 건강한 사람에게서 부작용 및 안전한 약물 용량을 확인하는 단계인 임상 1상 시험에서 건강한 성인 총 88명을 대상으로 평가한 결과, 심각한 부작용은 발생하지 않았으며 안전성 또한 양호한 것으로 확인했다.
또한 지방간염 소견을 보이는 성인 8명을 대상으로 한 예비 효능 평가는 현재 진행 중이다.
안진희 교수는 “이번 연구는 비알콜성 지방간염의 치료를 위한 새로운 타겟 발굴을 통해 부작용이 적고 안전성이 보장된 치료제 개발을 목적으로, 현재 혁신신약 개발 바이오 벤처인 ㈜제이디바이오사이언스를 통해 호주에서 글로벌 임상 1상을 진행 중”이라고 밝혔다.
안 교수는 또한 “연구팀이 개발하고 있는 신약 후보물질은 안전성이 높으면서 간 지방축적을 억제시키는 예방효과뿐만 아니라 간 섬유화에 직접적인 치료 효과를 보인다는 강점이 있어 다른 경쟁 약물과는 차별화된다”고 설명했다.
우리 대학 김하일 교수는 “현재까지 체중을 조절하는 방법 외에는 치료방법이 없는 이 질환에서 비만하지 않은 환자에게 사용할 수 있는 약은 개발이 시도된 적도 없다”면서 “이번 연구를 계기로 체중에 영향을 주지 않으면서 비알코올성 지방간염을 포함한 다양한 대사질환 치료기술의 개발이 가능해질 것으로 기대한다”고 말했다.
GIST 안진희 교수 연구팀과 KAIST 김하일 교수 연구팀, ㈜제이디바이오사이언스(JD BIOSCIENCE) 연구팀이 함께 수행한 이번 연구는 과학기술정보통신부, 국가신약개발사업에서 지원을 받아 수행됐으며, 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’에 2024년 1월 20일 게재됐다.
또한 지난 4일부터 3일간 미국 유타에서 개최된 ‘NASH 치료제 전문 콘퍼런스(NASH-TAG Conference 2024)’에서 대사이상 관련 지방간염(MASH)* 치료제 후보물질인 ‘GM-60106(개발코드명)’의 임상 연구 결과를 발표해 우수 초록으로 선정되기도 했다.
* 대사이상 관련 지방간염(MASH): 비알코올성 지방간염(NASH)의 새로운 명칭
2024.01.30 조회수 9362
지방간 치료제 신약 물질 개발
국내 연구진이 말초조직에 작용하는 비알코올성 지방간질환(NAFLD, Nonalcoholic fatty liver disease) 치료를 위한 신약 후보 물질을 개발하는 데 성공했다. 현재까지 최적의 비알코올성 지방간염(NASH) 치료제가 없는 상황에서 지방간 축적과 간 섬유화를 동시에 억제하면서 안전성이 증명된 치료제 개발이 기대된다.
광주과학기술원(GIST)은 화학과 안진희 교수 연구팀과 우리 대학 의과학대학원 김하일 교수 연구팀이 다년간 기초연구를 통해 질환 특이 단백질(HTR2A)을 억제할 수 있는 신규 화합물을 개발했으며, 안진희 교수의 창업기업인 ㈜제이디바이오사이언스에서 전임상 시험(동물 시험)을 통해 효능과 안전성을 입증하는 데 성공했다고 밝혔다.
비알코올성 지방간 질환의 유병율은 20~30%에 이르고, 지방간염 질환은 전 세계 성인 인구의 5% 이상이 보유하고 있을 정도로 높은 유병률을 보임에도 불구하고 현재까지 제품화된 치료제가 전혀 없다.
비알코올성 지방간질환은 지방간에서 시작해 지방간염, 섬유화, 간경화, 간암으로 진행되는 만성질환이며, 심혈관질환 및 간 관련 합병증 등에 의해 사망률이 증가하므로 발병 초기에 적절한 치료가 필요하다.
GIST와 KAIST 공동 연구팀이 개발한 이 신규 화합물은 지방간염에 치료 효과를 보이는 혁신신약 후보 물질로서, 세로토닌 수용체 단백질(5HT2A)을 억제함으로써 간 내 지방 축적과 간 섬유화를 동시에 억제하는 이중 작용 기전을 갖고 있다.
연구팀은 이 물질이 지방간 동물 및 지방간염 동물 모델에서 간 내 지방 축적으로 발생하는 간 지방증과 간 섬유화*를 동시에 50~70% 가량 억제함으로써 치료 효과가 있는 것을 확인하였다.
* 섬유화(fibrosis): 간의 일부가 굳는 현상으로, 지방간염 개선의 주요 지표로 쓰임
이 물질은 혈액-뇌 장벽(Blood-Brain Barrier) 투과도가 최소화되도록 최적의 극성과 지질친화도를 갖춘 화합물로 설계되어 뇌에 영향을 주지 않아 우울증, 자살 충동 등 중추신경계(CNS) 부작용이 적으며, 뇌 이외의 조직에서는 질환 타겟에 대한 억제력이 우수(IC50*=14 nM)하다고 연구팀은 설명했다. 또한 임상 3상 단계의 경쟁 약물과 효능을 비교해 본 결과, 간섬유화 개선 효능이 월등히 우수한 것으로 나타났다.
* IC50(half maximal inhibitory concentration): 특정 생물학적 또는 생화학적 기능을 50% 억제하는 물질의 농도
전임상 시험에 의해 얻은 약리작용 데이터를 토대로 건강한 사람에게서 부작용 및 안전한 약물 용량을 확인하는 단계인 임상 1상 시험에서 건강한 성인 총 88명을 대상으로 평가한 결과, 심각한 부작용은 발생하지 않았으며 안전성 또한 양호한 것으로 확인했다.
또한 지방간염 소견을 보이는 성인 8명을 대상으로 한 예비 효능 평가는 현재 진행 중이다.
안진희 교수는 “이번 연구는 비알콜성 지방간염의 치료를 위한 새로운 타겟 발굴을 통해 부작용이 적고 안전성이 보장된 치료제 개발을 목적으로, 현재 혁신신약 개발 바이오 벤처인 ㈜제이디바이오사이언스를 통해 호주에서 글로벌 임상 1상을 진행 중”이라고 밝혔다.
안 교수는 또한 “연구팀이 개발하고 있는 신약 후보물질은 안전성이 높으면서 간 지방축적을 억제시키는 예방효과뿐만 아니라 간 섬유화에 직접적인 치료 효과를 보인다는 강점이 있어 다른 경쟁 약물과는 차별화된다”고 설명했다.
우리 대학 김하일 교수는 “현재까지 체중을 조절하는 방법 외에는 치료방법이 없는 이 질환에서 비만하지 않은 환자에게 사용할 수 있는 약은 개발이 시도된 적도 없다”면서 “이번 연구를 계기로 체중에 영향을 주지 않으면서 비알코올성 지방간염을 포함한 다양한 대사질환 치료기술의 개발이 가능해질 것으로 기대한다”고 말했다.
GIST 안진희 교수 연구팀과 KAIST 김하일 교수 연구팀, ㈜제이디바이오사이언스(JD BIOSCIENCE) 연구팀이 함께 수행한 이번 연구는 과학기술정보통신부, 국가신약개발사업에서 지원을 받아 수행됐으며, 국제 학술지인 ‘네이처 커뮤니케이션즈(Nature Communications)’에 2024년 1월 20일 게재됐다.
또한 지난 4일부터 3일간 미국 유타에서 개최된 ‘NASH 치료제 전문 콘퍼런스(NASH-TAG Conference 2024)’에서 대사이상 관련 지방간염(MASH)* 치료제 후보물질인 ‘GM-60106(개발코드명)’의 임상 연구 결과를 발표해 우수 초록으로 선정되기도 했다.
* 대사이상 관련 지방간염(MASH): 비알코올성 지방간염(NASH)의 새로운 명칭
2024.01.30 조회수 9362 -
 기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 6282
기억하고 인지하는 과정을 실시간 관찰하다
우리 뇌 속에는 약 860억 개의 신경세포와 신경세포 간의 신호를 주고받아 우리의 인지, 감정, 기억 등과 같은 다양한 뇌 기능을 조절하도록 돕는 600조 개에 달하는 시냅스가 존재한다. 흥미롭게도 노화나 알츠하이머병과 같은 질병 상황에서 시냅스는 감소하는 것으로 알려져, 시냅스에 관한 연구가 주목받고 있지만 아직 시냅스의 구조 변화를 실시간으로 관찰하는 데에는 한계가 있다.
우리 대학 생명과학과 허원도 교수 연구팀이 세계 최초로 시냅스의 형성과 소멸 및 변화를 실시간으로 관찰할 수 있는 기술 개발에 성공했다고 9일 밝혔다.
허원도 교수 연구팀은 형광 단백질(dimerization-dependent fluorescent protein, ddFP)을 시냅스와 결합시켜 신경세포 간의 시냅스 연결 과정을 실시간으로 관찰할 수 있는 기술을 개발했다. 이 기술을 시냅스(Synapse)와 스냅샷 (Snapshot)을 조합한 시냅샷(SynapShot)이라고 이름 지었고 기존에는 구현하기 어려웠던 시냅스 형성과 소멸 그리고 역동적인 변화 과정을 실시간으로 추적하고 관찰하는데 성공했다.
허원도 교수 연구팀은 초록과 빨강 형광을 띠는 시냅샷을 디자인해 두 개의 서로 다른 신경세포와 연결된 시냅스를 쉽게 구별하여 관찰할 수 있었다. 또한, 빛으로 분자의 기능을 조절할 수 있는 광유전학 기술과 융합하여 신경세포의 특정 기능을 빛으로 조절함과 동시에 시냅스의 변화를 관찰하는 데 성공했다.
허원도 교수 연구팀이 개발한 시냅샷은 미국 존스홉킨스 의대 권형배 교수 연구팀과 공동연구를 통해 살아있는 생쥐에게 시각적 구별 훈련, 운동 및 마취 등 여러 상황을 유도하고 각 과정에서 시냅스의 변화를 실시간으로 관찰해 각각의 시냅스가 상당히 빠르고 역동적으로 변화될 수 있음을 보였다. 이는 살아있는 포유류의 시냅스 변화를 세계 최초로 관찰한 것이다.
교신저자 허원도 교수는 “우리 연구팀이 국내외 연구팀과 공동연구를 통해 시냅샷 기술로 과거에는 구현하기 어려웠던 시냅스의 빠르고 역동적인 형성과 변화를 직접 관찰할 수 있는 가능성을 열었으며, 이 기술은 뇌과학 연구분야의 연구방법론에 혁신을 가져올 것으로 예상되며 뇌 과학의 미래를 밝히는 중요한 역할을 할 것으로 기대된다”고 말했다.
생명과학과 손승규(박사과정), 이진수(박사과정), 존스홉킨스 의과대학 정강훈 박사가 공동 제1 저자로 수행한 이번 연구는 저명 국제 학술지 ‘네이처 메쏘드(Nature Methods)’2024년 2월호 인쇄판에 게재될 예정이며, 2024년 1월 8일자로 온라인판에 게재됐다. (논문명: Real-time visualization of structural dynamics of synapses in live cells in vivo). (Impact Factor: 47.99). (DOI: 10.1038/s41592-023-02122-4)
한편, 이번 연구는 KAIST 중견연구자지원사업, KAIST 글로벌 특이점 사업의 지원을 받아 수행됐다.
2024.01.09 조회수 6282