-
 헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
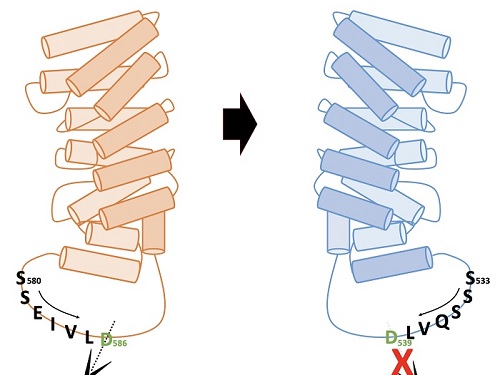
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02
조회수 8822
-
 뇌 모방 스핀 소자 핵심기술 개발
우리 대학 물리학과 김갑진 교수와 신소재공학과 박병국 교수 공동연구팀이 뇌 모방 소자로 개발 중인 스핀토크발진기 주파수 대역을 증대시킬 핵심 기술을 개발했다고 18일 밝혔다.
두 연구팀은 비자성체/강자성체/산화물 3중층 구조의 자기발진소자에 게이트 전압을 인가하여 GHz 수준의 발진주파수 조절에 성공하였다. 이는 기존 기술보다 약 10배 이상 향상된 결과로 스핀토크 기반 뉴로모픽 소자가 가진 학습 효과의 휘발성, 좁은 주파수 대역 등의 문제를 해결할 핵심 기술로 제안되었다.
본 소자는 게이트 전압이 영구적으로 수직자기이방성을 변화시켜 소자에 전류가 흐르지 않아도 학습 내용이 저장되어 있는 비휘발성 특성을 가지고 있으며 그 폭이 GHz 수준으로 넓어 뉴로모픽 소자 활용성을 증대시켜줄 것으로 기대된다.
신소재공학과 최종국 박사과정과 물리학과 박재현 박사가 공동 제1저자로 참여하고, KAIST 신소재공학과 강민구 연구원, 고려대학교 이재성 교수와 김도윤 연구원, KAIST 물리학과 이경진 교수가 공동저자로 참여한 본 논문은 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 6월 30일 온라인 게재됐다. (논문명 : Voltage-driven gigahertz frequency tuning of spin Hall nano-oscillators)
기존의 스핀토크발진기 기반 뉴로모픽 소자는 학습 대상을 주파수 대역에 대응시켜 학습하는 소자로, 전류가 흐르지 않으면 학습 내용이 사라지는 휘발성과 200MHz 이내의 제한적인 학습 가능 대역폭을 가지고 있어 이에 대한 개선이 필요한 상황이다.
이번 연구에서 연구팀은 게이트 전압 인가가 소자의 수직자기이방성을 영구적으로 조절하고 이를 통해 자기공명주파수가 조절된다는 사실을 이용하여 기존 보고의 10배 이상인 2.1 GHz 이상의 광대역 조절 가능한 발진기를 실현하였다. 본 기술은 스핀-홀 나노 발진기 기반 뉴로모픽 소자 개발에 핵심 기술로 활용될 것이라 기대된다.
한편 이번 연구는 KAIST 글로벌 특이점 연구사업, 삼성미래기술육성사업, 한국연구재단 선도연구센터/중견연구자지원사업의 지원을 받아 수행됐다.
뇌 모방 스핀 소자 핵심기술 개발
우리 대학 물리학과 김갑진 교수와 신소재공학과 박병국 교수 공동연구팀이 뇌 모방 소자로 개발 중인 스핀토크발진기 주파수 대역을 증대시킬 핵심 기술을 개발했다고 18일 밝혔다.
두 연구팀은 비자성체/강자성체/산화물 3중층 구조의 자기발진소자에 게이트 전압을 인가하여 GHz 수준의 발진주파수 조절에 성공하였다. 이는 기존 기술보다 약 10배 이상 향상된 결과로 스핀토크 기반 뉴로모픽 소자가 가진 학습 효과의 휘발성, 좁은 주파수 대역 등의 문제를 해결할 핵심 기술로 제안되었다.
본 소자는 게이트 전압이 영구적으로 수직자기이방성을 변화시켜 소자에 전류가 흐르지 않아도 학습 내용이 저장되어 있는 비휘발성 특성을 가지고 있으며 그 폭이 GHz 수준으로 넓어 뉴로모픽 소자 활용성을 증대시켜줄 것으로 기대된다.
신소재공학과 최종국 박사과정과 물리학과 박재현 박사가 공동 제1저자로 참여하고, KAIST 신소재공학과 강민구 연구원, 고려대학교 이재성 교수와 김도윤 연구원, KAIST 물리학과 이경진 교수가 공동저자로 참여한 본 논문은 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 6월 30일 온라인 게재됐다. (논문명 : Voltage-driven gigahertz frequency tuning of spin Hall nano-oscillators)
기존의 스핀토크발진기 기반 뉴로모픽 소자는 학습 대상을 주파수 대역에 대응시켜 학습하는 소자로, 전류가 흐르지 않으면 학습 내용이 사라지는 휘발성과 200MHz 이내의 제한적인 학습 가능 대역폭을 가지고 있어 이에 대한 개선이 필요한 상황이다.
이번 연구에서 연구팀은 게이트 전압 인가가 소자의 수직자기이방성을 영구적으로 조절하고 이를 통해 자기공명주파수가 조절된다는 사실을 이용하여 기존 보고의 10배 이상인 2.1 GHz 이상의 광대역 조절 가능한 발진기를 실현하였다. 본 기술은 스핀-홀 나노 발진기 기반 뉴로모픽 소자 개발에 핵심 기술로 활용될 것이라 기대된다.
한편 이번 연구는 KAIST 글로벌 특이점 연구사업, 삼성미래기술육성사업, 한국연구재단 선도연구센터/중견연구자지원사업의 지원을 받아 수행됐다.
2022.07.29
조회수 10405
-
 대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19
조회수 12287
-
 기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
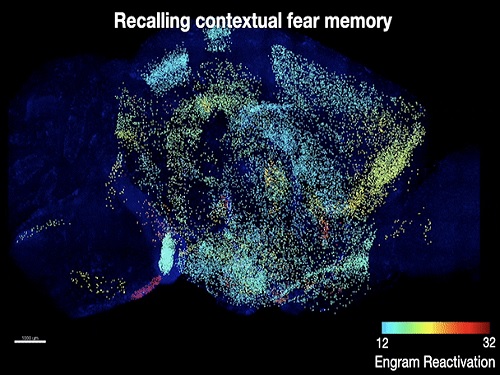
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
2022.06.02
조회수 8970
-
 생각만으로 정확하게 로봇팔 조종이 가능한 뇌-기계 인터페이스 개발
우리 대학 바이오및뇌공학과 정재승 교수 연구팀이 3차원 공간상에서 생각만으로 로봇팔을 높은 정확도 (90.9~92.6%)로 조종하는 `뇌-기계 인터페이스 시스템'을 개발했다고 23일 밝혔다.
정 교수 연구팀은 인공지능과 유전자 알고리즘을 사용해 인간의 대뇌 심부에서 측정한 뇌파만으로 팔 움직임의 의도를 파악해 로봇팔을 제어하는 새로운 형태의 뇌-기계 인터페이스 시스템을 개발했다. 뇌 활동만으로 사람의 의도를 파악해 로봇이나 기계가 대신 행동에 옮기는 `뇌-기계 인터페이스' 기술은 최근 급속도로 발전하고 있다. 하지만 손을 움직이는 정도의 의도 파악을 넘어, 팔 움직임의 방향에 대한 의도를 섬세하게 파악해 정교하게 로봇팔을 움직이는 기술은 아직 정확도가 높지 않았다.
하지만 연구팀은 이번 연구에서 조종 `방향'에 대한 의도를 뇌 활동만으로 인식하는 인공지능 모델을 개발했고, 그 결과 3차원 공간상에서 24개의 방향을 90% 이상의 정확도로 정교하게 해석하는 시스템을 개발했다.
게다가 딥러닝 등 기존 기계학습 기술은 높은 사양의 GPU 하드웨어가 필요했지만, 이번 연구에서는 축적 컴퓨팅(Reservoir Computing) 기법을 이용해 낮은 사양의 하드웨어에서도 인공지능 학습이 가능하여 스마트 모바일 기기에서도 폭넓게 응용될 수 있도록 개발해, 향후 메타버스와 스마트 기기에도 폭넓게 적용이 가능할 것으로 기대된다.
우리 대학 김훈희 박사(現 강남대 조교수)가 제1 저자로 참여한 이번 연구는 국제학술지 `어플라이드 소프트 컴퓨팅(Applied Soft Computing)' 2022년 117권 3월호에 출판됐다. (논문명 : An electrocorticographic decoder for arm movement for brain-machine interface using an echo state network and Gaussian readout).
뇌-기계 인터페이스는 사용자의 뇌 활동을 통해 의도를 읽고 로봇이나 기계에 전달하는 기술로서 로봇, 드론, 컴퓨터뿐만 아니라 스마트 모바일 기기, 메타버스 등에서의 이용될 차세대 인터페이스 기술로 각광받고 있다.
특히 기존의 인터페이스가 외부 신체 기관을 통해 명령을 간접 전달(버튼, 터치, 제스처 등)해야 하지만 뇌-기계 인터페이스는 명령을 뇌로부터 직접적 전달한다는 점에서 가장 진보된 인터페이스 기술로 여겨진다.
그러나 뇌파는 개개인의 차이가 매우 크고, 단일 신경 세포로부터 정확한 신호를 읽는 것이 아니라 넓은 영역에 있는 신경 세포 집단의 전기적 신호 특성을 해석해야 하므로 잡음이 크다는 한계점을 가지고 있다.
연구팀은 이러한 문제 해결을 위해 최첨단 인공지능 기법의 하나인 `축적 컴퓨팅 기법'을 이용해 뇌-기계 인터페이스에서 필요한 개개인의 뇌파 신호의 중요 특성을 인공신경망이 자동으로 학습해 찾을 수 있도록 구현했다.
또한 유전자 알고리즘(Genetic Algorithm)을 이용해 인공지능 신경망이 최적의 뇌파 특성을 효율적으로 찾을 수 있게 시스템을 설계했다. 연구팀은 심부 뇌파를 최종 해석하는 리드아웃(Readout)을 가우시안(Gaussian) 모델로 설계해 시각피질 신경 세포가 방향을 표현하는 방법을 모방하는 인공신경망을 개발했다. 이런 리드아웃 방식은 축적 컴퓨팅의 선형 학습 알고리즘을 이용해 일반적 사양의 간단한 하드웨어에서도 빠르게 학습할 수 있어 메타버스, 스마트기기 등 일상생활에서 응용이 가능해진다.
특히, 이번 연구에서 만들어진 뇌-기계 인터페이스 인공지능 모델은 3차원상에서 24가지 방향 즉, 각 차원에서 8가지 방향을 디코딩할 수 있으며 모든 방향에서 평균 90% 이상의 정확도 (90.9%~92.6% 범위)를 보였다. 또한 연구된 뇌-기계 인터페이스는 3차원 공간상에서 로봇팔을 움직이는 상상을 할 때의 뇌파를 해석해 성공적으로 로봇팔을 움직이는 시뮬레이션 결과를 보였다.
인공지능 시스템을 만든 제1 저자인 김훈희 박사는 "공학적인 신호처리 기법에 의존해 온 기존 뇌파 디코딩 방법과는 달리, 인간 뇌의 실제 작동 구조를 모방한 인공신경망을 개발해 좀더 발전된 형태의 뇌-기계 인터페이스 시스템을 개발해 기쁘다ˮ면서 "향후 뇌의 특성을 좀 더 구체적으로 이용한 `뇌 모방 인공지능(Brain-inspired A.I.)'을 이용한 다양한 뇌-기계 인터페이스를 개발할 계획이다ˮ라고 말했다.
이번 연구를 주도한 연구책임자 정재승 교수는 "뇌파를 통해 생각만으로 로봇팔을 구동하는 `뇌-기계 인터페이스 시스템'들이 대부분 고사양 하드웨어가 필요해 실시간 응용으로 나아가기 어렵고 스마트기기 등으로 적용이 어려웠다. 그러나 이번 시스템은 90%~92%의 높은 정확도를 가진 의도 인식 인공지능 시스템을 만들어 메타버스 안에서 아바타를 생각대로 움직이게 하거나 앱을 생각만으로 컨트롤하는 스마트기기 등에 광범위하게 사용될 수 있다ˮ고 말했다.
이번 연구 결과는 사지마비 환자나 사고로 팔을 잃은 환자들을 위한 로봇팔 장착 및 제어 기술부터, 메타버스, 스마트기기, 게임, 엔터테인먼트 애플리케이션 등 다양한 시스템에 뇌-기계 인터페이스를 적용할 가능성을 열어 줄 것으로 기대된다.
이번 연구는 한국연구재단 뇌 원천기술개발사업의 지원을 받아 수행됐다.
생각만으로 정확하게 로봇팔 조종이 가능한 뇌-기계 인터페이스 개발
우리 대학 바이오및뇌공학과 정재승 교수 연구팀이 3차원 공간상에서 생각만으로 로봇팔을 높은 정확도 (90.9~92.6%)로 조종하는 `뇌-기계 인터페이스 시스템'을 개발했다고 23일 밝혔다.
정 교수 연구팀은 인공지능과 유전자 알고리즘을 사용해 인간의 대뇌 심부에서 측정한 뇌파만으로 팔 움직임의 의도를 파악해 로봇팔을 제어하는 새로운 형태의 뇌-기계 인터페이스 시스템을 개발했다. 뇌 활동만으로 사람의 의도를 파악해 로봇이나 기계가 대신 행동에 옮기는 `뇌-기계 인터페이스' 기술은 최근 급속도로 발전하고 있다. 하지만 손을 움직이는 정도의 의도 파악을 넘어, 팔 움직임의 방향에 대한 의도를 섬세하게 파악해 정교하게 로봇팔을 움직이는 기술은 아직 정확도가 높지 않았다.
하지만 연구팀은 이번 연구에서 조종 `방향'에 대한 의도를 뇌 활동만으로 인식하는 인공지능 모델을 개발했고, 그 결과 3차원 공간상에서 24개의 방향을 90% 이상의 정확도로 정교하게 해석하는 시스템을 개발했다.
게다가 딥러닝 등 기존 기계학습 기술은 높은 사양의 GPU 하드웨어가 필요했지만, 이번 연구에서는 축적 컴퓨팅(Reservoir Computing) 기법을 이용해 낮은 사양의 하드웨어에서도 인공지능 학습이 가능하여 스마트 모바일 기기에서도 폭넓게 응용될 수 있도록 개발해, 향후 메타버스와 스마트 기기에도 폭넓게 적용이 가능할 것으로 기대된다.
우리 대학 김훈희 박사(現 강남대 조교수)가 제1 저자로 참여한 이번 연구는 국제학술지 `어플라이드 소프트 컴퓨팅(Applied Soft Computing)' 2022년 117권 3월호에 출판됐다. (논문명 : An electrocorticographic decoder for arm movement for brain-machine interface using an echo state network and Gaussian readout).
뇌-기계 인터페이스는 사용자의 뇌 활동을 통해 의도를 읽고 로봇이나 기계에 전달하는 기술로서 로봇, 드론, 컴퓨터뿐만 아니라 스마트 모바일 기기, 메타버스 등에서의 이용될 차세대 인터페이스 기술로 각광받고 있다.
특히 기존의 인터페이스가 외부 신체 기관을 통해 명령을 간접 전달(버튼, 터치, 제스처 등)해야 하지만 뇌-기계 인터페이스는 명령을 뇌로부터 직접적 전달한다는 점에서 가장 진보된 인터페이스 기술로 여겨진다.
그러나 뇌파는 개개인의 차이가 매우 크고, 단일 신경 세포로부터 정확한 신호를 읽는 것이 아니라 넓은 영역에 있는 신경 세포 집단의 전기적 신호 특성을 해석해야 하므로 잡음이 크다는 한계점을 가지고 있다.
연구팀은 이러한 문제 해결을 위해 최첨단 인공지능 기법의 하나인 `축적 컴퓨팅 기법'을 이용해 뇌-기계 인터페이스에서 필요한 개개인의 뇌파 신호의 중요 특성을 인공신경망이 자동으로 학습해 찾을 수 있도록 구현했다.
또한 유전자 알고리즘(Genetic Algorithm)을 이용해 인공지능 신경망이 최적의 뇌파 특성을 효율적으로 찾을 수 있게 시스템을 설계했다. 연구팀은 심부 뇌파를 최종 해석하는 리드아웃(Readout)을 가우시안(Gaussian) 모델로 설계해 시각피질 신경 세포가 방향을 표현하는 방법을 모방하는 인공신경망을 개발했다. 이런 리드아웃 방식은 축적 컴퓨팅의 선형 학습 알고리즘을 이용해 일반적 사양의 간단한 하드웨어에서도 빠르게 학습할 수 있어 메타버스, 스마트기기 등 일상생활에서 응용이 가능해진다.
특히, 이번 연구에서 만들어진 뇌-기계 인터페이스 인공지능 모델은 3차원상에서 24가지 방향 즉, 각 차원에서 8가지 방향을 디코딩할 수 있으며 모든 방향에서 평균 90% 이상의 정확도 (90.9%~92.6% 범위)를 보였다. 또한 연구된 뇌-기계 인터페이스는 3차원 공간상에서 로봇팔을 움직이는 상상을 할 때의 뇌파를 해석해 성공적으로 로봇팔을 움직이는 시뮬레이션 결과를 보였다.
인공지능 시스템을 만든 제1 저자인 김훈희 박사는 "공학적인 신호처리 기법에 의존해 온 기존 뇌파 디코딩 방법과는 달리, 인간 뇌의 실제 작동 구조를 모방한 인공신경망을 개발해 좀더 발전된 형태의 뇌-기계 인터페이스 시스템을 개발해 기쁘다ˮ면서 "향후 뇌의 특성을 좀 더 구체적으로 이용한 `뇌 모방 인공지능(Brain-inspired A.I.)'을 이용한 다양한 뇌-기계 인터페이스를 개발할 계획이다ˮ라고 말했다.
이번 연구를 주도한 연구책임자 정재승 교수는 "뇌파를 통해 생각만으로 로봇팔을 구동하는 `뇌-기계 인터페이스 시스템'들이 대부분 고사양 하드웨어가 필요해 실시간 응용으로 나아가기 어렵고 스마트기기 등으로 적용이 어려웠다. 그러나 이번 시스템은 90%~92%의 높은 정확도를 가진 의도 인식 인공지능 시스템을 만들어 메타버스 안에서 아바타를 생각대로 움직이게 하거나 앱을 생각만으로 컨트롤하는 스마트기기 등에 광범위하게 사용될 수 있다ˮ고 말했다.
이번 연구 결과는 사지마비 환자나 사고로 팔을 잃은 환자들을 위한 로봇팔 장착 및 제어 기술부터, 메타버스, 스마트기기, 게임, 엔터테인먼트 애플리케이션 등 다양한 시스템에 뇌-기계 인터페이스를 적용할 가능성을 열어 줄 것으로 기대된다.
이번 연구는 한국연구재단 뇌 원천기술개발사업의 지원을 받아 수행됐다.
2022.02.24
조회수 15907
-
 인공지능의 오랜 난제를 뇌 기반 인공지능으로 풀다
우리 대학 바이오및뇌공학과 이상완 교수(신경과학 인공지능 융합연구센터장) 연구팀이 뇌 기반 인공지능 기술을 이용해 인공지능의 난제 중 하나인 과적합-과소적합 상충 문제를 해결하는 원리를 풀어내는 데 성공했다고 5일 밝혔다.
이상완 교수와 김동재 박사(現 뉴욕대학교 박사후 연구원)가 주도하고 우리 대학 정재승 교수가 참여한 이번 연구는 `강화학습 중 편향-분산 상충 문제에 대한 전두엽의 해법'이라는 제목으로 국제 학술지 셀(Cell)의 오픈 액세스 저널인 `셀 리포트(Cell Reports)'에 지난해 12월 28일 字 온라인판에 게재됐다. (논문명: Prefrontal solution to the bias-variance tradeoff during reinforcement learning)
최근 인공지능 모델들은 다양한 실제 문제들에 대해 최적의 해법을 제시하지만, 상황 변화에 유동적으로 대응하는 부분에 있어서는 여전히 어려움을 겪고 있다. 기계학습에서는 이를 과소적합-과적합의 위험성 (underfitting-overfitting risk) 또는 편향-분산 상충 문제(bias-variance tradeoff)라 하며 오랫동안 연구됐지만, 실제 세계와 같이 상충 조건이 계속 변하는 상황에서의 명확한 해법은 아직 제안된 바가 없다.
반면 인간은 현재 주어진 문제에 집중하면서도(과소적합 문제 해결), 당면 문제에 과하게 집착하지 않고(과적합 문제 해결) 변하는 상황에 맞게 유동적으로 대처한다. 연구팀은 뇌 데이터, 확률과정 추론 모형, 강화학습 알고리즘을 이용해 인간의 뇌가 이 문제를 어떻게 해결하는지에 대한 이론적 틀을 마련하고 이로부터 유동적인 메타 강화학습 모델을 도출해냈다.
놀랍게도 인간의 뇌는 중뇌 도파민 회로와 전두엽에서 처리되는 `예측 오차'의 하한선(prediction error lower bound)이라는 단 한 가지 정보를 이용해 이 문제를 해결한다. 우리의 전두엽, 특히 복외측전전두피질은 현재 내가 사용하고 있는 문제 해결 방식으로 주어진 문제를 얼마나 잘 풀 수 있을지에 대한 기대치의 한계를 추정하고(예: `이렇게 풀면 90점까지는 받을 수 있어'), 변화하는 상황에 맞춰 최적인 문제 해결전략을 유동적으로 선택하는 과정 (예: `이렇게 풀면 기껏해야 70점이니 다르게 풀어보자')을 통해 과소적합-과적합의 위험을 최소화하게 된다.
이상완 교수 연구팀은 2014년 해당 전두엽 영역이 환경의 불확실성을 바탕으로 강화학습전략을 유동적으로 조절하는 데 관여한다는 사실을 처음 발견했고(`뉴런(Neuron)' 학술지에 발표), 2015년에는 인과관계 추론 과정에도 관여한다는 사실을 발견했다(`PLOS Biology' 학술지에 발표). 이어 2019년에는 해당 뇌 영역이 문제의 복잡도까지 고려할 수 있다는 사실을 발견했다(`네이처 커뮤니케이션즈(Nature Communications)' 학술지에 발표).
이러한 일련의 연구 결과들은 자신의 학습 및 추론 능력을 스스로 평가하는 인간의 메타 인지 능력을 보여주는 증거로, 이 능력을 바탕으로 인공지능이 풀기 어려워하는 현실 세계의 다양한 상충적 상황들을 풀어낼 수 있다는 `전두엽 메타 학습 이론'을 정립한 바 있다(`사이언스 로보틱스(Science Robotics)' 학술지에 발표). 이번 연구는 이 이론에 기반해 인공지능의 오랜 난제 중 하나인 과소적합-과적합 상충 문제를 실제로 풀어낸 최초의 사례로 평가된다.
연구를 통해 개발된 메타 강화학습 모델을 이용하면 간단한 게임을 통해 인간의 유동적 문제 해결 능력을 간접적으로 측정할 수 있다. 더 나아가 스마트 교육이나 중독과 관련된 인지 행동치료에 적용할 경우 상황 변화에 유동적으로 대처하는 인간의 문제 해결 능력 자체를 향상할 수 있을 것으로 기대된다. 차세대 인공지능, 스마트 교육, 인지 행동치료 등 다양한 분야에 파급력이 큰 원천 기술로 최근 국내 및 해외 특허 출원이 완료된 상태다.
연구를 주도한 제1 저자 김동재 박사는 "인간 지능의 특장점에 대한 이해가 얼마나 중요한지 보여주는 연구 중 하나ˮ라고 말했다. 연구 책임자인 이상완 교수는 "인공지능이 우리보다 잘 푸는 문제가 많지만, 반대로 인공지능으로 풀기 어려운 문제들이 우리에게는 정말 쉽게 느껴지는 경우들이 많다. 인간의 다양한 고위 수준 능력을 인공지능 이론 관점에서 형식화하는 연구를 통해 인간 지능의 비밀을 하나씩 풀어나갈 수 있을 것으로 기대된다ˮ라며 "이러한 뇌 기반 인공지능 연구는 인간의 지능을 공학적으로 탐구하는 과정으로 볼 수 있으며, 인간과 인공지능이 서로 도우며 함께 성장해 나갈 수 있는 명확한 기준점을 마련할 수 있을 것ˮ이라고 말했다. 이상완 교수는 뇌 기반 인공지능 연구의 독창성과 도전성을 인정받아 구글 교수 연구상과 IBM 학술상을 받은 바 있다.
연구팀은 과학기술정보통신부의 재원으로 정보통신기획평가원의 지원을 받아 설립한 KAIST 신경과학-인공지능 융합연구센터에서 기반 기술을 활용해 인간 지능을 모사한 차세대 인공지능 모델을 개발하고, 아울러 딥마인드, IBM 인공지능 연구소, MIT, 옥스퍼드 대학 등 국제 공동연구 협약 기관과 공동연구를 통해 기술의 파급력을 높여나갈 계획이라고 말했다.
한편 이번 연구는 삼성전자 미래기술육성센터, 과학기술정보통신부 정보통신기획평가원 및 한국연구재단의 지원을 받아 수행됐다.
인공지능의 오랜 난제를 뇌 기반 인공지능으로 풀다
우리 대학 바이오및뇌공학과 이상완 교수(신경과학 인공지능 융합연구센터장) 연구팀이 뇌 기반 인공지능 기술을 이용해 인공지능의 난제 중 하나인 과적합-과소적합 상충 문제를 해결하는 원리를 풀어내는 데 성공했다고 5일 밝혔다.
이상완 교수와 김동재 박사(現 뉴욕대학교 박사후 연구원)가 주도하고 우리 대학 정재승 교수가 참여한 이번 연구는 `강화학습 중 편향-분산 상충 문제에 대한 전두엽의 해법'이라는 제목으로 국제 학술지 셀(Cell)의 오픈 액세스 저널인 `셀 리포트(Cell Reports)'에 지난해 12월 28일 字 온라인판에 게재됐다. (논문명: Prefrontal solution to the bias-variance tradeoff during reinforcement learning)
최근 인공지능 모델들은 다양한 실제 문제들에 대해 최적의 해법을 제시하지만, 상황 변화에 유동적으로 대응하는 부분에 있어서는 여전히 어려움을 겪고 있다. 기계학습에서는 이를 과소적합-과적합의 위험성 (underfitting-overfitting risk) 또는 편향-분산 상충 문제(bias-variance tradeoff)라 하며 오랫동안 연구됐지만, 실제 세계와 같이 상충 조건이 계속 변하는 상황에서의 명확한 해법은 아직 제안된 바가 없다.
반면 인간은 현재 주어진 문제에 집중하면서도(과소적합 문제 해결), 당면 문제에 과하게 집착하지 않고(과적합 문제 해결) 변하는 상황에 맞게 유동적으로 대처한다. 연구팀은 뇌 데이터, 확률과정 추론 모형, 강화학습 알고리즘을 이용해 인간의 뇌가 이 문제를 어떻게 해결하는지에 대한 이론적 틀을 마련하고 이로부터 유동적인 메타 강화학습 모델을 도출해냈다.
놀랍게도 인간의 뇌는 중뇌 도파민 회로와 전두엽에서 처리되는 `예측 오차'의 하한선(prediction error lower bound)이라는 단 한 가지 정보를 이용해 이 문제를 해결한다. 우리의 전두엽, 특히 복외측전전두피질은 현재 내가 사용하고 있는 문제 해결 방식으로 주어진 문제를 얼마나 잘 풀 수 있을지에 대한 기대치의 한계를 추정하고(예: `이렇게 풀면 90점까지는 받을 수 있어'), 변화하는 상황에 맞춰 최적인 문제 해결전략을 유동적으로 선택하는 과정 (예: `이렇게 풀면 기껏해야 70점이니 다르게 풀어보자')을 통해 과소적합-과적합의 위험을 최소화하게 된다.
이상완 교수 연구팀은 2014년 해당 전두엽 영역이 환경의 불확실성을 바탕으로 강화학습전략을 유동적으로 조절하는 데 관여한다는 사실을 처음 발견했고(`뉴런(Neuron)' 학술지에 발표), 2015년에는 인과관계 추론 과정에도 관여한다는 사실을 발견했다(`PLOS Biology' 학술지에 발표). 이어 2019년에는 해당 뇌 영역이 문제의 복잡도까지 고려할 수 있다는 사실을 발견했다(`네이처 커뮤니케이션즈(Nature Communications)' 학술지에 발표).
이러한 일련의 연구 결과들은 자신의 학습 및 추론 능력을 스스로 평가하는 인간의 메타 인지 능력을 보여주는 증거로, 이 능력을 바탕으로 인공지능이 풀기 어려워하는 현실 세계의 다양한 상충적 상황들을 풀어낼 수 있다는 `전두엽 메타 학습 이론'을 정립한 바 있다(`사이언스 로보틱스(Science Robotics)' 학술지에 발표). 이번 연구는 이 이론에 기반해 인공지능의 오랜 난제 중 하나인 과소적합-과적합 상충 문제를 실제로 풀어낸 최초의 사례로 평가된다.
연구를 통해 개발된 메타 강화학습 모델을 이용하면 간단한 게임을 통해 인간의 유동적 문제 해결 능력을 간접적으로 측정할 수 있다. 더 나아가 스마트 교육이나 중독과 관련된 인지 행동치료에 적용할 경우 상황 변화에 유동적으로 대처하는 인간의 문제 해결 능력 자체를 향상할 수 있을 것으로 기대된다. 차세대 인공지능, 스마트 교육, 인지 행동치료 등 다양한 분야에 파급력이 큰 원천 기술로 최근 국내 및 해외 특허 출원이 완료된 상태다.
연구를 주도한 제1 저자 김동재 박사는 "인간 지능의 특장점에 대한 이해가 얼마나 중요한지 보여주는 연구 중 하나ˮ라고 말했다. 연구 책임자인 이상완 교수는 "인공지능이 우리보다 잘 푸는 문제가 많지만, 반대로 인공지능으로 풀기 어려운 문제들이 우리에게는 정말 쉽게 느껴지는 경우들이 많다. 인간의 다양한 고위 수준 능력을 인공지능 이론 관점에서 형식화하는 연구를 통해 인간 지능의 비밀을 하나씩 풀어나갈 수 있을 것으로 기대된다ˮ라며 "이러한 뇌 기반 인공지능 연구는 인간의 지능을 공학적으로 탐구하는 과정으로 볼 수 있으며, 인간과 인공지능이 서로 도우며 함께 성장해 나갈 수 있는 명확한 기준점을 마련할 수 있을 것ˮ이라고 말했다. 이상완 교수는 뇌 기반 인공지능 연구의 독창성과 도전성을 인정받아 구글 교수 연구상과 IBM 학술상을 받은 바 있다.
연구팀은 과학기술정보통신부의 재원으로 정보통신기획평가원의 지원을 받아 설립한 KAIST 신경과학-인공지능 융합연구센터에서 기반 기술을 활용해 인간 지능을 모사한 차세대 인공지능 모델을 개발하고, 아울러 딥마인드, IBM 인공지능 연구소, MIT, 옥스퍼드 대학 등 국제 공동연구 협약 기관과 공동연구를 통해 기술의 파급력을 높여나갈 계획이라고 말했다.
한편 이번 연구는 삼성전자 미래기술육성센터, 과학기술정보통신부 정보통신기획평가원 및 한국연구재단의 지원을 받아 수행됐다.
2022.01.05
조회수 11928
-
 학습 없이 자발적으로 발생하는 뇌 인지기능 원리 밝혀
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 학습을 전혀 거치지 않은 뇌 신경망에서 선천적인 인지 기능이 발생하는 원리를 규명했다고 30일 밝혔다.
이번 연구 결과는 동물들이 출생 직후 학습을 거치지 않은 상태에서도 기초적 인지 기능들을 수행할 수 있게 하는 `선천적 뇌 기능'에 대한 이해에 다가가는 기초를 마련했으며 `초기 뇌 신경망 인지 기능의 발생'에 대해 기존의 상식과 완전히 다른 시각을 제시한다.
또한 연구팀의 결과는 일반적인 인공지능 모델에서 기능을 발생시키기 위해서는 외부의 데이터 학습이 반드시 요구되는 것과 달리, 생물학적 뇌 신경망의 기능 발생과 진화는 확률적으로 생성되는 물리적 연결 구조에 의해 자발적으로 발생할 수 있다는 차별된 기저 원리를 제안한다.
연구팀은 인지과학 분야에서 활발히 연구돼 온 얼굴 인지 기능(face detection)에 초점을 두어 뇌의 시각 신경망을 모사한 인공신경망에서의 사물 인지 기능을 시뮬레이션했다. 이를 통해 모든 연결 가중치가 무작위로 정해지도록 초기화된 심층신경망이 전혀 학습을 거치지 않은 상태에서도 얼굴 이미지를 다른 사물 이미지와 구별할 수 있음을 발견했다.
연구팀은 이러한 무작위화 신경망에서 발생하는 얼굴 선택성 (face-selectivity)이 실제 동물 실험에서 관측되는 다양한 생물학적, 인지 행동적 특성들과 매우 유사한 양상을 보이는 것을 확인했다. 이는 이론적 모델 기반의 본 연구 결과가 충분한 생물학적 타당성을 가지며, 향후 뇌 신경망에서 나타나는 선천적 인지 기능의 핵심적 발생 원리를 설명하는 일반적인 이론으로 확장될 수 있음을 시사한다.
우리 대학 바이오및뇌공학과 백승대, 송민 박사과정이 공동 제 1저자로 참여한 이번 연구는 국제 학술지 `네이처 (Nature)'의 자매지 `네이처 커뮤니케이션스 (Nature Communications)' 12월 16일 字에 게재됐다. (논문명 : Face Detection in Untrained Deep Neural Networks)
인지 지능의 최초 발생에 관한 연구는 뇌신경과학, 인지과학과 인공지능 분야 모두에서 중요한 주제다. 특히, 별다른 학습 과정 없이 출생 직후부터 다양한 인지 기능을 수행할 수 있게 하는 뇌의 `선천적' 인지 기능은 데이터 입력을 통한 학습에 의존하는 인공신경망의 기능과 뚜렷이 구별되며, 이에 대한 이해는 생물학적 지능의 발생과 진화의 원리를 밝히는 데 결정적인 역할을 할 것으로 기대됐다.
또한 얼굴 인지 기능은 사회적 행동을 하는 다양한 동물 종의 어린 개체들에서 관측되며, 이 기능의 발생을 위해 외부 정보의 학습이 필수적인지는 학계에서 활발하게 논의돼왔다.
연구팀은 앞서 진행했던 연구를 토대로 구축한 신경망 기능 발생 이론에 기반해, 아무런 학습을 거치지 않은 계층적 신경망의 초기 피드 포워드 연결 구조를 통해 얼굴 인지 기능이 자발적으로 형성될 수 있을 것이라 가정했다. 이를 확인하기 위해 수행한 심층신경망 시뮬레이션에서 얼굴 이미지를 비롯한 단순 사물의 인식 기능은 학습을 전혀 거치지 않은 초기 무작위화 신경망에서 자발적으로 발생할 수 있음을 확인했다.
이러한 결과는 학습이 이루어지기 전, 신경망의 초기 구조가 갖춰진 시점에 이미 다양한 인지 기능이 발생할 수 있음을 보여주며, 뇌 과학의 오랜 화두인 지능 형성의 선천성 또는 후천성(nature vs. nurture) 논의와 관련해 자발적으로 발생하는 선천적 기능 발생에 대한 이해의 중요성을 강조한다.
백세범 교수는 "이번 연구는 뇌신경과학 연구의 가장 근본적인 질문 중 하나인 선천적인 인지 기능의 발생을 설명할 수 있는 최초의 이론을 제시해 생물학적 지능의 발생과 진화의 원리를 이해하는데 결정적인 단서를 제공할 것으로 기대된다ˮ며 "한편으로 데이터 학습 기반 인공지능 구현의 방법과 완전히 다른 관점의 생물학적 지능 구현 원리를 정립해 현재의 인공지능 개발의 상식과 완전히 다른 시각을 제공할 수 있을 것으로 기대된다ˮ고 언급했다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST 특이점교수 사업의 지원을 받아 수행됐다.
학습 없이 자발적으로 발생하는 뇌 인지기능 원리 밝혀
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 학습을 전혀 거치지 않은 뇌 신경망에서 선천적인 인지 기능이 발생하는 원리를 규명했다고 30일 밝혔다.
이번 연구 결과는 동물들이 출생 직후 학습을 거치지 않은 상태에서도 기초적 인지 기능들을 수행할 수 있게 하는 `선천적 뇌 기능'에 대한 이해에 다가가는 기초를 마련했으며 `초기 뇌 신경망 인지 기능의 발생'에 대해 기존의 상식과 완전히 다른 시각을 제시한다.
또한 연구팀의 결과는 일반적인 인공지능 모델에서 기능을 발생시키기 위해서는 외부의 데이터 학습이 반드시 요구되는 것과 달리, 생물학적 뇌 신경망의 기능 발생과 진화는 확률적으로 생성되는 물리적 연결 구조에 의해 자발적으로 발생할 수 있다는 차별된 기저 원리를 제안한다.
연구팀은 인지과학 분야에서 활발히 연구돼 온 얼굴 인지 기능(face detection)에 초점을 두어 뇌의 시각 신경망을 모사한 인공신경망에서의 사물 인지 기능을 시뮬레이션했다. 이를 통해 모든 연결 가중치가 무작위로 정해지도록 초기화된 심층신경망이 전혀 학습을 거치지 않은 상태에서도 얼굴 이미지를 다른 사물 이미지와 구별할 수 있음을 발견했다.
연구팀은 이러한 무작위화 신경망에서 발생하는 얼굴 선택성 (face-selectivity)이 실제 동물 실험에서 관측되는 다양한 생물학적, 인지 행동적 특성들과 매우 유사한 양상을 보이는 것을 확인했다. 이는 이론적 모델 기반의 본 연구 결과가 충분한 생물학적 타당성을 가지며, 향후 뇌 신경망에서 나타나는 선천적 인지 기능의 핵심적 발생 원리를 설명하는 일반적인 이론으로 확장될 수 있음을 시사한다.
우리 대학 바이오및뇌공학과 백승대, 송민 박사과정이 공동 제 1저자로 참여한 이번 연구는 국제 학술지 `네이처 (Nature)'의 자매지 `네이처 커뮤니케이션스 (Nature Communications)' 12월 16일 字에 게재됐다. (논문명 : Face Detection in Untrained Deep Neural Networks)
인지 지능의 최초 발생에 관한 연구는 뇌신경과학, 인지과학과 인공지능 분야 모두에서 중요한 주제다. 특히, 별다른 학습 과정 없이 출생 직후부터 다양한 인지 기능을 수행할 수 있게 하는 뇌의 `선천적' 인지 기능은 데이터 입력을 통한 학습에 의존하는 인공신경망의 기능과 뚜렷이 구별되며, 이에 대한 이해는 생물학적 지능의 발생과 진화의 원리를 밝히는 데 결정적인 역할을 할 것으로 기대됐다.
또한 얼굴 인지 기능은 사회적 행동을 하는 다양한 동물 종의 어린 개체들에서 관측되며, 이 기능의 발생을 위해 외부 정보의 학습이 필수적인지는 학계에서 활발하게 논의돼왔다.
연구팀은 앞서 진행했던 연구를 토대로 구축한 신경망 기능 발생 이론에 기반해, 아무런 학습을 거치지 않은 계층적 신경망의 초기 피드 포워드 연결 구조를 통해 얼굴 인지 기능이 자발적으로 형성될 수 있을 것이라 가정했다. 이를 확인하기 위해 수행한 심층신경망 시뮬레이션에서 얼굴 이미지를 비롯한 단순 사물의 인식 기능은 학습을 전혀 거치지 않은 초기 무작위화 신경망에서 자발적으로 발생할 수 있음을 확인했다.
이러한 결과는 학습이 이루어지기 전, 신경망의 초기 구조가 갖춰진 시점에 이미 다양한 인지 기능이 발생할 수 있음을 보여주며, 뇌 과학의 오랜 화두인 지능 형성의 선천성 또는 후천성(nature vs. nurture) 논의와 관련해 자발적으로 발생하는 선천적 기능 발생에 대한 이해의 중요성을 강조한다.
백세범 교수는 "이번 연구는 뇌신경과학 연구의 가장 근본적인 질문 중 하나인 선천적인 인지 기능의 발생을 설명할 수 있는 최초의 이론을 제시해 생물학적 지능의 발생과 진화의 원리를 이해하는데 결정적인 단서를 제공할 것으로 기대된다ˮ며 "한편으로 데이터 학습 기반 인공지능 구현의 방법과 완전히 다른 관점의 생물학적 지능 구현 원리를 정립해 현재의 인공지능 개발의 상식과 완전히 다른 시각을 제공할 수 있을 것으로 기대된다ˮ고 언급했다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST 특이점교수 사업의 지원을 받아 수행됐다.
2021.12.31
조회수 10593
-
 아동의 다언어 사용이 뇌 전체 연결망 향상에 미치는 영향 확인
우리 대학 바이오및뇌공학과 정용 교수 연구팀이 미국 예일대학교(Yale University) 심리학과 마빈 천(Marvin M. Chun) 교수 연구팀과 공동연구를 통해 아동기의 외국어 구사 여부가 인지능력을 향상하고 뇌 연결망에 변화를 가져온다고 10일 밝혔다.
연구팀은 미국 국립 보건원(National Institutes of Health, NIH)의 청소년 뇌 인지 발달 연구(the Adolescent Brain Cognitive Development, ABCD Study) 데이터를 사용해 발달단계에 있는 9-10세 아이들의 인지기능 점수와 기능적 자기공명영상(functional magnetic resonance imaging, fMRI)을 분석했다. 모국어 외 다른 언어를 추가로 사용하는 아이들은 모국어만 사용하는 아이들에 비해 기억을 측정하는 인지 과제에서 높은 점수를 보였다. 또한 다언어 사용은 아이들의 뇌 전체 연결망에도 영향을 주는 것으로 확인됐다.
바이오및뇌공학과 권영혜 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `미국국립과학원회보(Proceedings of the National Academy of Sciences of the United States of America, PNAS)' 11월 118권 49호에 출판됐다. (논문명 : Predicting multilingual effects on executive function and individual connectomes in children: an ABCD Study).
뇌는 과제를 수행할 뿐만 아니라 쉬고 있을 때도 특정 영역들이 활성화된다. 기능적 자기공명영상(fMRI)을 통해 활성화되는 각 영역을 관찰할 수 있고, 이 영역들이 서로 어떻게 연결이 돼 있는지 기능적 뇌 연결망(functional connectivity)을 계산할 수 있다.
뇌 모든 영역 간의 연결 패턴을 나타내는 뇌 전체 연결망(whole-brain functional connectivity, connectome)은 사람마다 다르고, 그 사람의 나이, 지능, 인지기능 등 그 사람만의 고유한 특성을 내포하고 있다고 알려져 최근 뇌 과학 분야에서 활발히 연구되고 있다.
연구팀은 뇌의 특정 영역에 국한하지 않고 뇌 전체의 연결망에 초점을 맞춰, 여러 언어를 하는 아이들과 하나의 언어만 사용하는 아이들이 서로 다른 뇌 전체 연결망을 가지는 것을 관찰했다. 기억 관련 과제를 수행할 때 다언어 사용 아이들은 단일언어 사용 아이들에 비해 뇌 후두엽(occipital lobe)과 피질하 영역(subcortical area)간 강한 연결망을 보였다. 아이들이 아무 과제를 수행하지 않는 휴지기(resting state)에도 두 그룹 간 차이가 관찰됐는데, 다언어 사용 아이들에게서 뇌 후두엽과 전전두엽(prefrontal cortex)간 강한 연결성을 보였다.
더 나아가 연구팀은 기계학습을 통해 아이들이 기억 관련 과제를 수행할 때와 휴지기일 때 나타나는 뇌 전체 연결망만으로 그 아이가 여러 언어를 사용하는지 한 언어를 사용하는지를 성공적으로 예측할 수 있었다. 또한 다언어 사용 아이들이 기억 관련 과제를 수행할 때 관찰되는 기억 관련 연결망만으로 그 아이들이 해당 과제에서 어떤 점수를 얻었는지 예측할 수 있었다. 단일 언어사용 아이들에게서는 이러한 현상이 발견되지 않았는데, 이는 다언어 사용 아이들의 뇌 전체 연결망이 그들의 행동과 더 밀접한 관계를 맺고 있다는 것을 시사한다.
연구팀은 이번 연구를 통해 발달단계에 있는 9-10세 아이들의 다언어 사용 여부가 뇌 전체 연결망에 변화를 주는 것을 확인했다. 이 연구를 바탕으로 다언어 사용의 영향이 발달단계를 거치며 성인이 될 때까지 어떻게 변화하는지 이해하는 데 도움이 될 것으로 기대한다. 더 나아가 다언어 사용은 알츠하이머와 같은 퇴행성 뇌질환에 동반되는 인지기능 저하를 방어하는 뇌인지 예비능(cognitive reserve)을 가져오는데, 이 현상을 연구하는 데 도움이 될 것으로 기대된다.
제1 저자인 권영혜 박사과정은 "성인보다 언어사용 기간이 짧은 9-10세 아이들에게서도 여러 언어의 사용이 인지기능과 뇌 연결 패턴에 영향을 주는 것을 확인하였다ˮ 라며 "어렸을 때부터 형성된 이러한 차이가 시간이 흐르면서 어떠한 형태로 자리 잡아 성인이 되었을 때 그리고 노인이 되어서까지 영향을 주는지를 이해하는 데 도움이 되길 바란다ˮ 라고 말했다.
이번 연구는 한국연구재단, 산업통상자원부, 미국 국립 보건원 지원을 받아 수행됐다.
아동의 다언어 사용이 뇌 전체 연결망 향상에 미치는 영향 확인
우리 대학 바이오및뇌공학과 정용 교수 연구팀이 미국 예일대학교(Yale University) 심리학과 마빈 천(Marvin M. Chun) 교수 연구팀과 공동연구를 통해 아동기의 외국어 구사 여부가 인지능력을 향상하고 뇌 연결망에 변화를 가져온다고 10일 밝혔다.
연구팀은 미국 국립 보건원(National Institutes of Health, NIH)의 청소년 뇌 인지 발달 연구(the Adolescent Brain Cognitive Development, ABCD Study) 데이터를 사용해 발달단계에 있는 9-10세 아이들의 인지기능 점수와 기능적 자기공명영상(functional magnetic resonance imaging, fMRI)을 분석했다. 모국어 외 다른 언어를 추가로 사용하는 아이들은 모국어만 사용하는 아이들에 비해 기억을 측정하는 인지 과제에서 높은 점수를 보였다. 또한 다언어 사용은 아이들의 뇌 전체 연결망에도 영향을 주는 것으로 확인됐다.
바이오및뇌공학과 권영혜 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `미국국립과학원회보(Proceedings of the National Academy of Sciences of the United States of America, PNAS)' 11월 118권 49호에 출판됐다. (논문명 : Predicting multilingual effects on executive function and individual connectomes in children: an ABCD Study).
뇌는 과제를 수행할 뿐만 아니라 쉬고 있을 때도 특정 영역들이 활성화된다. 기능적 자기공명영상(fMRI)을 통해 활성화되는 각 영역을 관찰할 수 있고, 이 영역들이 서로 어떻게 연결이 돼 있는지 기능적 뇌 연결망(functional connectivity)을 계산할 수 있다.
뇌 모든 영역 간의 연결 패턴을 나타내는 뇌 전체 연결망(whole-brain functional connectivity, connectome)은 사람마다 다르고, 그 사람의 나이, 지능, 인지기능 등 그 사람만의 고유한 특성을 내포하고 있다고 알려져 최근 뇌 과학 분야에서 활발히 연구되고 있다.
연구팀은 뇌의 특정 영역에 국한하지 않고 뇌 전체의 연결망에 초점을 맞춰, 여러 언어를 하는 아이들과 하나의 언어만 사용하는 아이들이 서로 다른 뇌 전체 연결망을 가지는 것을 관찰했다. 기억 관련 과제를 수행할 때 다언어 사용 아이들은 단일언어 사용 아이들에 비해 뇌 후두엽(occipital lobe)과 피질하 영역(subcortical area)간 강한 연결망을 보였다. 아이들이 아무 과제를 수행하지 않는 휴지기(resting state)에도 두 그룹 간 차이가 관찰됐는데, 다언어 사용 아이들에게서 뇌 후두엽과 전전두엽(prefrontal cortex)간 강한 연결성을 보였다.
더 나아가 연구팀은 기계학습을 통해 아이들이 기억 관련 과제를 수행할 때와 휴지기일 때 나타나는 뇌 전체 연결망만으로 그 아이가 여러 언어를 사용하는지 한 언어를 사용하는지를 성공적으로 예측할 수 있었다. 또한 다언어 사용 아이들이 기억 관련 과제를 수행할 때 관찰되는 기억 관련 연결망만으로 그 아이들이 해당 과제에서 어떤 점수를 얻었는지 예측할 수 있었다. 단일 언어사용 아이들에게서는 이러한 현상이 발견되지 않았는데, 이는 다언어 사용 아이들의 뇌 전체 연결망이 그들의 행동과 더 밀접한 관계를 맺고 있다는 것을 시사한다.
연구팀은 이번 연구를 통해 발달단계에 있는 9-10세 아이들의 다언어 사용 여부가 뇌 전체 연결망에 변화를 주는 것을 확인했다. 이 연구를 바탕으로 다언어 사용의 영향이 발달단계를 거치며 성인이 될 때까지 어떻게 변화하는지 이해하는 데 도움이 될 것으로 기대한다. 더 나아가 다언어 사용은 알츠하이머와 같은 퇴행성 뇌질환에 동반되는 인지기능 저하를 방어하는 뇌인지 예비능(cognitive reserve)을 가져오는데, 이 현상을 연구하는 데 도움이 될 것으로 기대된다.
제1 저자인 권영혜 박사과정은 "성인보다 언어사용 기간이 짧은 9-10세 아이들에게서도 여러 언어의 사용이 인지기능과 뇌 연결 패턴에 영향을 주는 것을 확인하였다ˮ 라며 "어렸을 때부터 형성된 이러한 차이가 시간이 흐르면서 어떠한 형태로 자리 잡아 성인이 되었을 때 그리고 노인이 되어서까지 영향을 주는지를 이해하는 데 도움이 되길 바란다ˮ 라고 말했다.
이번 연구는 한국연구재단, 산업통상자원부, 미국 국립 보건원 지원을 받아 수행됐다.
2021.12.10
조회수 11656
-
 사물인터넷 기반 다수의 뇌 신경회로 동시 원격제어 시스템 개발
우리 연구진이 인터넷을 이용해 뇌 신경회로를 원격 제어할 수 있는 무선 네트워크 기술을 개발했다. 이 기술을 활용하면 시간과 장소에 구애받지 않고 목표 동물의 뇌 신경회로를 정교하게 제어할 수 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 미국 워싱턴 대학교(Washington University in St. Louis), 미국 콜로라도 대학교(University of Colorado Boulder) 연구팀과의 공동 연구를 통해 사물인터넷 기반의 뇌 신경회로 원격제어 시스템을 개발했다고 8일 밝혔다.
이번 개발 기술은 많은 시간과 인력이 있어야 하는 뇌 연구 및 다양한 신경과학 연구를 자동화시켜 다양한 퇴행성 뇌 질환과 정신질환의 발병 기전 규명과 치료법 개발의 가속화에 크게 기여할 것으로 기대된다. 또한, 먼 거리에 있는 환자의 질환을 원격으로 치료하는 원격 의료 구현에도 활용될 수 있을 것으로 예상된다.
우리 대학 전기및전자공학부 라자 콰지(Raza Qazi) 연구원과 김충연 박사과정, 그리고 워싱턴대 카일 파커(Kyle E. Parker) 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)' 11월 25일 字에 게재됐다. (논문명 : Scalable and modular wireless-network infrastructure for large-scale behavioural neuroscience)
전 세계적으로 고령화 시대에 접어드는 현 상황에서 알츠하이머병, 파킨슨병과 같은 뇌 질환들로 고통받는 환자 수가 급증하고 있다. 이에 따라 근본적인 뇌 질환 치료법을 개발하기 위해 뇌 기능 및 뇌 질환 발병기전을 규명하기 위한 뇌 연구가 매우 시급하지만, 뇌 연구의 진행 속도가 뇌 질환 환자의 증가 속도를 따라잡지 못하고 있어서 뇌 연구의 효율성을 극대화하기 위한 새로운 기술 개발이 절실히 요구된다.
기존 뇌 연구에 사용되던 대부분의 신경과학 장치들은 외부 장비와 선으로 연결된 유선 방식으로 구동됐지만, 이러한 방식은 피실험 동물들을 물리적으로 제약할 뿐 아니라 실험 진행자의 직접적인 개입이 불가피해 피실험 동물의 행동에 영향을 주는 `관찰자 효과'를 발생시켜서 정확한 뇌 연구 결과 도출을 어렵게 만든다. 아울러 모든 과정에서 실험자의 직접적인 조작이 요구돼 연구에 많은 시간과 인력, 비용이 발생하게 한다.
연구팀은 사물인터넷(Internet of Things; IoT) 기술을 접목해 다양한 다수의 뇌 이식용 기기들을 인터넷 원격으로 동시 제어하거나 예약된 스케줄에 따라 기기들이 자동으로 구동되도록 하는 무선 네트워크 시스템을 개발했다. 이를 통해 시간과 장소에 상관없이 목표 동물들의 특정 뇌 회로를 원격 제어하는 것을 가능하게 했다. 이 시스템은 사용자가 인터넷 웹사이트 기반의 무선 네트워크 플랫폼을 통해 뇌 이식용 장치의 원격제어, 자동화된 데이터 수집, 뇌 회로 제어 스케줄링 등의 다양한 기능을 손쉽게 구현할 수 있도록 설계됐다.
연구팀은 이 시스템의 뇌 신경회로 자동 원격제어 기능을 사용해 자체 제작한 무선 장치(뉴럴 임플란트)가 이식된 수십 마리의 쥐의 뇌 신경회로를 광유전학적 방법으로 사람의 개입 없이 정교하게 원격 자동 제어함으로써, 완전 자동화된 뇌 연구 실험에 적용 가능함을 입증했다. 이 실험을 통해 쥐의 먹이 섭취량, 활동량, 그리고 다른 쥐들과의 사회적 상호작용 빈도를 성공적으로 조절함으로써, 예약이 설정된 대로 다수 동물의 뇌 신경회로를 동시에 독립적으로 원격 제어할 수 있음을 보였다.
정 교수는 "개발된 원격제어 기술은 동물을 활용한 뇌 연구에 필요한 인간개입을 최소화함으로써 뇌 연구의 효율을 높이고 실험의 불확실성을 크게 줄일 수 있을 것ˮ이라며 "이 기술은 뇌 연구를 넘어, 많은 동물 실험을 필요로 하는 신약 개발, 병원 방문 없이 뇌 질환 및 다양한 질병을 치료하기 위한 원격 의료 구현에도 적용될 수 있을 것이다ˮ라고 말했다.
연구팀은 이 기술이 더욱 광범위하게 뇌 과학 연구 및 치료에 사용될 수 있게 하도록, 인공지능 기반의 실시간 뇌파 원격 모니터링 기술을 개발해 본 시스템과 접목하기 위한 연구를 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 연구사업, 한국연구재단이 추진하는 중견연구자지원사업 및 바이오의료기술개발사업, 미국 국립보건원의 지원을 받아 수행됐다.
사물인터넷 기반 다수의 뇌 신경회로 동시 원격제어 시스템 개발
우리 연구진이 인터넷을 이용해 뇌 신경회로를 원격 제어할 수 있는 무선 네트워크 기술을 개발했다. 이 기술을 활용하면 시간과 장소에 구애받지 않고 목표 동물의 뇌 신경회로를 정교하게 제어할 수 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 미국 워싱턴 대학교(Washington University in St. Louis), 미국 콜로라도 대학교(University of Colorado Boulder) 연구팀과의 공동 연구를 통해 사물인터넷 기반의 뇌 신경회로 원격제어 시스템을 개발했다고 8일 밝혔다.
이번 개발 기술은 많은 시간과 인력이 있어야 하는 뇌 연구 및 다양한 신경과학 연구를 자동화시켜 다양한 퇴행성 뇌 질환과 정신질환의 발병 기전 규명과 치료법 개발의 가속화에 크게 기여할 것으로 기대된다. 또한, 먼 거리에 있는 환자의 질환을 원격으로 치료하는 원격 의료 구현에도 활용될 수 있을 것으로 예상된다.
우리 대학 전기및전자공학부 라자 콰지(Raza Qazi) 연구원과 김충연 박사과정, 그리고 워싱턴대 카일 파커(Kyle E. Parker) 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)' 11월 25일 字에 게재됐다. (논문명 : Scalable and modular wireless-network infrastructure for large-scale behavioural neuroscience)
전 세계적으로 고령화 시대에 접어드는 현 상황에서 알츠하이머병, 파킨슨병과 같은 뇌 질환들로 고통받는 환자 수가 급증하고 있다. 이에 따라 근본적인 뇌 질환 치료법을 개발하기 위해 뇌 기능 및 뇌 질환 발병기전을 규명하기 위한 뇌 연구가 매우 시급하지만, 뇌 연구의 진행 속도가 뇌 질환 환자의 증가 속도를 따라잡지 못하고 있어서 뇌 연구의 효율성을 극대화하기 위한 새로운 기술 개발이 절실히 요구된다.
기존 뇌 연구에 사용되던 대부분의 신경과학 장치들은 외부 장비와 선으로 연결된 유선 방식으로 구동됐지만, 이러한 방식은 피실험 동물들을 물리적으로 제약할 뿐 아니라 실험 진행자의 직접적인 개입이 불가피해 피실험 동물의 행동에 영향을 주는 `관찰자 효과'를 발생시켜서 정확한 뇌 연구 결과 도출을 어렵게 만든다. 아울러 모든 과정에서 실험자의 직접적인 조작이 요구돼 연구에 많은 시간과 인력, 비용이 발생하게 한다.
연구팀은 사물인터넷(Internet of Things; IoT) 기술을 접목해 다양한 다수의 뇌 이식용 기기들을 인터넷 원격으로 동시 제어하거나 예약된 스케줄에 따라 기기들이 자동으로 구동되도록 하는 무선 네트워크 시스템을 개발했다. 이를 통해 시간과 장소에 상관없이 목표 동물들의 특정 뇌 회로를 원격 제어하는 것을 가능하게 했다. 이 시스템은 사용자가 인터넷 웹사이트 기반의 무선 네트워크 플랫폼을 통해 뇌 이식용 장치의 원격제어, 자동화된 데이터 수집, 뇌 회로 제어 스케줄링 등의 다양한 기능을 손쉽게 구현할 수 있도록 설계됐다.
연구팀은 이 시스템의 뇌 신경회로 자동 원격제어 기능을 사용해 자체 제작한 무선 장치(뉴럴 임플란트)가 이식된 수십 마리의 쥐의 뇌 신경회로를 광유전학적 방법으로 사람의 개입 없이 정교하게 원격 자동 제어함으로써, 완전 자동화된 뇌 연구 실험에 적용 가능함을 입증했다. 이 실험을 통해 쥐의 먹이 섭취량, 활동량, 그리고 다른 쥐들과의 사회적 상호작용 빈도를 성공적으로 조절함으로써, 예약이 설정된 대로 다수 동물의 뇌 신경회로를 동시에 독립적으로 원격 제어할 수 있음을 보였다.
정 교수는 "개발된 원격제어 기술은 동물을 활용한 뇌 연구에 필요한 인간개입을 최소화함으로써 뇌 연구의 효율을 높이고 실험의 불확실성을 크게 줄일 수 있을 것ˮ이라며 "이 기술은 뇌 연구를 넘어, 많은 동물 실험을 필요로 하는 신약 개발, 병원 방문 없이 뇌 질환 및 다양한 질병을 치료하기 위한 원격 의료 구현에도 적용될 수 있을 것이다ˮ라고 말했다.
연구팀은 이 기술이 더욱 광범위하게 뇌 과학 연구 및 치료에 사용될 수 있게 하도록, 인공지능 기반의 실시간 뇌파 원격 모니터링 기술을 개발해 본 시스템과 접목하기 위한 연구를 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 연구사업, 한국연구재단이 추진하는 중견연구자지원사업 및 바이오의료기술개발사업, 미국 국립보건원의 지원을 받아 수행됐다.
2021.12.08
조회수 12481
-
 빛으로 뇌 기능, 행동, 감정을 자유롭게 조절한다
우리 대학 생명과학과 허원도 교수 연구팀은 빛으로 뇌 기능 및 행동을 자유자재로 조절하는 광유전학 기술인 ‘Opto-vTrap(옵토-브이트랩)’을 개발했다. 나아가 동물실험을 통해 뇌 활성 뿐 아니라 활동과 감정까지 조절할 수 있음을 확인했다.
뇌 활성은 신경세포와 신경교세포와 같은 뇌세포들이 서로 신호를 주고받으며 조절된다. 이 같은 상호작용은 뇌 세포 내 ‘소낭’안에 담긴 신경전달물질 분비를 통해 이루어진다. 소낭이 뇌 활성을 조절하는 사령관인 셈이다. 뇌 활성 조절은 뇌 연구를 위한 필수 기술이다. 뇌의 특정 부위나 세포의 활성을 촉진 및 억제해보면 특정 뇌 부위가 담당하는 기능, 여러 뇌 부위 간 상호작용의 역할, 특정 상황에서 다양한 뇌세포의 기능 등 특정 상황에서 뇌 작동이 어떠한 원리로 일어나는지 밝힐 수 있기 때문이다.
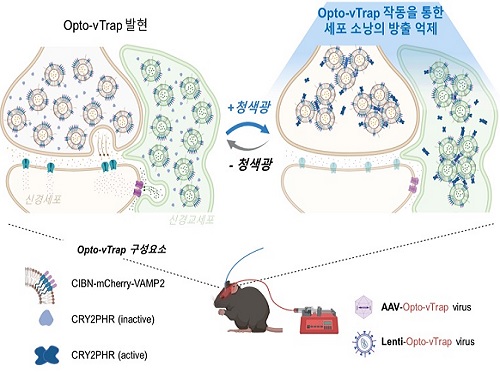
그러나 기존 뇌 활성 조절 기술은 원하는 시점에 특정 뇌세포의 활성을 자유롭게 조절하기 어려웠다. 지금까지는 세포 전위차 조절 방식을 사용하였는데, 이는 주변 환경의 산성도를 변화시키거나 원하지 않는 다른 자극을 유발할 뿐만 아니라 전위차에 반응하지 않는 세포에는 사용하지 못하는 한계가 있었다. 이번에 개발한 Opto-vTrap 기술은 세포 소낭을 직접 특이적으로 조절할 수 있어 원하는 시점에 다양한 종류의 뇌세포에서 이용이 가능하다.
연구진은 신경전달물질 분비를 직접 조절하고자 세포에 빛을 쪼이면 순간적으로 내부에 올가미처럼 트랩을 만드는 자체 개발 원천기술을 응용, 소낭에 적용했다. Opto-vTrap을 발현하는 세포나 조직에 빛(청색광)을 가하면 소낭 내 광수용체 단백질들이 엉겨 붙으며 소낭이 트랩 안에 포획되고 신경전달물질 분비가 억제된다. 요컨대 Opto-vTrap으로 소낭의 신호전달물질 분비를 직접 제어하여 뇌 활성을 자유롭게 조절하는 것이다. 연구진은 세포와 조직실험에서 나아가 Opto-vTrap 바이러스를 이용한 동물실험을 통해 뇌세포 신호전달 뿐만 아니라 기억·감정·행동도 조절 가능함을 확인하였다.
Opto-vTrap을 이용하면 뇌의 여러 부위간 복합적 상호작용 원리를 밝히고, 뇌세포 형태별 뇌 기능에 미치는 영향을 연구하는 데 유용하게 활용될 것으로 기대된다.
허원도 교수는 “Opto-vTrap은 신경세포와 신경교세포 모두에 잘 작동되기에 향후 다양한 뇌과학 연구 분야에 이용되리라 기대한다” 며 “앞으로 본 기술을 활용하여 특정 뇌세포의 시공간적 기능 연구를 진행하고자 한다.”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 중견연구과제 및 KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
이번 연구 결과는 뇌 과학 학술지 뉴런 (Neuron, IF:17.173) 에 12월 1일(수) 1시(한국시간) 게재됐다.
빛으로 뇌 기능, 행동, 감정을 자유롭게 조절한다
우리 대학 생명과학과 허원도 교수 연구팀은 빛으로 뇌 기능 및 행동을 자유자재로 조절하는 광유전학 기술인 ‘Opto-vTrap(옵토-브이트랩)’을 개발했다. 나아가 동물실험을 통해 뇌 활성 뿐 아니라 활동과 감정까지 조절할 수 있음을 확인했다.
뇌 활성은 신경세포와 신경교세포와 같은 뇌세포들이 서로 신호를 주고받으며 조절된다. 이 같은 상호작용은 뇌 세포 내 ‘소낭’안에 담긴 신경전달물질 분비를 통해 이루어진다. 소낭이 뇌 활성을 조절하는 사령관인 셈이다. 뇌 활성 조절은 뇌 연구를 위한 필수 기술이다. 뇌의 특정 부위나 세포의 활성을 촉진 및 억제해보면 특정 뇌 부위가 담당하는 기능, 여러 뇌 부위 간 상호작용의 역할, 특정 상황에서 다양한 뇌세포의 기능 등 특정 상황에서 뇌 작동이 어떠한 원리로 일어나는지 밝힐 수 있기 때문이다.
그러나 기존 뇌 활성 조절 기술은 원하는 시점에 특정 뇌세포의 활성을 자유롭게 조절하기 어려웠다. 지금까지는 세포 전위차 조절 방식을 사용하였는데, 이는 주변 환경의 산성도를 변화시키거나 원하지 않는 다른 자극을 유발할 뿐만 아니라 전위차에 반응하지 않는 세포에는 사용하지 못하는 한계가 있었다. 이번에 개발한 Opto-vTrap 기술은 세포 소낭을 직접 특이적으로 조절할 수 있어 원하는 시점에 다양한 종류의 뇌세포에서 이용이 가능하다.
연구진은 신경전달물질 분비를 직접 조절하고자 세포에 빛을 쪼이면 순간적으로 내부에 올가미처럼 트랩을 만드는 자체 개발 원천기술을 응용, 소낭에 적용했다. Opto-vTrap을 발현하는 세포나 조직에 빛(청색광)을 가하면 소낭 내 광수용체 단백질들이 엉겨 붙으며 소낭이 트랩 안에 포획되고 신경전달물질 분비가 억제된다. 요컨대 Opto-vTrap으로 소낭의 신호전달물질 분비를 직접 제어하여 뇌 활성을 자유롭게 조절하는 것이다. 연구진은 세포와 조직실험에서 나아가 Opto-vTrap 바이러스를 이용한 동물실험을 통해 뇌세포 신호전달 뿐만 아니라 기억·감정·행동도 조절 가능함을 확인하였다.
Opto-vTrap을 이용하면 뇌의 여러 부위간 복합적 상호작용 원리를 밝히고, 뇌세포 형태별 뇌 기능에 미치는 영향을 연구하는 데 유용하게 활용될 것으로 기대된다.
허원도 교수는 “Opto-vTrap은 신경세포와 신경교세포 모두에 잘 작동되기에 향후 다양한 뇌과학 연구 분야에 이용되리라 기대한다” 며 “앞으로 본 기술을 활용하여 특정 뇌세포의 시공간적 기능 연구를 진행하고자 한다.”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 중견연구과제 및 KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
이번 연구 결과는 뇌 과학 학술지 뉴런 (Neuron, IF:17.173) 에 12월 1일(수) 1시(한국시간) 게재됐다.
2021.12.03
조회수 10171
-
 하이드로젤 기반 유연성 뇌-기계 인터페이스 개발
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 메사추세츠 공과대학(MIT) 폴리나 아니키바(Polina Anikeeva) 교수, 쏸허 자오(Xuanhe Zhao) 교수, 육현우 박사 공동 연구팀과 함께 *하이드로젤 기반의 유연성 뇌-기계 인터페이스를 개발하는 데 성공했다고 21일 밝혔다.
☞ 하이드로젤: 물과 젤리가 합쳐진 합성어이며 주로 필러, 보톡스, 화장품에 쓰이는 반고체 상태의 물질이다. 인공적인 인체 조직을 만드는 원료로 적합해 의학적으로도 널리 쓰인다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 2021년 6월 8일 字로 출판됐다. (논문명: Adaptive and multifunctional hydrogel hybrid probes for long-term sensing and modulation of neural activity)
뇌 구조를 연구하거나 뇌 신경 질환의 메커니즘을 파악, 치료하기 위해서는, 실시간으로 뇌를 자극하고 신호를 측정할 수 있는 인터페이스의 개발이 필수적이다. 그러나 기존의 신경 인터페이스는 기계적, 화학적 특성이 뇌 조직과 너무 달라서 일어나는 이물 반응(foreign body response) 때문에, 주변에 절연세포층이 형성돼 그 수명이 매우 짧아진다는 문제점을 가지고 있었다.
연구팀은 해당 문제의 해결을 위해, 직접 제작한 다기능성 파이버 다발을 하이드로젤 몸체에 넣는 방법을 이용해 `뇌 모사형 신경 인터페이스'를 제작했다. 해당 장치는 빛으로 특정 신경세포종만을 자극할 수 있는 광유전학 기술을 적용하기 위한 광섬유뿐만 아니라, 뇌에서 신호를 읽을 수 있는 전극 다발, 약물을 뇌 속으로 전달할 수 있는 미세 유체 채널을 모두 보유하고 있다.
해당 인터페이스는 하이드로젤 몸체를 건조시킨 상태에서는 단단한 성질이 고분자와 유사해 몸체에 삽입하기가 쉽다. 하지만 몸에 들어가면 체내의 수분을 빠르게 흡수해. 부드럽고 수분이 풍부한 주변 조직과 유사한 상태가 되므로 이물 반응을 최소화할 수 있다.
연구팀은 이러한 특성을 가진 장치를 동물 모델에 직접 적용해, 기존의 기록을 훨씬 뛰어넘는 삽입 후 6개월까지도 뇌 신호를 측정할 수 있음을 보였다. 또한 자유롭게 움직이는 쥐를 대상으로 초장기간 광유전학 실험, 행동 실험 등이 가능하며, 이물 반응에 의한 아교세포 및 면역세포의 발현이 기존 장치보다 현저히 줄어듦을 증명했다.
박성준 교수는 "이번 연구는 최초로 하이드로젤을 다기능 신경 인터페이스의 구성물질로 사용해 그 수명을 대폭 상승시켰다는 데에 의의가 있으며, 해당 연구를 통해 향후 알츠하이머병, 파킨슨병 등 초장기간 관찰이 필요한 뇌 신경 질환 연구가 더욱 발전할 수 있을 것으로 기대된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 신진연구사업, 범부처의료기기개발 사업, 나노소재원천기술개발사업, 차세대 지능형 반도체 개발사업, KK-JRC 스마트 프로젝트, 카이스트 글로벌 이니셔티브 프로그램, 포스트 인공지능(Post-AI) 프로젝트 사업의 지원을 받아 수행됐다.
하이드로젤 기반 유연성 뇌-기계 인터페이스 개발
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 메사추세츠 공과대학(MIT) 폴리나 아니키바(Polina Anikeeva) 교수, 쏸허 자오(Xuanhe Zhao) 교수, 육현우 박사 공동 연구팀과 함께 *하이드로젤 기반의 유연성 뇌-기계 인터페이스를 개발하는 데 성공했다고 21일 밝혔다.
☞ 하이드로젤: 물과 젤리가 합쳐진 합성어이며 주로 필러, 보톡스, 화장품에 쓰이는 반고체 상태의 물질이다. 인공적인 인체 조직을 만드는 원료로 적합해 의학적으로도 널리 쓰인다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 2021년 6월 8일 字로 출판됐다. (논문명: Adaptive and multifunctional hydrogel hybrid probes for long-term sensing and modulation of neural activity)
뇌 구조를 연구하거나 뇌 신경 질환의 메커니즘을 파악, 치료하기 위해서는, 실시간으로 뇌를 자극하고 신호를 측정할 수 있는 인터페이스의 개발이 필수적이다. 그러나 기존의 신경 인터페이스는 기계적, 화학적 특성이 뇌 조직과 너무 달라서 일어나는 이물 반응(foreign body response) 때문에, 주변에 절연세포층이 형성돼 그 수명이 매우 짧아진다는 문제점을 가지고 있었다.
연구팀은 해당 문제의 해결을 위해, 직접 제작한 다기능성 파이버 다발을 하이드로젤 몸체에 넣는 방법을 이용해 `뇌 모사형 신경 인터페이스'를 제작했다. 해당 장치는 빛으로 특정 신경세포종만을 자극할 수 있는 광유전학 기술을 적용하기 위한 광섬유뿐만 아니라, 뇌에서 신호를 읽을 수 있는 전극 다발, 약물을 뇌 속으로 전달할 수 있는 미세 유체 채널을 모두 보유하고 있다.
해당 인터페이스는 하이드로젤 몸체를 건조시킨 상태에서는 단단한 성질이 고분자와 유사해 몸체에 삽입하기가 쉽다. 하지만 몸에 들어가면 체내의 수분을 빠르게 흡수해. 부드럽고 수분이 풍부한 주변 조직과 유사한 상태가 되므로 이물 반응을 최소화할 수 있다.
연구팀은 이러한 특성을 가진 장치를 동물 모델에 직접 적용해, 기존의 기록을 훨씬 뛰어넘는 삽입 후 6개월까지도 뇌 신호를 측정할 수 있음을 보였다. 또한 자유롭게 움직이는 쥐를 대상으로 초장기간 광유전학 실험, 행동 실험 등이 가능하며, 이물 반응에 의한 아교세포 및 면역세포의 발현이 기존 장치보다 현저히 줄어듦을 증명했다.
박성준 교수는 "이번 연구는 최초로 하이드로젤을 다기능 신경 인터페이스의 구성물질로 사용해 그 수명을 대폭 상승시켰다는 데에 의의가 있으며, 해당 연구를 통해 향후 알츠하이머병, 파킨슨병 등 초장기간 관찰이 필요한 뇌 신경 질환 연구가 더욱 발전할 수 있을 것으로 기대된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 신진연구사업, 범부처의료기기개발 사업, 나노소재원천기술개발사업, 차세대 지능형 반도체 개발사업, KK-JRC 스마트 프로젝트, 카이스트 글로벌 이니셔티브 프로그램, 포스트 인공지능(Post-AI) 프로젝트 사업의 지원을 받아 수행됐다.
2021.06.21
조회수 32595
-
 신경세포의 흥분성 증가로 인한 뇌 질환 기제 규명
관련 유튜브 영상 링크 : https://www.youtube.com/watch?v=dwV_Xs7tHEY&t=13s
우리 연구진이 뇌 신경세포의 흥분과 억제 불균형을 일으키는 새로운 기전을 규명했다. 이는 발작과 같은 다양한 뇌 신경질환의 원인과 연결되며, 뇌 질환 치료에 활용이 기대된다.
우리 대학 생명과학과 정원석 교수와 박정주 박사과정 연구팀이 억제성 시냅스가 *미세아교세포에 의해 제거되는 분자 기전을 처음으로 밝히고, 이 현상이 과도하게 일어날 때 신경세포의 흥분성 증가로 발작과 같은 뇌 질환이 일어날 수 있음을 증명해 국제학술지 `엠보저널(EMBO Journal)'에 공개했다고 2일 밝혔다.
☞ 미세아교세포(microgila): 뇌에서 면역기능을 담당하는 신경세포의 일종이다. 뇌와 척추 전역에 분포돼 있으며, 정상적인 뇌 기능을 수행하도록 핵심적인 역할을 한다.
*시냅스는 뇌 발달 및 학습 시에 생성과 제거가 반복되는 변화를 겪는다. 정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포와 미세아교세포가 신경세포의 불필요한 시냅스를 잡아먹어 제거할 수 있음을 밝힌 바 있다. 하지만, 이 과정에서 어떤 물질이 특정 시냅스를 표지해 교세포들로 하여금 제거하도록 유도하는지는 알려지지 않았다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
연구팀은 포스파티딜세린 (phosphatidylserine)이라는 세포막에 존재하는 인지질 중의 하나가 죽어가는 세포 표면에 선택적으로 표지돼 면역세포에 의해 세포를 잡아먹도록 유도한다는 사실에 착안했다. 죽어가는 세포가 제거되는 분자 기전이 시냅스만이 선택적으로 제거되는 현상에도 응용될 수 있을 것이라 예상한 것이다.
이 가정을 증명하기 위해 연구팀은 포스파티딜세린을 신경세포 표면에 인위적으로 노출한 후, 특정 시냅스가 교세포에 의해 잡아먹힐 수 있는지 연구했다.
먼저 연구팀은 포스파티딜세린을 항상 세포 표면으로부터 안으로 지속적으로 불러들여 정상 세포막에서 이들을 노출되지 않도록 막고 있는 플립파아제(Flippase)라는 단백질의 기능을 신경세포에서만 억제할 수 있는 실험용 쥐 모델을 제작했다.
그 결과 놀랍게도 신경세포의 세포체 주변의 표면에서만 선택적으로 포스파티딜세린이 표지됨을 발견했고 이로 인해 세포막이나 흥분성 시냅스의 손상 없이 억제성 시냅스만이 선택적으로 감소함을 발견했다. 그뿐만 아니라 해당 쥐 모델은 청각을 담당하는 뇌 지역에서 흥분-억제 균형이 깨져서 소리로 인해 촉발되는 특이한 발작 증세를 일으킴을 확인했다.
더 나아가 연구팀은 미세아교세포를 인위적으로 제거하거나 미세아교세포에 존재하는 특정 포식 수용체를 제거했을 때, 신경세포의 표면에 포스파티딜세린이 표지되었을지라도 과도한 억제성 시냅스 감소와 발작 증세가 방지될 수 있음을 발견했다.
이로써 신경세포체 주변 세포막에 포스파티딜세린이 표지되는 것이 미세아교세포가 포식 수용체를 통해 억제성 시냅스만을 선택적으로 먹는 기전으로 쓰일 수 있음을 최초로 규명한 것이다.
연구팀의 이 같은 발견은 흥분성 및 억제성 시냅스가 서로 다른 기전을 통해 미세아교세포에 의해 제거될 수 있음을 처음으로 제시한 것이며, 미세아교세포에 의한 과도한 억제성 시냅스 제거 기전이 뇌 신경세포의 흥분-억제 불균형 발생의 새로운 원인이 될 수 있음을 증명한 것이다.
연구팀 관계자는 "비정상적인 억제성 시냅스 수 변화는 발작, 자폐 스펙트럼 장애, 조현병, 치매 등과 같은 다양한 뇌 질환의 유병률과 연관성이 높다ˮ며 "뇌에서의 흥분-억제 균형이 깨져서 일어나는 다양한 뇌 신경질환에서 미세아교세포가 억제성 시냅스를 먹는 현상을 조절하는 것이 이들 질환을 치료하는 새로운 전략이 될 것이다ˮ고 말했다.
우리 대학 생명과학과 박정주 박사과정이 제1 저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 `엠보저널(EMBO Journal)'에 지난 5월 20일 字 공개됐다. (논문명: Microglial MERTK eliminates phosphatidylserine-displaying inhibitory post-synapses)
한편, 이번 연구는 삼성미래기술육성재단의 도움을 받아 진행됐다.
신경세포의 흥분성 증가로 인한 뇌 질환 기제 규명
관련 유튜브 영상 링크 : https://www.youtube.com/watch?v=dwV_Xs7tHEY&t=13s
우리 연구진이 뇌 신경세포의 흥분과 억제 불균형을 일으키는 새로운 기전을 규명했다. 이는 발작과 같은 다양한 뇌 신경질환의 원인과 연결되며, 뇌 질환 치료에 활용이 기대된다.
우리 대학 생명과학과 정원석 교수와 박정주 박사과정 연구팀이 억제성 시냅스가 *미세아교세포에 의해 제거되는 분자 기전을 처음으로 밝히고, 이 현상이 과도하게 일어날 때 신경세포의 흥분성 증가로 발작과 같은 뇌 질환이 일어날 수 있음을 증명해 국제학술지 `엠보저널(EMBO Journal)'에 공개했다고 2일 밝혔다.
☞ 미세아교세포(microgila): 뇌에서 면역기능을 담당하는 신경세포의 일종이다. 뇌와 척추 전역에 분포돼 있으며, 정상적인 뇌 기능을 수행하도록 핵심적인 역할을 한다.
*시냅스는 뇌 발달 및 학습 시에 생성과 제거가 반복되는 변화를 겪는다. 정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포와 미세아교세포가 신경세포의 불필요한 시냅스를 잡아먹어 제거할 수 있음을 밝힌 바 있다. 하지만, 이 과정에서 어떤 물질이 특정 시냅스를 표지해 교세포들로 하여금 제거하도록 유도하는지는 알려지지 않았다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
연구팀은 포스파티딜세린 (phosphatidylserine)이라는 세포막에 존재하는 인지질 중의 하나가 죽어가는 세포 표면에 선택적으로 표지돼 면역세포에 의해 세포를 잡아먹도록 유도한다는 사실에 착안했다. 죽어가는 세포가 제거되는 분자 기전이 시냅스만이 선택적으로 제거되는 현상에도 응용될 수 있을 것이라 예상한 것이다.
이 가정을 증명하기 위해 연구팀은 포스파티딜세린을 신경세포 표면에 인위적으로 노출한 후, 특정 시냅스가 교세포에 의해 잡아먹힐 수 있는지 연구했다.
먼저 연구팀은 포스파티딜세린을 항상 세포 표면으로부터 안으로 지속적으로 불러들여 정상 세포막에서 이들을 노출되지 않도록 막고 있는 플립파아제(Flippase)라는 단백질의 기능을 신경세포에서만 억제할 수 있는 실험용 쥐 모델을 제작했다.
그 결과 놀랍게도 신경세포의 세포체 주변의 표면에서만 선택적으로 포스파티딜세린이 표지됨을 발견했고 이로 인해 세포막이나 흥분성 시냅스의 손상 없이 억제성 시냅스만이 선택적으로 감소함을 발견했다. 그뿐만 아니라 해당 쥐 모델은 청각을 담당하는 뇌 지역에서 흥분-억제 균형이 깨져서 소리로 인해 촉발되는 특이한 발작 증세를 일으킴을 확인했다.
더 나아가 연구팀은 미세아교세포를 인위적으로 제거하거나 미세아교세포에 존재하는 특정 포식 수용체를 제거했을 때, 신경세포의 표면에 포스파티딜세린이 표지되었을지라도 과도한 억제성 시냅스 감소와 발작 증세가 방지될 수 있음을 발견했다.
이로써 신경세포체 주변 세포막에 포스파티딜세린이 표지되는 것이 미세아교세포가 포식 수용체를 통해 억제성 시냅스만을 선택적으로 먹는 기전으로 쓰일 수 있음을 최초로 규명한 것이다.
연구팀의 이 같은 발견은 흥분성 및 억제성 시냅스가 서로 다른 기전을 통해 미세아교세포에 의해 제거될 수 있음을 처음으로 제시한 것이며, 미세아교세포에 의한 과도한 억제성 시냅스 제거 기전이 뇌 신경세포의 흥분-억제 불균형 발생의 새로운 원인이 될 수 있음을 증명한 것이다.
연구팀 관계자는 "비정상적인 억제성 시냅스 수 변화는 발작, 자폐 스펙트럼 장애, 조현병, 치매 등과 같은 다양한 뇌 질환의 유병률과 연관성이 높다ˮ며 "뇌에서의 흥분-억제 균형이 깨져서 일어나는 다양한 뇌 신경질환에서 미세아교세포가 억제성 시냅스를 먹는 현상을 조절하는 것이 이들 질환을 치료하는 새로운 전략이 될 것이다ˮ고 말했다.
우리 대학 생명과학과 박정주 박사과정이 제1 저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 `엠보저널(EMBO Journal)'에 지난 5월 20일 字 공개됐다. (논문명: Microglial MERTK eliminates phosphatidylserine-displaying inhibitory post-synapses)
한편, 이번 연구는 삼성미래기술육성재단의 도움을 받아 진행됐다.
2021.06.03
조회수 60760
 헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 8822
헌팅턴병 발병원인 제거를 위한 치료제 개발 방법 제시
우리 대학 생명과학과 송지준 교수 연구팀이 헌팅턴병(Huntington's disease)을 치료할 수 있는 새로운 개념의 방법을 제시했다고 2일 밝혔다.
헌팅턴병은 희귀 유전성 질환으로 근육 간 조정 능력 상실과 인지능력 저하, 정신적인 문제가 동반되는 신경계 퇴행성 질환이다. 이는 유전되는 퇴행성 뇌 질환이며 헌팅턴 단백질에 글루타민 아미노산이 여러 개가 연속적으로 확장되는 돌연변이로 인해 발병된다.
헌팅턴병은 약 1~3만 명 중 1명의 발병률을 가지고, 10여 년의 퇴행과정을 거쳐 죽음에 이르게 하는 병이다. 아미노산이 3,000개 이상 연결돼 만들어지는 거대 단백질인 헌팅틴(Huntingtin) 단백질은 질병을 일으키기는 하지만, 생체기능에 필수적인 단백질이고, 병을 일으키는 형태의 단백질만을 치료 표적으로 골라내는 것이 매우 중요하다.
송 교수 연구팀은 네델란드 프로큐알 테라퓨틱스(ProQR Therapeutics NV), 프랑스 그레노블 대학, 스웨덴 왕립 공대의 연구그룹이 참여한 국제 공동연구를 통해, 헌팅턴병을 유발하는 돌연변이 헌팅틴 단백질을 고유의 기능을 유지하면서 질병을 일으키지 않는 형태로 전환해 헌팅턴병을 치료하는 새로운 방법론을 제시했다. 이 결과는 헌팅턴병 치료제를 개발하는데 적용될 수 있을 것으로 기대된다.
우리 대학 생명과학과 김형주 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 저명 학술지 `임상연구저널(Journal of Clinical Investigation Insights)' 온라인판에 출판됐다.
(논문명 : A pathogenic proteolysis-resistant huntingtin isoform induced by an antisense oligonucleotide maintains huntingtin function) https://elifesciences.org/articles/76823
연구팀은 알엔에이(RNA)의 일종인 안티센스올리고뉴클레오타이드(antisense oligonucleotide)를 이용해 생성이 유도된 헌팅틴 델타 12의 형태가, 헌팅턴병을 유발하는 주요 원인인 단백질 아미노산 말단부위로 인해 절단되지 않으면서도 헌팅틴 단백질 고유의 기능을 유지한다는 사실 밝혔다. 연구팀이 결과는 헌팅턴병 치료제 개발의 새로운 개념으로 이용될 수 있을 것으로 기대된다.
이번 연구를 주도한 생명과학과 송지준 교수는 "이번 연구는 한국을 포함한 4개국의 공동연구를 통해 이뤄진 것으로, 질병을 유발하는 헌팅틴 단백질을 정상상태로 유도하는 방법이 헌팅턴병 치료제 개발에 새로운 길을 열어줄 것으로 기대한다ˮ이라고 설명했다.
한편 이번 연구는 한국연구재단 글로벌연구실(Global Research Laboratory) 사업의 지원을 받아 수행됐다.
2022.09.02 조회수 8822 뇌 모방 스핀 소자 핵심기술 개발
우리 대학 물리학과 김갑진 교수와 신소재공학과 박병국 교수 공동연구팀이 뇌 모방 소자로 개발 중인 스핀토크발진기 주파수 대역을 증대시킬 핵심 기술을 개발했다고 18일 밝혔다.
두 연구팀은 비자성체/강자성체/산화물 3중층 구조의 자기발진소자에 게이트 전압을 인가하여 GHz 수준의 발진주파수 조절에 성공하였다. 이는 기존 기술보다 약 10배 이상 향상된 결과로 스핀토크 기반 뉴로모픽 소자가 가진 학습 효과의 휘발성, 좁은 주파수 대역 등의 문제를 해결할 핵심 기술로 제안되었다.
본 소자는 게이트 전압이 영구적으로 수직자기이방성을 변화시켜 소자에 전류가 흐르지 않아도 학습 내용이 저장되어 있는 비휘발성 특성을 가지고 있으며 그 폭이 GHz 수준으로 넓어 뉴로모픽 소자 활용성을 증대시켜줄 것으로 기대된다.
신소재공학과 최종국 박사과정과 물리학과 박재현 박사가 공동 제1저자로 참여하고, KAIST 신소재공학과 강민구 연구원, 고려대학교 이재성 교수와 김도윤 연구원, KAIST 물리학과 이경진 교수가 공동저자로 참여한 본 논문은 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 6월 30일 온라인 게재됐다. (논문명 : Voltage-driven gigahertz frequency tuning of spin Hall nano-oscillators)
기존의 스핀토크발진기 기반 뉴로모픽 소자는 학습 대상을 주파수 대역에 대응시켜 학습하는 소자로, 전류가 흐르지 않으면 학습 내용이 사라지는 휘발성과 200MHz 이내의 제한적인 학습 가능 대역폭을 가지고 있어 이에 대한 개선이 필요한 상황이다.
이번 연구에서 연구팀은 게이트 전압 인가가 소자의 수직자기이방성을 영구적으로 조절하고 이를 통해 자기공명주파수가 조절된다는 사실을 이용하여 기존 보고의 10배 이상인 2.1 GHz 이상의 광대역 조절 가능한 발진기를 실현하였다. 본 기술은 스핀-홀 나노 발진기 기반 뉴로모픽 소자 개발에 핵심 기술로 활용될 것이라 기대된다.
한편 이번 연구는 KAIST 글로벌 특이점 연구사업, 삼성미래기술육성사업, 한국연구재단 선도연구센터/중견연구자지원사업의 지원을 받아 수행됐다.
2022.07.29 조회수 10405
뇌 모방 스핀 소자 핵심기술 개발
우리 대학 물리학과 김갑진 교수와 신소재공학과 박병국 교수 공동연구팀이 뇌 모방 소자로 개발 중인 스핀토크발진기 주파수 대역을 증대시킬 핵심 기술을 개발했다고 18일 밝혔다.
두 연구팀은 비자성체/강자성체/산화물 3중층 구조의 자기발진소자에 게이트 전압을 인가하여 GHz 수준의 발진주파수 조절에 성공하였다. 이는 기존 기술보다 약 10배 이상 향상된 결과로 스핀토크 기반 뉴로모픽 소자가 가진 학습 효과의 휘발성, 좁은 주파수 대역 등의 문제를 해결할 핵심 기술로 제안되었다.
본 소자는 게이트 전압이 영구적으로 수직자기이방성을 변화시켜 소자에 전류가 흐르지 않아도 학습 내용이 저장되어 있는 비휘발성 특성을 가지고 있으며 그 폭이 GHz 수준으로 넓어 뉴로모픽 소자 활용성을 증대시켜줄 것으로 기대된다.
신소재공학과 최종국 박사과정과 물리학과 박재현 박사가 공동 제1저자로 참여하고, KAIST 신소재공학과 강민구 연구원, 고려대학교 이재성 교수와 김도윤 연구원, KAIST 물리학과 이경진 교수가 공동저자로 참여한 본 논문은 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’에 6월 30일 온라인 게재됐다. (논문명 : Voltage-driven gigahertz frequency tuning of spin Hall nano-oscillators)
기존의 스핀토크발진기 기반 뉴로모픽 소자는 학습 대상을 주파수 대역에 대응시켜 학습하는 소자로, 전류가 흐르지 않으면 학습 내용이 사라지는 휘발성과 200MHz 이내의 제한적인 학습 가능 대역폭을 가지고 있어 이에 대한 개선이 필요한 상황이다.
이번 연구에서 연구팀은 게이트 전압 인가가 소자의 수직자기이방성을 영구적으로 조절하고 이를 통해 자기공명주파수가 조절된다는 사실을 이용하여 기존 보고의 10배 이상인 2.1 GHz 이상의 광대역 조절 가능한 발진기를 실현하였다. 본 기술은 스핀-홀 나노 발진기 기반 뉴로모픽 소자 개발에 핵심 기술로 활용될 것이라 기대된다.
한편 이번 연구는 KAIST 글로벌 특이점 연구사업, 삼성미래기술육성사업, 한국연구재단 선도연구센터/중견연구자지원사업의 지원을 받아 수행됐다.
2022.07.29 조회수 10405 대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19 조회수 12287
대규모 한국인 자폐증 가족 유전체 연구를 통한 새로운 자폐 유전변이 최초 발견
우리 대학 의과학대학원 이정호 교수와 바이오및뇌공학과 최정균 교수, 생명과학과 김은준 교수(IBS 시냅스뇌질환연구단장), 분당서울대병원 유희정 교수, KISTI 공동 연구팀이 아시아 최초로 대규모 한국인 자폐증 가족 코호트를 모집하고 전장 유전체 분석을 실시해 자폐증 유발 유전변이가 단백질을 암호화하지 않는 유전체 영역인 비-부호화 영역에서 발생할 수 있다는 사실을 규명했고, 이를 통해 자폐증 원인의 새로운 이해와 치료 전기를 마련했다고 19일 밝혔다.
이번 연구내용은 세계적 정신의학 학술지 ‘분자 정신의학(Molecular Psychiatry)’에 7월 15일 자에 게재됐다.
자폐증은 사회적 의사소통 결핍이나 이상, 반복적이거나 틀에 박힌 행동 문제가 유아 시절 시작돼 거의 평생 지속되는 뇌 신경 발달장애로, 질환 발생의 근본적인 원인에 대한 이해가 매우 부족하며, 공식적으로 인정된 치료 약제가 전무하다. 자폐증 원인에 대한 이해의 필요성은 대중들의 높은 관심을 통해서도 가늠해볼 수 있는데, 예를 들어 최근 세간의 이목이 집중된 드라마 ‘이상한 변호사 우영우’의 주인공이 자폐증을 앓고 있다.
연구진은 자폐증 유발 유전변이가 비-부호화 유전체 영역에서 발생한다는 사실을 발견했으며, 이를 세계 최초로 한국인 자폐증 샘플로 제작한 인간 줄기세포를 이용해 증명했다. 자폐증의 근본 원인을 규명한 획기적인 연구 결과로서, 기존 연구의 한계를 뛰어넘어 그간 유전체 분야의 난공불락으로 여겨졌던 비-부호화 영역에 초점을 맞춘 혁신적인 발상으로 자폐증 치료의 새로운 전기가 마련될 것으로 예상된다.
연구진은 IBS와 한국연구재단, 국가바이오빅데이터 사업단의 지원을 통해 2011년부터 현재 3,708명에 달하는 자폐 환자와 그 가족들로 구성된 대규모 한국인 코호트를 구축하고 유전체 분석을 진행하고 있으며, 이번 연구 결과는 813명의 전장 유전체 염기서열 분석을 바탕으로 이뤄졌다. (그림 1)
유전체 데이터의 98% 이상을 차지하고 있으나 그간 자폐증 유전체 연구에서 조명받지 못했던 비-부호화 영역을 집중적으로 규명하고자, 연구진은 3차원 공간상의 염색질 상호작용(three-dimensional chromatin interaction)이라는 새로운 분석 방식을 사용했으며 (그림 2), 비-부호화 영역에서 발생한 유전변이가 멀리 떨어져 있는 자폐 유전자의 기능에 심각한 이상을 초래할 수 있음을 증명했다. (그림 3)
특히, 본 코호트의 한국인 자폐증 가족으로부터 직접 인간 줄기세포를 제작해 태아기 신경세포를 재현했으며, 이러한 생애 초기 신경 발달단계에서 비-부호화 영역의 유전변이에 의해 최대 500,000 base-pair(유전체 거리 단위) 이상 떨어져 있는 유전자의 발현이 비정상적으로 낮아지거나 높아질 수 있음을 세계 최초로 증명했다 (그림 4)
이번 연구 성과는 자폐증 유발 유전변이가 단백질을 부호화하지 않는 비-부호화 영역에서 발생해, 멀리 떨어져 있는 유전자의 기능에 영향을 미침으로써 신경 발달단계 초기부터 질병 발병에 기여한다는 획기적인 자폐증 원인에 대한 발견이다. 연구팀은 그간 단백질을 부호화하는 영역에만 쏠려 있던 정신질환 연구 풍토 속에서, 비-부호화 영역을 규명하는 방향으로 전환해야 자폐증 치료의 비밀을 풀 수 있다는 새로운 접근법을 제시했다.
IBS 시냅스뇌질환연구단(김은준 교수팀 프로젝트 제안 및 개시), 서울의대 및 분당서울대병원(유희정교수팀 코호트 구축 및 임상 평가), KISTI(대용량 컴퓨팅 리소스 및 유전체 데이터 분석 파이프라인 제공), KAIST (이정호 교수팀, 최정균 교수팀 비-부호화 영역 유전변이 분석) 공동 연구팀이 통합된 유전체-임상 데이터에 대해 3차원 공간상의 염색질 상호작용 분석을 통해 비-부호화 영역에서 발생한 유전변이가 자폐증 발병에 기여함을 규명했다.
이는 순수 국내의 임상가와 기초과학자, 생물정보학 전문가의 융합연구로 이루어낸 성과이며, 아시아 최초의 대규모 전장-유전체 데이터 기반 코호트 구축과 유전체 분석 모델의 기틀을 마련함으로써 대한민국 유전체 연구의 선도적인 역할을 한 것이다. 자폐 유전체 연구는 지난 10년간 북미와 유럽을 위주로 대규모로 진행됐으나, 한국을 비롯한 아시아에서는 상대적으로 연구가 덜 진행됐다.
논문의 공동 제1 저자인 KAIST 의과학대학원 졸업생 김일빈 박사는 “신경발달장애 중 자폐증은 특히 치료가 어려운 것으로 알려져 있는데, 발병 원인 중 하나로 지목되는 유전체 영역의 이상을 한국인 고유의 데이터를 사용해 순수 국내 연구진들의 힘으로 발견해냈다는 데 큰 의미가 있으며, 이 연구 성과가 언젠가는 이루어질 자폐증 치료제 개발을 위한 작은 발판이 되길 바란다”라고 말했다. 분당서울대병원의 유희정 교수도 “우리나라 연구진의 힘을 모아 자폐증의 비밀을 풀기 위한 첫걸음을 내딛었다. 연구에 참여해 준 당사자와 가족들의 헌신으로 이룬 일이라고 생각한다. 하지만 우리가 자폐증의 발병 기전을 완전히 이해하고 나아가 치료제를 개발하기 위해서는 아직 연구해야 할 것이 많다. 유전체 연구에 대한 국가 차원의 지원이 절실하며, 자폐증을 가진 분들과 가족들의 관심도 꼭 필요하다”는 점을 강조했다.
한편 이번 연구는 서경배과학재단, 한국연구재단, 보건산업진흥원사업을 통해 수행됐다.
2022.07.19 조회수 12287 기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
2022.06.02 조회수 8970
기억 저장 세포의 뇌 지도 제작기법 최초 개발
우리 대학 연구진이 기억을 저장하는 다양한 뇌 부위 세포들의 분포를 지도로 제작하는 기법의 개발에 최초로 성공했다.
바이오및뇌공학과 박영균 교수 연구팀이 메사추세츠 공과대학(MIT) 정광훈 교수 및 스스무 도네가와(Susumu Tonegawa) 교수 공동연구팀과 함께 단일 기억을 저장하는 세포들을 생쥐의 뇌 전체에서 매핑하는 기법을 개발하고, 이를 통해 공간 공포 기억을 저장하는 새로운 뇌 부위 세포들을 발견했다고 2일 밝혔다.
기억은 주로 몇몇 뇌 부위에 국한해 연구돼왔다. 예를 들어 공포 기억은 편도체, 공간 기억은 해마의 세포들에 저장된다고 생각돼왔으며, 해당 뇌 부위들이 주로 연구됐다. 하지만 단일 기억이 다양한 뇌 부위에 나누어 저장될 것이라는 가설도 제시돼왔는데, 이러한 가설은 기억을 저장하는 세포들의 분포를 뇌 전체에서 확인(매핑)함으로써 확실한 검증이 가능하나, 이는 기술적 한계로 이뤄지지 못했다.
공동연구팀은 기존 팀이 개발한 전뇌 투명화 기술(SHIELD) 및 초고속 전뇌 면역염색 기술(eFLASH)을 통해, 공간 공포 기억을 학습한 생쥐에서 기억의 학습과 회상 시 모두 활성화된 세포들을 뇌 전체에서 매핑했다. 이를 통해 공간 공포 기억을 저장하고 있을 확률이 높은 뇌 부위의 세포들을 생쥐 뇌 전체에서 찾아낼 수 있었다. 이후 해당 세포들을 광유전학적 방법으로 조절해 해당 세포들에 공간 공포 기억이 저장됐음을 확인함으로써, 공간 공포 기억을 저장하는 7개의 새로운 뇌 부위와 세포들을 연구팀은 찾아낼 수 있었다.
그렇다면 기억에 다양한 뇌 부위의 기억저장 세포들이 모두 필요한 것일까? 연구팀은 이를 확인하기 위해, 화학유전학 기법을 통해 다양한 뇌 부위의 기억저장 세포들을 한꺼번에 자극해 보았으며, 그 결과 뇌의 한 부위의 기억저장 세포를 자극했을 때와는 다르게, 자연적인 기억 회상에 가까운 기억의 완전한 회상이 유도됨을 확인했다. 이는 다양한 뇌 부위의 기억저장 세포들의 활성이 기억에 모두 필요함을 의미한다.
박영균 교수는 "이번 연구는 연구팀이 기존에 개발한 기술들에 힘입어 기억저장 세포의 매핑을 최초로 실현하고, 이를 통해 단일 기억이 다양한 뇌 부위 세포들에 흩어져 저장됨을 증명한 데 의의가 있다ˮ며, "이번 연구에서 밝혀진 기억저장 세포의 뇌 지도는, 각 뇌 부위의 세포 및 세포 간 상호작용이 기억에 있어 각각 어떠한 세부적인 기능을 하는지에 관한 연구를 촉진함으로써, 기억의 메커니즘에 대한 완전한 이해를 도울 수 있다ˮ고 말했다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 지난 4월 4일 자로 게재됐다(논문명: Brain-wide mapping reveals that engrams for a single memory are distributed across multiple brain regions)
2022.06.02 조회수 8970 생각만으로 정확하게 로봇팔 조종이 가능한 뇌-기계 인터페이스 개발
우리 대학 바이오및뇌공학과 정재승 교수 연구팀이 3차원 공간상에서 생각만으로 로봇팔을 높은 정확도 (90.9~92.6%)로 조종하는 `뇌-기계 인터페이스 시스템'을 개발했다고 23일 밝혔다.
정 교수 연구팀은 인공지능과 유전자 알고리즘을 사용해 인간의 대뇌 심부에서 측정한 뇌파만으로 팔 움직임의 의도를 파악해 로봇팔을 제어하는 새로운 형태의 뇌-기계 인터페이스 시스템을 개발했다. 뇌 활동만으로 사람의 의도를 파악해 로봇이나 기계가 대신 행동에 옮기는 `뇌-기계 인터페이스' 기술은 최근 급속도로 발전하고 있다. 하지만 손을 움직이는 정도의 의도 파악을 넘어, 팔 움직임의 방향에 대한 의도를 섬세하게 파악해 정교하게 로봇팔을 움직이는 기술은 아직 정확도가 높지 않았다.
하지만 연구팀은 이번 연구에서 조종 `방향'에 대한 의도를 뇌 활동만으로 인식하는 인공지능 모델을 개발했고, 그 결과 3차원 공간상에서 24개의 방향을 90% 이상의 정확도로 정교하게 해석하는 시스템을 개발했다.
게다가 딥러닝 등 기존 기계학습 기술은 높은 사양의 GPU 하드웨어가 필요했지만, 이번 연구에서는 축적 컴퓨팅(Reservoir Computing) 기법을 이용해 낮은 사양의 하드웨어에서도 인공지능 학습이 가능하여 스마트 모바일 기기에서도 폭넓게 응용될 수 있도록 개발해, 향후 메타버스와 스마트 기기에도 폭넓게 적용이 가능할 것으로 기대된다.
우리 대학 김훈희 박사(現 강남대 조교수)가 제1 저자로 참여한 이번 연구는 국제학술지 `어플라이드 소프트 컴퓨팅(Applied Soft Computing)' 2022년 117권 3월호에 출판됐다. (논문명 : An electrocorticographic decoder for arm movement for brain-machine interface using an echo state network and Gaussian readout).
뇌-기계 인터페이스는 사용자의 뇌 활동을 통해 의도를 읽고 로봇이나 기계에 전달하는 기술로서 로봇, 드론, 컴퓨터뿐만 아니라 스마트 모바일 기기, 메타버스 등에서의 이용될 차세대 인터페이스 기술로 각광받고 있다.
특히 기존의 인터페이스가 외부 신체 기관을 통해 명령을 간접 전달(버튼, 터치, 제스처 등)해야 하지만 뇌-기계 인터페이스는 명령을 뇌로부터 직접적 전달한다는 점에서 가장 진보된 인터페이스 기술로 여겨진다.
그러나 뇌파는 개개인의 차이가 매우 크고, 단일 신경 세포로부터 정확한 신호를 읽는 것이 아니라 넓은 영역에 있는 신경 세포 집단의 전기적 신호 특성을 해석해야 하므로 잡음이 크다는 한계점을 가지고 있다.
연구팀은 이러한 문제 해결을 위해 최첨단 인공지능 기법의 하나인 `축적 컴퓨팅 기법'을 이용해 뇌-기계 인터페이스에서 필요한 개개인의 뇌파 신호의 중요 특성을 인공신경망이 자동으로 학습해 찾을 수 있도록 구현했다.
또한 유전자 알고리즘(Genetic Algorithm)을 이용해 인공지능 신경망이 최적의 뇌파 특성을 효율적으로 찾을 수 있게 시스템을 설계했다. 연구팀은 심부 뇌파를 최종 해석하는 리드아웃(Readout)을 가우시안(Gaussian) 모델로 설계해 시각피질 신경 세포가 방향을 표현하는 방법을 모방하는 인공신경망을 개발했다. 이런 리드아웃 방식은 축적 컴퓨팅의 선형 학습 알고리즘을 이용해 일반적 사양의 간단한 하드웨어에서도 빠르게 학습할 수 있어 메타버스, 스마트기기 등 일상생활에서 응용이 가능해진다.
특히, 이번 연구에서 만들어진 뇌-기계 인터페이스 인공지능 모델은 3차원상에서 24가지 방향 즉, 각 차원에서 8가지 방향을 디코딩할 수 있으며 모든 방향에서 평균 90% 이상의 정확도 (90.9%~92.6% 범위)를 보였다. 또한 연구된 뇌-기계 인터페이스는 3차원 공간상에서 로봇팔을 움직이는 상상을 할 때의 뇌파를 해석해 성공적으로 로봇팔을 움직이는 시뮬레이션 결과를 보였다.
인공지능 시스템을 만든 제1 저자인 김훈희 박사는 "공학적인 신호처리 기법에 의존해 온 기존 뇌파 디코딩 방법과는 달리, 인간 뇌의 실제 작동 구조를 모방한 인공신경망을 개발해 좀더 발전된 형태의 뇌-기계 인터페이스 시스템을 개발해 기쁘다ˮ면서 "향후 뇌의 특성을 좀 더 구체적으로 이용한 `뇌 모방 인공지능(Brain-inspired A.I.)'을 이용한 다양한 뇌-기계 인터페이스를 개발할 계획이다ˮ라고 말했다.
이번 연구를 주도한 연구책임자 정재승 교수는 "뇌파를 통해 생각만으로 로봇팔을 구동하는 `뇌-기계 인터페이스 시스템'들이 대부분 고사양 하드웨어가 필요해 실시간 응용으로 나아가기 어렵고 스마트기기 등으로 적용이 어려웠다. 그러나 이번 시스템은 90%~92%의 높은 정확도를 가진 의도 인식 인공지능 시스템을 만들어 메타버스 안에서 아바타를 생각대로 움직이게 하거나 앱을 생각만으로 컨트롤하는 스마트기기 등에 광범위하게 사용될 수 있다ˮ고 말했다.
이번 연구 결과는 사지마비 환자나 사고로 팔을 잃은 환자들을 위한 로봇팔 장착 및 제어 기술부터, 메타버스, 스마트기기, 게임, 엔터테인먼트 애플리케이션 등 다양한 시스템에 뇌-기계 인터페이스를 적용할 가능성을 열어 줄 것으로 기대된다.
이번 연구는 한국연구재단 뇌 원천기술개발사업의 지원을 받아 수행됐다.
2022.02.24 조회수 15907
생각만으로 정확하게 로봇팔 조종이 가능한 뇌-기계 인터페이스 개발
우리 대학 바이오및뇌공학과 정재승 교수 연구팀이 3차원 공간상에서 생각만으로 로봇팔을 높은 정확도 (90.9~92.6%)로 조종하는 `뇌-기계 인터페이스 시스템'을 개발했다고 23일 밝혔다.
정 교수 연구팀은 인공지능과 유전자 알고리즘을 사용해 인간의 대뇌 심부에서 측정한 뇌파만으로 팔 움직임의 의도를 파악해 로봇팔을 제어하는 새로운 형태의 뇌-기계 인터페이스 시스템을 개발했다. 뇌 활동만으로 사람의 의도를 파악해 로봇이나 기계가 대신 행동에 옮기는 `뇌-기계 인터페이스' 기술은 최근 급속도로 발전하고 있다. 하지만 손을 움직이는 정도의 의도 파악을 넘어, 팔 움직임의 방향에 대한 의도를 섬세하게 파악해 정교하게 로봇팔을 움직이는 기술은 아직 정확도가 높지 않았다.
하지만 연구팀은 이번 연구에서 조종 `방향'에 대한 의도를 뇌 활동만으로 인식하는 인공지능 모델을 개발했고, 그 결과 3차원 공간상에서 24개의 방향을 90% 이상의 정확도로 정교하게 해석하는 시스템을 개발했다.
게다가 딥러닝 등 기존 기계학습 기술은 높은 사양의 GPU 하드웨어가 필요했지만, 이번 연구에서는 축적 컴퓨팅(Reservoir Computing) 기법을 이용해 낮은 사양의 하드웨어에서도 인공지능 학습이 가능하여 스마트 모바일 기기에서도 폭넓게 응용될 수 있도록 개발해, 향후 메타버스와 스마트 기기에도 폭넓게 적용이 가능할 것으로 기대된다.
우리 대학 김훈희 박사(現 강남대 조교수)가 제1 저자로 참여한 이번 연구는 국제학술지 `어플라이드 소프트 컴퓨팅(Applied Soft Computing)' 2022년 117권 3월호에 출판됐다. (논문명 : An electrocorticographic decoder for arm movement for brain-machine interface using an echo state network and Gaussian readout).
뇌-기계 인터페이스는 사용자의 뇌 활동을 통해 의도를 읽고 로봇이나 기계에 전달하는 기술로서 로봇, 드론, 컴퓨터뿐만 아니라 스마트 모바일 기기, 메타버스 등에서의 이용될 차세대 인터페이스 기술로 각광받고 있다.
특히 기존의 인터페이스가 외부 신체 기관을 통해 명령을 간접 전달(버튼, 터치, 제스처 등)해야 하지만 뇌-기계 인터페이스는 명령을 뇌로부터 직접적 전달한다는 점에서 가장 진보된 인터페이스 기술로 여겨진다.
그러나 뇌파는 개개인의 차이가 매우 크고, 단일 신경 세포로부터 정확한 신호를 읽는 것이 아니라 넓은 영역에 있는 신경 세포 집단의 전기적 신호 특성을 해석해야 하므로 잡음이 크다는 한계점을 가지고 있다.
연구팀은 이러한 문제 해결을 위해 최첨단 인공지능 기법의 하나인 `축적 컴퓨팅 기법'을 이용해 뇌-기계 인터페이스에서 필요한 개개인의 뇌파 신호의 중요 특성을 인공신경망이 자동으로 학습해 찾을 수 있도록 구현했다.
또한 유전자 알고리즘(Genetic Algorithm)을 이용해 인공지능 신경망이 최적의 뇌파 특성을 효율적으로 찾을 수 있게 시스템을 설계했다. 연구팀은 심부 뇌파를 최종 해석하는 리드아웃(Readout)을 가우시안(Gaussian) 모델로 설계해 시각피질 신경 세포가 방향을 표현하는 방법을 모방하는 인공신경망을 개발했다. 이런 리드아웃 방식은 축적 컴퓨팅의 선형 학습 알고리즘을 이용해 일반적 사양의 간단한 하드웨어에서도 빠르게 학습할 수 있어 메타버스, 스마트기기 등 일상생활에서 응용이 가능해진다.
특히, 이번 연구에서 만들어진 뇌-기계 인터페이스 인공지능 모델은 3차원상에서 24가지 방향 즉, 각 차원에서 8가지 방향을 디코딩할 수 있으며 모든 방향에서 평균 90% 이상의 정확도 (90.9%~92.6% 범위)를 보였다. 또한 연구된 뇌-기계 인터페이스는 3차원 공간상에서 로봇팔을 움직이는 상상을 할 때의 뇌파를 해석해 성공적으로 로봇팔을 움직이는 시뮬레이션 결과를 보였다.
인공지능 시스템을 만든 제1 저자인 김훈희 박사는 "공학적인 신호처리 기법에 의존해 온 기존 뇌파 디코딩 방법과는 달리, 인간 뇌의 실제 작동 구조를 모방한 인공신경망을 개발해 좀더 발전된 형태의 뇌-기계 인터페이스 시스템을 개발해 기쁘다ˮ면서 "향후 뇌의 특성을 좀 더 구체적으로 이용한 `뇌 모방 인공지능(Brain-inspired A.I.)'을 이용한 다양한 뇌-기계 인터페이스를 개발할 계획이다ˮ라고 말했다.
이번 연구를 주도한 연구책임자 정재승 교수는 "뇌파를 통해 생각만으로 로봇팔을 구동하는 `뇌-기계 인터페이스 시스템'들이 대부분 고사양 하드웨어가 필요해 실시간 응용으로 나아가기 어렵고 스마트기기 등으로 적용이 어려웠다. 그러나 이번 시스템은 90%~92%의 높은 정확도를 가진 의도 인식 인공지능 시스템을 만들어 메타버스 안에서 아바타를 생각대로 움직이게 하거나 앱을 생각만으로 컨트롤하는 스마트기기 등에 광범위하게 사용될 수 있다ˮ고 말했다.
이번 연구 결과는 사지마비 환자나 사고로 팔을 잃은 환자들을 위한 로봇팔 장착 및 제어 기술부터, 메타버스, 스마트기기, 게임, 엔터테인먼트 애플리케이션 등 다양한 시스템에 뇌-기계 인터페이스를 적용할 가능성을 열어 줄 것으로 기대된다.
이번 연구는 한국연구재단 뇌 원천기술개발사업의 지원을 받아 수행됐다.
2022.02.24 조회수 15907 인공지능의 오랜 난제를 뇌 기반 인공지능으로 풀다
우리 대학 바이오및뇌공학과 이상완 교수(신경과학 인공지능 융합연구센터장) 연구팀이 뇌 기반 인공지능 기술을 이용해 인공지능의 난제 중 하나인 과적합-과소적합 상충 문제를 해결하는 원리를 풀어내는 데 성공했다고 5일 밝혔다.
이상완 교수와 김동재 박사(現 뉴욕대학교 박사후 연구원)가 주도하고 우리 대학 정재승 교수가 참여한 이번 연구는 `강화학습 중 편향-분산 상충 문제에 대한 전두엽의 해법'이라는 제목으로 국제 학술지 셀(Cell)의 오픈 액세스 저널인 `셀 리포트(Cell Reports)'에 지난해 12월 28일 字 온라인판에 게재됐다. (논문명: Prefrontal solution to the bias-variance tradeoff during reinforcement learning)
최근 인공지능 모델들은 다양한 실제 문제들에 대해 최적의 해법을 제시하지만, 상황 변화에 유동적으로 대응하는 부분에 있어서는 여전히 어려움을 겪고 있다. 기계학습에서는 이를 과소적합-과적합의 위험성 (underfitting-overfitting risk) 또는 편향-분산 상충 문제(bias-variance tradeoff)라 하며 오랫동안 연구됐지만, 실제 세계와 같이 상충 조건이 계속 변하는 상황에서의 명확한 해법은 아직 제안된 바가 없다.
반면 인간은 현재 주어진 문제에 집중하면서도(과소적합 문제 해결), 당면 문제에 과하게 집착하지 않고(과적합 문제 해결) 변하는 상황에 맞게 유동적으로 대처한다. 연구팀은 뇌 데이터, 확률과정 추론 모형, 강화학습 알고리즘을 이용해 인간의 뇌가 이 문제를 어떻게 해결하는지에 대한 이론적 틀을 마련하고 이로부터 유동적인 메타 강화학습 모델을 도출해냈다.
놀랍게도 인간의 뇌는 중뇌 도파민 회로와 전두엽에서 처리되는 `예측 오차'의 하한선(prediction error lower bound)이라는 단 한 가지 정보를 이용해 이 문제를 해결한다. 우리의 전두엽, 특히 복외측전전두피질은 현재 내가 사용하고 있는 문제 해결 방식으로 주어진 문제를 얼마나 잘 풀 수 있을지에 대한 기대치의 한계를 추정하고(예: `이렇게 풀면 90점까지는 받을 수 있어'), 변화하는 상황에 맞춰 최적인 문제 해결전략을 유동적으로 선택하는 과정 (예: `이렇게 풀면 기껏해야 70점이니 다르게 풀어보자')을 통해 과소적합-과적합의 위험을 최소화하게 된다.
이상완 교수 연구팀은 2014년 해당 전두엽 영역이 환경의 불확실성을 바탕으로 강화학습전략을 유동적으로 조절하는 데 관여한다는 사실을 처음 발견했고(`뉴런(Neuron)' 학술지에 발표), 2015년에는 인과관계 추론 과정에도 관여한다는 사실을 발견했다(`PLOS Biology' 학술지에 발표). 이어 2019년에는 해당 뇌 영역이 문제의 복잡도까지 고려할 수 있다는 사실을 발견했다(`네이처 커뮤니케이션즈(Nature Communications)' 학술지에 발표).
이러한 일련의 연구 결과들은 자신의 학습 및 추론 능력을 스스로 평가하는 인간의 메타 인지 능력을 보여주는 증거로, 이 능력을 바탕으로 인공지능이 풀기 어려워하는 현실 세계의 다양한 상충적 상황들을 풀어낼 수 있다는 `전두엽 메타 학습 이론'을 정립한 바 있다(`사이언스 로보틱스(Science Robotics)' 학술지에 발표). 이번 연구는 이 이론에 기반해 인공지능의 오랜 난제 중 하나인 과소적합-과적합 상충 문제를 실제로 풀어낸 최초의 사례로 평가된다.
연구를 통해 개발된 메타 강화학습 모델을 이용하면 간단한 게임을 통해 인간의 유동적 문제 해결 능력을 간접적으로 측정할 수 있다. 더 나아가 스마트 교육이나 중독과 관련된 인지 행동치료에 적용할 경우 상황 변화에 유동적으로 대처하는 인간의 문제 해결 능력 자체를 향상할 수 있을 것으로 기대된다. 차세대 인공지능, 스마트 교육, 인지 행동치료 등 다양한 분야에 파급력이 큰 원천 기술로 최근 국내 및 해외 특허 출원이 완료된 상태다.
연구를 주도한 제1 저자 김동재 박사는 "인간 지능의 특장점에 대한 이해가 얼마나 중요한지 보여주는 연구 중 하나ˮ라고 말했다. 연구 책임자인 이상완 교수는 "인공지능이 우리보다 잘 푸는 문제가 많지만, 반대로 인공지능으로 풀기 어려운 문제들이 우리에게는 정말 쉽게 느껴지는 경우들이 많다. 인간의 다양한 고위 수준 능력을 인공지능 이론 관점에서 형식화하는 연구를 통해 인간 지능의 비밀을 하나씩 풀어나갈 수 있을 것으로 기대된다ˮ라며 "이러한 뇌 기반 인공지능 연구는 인간의 지능을 공학적으로 탐구하는 과정으로 볼 수 있으며, 인간과 인공지능이 서로 도우며 함께 성장해 나갈 수 있는 명확한 기준점을 마련할 수 있을 것ˮ이라고 말했다. 이상완 교수는 뇌 기반 인공지능 연구의 독창성과 도전성을 인정받아 구글 교수 연구상과 IBM 학술상을 받은 바 있다.
연구팀은 과학기술정보통신부의 재원으로 정보통신기획평가원의 지원을 받아 설립한 KAIST 신경과학-인공지능 융합연구센터에서 기반 기술을 활용해 인간 지능을 모사한 차세대 인공지능 모델을 개발하고, 아울러 딥마인드, IBM 인공지능 연구소, MIT, 옥스퍼드 대학 등 국제 공동연구 협약 기관과 공동연구를 통해 기술의 파급력을 높여나갈 계획이라고 말했다.
한편 이번 연구는 삼성전자 미래기술육성센터, 과학기술정보통신부 정보통신기획평가원 및 한국연구재단의 지원을 받아 수행됐다.
2022.01.05 조회수 11928
인공지능의 오랜 난제를 뇌 기반 인공지능으로 풀다
우리 대학 바이오및뇌공학과 이상완 교수(신경과학 인공지능 융합연구센터장) 연구팀이 뇌 기반 인공지능 기술을 이용해 인공지능의 난제 중 하나인 과적합-과소적합 상충 문제를 해결하는 원리를 풀어내는 데 성공했다고 5일 밝혔다.
이상완 교수와 김동재 박사(現 뉴욕대학교 박사후 연구원)가 주도하고 우리 대학 정재승 교수가 참여한 이번 연구는 `강화학습 중 편향-분산 상충 문제에 대한 전두엽의 해법'이라는 제목으로 국제 학술지 셀(Cell)의 오픈 액세스 저널인 `셀 리포트(Cell Reports)'에 지난해 12월 28일 字 온라인판에 게재됐다. (논문명: Prefrontal solution to the bias-variance tradeoff during reinforcement learning)
최근 인공지능 모델들은 다양한 실제 문제들에 대해 최적의 해법을 제시하지만, 상황 변화에 유동적으로 대응하는 부분에 있어서는 여전히 어려움을 겪고 있다. 기계학습에서는 이를 과소적합-과적합의 위험성 (underfitting-overfitting risk) 또는 편향-분산 상충 문제(bias-variance tradeoff)라 하며 오랫동안 연구됐지만, 실제 세계와 같이 상충 조건이 계속 변하는 상황에서의 명확한 해법은 아직 제안된 바가 없다.
반면 인간은 현재 주어진 문제에 집중하면서도(과소적합 문제 해결), 당면 문제에 과하게 집착하지 않고(과적합 문제 해결) 변하는 상황에 맞게 유동적으로 대처한다. 연구팀은 뇌 데이터, 확률과정 추론 모형, 강화학습 알고리즘을 이용해 인간의 뇌가 이 문제를 어떻게 해결하는지에 대한 이론적 틀을 마련하고 이로부터 유동적인 메타 강화학습 모델을 도출해냈다.
놀랍게도 인간의 뇌는 중뇌 도파민 회로와 전두엽에서 처리되는 `예측 오차'의 하한선(prediction error lower bound)이라는 단 한 가지 정보를 이용해 이 문제를 해결한다. 우리의 전두엽, 특히 복외측전전두피질은 현재 내가 사용하고 있는 문제 해결 방식으로 주어진 문제를 얼마나 잘 풀 수 있을지에 대한 기대치의 한계를 추정하고(예: `이렇게 풀면 90점까지는 받을 수 있어'), 변화하는 상황에 맞춰 최적인 문제 해결전략을 유동적으로 선택하는 과정 (예: `이렇게 풀면 기껏해야 70점이니 다르게 풀어보자')을 통해 과소적합-과적합의 위험을 최소화하게 된다.
이상완 교수 연구팀은 2014년 해당 전두엽 영역이 환경의 불확실성을 바탕으로 강화학습전략을 유동적으로 조절하는 데 관여한다는 사실을 처음 발견했고(`뉴런(Neuron)' 학술지에 발표), 2015년에는 인과관계 추론 과정에도 관여한다는 사실을 발견했다(`PLOS Biology' 학술지에 발표). 이어 2019년에는 해당 뇌 영역이 문제의 복잡도까지 고려할 수 있다는 사실을 발견했다(`네이처 커뮤니케이션즈(Nature Communications)' 학술지에 발표).
이러한 일련의 연구 결과들은 자신의 학습 및 추론 능력을 스스로 평가하는 인간의 메타 인지 능력을 보여주는 증거로, 이 능력을 바탕으로 인공지능이 풀기 어려워하는 현실 세계의 다양한 상충적 상황들을 풀어낼 수 있다는 `전두엽 메타 학습 이론'을 정립한 바 있다(`사이언스 로보틱스(Science Robotics)' 학술지에 발표). 이번 연구는 이 이론에 기반해 인공지능의 오랜 난제 중 하나인 과소적합-과적합 상충 문제를 실제로 풀어낸 최초의 사례로 평가된다.
연구를 통해 개발된 메타 강화학습 모델을 이용하면 간단한 게임을 통해 인간의 유동적 문제 해결 능력을 간접적으로 측정할 수 있다. 더 나아가 스마트 교육이나 중독과 관련된 인지 행동치료에 적용할 경우 상황 변화에 유동적으로 대처하는 인간의 문제 해결 능력 자체를 향상할 수 있을 것으로 기대된다. 차세대 인공지능, 스마트 교육, 인지 행동치료 등 다양한 분야에 파급력이 큰 원천 기술로 최근 국내 및 해외 특허 출원이 완료된 상태다.
연구를 주도한 제1 저자 김동재 박사는 "인간 지능의 특장점에 대한 이해가 얼마나 중요한지 보여주는 연구 중 하나ˮ라고 말했다. 연구 책임자인 이상완 교수는 "인공지능이 우리보다 잘 푸는 문제가 많지만, 반대로 인공지능으로 풀기 어려운 문제들이 우리에게는 정말 쉽게 느껴지는 경우들이 많다. 인간의 다양한 고위 수준 능력을 인공지능 이론 관점에서 형식화하는 연구를 통해 인간 지능의 비밀을 하나씩 풀어나갈 수 있을 것으로 기대된다ˮ라며 "이러한 뇌 기반 인공지능 연구는 인간의 지능을 공학적으로 탐구하는 과정으로 볼 수 있으며, 인간과 인공지능이 서로 도우며 함께 성장해 나갈 수 있는 명확한 기준점을 마련할 수 있을 것ˮ이라고 말했다. 이상완 교수는 뇌 기반 인공지능 연구의 독창성과 도전성을 인정받아 구글 교수 연구상과 IBM 학술상을 받은 바 있다.
연구팀은 과학기술정보통신부의 재원으로 정보통신기획평가원의 지원을 받아 설립한 KAIST 신경과학-인공지능 융합연구센터에서 기반 기술을 활용해 인간 지능을 모사한 차세대 인공지능 모델을 개발하고, 아울러 딥마인드, IBM 인공지능 연구소, MIT, 옥스퍼드 대학 등 국제 공동연구 협약 기관과 공동연구를 통해 기술의 파급력을 높여나갈 계획이라고 말했다.
한편 이번 연구는 삼성전자 미래기술육성센터, 과학기술정보통신부 정보통신기획평가원 및 한국연구재단의 지원을 받아 수행됐다.
2022.01.05 조회수 11928 학습 없이 자발적으로 발생하는 뇌 인지기능 원리 밝혀
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 학습을 전혀 거치지 않은 뇌 신경망에서 선천적인 인지 기능이 발생하는 원리를 규명했다고 30일 밝혔다.
이번 연구 결과는 동물들이 출생 직후 학습을 거치지 않은 상태에서도 기초적 인지 기능들을 수행할 수 있게 하는 `선천적 뇌 기능'에 대한 이해에 다가가는 기초를 마련했으며 `초기 뇌 신경망 인지 기능의 발생'에 대해 기존의 상식과 완전히 다른 시각을 제시한다.
또한 연구팀의 결과는 일반적인 인공지능 모델에서 기능을 발생시키기 위해서는 외부의 데이터 학습이 반드시 요구되는 것과 달리, 생물학적 뇌 신경망의 기능 발생과 진화는 확률적으로 생성되는 물리적 연결 구조에 의해 자발적으로 발생할 수 있다는 차별된 기저 원리를 제안한다.
연구팀은 인지과학 분야에서 활발히 연구돼 온 얼굴 인지 기능(face detection)에 초점을 두어 뇌의 시각 신경망을 모사한 인공신경망에서의 사물 인지 기능을 시뮬레이션했다. 이를 통해 모든 연결 가중치가 무작위로 정해지도록 초기화된 심층신경망이 전혀 학습을 거치지 않은 상태에서도 얼굴 이미지를 다른 사물 이미지와 구별할 수 있음을 발견했다.
연구팀은 이러한 무작위화 신경망에서 발생하는 얼굴 선택성 (face-selectivity)이 실제 동물 실험에서 관측되는 다양한 생물학적, 인지 행동적 특성들과 매우 유사한 양상을 보이는 것을 확인했다. 이는 이론적 모델 기반의 본 연구 결과가 충분한 생물학적 타당성을 가지며, 향후 뇌 신경망에서 나타나는 선천적 인지 기능의 핵심적 발생 원리를 설명하는 일반적인 이론으로 확장될 수 있음을 시사한다.
우리 대학 바이오및뇌공학과 백승대, 송민 박사과정이 공동 제 1저자로 참여한 이번 연구는 국제 학술지 `네이처 (Nature)'의 자매지 `네이처 커뮤니케이션스 (Nature Communications)' 12월 16일 字에 게재됐다. (논문명 : Face Detection in Untrained Deep Neural Networks)
인지 지능의 최초 발생에 관한 연구는 뇌신경과학, 인지과학과 인공지능 분야 모두에서 중요한 주제다. 특히, 별다른 학습 과정 없이 출생 직후부터 다양한 인지 기능을 수행할 수 있게 하는 뇌의 `선천적' 인지 기능은 데이터 입력을 통한 학습에 의존하는 인공신경망의 기능과 뚜렷이 구별되며, 이에 대한 이해는 생물학적 지능의 발생과 진화의 원리를 밝히는 데 결정적인 역할을 할 것으로 기대됐다.
또한 얼굴 인지 기능은 사회적 행동을 하는 다양한 동물 종의 어린 개체들에서 관측되며, 이 기능의 발생을 위해 외부 정보의 학습이 필수적인지는 학계에서 활발하게 논의돼왔다.
연구팀은 앞서 진행했던 연구를 토대로 구축한 신경망 기능 발생 이론에 기반해, 아무런 학습을 거치지 않은 계층적 신경망의 초기 피드 포워드 연결 구조를 통해 얼굴 인지 기능이 자발적으로 형성될 수 있을 것이라 가정했다. 이를 확인하기 위해 수행한 심층신경망 시뮬레이션에서 얼굴 이미지를 비롯한 단순 사물의 인식 기능은 학습을 전혀 거치지 않은 초기 무작위화 신경망에서 자발적으로 발생할 수 있음을 확인했다.
이러한 결과는 학습이 이루어지기 전, 신경망의 초기 구조가 갖춰진 시점에 이미 다양한 인지 기능이 발생할 수 있음을 보여주며, 뇌 과학의 오랜 화두인 지능 형성의 선천성 또는 후천성(nature vs. nurture) 논의와 관련해 자발적으로 발생하는 선천적 기능 발생에 대한 이해의 중요성을 강조한다.
백세범 교수는 "이번 연구는 뇌신경과학 연구의 가장 근본적인 질문 중 하나인 선천적인 인지 기능의 발생을 설명할 수 있는 최초의 이론을 제시해 생물학적 지능의 발생과 진화의 원리를 이해하는데 결정적인 단서를 제공할 것으로 기대된다ˮ며 "한편으로 데이터 학습 기반 인공지능 구현의 방법과 완전히 다른 관점의 생물학적 지능 구현 원리를 정립해 현재의 인공지능 개발의 상식과 완전히 다른 시각을 제공할 수 있을 것으로 기대된다ˮ고 언급했다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST 특이점교수 사업의 지원을 받아 수행됐다.
2021.12.31 조회수 10593
학습 없이 자발적으로 발생하는 뇌 인지기능 원리 밝혀
우리 대학 바이오및뇌공학과 백세범 교수 연구팀이 학습을 전혀 거치지 않은 뇌 신경망에서 선천적인 인지 기능이 발생하는 원리를 규명했다고 30일 밝혔다.
이번 연구 결과는 동물들이 출생 직후 학습을 거치지 않은 상태에서도 기초적 인지 기능들을 수행할 수 있게 하는 `선천적 뇌 기능'에 대한 이해에 다가가는 기초를 마련했으며 `초기 뇌 신경망 인지 기능의 발생'에 대해 기존의 상식과 완전히 다른 시각을 제시한다.
또한 연구팀의 결과는 일반적인 인공지능 모델에서 기능을 발생시키기 위해서는 외부의 데이터 학습이 반드시 요구되는 것과 달리, 생물학적 뇌 신경망의 기능 발생과 진화는 확률적으로 생성되는 물리적 연결 구조에 의해 자발적으로 발생할 수 있다는 차별된 기저 원리를 제안한다.
연구팀은 인지과학 분야에서 활발히 연구돼 온 얼굴 인지 기능(face detection)에 초점을 두어 뇌의 시각 신경망을 모사한 인공신경망에서의 사물 인지 기능을 시뮬레이션했다. 이를 통해 모든 연결 가중치가 무작위로 정해지도록 초기화된 심층신경망이 전혀 학습을 거치지 않은 상태에서도 얼굴 이미지를 다른 사물 이미지와 구별할 수 있음을 발견했다.
연구팀은 이러한 무작위화 신경망에서 발생하는 얼굴 선택성 (face-selectivity)이 실제 동물 실험에서 관측되는 다양한 생물학적, 인지 행동적 특성들과 매우 유사한 양상을 보이는 것을 확인했다. 이는 이론적 모델 기반의 본 연구 결과가 충분한 생물학적 타당성을 가지며, 향후 뇌 신경망에서 나타나는 선천적 인지 기능의 핵심적 발생 원리를 설명하는 일반적인 이론으로 확장될 수 있음을 시사한다.
우리 대학 바이오및뇌공학과 백승대, 송민 박사과정이 공동 제 1저자로 참여한 이번 연구는 국제 학술지 `네이처 (Nature)'의 자매지 `네이처 커뮤니케이션스 (Nature Communications)' 12월 16일 字에 게재됐다. (논문명 : Face Detection in Untrained Deep Neural Networks)
인지 지능의 최초 발생에 관한 연구는 뇌신경과학, 인지과학과 인공지능 분야 모두에서 중요한 주제다. 특히, 별다른 학습 과정 없이 출생 직후부터 다양한 인지 기능을 수행할 수 있게 하는 뇌의 `선천적' 인지 기능은 데이터 입력을 통한 학습에 의존하는 인공신경망의 기능과 뚜렷이 구별되며, 이에 대한 이해는 생물학적 지능의 발생과 진화의 원리를 밝히는 데 결정적인 역할을 할 것으로 기대됐다.
또한 얼굴 인지 기능은 사회적 행동을 하는 다양한 동물 종의 어린 개체들에서 관측되며, 이 기능의 발생을 위해 외부 정보의 학습이 필수적인지는 학계에서 활발하게 논의돼왔다.
연구팀은 앞서 진행했던 연구를 토대로 구축한 신경망 기능 발생 이론에 기반해, 아무런 학습을 거치지 않은 계층적 신경망의 초기 피드 포워드 연결 구조를 통해 얼굴 인지 기능이 자발적으로 형성될 수 있을 것이라 가정했다. 이를 확인하기 위해 수행한 심층신경망 시뮬레이션에서 얼굴 이미지를 비롯한 단순 사물의 인식 기능은 학습을 전혀 거치지 않은 초기 무작위화 신경망에서 자발적으로 발생할 수 있음을 확인했다.
이러한 결과는 학습이 이루어지기 전, 신경망의 초기 구조가 갖춰진 시점에 이미 다양한 인지 기능이 발생할 수 있음을 보여주며, 뇌 과학의 오랜 화두인 지능 형성의 선천성 또는 후천성(nature vs. nurture) 논의와 관련해 자발적으로 발생하는 선천적 기능 발생에 대한 이해의 중요성을 강조한다.
백세범 교수는 "이번 연구는 뇌신경과학 연구의 가장 근본적인 질문 중 하나인 선천적인 인지 기능의 발생을 설명할 수 있는 최초의 이론을 제시해 생물학적 지능의 발생과 진화의 원리를 이해하는데 결정적인 단서를 제공할 것으로 기대된다ˮ며 "한편으로 데이터 학습 기반 인공지능 구현의 방법과 완전히 다른 관점의 생물학적 지능 구현 원리를 정립해 현재의 인공지능 개발의 상식과 완전히 다른 시각을 제공할 수 있을 것으로 기대된다ˮ고 언급했다.
한편 이번 연구는 한국연구재단의 이공분야기초연구사업 및 원천기술개발사업, KAIST 특이점교수 사업의 지원을 받아 수행됐다.
2021.12.31 조회수 10593 아동의 다언어 사용이 뇌 전체 연결망 향상에 미치는 영향 확인
우리 대학 바이오및뇌공학과 정용 교수 연구팀이 미국 예일대학교(Yale University) 심리학과 마빈 천(Marvin M. Chun) 교수 연구팀과 공동연구를 통해 아동기의 외국어 구사 여부가 인지능력을 향상하고 뇌 연결망에 변화를 가져온다고 10일 밝혔다.
연구팀은 미국 국립 보건원(National Institutes of Health, NIH)의 청소년 뇌 인지 발달 연구(the Adolescent Brain Cognitive Development, ABCD Study) 데이터를 사용해 발달단계에 있는 9-10세 아이들의 인지기능 점수와 기능적 자기공명영상(functional magnetic resonance imaging, fMRI)을 분석했다. 모국어 외 다른 언어를 추가로 사용하는 아이들은 모국어만 사용하는 아이들에 비해 기억을 측정하는 인지 과제에서 높은 점수를 보였다. 또한 다언어 사용은 아이들의 뇌 전체 연결망에도 영향을 주는 것으로 확인됐다.
바이오및뇌공학과 권영혜 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `미국국립과학원회보(Proceedings of the National Academy of Sciences of the United States of America, PNAS)' 11월 118권 49호에 출판됐다. (논문명 : Predicting multilingual effects on executive function and individual connectomes in children: an ABCD Study).
뇌는 과제를 수행할 뿐만 아니라 쉬고 있을 때도 특정 영역들이 활성화된다. 기능적 자기공명영상(fMRI)을 통해 활성화되는 각 영역을 관찰할 수 있고, 이 영역들이 서로 어떻게 연결이 돼 있는지 기능적 뇌 연결망(functional connectivity)을 계산할 수 있다.
뇌 모든 영역 간의 연결 패턴을 나타내는 뇌 전체 연결망(whole-brain functional connectivity, connectome)은 사람마다 다르고, 그 사람의 나이, 지능, 인지기능 등 그 사람만의 고유한 특성을 내포하고 있다고 알려져 최근 뇌 과학 분야에서 활발히 연구되고 있다.
연구팀은 뇌의 특정 영역에 국한하지 않고 뇌 전체의 연결망에 초점을 맞춰, 여러 언어를 하는 아이들과 하나의 언어만 사용하는 아이들이 서로 다른 뇌 전체 연결망을 가지는 것을 관찰했다. 기억 관련 과제를 수행할 때 다언어 사용 아이들은 단일언어 사용 아이들에 비해 뇌 후두엽(occipital lobe)과 피질하 영역(subcortical area)간 강한 연결망을 보였다. 아이들이 아무 과제를 수행하지 않는 휴지기(resting state)에도 두 그룹 간 차이가 관찰됐는데, 다언어 사용 아이들에게서 뇌 후두엽과 전전두엽(prefrontal cortex)간 강한 연결성을 보였다.
더 나아가 연구팀은 기계학습을 통해 아이들이 기억 관련 과제를 수행할 때와 휴지기일 때 나타나는 뇌 전체 연결망만으로 그 아이가 여러 언어를 사용하는지 한 언어를 사용하는지를 성공적으로 예측할 수 있었다. 또한 다언어 사용 아이들이 기억 관련 과제를 수행할 때 관찰되는 기억 관련 연결망만으로 그 아이들이 해당 과제에서 어떤 점수를 얻었는지 예측할 수 있었다. 단일 언어사용 아이들에게서는 이러한 현상이 발견되지 않았는데, 이는 다언어 사용 아이들의 뇌 전체 연결망이 그들의 행동과 더 밀접한 관계를 맺고 있다는 것을 시사한다.
연구팀은 이번 연구를 통해 발달단계에 있는 9-10세 아이들의 다언어 사용 여부가 뇌 전체 연결망에 변화를 주는 것을 확인했다. 이 연구를 바탕으로 다언어 사용의 영향이 발달단계를 거치며 성인이 될 때까지 어떻게 변화하는지 이해하는 데 도움이 될 것으로 기대한다. 더 나아가 다언어 사용은 알츠하이머와 같은 퇴행성 뇌질환에 동반되는 인지기능 저하를 방어하는 뇌인지 예비능(cognitive reserve)을 가져오는데, 이 현상을 연구하는 데 도움이 될 것으로 기대된다.
제1 저자인 권영혜 박사과정은 "성인보다 언어사용 기간이 짧은 9-10세 아이들에게서도 여러 언어의 사용이 인지기능과 뇌 연결 패턴에 영향을 주는 것을 확인하였다ˮ 라며 "어렸을 때부터 형성된 이러한 차이가 시간이 흐르면서 어떠한 형태로 자리 잡아 성인이 되었을 때 그리고 노인이 되어서까지 영향을 주는지를 이해하는 데 도움이 되길 바란다ˮ 라고 말했다.
이번 연구는 한국연구재단, 산업통상자원부, 미국 국립 보건원 지원을 받아 수행됐다.
2021.12.10 조회수 11656
아동의 다언어 사용이 뇌 전체 연결망 향상에 미치는 영향 확인
우리 대학 바이오및뇌공학과 정용 교수 연구팀이 미국 예일대학교(Yale University) 심리학과 마빈 천(Marvin M. Chun) 교수 연구팀과 공동연구를 통해 아동기의 외국어 구사 여부가 인지능력을 향상하고 뇌 연결망에 변화를 가져온다고 10일 밝혔다.
연구팀은 미국 국립 보건원(National Institutes of Health, NIH)의 청소년 뇌 인지 발달 연구(the Adolescent Brain Cognitive Development, ABCD Study) 데이터를 사용해 발달단계에 있는 9-10세 아이들의 인지기능 점수와 기능적 자기공명영상(functional magnetic resonance imaging, fMRI)을 분석했다. 모국어 외 다른 언어를 추가로 사용하는 아이들은 모국어만 사용하는 아이들에 비해 기억을 측정하는 인지 과제에서 높은 점수를 보였다. 또한 다언어 사용은 아이들의 뇌 전체 연결망에도 영향을 주는 것으로 확인됐다.
바이오및뇌공학과 권영혜 박사과정이 제1 저자로 참여한 이번 연구는 국제 학술지 `미국국립과학원회보(Proceedings of the National Academy of Sciences of the United States of America, PNAS)' 11월 118권 49호에 출판됐다. (논문명 : Predicting multilingual effects on executive function and individual connectomes in children: an ABCD Study).
뇌는 과제를 수행할 뿐만 아니라 쉬고 있을 때도 특정 영역들이 활성화된다. 기능적 자기공명영상(fMRI)을 통해 활성화되는 각 영역을 관찰할 수 있고, 이 영역들이 서로 어떻게 연결이 돼 있는지 기능적 뇌 연결망(functional connectivity)을 계산할 수 있다.
뇌 모든 영역 간의 연결 패턴을 나타내는 뇌 전체 연결망(whole-brain functional connectivity, connectome)은 사람마다 다르고, 그 사람의 나이, 지능, 인지기능 등 그 사람만의 고유한 특성을 내포하고 있다고 알려져 최근 뇌 과학 분야에서 활발히 연구되고 있다.
연구팀은 뇌의 특정 영역에 국한하지 않고 뇌 전체의 연결망에 초점을 맞춰, 여러 언어를 하는 아이들과 하나의 언어만 사용하는 아이들이 서로 다른 뇌 전체 연결망을 가지는 것을 관찰했다. 기억 관련 과제를 수행할 때 다언어 사용 아이들은 단일언어 사용 아이들에 비해 뇌 후두엽(occipital lobe)과 피질하 영역(subcortical area)간 강한 연결망을 보였다. 아이들이 아무 과제를 수행하지 않는 휴지기(resting state)에도 두 그룹 간 차이가 관찰됐는데, 다언어 사용 아이들에게서 뇌 후두엽과 전전두엽(prefrontal cortex)간 강한 연결성을 보였다.
더 나아가 연구팀은 기계학습을 통해 아이들이 기억 관련 과제를 수행할 때와 휴지기일 때 나타나는 뇌 전체 연결망만으로 그 아이가 여러 언어를 사용하는지 한 언어를 사용하는지를 성공적으로 예측할 수 있었다. 또한 다언어 사용 아이들이 기억 관련 과제를 수행할 때 관찰되는 기억 관련 연결망만으로 그 아이들이 해당 과제에서 어떤 점수를 얻었는지 예측할 수 있었다. 단일 언어사용 아이들에게서는 이러한 현상이 발견되지 않았는데, 이는 다언어 사용 아이들의 뇌 전체 연결망이 그들의 행동과 더 밀접한 관계를 맺고 있다는 것을 시사한다.
연구팀은 이번 연구를 통해 발달단계에 있는 9-10세 아이들의 다언어 사용 여부가 뇌 전체 연결망에 변화를 주는 것을 확인했다. 이 연구를 바탕으로 다언어 사용의 영향이 발달단계를 거치며 성인이 될 때까지 어떻게 변화하는지 이해하는 데 도움이 될 것으로 기대한다. 더 나아가 다언어 사용은 알츠하이머와 같은 퇴행성 뇌질환에 동반되는 인지기능 저하를 방어하는 뇌인지 예비능(cognitive reserve)을 가져오는데, 이 현상을 연구하는 데 도움이 될 것으로 기대된다.
제1 저자인 권영혜 박사과정은 "성인보다 언어사용 기간이 짧은 9-10세 아이들에게서도 여러 언어의 사용이 인지기능과 뇌 연결 패턴에 영향을 주는 것을 확인하였다ˮ 라며 "어렸을 때부터 형성된 이러한 차이가 시간이 흐르면서 어떠한 형태로 자리 잡아 성인이 되었을 때 그리고 노인이 되어서까지 영향을 주는지를 이해하는 데 도움이 되길 바란다ˮ 라고 말했다.
이번 연구는 한국연구재단, 산업통상자원부, 미국 국립 보건원 지원을 받아 수행됐다.
2021.12.10 조회수 11656 사물인터넷 기반 다수의 뇌 신경회로 동시 원격제어 시스템 개발
우리 연구진이 인터넷을 이용해 뇌 신경회로를 원격 제어할 수 있는 무선 네트워크 기술을 개발했다. 이 기술을 활용하면 시간과 장소에 구애받지 않고 목표 동물의 뇌 신경회로를 정교하게 제어할 수 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 미국 워싱턴 대학교(Washington University in St. Louis), 미국 콜로라도 대학교(University of Colorado Boulder) 연구팀과의 공동 연구를 통해 사물인터넷 기반의 뇌 신경회로 원격제어 시스템을 개발했다고 8일 밝혔다.
이번 개발 기술은 많은 시간과 인력이 있어야 하는 뇌 연구 및 다양한 신경과학 연구를 자동화시켜 다양한 퇴행성 뇌 질환과 정신질환의 발병 기전 규명과 치료법 개발의 가속화에 크게 기여할 것으로 기대된다. 또한, 먼 거리에 있는 환자의 질환을 원격으로 치료하는 원격 의료 구현에도 활용될 수 있을 것으로 예상된다.
우리 대학 전기및전자공학부 라자 콰지(Raza Qazi) 연구원과 김충연 박사과정, 그리고 워싱턴대 카일 파커(Kyle E. Parker) 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)' 11월 25일 字에 게재됐다. (논문명 : Scalable and modular wireless-network infrastructure for large-scale behavioural neuroscience)
전 세계적으로 고령화 시대에 접어드는 현 상황에서 알츠하이머병, 파킨슨병과 같은 뇌 질환들로 고통받는 환자 수가 급증하고 있다. 이에 따라 근본적인 뇌 질환 치료법을 개발하기 위해 뇌 기능 및 뇌 질환 발병기전을 규명하기 위한 뇌 연구가 매우 시급하지만, 뇌 연구의 진행 속도가 뇌 질환 환자의 증가 속도를 따라잡지 못하고 있어서 뇌 연구의 효율성을 극대화하기 위한 새로운 기술 개발이 절실히 요구된다.
기존 뇌 연구에 사용되던 대부분의 신경과학 장치들은 외부 장비와 선으로 연결된 유선 방식으로 구동됐지만, 이러한 방식은 피실험 동물들을 물리적으로 제약할 뿐 아니라 실험 진행자의 직접적인 개입이 불가피해 피실험 동물의 행동에 영향을 주는 `관찰자 효과'를 발생시켜서 정확한 뇌 연구 결과 도출을 어렵게 만든다. 아울러 모든 과정에서 실험자의 직접적인 조작이 요구돼 연구에 많은 시간과 인력, 비용이 발생하게 한다.
연구팀은 사물인터넷(Internet of Things; IoT) 기술을 접목해 다양한 다수의 뇌 이식용 기기들을 인터넷 원격으로 동시 제어하거나 예약된 스케줄에 따라 기기들이 자동으로 구동되도록 하는 무선 네트워크 시스템을 개발했다. 이를 통해 시간과 장소에 상관없이 목표 동물들의 특정 뇌 회로를 원격 제어하는 것을 가능하게 했다. 이 시스템은 사용자가 인터넷 웹사이트 기반의 무선 네트워크 플랫폼을 통해 뇌 이식용 장치의 원격제어, 자동화된 데이터 수집, 뇌 회로 제어 스케줄링 등의 다양한 기능을 손쉽게 구현할 수 있도록 설계됐다.
연구팀은 이 시스템의 뇌 신경회로 자동 원격제어 기능을 사용해 자체 제작한 무선 장치(뉴럴 임플란트)가 이식된 수십 마리의 쥐의 뇌 신경회로를 광유전학적 방법으로 사람의 개입 없이 정교하게 원격 자동 제어함으로써, 완전 자동화된 뇌 연구 실험에 적용 가능함을 입증했다. 이 실험을 통해 쥐의 먹이 섭취량, 활동량, 그리고 다른 쥐들과의 사회적 상호작용 빈도를 성공적으로 조절함으로써, 예약이 설정된 대로 다수 동물의 뇌 신경회로를 동시에 독립적으로 원격 제어할 수 있음을 보였다.
정 교수는 "개발된 원격제어 기술은 동물을 활용한 뇌 연구에 필요한 인간개입을 최소화함으로써 뇌 연구의 효율을 높이고 실험의 불확실성을 크게 줄일 수 있을 것ˮ이라며 "이 기술은 뇌 연구를 넘어, 많은 동물 실험을 필요로 하는 신약 개발, 병원 방문 없이 뇌 질환 및 다양한 질병을 치료하기 위한 원격 의료 구현에도 적용될 수 있을 것이다ˮ라고 말했다.
연구팀은 이 기술이 더욱 광범위하게 뇌 과학 연구 및 치료에 사용될 수 있게 하도록, 인공지능 기반의 실시간 뇌파 원격 모니터링 기술을 개발해 본 시스템과 접목하기 위한 연구를 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 연구사업, 한국연구재단이 추진하는 중견연구자지원사업 및 바이오의료기술개발사업, 미국 국립보건원의 지원을 받아 수행됐다.
2021.12.08 조회수 12481
사물인터넷 기반 다수의 뇌 신경회로 동시 원격제어 시스템 개발
우리 연구진이 인터넷을 이용해 뇌 신경회로를 원격 제어할 수 있는 무선 네트워크 기술을 개발했다. 이 기술을 활용하면 시간과 장소에 구애받지 않고 목표 동물의 뇌 신경회로를 정교하게 제어할 수 있다.
우리 대학 전기및전자공학부 정재웅 교수 연구팀이 미국 워싱턴 대학교(Washington University in St. Louis), 미국 콜로라도 대학교(University of Colorado Boulder) 연구팀과의 공동 연구를 통해 사물인터넷 기반의 뇌 신경회로 원격제어 시스템을 개발했다고 8일 밝혔다.
이번 개발 기술은 많은 시간과 인력이 있어야 하는 뇌 연구 및 다양한 신경과학 연구를 자동화시켜 다양한 퇴행성 뇌 질환과 정신질환의 발병 기전 규명과 치료법 개발의 가속화에 크게 기여할 것으로 기대된다. 또한, 먼 거리에 있는 환자의 질환을 원격으로 치료하는 원격 의료 구현에도 활용될 수 있을 것으로 예상된다.
우리 대학 전기및전자공학부 라자 콰지(Raza Qazi) 연구원과 김충연 박사과정, 그리고 워싱턴대 카일 파커(Kyle E. Parker) 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)' 11월 25일 字에 게재됐다. (논문명 : Scalable and modular wireless-network infrastructure for large-scale behavioural neuroscience)
전 세계적으로 고령화 시대에 접어드는 현 상황에서 알츠하이머병, 파킨슨병과 같은 뇌 질환들로 고통받는 환자 수가 급증하고 있다. 이에 따라 근본적인 뇌 질환 치료법을 개발하기 위해 뇌 기능 및 뇌 질환 발병기전을 규명하기 위한 뇌 연구가 매우 시급하지만, 뇌 연구의 진행 속도가 뇌 질환 환자의 증가 속도를 따라잡지 못하고 있어서 뇌 연구의 효율성을 극대화하기 위한 새로운 기술 개발이 절실히 요구된다.
기존 뇌 연구에 사용되던 대부분의 신경과학 장치들은 외부 장비와 선으로 연결된 유선 방식으로 구동됐지만, 이러한 방식은 피실험 동물들을 물리적으로 제약할 뿐 아니라 실험 진행자의 직접적인 개입이 불가피해 피실험 동물의 행동에 영향을 주는 `관찰자 효과'를 발생시켜서 정확한 뇌 연구 결과 도출을 어렵게 만든다. 아울러 모든 과정에서 실험자의 직접적인 조작이 요구돼 연구에 많은 시간과 인력, 비용이 발생하게 한다.
연구팀은 사물인터넷(Internet of Things; IoT) 기술을 접목해 다양한 다수의 뇌 이식용 기기들을 인터넷 원격으로 동시 제어하거나 예약된 스케줄에 따라 기기들이 자동으로 구동되도록 하는 무선 네트워크 시스템을 개발했다. 이를 통해 시간과 장소에 상관없이 목표 동물들의 특정 뇌 회로를 원격 제어하는 것을 가능하게 했다. 이 시스템은 사용자가 인터넷 웹사이트 기반의 무선 네트워크 플랫폼을 통해 뇌 이식용 장치의 원격제어, 자동화된 데이터 수집, 뇌 회로 제어 스케줄링 등의 다양한 기능을 손쉽게 구현할 수 있도록 설계됐다.
연구팀은 이 시스템의 뇌 신경회로 자동 원격제어 기능을 사용해 자체 제작한 무선 장치(뉴럴 임플란트)가 이식된 수십 마리의 쥐의 뇌 신경회로를 광유전학적 방법으로 사람의 개입 없이 정교하게 원격 자동 제어함으로써, 완전 자동화된 뇌 연구 실험에 적용 가능함을 입증했다. 이 실험을 통해 쥐의 먹이 섭취량, 활동량, 그리고 다른 쥐들과의 사회적 상호작용 빈도를 성공적으로 조절함으로써, 예약이 설정된 대로 다수 동물의 뇌 신경회로를 동시에 독립적으로 원격 제어할 수 있음을 보였다.
정 교수는 "개발된 원격제어 기술은 동물을 활용한 뇌 연구에 필요한 인간개입을 최소화함으로써 뇌 연구의 효율을 높이고 실험의 불확실성을 크게 줄일 수 있을 것ˮ이라며 "이 기술은 뇌 연구를 넘어, 많은 동물 실험을 필요로 하는 신약 개발, 병원 방문 없이 뇌 질환 및 다양한 질병을 치료하기 위한 원격 의료 구현에도 적용될 수 있을 것이다ˮ라고 말했다.
연구팀은 이 기술이 더욱 광범위하게 뇌 과학 연구 및 치료에 사용될 수 있게 하도록, 인공지능 기반의 실시간 뇌파 원격 모니터링 기술을 개발해 본 시스템과 접목하기 위한 연구를 계획하고 있다.
한편 이번 연구는 KAIST 글로벌 특이점 연구사업, 한국연구재단이 추진하는 중견연구자지원사업 및 바이오의료기술개발사업, 미국 국립보건원의 지원을 받아 수행됐다.
2021.12.08 조회수 12481 빛으로 뇌 기능, 행동, 감정을 자유롭게 조절한다
우리 대학 생명과학과 허원도 교수 연구팀은 빛으로 뇌 기능 및 행동을 자유자재로 조절하는 광유전학 기술인 ‘Opto-vTrap(옵토-브이트랩)’을 개발했다. 나아가 동물실험을 통해 뇌 활성 뿐 아니라 활동과 감정까지 조절할 수 있음을 확인했다.
뇌 활성은 신경세포와 신경교세포와 같은 뇌세포들이 서로 신호를 주고받으며 조절된다. 이 같은 상호작용은 뇌 세포 내 ‘소낭’안에 담긴 신경전달물질 분비를 통해 이루어진다. 소낭이 뇌 활성을 조절하는 사령관인 셈이다. 뇌 활성 조절은 뇌 연구를 위한 필수 기술이다. 뇌의 특정 부위나 세포의 활성을 촉진 및 억제해보면 특정 뇌 부위가 담당하는 기능, 여러 뇌 부위 간 상호작용의 역할, 특정 상황에서 다양한 뇌세포의 기능 등 특정 상황에서 뇌 작동이 어떠한 원리로 일어나는지 밝힐 수 있기 때문이다.
그러나 기존 뇌 활성 조절 기술은 원하는 시점에 특정 뇌세포의 활성을 자유롭게 조절하기 어려웠다. 지금까지는 세포 전위차 조절 방식을 사용하였는데, 이는 주변 환경의 산성도를 변화시키거나 원하지 않는 다른 자극을 유발할 뿐만 아니라 전위차에 반응하지 않는 세포에는 사용하지 못하는 한계가 있었다. 이번에 개발한 Opto-vTrap 기술은 세포 소낭을 직접 특이적으로 조절할 수 있어 원하는 시점에 다양한 종류의 뇌세포에서 이용이 가능하다.
연구진은 신경전달물질 분비를 직접 조절하고자 세포에 빛을 쪼이면 순간적으로 내부에 올가미처럼 트랩을 만드는 자체 개발 원천기술을 응용, 소낭에 적용했다. Opto-vTrap을 발현하는 세포나 조직에 빛(청색광)을 가하면 소낭 내 광수용체 단백질들이 엉겨 붙으며 소낭이 트랩 안에 포획되고 신경전달물질 분비가 억제된다. 요컨대 Opto-vTrap으로 소낭의 신호전달물질 분비를 직접 제어하여 뇌 활성을 자유롭게 조절하는 것이다. 연구진은 세포와 조직실험에서 나아가 Opto-vTrap 바이러스를 이용한 동물실험을 통해 뇌세포 신호전달 뿐만 아니라 기억·감정·행동도 조절 가능함을 확인하였다.
Opto-vTrap을 이용하면 뇌의 여러 부위간 복합적 상호작용 원리를 밝히고, 뇌세포 형태별 뇌 기능에 미치는 영향을 연구하는 데 유용하게 활용될 것으로 기대된다.
허원도 교수는 “Opto-vTrap은 신경세포와 신경교세포 모두에 잘 작동되기에 향후 다양한 뇌과학 연구 분야에 이용되리라 기대한다” 며 “앞으로 본 기술을 활용하여 특정 뇌세포의 시공간적 기능 연구를 진행하고자 한다.”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 중견연구과제 및 KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
이번 연구 결과는 뇌 과학 학술지 뉴런 (Neuron, IF:17.173) 에 12월 1일(수) 1시(한국시간) 게재됐다.
2021.12.03 조회수 10171
빛으로 뇌 기능, 행동, 감정을 자유롭게 조절한다
우리 대학 생명과학과 허원도 교수 연구팀은 빛으로 뇌 기능 및 행동을 자유자재로 조절하는 광유전학 기술인 ‘Opto-vTrap(옵토-브이트랩)’을 개발했다. 나아가 동물실험을 통해 뇌 활성 뿐 아니라 활동과 감정까지 조절할 수 있음을 확인했다.
뇌 활성은 신경세포와 신경교세포와 같은 뇌세포들이 서로 신호를 주고받으며 조절된다. 이 같은 상호작용은 뇌 세포 내 ‘소낭’안에 담긴 신경전달물질 분비를 통해 이루어진다. 소낭이 뇌 활성을 조절하는 사령관인 셈이다. 뇌 활성 조절은 뇌 연구를 위한 필수 기술이다. 뇌의 특정 부위나 세포의 활성을 촉진 및 억제해보면 특정 뇌 부위가 담당하는 기능, 여러 뇌 부위 간 상호작용의 역할, 특정 상황에서 다양한 뇌세포의 기능 등 특정 상황에서 뇌 작동이 어떠한 원리로 일어나는지 밝힐 수 있기 때문이다.
그러나 기존 뇌 활성 조절 기술은 원하는 시점에 특정 뇌세포의 활성을 자유롭게 조절하기 어려웠다. 지금까지는 세포 전위차 조절 방식을 사용하였는데, 이는 주변 환경의 산성도를 변화시키거나 원하지 않는 다른 자극을 유발할 뿐만 아니라 전위차에 반응하지 않는 세포에는 사용하지 못하는 한계가 있었다. 이번에 개발한 Opto-vTrap 기술은 세포 소낭을 직접 특이적으로 조절할 수 있어 원하는 시점에 다양한 종류의 뇌세포에서 이용이 가능하다.
연구진은 신경전달물질 분비를 직접 조절하고자 세포에 빛을 쪼이면 순간적으로 내부에 올가미처럼 트랩을 만드는 자체 개발 원천기술을 응용, 소낭에 적용했다. Opto-vTrap을 발현하는 세포나 조직에 빛(청색광)을 가하면 소낭 내 광수용체 단백질들이 엉겨 붙으며 소낭이 트랩 안에 포획되고 신경전달물질 분비가 억제된다. 요컨대 Opto-vTrap으로 소낭의 신호전달물질 분비를 직접 제어하여 뇌 활성을 자유롭게 조절하는 것이다. 연구진은 세포와 조직실험에서 나아가 Opto-vTrap 바이러스를 이용한 동물실험을 통해 뇌세포 신호전달 뿐만 아니라 기억·감정·행동도 조절 가능함을 확인하였다.
Opto-vTrap을 이용하면 뇌의 여러 부위간 복합적 상호작용 원리를 밝히고, 뇌세포 형태별 뇌 기능에 미치는 영향을 연구하는 데 유용하게 활용될 것으로 기대된다.
허원도 교수는 “Opto-vTrap은 신경세포와 신경교세포 모두에 잘 작동되기에 향후 다양한 뇌과학 연구 분야에 이용되리라 기대한다” 며 “앞으로 본 기술을 활용하여 특정 뇌세포의 시공간적 기능 연구를 진행하고자 한다.”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 중견연구과제 및 KAIST 글로벌 특이점 연구사업의 지원을 받아 수행됐다.
이번 연구 결과는 뇌 과학 학술지 뉴런 (Neuron, IF:17.173) 에 12월 1일(수) 1시(한국시간) 게재됐다.
2021.12.03 조회수 10171 하이드로젤 기반 유연성 뇌-기계 인터페이스 개발
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 메사추세츠 공과대학(MIT) 폴리나 아니키바(Polina Anikeeva) 교수, 쏸허 자오(Xuanhe Zhao) 교수, 육현우 박사 공동 연구팀과 함께 *하이드로젤 기반의 유연성 뇌-기계 인터페이스를 개발하는 데 성공했다고 21일 밝혔다.
☞ 하이드로젤: 물과 젤리가 합쳐진 합성어이며 주로 필러, 보톡스, 화장품에 쓰이는 반고체 상태의 물질이다. 인공적인 인체 조직을 만드는 원료로 적합해 의학적으로도 널리 쓰인다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 2021년 6월 8일 字로 출판됐다. (논문명: Adaptive and multifunctional hydrogel hybrid probes for long-term sensing and modulation of neural activity)
뇌 구조를 연구하거나 뇌 신경 질환의 메커니즘을 파악, 치료하기 위해서는, 실시간으로 뇌를 자극하고 신호를 측정할 수 있는 인터페이스의 개발이 필수적이다. 그러나 기존의 신경 인터페이스는 기계적, 화학적 특성이 뇌 조직과 너무 달라서 일어나는 이물 반응(foreign body response) 때문에, 주변에 절연세포층이 형성돼 그 수명이 매우 짧아진다는 문제점을 가지고 있었다.
연구팀은 해당 문제의 해결을 위해, 직접 제작한 다기능성 파이버 다발을 하이드로젤 몸체에 넣는 방법을 이용해 `뇌 모사형 신경 인터페이스'를 제작했다. 해당 장치는 빛으로 특정 신경세포종만을 자극할 수 있는 광유전학 기술을 적용하기 위한 광섬유뿐만 아니라, 뇌에서 신호를 읽을 수 있는 전극 다발, 약물을 뇌 속으로 전달할 수 있는 미세 유체 채널을 모두 보유하고 있다.
해당 인터페이스는 하이드로젤 몸체를 건조시킨 상태에서는 단단한 성질이 고분자와 유사해 몸체에 삽입하기가 쉽다. 하지만 몸에 들어가면 체내의 수분을 빠르게 흡수해. 부드럽고 수분이 풍부한 주변 조직과 유사한 상태가 되므로 이물 반응을 최소화할 수 있다.
연구팀은 이러한 특성을 가진 장치를 동물 모델에 직접 적용해, 기존의 기록을 훨씬 뛰어넘는 삽입 후 6개월까지도 뇌 신호를 측정할 수 있음을 보였다. 또한 자유롭게 움직이는 쥐를 대상으로 초장기간 광유전학 실험, 행동 실험 등이 가능하며, 이물 반응에 의한 아교세포 및 면역세포의 발현이 기존 장치보다 현저히 줄어듦을 증명했다.
박성준 교수는 "이번 연구는 최초로 하이드로젤을 다기능 신경 인터페이스의 구성물질로 사용해 그 수명을 대폭 상승시켰다는 데에 의의가 있으며, 해당 연구를 통해 향후 알츠하이머병, 파킨슨병 등 초장기간 관찰이 필요한 뇌 신경 질환 연구가 더욱 발전할 수 있을 것으로 기대된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 신진연구사업, 범부처의료기기개발 사업, 나노소재원천기술개발사업, 차세대 지능형 반도체 개발사업, KK-JRC 스마트 프로젝트, 카이스트 글로벌 이니셔티브 프로그램, 포스트 인공지능(Post-AI) 프로젝트 사업의 지원을 받아 수행됐다.
2021.06.21 조회수 32595
하이드로젤 기반 유연성 뇌-기계 인터페이스 개발
우리 대학 바이오및뇌공학과 박성준 교수 연구팀이 메사추세츠 공과대학(MIT) 폴리나 아니키바(Polina Anikeeva) 교수, 쏸허 자오(Xuanhe Zhao) 교수, 육현우 박사 공동 연구팀과 함께 *하이드로젤 기반의 유연성 뇌-기계 인터페이스를 개발하는 데 성공했다고 21일 밝혔다.
☞ 하이드로젤: 물과 젤리가 합쳐진 합성어이며 주로 필러, 보톡스, 화장품에 쓰이는 반고체 상태의 물질이다. 인공적인 인체 조직을 만드는 원료로 적합해 의학적으로도 널리 쓰인다.
이번 연구 결과는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)'에 2021년 6월 8일 字로 출판됐다. (논문명: Adaptive and multifunctional hydrogel hybrid probes for long-term sensing and modulation of neural activity)
뇌 구조를 연구하거나 뇌 신경 질환의 메커니즘을 파악, 치료하기 위해서는, 실시간으로 뇌를 자극하고 신호를 측정할 수 있는 인터페이스의 개발이 필수적이다. 그러나 기존의 신경 인터페이스는 기계적, 화학적 특성이 뇌 조직과 너무 달라서 일어나는 이물 반응(foreign body response) 때문에, 주변에 절연세포층이 형성돼 그 수명이 매우 짧아진다는 문제점을 가지고 있었다.
연구팀은 해당 문제의 해결을 위해, 직접 제작한 다기능성 파이버 다발을 하이드로젤 몸체에 넣는 방법을 이용해 `뇌 모사형 신경 인터페이스'를 제작했다. 해당 장치는 빛으로 특정 신경세포종만을 자극할 수 있는 광유전학 기술을 적용하기 위한 광섬유뿐만 아니라, 뇌에서 신호를 읽을 수 있는 전극 다발, 약물을 뇌 속으로 전달할 수 있는 미세 유체 채널을 모두 보유하고 있다.
해당 인터페이스는 하이드로젤 몸체를 건조시킨 상태에서는 단단한 성질이 고분자와 유사해 몸체에 삽입하기가 쉽다. 하지만 몸에 들어가면 체내의 수분을 빠르게 흡수해. 부드럽고 수분이 풍부한 주변 조직과 유사한 상태가 되므로 이물 반응을 최소화할 수 있다.
연구팀은 이러한 특성을 가진 장치를 동물 모델에 직접 적용해, 기존의 기록을 훨씬 뛰어넘는 삽입 후 6개월까지도 뇌 신호를 측정할 수 있음을 보였다. 또한 자유롭게 움직이는 쥐를 대상으로 초장기간 광유전학 실험, 행동 실험 등이 가능하며, 이물 반응에 의한 아교세포 및 면역세포의 발현이 기존 장치보다 현저히 줄어듦을 증명했다.
박성준 교수는 "이번 연구는 최초로 하이드로젤을 다기능 신경 인터페이스의 구성물질로 사용해 그 수명을 대폭 상승시켰다는 데에 의의가 있으며, 해당 연구를 통해 향후 알츠하이머병, 파킨슨병 등 초장기간 관찰이 필요한 뇌 신경 질환 연구가 더욱 발전할 수 있을 것으로 기대된다ˮ 라고 말했다.
한편 이번 연구는 한국연구재단 신진연구사업, 범부처의료기기개발 사업, 나노소재원천기술개발사업, 차세대 지능형 반도체 개발사업, KK-JRC 스마트 프로젝트, 카이스트 글로벌 이니셔티브 프로그램, 포스트 인공지능(Post-AI) 프로젝트 사업의 지원을 받아 수행됐다.
2021.06.21 조회수 32595 신경세포의 흥분성 증가로 인한 뇌 질환 기제 규명
관련 유튜브 영상 링크 : https://www.youtube.com/watch?v=dwV_Xs7tHEY&t=13s
우리 연구진이 뇌 신경세포의 흥분과 억제 불균형을 일으키는 새로운 기전을 규명했다. 이는 발작과 같은 다양한 뇌 신경질환의 원인과 연결되며, 뇌 질환 치료에 활용이 기대된다.
우리 대학 생명과학과 정원석 교수와 박정주 박사과정 연구팀이 억제성 시냅스가 *미세아교세포에 의해 제거되는 분자 기전을 처음으로 밝히고, 이 현상이 과도하게 일어날 때 신경세포의 흥분성 증가로 발작과 같은 뇌 질환이 일어날 수 있음을 증명해 국제학술지 `엠보저널(EMBO Journal)'에 공개했다고 2일 밝혔다.
☞ 미세아교세포(microgila): 뇌에서 면역기능을 담당하는 신경세포의 일종이다. 뇌와 척추 전역에 분포돼 있으며, 정상적인 뇌 기능을 수행하도록 핵심적인 역할을 한다.
*시냅스는 뇌 발달 및 학습 시에 생성과 제거가 반복되는 변화를 겪는다. 정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포와 미세아교세포가 신경세포의 불필요한 시냅스를 잡아먹어 제거할 수 있음을 밝힌 바 있다. 하지만, 이 과정에서 어떤 물질이 특정 시냅스를 표지해 교세포들로 하여금 제거하도록 유도하는지는 알려지지 않았다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
연구팀은 포스파티딜세린 (phosphatidylserine)이라는 세포막에 존재하는 인지질 중의 하나가 죽어가는 세포 표면에 선택적으로 표지돼 면역세포에 의해 세포를 잡아먹도록 유도한다는 사실에 착안했다. 죽어가는 세포가 제거되는 분자 기전이 시냅스만이 선택적으로 제거되는 현상에도 응용될 수 있을 것이라 예상한 것이다.
이 가정을 증명하기 위해 연구팀은 포스파티딜세린을 신경세포 표면에 인위적으로 노출한 후, 특정 시냅스가 교세포에 의해 잡아먹힐 수 있는지 연구했다.
먼저 연구팀은 포스파티딜세린을 항상 세포 표면으로부터 안으로 지속적으로 불러들여 정상 세포막에서 이들을 노출되지 않도록 막고 있는 플립파아제(Flippase)라는 단백질의 기능을 신경세포에서만 억제할 수 있는 실험용 쥐 모델을 제작했다.
그 결과 놀랍게도 신경세포의 세포체 주변의 표면에서만 선택적으로 포스파티딜세린이 표지됨을 발견했고 이로 인해 세포막이나 흥분성 시냅스의 손상 없이 억제성 시냅스만이 선택적으로 감소함을 발견했다. 그뿐만 아니라 해당 쥐 모델은 청각을 담당하는 뇌 지역에서 흥분-억제 균형이 깨져서 소리로 인해 촉발되는 특이한 발작 증세를 일으킴을 확인했다.
더 나아가 연구팀은 미세아교세포를 인위적으로 제거하거나 미세아교세포에 존재하는 특정 포식 수용체를 제거했을 때, 신경세포의 표면에 포스파티딜세린이 표지되었을지라도 과도한 억제성 시냅스 감소와 발작 증세가 방지될 수 있음을 발견했다.
이로써 신경세포체 주변 세포막에 포스파티딜세린이 표지되는 것이 미세아교세포가 포식 수용체를 통해 억제성 시냅스만을 선택적으로 먹는 기전으로 쓰일 수 있음을 최초로 규명한 것이다.
연구팀의 이 같은 발견은 흥분성 및 억제성 시냅스가 서로 다른 기전을 통해 미세아교세포에 의해 제거될 수 있음을 처음으로 제시한 것이며, 미세아교세포에 의한 과도한 억제성 시냅스 제거 기전이 뇌 신경세포의 흥분-억제 불균형 발생의 새로운 원인이 될 수 있음을 증명한 것이다.
연구팀 관계자는 "비정상적인 억제성 시냅스 수 변화는 발작, 자폐 스펙트럼 장애, 조현병, 치매 등과 같은 다양한 뇌 질환의 유병률과 연관성이 높다ˮ며 "뇌에서의 흥분-억제 균형이 깨져서 일어나는 다양한 뇌 신경질환에서 미세아교세포가 억제성 시냅스를 먹는 현상을 조절하는 것이 이들 질환을 치료하는 새로운 전략이 될 것이다ˮ고 말했다.
우리 대학 생명과학과 박정주 박사과정이 제1 저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 `엠보저널(EMBO Journal)'에 지난 5월 20일 字 공개됐다. (논문명: Microglial MERTK eliminates phosphatidylserine-displaying inhibitory post-synapses)
한편, 이번 연구는 삼성미래기술육성재단의 도움을 받아 진행됐다.
2021.06.03 조회수 60760
신경세포의 흥분성 증가로 인한 뇌 질환 기제 규명
관련 유튜브 영상 링크 : https://www.youtube.com/watch?v=dwV_Xs7tHEY&t=13s
우리 연구진이 뇌 신경세포의 흥분과 억제 불균형을 일으키는 새로운 기전을 규명했다. 이는 발작과 같은 다양한 뇌 신경질환의 원인과 연결되며, 뇌 질환 치료에 활용이 기대된다.
우리 대학 생명과학과 정원석 교수와 박정주 박사과정 연구팀이 억제성 시냅스가 *미세아교세포에 의해 제거되는 분자 기전을 처음으로 밝히고, 이 현상이 과도하게 일어날 때 신경세포의 흥분성 증가로 발작과 같은 뇌 질환이 일어날 수 있음을 증명해 국제학술지 `엠보저널(EMBO Journal)'에 공개했다고 2일 밝혔다.
☞ 미세아교세포(microgila): 뇌에서 면역기능을 담당하는 신경세포의 일종이다. 뇌와 척추 전역에 분포돼 있으며, 정상적인 뇌 기능을 수행하도록 핵심적인 역할을 한다.
*시냅스는 뇌 발달 및 학습 시에 생성과 제거가 반복되는 변화를 겪는다. 정원석 교수 연구팀은 이전 연구를 통해 비신경세포인 별아교세포와 미세아교세포가 신경세포의 불필요한 시냅스를 잡아먹어 제거할 수 있음을 밝힌 바 있다. 하지만, 이 과정에서 어떤 물질이 특정 시냅스를 표지해 교세포들로 하여금 제거하도록 유도하는지는 알려지지 않았다.
☞ 시냅스(synapse): 뉴런(신경세포) 간 또는 뉴런과 다른 세포 사이의 접합 관계나 접합 부위를 말한다. 뉴런이 모여 있는 곳, 즉 뇌와 척수에 집중되어 있다.
연구팀은 포스파티딜세린 (phosphatidylserine)이라는 세포막에 존재하는 인지질 중의 하나가 죽어가는 세포 표면에 선택적으로 표지돼 면역세포에 의해 세포를 잡아먹도록 유도한다는 사실에 착안했다. 죽어가는 세포가 제거되는 분자 기전이 시냅스만이 선택적으로 제거되는 현상에도 응용될 수 있을 것이라 예상한 것이다.
이 가정을 증명하기 위해 연구팀은 포스파티딜세린을 신경세포 표면에 인위적으로 노출한 후, 특정 시냅스가 교세포에 의해 잡아먹힐 수 있는지 연구했다.
먼저 연구팀은 포스파티딜세린을 항상 세포 표면으로부터 안으로 지속적으로 불러들여 정상 세포막에서 이들을 노출되지 않도록 막고 있는 플립파아제(Flippase)라는 단백질의 기능을 신경세포에서만 억제할 수 있는 실험용 쥐 모델을 제작했다.
그 결과 놀랍게도 신경세포의 세포체 주변의 표면에서만 선택적으로 포스파티딜세린이 표지됨을 발견했고 이로 인해 세포막이나 흥분성 시냅스의 손상 없이 억제성 시냅스만이 선택적으로 감소함을 발견했다. 그뿐만 아니라 해당 쥐 모델은 청각을 담당하는 뇌 지역에서 흥분-억제 균형이 깨져서 소리로 인해 촉발되는 특이한 발작 증세를 일으킴을 확인했다.
더 나아가 연구팀은 미세아교세포를 인위적으로 제거하거나 미세아교세포에 존재하는 특정 포식 수용체를 제거했을 때, 신경세포의 표면에 포스파티딜세린이 표지되었을지라도 과도한 억제성 시냅스 감소와 발작 증세가 방지될 수 있음을 발견했다.
이로써 신경세포체 주변 세포막에 포스파티딜세린이 표지되는 것이 미세아교세포가 포식 수용체를 통해 억제성 시냅스만을 선택적으로 먹는 기전으로 쓰일 수 있음을 최초로 규명한 것이다.
연구팀의 이 같은 발견은 흥분성 및 억제성 시냅스가 서로 다른 기전을 통해 미세아교세포에 의해 제거될 수 있음을 처음으로 제시한 것이며, 미세아교세포에 의한 과도한 억제성 시냅스 제거 기전이 뇌 신경세포의 흥분-억제 불균형 발생의 새로운 원인이 될 수 있음을 증명한 것이다.
연구팀 관계자는 "비정상적인 억제성 시냅스 수 변화는 발작, 자폐 스펙트럼 장애, 조현병, 치매 등과 같은 다양한 뇌 질환의 유병률과 연관성이 높다ˮ며 "뇌에서의 흥분-억제 균형이 깨져서 일어나는 다양한 뇌 신경질환에서 미세아교세포가 억제성 시냅스를 먹는 현상을 조절하는 것이 이들 질환을 치료하는 새로운 전략이 될 것이다ˮ고 말했다.
우리 대학 생명과학과 박정주 박사과정이 제1 저자로 참여하고, 정원석 교수가 교신저자로 참여한 이번 연구는 국제학술지 `엠보저널(EMBO Journal)'에 지난 5월 20일 字 공개됐다. (논문명: Microglial MERTK eliminates phosphatidylserine-displaying inhibitory post-synapses)
한편, 이번 연구는 삼성미래기술육성재단의 도움을 받아 진행됐다.
2021.06.03 조회수 60760