%ED%98%84%EB%AF%B8%EA%B2%BD
-
 원자간력 현미경(AFM)을 이용한 배터리 전극의 구성 성분 분포 영상화 기법 개발
우리 대학 신소재공학과 홍승범 교수 연구팀이 원자간력 현미경(AFM, Atomic Force Microscope)을 이용해 배터리 전극의 구성성분 분포를 파악하는 영상화 기법을 개발하는 데 성공했다.
관련 기술은 차세대 배터리로 주목받는 전고체전지 설계를 용이하게 할 수 있고 다른 전기화학 소재에도 제조 공정을 크게 혁신하는 토대가 될 것으로 기대된다.
김홍준 연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 `ACS 어플라이드 에너지 머티리얼스(ACS Applied Energy Materials)'지 4월 27일 字에 게재됐다. (논문명: Visualization of Functional Components in a Lithium Silicon Titanium Phosphate-Natural Graphite Composite Anode)
리튬이온전지는 휴대용 장비와 전기자동차 등 여러 분야에서 강력한 전기 에너지저장장치(ESS)로 사용되고 있다. 그러나 액체나 젤 형태의 전해질을 사용하는 리튬이온전지는 충격이나 압력으로 인한 발화 가능성이 크고 충전소요 시간이 길어지는 취약점을 안고 있다. 따라서 지난 13일 국내 1, 2위 대기업인 삼성그룹과 현대차 그룹 수장들이 첫 단독 회동을 통해 협업을 논의한 사례에서 보듯 고체 전해질을 이용한 전고체전지가 가장 유망한 차세대 배터리로 주목을 받고 있다.
전고체전지는 양극과 음극 사이의 전해질을 액체가 아닌 고체로 대체한 전지다. 전고체전지는 특히 부피를 절반으로 줄이면서 대용량 구현이 가능해 완전 충전 시 최대 주행거리가 800Km에 달하기 때문에 글로벌완성차 업체와 배터리 업체를 중심으로 기술 상용화를 위한 연구개발(R&D) 움직임이 활발하다.
다만 전고체전지가 차세대 배터리로 확고히 자리를 잡기 위해서는 낮은 이온전도도와 전극-전해질 계면의 접합성 문제를 해결해야 한다. 이를 위해 리튬이온전도체가 분산된 복합 전극에 관한 연구가 활발히 진행되고 있다. 또 전지 구동 성능에 큰 영향을 미치는 복합 전극의 재료적 특성을 이해하기 위해서는 미시적 규모로 혼합된 활물질, 이온전도체, 바인더 그리고 도전재와 같은 구성성분들의 형상과 분포를 파악할 수 있는 기술이 필요하다.
홍승범 교수 연구팀이 개발한 영상화 기법은 이러한 문제점들을 거시·미시적 다중 스케일에서 전기화학 변위 현미경과 횡력 현미경 등 원자간력 현미경의 다양한 기능을 활용해 위치에 따른 검출 신호의 감도 차이로 구성성분들의 영역을 구별해 해결했다. 기존 전극과 복합 전극을 비교해서 결과를 제시했으며, 영역들의 구별뿐만 아니라 단일 영역 내에서 나노 스케일의 이온 반응성 세기 분포와 마찰력 세기 분포의 상관관계 파악을 통해 바인더 구성 비율이 이온 반응성에 미치는 영향을 파악했다.
또 기존 전자 현미경을 이용해 관찰할 경우, 진공 환경이 필수적으로 필요하고, 분석을 위한 시편 제작 시 매우 얇은 막 형태로 제작 및 백금 입자를 코팅해야 하는 등 특별한 사전처리 절차가 필요했다. 반면 홍 교수 연구팀이 이번 연구를 통해 제시한 관찰 방법은 일반적인 환경에서 수행할 수 있고, 특별한 사전처리 절차가 필요하지 않다. 이와 함께 다른 영상화 장비보다 관찰의 준비 과정이 편리하며, 공간 분해 능력과 검출 신호의 세기 분해 능력이 월등하고, 성분 관찰 시에는 3차원 표면 형상 정보가 제공된다는 장점이 있다.
홍승범 교수는 "원자간력 현미경을 이용해 개발된 분석 기법은 복합 소재 내의 각 구성성분이 물질의 최종적인 성질에 기여하는 역할을 정량적으로 이해하는 데 유리하다ˮ 면서 "이 기술은 차세대 전고체전지의 설계 방향을 다중 스케일에서 제시할 뿐만 아니라, 다른 전기화학 소재의 제조 공정에도 혁신의 기틀을 마련할 수 있을 것으로 기대된다ˮ 고 강조했다.
한편 이번 연구는 과학기술정보통신부·한국연구재단 거대과학연구개발사업, 웨어러블 플랫폼 소재 기술센터 지원 기초연구사업 및 KAIST 글로벌특이점연구 지원으로 수행됐다.
2020.05.19 조회수 16499
원자간력 현미경(AFM)을 이용한 배터리 전극의 구성 성분 분포 영상화 기법 개발
우리 대학 신소재공학과 홍승범 교수 연구팀이 원자간력 현미경(AFM, Atomic Force Microscope)을 이용해 배터리 전극의 구성성분 분포를 파악하는 영상화 기법을 개발하는 데 성공했다.
관련 기술은 차세대 배터리로 주목받는 전고체전지 설계를 용이하게 할 수 있고 다른 전기화학 소재에도 제조 공정을 크게 혁신하는 토대가 될 것으로 기대된다.
김홍준 연구원이 제1 저자로 참여한 이번 연구는 국제 학술지 `ACS 어플라이드 에너지 머티리얼스(ACS Applied Energy Materials)'지 4월 27일 字에 게재됐다. (논문명: Visualization of Functional Components in a Lithium Silicon Titanium Phosphate-Natural Graphite Composite Anode)
리튬이온전지는 휴대용 장비와 전기자동차 등 여러 분야에서 강력한 전기 에너지저장장치(ESS)로 사용되고 있다. 그러나 액체나 젤 형태의 전해질을 사용하는 리튬이온전지는 충격이나 압력으로 인한 발화 가능성이 크고 충전소요 시간이 길어지는 취약점을 안고 있다. 따라서 지난 13일 국내 1, 2위 대기업인 삼성그룹과 현대차 그룹 수장들이 첫 단독 회동을 통해 협업을 논의한 사례에서 보듯 고체 전해질을 이용한 전고체전지가 가장 유망한 차세대 배터리로 주목을 받고 있다.
전고체전지는 양극과 음극 사이의 전해질을 액체가 아닌 고체로 대체한 전지다. 전고체전지는 특히 부피를 절반으로 줄이면서 대용량 구현이 가능해 완전 충전 시 최대 주행거리가 800Km에 달하기 때문에 글로벌완성차 업체와 배터리 업체를 중심으로 기술 상용화를 위한 연구개발(R&D) 움직임이 활발하다.
다만 전고체전지가 차세대 배터리로 확고히 자리를 잡기 위해서는 낮은 이온전도도와 전극-전해질 계면의 접합성 문제를 해결해야 한다. 이를 위해 리튬이온전도체가 분산된 복합 전극에 관한 연구가 활발히 진행되고 있다. 또 전지 구동 성능에 큰 영향을 미치는 복합 전극의 재료적 특성을 이해하기 위해서는 미시적 규모로 혼합된 활물질, 이온전도체, 바인더 그리고 도전재와 같은 구성성분들의 형상과 분포를 파악할 수 있는 기술이 필요하다.
홍승범 교수 연구팀이 개발한 영상화 기법은 이러한 문제점들을 거시·미시적 다중 스케일에서 전기화학 변위 현미경과 횡력 현미경 등 원자간력 현미경의 다양한 기능을 활용해 위치에 따른 검출 신호의 감도 차이로 구성성분들의 영역을 구별해 해결했다. 기존 전극과 복합 전극을 비교해서 결과를 제시했으며, 영역들의 구별뿐만 아니라 단일 영역 내에서 나노 스케일의 이온 반응성 세기 분포와 마찰력 세기 분포의 상관관계 파악을 통해 바인더 구성 비율이 이온 반응성에 미치는 영향을 파악했다.
또 기존 전자 현미경을 이용해 관찰할 경우, 진공 환경이 필수적으로 필요하고, 분석을 위한 시편 제작 시 매우 얇은 막 형태로 제작 및 백금 입자를 코팅해야 하는 등 특별한 사전처리 절차가 필요했다. 반면 홍 교수 연구팀이 이번 연구를 통해 제시한 관찰 방법은 일반적인 환경에서 수행할 수 있고, 특별한 사전처리 절차가 필요하지 않다. 이와 함께 다른 영상화 장비보다 관찰의 준비 과정이 편리하며, 공간 분해 능력과 검출 신호의 세기 분해 능력이 월등하고, 성분 관찰 시에는 3차원 표면 형상 정보가 제공된다는 장점이 있다.
홍승범 교수는 "원자간력 현미경을 이용해 개발된 분석 기법은 복합 소재 내의 각 구성성분이 물질의 최종적인 성질에 기여하는 역할을 정량적으로 이해하는 데 유리하다ˮ 면서 "이 기술은 차세대 전고체전지의 설계 방향을 다중 스케일에서 제시할 뿐만 아니라, 다른 전기화학 소재의 제조 공정에도 혁신의 기틀을 마련할 수 있을 것으로 기대된다ˮ 고 강조했다.
한편 이번 연구는 과학기술정보통신부·한국연구재단 거대과학연구개발사업, 웨어러블 플랫폼 소재 기술센터 지원 기초연구사업 및 KAIST 글로벌특이점연구 지원으로 수행됐다.
2020.05.19 조회수 16499 -
 초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
2020.02.21 조회수 15592
초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
2020.02.21 조회수 15592 -
 김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
2019.04.01 조회수 23327
김필한 교수, 패혈증 환자의 폐 손상 원인 밝혀
〈 김필한 교수 〉
우리 대학 의과학대학원/나노과학기술대학원 김필한 교수 연구팀이 3차원 생체현미경 기술을 통해 패혈증 폐에서 모세혈관과 혈액 내 순환 세포를 고해상도 촬영하는 데 성공했다.
연구팀은 패혈증 폐의 모세혈관 내부에서 백혈구의 일종인 호중구(好中球, neutrophil)들이 서로 응집하며 혈액 미세순환의 저해를 유발하고, 나아가 피가 통하지 않는 사강(死腔, dead space)을 형성함을 규명했다.
연구팀은 이 현상이 패혈증 모델의 폐손상으로 이어지는 조직 저산소증 유발의 원인이 되며, 호중구 응집을 해소하면 미세순환이 개선되며 저산소증도 함께 호전됨을 증명했다.
박인원 박사(현 분당서울대학교병원 응급의학과)가 주도한 이번 연구결과는 의학 분야 국제 학술지 ‘유럽호흡기학회지(European Respiratory Journal)’에 3월 28일 자에 게재됐다.
폐는 호흡을 통해 생명 유지의 필수 작용인 산소와 이산화탄소 간 가스 교환을 하는 기관으로 이는 적혈구들이 순환하는 수많은 모세혈관으로 둘러싸인 폐포(肺胞)에서 이뤄진다.
폐포의 미세순환 관찰을 위해 연구자들이 지속적인 노력을 하고 있으나 호흡을 위해 항상 움직이는 폐 안의 모세혈관과 적혈구의 미세순환을 고해상도로 촬영하는 것은 매우 어려웠다.
연구팀은 자체 개발한 초고속 레이저 스캐닝 공초점 현미경과 폐의 호흡 상태를 보존하면서 움직임을 최소화할 수 있는 영상 챔버를 새롭게 제작했다. 이를 통해 패혈증 동물모델의 폐에서 모세혈관 내부의 적혈구 순환 촬영에 성공했다.
이 과정에서 패혈증 모델의 폐에서 적혈구들이 순환하지 않는 공간인 사강이 증가하며 이곳에서 저산소증이 유발되는 것을 발견했다. 이는 혈액 내부의 호중구들이 모세혈관과 세동맥 내부에서 서로 응집하며 갇히는 현상으로 인해 발생함을 밝혔다. 갇힌 호중구들은 미세순환 저해, 활성산소의 다량 생산 등 패혈증 모델의 폐 조직 손상을 유발하는 것도 확인했다.
연구팀은 추가 연구를 통해 폐혈관 내부의 응집한 호중구가 전신을 순환하는 호중구에 비해 세포 간 부착에 관여하는 Mac-1 수용체(CD11b/CD18)가 높게 발현함을 증명했다. 이어 Mac-1 저해제를 패혈증 모델에 사용하여 호중구 응집으로 저해된 미세순환을 개선하고 저산소증의 호전과 폐부종 감소를 증명했다.
연구팀이 독자 개발한 최첨단 고해상도 3차원 생체현미경 기술은 살아있는 폐 안 세포들의 실시간 영상촬영이 가능해 패혈증을 포함한 여러 폐 질환의 연구에 다양하게 활용될 것으로 기대된다.
연구팀의 폐 미세순환 영상촬영 및 정밀 분석 기법은 향후 미세순환과 연관된 다양한 질환들의 연구뿐 아니라 새로운 진단기술 개발 및 치료제의 평가를 위한 원천기술로 활용될 것으로 보인다.
김 교수 연구팀의 3차원 생체현미경 기술은 KAIST 교원창업기업인 아이빔테크놀로지(IVIM Technology, Inc)를 통해 상용화돼 올인원 생체현미경 모델 ‘IVM-CM’과 ‘IVM-C’로 출시됐으며 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비로서 미래 글로벌 바이오헬스 시장에 핵심 장비로 활용될 예정이다.
김 교수는 “패혈증으로 인한 급성 폐손상 모델에서 폐 미세순환의 저해가 호중구로 인하여 발생하며, 이를 제어하면 미세순환 개선을 통해 저산소증 및 폐부종을 해소할 수 있어 패혈증 환자를 치료하는 새로운 전략이 될 수 있음을 새롭게 밝혀냈다.”고 말했다.
이번 연구는 의과학대학원 졸업생 박인원 박사가 1저자로 참여했고 유한재단 보건장학회, 교육부 글로벌박사펠로우쉽사업, 과학기술정보통신부의 글로벌프론티어사업과 이공분야기초연구사업, 그리고 보건복지부의 질환극복기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 초고속 레이저주사 3차원 생체현미경 시스템
그림2. 생체 내 폐 이미징 기술 개념도 및 사진
2019.04.01 조회수 23327 -
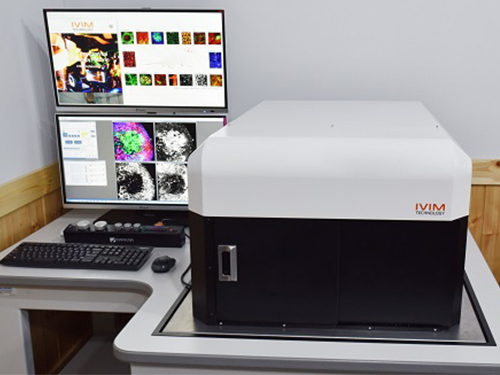 김필한 교수 교원창업기업, 3차원 생체현미경 IVM-CM 출시
〈김필한 교수, 아이빔테크놀로지 김인선 CEO〉
우리 대학 나노과학기술대학원/의과학대학원 김필한 교수 연구팀이 소속된 교원창업기업 아이빔테크놀로지(IVIM Technology, Inc)가 3차원 올인원 생체 현미경 ‘IVM-CM’과 ‘IVM-C’를 개발했다.
이는 김필한 교수 연구팀의 혁신적 생체현미경(IntraVital Microscopy, IVM) 원천기술을 토대로 개발한 것으로 미래 글로벌 바이오헬스 시장에 활용될 예정이다.
세계적 현미경 제조사들의 기술을 넘어 혁신적 원천 기술을 기반으로 개발된 ‘IVM-C’와 ‘IVM-CM’은 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
생체현미경은 바이오제약 분야에서 크게 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
인체는 수없이 많은 세포들이 복잡한 상호작용을 통해 동작한다. 그러나 현재 신약개발 전임상 단계에서는 시험관 내(in-vitro)와 생체 외(ex-vivo) 실험처럼 상호작용이 일어나지 않는 방식의 연구가 주로 수행되고 있다.
이러한 실험 결과들로만 얻은 결과로 임상시험에 진입한다면 오류와 실패의 가능성이 높아진다. 따라서 신약개발을 위한 임상시험 전 마지막 단계에서 반드시 살아있는 동물에서의 생체 내(in-vivo) 실험으로 효능 분석이 진행돼야 한다.
생체현미경 기술은 바로 이 과정에서 살아있는 동물 내부의 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 고해상도 영상으로 직접 관찰할 수 있어 시험 결과의 오류, 시간, 비용을 현저히 줄일 수 있다.
기존 현미경 기술을 살아있는 생체에 적용하려면 영상획득 과정 동안 생체를 유지하기 위한 여러 추가적인 장비가 필요하다. 또한 영상 속도와 해상도의 한계로 인해 생체 내부의 세포를 직접 관찰하기 어려웠다.
아이빔테크놀로지의 ‘IVM-C’와 ‘IVM-CM’모델은 최초의 올인원 3차원 생체현미경 제품으로 살아있는 생체 내부조직을 구성하는 세포들을 고해상도로 직접 관찰할 수 있다.
기존 MRI나 CT 등으로 불가능했던 신체의 다양한 장기 내부에서 움직이는 세포들을 하나하나 구별해 관찰하는 것이 가능하다. 이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 ‘IVM-C’와 ‘IVM-CM’모델은 독보적인 초고속 레이저스캐닝 기술을 이용해 기존 기술수준을 크게 뛰어넘는 고해상도와 정밀도로 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화하는 것이 가능하다.
‘IVM-C’모델은 살아있는 생체 내부의 고해상도 공초점 영상을 총 4가지 색으로 동시에 획득할 수 있으며, ‘IVM-CM’모델은 공초점 영상과 더불어 고속펄스레이저를 이용한 다중광자 영상까지 획득할 수 있다.
최고기술책임자(CTO) 김필한 교수는 “‘IVM-C’와 ‘IVM-CM’은 세포치료제, 면역치료제, 신약 및 선도물질 효능 분석 시 다양한 세포들이 존재하는 생체 내 환경에서 단일 세포 단위의 정밀한 효능 분석이 가능한 유일한 장비로 생명 현상을 보다 정밀하게 종합 분석하기 위한 혁신적 원천 기술로 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술 발전을 가속화할 핵심 기술이 될 것이다”고 말했다.
아이빔테크놀로지는 시장성과 성장 가능성을 높게 평가받아 창업 후 3개월 만인 작년 9월 30억 원의 투자 유치를 달성한 바 있다.
대표이사는 김인선 전 제넥신 경영지원본부장, 최고기술책임자는 김필한 교수, 영업 및 마케팅 총괄은 독일 광학 기업인 칼자이스에서 14년간 경험을 쌓은 박수진 이사가 맡고 있다.
또한 우리 대학 박사 출신들로 구성된 기술개발팀과 연구서비스팀이 차세대 후속 장비 개발과 글로벌 바이오헬스 시장 활성화를 위해 노력하고 있다.
김필한 교수 연구팀은 창업원 엔드-런(End-Run) 사업화도약과제에 참여했으며, 아이빔테크놀로지는 창업원의 지원을 받아 설립됐다.
□ 사진 설명
사진1. IVM-CM 장비사진
사진2. IVM-CM 생체영상결과 사진
사진3. IVM-CM 생체 내부 세포 추적 사진
2018.09.05 조회수 15397
김필한 교수 교원창업기업, 3차원 생체현미경 IVM-CM 출시
〈김필한 교수, 아이빔테크놀로지 김인선 CEO〉
우리 대학 나노과학기술대학원/의과학대학원 김필한 교수 연구팀이 소속된 교원창업기업 아이빔테크놀로지(IVIM Technology, Inc)가 3차원 올인원 생체 현미경 ‘IVM-CM’과 ‘IVM-C’를 개발했다.
이는 김필한 교수 연구팀의 혁신적 생체현미경(IntraVital Microscopy, IVM) 원천기술을 토대로 개발한 것으로 미래 글로벌 바이오헬스 시장에 활용될 예정이다.
세계적 현미경 제조사들의 기술을 넘어 혁신적 원천 기술을 기반으로 개발된 ‘IVM-C’와 ‘IVM-CM’은 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
생체현미경은 바이오제약 분야에서 크게 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
인체는 수없이 많은 세포들이 복잡한 상호작용을 통해 동작한다. 그러나 현재 신약개발 전임상 단계에서는 시험관 내(in-vitro)와 생체 외(ex-vivo) 실험처럼 상호작용이 일어나지 않는 방식의 연구가 주로 수행되고 있다.
이러한 실험 결과들로만 얻은 결과로 임상시험에 진입한다면 오류와 실패의 가능성이 높아진다. 따라서 신약개발을 위한 임상시험 전 마지막 단계에서 반드시 살아있는 동물에서의 생체 내(in-vivo) 실험으로 효능 분석이 진행돼야 한다.
생체현미경 기술은 바로 이 과정에서 살아있는 동물 내부의 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 고해상도 영상으로 직접 관찰할 수 있어 시험 결과의 오류, 시간, 비용을 현저히 줄일 수 있다.
기존 현미경 기술을 살아있는 생체에 적용하려면 영상획득 과정 동안 생체를 유지하기 위한 여러 추가적인 장비가 필요하다. 또한 영상 속도와 해상도의 한계로 인해 생체 내부의 세포를 직접 관찰하기 어려웠다.
아이빔테크놀로지의 ‘IVM-C’와 ‘IVM-CM’모델은 최초의 올인원 3차원 생체현미경 제품으로 살아있는 생체 내부조직을 구성하는 세포들을 고해상도로 직접 관찰할 수 있다.
기존 MRI나 CT 등으로 불가능했던 신체의 다양한 장기 내부에서 움직이는 세포들을 하나하나 구별해 관찰하는 것이 가능하다. 이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 ‘IVM-C’와 ‘IVM-CM’모델은 독보적인 초고속 레이저스캐닝 기술을 이용해 기존 기술수준을 크게 뛰어넘는 고해상도와 정밀도로 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화하는 것이 가능하다.
‘IVM-C’모델은 살아있는 생체 내부의 고해상도 공초점 영상을 총 4가지 색으로 동시에 획득할 수 있으며, ‘IVM-CM’모델은 공초점 영상과 더불어 고속펄스레이저를 이용한 다중광자 영상까지 획득할 수 있다.
최고기술책임자(CTO) 김필한 교수는 “‘IVM-C’와 ‘IVM-CM’은 세포치료제, 면역치료제, 신약 및 선도물질 효능 분석 시 다양한 세포들이 존재하는 생체 내 환경에서 단일 세포 단위의 정밀한 효능 분석이 가능한 유일한 장비로 생명 현상을 보다 정밀하게 종합 분석하기 위한 혁신적 원천 기술로 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술 발전을 가속화할 핵심 기술이 될 것이다”고 말했다.
아이빔테크놀로지는 시장성과 성장 가능성을 높게 평가받아 창업 후 3개월 만인 작년 9월 30억 원의 투자 유치를 달성한 바 있다.
대표이사는 김인선 전 제넥신 경영지원본부장, 최고기술책임자는 김필한 교수, 영업 및 마케팅 총괄은 독일 광학 기업인 칼자이스에서 14년간 경험을 쌓은 박수진 이사가 맡고 있다.
또한 우리 대학 박사 출신들로 구성된 기술개발팀과 연구서비스팀이 차세대 후속 장비 개발과 글로벌 바이오헬스 시장 활성화를 위해 노력하고 있다.
김필한 교수 연구팀은 창업원 엔드-런(End-Run) 사업화도약과제에 참여했으며, 아이빔테크놀로지는 창업원의 지원을 받아 설립됐다.
□ 사진 설명
사진1. IVM-CM 장비사진
사진2. IVM-CM 생체영상결과 사진
사진3. IVM-CM 생체 내부 세포 추적 사진
2018.09.05 조회수 15397 -
 박정영, 정유성 교수, 합금 촉매의 화학반응 실시간 관찰 성공
〈 박 정 영, 정 유 성 교수〉
우리 대학 EEWS 대학원 박정영, 정유성 교수 연구팀이 합금 촉매 표면에서 벌어지는 화학 반응 과정을 실시간으로 관찰해 합금 촉매의 반응성 향상과 직결된 반응 원리를 규명했다.
연구팀의 관찰 결과는 차세대 고성능 촉매 설계에 활용할 수 있는 반응성 향상 원리의 기반이 될 것으로 기대된다.
GIST 물리․광과학과 문봉진 교수 연구팀과 공동으로 수행한 이번 연구 결과는 종합 과학 분야 국제 학술지 ‘사이언스 어드밴시스(Science Advances)’ 7월 13일자 온라인 판에 게재됐다. (논문명 : Adsorbate-driven reactive interfacial Pt-NiO1-x nanostructure formation on the Pt3Ni(111) alloy surface, 백금-니켈 합금 표면위의 촉매 활성도가 높은 금속-산화물 경계 나노구조물 형성의 실시간 관찰)
합금 촉매는 단일 금속 또는 금속 산화물 촉매에 비해 뛰어난 성능을 보여 연료전지반응이나 탄소계열 공업화학반응 등에 이용되고 있다. 하지만 합금 촉매 반응의 결과에 대한 근본적인 원리는 자세히 밝혀지지 않아 촉매 연구 과정에서 발생하는 예상치 못한 결과를 설명하기 어려웠다.
연구팀은 문제 해결을 위해 기존의 표면 직접 관찰 기기의 한계점을 크게 개선한 ‘상압 주사 터널링 전자 현미경’과 ‘상압 X-선 광전자분광기’를 활용해 백금-니켈 합금 촉매 표면의 역동적인 변화 과정을 관찰했다.
이를 통해 실제 반응 환경에서 백금-니켈 합금 촉매의 반응성 향상 이유가 금속-산화물 계면 나노구조의 표면 형성으로부터 시작됨을 밝혀냈다.
또한 일산화탄소 산화반응 과정에서 백금 혹은 니켈 산화물 단일 촉매에 비해 금속-산화물 계면 나노구조가 갖는 비교적 낮은 활성화 에너지는 촉매 반응 원리 상 반응성 향상에 보다 유리한 화학 반응 경로를 제시할 수 있음을 확인했다.
이 결과는 밀도범함수 이론을 바탕으로 한 양자역학 모델링 계산 결과를 통해 입증됐다.
박정영 교수는 “초고진공 환경을 기반으로 한 기존의 표면 과학이 풀지 못한 실제 반응 환경에서의 합금 촉매 반응 과정을 직접 관찰한 첫 연구사례이다”며 “합금 촉매의 계면이 촉매 향상도를 높일 수 있고, 현재 진행 중인 촉매전자학 연구와도 밀접한 관계를 가지고 있다. 다양한 종류의 실제 반응 환경에 근접한 촉매 표면 반응을 연구할 계획이다.”고 말했다.
이론적 원리 규명 연구를 주도한 정유성 교수는 “직접 관찰과 양자 계산을 통해 합금 촉매의 주된 활성 자리가 계면임을 규명한 연구로, 다양한 합금 촉매의 설계 및 최적화에 중요한 단서가 될 것이다”고 말했다.
상압 표면 분석을 주도한 GIST 문봉진 교수는“이 연구는 외부의 분자들과 쉴 새 없이 반응하면서 움직이는 마치 살아서 숨쉬고 있는 원자의 움직임과 반응성을 동시에 측정한 완벽한 표면물리연구이다”고 말했다.
이번 연구는 기초과학연구원 및 한국연구재단, GIST 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 주사 터널링 전자 현미경을 이용한 실시간 표면 관찰 이미지
그림2. 시간에 따른 표면 직접 관찰 이미지
2018.07.16 조회수 16231
박정영, 정유성 교수, 합금 촉매의 화학반응 실시간 관찰 성공
〈 박 정 영, 정 유 성 교수〉
우리 대학 EEWS 대학원 박정영, 정유성 교수 연구팀이 합금 촉매 표면에서 벌어지는 화학 반응 과정을 실시간으로 관찰해 합금 촉매의 반응성 향상과 직결된 반응 원리를 규명했다.
연구팀의 관찰 결과는 차세대 고성능 촉매 설계에 활용할 수 있는 반응성 향상 원리의 기반이 될 것으로 기대된다.
GIST 물리․광과학과 문봉진 교수 연구팀과 공동으로 수행한 이번 연구 결과는 종합 과학 분야 국제 학술지 ‘사이언스 어드밴시스(Science Advances)’ 7월 13일자 온라인 판에 게재됐다. (논문명 : Adsorbate-driven reactive interfacial Pt-NiO1-x nanostructure formation on the Pt3Ni(111) alloy surface, 백금-니켈 합금 표면위의 촉매 활성도가 높은 금속-산화물 경계 나노구조물 형성의 실시간 관찰)
합금 촉매는 단일 금속 또는 금속 산화물 촉매에 비해 뛰어난 성능을 보여 연료전지반응이나 탄소계열 공업화학반응 등에 이용되고 있다. 하지만 합금 촉매 반응의 결과에 대한 근본적인 원리는 자세히 밝혀지지 않아 촉매 연구 과정에서 발생하는 예상치 못한 결과를 설명하기 어려웠다.
연구팀은 문제 해결을 위해 기존의 표면 직접 관찰 기기의 한계점을 크게 개선한 ‘상압 주사 터널링 전자 현미경’과 ‘상압 X-선 광전자분광기’를 활용해 백금-니켈 합금 촉매 표면의 역동적인 변화 과정을 관찰했다.
이를 통해 실제 반응 환경에서 백금-니켈 합금 촉매의 반응성 향상 이유가 금속-산화물 계면 나노구조의 표면 형성으로부터 시작됨을 밝혀냈다.
또한 일산화탄소 산화반응 과정에서 백금 혹은 니켈 산화물 단일 촉매에 비해 금속-산화물 계면 나노구조가 갖는 비교적 낮은 활성화 에너지는 촉매 반응 원리 상 반응성 향상에 보다 유리한 화학 반응 경로를 제시할 수 있음을 확인했다.
이 결과는 밀도범함수 이론을 바탕으로 한 양자역학 모델링 계산 결과를 통해 입증됐다.
박정영 교수는 “초고진공 환경을 기반으로 한 기존의 표면 과학이 풀지 못한 실제 반응 환경에서의 합금 촉매 반응 과정을 직접 관찰한 첫 연구사례이다”며 “합금 촉매의 계면이 촉매 향상도를 높일 수 있고, 현재 진행 중인 촉매전자학 연구와도 밀접한 관계를 가지고 있다. 다양한 종류의 실제 반응 환경에 근접한 촉매 표면 반응을 연구할 계획이다.”고 말했다.
이론적 원리 규명 연구를 주도한 정유성 교수는 “직접 관찰과 양자 계산을 통해 합금 촉매의 주된 활성 자리가 계면임을 규명한 연구로, 다양한 합금 촉매의 설계 및 최적화에 중요한 단서가 될 것이다”고 말했다.
상압 표면 분석을 주도한 GIST 문봉진 교수는“이 연구는 외부의 분자들과 쉴 새 없이 반응하면서 움직이는 마치 살아서 숨쉬고 있는 원자의 움직임과 반응성을 동시에 측정한 완벽한 표면물리연구이다”고 말했다.
이번 연구는 기초과학연구원 및 한국연구재단, GIST 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 주사 터널링 전자 현미경을 이용한 실시간 표면 관찰 이미지
그림2. 시간에 따른 표면 직접 관찰 이미지
2018.07.16 조회수 16231 -
 김필한 교수, 초고속 레이저 생체현미경 개발
〈 김 필 한 교수 〉
우리 대학 나노과학기술대학원 김필한 교수 연구팀이 개발한 초고속 생체현미경(IVM: IntraVital Microscopy)을 통해 미래 글로벌 바이오헬스 시장을 겨냥한 상용화에 나선다.
김 교수는 (재)의약바이오컨버젼스연구단, 서울대학교 김성훈 교수와의 공동 연구를 통해 개발한 최첨단 초고속 레이저스캐닝 3차원 생체현미경 기술을 토대로 아이빔테크놀로지(주)(IVIM Technology, Inc)를 창업했다.
이 생체현미경(IntraVital Microscopy : IVM)은 수많은 세포들 간 상호작용을 통해 나타나는 생명 현상을 탐구하고 여러 질환의 복잡한 발생 과정을 밝힘으로써 기초 의생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
연구팀의 기술은 살아있는 생체 내부조직을 구성하는 세포의 움직임을 직접 관찰할 수 있다. MRI나 CT 등 기존 생체영상 기술로는 불가능한 신체 다양한 장기 내부의 수많은 세포 하나하나를 구별하고 각 세포들의 움직임을 3차원으로 즉시 확인 가능하다.
이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 초고속 생체현미경 기술은 여러 색의 레이저 빔을 이용해 기존의 조직분석 기술로는 불가능했던 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화할 수 있다.
이를 활용하면 생체 외부에서 수집한 데이터로 수립한 가정을 실제 살아있는 생체 내 환경에서 세포 단위로 검증하고 분석할 수 있다.
생체현미경은 바이오제약 분야에서도 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
연구팀의 생체현미경은 동물실험에서 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 동영상으로 관찰할 수 있다. 현재 (재)의약바이오컨버젼스연구단과 함께 차세대 신약개발을 위한 핵심기술로 발전시키기 위해 노력 중이다.
김 교수가 창업한 회사는 시장성과 성장가능성을 높게 평가받아 벤처기업으로서는 이례적으로 빠르게 창업 3개월 만에 LB인베스트먼트와 에이티넘인베스트먼트로부터 총 30억 원의 투자를 유치했다.
김 교수는 “이 기술은 다양한 생명 현상을 보다 정밀하게 종합 분석하기 위한 원천기술이다”며 “고령화 사회의 도래와 함께 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술의 발전을 가속화할 핵심 기술이 될 것으로 확신한다”고 말했다.
김 교수 연구팀의 연구는 창업원의 엔드런(End-Run) 사업과 과학기술정보통신부가 추진하는 글로벌프론티어사업의 혁신형의약바이오컨버전스사업의 지원을 받아 수행됐다.
□ 사진 설명
사진1. 초고속 레이저 생체현미경 (IVM) 사진1
사진2. 초고속 레이저 생체현미경 (IVM) 사진2
사진3. 생체 내부 세포수준 변화의 IVM 영상 결과
사진4. 생체 내부 다양한 장기의 세포수준 IVM 영상 결과
2017.11.21 조회수 25750
김필한 교수, 초고속 레이저 생체현미경 개발
〈 김 필 한 교수 〉
우리 대학 나노과학기술대학원 김필한 교수 연구팀이 개발한 초고속 생체현미경(IVM: IntraVital Microscopy)을 통해 미래 글로벌 바이오헬스 시장을 겨냥한 상용화에 나선다.
김 교수는 (재)의약바이오컨버젼스연구단, 서울대학교 김성훈 교수와의 공동 연구를 통해 개발한 최첨단 초고속 레이저스캐닝 3차원 생체현미경 기술을 토대로 아이빔테크놀로지(주)(IVIM Technology, Inc)를 창업했다.
이 생체현미경(IntraVital Microscopy : IVM)은 수많은 세포들 간 상호작용을 통해 나타나는 생명 현상을 탐구하고 여러 질환의 복잡한 발생 과정을 밝힘으로써 기초 의생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
연구팀의 기술은 살아있는 생체 내부조직을 구성하는 세포의 움직임을 직접 관찰할 수 있다. MRI나 CT 등 기존 생체영상 기술로는 불가능한 신체 다양한 장기 내부의 수많은 세포 하나하나를 구별하고 각 세포들의 움직임을 3차원으로 즉시 확인 가능하다.
이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 초고속 생체현미경 기술은 여러 색의 레이저 빔을 이용해 기존의 조직분석 기술로는 불가능했던 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화할 수 있다.
이를 활용하면 생체 외부에서 수집한 데이터로 수립한 가정을 실제 살아있는 생체 내 환경에서 세포 단위로 검증하고 분석할 수 있다.
생체현미경은 바이오제약 분야에서도 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
연구팀의 생체현미경은 동물실험에서 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 동영상으로 관찰할 수 있다. 현재 (재)의약바이오컨버젼스연구단과 함께 차세대 신약개발을 위한 핵심기술로 발전시키기 위해 노력 중이다.
김 교수가 창업한 회사는 시장성과 성장가능성을 높게 평가받아 벤처기업으로서는 이례적으로 빠르게 창업 3개월 만에 LB인베스트먼트와 에이티넘인베스트먼트로부터 총 30억 원의 투자를 유치했다.
김 교수는 “이 기술은 다양한 생명 현상을 보다 정밀하게 종합 분석하기 위한 원천기술이다”며 “고령화 사회의 도래와 함께 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술의 발전을 가속화할 핵심 기술이 될 것으로 확신한다”고 말했다.
김 교수 연구팀의 연구는 창업원의 엔드런(End-Run) 사업과 과학기술정보통신부가 추진하는 글로벌프론티어사업의 혁신형의약바이오컨버전스사업의 지원을 받아 수행됐다.
□ 사진 설명
사진1. 초고속 레이저 생체현미경 (IVM) 사진1
사진2. 초고속 레이저 생체현미경 (IVM) 사진2
사진3. 생체 내부 세포수준 변화의 IVM 영상 결과
사진4. 생체 내부 다양한 장기의 세포수준 IVM 영상 결과
2017.11.21 조회수 25750 -
 김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21494
김호민 교수, 패혈증 원인 물질의 생체 내 메커니즘 최초 발견
우리 대학 의과학대학원 김호민 교수와 연세대학교 윤태영 교수 공동 연구팀이 우리 몸이 패혈증의 원인 물질인 박테리아 내독소를 어떻게 받아들이고 전달하는지 규명했다.
이를 통해 박테리아 내독소가 생체 내 단백질로 전달되는 분자 원리를 밝혀냄으로써 내독소가 전달되는 길목을 차단해 패혈증을 치료할 수 있는 새로운 가능성이 제시됐다.
패혈증은 감염에 의해서 과도하게 활성화된 면역반응에 따른 전신성 염증반응 증후군이다.
이 연구는 면역학 분야 국제 학술지이며, 셀(Cell) 자매지인‘이뮤니티 (Immunity)’12월 13일자에 게재되었다.
그람 음성균 세포외막에 존재하는 내독소는 생체 내 단백질을 통해 면역세포 표면의 세포수용체로 전달돼 선천성 면역 반응을 활성화시킨다.
감염에 의한 혈액 내 내독소 다량 유입은 고열, 혈압저하, 장기손상 등 과도한 염증반응의 결과인 패혈증으로 이어질 수 있지만, 내독소 인식 및 전달 관련 구체적인 분자 원리가 밝혀져 있지 않아 패혈증 치료제 개발에 한계가 있었다.
연구팀은 문제 해결을 위해 단분자 형광기법과 바이오 투과전자현미경을 활용했다. 마이셀(Micelle) 형태로 존재하는 내독소 표면에 막대 모양의 LBP가 결합하여 내독소를 인식하고, 여기에 CD14가 빠르게 결합해 내독소 한 분자를 가져간 후 면역세포 수용체인 TLR4-MD2와의 상호결합을 통해 건네주는 내독소 인식 및 전달 원리를 확인했다.
박테리아 내독소와 정제된 LBP 단백질을 혼합해 바이오투과전자현미경으로 사진을 찍은 후 각각의 분자의 모양을 컴퓨터를 활용한 이미지 프로세싱을 통해 분석함으로써 내독소와 결합한 LBP 단백질 구조를 최초로 규명했다.
특히 막대모양의 LBP 단백질이 그들의 N-도메인 끝을 통해 내독소 마이셀 표면에 결합함으로써 박테리아 내독소만을 특이적으로 인식하는 것을 발견했다.
연구팀은 박테리아 내독소에 형광을 부착시킨 후 내독소 항체를 활용해 유리슬라이드 표면에 코팅시키고, LBP, CD14, TLR4-MD2 단백질들을 흘려주면서 박테리아 내독소, LBP, CD14, TLR4-MD2 분자 하나하나의 동적인 움직임을 실시간으로 관찰하는 단분자 형광 시스템을 최초로 구축했다.
이를 통해 박테리아 내독소 표면에 결합한 LBP 단백질로부터 CD14 단백질이 내독소 한 분자만을 반복적으로 가져간 후 빠르게 TLR4-MD2로 전달함으로써 선천성 면역의 세포신호전달을 활성화 시키는 분자메커니즘을 최초로 규명했다.
또한 마우스 면역세포인 수지상세포를 활용하여 첨단 생물물리학적인 기법을 통해 제시한 분자메커니즘이 생체 내에서 내독소를 인식하여 면역반응을 유발하는 핵심 메커니즘을 검증했다.
기존의 실험방법으로 접근이 어려웠던 LBP, CD14, TLR4-MD2 단백질들 간의 동적인 상호작용을 최신 첨단 실험기법을 통하여 분자수준에서 규명함으로써 생체 내 내독소 인식 및 전달메커니즘을 규명했다.
연구 방법 및 결과는 박테리아 감염에 의한 선천성 면역 연구에 새로운 방향을 제시할 것이며 특히 이 연구에서 규명한 분자적, 구조적 지식들은 패혈증 발병메커니즘 연구 및 치료제 개발에 적극 활용될 수 있을 것으로 기대된다.
김호민 교수는“박테리아 내독소가 생체 내 단백질들의 동적인 상호작용에 의해 면역세포로 전달되는 일련의 과정들을 분자수준에서 최초로 밝힌 것이다”며 “박테리아 내독소 인식 및 전달메커니즘 이해를 통하여 선천성 면역 유발 메커니즘 이해뿐만 아니라 패혈증 예방 및 치료제 개발에 기여할 것으로 기대된다”라고 말했다.
이번 연구는 미래창조과학부, 한국연구재단 기초연구사업(개인연구, 집단연구), IBS 나노의학연구단의 지원으로 수행됐다.
□ 그림 설명
그림1. 생체 내 박테리아 내독소 전달 메커니즘
2016.12.27 조회수 21494 -
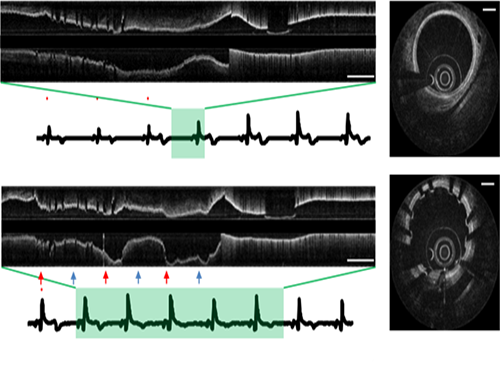 오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
2016.08.04 조회수 17764
오왕열 교수, 영상왜곡 없는 3차원 관상동맥 내시현미경 시스템 개발
〈 오 왕 열 교수 〉
우리 대학 기계공학과 오왕열 교수 연구팀(KI 헬스사이언스 연구소)이 영상왜곡 없이 관상동맥 내부를 정확히 이미징할 수 있는 관상동맥 내시현미경 시스템을 개발했다.
이 시스템으로 생체 관상동맥 내부 3차원 미세구조를 단일 심박 내에서 초고속 및 고해상도로 촬영했고 단일 심박 내에서 고해상도로 이미징 하는데 성공했다.
연구팀은 이 시스템을 사용해 인간과 비슷한 돼지 심장의 관상동맥 이미징에 성공함으로써 급성 심근경색으로 대표되는 관상동맥 질환의 정확한 진단 및 치료에 새로운 방향을 제시할 것으로 기대된다.
연구 결과는 심혈관분야의 임상저널인 ‘미국심장학회 학술지(JACC Cardiovascular Imaging : Journal of American College of Cardiology Cardiovascular Imaging)’ 5월호에 게재됐다.
돌연사의 가장 큰 원인인 급성 심근경색은 심장표면에 존재하면서 심장근육에 혈액을 공급하는 관상동맥(coronary artery)이 좁아지고 막혀 심장박동이 중지돼 갑작스럽게 사망하는 질환이다.
따라서 급성 심근경색을 예측하는 것은 매우 중요하며 이를 위해서는 의료진이 정확하게 진단할 수 있는 자료가 필수적이다.
광단층영상기술(OCT, Optical Coherence Tomography) 기반의 혈관 내시경은 현재 가장 높은 해상도의 심혈관 내부 영상을 제공하고 있다. 하지만 통상적으로 초당 100장 정도를 촬영하기 때문에 관상동맥 전체의 영상을 획득하는데 최소 3~5초가 소요된다.
이 사이 발생한 수차례의 심장 박동은 혈관의 반복적인 수축 및 팽창을 일으키고, 이는 정상적인 혈관도 마치 좁아진 것처럼 울퉁불퉁하게 보이는 영상왜곡으로 이어져 진단의 정확도가 떨어지게 된다.
연구팀이 개발한 단일 심박 주기 내 3차원 관상동맥 OCT 이미징 기술은 이러한 문제를 해결할 수 있는 핵심 기술이다. 초당 500장 촬영하는 고속 관상동맥 및 심박을 모니터링해 가장 움직임이 적은 영역을 자동적으로 포착 후 이미징을 수행하는 기술을 개발했다.
이를 통해 심장 박동으로 인한 영상 왜곡 없이 7센티미터 길이의 관상동맥을 0.7초 사이에 촬영해 내부 고해상도 영상을 확보할 수 있었다.
오 교수 연구팀은 고려대구로병원 김진원 교수 연구팀과의 협력을 통해 사람의 관상동맥과 비슷한 크기를 갖는 돼지 관상동맥의 단일 심박 내 초고속 3차원 이미징에 성공했다.
연구팀은 “이번 연구 결과를 통해 국내에서 개발한 세계 최고의 기술이 병원과의 긴밀한 협력을 통해 실제 임상에서의 한계를 극복하고 유용성을 인정받았다”고 밝혔다.
오 교수는 “심혈관 내 플라크 형태 분석과 스텐트(stent : 혈관 확장을 위해 혈관에 삽입하는 구조물) 삽입 등에 유용하게 사용 가능할 것으로 기대된다”며 “환자에 적용하기 위해 식약처 승인을 받기 위한 과정을 준비 중이다”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 단일심박 초고속 관상동맥 OCT로 획득한 돼지 관상동맥의 길이방향 영상
그림1. 관상동맥 OCT로 영상으로부터 얻은 관상동맥 3차원 구조 복원 영상
2016.08.04 조회수 17764 -
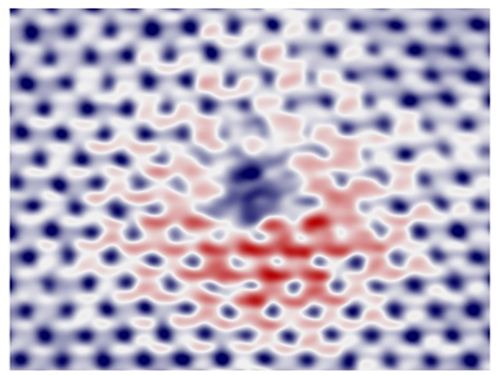 물질 간 온도차이로 전자구름 세계 첫 관찰
모든 물체는 매우 작은 알갱이인 원자로 이루어져 있다. 원자는 모든 무게를 함유하는 원자핵과 그 주변을 구름모양으로 둘러싼 상대적으로 매우 가벼운 전자로 구성돼 있다.
전자의 구름모양을 상온에서도 정확하게 관찰하는 새로운 전자현미경 기술이 국내 연구진에 의해 세계 최초로 개발됐다. 전자구름을 최초 관찰했던 주사터널링현미경 기술 이후 33년만이다.
KAIST(총장 강성모) 나노과학기술대학원 김용현 교수와 한국표준과학연구원 여호기 박사는 온도 차이를 이용해 전압을 발생시켜 선명한 원자의 영상은 물론 전자의 구름모양도 관찰할 수 있는 주사제벡현미경(SSM, Scanning Seebeck Microscope)을 개발했다.
연구 결과는 미국 물리학회가 발행하는 물리학분야 최고 권위지인 ‘피지컬 리뷰 레터스(Physical Review Letters)’ 1일자 온라인 판에 게재됐다.
상온에서도 매우 높은 해상도를 보여주는 주사제벡현미경은 그래핀·반도체의 결함을 원자단위까지 정확하게 관찰할 수 있어 이들 제품의 품질과 가격경쟁력 향상에 크게 기여할 수 있을 것으로 기대된다. 또 주사제백현미경의 원리를 열전소재 연구에 활용하면 차세대 고효율 열전소재를 개발하는데 도움이 될 것으로 전망된다.
고대 그리스 철학자 데모크리토스는 물체를 쪼개고 쪼개다보면 더 이상 쪼갤 수 없는 입자를 만나게 된다고 주장했고 이 입자를 ‘원자’라고 이름 붙였다. 이후 많은 가설과 실험을 거쳐 1920년대 ‘전자는 파동’이라는 양자역학이 확립되었다. 이제 과학자들은 원자 내부에는 원자핵과 주위를 둘러싼 구름 모양의 전자가 존재한다고 믿는다.
이러한 전자의 구름 모양을 최초로 관측한 기술이 1981년 스위스 IBM에서 발명된 주사터널링현미경(STM, Scanning Tunneling Microscope)이고, 현재까지 전자구름을 관측할 수 있는 유일한 기술이었다. 이 발명의 공로로 비니히와 로러 박사는 1986년 노벨 물리학상을 받았다.
그러나 이 기술은 아주 작은 전기신호를 감지하기 위해 초정밀·극저온·무진동 환경이 요구되는 등 응용에 많은 제약이 있었다. 또 전압을 가해 전류를 측정하는 기존 방식은 전류가 흐르면서 원자핵을 둘러싸고 있는 전자구름에 영향을 주어 실제로는 왜곡된 형태를 보는 것이다.
연구팀은 기존 방식을 완전히 탈피, 한쪽에 열을 가해 두 물질의 온도차로 전압이 발생하는 ‘제벡효과’라는 물리현상을 활용했다.
연구팀은 관찰하고자 하는 그래핀을 약간 가열된 온도(37~57℃)에 두고 탐침은 상온(27℃)에 있도록 해 이로 인해 발생되는 전압을 측정했다. 그 결과 상온에서 전자구름이 물결치는 모양을 세계 최초로 관찰하는데 성공했다. 결함주변에서 전자가 물결치는 모양은 양자역학 현상의 주요 특징 중 하나이다.
더 나아가 연구팀은 원자수준 제벡효과로부터 전자구름이 관측되는 이론적 원리를 양자역학에 기초해 규명했으며, 컴퓨터 시뮬레이션을 통해 실험 결과를 해석하는 기술도 확보했다.
김용현 교수는 “그동안 잘 알려져 있지 않은 나노 열물리 현상을 이해할 수 있는 기본 틀을 잡는데 성공했다”며 “주사제벡현미경 기술이 응집물질 표면연구의 중요한 새 도구로 자리 잡을 것”이라고 말했다.
여호기 박사는 “열과 전자의 상호작용을 이용하면 마치 기존 주사터널링현미경 기술에 자연적인 미분증폭기를 설치한 효과가 발생한다는 사실을 증명한 것”이이라며 “향후 기존 기술과 상호보완적으로 기능할 것”이라고 말했다.
한편, KAIST 나노과학기술대학원 김용현 교수와 한국표준과학연구원 여호기 박사가 공동으로 주도한 이번 연구는 KAIST 나노과학기술대학원 이의섭 석박통합과정 학생과 한국표준과학연구원 조상희 박사가 참여했고, 미래창조과학부 중견연구자지원사업 핵심연구와 글로벌프론티어사업, 신기술융합형성장동력사업의 지원 하에 수행되었다.
그림1. 주사제벡현미경의 개념도와 동작원리. 탐침과 샘플이 각각 다른 온도에 있고 이 때문에 전압이 발생한다.
그림2. 주사제벡현미경을 이용해 상온 그래핀에서 관측된 전자가 물결치는 모양.
2014.04.02 조회수 19869
물질 간 온도차이로 전자구름 세계 첫 관찰
모든 물체는 매우 작은 알갱이인 원자로 이루어져 있다. 원자는 모든 무게를 함유하는 원자핵과 그 주변을 구름모양으로 둘러싼 상대적으로 매우 가벼운 전자로 구성돼 있다.
전자의 구름모양을 상온에서도 정확하게 관찰하는 새로운 전자현미경 기술이 국내 연구진에 의해 세계 최초로 개발됐다. 전자구름을 최초 관찰했던 주사터널링현미경 기술 이후 33년만이다.
KAIST(총장 강성모) 나노과학기술대학원 김용현 교수와 한국표준과학연구원 여호기 박사는 온도 차이를 이용해 전압을 발생시켜 선명한 원자의 영상은 물론 전자의 구름모양도 관찰할 수 있는 주사제벡현미경(SSM, Scanning Seebeck Microscope)을 개발했다.
연구 결과는 미국 물리학회가 발행하는 물리학분야 최고 권위지인 ‘피지컬 리뷰 레터스(Physical Review Letters)’ 1일자 온라인 판에 게재됐다.
상온에서도 매우 높은 해상도를 보여주는 주사제벡현미경은 그래핀·반도체의 결함을 원자단위까지 정확하게 관찰할 수 있어 이들 제품의 품질과 가격경쟁력 향상에 크게 기여할 수 있을 것으로 기대된다. 또 주사제백현미경의 원리를 열전소재 연구에 활용하면 차세대 고효율 열전소재를 개발하는데 도움이 될 것으로 전망된다.
고대 그리스 철학자 데모크리토스는 물체를 쪼개고 쪼개다보면 더 이상 쪼갤 수 없는 입자를 만나게 된다고 주장했고 이 입자를 ‘원자’라고 이름 붙였다. 이후 많은 가설과 실험을 거쳐 1920년대 ‘전자는 파동’이라는 양자역학이 확립되었다. 이제 과학자들은 원자 내부에는 원자핵과 주위를 둘러싼 구름 모양의 전자가 존재한다고 믿는다.
이러한 전자의 구름 모양을 최초로 관측한 기술이 1981년 스위스 IBM에서 발명된 주사터널링현미경(STM, Scanning Tunneling Microscope)이고, 현재까지 전자구름을 관측할 수 있는 유일한 기술이었다. 이 발명의 공로로 비니히와 로러 박사는 1986년 노벨 물리학상을 받았다.
그러나 이 기술은 아주 작은 전기신호를 감지하기 위해 초정밀·극저온·무진동 환경이 요구되는 등 응용에 많은 제약이 있었다. 또 전압을 가해 전류를 측정하는 기존 방식은 전류가 흐르면서 원자핵을 둘러싸고 있는 전자구름에 영향을 주어 실제로는 왜곡된 형태를 보는 것이다.
연구팀은 기존 방식을 완전히 탈피, 한쪽에 열을 가해 두 물질의 온도차로 전압이 발생하는 ‘제벡효과’라는 물리현상을 활용했다.
연구팀은 관찰하고자 하는 그래핀을 약간 가열된 온도(37~57℃)에 두고 탐침은 상온(27℃)에 있도록 해 이로 인해 발생되는 전압을 측정했다. 그 결과 상온에서 전자구름이 물결치는 모양을 세계 최초로 관찰하는데 성공했다. 결함주변에서 전자가 물결치는 모양은 양자역학 현상의 주요 특징 중 하나이다.
더 나아가 연구팀은 원자수준 제벡효과로부터 전자구름이 관측되는 이론적 원리를 양자역학에 기초해 규명했으며, 컴퓨터 시뮬레이션을 통해 실험 결과를 해석하는 기술도 확보했다.
김용현 교수는 “그동안 잘 알려져 있지 않은 나노 열물리 현상을 이해할 수 있는 기본 틀을 잡는데 성공했다”며 “주사제벡현미경 기술이 응집물질 표면연구의 중요한 새 도구로 자리 잡을 것”이라고 말했다.
여호기 박사는 “열과 전자의 상호작용을 이용하면 마치 기존 주사터널링현미경 기술에 자연적인 미분증폭기를 설치한 효과가 발생한다는 사실을 증명한 것”이이라며 “향후 기존 기술과 상호보완적으로 기능할 것”이라고 말했다.
한편, KAIST 나노과학기술대학원 김용현 교수와 한국표준과학연구원 여호기 박사가 공동으로 주도한 이번 연구는 KAIST 나노과학기술대학원 이의섭 석박통합과정 학생과 한국표준과학연구원 조상희 박사가 참여했고, 미래창조과학부 중견연구자지원사업 핵심연구와 글로벌프론티어사업, 신기술융합형성장동력사업의 지원 하에 수행되었다.
그림1. 주사제벡현미경의 개념도와 동작원리. 탐침과 샘플이 각각 다른 온도에 있고 이 때문에 전압이 발생한다.
그림2. 주사제벡현미경을 이용해 상온 그래핀에서 관측된 전자가 물결치는 모양.
2014.04.02 조회수 19869 -
 실시간 조직검사 하는 초소형 현미경 개발
지난해 대장내시경 검사를 받은 34살 직장인 문 모씨는 5mm 크기의 용종이 발견돼 제거수술을 받았다. 대장암 가족병력이 있어 일주일 후 조직검사 결과가 나온다는 말에 초초한 마음으로 밤잠을 설쳤다.
우리 학교 바이오및뇌공학과 정기훈 교수 연구팀은 내시경에 장착해 실시간 조직검사를 할 수 있는 초소형 현미경을 개발, 광학분야 세계적 학술지인 옵틱스 익스프레스(Optics Express) 3월 5일자 온라인판에 게재됐다.
지름이 3.2mm에 불과한 이 현미경은 20f/s(초당 프레임 수)의 속도로 3mm 깊이까지 3차원으로 스캔할 수 있다. 분해능(최소 식별 거리)은 머리카락 두께(100μm)의 약 1/6인 17μm(마이크로미터, 100만분의 1미터)로 암세포, 정상세포, 염증세포 등을 정확하게 구별해 낼 수 있다.
이 기술 개발로 △보통 2~3일 걸리던 조직검사를 실시간으로 수행할 수 있고 △불필요한 조직검사 횟수를 줄일 수 있으며 △점막절제술 시 정확한 위치에 대한 시술이 가능해져 합병증을 감소시킬 수 있을 것으로 기대된다.
이와 함께 현재 전 세계 의료용 내시경장비는 일본 업체들이 독점하고 있어 진입장벽이 매우 높지만 정 교수 연구팀의 초소형 현미경 개발로 우리 기술이 새로운 의료기기 시장에 진입할 수 있을 것으로 기대된다.
기존 내시경 조직검사는 의심되는 병변부위를 절제한 후 현미경으로 조직검사를 수행하기 때문에 실시간 진단이 불가능하다. 또 조직검사 과정에서 세포 염색 등을 위한 시간이 오래 걸려 정확도가 떨어진다.
이러한 문제점을 극복하기 위해 물리적인 절개 없이 실시간으로 조직을 진단하는 광간섭단층촬영술(OCT, Optical Cohrence Tomography) 등 차세대 영상기법을 내시경에 접목하는 연구가 최근 활발히 진행 중이다.
소화기 내시경(지름 약 11mm)에 최신 영상기술을 접목하기 위해서는 직경 3.5mm이내의 한정된 공간에 초소형 현미경을 구현하는 것이 핵심이다. 최근에는 압전소자와 광섬유를 이용해 직접 스캐닝하는 방식이 주로 사용됐다.
그러나 기존 광섬유 스캐너는 광섬유의 대칭적 구조로 인해 발생하는 물리적 간섭현상에 매우 취약해 임상용 의료내시경 개발에 한계가 있었다.
연구팀은 미세전자기계기술(MEMS, Micro Electro Mechanical Systems)을 이용해 문제점을 해결했다.
연구팀은 광식각공정 및 심도반응성 이온기술을 이용해 미세 실리콘 보조 구조물을 제작했다. 이를 광섬유와 결합해 구동특성을 변조함으로써 간섭현상을 해결하고 광섬유 스캐너의 안정성을 크게 향상시켰다. 또 스캔 패턴을 변화시켜 시간에 따라 연속적으로 해상도를 높일 수 있는 이미지 복원방법을 구현했다.
그 결과 관찰한 부분의 3차원 구조를 최소 0.5초 내에 측정할 수 있었다. 스캔 시간이 늘어남에 따라 연구팀은 좀 더 정밀한 이미지를 얻을 수 있었다.
정기훈 교수는 “국내 내시경 업체 및 병원과 긴밀한 협력을 통해 시제품 제품 개발에 박차를 가하고 있다”며 “동물실험 및 임상실험을 거쳐 수년 내 상용화 될 것”이라고 제품 출시에 대한 기대감을 내비쳤다.
그림1. (A)광섬유 스캐너의 구동특성 변조를 위한 미세 실리콘 구조물의 제작공정 모식도 (B),(C)제작된 미세 실리콘 구조물 이미지 (D)미세 실리콘 구조물이 결합된 광섬유 스캐너
그림2. 현미내시경이 장착된 의료용 내시경
그림3. (A)내시현미경의 광간섭단층촬영 이미지 (B),(C),(D)개략적인 전체 구조의 파악 후 시간에 따라 정밀한 이미지를 얻을 수 있음. (E),(F)제작된 내시현미경을 통해 0.5초간 측정한 동물조직의 3차원 단층 이미징
그림4. 기존 광섬유(좌측)와 개발된 광섬유 스캐너의 1·2차원 구동 패턴(우측). 물리적 간섭현상으로 인해 깨끗한 라인스캐닝이 어려우며 나선형 스캐닝만 가능했으나 미세 실리콘 보조구조물을 이용해 간섭현상을 해결하고 스캔 패턴을 변형시킴.
2014.03.27 조회수 19266
실시간 조직검사 하는 초소형 현미경 개발
지난해 대장내시경 검사를 받은 34살 직장인 문 모씨는 5mm 크기의 용종이 발견돼 제거수술을 받았다. 대장암 가족병력이 있어 일주일 후 조직검사 결과가 나온다는 말에 초초한 마음으로 밤잠을 설쳤다.
우리 학교 바이오및뇌공학과 정기훈 교수 연구팀은 내시경에 장착해 실시간 조직검사를 할 수 있는 초소형 현미경을 개발, 광학분야 세계적 학술지인 옵틱스 익스프레스(Optics Express) 3월 5일자 온라인판에 게재됐다.
지름이 3.2mm에 불과한 이 현미경은 20f/s(초당 프레임 수)의 속도로 3mm 깊이까지 3차원으로 스캔할 수 있다. 분해능(최소 식별 거리)은 머리카락 두께(100μm)의 약 1/6인 17μm(마이크로미터, 100만분의 1미터)로 암세포, 정상세포, 염증세포 등을 정확하게 구별해 낼 수 있다.
이 기술 개발로 △보통 2~3일 걸리던 조직검사를 실시간으로 수행할 수 있고 △불필요한 조직검사 횟수를 줄일 수 있으며 △점막절제술 시 정확한 위치에 대한 시술이 가능해져 합병증을 감소시킬 수 있을 것으로 기대된다.
이와 함께 현재 전 세계 의료용 내시경장비는 일본 업체들이 독점하고 있어 진입장벽이 매우 높지만 정 교수 연구팀의 초소형 현미경 개발로 우리 기술이 새로운 의료기기 시장에 진입할 수 있을 것으로 기대된다.
기존 내시경 조직검사는 의심되는 병변부위를 절제한 후 현미경으로 조직검사를 수행하기 때문에 실시간 진단이 불가능하다. 또 조직검사 과정에서 세포 염색 등을 위한 시간이 오래 걸려 정확도가 떨어진다.
이러한 문제점을 극복하기 위해 물리적인 절개 없이 실시간으로 조직을 진단하는 광간섭단층촬영술(OCT, Optical Cohrence Tomography) 등 차세대 영상기법을 내시경에 접목하는 연구가 최근 활발히 진행 중이다.
소화기 내시경(지름 약 11mm)에 최신 영상기술을 접목하기 위해서는 직경 3.5mm이내의 한정된 공간에 초소형 현미경을 구현하는 것이 핵심이다. 최근에는 압전소자와 광섬유를 이용해 직접 스캐닝하는 방식이 주로 사용됐다.
그러나 기존 광섬유 스캐너는 광섬유의 대칭적 구조로 인해 발생하는 물리적 간섭현상에 매우 취약해 임상용 의료내시경 개발에 한계가 있었다.
연구팀은 미세전자기계기술(MEMS, Micro Electro Mechanical Systems)을 이용해 문제점을 해결했다.
연구팀은 광식각공정 및 심도반응성 이온기술을 이용해 미세 실리콘 보조 구조물을 제작했다. 이를 광섬유와 결합해 구동특성을 변조함으로써 간섭현상을 해결하고 광섬유 스캐너의 안정성을 크게 향상시켰다. 또 스캔 패턴을 변화시켜 시간에 따라 연속적으로 해상도를 높일 수 있는 이미지 복원방법을 구현했다.
그 결과 관찰한 부분의 3차원 구조를 최소 0.5초 내에 측정할 수 있었다. 스캔 시간이 늘어남에 따라 연구팀은 좀 더 정밀한 이미지를 얻을 수 있었다.
정기훈 교수는 “국내 내시경 업체 및 병원과 긴밀한 협력을 통해 시제품 제품 개발에 박차를 가하고 있다”며 “동물실험 및 임상실험을 거쳐 수년 내 상용화 될 것”이라고 제품 출시에 대한 기대감을 내비쳤다.
그림1. (A)광섬유 스캐너의 구동특성 변조를 위한 미세 실리콘 구조물의 제작공정 모식도 (B),(C)제작된 미세 실리콘 구조물 이미지 (D)미세 실리콘 구조물이 결합된 광섬유 스캐너
그림2. 현미내시경이 장착된 의료용 내시경
그림3. (A)내시현미경의 광간섭단층촬영 이미지 (B),(C),(D)개략적인 전체 구조의 파악 후 시간에 따라 정밀한 이미지를 얻을 수 있음. (E),(F)제작된 내시현미경을 통해 0.5초간 측정한 동물조직의 3차원 단층 이미징
그림4. 기존 광섬유(좌측)와 개발된 광섬유 스캐너의 1·2차원 구동 패턴(우측). 물리적 간섭현상으로 인해 깨끗한 라인스캐닝이 어려우며 나선형 스캐닝만 가능했으나 미세 실리콘 보조구조물을 이용해 간섭현상을 해결하고 스캔 패턴을 변형시킴.
2014.03.27 조회수 19266 -
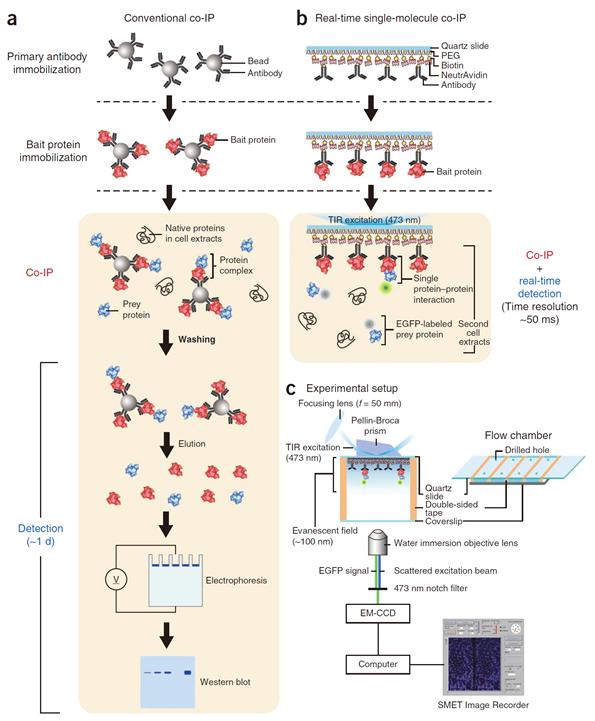 단분자 수준 단백질 상호작용 측정 성공
- 하나의 분자 수준에서 두 단백질 상호작용 실시간 관찰 성공 -- 면역침강 기법의 측정한계와 시간분해능 십만 배 향상 -
우리 학교 물리학과 윤태영 교수 연구팀이 하나의 분자 수준에서 실시간으로 두 단백질 사이의 상호작용을 관찰하는 기술을 개발한 연구 결과가 ‘네이처 프로토콜스 (Nature Protocols)’ 10월 호에 초청 논문으로 게재됐다.
윤 교수 연구팀은 먼저 하나의 분자까지 관찰할 수 있는 형광현미경을 개발했다.
연구팀은 분자생물학에서 단백질 상호작용 분석에 전통적으로 사용되는 ‘면역침강기법’을 개발한 현미경과 접목함으로써 ‘실시간 단분자 면역침강기법’을 개발해냈다. 이를 통해 연구팀은 순간적으로 상호작용이 반복되는 두 단백질의 반응을 수십 밀리 초 단위에서 정밀하게 관측하는데 성공하였다.
기존의 면역침강기법은 두 단백질 사이의 상호작용을 검출하기 위해 최소 1일 이상의 시간이 소요되었다. 이로 인해 약한 상호작용이나 순간적인 작용을 검출해 내는데 있어 그 한계가 있었다. 또한 결과로 나타난 그림이 단백질 밴드의 세기로 측정되므로 정량적인 분석이 어렵고, 실시간 관측이 불가능한 단점이 있었다.
연구팀은 이러한 기존 방법을 대폭 개량함과 동시에 단분자 수준에서 정밀한 기법을 개발해 내고자 하였다. 새롭게 개발된 기술을 사용하면, 1시간 이내에 원하는 단백질 사이의 상호작용을 관측할 수 있게 된다. 또한 두 단백질의 상호작용을 실시간으로 측정할 수 있으므로 상호작용의 현상을 보다 심도있게 측정하고, 계량할 수 있는 것이다.
또한 실험에 사용되는 모든 프로그램을 연구팀에서 직접 제작, 배포하여 본 기법에 대한 원천기술을 확보함과 동시에, 세계적인 인프라를 구축하는데 있어 토대를 마련하기도 하였다.
윤태영 교수는 “이번에 개발한 기술은 별도의 단백질 발현이나 정제과정을 필요로 하지 않아 매우 미량의 단백질 샘플만 주어져도 그 상호작용을 단분자 동역학 수준에서 매우 정밀하게 분석할 수 있다”며 “암 환자 조직에서 얻어진 발암 단백질도 정확히 분석할 수 있어 향후 맞춤형 항암제 개발을 위한 플랫폼을 마련할 수 있다”고 전했다.
그림1. 기존의 면역침강법과 새로이 개발된 실시간 단분자 면역침강법의 비교 모식도
2013.11.25 조회수 19861
단분자 수준 단백질 상호작용 측정 성공
- 하나의 분자 수준에서 두 단백질 상호작용 실시간 관찰 성공 -- 면역침강 기법의 측정한계와 시간분해능 십만 배 향상 -
우리 학교 물리학과 윤태영 교수 연구팀이 하나의 분자 수준에서 실시간으로 두 단백질 사이의 상호작용을 관찰하는 기술을 개발한 연구 결과가 ‘네이처 프로토콜스 (Nature Protocols)’ 10월 호에 초청 논문으로 게재됐다.
윤 교수 연구팀은 먼저 하나의 분자까지 관찰할 수 있는 형광현미경을 개발했다.
연구팀은 분자생물학에서 단백질 상호작용 분석에 전통적으로 사용되는 ‘면역침강기법’을 개발한 현미경과 접목함으로써 ‘실시간 단분자 면역침강기법’을 개발해냈다. 이를 통해 연구팀은 순간적으로 상호작용이 반복되는 두 단백질의 반응을 수십 밀리 초 단위에서 정밀하게 관측하는데 성공하였다.
기존의 면역침강기법은 두 단백질 사이의 상호작용을 검출하기 위해 최소 1일 이상의 시간이 소요되었다. 이로 인해 약한 상호작용이나 순간적인 작용을 검출해 내는데 있어 그 한계가 있었다. 또한 결과로 나타난 그림이 단백질 밴드의 세기로 측정되므로 정량적인 분석이 어렵고, 실시간 관측이 불가능한 단점이 있었다.
연구팀은 이러한 기존 방법을 대폭 개량함과 동시에 단분자 수준에서 정밀한 기법을 개발해 내고자 하였다. 새롭게 개발된 기술을 사용하면, 1시간 이내에 원하는 단백질 사이의 상호작용을 관측할 수 있게 된다. 또한 두 단백질의 상호작용을 실시간으로 측정할 수 있으므로 상호작용의 현상을 보다 심도있게 측정하고, 계량할 수 있는 것이다.
또한 실험에 사용되는 모든 프로그램을 연구팀에서 직접 제작, 배포하여 본 기법에 대한 원천기술을 확보함과 동시에, 세계적인 인프라를 구축하는데 있어 토대를 마련하기도 하였다.
윤태영 교수는 “이번에 개발한 기술은 별도의 단백질 발현이나 정제과정을 필요로 하지 않아 매우 미량의 단백질 샘플만 주어져도 그 상호작용을 단분자 동역학 수준에서 매우 정밀하게 분석할 수 있다”며 “암 환자 조직에서 얻어진 발암 단백질도 정확히 분석할 수 있어 향후 맞춤형 항암제 개발을 위한 플랫폼을 마련할 수 있다”고 전했다.
그림1. 기존의 면역침강법과 새로이 개발된 실시간 단분자 면역침강법의 비교 모식도
2013.11.25 조회수 19861 -
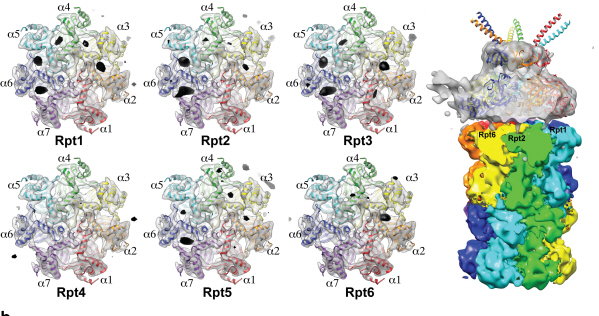 세포 내 단백질분해 복합체 조립과정 규명
- 바이오 투과전자현미경을 사용한 고해상도 3차원 구조분석 성공 -
- “신규 항암제 개발에 커다란 도움 될 것” -- 네이처(Nature) 5월 5일자 게재 -
단백질분자도 전자현미경을 이용해 관찰하고, 고해상도 3차원 구조를 분석하는 것이 가능해졌다.
우리 학교 의과학대학원 김호민 교수가 바이오 투과전자현미경을 이용해 세포 내 단백질의 분해를 담당하는 프로테아좀(proteasome) 복합체의 고해상도 구조를 규명했다.
이번 연구는 세계 최고 권위 학술지 ‘네이처(Nature, IF= 36.28)’ 5월 5일자 온라인판에 게재됐다.
우리 몸은 단백질의 생성과 소멸을 통해 세포 내 여러 가지 작용을 조절하고, 항상성을 유지한다. 프로테아좀 복합체는 폐기물 처리시설처럼 세포 내부에 있는 필요 없는 단백질들을 적절한 시기에 없애주면서 생체 조절의 핵심기능을 맡고 있다.
그러나 프로테아좀 복합체에 돌연변이가 생기면 사람에게 발생하는 주요 질병인 암, 퇴행성 뇌질환, 면역질환 등으로 이어질 수 있다.
현재 혈액암의 일종인 다발성 골수종의 치료제로 사용되고 있는 벨케이드(Velcade)가 바로 이 프로테아좀의 기능을 억제해 암세포 분열을 억제하는 항암제인데, 보다 더 약효가 좋고 부작용이 적은 항암제 및 질병치료제 개발을 위해 프로테아좀 복합체 관련 연구가 20년 이상 꾸준히 진행되고 있다.
30여개의 단백질이 모여서 만들어진 프로테아좀 복합체의 경우 크기가 매우 크고 구조가 복잡하기 때문에 기능을 이해하기 위한 3차원 구조 분석에 많은 어려움을 겪어왔다.
연구팀은 기존에 널리 사용되던 단백질 구조분석기술인 단백질결정학 기술 대신, 바이오 투과전자현미경 안에 얼려진 단백질샘플을 넣고 수백 장의 사진을 찍은 후 여러 각도에서 찍힌 단백질 사진을 고성능 컴퓨터를 이용해 분석함으로써 프로테아좀 복합체의 3차원 구조를 규명하는데 성공했다.
이 기술은 단백질결정학을 이용한 방법 보다 적은 단백질 샘플로 분석이 가능하며, 크기가 아주 큰 복합체 분석에 용이하다는 장점이 있다.
김호민 교수는 이번 연구에 대해 “프로테아좀 복합체 조립과정 이해 및 3차원 구조 규명은 생체 내 단백질 소멸 조절 과정에 대한 이해를 높일 뿐 아니라 이를 활용한 신약 개발이 활발히 이루어 질 것”이라고 말했다.
또 “국내 처음으로 도입된 바이오 투과전자현미경을 이용한 고해상도 단백질 구조분석은 기존의 단백질 결정학 기술로 접근이 어려웠던 매우 큰 단백질 복합체의 구조 분석을 가능케 할 것”이라며 “단백질결정학 기술과 바이오 투과전자현미경기술을 상호보완적으로 사용한다면 향후 여러 단백질복합체 3차 구조 연구에 큰 시너지효과를 가져올 수 있을 것으로 기대된다”고 말했다.
이번 연구는 KAIST 김호민 교수가 미국 캘리포니아대학 샌프란시스코 캠퍼스에서 박사 후 연구원으로 있을 당시부터 수행해 온 연구로 이판 쳉(Yifan Cheng) 교수의 지도를 받았으며, 하버드대, 콜로라도대와 공동으로 수행됐다.
그림1. 바이오 투과전자현미경으로 찍은 얼려진 상태의 단백질 샘플(프로테아좀 복합체) 사진
그림2. 바이오 투과전자현미경 이미지 분석을 통한 단백질 3차 구조
2013.05.06 조회수 16661
세포 내 단백질분해 복합체 조립과정 규명
- 바이오 투과전자현미경을 사용한 고해상도 3차원 구조분석 성공 -
- “신규 항암제 개발에 커다란 도움 될 것” -- 네이처(Nature) 5월 5일자 게재 -
단백질분자도 전자현미경을 이용해 관찰하고, 고해상도 3차원 구조를 분석하는 것이 가능해졌다.
우리 학교 의과학대학원 김호민 교수가 바이오 투과전자현미경을 이용해 세포 내 단백질의 분해를 담당하는 프로테아좀(proteasome) 복합체의 고해상도 구조를 규명했다.
이번 연구는 세계 최고 권위 학술지 ‘네이처(Nature, IF= 36.28)’ 5월 5일자 온라인판에 게재됐다.
우리 몸은 단백질의 생성과 소멸을 통해 세포 내 여러 가지 작용을 조절하고, 항상성을 유지한다. 프로테아좀 복합체는 폐기물 처리시설처럼 세포 내부에 있는 필요 없는 단백질들을 적절한 시기에 없애주면서 생체 조절의 핵심기능을 맡고 있다.
그러나 프로테아좀 복합체에 돌연변이가 생기면 사람에게 발생하는 주요 질병인 암, 퇴행성 뇌질환, 면역질환 등으로 이어질 수 있다.
현재 혈액암의 일종인 다발성 골수종의 치료제로 사용되고 있는 벨케이드(Velcade)가 바로 이 프로테아좀의 기능을 억제해 암세포 분열을 억제하는 항암제인데, 보다 더 약효가 좋고 부작용이 적은 항암제 및 질병치료제 개발을 위해 프로테아좀 복합체 관련 연구가 20년 이상 꾸준히 진행되고 있다.
30여개의 단백질이 모여서 만들어진 프로테아좀 복합체의 경우 크기가 매우 크고 구조가 복잡하기 때문에 기능을 이해하기 위한 3차원 구조 분석에 많은 어려움을 겪어왔다.
연구팀은 기존에 널리 사용되던 단백질 구조분석기술인 단백질결정학 기술 대신, 바이오 투과전자현미경 안에 얼려진 단백질샘플을 넣고 수백 장의 사진을 찍은 후 여러 각도에서 찍힌 단백질 사진을 고성능 컴퓨터를 이용해 분석함으로써 프로테아좀 복합체의 3차원 구조를 규명하는데 성공했다.
이 기술은 단백질결정학을 이용한 방법 보다 적은 단백질 샘플로 분석이 가능하며, 크기가 아주 큰 복합체 분석에 용이하다는 장점이 있다.
김호민 교수는 이번 연구에 대해 “프로테아좀 복합체 조립과정 이해 및 3차원 구조 규명은 생체 내 단백질 소멸 조절 과정에 대한 이해를 높일 뿐 아니라 이를 활용한 신약 개발이 활발히 이루어 질 것”이라고 말했다.
또 “국내 처음으로 도입된 바이오 투과전자현미경을 이용한 고해상도 단백질 구조분석은 기존의 단백질 결정학 기술로 접근이 어려웠던 매우 큰 단백질 복합체의 구조 분석을 가능케 할 것”이라며 “단백질결정학 기술과 바이오 투과전자현미경기술을 상호보완적으로 사용한다면 향후 여러 단백질복합체 3차 구조 연구에 큰 시너지효과를 가져올 수 있을 것으로 기대된다”고 말했다.
이번 연구는 KAIST 김호민 교수가 미국 캘리포니아대학 샌프란시스코 캠퍼스에서 박사 후 연구원으로 있을 당시부터 수행해 온 연구로 이판 쳉(Yifan Cheng) 교수의 지도를 받았으며, 하버드대, 콜로라도대와 공동으로 수행됐다.
그림1. 바이오 투과전자현미경으로 찍은 얼려진 상태의 단백질 샘플(프로테아좀 복합체) 사진
그림2. 바이오 투과전자현미경 이미지 분석을 통한 단백질 3차 구조
2013.05.06 조회수 16661