-
 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12
조회수 11899
-
 디스플레이 소재로 빛 이용해 친환경 암모니아 합성법 제시
우리 대학 생명화학공학과 이도창 교수, 이상엽 특훈교수, 박영신 연구교수 연구팀이 디스플레이 소재인 양자점(퀀텀닷)을 이용해 *질소 고정 박테리아의 암모니아 생산 효율을 대폭 늘렸다고 16일 밝혔다.
☞ 질소 고정(Nitrogen Fixation) : 공기 중 질소 기체 분자(N₂)를 암모니아(NH₃)를 비롯한 질소화합물로 전환하는 과정을 말한다.
이 교수 연구팀은 양자점에 의해 흡수된 빛 에너지가 박테리아의 암모니아 합성 반응에 사용되도록 설계했으며, 그 결과 박테리아의 암모니아 생산량을 큰 폭으로 증가시킬 수 있었다. 이를 위해 연구팀은 양자점을 질소고정 박테리아 안에 더 많이 넣을 수 있는 방법을 제시했다.
생명화학공학과 고성준 박사가 제1저자로 참여한 이번 연구의 결과는 국제 학술지 `미국 화학회지(JACS)'에 표지 논문으로 선정돼 출판됐다. (논문명 : Light-Driven Ammonia Production by Azotobacter vinelandii Cultured in Medium Containing Colloidal Quantum Dots).
질소 고정 박테리아는 질소 고정 효소를 이용해 대기 중 질소를 암모니아로 전환하여 생장에 필요한 단백질을 생산한다. 이러한 질소 고정 반응은 화학적 암모니아 합성법인 하버-보슈 공정에 비해 에너지 소비와 이산화탄소 배출이 현저하게 적다.
하지만, 박테리아는 생장에 필요한 만큼만 암모니아를 생산하도록 진화돼 질소 고정 효소의 반응이 느리기에 이를 산업적으로 활용하기 어렵다. 질소 고정 반응이 느린 이유는 효소의 두 가지 구성요소(전자 전달부, 촉매 반응부)의 비효율적인 상호작용 때문이다. 전자 전달부가 촉매 반응부에 전자를 공급한 후, 반드시 탈착돼야만 촉매 반응부가 새로운 전자를 추가로 공급받아 암모니아를 생성할 수 있다.
연구팀은 문제 해결을 위해 빛을 흡수하는 양자점을 박테리아의 질소 고정 반응에 전자 공급원으로 활용해 나노·바이오 복합 시스템을 구축했다. 양자점은 수 나노미터의 작은 크기를 갖는 반도체 나노입자이며 디스플레이 소재로 많이 알려진 물질이다. 하지만, 양자점이 흡수한 빛 에너지를 표면에 쉽게 전달할 수 있도록 입자의 구조 및 표면을 제어하면 광 감응 및 광 촉매 소재로도 우수한 특성을 보인다. 연구팀은 질소 고정 효소의 전자 전달부 역할을 양자점으로 대체하기 위해 양자점의 코어/쉘 구조를 전자 전달에 유리하게 설계했다. 또한, 양자점이 생물학적 시스템에 결합할 수 있도록 표면 화학 특성을 제어해 수(水)분산 특성을 확보했다.
연구팀은 구조 및 표면이 제어된 양자점을 질소 고정 박테리아의 대사활동이 가장 활발한 성장기에 추가해, 박테리아의 능동적인 양자점 흡수를 유도했다. 이렇게 제작된 양자점-박테리아 복합 시스템에 빛을 조사한 결과, 질소고정 반응 속도가 증가하며 암모니아 생산량이 대폭 증가함을 확인했다. 고성준 박사는 "디스플레이 소재와 미생물의 장점을 합해 빛 에너지를 이용한 새로운 방식의 암모니아 합성법을 제시한 결과ˮ라며 "이번 연구를 활용한 그린 암모니아 생산 플랫폼을 구축한다면, 환경 및 에너지 문제에 적극적으로 대응할 수 있을 것이다ˮ라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
디스플레이 소재로 빛 이용해 친환경 암모니아 합성법 제시
우리 대학 생명화학공학과 이도창 교수, 이상엽 특훈교수, 박영신 연구교수 연구팀이 디스플레이 소재인 양자점(퀀텀닷)을 이용해 *질소 고정 박테리아의 암모니아 생산 효율을 대폭 늘렸다고 16일 밝혔다.
☞ 질소 고정(Nitrogen Fixation) : 공기 중 질소 기체 분자(N₂)를 암모니아(NH₃)를 비롯한 질소화합물로 전환하는 과정을 말한다.
이 교수 연구팀은 양자점에 의해 흡수된 빛 에너지가 박테리아의 암모니아 합성 반응에 사용되도록 설계했으며, 그 결과 박테리아의 암모니아 생산량을 큰 폭으로 증가시킬 수 있었다. 이를 위해 연구팀은 양자점을 질소고정 박테리아 안에 더 많이 넣을 수 있는 방법을 제시했다.
생명화학공학과 고성준 박사가 제1저자로 참여한 이번 연구의 결과는 국제 학술지 `미국 화학회지(JACS)'에 표지 논문으로 선정돼 출판됐다. (논문명 : Light-Driven Ammonia Production by Azotobacter vinelandii Cultured in Medium Containing Colloidal Quantum Dots).
질소 고정 박테리아는 질소 고정 효소를 이용해 대기 중 질소를 암모니아로 전환하여 생장에 필요한 단백질을 생산한다. 이러한 질소 고정 반응은 화학적 암모니아 합성법인 하버-보슈 공정에 비해 에너지 소비와 이산화탄소 배출이 현저하게 적다.
하지만, 박테리아는 생장에 필요한 만큼만 암모니아를 생산하도록 진화돼 질소 고정 효소의 반응이 느리기에 이를 산업적으로 활용하기 어렵다. 질소 고정 반응이 느린 이유는 효소의 두 가지 구성요소(전자 전달부, 촉매 반응부)의 비효율적인 상호작용 때문이다. 전자 전달부가 촉매 반응부에 전자를 공급한 후, 반드시 탈착돼야만 촉매 반응부가 새로운 전자를 추가로 공급받아 암모니아를 생성할 수 있다.
연구팀은 문제 해결을 위해 빛을 흡수하는 양자점을 박테리아의 질소 고정 반응에 전자 공급원으로 활용해 나노·바이오 복합 시스템을 구축했다. 양자점은 수 나노미터의 작은 크기를 갖는 반도체 나노입자이며 디스플레이 소재로 많이 알려진 물질이다. 하지만, 양자점이 흡수한 빛 에너지를 표면에 쉽게 전달할 수 있도록 입자의 구조 및 표면을 제어하면 광 감응 및 광 촉매 소재로도 우수한 특성을 보인다. 연구팀은 질소 고정 효소의 전자 전달부 역할을 양자점으로 대체하기 위해 양자점의 코어/쉘 구조를 전자 전달에 유리하게 설계했다. 또한, 양자점이 생물학적 시스템에 결합할 수 있도록 표면 화학 특성을 제어해 수(水)분산 특성을 확보했다.
연구팀은 구조 및 표면이 제어된 양자점을 질소 고정 박테리아의 대사활동이 가장 활발한 성장기에 추가해, 박테리아의 능동적인 양자점 흡수를 유도했다. 이렇게 제작된 양자점-박테리아 복합 시스템에 빛을 조사한 결과, 질소고정 반응 속도가 증가하며 암모니아 생산량이 대폭 증가함을 확인했다. 고성준 박사는 "디스플레이 소재와 미생물의 장점을 합해 빛 에너지를 이용한 새로운 방식의 암모니아 합성법을 제시한 결과ˮ라며 "이번 연구를 활용한 그린 암모니아 생산 플랫폼을 구축한다면, 환경 및 에너지 문제에 적극적으로 대응할 수 있을 것이다ˮ라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.06.16
조회수 11900
-
 암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23
조회수 12737
-
 체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26
조회수 9060
-
 췌장 내 미토콘드리아 기능 장애, 췌장염에 이어 췌장암 위험성 높여
우리 대학 의과학대학원 서재명 교수 연구팀은 Salk 연구소 로날드 에반스(Ronald M. Evans) 교수, Harbor-UCLA 병원 에이지 요시하라(Eiji Yoshihara) 교수와 국제공동 연구를 통해 에너지 대사 및 생리기능 조절에 중요한 에스트로겐 관련 수용체 감마(ERRγ)의 기능부전이 췌장염 및 췌장 외분비선 질환을 유발할 수 있음을 22일 밝혔다.
췌장조직에서는 하루 동안 한 컵 정도의 소화액을 생산하고 분비한다. 그러나 소화액이 장으로 이동하기 전에 활성화되면 췌장조직 자체에 심각한 손상이 일어나며, 이로 인해 췌장염이 발생하게 된다. 대표적인 췌장염의 원인은 담석이 담췌관을 막아 소화액이 역류하거나 과도한 음주로 인해 췌장 세포의 에너지 항상성이 무너지면서 세포사멸을 유발함으로써 발병한다고 알려져 있다. 만성적인 췌장염은 극심한 고통을 수반함과 더불어 치사율 높은 췌장암의 원인이 될 수도 있어서 학계에서는 주목하고 있는 분야다.
연구팀은 “다량의 소화액을 분비하는 췌장 세포는 많은 양의 에너지를 소모하기 때문에, 에너지대사 기능이 저하되면 췌장염을 비롯한 다양한 췌장 질환에 노출될 수 있다. 건강한 췌장기능을 유지하기 위해 강력한 미토콘드리아의 에너지 생산 체계가 필요하다고 알려져 있었으나 췌장 미토콘드리아 에너지대사의 핵심 조절인자는 알려져 있지 않았다. 본 연구 결과는 ERRγ가 췌장 에너지 생성에 필수적일 뿐만 아니라 ERRγ의 기능이상이 췌장염과 췌장암 초기 발병기전에 관여한다는 점을 보여준다”고 밝혔다.
연구진은 췌장염 환자의 췌장 세포가 정상세포에 비해 ERRγ 유전자 활성이 감소하여 있음을 밝혀 임상적 연결고리를 보여주었으며, 이러한 발견은 ERRγ의 유전자 활성 조절을 통해 췌장염과 췌장암을 예방하거나 치료할 새로운 가능성을 열었다.
현재 연구팀은 미토콘드리아 조절 장애 및 췌장염이 초래하는 초기 췌장암을 예방하거나 치료하는 데 있어 ERRγ 활성 조절을 활용한 후속 연구를 이어가고 있다고 전했다.
우리 대학 의과학대학원 최진혁 박사와 Salk 연구소 오태규 박사가 공동 제1저자로 참여한 이번 연구는 4월 21일 소화기분야 최고 권위 저널인 ‘가스트로엔터롤로지 (Gastroenterology, IF 22.682)’ 온라인판에 게재됐다. (논문명: Estrogen-Related Receptor γ maintains pancreatic acinar cell function and identity by regulating cellular metabolism).
이번 연구는 과학기술정보통신부와 대구경북첨단의료산업진흥재단 원천기술개발사업, 과학기술정보통신부 글로벌연구실사업 및 한국과학기술원 국제공동연구지원사업의 지원을 받아 수행됐다.
췌장 내 미토콘드리아 기능 장애, 췌장염에 이어 췌장암 위험성 높여
우리 대학 의과학대학원 서재명 교수 연구팀은 Salk 연구소 로날드 에반스(Ronald M. Evans) 교수, Harbor-UCLA 병원 에이지 요시하라(Eiji Yoshihara) 교수와 국제공동 연구를 통해 에너지 대사 및 생리기능 조절에 중요한 에스트로겐 관련 수용체 감마(ERRγ)의 기능부전이 췌장염 및 췌장 외분비선 질환을 유발할 수 있음을 22일 밝혔다.
췌장조직에서는 하루 동안 한 컵 정도의 소화액을 생산하고 분비한다. 그러나 소화액이 장으로 이동하기 전에 활성화되면 췌장조직 자체에 심각한 손상이 일어나며, 이로 인해 췌장염이 발생하게 된다. 대표적인 췌장염의 원인은 담석이 담췌관을 막아 소화액이 역류하거나 과도한 음주로 인해 췌장 세포의 에너지 항상성이 무너지면서 세포사멸을 유발함으로써 발병한다고 알려져 있다. 만성적인 췌장염은 극심한 고통을 수반함과 더불어 치사율 높은 췌장암의 원인이 될 수도 있어서 학계에서는 주목하고 있는 분야다.
연구팀은 “다량의 소화액을 분비하는 췌장 세포는 많은 양의 에너지를 소모하기 때문에, 에너지대사 기능이 저하되면 췌장염을 비롯한 다양한 췌장 질환에 노출될 수 있다. 건강한 췌장기능을 유지하기 위해 강력한 미토콘드리아의 에너지 생산 체계가 필요하다고 알려져 있었으나 췌장 미토콘드리아 에너지대사의 핵심 조절인자는 알려져 있지 않았다. 본 연구 결과는 ERRγ가 췌장 에너지 생성에 필수적일 뿐만 아니라 ERRγ의 기능이상이 췌장염과 췌장암 초기 발병기전에 관여한다는 점을 보여준다”고 밝혔다.
연구진은 췌장염 환자의 췌장 세포가 정상세포에 비해 ERRγ 유전자 활성이 감소하여 있음을 밝혀 임상적 연결고리를 보여주었으며, 이러한 발견은 ERRγ의 유전자 활성 조절을 통해 췌장염과 췌장암을 예방하거나 치료할 새로운 가능성을 열었다.
현재 연구팀은 미토콘드리아 조절 장애 및 췌장염이 초래하는 초기 췌장암을 예방하거나 치료하는 데 있어 ERRγ 활성 조절을 활용한 후속 연구를 이어가고 있다고 전했다.
우리 대학 의과학대학원 최진혁 박사와 Salk 연구소 오태규 박사가 공동 제1저자로 참여한 이번 연구는 4월 21일 소화기분야 최고 권위 저널인 ‘가스트로엔터롤로지 (Gastroenterology, IF 22.682)’ 온라인판에 게재됐다. (논문명: Estrogen-Related Receptor γ maintains pancreatic acinar cell function and identity by regulating cellular metabolism).
이번 연구는 과학기술정보통신부와 대구경북첨단의료산업진흥재단 원천기술개발사업, 과학기술정보통신부 글로벌연구실사업 및 한국과학기술원 국제공동연구지원사업의 지원을 받아 수행됐다.
2022.04.22
조회수 9241
-
 일산화질소로부터 암모니아 생산하는 고효율 전기화학 기술 개발
발전소, 산업 시설 등에서 배출되는 배기가스 내 주요 대기오염 물질인 일산화질소(NO)로부터 암모니아를 생산하는 기술이 국내 연구진에 의해 개발됐다. 대기 중에서 초미세먼지를 유발하는 골칫거리인 일산화질소를 사용해 최근 수소 저장체로 주목받는 암모니아를 생산한 것이다.
우리 대학 건설및환경공학과 한종인 교수 연구팀이 UNIST(총장 이용훈) 에너지화학공학과 권영국 교수팀, 한국화학연구원(원장 이미혜) 환경자원연구센터 김동연 박사와 함께 일산화질소로부터 암모니아를 생산하는 고효율 전기화학 시스템을 개발했다고 23일 밝혔다. 개발된 시스템은 비싼 귀금속 촉매 대신 값싼 철 촉매를 이용해 상온 및 상압 조건에서 세계 최고 수준의 전기화학적 암모니아 생산 속도를 기록했다.
일산화질소는 발전소, 산업용 보일러, 제철소 등 연소시설에서 배출되는 질소산화물(NOx)의 대부분(95% 이상)을 차지하고 있는 유해 가스로, 호흡기 질환을 유발할 뿐만 아니라 산성비 및 대기 중 오존을 생성해 배출량이 엄격히 규제되고 있다. 현재 대부분의 처리 기술은 일산화질소의 단순 제거에만 초점을 맞추고 있지만 한 교수팀은 버려지는 일산화질소의 가치에 주목했다. 일산화질소의 높은 반응성을 이용해 적은 에너지만으로 유용 자원인 암모니아 생산의 가능성을 본 것이다.
연구팀은 물에 잘 녹지 않는 일산화질소의 한계를 극복하기 위해 기존의철-킬레이트를 포함한 일산화질소 흡수제를 사용하는 방식 대신 기체를 직접적으로 전극에 주입하는 기체 확산 전극을 사용해 물질전달 속도를 획기적으로 늘렸다. 이로써 공정에 소모되는 화학약품 비용을 줄이고 전기화학 셀 운전 시 발생하는 폐수 처리를 간편화했다.
나노 크기의 철 촉매를 전극에 도포해 부반응을 억제하고 암모니아에 대한 생성물의 선택도를 확보했으며, 전기화학적 암모니아 생산 성능을 결정하는 중요한 지표인 암모니아 생산 속도는 1,236μmolcm-2h-1를 기록했다. 이는 기존의 질소 기체(N2)를 활용한 전기화학적 암모니아 생산 속도 범위인 10μmolcm-2h-1을 100배 이상 넘어선 수준이다.
이러한 접근법은 대부분의 전기화학 반응에서 100%의 순수한 원료 기체를 필요로 하는 것과 달리 사용되는 일산화질소 가스의 농도를 1~10%까지 낮출 수 있어 해당 기술의 현장 적용성을 높일 수 있을 것으로 기대된다.
또한 기존의 암모니아 생산 공정인 하버-보쉬법이 섭씨 400도, 200기압 이상의 고에너지 조건을 요구하는 데 반해, 연구팀이 개발한 전기화학 시스템은 상온 및 상압 조건에서 암모니아 생산이 가능해 공정 설비와 비용 부담을 크게 줄일 수 있을 전망이다.
이번 연구를 주도적으로 진행한 한 교수 연구팀의 천선정 박사과정 학생은 "최근 대기오염, 탄소 중립 등의 이슈가 꾸준히 확산하는 가운데 지속할 수 있는 기술 개발에 대한 중요성이 커지고 있다ˮ며 "대기오염의 원인을 효과적으로 제거하는 동시에 탄소배출이 없는 암모니아 연료를 생산해 새로운 관점으로 환경문제를 해결하고자 했다ˮ고 말했다.
우리 대학 천선정 박사과정, 창원대학교 김원준 교수가 공동 제1 저자로 참여한 이번 연구성과는 저명 국제 학술지인 `ACS 에너지 레터스(Energy Letters)'에 3월 11일 자로 출판됐으며, 속표지논문으로 선정됐다. (논문명: Electro-synthesis of ammonia from dilute nitric oxide on a gas diffusion electrode).
한편 이번 연구는 한국에너지기술평가원, 한국연구재단 등의 지원을 받아 수행됐다.
일산화질소로부터 암모니아 생산하는 고효율 전기화학 기술 개발
발전소, 산업 시설 등에서 배출되는 배기가스 내 주요 대기오염 물질인 일산화질소(NO)로부터 암모니아를 생산하는 기술이 국내 연구진에 의해 개발됐다. 대기 중에서 초미세먼지를 유발하는 골칫거리인 일산화질소를 사용해 최근 수소 저장체로 주목받는 암모니아를 생산한 것이다.
우리 대학 건설및환경공학과 한종인 교수 연구팀이 UNIST(총장 이용훈) 에너지화학공학과 권영국 교수팀, 한국화학연구원(원장 이미혜) 환경자원연구센터 김동연 박사와 함께 일산화질소로부터 암모니아를 생산하는 고효율 전기화학 시스템을 개발했다고 23일 밝혔다. 개발된 시스템은 비싼 귀금속 촉매 대신 값싼 철 촉매를 이용해 상온 및 상압 조건에서 세계 최고 수준의 전기화학적 암모니아 생산 속도를 기록했다.
일산화질소는 발전소, 산업용 보일러, 제철소 등 연소시설에서 배출되는 질소산화물(NOx)의 대부분(95% 이상)을 차지하고 있는 유해 가스로, 호흡기 질환을 유발할 뿐만 아니라 산성비 및 대기 중 오존을 생성해 배출량이 엄격히 규제되고 있다. 현재 대부분의 처리 기술은 일산화질소의 단순 제거에만 초점을 맞추고 있지만 한 교수팀은 버려지는 일산화질소의 가치에 주목했다. 일산화질소의 높은 반응성을 이용해 적은 에너지만으로 유용 자원인 암모니아 생산의 가능성을 본 것이다.
연구팀은 물에 잘 녹지 않는 일산화질소의 한계를 극복하기 위해 기존의철-킬레이트를 포함한 일산화질소 흡수제를 사용하는 방식 대신 기체를 직접적으로 전극에 주입하는 기체 확산 전극을 사용해 물질전달 속도를 획기적으로 늘렸다. 이로써 공정에 소모되는 화학약품 비용을 줄이고 전기화학 셀 운전 시 발생하는 폐수 처리를 간편화했다.
나노 크기의 철 촉매를 전극에 도포해 부반응을 억제하고 암모니아에 대한 생성물의 선택도를 확보했으며, 전기화학적 암모니아 생산 성능을 결정하는 중요한 지표인 암모니아 생산 속도는 1,236μmolcm-2h-1를 기록했다. 이는 기존의 질소 기체(N2)를 활용한 전기화학적 암모니아 생산 속도 범위인 10μmolcm-2h-1을 100배 이상 넘어선 수준이다.
이러한 접근법은 대부분의 전기화학 반응에서 100%의 순수한 원료 기체를 필요로 하는 것과 달리 사용되는 일산화질소 가스의 농도를 1~10%까지 낮출 수 있어 해당 기술의 현장 적용성을 높일 수 있을 것으로 기대된다.
또한 기존의 암모니아 생산 공정인 하버-보쉬법이 섭씨 400도, 200기압 이상의 고에너지 조건을 요구하는 데 반해, 연구팀이 개발한 전기화학 시스템은 상온 및 상압 조건에서 암모니아 생산이 가능해 공정 설비와 비용 부담을 크게 줄일 수 있을 전망이다.
이번 연구를 주도적으로 진행한 한 교수 연구팀의 천선정 박사과정 학생은 "최근 대기오염, 탄소 중립 등의 이슈가 꾸준히 확산하는 가운데 지속할 수 있는 기술 개발에 대한 중요성이 커지고 있다ˮ며 "대기오염의 원인을 효과적으로 제거하는 동시에 탄소배출이 없는 암모니아 연료를 생산해 새로운 관점으로 환경문제를 해결하고자 했다ˮ고 말했다.
우리 대학 천선정 박사과정, 창원대학교 김원준 교수가 공동 제1 저자로 참여한 이번 연구성과는 저명 국제 학술지인 `ACS 에너지 레터스(Energy Letters)'에 3월 11일 자로 출판됐으며, 속표지논문으로 선정됐다. (논문명: Electro-synthesis of ammonia from dilute nitric oxide on a gas diffusion electrode).
한편 이번 연구는 한국에너지기술평가원, 한국연구재단 등의 지원을 받아 수행됐다.
2022.03.24
조회수 14214
-
 유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24
조회수 12257
-
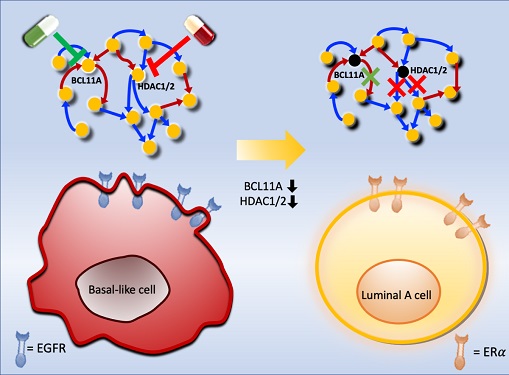 악성 유방암 세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 악성 유방암세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술을 개발하는 데 성공했다고 30일 밝혔다.
연구팀은 유방암 아류 중에서 가장 악성으로 알려진 삼중음성 유방암(basal-like 혹은 triple negative) 환자들과 호르몬 치료가 가능한 루미날-A 유방암(luminal-A) 환자들의 유전자 네트워크를 컴퓨터시뮬레이션을 통해 분석함으로써 삼중음성 유방암세포를 루미날-A 유방암세포로 변환하는데 필요한 핵심 인자를 규명했다. 그리고 이를 조절해 삼중음성 유방암세포를 루미날-A 유방암세포로 리프로그래밍한 뒤 호르몬 치료를 시행하는 새로운 치료 원리를 개발했다.
우리 대학 최새롬 박사과정, 황채영 박사, 이종훈 박사과정 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치 (Cancer Research)' 11월 30일 字 논문으로 출판됐다. (논문명: Network analysis identifies regulators of basal-like breast cancer reprogramming and endocrine therapy vulnerability)
현재 삼중음성 유방암 환자들에게 적용되는 항암 화학요법은 빠르게 분열해 전이를 일으키는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 하지만 이러한 치료는 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 심각한 부작용을 일으킨다. 또한 삼중음성 유방암세포들은 이와 같은 독성항암제에 처음부터 내성을 갖거나 새로운 내성을 획득하면서 결국 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 삼중음성 유방암에 대한 현재의 항암치료는 내성을 갖는 암세포를 없애기 위해 더 많은 정상세포의 사멸을 감수해야만 하는 큰 한계를 지니고 있다.
이를 극복하기 위해 암세포만을 특이적으로 공격하는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽이려는 공통적인 원리 때문에 근본적인 한계를 가진다.
조 교수 연구팀은 시스템생물학 연구기법을 통해 악성 유방암세포인 삼중음성 유방암세포를 호르몬 치료가 가능한 루미날-A 유방암세포로 변환시킨 뒤 치료하는 새로운 개념의 치료전략을 개발했다. 이를 위해 유전자 네트워크의 수학모델을 개발하고 대규모 컴퓨터시뮬레이션 분석과 복잡계 네트워크 제어기술을 적용한 결과 두 개의 핵심 분자 타겟인 `BCL11A'와 `HDAC1/2'를 발굴했다.
조 교수 연구팀은 BCL11A와 HDAC1/2를 억제함으로써 삼중음성 유방암세포를 효과적으로 루미날-A 유방암세포로 변환시킬 수 있음을 분자 세포실험을 통해 증명했다. 삼중음성 유방암세포에서 이 핵심 인자들을 억제했을 때 세포의 분열이 감소하고, 삼중음성 유방암세포의 주요 세포성장 신호 흐름 경로인 `EGFR'과 관련된 인자들의 활동이 감소했으며, 루미날-A 유방암세포의 주요 세포성장 신호흐름 경로인 `ERa' 신호전달 경로 인자들의 활성이 회복되는 것을 확인했다.
이번 연구에서 발굴된 분자 타겟 중 BCL11A 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 임상실험을 통해 악성 유방암세포를 치료 가능한 세포상태로 리프로그래밍 함으로써 안전하고 효과적으로 치료하는 새로운 치료기술이 실현될 수 있을 것으로 보인다. 특히 이처럼 암세포의 성질을 되돌리거나 변환하는 암세포 리프로그래밍 기반의 새로운 치료전략이 임상에서 실현된다면 현재 항암치료의 많은 부작용과 내성 발생을 근본적으로 해결함으로써 암 환자의 고통을 최소화하고 삶의 질을 크게 향상시킬 수 있을 것으로 기대된다.
조 교수는 "그동안 유방암 중에서도 가장 악성인 삼중음성 유방암은 독성이 강해 큰 부작용을 일으키는 화학 항암치료 외에는 방법이 없었으나 이를 호르몬 치료가 가능하며 덜 악성인 루미날-A 유방암세포로 리프로그래밍해 효과적으로 치료할 수 있는 새로운 가능성을 열었다ˮ라며 "이번 연구는 악성 암세포를 직접 없애려고 하기보다 치료가 수월한 세포 상태로 되돌린 뒤 치료하는 새로운 방식의 항암 치료전략을 제시했다ˮ라고 말했다.
조 교수 연구팀은 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구에 성공한 바 있으며, 이번 연구 결과는 암세포 리프로그래밍을 통한 가역화 기술 개발의 두 번째 성과다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 한국전자통신연구소 공동연구사업, KAIST Grand Challenge 30의 지원으로 수행됐다.
악성 유방암 세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 악성 유방암세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술을 개발하는 데 성공했다고 30일 밝혔다.
연구팀은 유방암 아류 중에서 가장 악성으로 알려진 삼중음성 유방암(basal-like 혹은 triple negative) 환자들과 호르몬 치료가 가능한 루미날-A 유방암(luminal-A) 환자들의 유전자 네트워크를 컴퓨터시뮬레이션을 통해 분석함으로써 삼중음성 유방암세포를 루미날-A 유방암세포로 변환하는데 필요한 핵심 인자를 규명했다. 그리고 이를 조절해 삼중음성 유방암세포를 루미날-A 유방암세포로 리프로그래밍한 뒤 호르몬 치료를 시행하는 새로운 치료 원리를 개발했다.
우리 대학 최새롬 박사과정, 황채영 박사, 이종훈 박사과정 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치 (Cancer Research)' 11월 30일 字 논문으로 출판됐다. (논문명: Network analysis identifies regulators of basal-like breast cancer reprogramming and endocrine therapy vulnerability)
현재 삼중음성 유방암 환자들에게 적용되는 항암 화학요법은 빠르게 분열해 전이를 일으키는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 하지만 이러한 치료는 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 심각한 부작용을 일으킨다. 또한 삼중음성 유방암세포들은 이와 같은 독성항암제에 처음부터 내성을 갖거나 새로운 내성을 획득하면서 결국 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 삼중음성 유방암에 대한 현재의 항암치료는 내성을 갖는 암세포를 없애기 위해 더 많은 정상세포의 사멸을 감수해야만 하는 큰 한계를 지니고 있다.
이를 극복하기 위해 암세포만을 특이적으로 공격하는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽이려는 공통적인 원리 때문에 근본적인 한계를 가진다.
조 교수 연구팀은 시스템생물학 연구기법을 통해 악성 유방암세포인 삼중음성 유방암세포를 호르몬 치료가 가능한 루미날-A 유방암세포로 변환시킨 뒤 치료하는 새로운 개념의 치료전략을 개발했다. 이를 위해 유전자 네트워크의 수학모델을 개발하고 대규모 컴퓨터시뮬레이션 분석과 복잡계 네트워크 제어기술을 적용한 결과 두 개의 핵심 분자 타겟인 `BCL11A'와 `HDAC1/2'를 발굴했다.
조 교수 연구팀은 BCL11A와 HDAC1/2를 억제함으로써 삼중음성 유방암세포를 효과적으로 루미날-A 유방암세포로 변환시킬 수 있음을 분자 세포실험을 통해 증명했다. 삼중음성 유방암세포에서 이 핵심 인자들을 억제했을 때 세포의 분열이 감소하고, 삼중음성 유방암세포의 주요 세포성장 신호 흐름 경로인 `EGFR'과 관련된 인자들의 활동이 감소했으며, 루미날-A 유방암세포의 주요 세포성장 신호흐름 경로인 `ERa' 신호전달 경로 인자들의 활성이 회복되는 것을 확인했다.
이번 연구에서 발굴된 분자 타겟 중 BCL11A 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 임상실험을 통해 악성 유방암세포를 치료 가능한 세포상태로 리프로그래밍 함으로써 안전하고 효과적으로 치료하는 새로운 치료기술이 실현될 수 있을 것으로 보인다. 특히 이처럼 암세포의 성질을 되돌리거나 변환하는 암세포 리프로그래밍 기반의 새로운 치료전략이 임상에서 실현된다면 현재 항암치료의 많은 부작용과 내성 발생을 근본적으로 해결함으로써 암 환자의 고통을 최소화하고 삶의 질을 크게 향상시킬 수 있을 것으로 기대된다.
조 교수는 "그동안 유방암 중에서도 가장 악성인 삼중음성 유방암은 독성이 강해 큰 부작용을 일으키는 화학 항암치료 외에는 방법이 없었으나 이를 호르몬 치료가 가능하며 덜 악성인 루미날-A 유방암세포로 리프로그래밍해 효과적으로 치료할 수 있는 새로운 가능성을 열었다ˮ라며 "이번 연구는 악성 암세포를 직접 없애려고 하기보다 치료가 수월한 세포 상태로 되돌린 뒤 치료하는 새로운 방식의 항암 치료전략을 제시했다ˮ라고 말했다.
조 교수 연구팀은 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구에 성공한 바 있으며, 이번 연구 결과는 암세포 리프로그래밍을 통한 가역화 기술 개발의 두 번째 성과다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 한국전자통신연구소 공동연구사업, KAIST Grand Challenge 30의 지원으로 수행됐다.
2021.11.30
조회수 12524
-
 면역관문 신호 극복하는 차세대 CAR-T 세포 치료제 개발
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역관문 신호를 극복하는 차세대 `키메라 항원 수용체 T(chimeric antigen receptor T, 이하 CAR-T) 세포' 치료제를 개발했다고 20일 밝혔다.
CAR-T 세포 치료제는 우리 몸에서 항암 및 항바이러스 기능에 중요한 역할을 하는 면역세포인 T 세포에 CAR 유전자를 도입해 항암 기능을 증가시킨 유전자 세포 치료제로서, 기존의 모든 항암 치료에 불응한 말기 백혈병 환자들을 대상으로 한 임상 시험에서 80% 이상의 높은 치료 효과를 보이며 `기적의 항암제'로 불리고 있는 항암 치료제다.
김 교수 연구팀은 CAR-T 세포 치료제 제작에 사용되는 렌티바이러스 벡터를 2종류의 짧은 헤어핀 RNA(short hairpin RNA, 이하 shRNA)가 CAR 유전자와 함께 발현하도록 개량했다. 이들 shRNA를 통해 T 세포의 기능 저하를 유도하는 2종의 면역관문 수용체인 `PD-1'과 `TIGIT'의 발현을 동시에 억제했을 때, 생쥐를 이용한 백혈병과 림프종 모델에서 CAR-T 세포의 향상된 항암 기능을 확인했다.
우리 대학 생명과학과 이영호 박사후연구원이 제1 저자 및 공동교신 저자로 참여한 이번 연구는 미국 유전자 세포 치료제 학회(American Society of Gene & Cell Therapy, ASGCT) 공식 학술지인 `분자 치료(Molecular Therapy)' 10월 온라인 판에 출판됐다. (논문명 : PD-1 and TIGIT downregulation distinctly affect the effector and early memory phenotypes of CD19-targeting CAR T cells).
해당 기술은 김 교수가 공동 창업한 CAR-T 세포 치료제 전문 개발 벤처인 ㈜큐로셀에 기술이전되어 올해 3월부터 삼성서울병원에서 기존 항암 치료 후 재발 및 불응하는 미만성 거대 B 세포 림프종 (diffuse large B cell lymphoma, DLBCL) 환자를 대상으로 1b/2a 단계 임상 시험이 진행중이며, 이는 국내에서 국내기술로 시도된 최초의 CAR-T 임상시험이다.
높은 항암 효과로 미국에서는 2017년 최초 2종의 CAR-T 치료제가 허가를 받았고, 산학계의 활발한 연구를 바탕으로 현재까지 총 5종의 CAR-T 치료제가 허가를 받았다. 최근에는 중국이 대규모 투자와 공격적인 임상 연구를 진행하며 CAR-T 치료제 분야의 새로운 강국으로 급부상해, 현재 전 세계적으로 진행 중인 500여 건의 CAR-T 임상 시험 중 절반 이상이 중국에서 진행되고 있다. 반면 현재 국내에서는 1건의 임상 시험 만이 진행 중이다.
이처럼 높은 치료 효과로 많은 관심을 받는 CAR-T 치료제이지만 지금까지 임상에서 극적인 효과를 보인 암종이 B 세포성 급성 백혈병과 다발 골수종 같은 혈액암에 국한돼 있으며, 혈액암 중에서도 B 세포성 만성 백혈병과 림프종에서는 상대적으로 치료 효과가 낮다는 점, 그리고 무엇보다 고형암에서 높은 효과를 보이는 CAR-T 치료제가 아직 없다는 것이 중요하게 해결해야 할 과제로 대두되고 있다.
연구팀은 CAR-T 세포의 효능을 제한할 수 있는 잠재적인 요소 중, T 세포의 활성을 억제하는 기능을 갖는 면역관문 수용체에 주목했다. T 세포에 발현하는 다양한 면역관문 수용체들은 본래 T 세포가 지속해서 활성화될 때 생기는 부작용을 방지하는 기능을 하고 있으나, 암세포가 이를 악용해 T 세포의 활성을 떨어뜨림으로써 면역계의 작용을 회피하는 메커니즘이 잘 알려져 있다.
연구팀은 2종의 shRNA를 동시에 발현하는 플랫폼을 기반으로 다양한 조합의 면역관문 수용체들의 발현을 억제해 보았고, 흥미롭게도 PD-1과 TIGIT의 조합이 유독 CAR-T 세포의 기능을 높게 향상하는 것을 발견했다. 이후 연구팀은 전사체 분석 및 세포 기능 시험을 통해 흥미롭게도 PD-1의 발현 억제는 CAR-T 세포의 작용 기능(effector function)을 향상하는 데 비해 TIGIT의 발현 억제는 분화를 지연시켜 생체 내에서 CAR-T 세포의 증식 및 지속성을 향상하는 것을 밝혔다.
제1 저자이자 공동교신 저자인 이영호 박사후연구원은 "PD-1과 TIGIT 신호 차단은 CAR-T 세포가 면역억제 현상을 극복할 수 있도록 고안된 새로운 기술 전략으로 기존 치료제의 효과를 기대하기 힘든 림프종 환자분들에게 꼭 필요한 치료제로 여겨질 것으로 기대한다ˮ라며 "CAR-T 치료제 개발 경험은 고형암을 포함하는 새로운 치료제 개발에 큰 자양분이 될 것이다ˮ라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자 지원사업 및 과학기술정보통신부 신약개발지원센터 R&D 지원 사업의 지원을 받아 수행됐다.
면역관문 신호 극복하는 차세대 CAR-T 세포 치료제 개발
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역관문 신호를 극복하는 차세대 `키메라 항원 수용체 T(chimeric antigen receptor T, 이하 CAR-T) 세포' 치료제를 개발했다고 20일 밝혔다.
CAR-T 세포 치료제는 우리 몸에서 항암 및 항바이러스 기능에 중요한 역할을 하는 면역세포인 T 세포에 CAR 유전자를 도입해 항암 기능을 증가시킨 유전자 세포 치료제로서, 기존의 모든 항암 치료에 불응한 말기 백혈병 환자들을 대상으로 한 임상 시험에서 80% 이상의 높은 치료 효과를 보이며 `기적의 항암제'로 불리고 있는 항암 치료제다.
김 교수 연구팀은 CAR-T 세포 치료제 제작에 사용되는 렌티바이러스 벡터를 2종류의 짧은 헤어핀 RNA(short hairpin RNA, 이하 shRNA)가 CAR 유전자와 함께 발현하도록 개량했다. 이들 shRNA를 통해 T 세포의 기능 저하를 유도하는 2종의 면역관문 수용체인 `PD-1'과 `TIGIT'의 발현을 동시에 억제했을 때, 생쥐를 이용한 백혈병과 림프종 모델에서 CAR-T 세포의 향상된 항암 기능을 확인했다.
우리 대학 생명과학과 이영호 박사후연구원이 제1 저자 및 공동교신 저자로 참여한 이번 연구는 미국 유전자 세포 치료제 학회(American Society of Gene & Cell Therapy, ASGCT) 공식 학술지인 `분자 치료(Molecular Therapy)' 10월 온라인 판에 출판됐다. (논문명 : PD-1 and TIGIT downregulation distinctly affect the effector and early memory phenotypes of CD19-targeting CAR T cells).
해당 기술은 김 교수가 공동 창업한 CAR-T 세포 치료제 전문 개발 벤처인 ㈜큐로셀에 기술이전되어 올해 3월부터 삼성서울병원에서 기존 항암 치료 후 재발 및 불응하는 미만성 거대 B 세포 림프종 (diffuse large B cell lymphoma, DLBCL) 환자를 대상으로 1b/2a 단계 임상 시험이 진행중이며, 이는 국내에서 국내기술로 시도된 최초의 CAR-T 임상시험이다.
높은 항암 효과로 미국에서는 2017년 최초 2종의 CAR-T 치료제가 허가를 받았고, 산학계의 활발한 연구를 바탕으로 현재까지 총 5종의 CAR-T 치료제가 허가를 받았다. 최근에는 중국이 대규모 투자와 공격적인 임상 연구를 진행하며 CAR-T 치료제 분야의 새로운 강국으로 급부상해, 현재 전 세계적으로 진행 중인 500여 건의 CAR-T 임상 시험 중 절반 이상이 중국에서 진행되고 있다. 반면 현재 국내에서는 1건의 임상 시험 만이 진행 중이다.
이처럼 높은 치료 효과로 많은 관심을 받는 CAR-T 치료제이지만 지금까지 임상에서 극적인 효과를 보인 암종이 B 세포성 급성 백혈병과 다발 골수종 같은 혈액암에 국한돼 있으며, 혈액암 중에서도 B 세포성 만성 백혈병과 림프종에서는 상대적으로 치료 효과가 낮다는 점, 그리고 무엇보다 고형암에서 높은 효과를 보이는 CAR-T 치료제가 아직 없다는 것이 중요하게 해결해야 할 과제로 대두되고 있다.
연구팀은 CAR-T 세포의 효능을 제한할 수 있는 잠재적인 요소 중, T 세포의 활성을 억제하는 기능을 갖는 면역관문 수용체에 주목했다. T 세포에 발현하는 다양한 면역관문 수용체들은 본래 T 세포가 지속해서 활성화될 때 생기는 부작용을 방지하는 기능을 하고 있으나, 암세포가 이를 악용해 T 세포의 활성을 떨어뜨림으로써 면역계의 작용을 회피하는 메커니즘이 잘 알려져 있다.
연구팀은 2종의 shRNA를 동시에 발현하는 플랫폼을 기반으로 다양한 조합의 면역관문 수용체들의 발현을 억제해 보았고, 흥미롭게도 PD-1과 TIGIT의 조합이 유독 CAR-T 세포의 기능을 높게 향상하는 것을 발견했다. 이후 연구팀은 전사체 분석 및 세포 기능 시험을 통해 흥미롭게도 PD-1의 발현 억제는 CAR-T 세포의 작용 기능(effector function)을 향상하는 데 비해 TIGIT의 발현 억제는 분화를 지연시켜 생체 내에서 CAR-T 세포의 증식 및 지속성을 향상하는 것을 밝혔다.
제1 저자이자 공동교신 저자인 이영호 박사후연구원은 "PD-1과 TIGIT 신호 차단은 CAR-T 세포가 면역억제 현상을 극복할 수 있도록 고안된 새로운 기술 전략으로 기존 치료제의 효과를 기대하기 힘든 림프종 환자분들에게 꼭 필요한 치료제로 여겨질 것으로 기대한다ˮ라며 "CAR-T 치료제 개발 경험은 고형암을 포함하는 새로운 치료제 개발에 큰 자양분이 될 것이다ˮ라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자 지원사업 및 과학기술정보통신부 신약개발지원센터 R&D 지원 사업의 지원을 받아 수행됐다.
2021.10.21
조회수 13039
-
 모트 전이 반도체로 진성 난수 생성기 개발
우리 대학 신소재공학과 김경민 교수 연구팀이 모트 전이 반도체의 확률적 거동을 이용한 진성 난수(True Random Number) 생성기 개발에 성공했다고 18일 밝혔다.
전자기기들이 초연결되는 메타버스 시대에는 전자기기 간에 대량의 데이터가 실시간으로 오가게 되는데, 이때 더욱 고도화된 데이터의 보안과 암호화 기술이 뒷받침돼야 한다. 현재 대부분의 난수는 소프트웨어로 생성되고 있는데, 이렇게 생성된 일반적인 난수는 소프트웨어의 해독을 통해 쉽게 예측할 수 있고 이는 데이터 보안 및 개인 정보 침해에 매우 큰 위협이 될 수 있다.
이에 반해 진성 난수는 자연의 무작위적인 물리적 현상으로부터 얻어지는 인간이 예측할 수 없는 난수로 이를 얻는 것은 궁극의 보안 기술을 구현하기 위해 필수적이다.
김경민 교수 연구팀은 진성 난수를 추출하기 위해 모트 전이 소재에 주목했다. 모트 전이 소재는 특정 온도에서 전기전도도가 부도체에서 도체로 전이하는 소재로, 이 소재에 전류를 흘려주어 가열하면 부도체 상태와 도체 상태가 주기적으로 변하는 상태의 진동 현상을 관찰할 수 있음이 잘 알려져 있었다. 연구팀은 이 과정에서 주기적으로 소재의 가열과 냉각이 반복될 때 열의 생성과 발산이 예측 불가능함을 이론적으로 입증했다.
연구팀은 이와 같은 모트 전이 소재에서의 예측 불가능한 특성을 진성 난수로 변환해주는 프로토타입의 진성 난수 생성기를 설계 및 제작하여 진성 난수를 성공적으로 수집했다.
공동 제1 저자인 신소재공학과 김광민 석사과정과 인재현 박사과정은 "모트 전이 반도체를 기반으로 하는 진성 난수 생성기는 25 마이크로초(μs) 마다 5.22 나노줄(nJ)의 에너지로 1개의 난수를 생성할 수 있는데 이는 기존 기술에 대비 최소 2.5배 이상 빠르고, 1,800분의 1 수준의 에너지로 저전력 동작이 가능하다ˮ며 "이는 저항 변화 메모리의 셀렉터 등 제한된 분야에서만 사용되던 모트 전이 소재를 진성 난수 생성기에 적합하다는 것을 입증한 결과로 새로운 하드웨어 보안용 소재 개발 분야를 개척한 의의가 있다ˮ 라고 말했다.
이러한 진성 난수 생성기는 반도체 칩의 형태로 제작해 기존 전자기기와 호환할 수 있으며 휴대전화 등 전자기기의 보안을 위한 암호화 하드웨어로 사용할 수 있을 것으로 기대된다.
이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 지난 5월 18일 字에 게재됐으며 산업통상자원부, 한국반도체연구조합, KAIST의 지원을 받아 수행됐다. (논문명 : Self-clocking fast and variation tolerant true random number generator based on a stochastic mott memristor)
모트 전이 반도체로 진성 난수 생성기 개발
우리 대학 신소재공학과 김경민 교수 연구팀이 모트 전이 반도체의 확률적 거동을 이용한 진성 난수(True Random Number) 생성기 개발에 성공했다고 18일 밝혔다.
전자기기들이 초연결되는 메타버스 시대에는 전자기기 간에 대량의 데이터가 실시간으로 오가게 되는데, 이때 더욱 고도화된 데이터의 보안과 암호화 기술이 뒷받침돼야 한다. 현재 대부분의 난수는 소프트웨어로 생성되고 있는데, 이렇게 생성된 일반적인 난수는 소프트웨어의 해독을 통해 쉽게 예측할 수 있고 이는 데이터 보안 및 개인 정보 침해에 매우 큰 위협이 될 수 있다.
이에 반해 진성 난수는 자연의 무작위적인 물리적 현상으로부터 얻어지는 인간이 예측할 수 없는 난수로 이를 얻는 것은 궁극의 보안 기술을 구현하기 위해 필수적이다.
김경민 교수 연구팀은 진성 난수를 추출하기 위해 모트 전이 소재에 주목했다. 모트 전이 소재는 특정 온도에서 전기전도도가 부도체에서 도체로 전이하는 소재로, 이 소재에 전류를 흘려주어 가열하면 부도체 상태와 도체 상태가 주기적으로 변하는 상태의 진동 현상을 관찰할 수 있음이 잘 알려져 있었다. 연구팀은 이 과정에서 주기적으로 소재의 가열과 냉각이 반복될 때 열의 생성과 발산이 예측 불가능함을 이론적으로 입증했다.
연구팀은 이와 같은 모트 전이 소재에서의 예측 불가능한 특성을 진성 난수로 변환해주는 프로토타입의 진성 난수 생성기를 설계 및 제작하여 진성 난수를 성공적으로 수집했다.
공동 제1 저자인 신소재공학과 김광민 석사과정과 인재현 박사과정은 "모트 전이 반도체를 기반으로 하는 진성 난수 생성기는 25 마이크로초(μs) 마다 5.22 나노줄(nJ)의 에너지로 1개의 난수를 생성할 수 있는데 이는 기존 기술에 대비 최소 2.5배 이상 빠르고, 1,800분의 1 수준의 에너지로 저전력 동작이 가능하다ˮ며 "이는 저항 변화 메모리의 셀렉터 등 제한된 분야에서만 사용되던 모트 전이 소재를 진성 난수 생성기에 적합하다는 것을 입증한 결과로 새로운 하드웨어 보안용 소재 개발 분야를 개척한 의의가 있다ˮ 라고 말했다.
이러한 진성 난수 생성기는 반도체 칩의 형태로 제작해 기존 전자기기와 호환할 수 있으며 휴대전화 등 전자기기의 보안을 위한 암호화 하드웨어로 사용할 수 있을 것으로 기대된다.
이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 지난 5월 18일 字에 게재됐으며 산업통상자원부, 한국반도체연구조합, KAIST의 지원을 받아 수행됐다. (논문명 : Self-clocking fast and variation tolerant true random number generator based on a stochastic mott memristor)
2021.08.18
조회수 14527
-
 암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27
조회수 31869
-
 개인 맞춤형 암 치료에 한 발짝 다가서
우리 연구진이 급성골수성백혈병(Acute myeloid leukemia)과 골수이형성증후군(Myelodysplastic syndromes) 치료에 사용되는 항암 화학 치료제 중 하나인 데시타빈(decitabine)의 인체 내 작용 메커니즘을 규명해 항암제 효과가 있는 환자와 없는 환자를 구별해 낼 수 있는 유전자 발굴에 성공했다.
이번 연구를 통해 환자별로 적합한 치료를 받을 수 있게 되면 환자들이 치료에 드는 경제적 지출과 시간적 소비 또한 확연하게 줄일 수 있을 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 서울대병원 혈액암센터 홍준식 교수 공동 연구팀이 항암 화학치료에서 작용하는 주요 인자를 찾아냈다고 7일 밝혔다.
생명화학공학과 박사과정에 재학 중인 구용석 학생, 서울대병원 박주환 연구원 그리고 우리 대학 조령은 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 3월 30일 字에 게재됐다. (논문명: Noncanonical immune response to the inhibition of DNA methylation via stabilization of endogenous retrovirus dsRNAs)
데시타빈과 같은 DNA 탈메틸화제(DNA demethylating agent)는 DNA 복제과정에 참여하고 DNA상에 존재하는 메틸기(-CH₃)를 제거해 유전자 발현을 조절한다. 특히 암세포에는 일반 세포보다 많은 양의 DNA가 메틸화돼 있으며, 이는 DNA에서 RNA를 생성하는 전사 과정을 억제하는 역할을 한다. 세포에 탈메틸화제 처리를 하면 DNA상에 메틸기가 제거돼 세포 내에 수많은 종류의 RNA들이 생성된다.
이렇게 데시타빈에 의해 조절되는 RNA 중에는 이중나선 RNA (double-stranded RNA, 이하 dsRNA)가 있다. 원래 dsRNA는 바이러스에 감염된 세포에서 많이 생산되며, 인간 세포는 바이러스에서 유래된 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다.
특이하게도 dsRNA를 인지하는 인간의 선천성 면역반응 시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 형태와 같은 구조적 특징을 이용해 dsRNA와 반응한다. 이와 같은 특징 때문에 꼭 바이러스에서 유래된 dsRNA가 아니라 체내에서 생성된 dsRNA 또한 외부 물질로 오인돼 비정상적인 면역반응을 일으킬 수 있다. 암 치료에서는 DNA 탈메틸화제 처리로 dsRNA의 발현량을 증가시키고 이는 dsRNA에 의한 면역 활성으로 이어져 암세포만의 세포사멸이 일어나게 된다.
연구팀은 이러한 데시타빈에 의한 dsRNA 발현증가 그리고 dsRNA에 의한 세포사멸을 조절하는 유전자를 연구했다. 특히, DNA 탈메틸화제를 투여받은 환자 중 많은 수의 환자가 약물의 효과를 보지 못한다는 점에 착안해 dsRNA와 상호작용하는 다양한 dsRNA 결합 단백질을 분석했다.
그 결과로 dsRNA와 직접 결합해 dsRNA의 안정성을 조절하는 단백질인 `스타우펜1(이하 Staufen1)'이 데시타빈에 의한 세포 반응에 중요한 기능을 한다는 것을 최초로 규명했다. Staufen1의 발현이 억제된 세포에서는 dsRNA가 빠르게 제거돼 하위 면역반응이 일어나지 않았으며 암세포의 사멸도 관찰되지 않았다.
연구팀은 데시타빈 뿐만 아니라 아자시티딘(azacitidine)과 같은 DNA 탈메틸화제를 투여받은 급성골수성백혈병과 골수이형성증후군 환자 46명의 골수추출액에서 Staufen1 유전자의 발현양상을 분석했고, 그 결과 약물의 효과를 보지 못한 환자에게서는 Staufen1의 발현이 유의미하게 감소해 있다는 것을 확인했다. 또한, Staufen1의 발현이 낮은 환자는 생존율(overall survival)과 무진행 생존율(progression-free survival)이 모두 낮아 환자의 예후가 좋지 않다는 것을 확인했다.
생명화학공학과 김유식 교수는 "이번 연구에서는 단순 데시타빈 항암제의 작용기전 규명을 넘어서 실제 데시타빈을 투여받은 환자의 검체에서도 그 효과를 검증했다ˮ면서 "추후 이번에 찾은 유전자의 바이오마커화를 통해 데시타빈과 아자시티딘과 같은 DNA 탈메틸화제의 효과를 예측할 수 있어 효과적인 맞춤형 암 치료전략을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원을 받아 수행됐다.
개인 맞춤형 암 치료에 한 발짝 다가서
우리 연구진이 급성골수성백혈병(Acute myeloid leukemia)과 골수이형성증후군(Myelodysplastic syndromes) 치료에 사용되는 항암 화학 치료제 중 하나인 데시타빈(decitabine)의 인체 내 작용 메커니즘을 규명해 항암제 효과가 있는 환자와 없는 환자를 구별해 낼 수 있는 유전자 발굴에 성공했다.
이번 연구를 통해 환자별로 적합한 치료를 받을 수 있게 되면 환자들이 치료에 드는 경제적 지출과 시간적 소비 또한 확연하게 줄일 수 있을 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 서울대병원 혈액암센터 홍준식 교수 공동 연구팀이 항암 화학치료에서 작용하는 주요 인자를 찾아냈다고 7일 밝혔다.
생명화학공학과 박사과정에 재학 중인 구용석 학생, 서울대병원 박주환 연구원 그리고 우리 대학 조령은 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 3월 30일 字에 게재됐다. (논문명: Noncanonical immune response to the inhibition of DNA methylation via stabilization of endogenous retrovirus dsRNAs)
데시타빈과 같은 DNA 탈메틸화제(DNA demethylating agent)는 DNA 복제과정에 참여하고 DNA상에 존재하는 메틸기(-CH₃)를 제거해 유전자 발현을 조절한다. 특히 암세포에는 일반 세포보다 많은 양의 DNA가 메틸화돼 있으며, 이는 DNA에서 RNA를 생성하는 전사 과정을 억제하는 역할을 한다. 세포에 탈메틸화제 처리를 하면 DNA상에 메틸기가 제거돼 세포 내에 수많은 종류의 RNA들이 생성된다.
이렇게 데시타빈에 의해 조절되는 RNA 중에는 이중나선 RNA (double-stranded RNA, 이하 dsRNA)가 있다. 원래 dsRNA는 바이러스에 감염된 세포에서 많이 생산되며, 인간 세포는 바이러스에서 유래된 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다.
특이하게도 dsRNA를 인지하는 인간의 선천성 면역반응 시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 형태와 같은 구조적 특징을 이용해 dsRNA와 반응한다. 이와 같은 특징 때문에 꼭 바이러스에서 유래된 dsRNA가 아니라 체내에서 생성된 dsRNA 또한 외부 물질로 오인돼 비정상적인 면역반응을 일으킬 수 있다. 암 치료에서는 DNA 탈메틸화제 처리로 dsRNA의 발현량을 증가시키고 이는 dsRNA에 의한 면역 활성으로 이어져 암세포만의 세포사멸이 일어나게 된다.
연구팀은 이러한 데시타빈에 의한 dsRNA 발현증가 그리고 dsRNA에 의한 세포사멸을 조절하는 유전자를 연구했다. 특히, DNA 탈메틸화제를 투여받은 환자 중 많은 수의 환자가 약물의 효과를 보지 못한다는 점에 착안해 dsRNA와 상호작용하는 다양한 dsRNA 결합 단백질을 분석했다.
그 결과로 dsRNA와 직접 결합해 dsRNA의 안정성을 조절하는 단백질인 `스타우펜1(이하 Staufen1)'이 데시타빈에 의한 세포 반응에 중요한 기능을 한다는 것을 최초로 규명했다. Staufen1의 발현이 억제된 세포에서는 dsRNA가 빠르게 제거돼 하위 면역반응이 일어나지 않았으며 암세포의 사멸도 관찰되지 않았다.
연구팀은 데시타빈 뿐만 아니라 아자시티딘(azacitidine)과 같은 DNA 탈메틸화제를 투여받은 급성골수성백혈병과 골수이형성증후군 환자 46명의 골수추출액에서 Staufen1 유전자의 발현양상을 분석했고, 그 결과 약물의 효과를 보지 못한 환자에게서는 Staufen1의 발현이 유의미하게 감소해 있다는 것을 확인했다. 또한, Staufen1의 발현이 낮은 환자는 생존율(overall survival)과 무진행 생존율(progression-free survival)이 모두 낮아 환자의 예후가 좋지 않다는 것을 확인했다.
생명화학공학과 김유식 교수는 "이번 연구에서는 단순 데시타빈 항암제의 작용기전 규명을 넘어서 실제 데시타빈을 투여받은 환자의 검체에서도 그 효과를 검증했다ˮ면서 "추후 이번에 찾은 유전자의 바이오마커화를 통해 데시타빈과 아자시티딘과 같은 DNA 탈메틸화제의 효과를 예측할 수 있어 효과적인 맞춤형 암 치료전략을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원을 받아 수행됐다.
2021.04.07
조회수 80222
 항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 11899
항암치료용 인공탄수화물 기반 나노의약 개발
우리 대학 생명과학과 전상용, 화학과 이희승 교수 공동연구팀이 인공탄수화물(artificial glycopolymer) 라이브러리 플랫폼을 이용해 항암치료용 나노의약(nanomedicine) 개발에 성공했다고 12일 밝혔다.
세포막을 둘러싸고 있는 다양한 형태의 당 사슬 집합체를 글라이코칼릭스(glycocalyx)라고 한다. 특히, 암세포 및 암종에 따라 특이적인 글라이코칼릭스는 여러 가지 당에 대해 다른 결합력을 가진다. 이에 착안해 연구팀은 자연에 가장 많이 존재하는 다섯 가지의 당들을 조합해 31가지의 인공탄수화물 후보군들을 합성한 후 최종적으로 30나노미터 크기의 인공탄수화물 기반 나노입자(glyconanoparticle) 라이브러리를 구축했다.
연구팀은 구축된 인공탄수화물 나노입자 라이브러리 스크리닝을 통해 표적 하고자 하는 암세포에 특이적으로 결합하는 나노입자 후보군을 선별했다. 선별된 인공탄수화물 나노입자 후보군을 암 동물모델에서 표적능 및 치료효능을 평가함으로써 표적 항암치료용 나노의약 개발에 적용할 수 있다는 것을 연구팀은 세계 최초로 제시하고 구현해냈다.
생명과학과 황창희 박사과정, 화학과 홍정우 박사과정이 공동 제1 저자로 참여한 이번 연구는 재료공학 분야 최정상급 학술지인 `어드밴스드 머티리얼즈(Advanced Materials, ISSN: 0935-9648 print, 1521-4095 online, Impact Factor: 32.086)' 6월 20일 字 온라인판에 게재 및 표지 논문 (Inside Back Cover)으로 선정됐다.
(https://doi.org/10.1002/adma.202203993. 논문명: Systematic Screening and Therapeutic Evaluation of Glyconanoparticles with Differential Cancer Affinities for Targeted Cancer Therapy)
당사슬(glycan)은 살아있는 모든 세포의 표면에 두드러지게 발현되며 세포 신호, 분자 인식 및 면역과 같은 수많은 과정에 광범위하게 참여한다고 알려져 있다. 종양세포의 경우 비정상적인 당사슬 패턴이 암 종마다 다르게 세포 표면에서 검출되고 있으며, 이러한 세포 표면에 존재하는 당사슬 층은 암세포의 전이(metastasis) 및 증식(proliferation) 등에 중요한 역할을 한다.
연구팀은 암세포 표면에 존재하는 이러한 비정상적 당사슬과 선택적으로 결합할 수 인공탄수화물 기반 나노입자 라이브러리 플랫폼을 개발하였다. 연구팀은 자연에 흔히 존재하는 다섯 가지의 당류인 글루코스 (glucose; Glc), 갈락토스 (galactose; Gal), 만노스 (mannose; Man), 글루코사민 (N-acetyl glucosamine; GlcNAc), 갈락토사민 (N-acetyl galactosamine; GalNAc) 들을 조합해 당사슬을 모방하는 31가지의 새로운 인공탄수화물들을 합성하였고 이로부터 나노크기의 인공탄수화물 나노입자들을 제조하였다.
연구팀은 암세포 및 종양 동물모델에서의 스크리닝 결과들을 바탕으로 특정 당 조합으로 이루어진 인공탄수화물 나노입자 높은 암-표적능을 보인다는 것을 최초로 검증하였다. 나아가 암-표적능이 뛰어난 인공탄수화물 나노입자에 항암제를 선적하여 목표로 하는 종양을 광열치료(photothermal therapy) 및 화학요법(chemotherapy)을 통해 효과적으로 치료할 수 있음을 동물실험에서 보여주었다.
전상용 교수는 "이번에 개발한 인공탄수화물 기반 나노입자 플랫폼은 암을 표적하는 나노의약 개발에 적용했지만, 암이 아닌 다른 질병이나 특정 장기 표적형 나노의약 개발에도 확장할 수 있어 후속 연구를 수행 중이다ˮ라고 말했다.
이번 연구는 한국연구재단의 리더연구사업(종양/염증 미세환경 표적 및 감응형 정밀 바이오-나노메디신 연구단) 및 선도연구센터사업(멀티스케일 카이랄 구조체 연구센터, CMCA)의 지원을 받아 수행됐다.
2022.07.12 조회수 11899 디스플레이 소재로 빛 이용해 친환경 암모니아 합성법 제시
우리 대학 생명화학공학과 이도창 교수, 이상엽 특훈교수, 박영신 연구교수 연구팀이 디스플레이 소재인 양자점(퀀텀닷)을 이용해 *질소 고정 박테리아의 암모니아 생산 효율을 대폭 늘렸다고 16일 밝혔다.
☞ 질소 고정(Nitrogen Fixation) : 공기 중 질소 기체 분자(N₂)를 암모니아(NH₃)를 비롯한 질소화합물로 전환하는 과정을 말한다.
이 교수 연구팀은 양자점에 의해 흡수된 빛 에너지가 박테리아의 암모니아 합성 반응에 사용되도록 설계했으며, 그 결과 박테리아의 암모니아 생산량을 큰 폭으로 증가시킬 수 있었다. 이를 위해 연구팀은 양자점을 질소고정 박테리아 안에 더 많이 넣을 수 있는 방법을 제시했다.
생명화학공학과 고성준 박사가 제1저자로 참여한 이번 연구의 결과는 국제 학술지 `미국 화학회지(JACS)'에 표지 논문으로 선정돼 출판됐다. (논문명 : Light-Driven Ammonia Production by Azotobacter vinelandii Cultured in Medium Containing Colloidal Quantum Dots).
질소 고정 박테리아는 질소 고정 효소를 이용해 대기 중 질소를 암모니아로 전환하여 생장에 필요한 단백질을 생산한다. 이러한 질소 고정 반응은 화학적 암모니아 합성법인 하버-보슈 공정에 비해 에너지 소비와 이산화탄소 배출이 현저하게 적다.
하지만, 박테리아는 생장에 필요한 만큼만 암모니아를 생산하도록 진화돼 질소 고정 효소의 반응이 느리기에 이를 산업적으로 활용하기 어렵다. 질소 고정 반응이 느린 이유는 효소의 두 가지 구성요소(전자 전달부, 촉매 반응부)의 비효율적인 상호작용 때문이다. 전자 전달부가 촉매 반응부에 전자를 공급한 후, 반드시 탈착돼야만 촉매 반응부가 새로운 전자를 추가로 공급받아 암모니아를 생성할 수 있다.
연구팀은 문제 해결을 위해 빛을 흡수하는 양자점을 박테리아의 질소 고정 반응에 전자 공급원으로 활용해 나노·바이오 복합 시스템을 구축했다. 양자점은 수 나노미터의 작은 크기를 갖는 반도체 나노입자이며 디스플레이 소재로 많이 알려진 물질이다. 하지만, 양자점이 흡수한 빛 에너지를 표면에 쉽게 전달할 수 있도록 입자의 구조 및 표면을 제어하면 광 감응 및 광 촉매 소재로도 우수한 특성을 보인다. 연구팀은 질소 고정 효소의 전자 전달부 역할을 양자점으로 대체하기 위해 양자점의 코어/쉘 구조를 전자 전달에 유리하게 설계했다. 또한, 양자점이 생물학적 시스템에 결합할 수 있도록 표면 화학 특성을 제어해 수(水)분산 특성을 확보했다.
연구팀은 구조 및 표면이 제어된 양자점을 질소 고정 박테리아의 대사활동이 가장 활발한 성장기에 추가해, 박테리아의 능동적인 양자점 흡수를 유도했다. 이렇게 제작된 양자점-박테리아 복합 시스템에 빛을 조사한 결과, 질소고정 반응 속도가 증가하며 암모니아 생산량이 대폭 증가함을 확인했다. 고성준 박사는 "디스플레이 소재와 미생물의 장점을 합해 빛 에너지를 이용한 새로운 방식의 암모니아 합성법을 제시한 결과ˮ라며 "이번 연구를 활용한 그린 암모니아 생산 플랫폼을 구축한다면, 환경 및 에너지 문제에 적극적으로 대응할 수 있을 것이다ˮ라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.06.16 조회수 11900
디스플레이 소재로 빛 이용해 친환경 암모니아 합성법 제시
우리 대학 생명화학공학과 이도창 교수, 이상엽 특훈교수, 박영신 연구교수 연구팀이 디스플레이 소재인 양자점(퀀텀닷)을 이용해 *질소 고정 박테리아의 암모니아 생산 효율을 대폭 늘렸다고 16일 밝혔다.
☞ 질소 고정(Nitrogen Fixation) : 공기 중 질소 기체 분자(N₂)를 암모니아(NH₃)를 비롯한 질소화합물로 전환하는 과정을 말한다.
이 교수 연구팀은 양자점에 의해 흡수된 빛 에너지가 박테리아의 암모니아 합성 반응에 사용되도록 설계했으며, 그 결과 박테리아의 암모니아 생산량을 큰 폭으로 증가시킬 수 있었다. 이를 위해 연구팀은 양자점을 질소고정 박테리아 안에 더 많이 넣을 수 있는 방법을 제시했다.
생명화학공학과 고성준 박사가 제1저자로 참여한 이번 연구의 결과는 국제 학술지 `미국 화학회지(JACS)'에 표지 논문으로 선정돼 출판됐다. (논문명 : Light-Driven Ammonia Production by Azotobacter vinelandii Cultured in Medium Containing Colloidal Quantum Dots).
질소 고정 박테리아는 질소 고정 효소를 이용해 대기 중 질소를 암모니아로 전환하여 생장에 필요한 단백질을 생산한다. 이러한 질소 고정 반응은 화학적 암모니아 합성법인 하버-보슈 공정에 비해 에너지 소비와 이산화탄소 배출이 현저하게 적다.
하지만, 박테리아는 생장에 필요한 만큼만 암모니아를 생산하도록 진화돼 질소 고정 효소의 반응이 느리기에 이를 산업적으로 활용하기 어렵다. 질소 고정 반응이 느린 이유는 효소의 두 가지 구성요소(전자 전달부, 촉매 반응부)의 비효율적인 상호작용 때문이다. 전자 전달부가 촉매 반응부에 전자를 공급한 후, 반드시 탈착돼야만 촉매 반응부가 새로운 전자를 추가로 공급받아 암모니아를 생성할 수 있다.
연구팀은 문제 해결을 위해 빛을 흡수하는 양자점을 박테리아의 질소 고정 반응에 전자 공급원으로 활용해 나노·바이오 복합 시스템을 구축했다. 양자점은 수 나노미터의 작은 크기를 갖는 반도체 나노입자이며 디스플레이 소재로 많이 알려진 물질이다. 하지만, 양자점이 흡수한 빛 에너지를 표면에 쉽게 전달할 수 있도록 입자의 구조 및 표면을 제어하면 광 감응 및 광 촉매 소재로도 우수한 특성을 보인다. 연구팀은 질소 고정 효소의 전자 전달부 역할을 양자점으로 대체하기 위해 양자점의 코어/쉘 구조를 전자 전달에 유리하게 설계했다. 또한, 양자점이 생물학적 시스템에 결합할 수 있도록 표면 화학 특성을 제어해 수(水)분산 특성을 확보했다.
연구팀은 구조 및 표면이 제어된 양자점을 질소 고정 박테리아의 대사활동이 가장 활발한 성장기에 추가해, 박테리아의 능동적인 양자점 흡수를 유도했다. 이렇게 제작된 양자점-박테리아 복합 시스템에 빛을 조사한 결과, 질소고정 반응 속도가 증가하며 암모니아 생산량이 대폭 증가함을 확인했다. 고성준 박사는 "디스플레이 소재와 미생물의 장점을 합해 빛 에너지를 이용한 새로운 방식의 암모니아 합성법을 제시한 결과ˮ라며 "이번 연구를 활용한 그린 암모니아 생산 플랫폼을 구축한다면, 환경 및 에너지 문제에 적극적으로 대응할 수 있을 것이다ˮ라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.06.16 조회수 11900 암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 12737
암, 뇌졸중, 치매 등 각종 난치병 진단하는 멀티 바이오마커를 동시에 탐지하는 고성능 기술 개발
우리 대학 신소재공학과 장재범 교수, 전기및전자공학부 윤영규 교수 연구팀이 기존 기술 대비 5배 이상 더 많은 단백질 바이오마커를 동시에 탐지할 수 있는 멀티 마커 동시 탐지 기술 개발을 했다고 23일 밝혔다.
바이오마커란, 단백질이나 DNA, RNA, 대사 물질 등의 생체 분자로써 이를 통해 몸 안의 변화를 알아낼 수 있어 암을 비롯해 뇌졸중, 치매 등 각종 난치병을 정밀하게 진단하는 표지자로 각광받고 있다.
최근 환자별로 암 조직 내부에 발현되는 단백질 마커가 서로 다르다는 사실이 밝혀지고 있으며, 이러한 차이에 따라서 암의 예후 및 항암제 반응성 등이 결정된다는 연구 결과가 발표되고 있다. 이에 따라서 암 조직에서 여러 단백질 마커를 동시에 탐지하는 기술이 반드시 요구된다.
이에 장 교수 연구팀은 기존 기술 대비 5배 이상 더 많은 수의 단백질 마커를 동시에 관찰할 수 있는 기술을 개발했다. 이 기술은 특수한 시약이나 고가의 장비가 필요하지 않아 암의 정확한 진단 및 항암제 개발, 새로운 단백질 마커 발굴 등에 폭넓게 활용될 수 있을 것으로 기대된다.
우리 대학 신소재공학과 서준영, 심연보, 김지원 연구원이 공동 제1 저자로 참여한 이번 연구는 국제 학술지 `네이처 커뮤니케이션스(Nature communications)' 5월 13권에 출판됐다. (논문명 : PICASSO allows ultra-multiplexed fluorescence imaging of spatially overlapping proteins without reference spectra measurements).
그동안 정밀 암 연구는 암 환자 조직 내부의 유전자를 분석하는 유전체 연구를 중심으로 진행돼왔다. 하지만 유전자 분석으로는 실제로 이 유전자로부터 단백질 마커가 얼마나 많이 발현되는지 혹은 어떤 공간적 분포로 발현되는지는 알 수 없다는 한계가 있다. 이에 따라서 최근 연구는 유전체 및 단백체를 동시에 분석하는 방향으로 나아가고 있다.
실제로 기존의 유전체 분석으로 유방암으로 진단받은 수백 명의 유방암 환자의 암 조직 내부 단백질 마커를 분석한 결과, 환자들을 생존율 및 약물 반응성이 서로 다른 여러 서브 타입으로 나눌 수 있다는 연구 결과가 발표된 바 있다. 또한, 최근 암을 정복할 신약으로 주목받고 있는 3세대 항암제인 면역항암제의 경우, 암 조직 내부의 면역세포를 활성화해 암을 치료한다.
이때, 암 조직 내부에 어떤 면역 단백질 마커가 발현되어 있는지에 따라서 그 약물 반응성에 큰 차이가 나타난다고 보고된 바 있다. 이처럼 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하는 기술은 새로운 암 서브 타입의 발굴, 각 서브 타입을 표적으로 하는 신약 개발, 적합한 항암제 추천 등을 위해 필수적으로 요구된다.
그동안 암 조직 내부에서 여러 단백질 마커를 동시에 탐지하기 위해서 질량 분석 이미지 처리법 혹은 형광염색법이 사용돼왔다. 질량 분석 이미지 처리법은 하나의 조직에서 다수의 단백질 마커를 동시에 탐지할 수 있다는 장점이 있으나, 고가의 특수 장비가 필요하고, 분석 과정에서 조직이 파괴되며, 전체 과정이 오래 걸린다는 단점이 있다. 형광염색법은 이와 같은 단점은 없으나, 한 번에 3개의 단백질 마커만 관찰할 수 있다는 단점이 있다.
장 교수 연구팀은 이러한 형광염색법의 한계를 해결하기 위해 한 번에 15개 이상, 최대 20개까지의 단백질 마커를 동시에 탐지할 수 있는 기술인 `피카소(PICASSO)' 기술을 개발했다. `PICASSO는 “Process of ultra-multiplexed Imaging of biomoleCules viA the unmixing of the Signals of Spectrally Overlapping fluorophores'의 약자로, 기술을 통해 다양한 생체분자들의 이미지를 형형색색으로 얻어낼 수 있기에 일반인들에게 가장 친숙한 화가 피카소의 이름을 기술명으로 정했다. 연구팀은 이를 위해 발광 스펙트럼이 유사한 형광 분자들을 동시에 사용하고, 이러한 형광 분자들의 신호를 정확하게 분리할 수 있는 기술을 개발했다. 연구팀은 이 기술을 이용해 하나의 조직에서 15개의 단백질 마커를 탐지하는 과정을 세 번 반복해 총 45개의 단백질 마커를 탐지하는 데 성공했다.
장 교수 연구팀이 개발한 `피카소(PICASSO)' 기술은 기존 멀티 마커 동시 탐지 기술 중 가장 낮은 비용으로, 가장 많은 수의 단백질 마커를, 가장 빠르게 탐지할 수 있는 기술로, 향후 암 진단 및 제약 등에 활용될 가능성이 매우 크다. 연구팀은 이 기술 개발 과정에서 4건의 국내 특허, 3건의 미국 특허, 2건의 EPO(유럽 특허) 및 PCT(국제 특허)를 출원해 이번 기술의 지적 재산권을 확보했다고 밝혔다.
제1 저자인 서준영 연구원은 "`피카소(PICASSO)' 기술을 통해 그동안 관찰하기 어려웠던 조직 내 수많은 단백질 마커의 발현 정도 및 분포 관찰에 성공했다ˮ며, "특수한 시약이나 고가의 장비 없이 연구자들에게 친숙한 형광현미경만을 사용해 기술 구현이 가능하므로 접근성이 매우 높은 유용한 기술이 될 것이고, 새로운 생명현상 규명, 암 바이오마커 발굴, 정밀진단 및 치료제 개발 등에 활발히 사용될 수 있을 것이다ˮ 라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.05.23 조회수 12737 체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26 조회수 9060
체중 부하가 암 진행에 영향을 미치는 기전 제시
우리 대학 의과학대학원 김준 교수 연구팀이 우리 대학 기계공학과 박형순 교수, 연세대 세브란스 병원 정기양 교수, 연세대 강남세브란스 병원 노미령 교수와의 공동 연구를 통해 악성흑색종이 발바닥에서 체중부하가 높은 부위에 주로 발생하는 기전을 제시했다고 26일 밝혔다.
의과학대학원 졸업생 서지명 박사와 김현석 박사과정 학생이 공동 제1 저자로 참여한 본 연구 논문은 4월 25일에 국제 학술지 네이쳐 커뮤니케이션(Nature Communications)저널에 발표됐다.
악성흑색종은 멜라닌 생성 세포에서 기원하는 치명적인 피부종양으로 자외선에 의한 DNA 손상이 주요 원인으로 알려져 있다. 하지만 자외선 노출이 적은 발바닥, 손바닥, 손톱 등에서도 악성흑색종이 발생한다. 발바닥 악성흑색종은 체중부하로 인한 압력 자극이 높은 부위에 집중적으로 발생하는 것으로 알려져 있는데 이 특이한 현상의 기전은 아직 밝혀지지 않았다.
연구팀은 생쥐의 발바닥에 흑색종 세포를 이식하고 강제 쳇바퀴 운동으로 발바닥에 기계적 스트레스를 가하는 실험을 수행했다. 반복적 기계적 스트레스는 흑색종에서 세포핵의 형태적 이상과 일시적 핵막 파열을 유도했다. 핵막 파열은 DNA 손상을 일으켰으며, 동시에 세포질로 유출된 DNA는 암 악성화와 연관된 내재 면역반응을 유도했다.
이식된 암세포의 주변에 있는 정상세포는 동일한 기계적 스트레스 상황에서도 핵막 불안정성과 DNA 손상을 보이지 않았다. 연구팀은 종양억제단백질 p53의 기능소실과 암 촉진 전사조절인자 YAP의 활성화가 상승적으로 핵막의 기계적 자극에 대한 취약성을 유도함을 규명했다. 이번 연구는 기계적 자극이 멜라닌 생성 세포의 암화를 시작하는 요소일 가능성은 낮지만 암 진행을 촉진하는 중요한 인자임을 보여준다.
연구를 주도한 김준 교수는 “이번 연구는 기계적 스트레스로 인한 암세포 핵막 손상이 암 진행에 영향을 미치는 중요한 인자임을 규명하였다”고 연구의 의의를 설명했다.
한편 이번 연구는 과학기술정보통신부의 중견연구 및 기초연구실 사업의 지원으로 수행됐다.
2022.04.26 조회수 9060 췌장 내 미토콘드리아 기능 장애, 췌장염에 이어 췌장암 위험성 높여
우리 대학 의과학대학원 서재명 교수 연구팀은 Salk 연구소 로날드 에반스(Ronald M. Evans) 교수, Harbor-UCLA 병원 에이지 요시하라(Eiji Yoshihara) 교수와 국제공동 연구를 통해 에너지 대사 및 생리기능 조절에 중요한 에스트로겐 관련 수용체 감마(ERRγ)의 기능부전이 췌장염 및 췌장 외분비선 질환을 유발할 수 있음을 22일 밝혔다.
췌장조직에서는 하루 동안 한 컵 정도의 소화액을 생산하고 분비한다. 그러나 소화액이 장으로 이동하기 전에 활성화되면 췌장조직 자체에 심각한 손상이 일어나며, 이로 인해 췌장염이 발생하게 된다. 대표적인 췌장염의 원인은 담석이 담췌관을 막아 소화액이 역류하거나 과도한 음주로 인해 췌장 세포의 에너지 항상성이 무너지면서 세포사멸을 유발함으로써 발병한다고 알려져 있다. 만성적인 췌장염은 극심한 고통을 수반함과 더불어 치사율 높은 췌장암의 원인이 될 수도 있어서 학계에서는 주목하고 있는 분야다.
연구팀은 “다량의 소화액을 분비하는 췌장 세포는 많은 양의 에너지를 소모하기 때문에, 에너지대사 기능이 저하되면 췌장염을 비롯한 다양한 췌장 질환에 노출될 수 있다. 건강한 췌장기능을 유지하기 위해 강력한 미토콘드리아의 에너지 생산 체계가 필요하다고 알려져 있었으나 췌장 미토콘드리아 에너지대사의 핵심 조절인자는 알려져 있지 않았다. 본 연구 결과는 ERRγ가 췌장 에너지 생성에 필수적일 뿐만 아니라 ERRγ의 기능이상이 췌장염과 췌장암 초기 발병기전에 관여한다는 점을 보여준다”고 밝혔다.
연구진은 췌장염 환자의 췌장 세포가 정상세포에 비해 ERRγ 유전자 활성이 감소하여 있음을 밝혀 임상적 연결고리를 보여주었으며, 이러한 발견은 ERRγ의 유전자 활성 조절을 통해 췌장염과 췌장암을 예방하거나 치료할 새로운 가능성을 열었다.
현재 연구팀은 미토콘드리아 조절 장애 및 췌장염이 초래하는 초기 췌장암을 예방하거나 치료하는 데 있어 ERRγ 활성 조절을 활용한 후속 연구를 이어가고 있다고 전했다.
우리 대학 의과학대학원 최진혁 박사와 Salk 연구소 오태규 박사가 공동 제1저자로 참여한 이번 연구는 4월 21일 소화기분야 최고 권위 저널인 ‘가스트로엔터롤로지 (Gastroenterology, IF 22.682)’ 온라인판에 게재됐다. (논문명: Estrogen-Related Receptor γ maintains pancreatic acinar cell function and identity by regulating cellular metabolism).
이번 연구는 과학기술정보통신부와 대구경북첨단의료산업진흥재단 원천기술개발사업, 과학기술정보통신부 글로벌연구실사업 및 한국과학기술원 국제공동연구지원사업의 지원을 받아 수행됐다.
2022.04.22 조회수 9241
췌장 내 미토콘드리아 기능 장애, 췌장염에 이어 췌장암 위험성 높여
우리 대학 의과학대학원 서재명 교수 연구팀은 Salk 연구소 로날드 에반스(Ronald M. Evans) 교수, Harbor-UCLA 병원 에이지 요시하라(Eiji Yoshihara) 교수와 국제공동 연구를 통해 에너지 대사 및 생리기능 조절에 중요한 에스트로겐 관련 수용체 감마(ERRγ)의 기능부전이 췌장염 및 췌장 외분비선 질환을 유발할 수 있음을 22일 밝혔다.
췌장조직에서는 하루 동안 한 컵 정도의 소화액을 생산하고 분비한다. 그러나 소화액이 장으로 이동하기 전에 활성화되면 췌장조직 자체에 심각한 손상이 일어나며, 이로 인해 췌장염이 발생하게 된다. 대표적인 췌장염의 원인은 담석이 담췌관을 막아 소화액이 역류하거나 과도한 음주로 인해 췌장 세포의 에너지 항상성이 무너지면서 세포사멸을 유발함으로써 발병한다고 알려져 있다. 만성적인 췌장염은 극심한 고통을 수반함과 더불어 치사율 높은 췌장암의 원인이 될 수도 있어서 학계에서는 주목하고 있는 분야다.
연구팀은 “다량의 소화액을 분비하는 췌장 세포는 많은 양의 에너지를 소모하기 때문에, 에너지대사 기능이 저하되면 췌장염을 비롯한 다양한 췌장 질환에 노출될 수 있다. 건강한 췌장기능을 유지하기 위해 강력한 미토콘드리아의 에너지 생산 체계가 필요하다고 알려져 있었으나 췌장 미토콘드리아 에너지대사의 핵심 조절인자는 알려져 있지 않았다. 본 연구 결과는 ERRγ가 췌장 에너지 생성에 필수적일 뿐만 아니라 ERRγ의 기능이상이 췌장염과 췌장암 초기 발병기전에 관여한다는 점을 보여준다”고 밝혔다.
연구진은 췌장염 환자의 췌장 세포가 정상세포에 비해 ERRγ 유전자 활성이 감소하여 있음을 밝혀 임상적 연결고리를 보여주었으며, 이러한 발견은 ERRγ의 유전자 활성 조절을 통해 췌장염과 췌장암을 예방하거나 치료할 새로운 가능성을 열었다.
현재 연구팀은 미토콘드리아 조절 장애 및 췌장염이 초래하는 초기 췌장암을 예방하거나 치료하는 데 있어 ERRγ 활성 조절을 활용한 후속 연구를 이어가고 있다고 전했다.
우리 대학 의과학대학원 최진혁 박사와 Salk 연구소 오태규 박사가 공동 제1저자로 참여한 이번 연구는 4월 21일 소화기분야 최고 권위 저널인 ‘가스트로엔터롤로지 (Gastroenterology, IF 22.682)’ 온라인판에 게재됐다. (논문명: Estrogen-Related Receptor γ maintains pancreatic acinar cell function and identity by regulating cellular metabolism).
이번 연구는 과학기술정보통신부와 대구경북첨단의료산업진흥재단 원천기술개발사업, 과학기술정보통신부 글로벌연구실사업 및 한국과학기술원 국제공동연구지원사업의 지원을 받아 수행됐다.
2022.04.22 조회수 9241 일산화질소로부터 암모니아 생산하는 고효율 전기화학 기술 개발
발전소, 산업 시설 등에서 배출되는 배기가스 내 주요 대기오염 물질인 일산화질소(NO)로부터 암모니아를 생산하는 기술이 국내 연구진에 의해 개발됐다. 대기 중에서 초미세먼지를 유발하는 골칫거리인 일산화질소를 사용해 최근 수소 저장체로 주목받는 암모니아를 생산한 것이다.
우리 대학 건설및환경공학과 한종인 교수 연구팀이 UNIST(총장 이용훈) 에너지화학공학과 권영국 교수팀, 한국화학연구원(원장 이미혜) 환경자원연구센터 김동연 박사와 함께 일산화질소로부터 암모니아를 생산하는 고효율 전기화학 시스템을 개발했다고 23일 밝혔다. 개발된 시스템은 비싼 귀금속 촉매 대신 값싼 철 촉매를 이용해 상온 및 상압 조건에서 세계 최고 수준의 전기화학적 암모니아 생산 속도를 기록했다.
일산화질소는 발전소, 산업용 보일러, 제철소 등 연소시설에서 배출되는 질소산화물(NOx)의 대부분(95% 이상)을 차지하고 있는 유해 가스로, 호흡기 질환을 유발할 뿐만 아니라 산성비 및 대기 중 오존을 생성해 배출량이 엄격히 규제되고 있다. 현재 대부분의 처리 기술은 일산화질소의 단순 제거에만 초점을 맞추고 있지만 한 교수팀은 버려지는 일산화질소의 가치에 주목했다. 일산화질소의 높은 반응성을 이용해 적은 에너지만으로 유용 자원인 암모니아 생산의 가능성을 본 것이다.
연구팀은 물에 잘 녹지 않는 일산화질소의 한계를 극복하기 위해 기존의철-킬레이트를 포함한 일산화질소 흡수제를 사용하는 방식 대신 기체를 직접적으로 전극에 주입하는 기체 확산 전극을 사용해 물질전달 속도를 획기적으로 늘렸다. 이로써 공정에 소모되는 화학약품 비용을 줄이고 전기화학 셀 운전 시 발생하는 폐수 처리를 간편화했다.
나노 크기의 철 촉매를 전극에 도포해 부반응을 억제하고 암모니아에 대한 생성물의 선택도를 확보했으며, 전기화학적 암모니아 생산 성능을 결정하는 중요한 지표인 암모니아 생산 속도는 1,236μmolcm-2h-1를 기록했다. 이는 기존의 질소 기체(N2)를 활용한 전기화학적 암모니아 생산 속도 범위인 10μmolcm-2h-1을 100배 이상 넘어선 수준이다.
이러한 접근법은 대부분의 전기화학 반응에서 100%의 순수한 원료 기체를 필요로 하는 것과 달리 사용되는 일산화질소 가스의 농도를 1~10%까지 낮출 수 있어 해당 기술의 현장 적용성을 높일 수 있을 것으로 기대된다.
또한 기존의 암모니아 생산 공정인 하버-보쉬법이 섭씨 400도, 200기압 이상의 고에너지 조건을 요구하는 데 반해, 연구팀이 개발한 전기화학 시스템은 상온 및 상압 조건에서 암모니아 생산이 가능해 공정 설비와 비용 부담을 크게 줄일 수 있을 전망이다.
이번 연구를 주도적으로 진행한 한 교수 연구팀의 천선정 박사과정 학생은 "최근 대기오염, 탄소 중립 등의 이슈가 꾸준히 확산하는 가운데 지속할 수 있는 기술 개발에 대한 중요성이 커지고 있다ˮ며 "대기오염의 원인을 효과적으로 제거하는 동시에 탄소배출이 없는 암모니아 연료를 생산해 새로운 관점으로 환경문제를 해결하고자 했다ˮ고 말했다.
우리 대학 천선정 박사과정, 창원대학교 김원준 교수가 공동 제1 저자로 참여한 이번 연구성과는 저명 국제 학술지인 `ACS 에너지 레터스(Energy Letters)'에 3월 11일 자로 출판됐으며, 속표지논문으로 선정됐다. (논문명: Electro-synthesis of ammonia from dilute nitric oxide on a gas diffusion electrode).
한편 이번 연구는 한국에너지기술평가원, 한국연구재단 등의 지원을 받아 수행됐다.
2022.03.24 조회수 14214
일산화질소로부터 암모니아 생산하는 고효율 전기화학 기술 개발
발전소, 산업 시설 등에서 배출되는 배기가스 내 주요 대기오염 물질인 일산화질소(NO)로부터 암모니아를 생산하는 기술이 국내 연구진에 의해 개발됐다. 대기 중에서 초미세먼지를 유발하는 골칫거리인 일산화질소를 사용해 최근 수소 저장체로 주목받는 암모니아를 생산한 것이다.
우리 대학 건설및환경공학과 한종인 교수 연구팀이 UNIST(총장 이용훈) 에너지화학공학과 권영국 교수팀, 한국화학연구원(원장 이미혜) 환경자원연구센터 김동연 박사와 함께 일산화질소로부터 암모니아를 생산하는 고효율 전기화학 시스템을 개발했다고 23일 밝혔다. 개발된 시스템은 비싼 귀금속 촉매 대신 값싼 철 촉매를 이용해 상온 및 상압 조건에서 세계 최고 수준의 전기화학적 암모니아 생산 속도를 기록했다.
일산화질소는 발전소, 산업용 보일러, 제철소 등 연소시설에서 배출되는 질소산화물(NOx)의 대부분(95% 이상)을 차지하고 있는 유해 가스로, 호흡기 질환을 유발할 뿐만 아니라 산성비 및 대기 중 오존을 생성해 배출량이 엄격히 규제되고 있다. 현재 대부분의 처리 기술은 일산화질소의 단순 제거에만 초점을 맞추고 있지만 한 교수팀은 버려지는 일산화질소의 가치에 주목했다. 일산화질소의 높은 반응성을 이용해 적은 에너지만으로 유용 자원인 암모니아 생산의 가능성을 본 것이다.
연구팀은 물에 잘 녹지 않는 일산화질소의 한계를 극복하기 위해 기존의철-킬레이트를 포함한 일산화질소 흡수제를 사용하는 방식 대신 기체를 직접적으로 전극에 주입하는 기체 확산 전극을 사용해 물질전달 속도를 획기적으로 늘렸다. 이로써 공정에 소모되는 화학약품 비용을 줄이고 전기화학 셀 운전 시 발생하는 폐수 처리를 간편화했다.
나노 크기의 철 촉매를 전극에 도포해 부반응을 억제하고 암모니아에 대한 생성물의 선택도를 확보했으며, 전기화학적 암모니아 생산 성능을 결정하는 중요한 지표인 암모니아 생산 속도는 1,236μmolcm-2h-1를 기록했다. 이는 기존의 질소 기체(N2)를 활용한 전기화학적 암모니아 생산 속도 범위인 10μmolcm-2h-1을 100배 이상 넘어선 수준이다.
이러한 접근법은 대부분의 전기화학 반응에서 100%의 순수한 원료 기체를 필요로 하는 것과 달리 사용되는 일산화질소 가스의 농도를 1~10%까지 낮출 수 있어 해당 기술의 현장 적용성을 높일 수 있을 것으로 기대된다.
또한 기존의 암모니아 생산 공정인 하버-보쉬법이 섭씨 400도, 200기압 이상의 고에너지 조건을 요구하는 데 반해, 연구팀이 개발한 전기화학 시스템은 상온 및 상압 조건에서 암모니아 생산이 가능해 공정 설비와 비용 부담을 크게 줄일 수 있을 전망이다.
이번 연구를 주도적으로 진행한 한 교수 연구팀의 천선정 박사과정 학생은 "최근 대기오염, 탄소 중립 등의 이슈가 꾸준히 확산하는 가운데 지속할 수 있는 기술 개발에 대한 중요성이 커지고 있다ˮ며 "대기오염의 원인을 효과적으로 제거하는 동시에 탄소배출이 없는 암모니아 연료를 생산해 새로운 관점으로 환경문제를 해결하고자 했다ˮ고 말했다.
우리 대학 천선정 박사과정, 창원대학교 김원준 교수가 공동 제1 저자로 참여한 이번 연구성과는 저명 국제 학술지인 `ACS 에너지 레터스(Energy Letters)'에 3월 11일 자로 출판됐으며, 속표지논문으로 선정됐다. (논문명: Electro-synthesis of ammonia from dilute nitric oxide on a gas diffusion electrode).
한편 이번 연구는 한국에너지기술평가원, 한국연구재단 등의 지원을 받아 수행됐다.
2022.03.24 조회수 14214 유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 12257
유전자 가위로 생체 내 정밀한 유전자 교정에 의한 면역 항암 치료
CRISPR/Cas9 시스템을 이용하여 유전자교정을 일으킴으로써 암의 면역 치료를 유도하는 기술이 우리 대학 연구진에 의해 개발됐다.
우리 대학 생명과학과 정현정 교수, 서울대학교 의과학과 정기훈 교수 공동연구팀이 CRISPR/Cas9 리보핵산단백질을 생체 내에 효과적으로 전달하는 나노복합체를 개발하여 면역 관문 유전자를 교정함으로써 항암 효과를 보이는데 성공했다고 밝혔다.
암은 현대인의 건강을 위협하는 대표적인 요인으로 꼽히고 있다. 암의 치료 방법 중 면역 항암 요법은 부작용이 적고 높은 치료 성적을 보여 다양한 암 유형에 적용할 수 있다. 기존에는 항체 기반 치료법이 주로 임상에서 사용되고 있으며 다양한 고형암의 치료에 승인되었으나, 일시적인 효과로 반복 투여가 필요하다.
CRISPR/Cas9 시스템은 유전체의 서열을 직접 정밀하게 교정할 수 있으며, DNA 이중가닥을 절단하는 Cas9 제한효소와 특정 서열을 표적하는 단일 가이드 RNA로 이루어진다. 유전자교정 치료제의 경우 일반적으로 바이러스 기반 치료 방법을 이용했으나 돌연변이 유발, 비특이적 표적 효과 등으로 인해 한계가 있다. 비바이러스 치료제로 Cas9 단백질 및 단일가닥 RNA를 이용하면 바이러스 치료보다 안전성을 높일 수 있으나 낮은 세포내 전달 효과로 치료 효능이 떨어진다. 전달 효율을 높이기 위해 기존에 다양한 방법이 개발되고 연구됐으나, 일반적으로 과량의 전달체물질을 사용함으로써 생체 내 독성 문제가 나타나는 한계점이 있다. 이러한 문제점을 개선하기 위해 연구팀은 Cas9 단백질에 세포내 유입을 촉진하는 고분자를 접합시켜 극미량의 전달체물질로 고효율 전달이 가능한 Cas9 컨쥬게이트를 제작하여 활용했다.
연구팀은 이러한 Cas9 컨쥬게이트, 단일 가이드 RNA 및 변형된 데옥시뉴클레오타이드(DNA)를 추가해 나노조립된 리보핵단백질 복합체(이하 NanoRNP)를 개발했다. 이 복합체는 Cas9 컨쥬게이트, RNA 및 DNA의 상호작용으로 쉽게 제작할 수 있고, 유전자 교정 치료제로써 단일 요법에 의해 항암 치료가 가능하다는 점이 장점이다.
우리 대학 생명과학과 석박사통합과정 이주희 학생이 제1 저자로 참여한 이번 연구 결과는 재료화학 분야 국제학술지 `케미스트리 오브 머티리얼즈(Chemistry of Materials)'에 12월 20일 字 온라인 게재됐다. (논문명 : Nano-assembly of a Chemically Tailored Cas9 Ribonucleoprotein for In Vivo Gene Editing and Cancer Immunotherapy)
NanoRNP의 경우 Cas9에 부착된 고분자가 강한 양이온성을 지녀 단일 가이드 RNA와 안정적으로 복합체를 형성시키며, 생체내 분해효소로부터 보호하여 활성을 향상시킨다. 본 연구팀은 NanoRNP를 피부암에서 많이 발현되는 프로그램된 세포사멸 리간드-1 (PD-L1) 유전자를 표적하는데 응용하였다. PD-L1은 면역 세포의 표면 수용체에 존재하는 프로그램된 세포사멸 수용체-1 (PD-1)과 상호작용하여 면역 세포의 반응을 억제해 암세포의 세포사멸 회피를 유도한다.
연구팀은 NanoRNP를 이용하여 PD-L1 유전자의 교정으로 유전자결손을 유도하여, 면역 세포들이 활성화되고 종양미세환경의 변화로 면역 세포에 의한 암세포 사멸이 유도됨을 확인했다.
연구팀은 이번 연구 결과를 응용해 향후 암 뿐만 아니라 유전 질환 등 다양한 질병에 적용함으로써 연구를 확대 및 발전시켜 나갈 수 있을 것으로 기대하고 있다.
한편 이번 연구는 한국연구재단 중견연구자지원사업, 범부처전주기의료기기연구개발사업 및 KAIST End Run 사업의 지원을 통해 이뤄졌다.
2021.12.24 조회수 12257 악성 유방암 세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 악성 유방암세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술을 개발하는 데 성공했다고 30일 밝혔다.
연구팀은 유방암 아류 중에서 가장 악성으로 알려진 삼중음성 유방암(basal-like 혹은 triple negative) 환자들과 호르몬 치료가 가능한 루미날-A 유방암(luminal-A) 환자들의 유전자 네트워크를 컴퓨터시뮬레이션을 통해 분석함으로써 삼중음성 유방암세포를 루미날-A 유방암세포로 변환하는데 필요한 핵심 인자를 규명했다. 그리고 이를 조절해 삼중음성 유방암세포를 루미날-A 유방암세포로 리프로그래밍한 뒤 호르몬 치료를 시행하는 새로운 치료 원리를 개발했다.
우리 대학 최새롬 박사과정, 황채영 박사, 이종훈 박사과정 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치 (Cancer Research)' 11월 30일 字 논문으로 출판됐다. (논문명: Network analysis identifies regulators of basal-like breast cancer reprogramming and endocrine therapy vulnerability)
현재 삼중음성 유방암 환자들에게 적용되는 항암 화학요법은 빠르게 분열해 전이를 일으키는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 하지만 이러한 치료는 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 심각한 부작용을 일으킨다. 또한 삼중음성 유방암세포들은 이와 같은 독성항암제에 처음부터 내성을 갖거나 새로운 내성을 획득하면서 결국 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 삼중음성 유방암에 대한 현재의 항암치료는 내성을 갖는 암세포를 없애기 위해 더 많은 정상세포의 사멸을 감수해야만 하는 큰 한계를 지니고 있다.
이를 극복하기 위해 암세포만을 특이적으로 공격하는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽이려는 공통적인 원리 때문에 근본적인 한계를 가진다.
조 교수 연구팀은 시스템생물학 연구기법을 통해 악성 유방암세포인 삼중음성 유방암세포를 호르몬 치료가 가능한 루미날-A 유방암세포로 변환시킨 뒤 치료하는 새로운 개념의 치료전략을 개발했다. 이를 위해 유전자 네트워크의 수학모델을 개발하고 대규모 컴퓨터시뮬레이션 분석과 복잡계 네트워크 제어기술을 적용한 결과 두 개의 핵심 분자 타겟인 `BCL11A'와 `HDAC1/2'를 발굴했다.
조 교수 연구팀은 BCL11A와 HDAC1/2를 억제함으로써 삼중음성 유방암세포를 효과적으로 루미날-A 유방암세포로 변환시킬 수 있음을 분자 세포실험을 통해 증명했다. 삼중음성 유방암세포에서 이 핵심 인자들을 억제했을 때 세포의 분열이 감소하고, 삼중음성 유방암세포의 주요 세포성장 신호 흐름 경로인 `EGFR'과 관련된 인자들의 활동이 감소했으며, 루미날-A 유방암세포의 주요 세포성장 신호흐름 경로인 `ERa' 신호전달 경로 인자들의 활성이 회복되는 것을 확인했다.
이번 연구에서 발굴된 분자 타겟 중 BCL11A 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 임상실험을 통해 악성 유방암세포를 치료 가능한 세포상태로 리프로그래밍 함으로써 안전하고 효과적으로 치료하는 새로운 치료기술이 실현될 수 있을 것으로 보인다. 특히 이처럼 암세포의 성질을 되돌리거나 변환하는 암세포 리프로그래밍 기반의 새로운 치료전략이 임상에서 실현된다면 현재 항암치료의 많은 부작용과 내성 발생을 근본적으로 해결함으로써 암 환자의 고통을 최소화하고 삶의 질을 크게 향상시킬 수 있을 것으로 기대된다.
조 교수는 "그동안 유방암 중에서도 가장 악성인 삼중음성 유방암은 독성이 강해 큰 부작용을 일으키는 화학 항암치료 외에는 방법이 없었으나 이를 호르몬 치료가 가능하며 덜 악성인 루미날-A 유방암세포로 리프로그래밍해 효과적으로 치료할 수 있는 새로운 가능성을 열었다ˮ라며 "이번 연구는 악성 암세포를 직접 없애려고 하기보다 치료가 수월한 세포 상태로 되돌린 뒤 치료하는 새로운 방식의 항암 치료전략을 제시했다ˮ라고 말했다.
조 교수 연구팀은 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구에 성공한 바 있으며, 이번 연구 결과는 암세포 리프로그래밍을 통한 가역화 기술 개발의 두 번째 성과다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 한국전자통신연구소 공동연구사업, KAIST Grand Challenge 30의 지원으로 수행됐다.
2021.11.30 조회수 12524
악성 유방암 세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술 개발
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 악성 유방암세포를 치료 가능한 상태로 되돌리는 암세포 리프로그래밍 기술을 개발하는 데 성공했다고 30일 밝혔다.
연구팀은 유방암 아류 중에서 가장 악성으로 알려진 삼중음성 유방암(basal-like 혹은 triple negative) 환자들과 호르몬 치료가 가능한 루미날-A 유방암(luminal-A) 환자들의 유전자 네트워크를 컴퓨터시뮬레이션을 통해 분석함으로써 삼중음성 유방암세포를 루미날-A 유방암세포로 변환하는데 필요한 핵심 인자를 규명했다. 그리고 이를 조절해 삼중음성 유방암세포를 루미날-A 유방암세포로 리프로그래밍한 뒤 호르몬 치료를 시행하는 새로운 치료 원리를 개발했다.
우리 대학 최새롬 박사과정, 황채영 박사, 이종훈 박사과정 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 `캔서 리서치 (Cancer Research)' 11월 30일 字 논문으로 출판됐다. (논문명: Network analysis identifies regulators of basal-like breast cancer reprogramming and endocrine therapy vulnerability)
현재 삼중음성 유방암 환자들에게 적용되는 항암 화학요법은 빠르게 분열해 전이를 일으키는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 하지만 이러한 치료는 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 심각한 부작용을 일으킨다. 또한 삼중음성 유방암세포들은 이와 같은 독성항암제에 처음부터 내성을 갖거나 새로운 내성을 획득하면서 결국 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 삼중음성 유방암에 대한 현재의 항암치료는 내성을 갖는 암세포를 없애기 위해 더 많은 정상세포의 사멸을 감수해야만 하는 큰 한계를 지니고 있다.
이를 극복하기 위해 암세포만을 특이적으로 공격하는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽이려는 공통적인 원리 때문에 근본적인 한계를 가진다.
조 교수 연구팀은 시스템생물학 연구기법을 통해 악성 유방암세포인 삼중음성 유방암세포를 호르몬 치료가 가능한 루미날-A 유방암세포로 변환시킨 뒤 치료하는 새로운 개념의 치료전략을 개발했다. 이를 위해 유전자 네트워크의 수학모델을 개발하고 대규모 컴퓨터시뮬레이션 분석과 복잡계 네트워크 제어기술을 적용한 결과 두 개의 핵심 분자 타겟인 `BCL11A'와 `HDAC1/2'를 발굴했다.
조 교수 연구팀은 BCL11A와 HDAC1/2를 억제함으로써 삼중음성 유방암세포를 효과적으로 루미날-A 유방암세포로 변환시킬 수 있음을 분자 세포실험을 통해 증명했다. 삼중음성 유방암세포에서 이 핵심 인자들을 억제했을 때 세포의 분열이 감소하고, 삼중음성 유방암세포의 주요 세포성장 신호 흐름 경로인 `EGFR'과 관련된 인자들의 활동이 감소했으며, 루미날-A 유방암세포의 주요 세포성장 신호흐름 경로인 `ERa' 신호전달 경로 인자들의 활성이 회복되는 것을 확인했다.
이번 연구에서 발굴된 분자 타겟 중 BCL11A 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 임상실험을 통해 악성 유방암세포를 치료 가능한 세포상태로 리프로그래밍 함으로써 안전하고 효과적으로 치료하는 새로운 치료기술이 실현될 수 있을 것으로 보인다. 특히 이처럼 암세포의 성질을 되돌리거나 변환하는 암세포 리프로그래밍 기반의 새로운 치료전략이 임상에서 실현된다면 현재 항암치료의 많은 부작용과 내성 발생을 근본적으로 해결함으로써 암 환자의 고통을 최소화하고 삶의 질을 크게 향상시킬 수 있을 것으로 기대된다.
조 교수는 "그동안 유방암 중에서도 가장 악성인 삼중음성 유방암은 독성이 강해 큰 부작용을 일으키는 화학 항암치료 외에는 방법이 없었으나 이를 호르몬 치료가 가능하며 덜 악성인 루미날-A 유방암세포로 리프로그래밍해 효과적으로 치료할 수 있는 새로운 가능성을 열었다ˮ라며 "이번 연구는 악성 암세포를 직접 없애려고 하기보다 치료가 수월한 세포 상태로 되돌린 뒤 치료하는 새로운 방식의 항암 치료전략을 제시했다ˮ라고 말했다.
조 교수 연구팀은 2020년 1월에 대장암세포를 정상 대장 세포로 되돌리는 연구에 성공한 바 있으며, 이번 연구 결과는 암세포 리프로그래밍을 통한 가역화 기술 개발의 두 번째 성과다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 한국전자통신연구소 공동연구사업, KAIST Grand Challenge 30의 지원으로 수행됐다.
2021.11.30 조회수 12524 면역관문 신호 극복하는 차세대 CAR-T 세포 치료제 개발
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역관문 신호를 극복하는 차세대 `키메라 항원 수용체 T(chimeric antigen receptor T, 이하 CAR-T) 세포' 치료제를 개발했다고 20일 밝혔다.
CAR-T 세포 치료제는 우리 몸에서 항암 및 항바이러스 기능에 중요한 역할을 하는 면역세포인 T 세포에 CAR 유전자를 도입해 항암 기능을 증가시킨 유전자 세포 치료제로서, 기존의 모든 항암 치료에 불응한 말기 백혈병 환자들을 대상으로 한 임상 시험에서 80% 이상의 높은 치료 효과를 보이며 `기적의 항암제'로 불리고 있는 항암 치료제다.
김 교수 연구팀은 CAR-T 세포 치료제 제작에 사용되는 렌티바이러스 벡터를 2종류의 짧은 헤어핀 RNA(short hairpin RNA, 이하 shRNA)가 CAR 유전자와 함께 발현하도록 개량했다. 이들 shRNA를 통해 T 세포의 기능 저하를 유도하는 2종의 면역관문 수용체인 `PD-1'과 `TIGIT'의 발현을 동시에 억제했을 때, 생쥐를 이용한 백혈병과 림프종 모델에서 CAR-T 세포의 향상된 항암 기능을 확인했다.
우리 대학 생명과학과 이영호 박사후연구원이 제1 저자 및 공동교신 저자로 참여한 이번 연구는 미국 유전자 세포 치료제 학회(American Society of Gene & Cell Therapy, ASGCT) 공식 학술지인 `분자 치료(Molecular Therapy)' 10월 온라인 판에 출판됐다. (논문명 : PD-1 and TIGIT downregulation distinctly affect the effector and early memory phenotypes of CD19-targeting CAR T cells).
해당 기술은 김 교수가 공동 창업한 CAR-T 세포 치료제 전문 개발 벤처인 ㈜큐로셀에 기술이전되어 올해 3월부터 삼성서울병원에서 기존 항암 치료 후 재발 및 불응하는 미만성 거대 B 세포 림프종 (diffuse large B cell lymphoma, DLBCL) 환자를 대상으로 1b/2a 단계 임상 시험이 진행중이며, 이는 국내에서 국내기술로 시도된 최초의 CAR-T 임상시험이다.
높은 항암 효과로 미국에서는 2017년 최초 2종의 CAR-T 치료제가 허가를 받았고, 산학계의 활발한 연구를 바탕으로 현재까지 총 5종의 CAR-T 치료제가 허가를 받았다. 최근에는 중국이 대규모 투자와 공격적인 임상 연구를 진행하며 CAR-T 치료제 분야의 새로운 강국으로 급부상해, 현재 전 세계적으로 진행 중인 500여 건의 CAR-T 임상 시험 중 절반 이상이 중국에서 진행되고 있다. 반면 현재 국내에서는 1건의 임상 시험 만이 진행 중이다.
이처럼 높은 치료 효과로 많은 관심을 받는 CAR-T 치료제이지만 지금까지 임상에서 극적인 효과를 보인 암종이 B 세포성 급성 백혈병과 다발 골수종 같은 혈액암에 국한돼 있으며, 혈액암 중에서도 B 세포성 만성 백혈병과 림프종에서는 상대적으로 치료 효과가 낮다는 점, 그리고 무엇보다 고형암에서 높은 효과를 보이는 CAR-T 치료제가 아직 없다는 것이 중요하게 해결해야 할 과제로 대두되고 있다.
연구팀은 CAR-T 세포의 효능을 제한할 수 있는 잠재적인 요소 중, T 세포의 활성을 억제하는 기능을 갖는 면역관문 수용체에 주목했다. T 세포에 발현하는 다양한 면역관문 수용체들은 본래 T 세포가 지속해서 활성화될 때 생기는 부작용을 방지하는 기능을 하고 있으나, 암세포가 이를 악용해 T 세포의 활성을 떨어뜨림으로써 면역계의 작용을 회피하는 메커니즘이 잘 알려져 있다.
연구팀은 2종의 shRNA를 동시에 발현하는 플랫폼을 기반으로 다양한 조합의 면역관문 수용체들의 발현을 억제해 보았고, 흥미롭게도 PD-1과 TIGIT의 조합이 유독 CAR-T 세포의 기능을 높게 향상하는 것을 발견했다. 이후 연구팀은 전사체 분석 및 세포 기능 시험을 통해 흥미롭게도 PD-1의 발현 억제는 CAR-T 세포의 작용 기능(effector function)을 향상하는 데 비해 TIGIT의 발현 억제는 분화를 지연시켜 생체 내에서 CAR-T 세포의 증식 및 지속성을 향상하는 것을 밝혔다.
제1 저자이자 공동교신 저자인 이영호 박사후연구원은 "PD-1과 TIGIT 신호 차단은 CAR-T 세포가 면역억제 현상을 극복할 수 있도록 고안된 새로운 기술 전략으로 기존 치료제의 효과를 기대하기 힘든 림프종 환자분들에게 꼭 필요한 치료제로 여겨질 것으로 기대한다ˮ라며 "CAR-T 치료제 개발 경험은 고형암을 포함하는 새로운 치료제 개발에 큰 자양분이 될 것이다ˮ라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자 지원사업 및 과학기술정보통신부 신약개발지원센터 R&D 지원 사업의 지원을 받아 수행됐다.
2021.10.21 조회수 13039
면역관문 신호 극복하는 차세대 CAR-T 세포 치료제 개발
우리 대학 생명과학과 김찬혁 교수 연구팀이 면역관문 신호를 극복하는 차세대 `키메라 항원 수용체 T(chimeric antigen receptor T, 이하 CAR-T) 세포' 치료제를 개발했다고 20일 밝혔다.
CAR-T 세포 치료제는 우리 몸에서 항암 및 항바이러스 기능에 중요한 역할을 하는 면역세포인 T 세포에 CAR 유전자를 도입해 항암 기능을 증가시킨 유전자 세포 치료제로서, 기존의 모든 항암 치료에 불응한 말기 백혈병 환자들을 대상으로 한 임상 시험에서 80% 이상의 높은 치료 효과를 보이며 `기적의 항암제'로 불리고 있는 항암 치료제다.
김 교수 연구팀은 CAR-T 세포 치료제 제작에 사용되는 렌티바이러스 벡터를 2종류의 짧은 헤어핀 RNA(short hairpin RNA, 이하 shRNA)가 CAR 유전자와 함께 발현하도록 개량했다. 이들 shRNA를 통해 T 세포의 기능 저하를 유도하는 2종의 면역관문 수용체인 `PD-1'과 `TIGIT'의 발현을 동시에 억제했을 때, 생쥐를 이용한 백혈병과 림프종 모델에서 CAR-T 세포의 향상된 항암 기능을 확인했다.
우리 대학 생명과학과 이영호 박사후연구원이 제1 저자 및 공동교신 저자로 참여한 이번 연구는 미국 유전자 세포 치료제 학회(American Society of Gene & Cell Therapy, ASGCT) 공식 학술지인 `분자 치료(Molecular Therapy)' 10월 온라인 판에 출판됐다. (논문명 : PD-1 and TIGIT downregulation distinctly affect the effector and early memory phenotypes of CD19-targeting CAR T cells).
해당 기술은 김 교수가 공동 창업한 CAR-T 세포 치료제 전문 개발 벤처인 ㈜큐로셀에 기술이전되어 올해 3월부터 삼성서울병원에서 기존 항암 치료 후 재발 및 불응하는 미만성 거대 B 세포 림프종 (diffuse large B cell lymphoma, DLBCL) 환자를 대상으로 1b/2a 단계 임상 시험이 진행중이며, 이는 국내에서 국내기술로 시도된 최초의 CAR-T 임상시험이다.
높은 항암 효과로 미국에서는 2017년 최초 2종의 CAR-T 치료제가 허가를 받았고, 산학계의 활발한 연구를 바탕으로 현재까지 총 5종의 CAR-T 치료제가 허가를 받았다. 최근에는 중국이 대규모 투자와 공격적인 임상 연구를 진행하며 CAR-T 치료제 분야의 새로운 강국으로 급부상해, 현재 전 세계적으로 진행 중인 500여 건의 CAR-T 임상 시험 중 절반 이상이 중국에서 진행되고 있다. 반면 현재 국내에서는 1건의 임상 시험 만이 진행 중이다.
이처럼 높은 치료 효과로 많은 관심을 받는 CAR-T 치료제이지만 지금까지 임상에서 극적인 효과를 보인 암종이 B 세포성 급성 백혈병과 다발 골수종 같은 혈액암에 국한돼 있으며, 혈액암 중에서도 B 세포성 만성 백혈병과 림프종에서는 상대적으로 치료 효과가 낮다는 점, 그리고 무엇보다 고형암에서 높은 효과를 보이는 CAR-T 치료제가 아직 없다는 것이 중요하게 해결해야 할 과제로 대두되고 있다.
연구팀은 CAR-T 세포의 효능을 제한할 수 있는 잠재적인 요소 중, T 세포의 활성을 억제하는 기능을 갖는 면역관문 수용체에 주목했다. T 세포에 발현하는 다양한 면역관문 수용체들은 본래 T 세포가 지속해서 활성화될 때 생기는 부작용을 방지하는 기능을 하고 있으나, 암세포가 이를 악용해 T 세포의 활성을 떨어뜨림으로써 면역계의 작용을 회피하는 메커니즘이 잘 알려져 있다.
연구팀은 2종의 shRNA를 동시에 발현하는 플랫폼을 기반으로 다양한 조합의 면역관문 수용체들의 발현을 억제해 보았고, 흥미롭게도 PD-1과 TIGIT의 조합이 유독 CAR-T 세포의 기능을 높게 향상하는 것을 발견했다. 이후 연구팀은 전사체 분석 및 세포 기능 시험을 통해 흥미롭게도 PD-1의 발현 억제는 CAR-T 세포의 작용 기능(effector function)을 향상하는 데 비해 TIGIT의 발현 억제는 분화를 지연시켜 생체 내에서 CAR-T 세포의 증식 및 지속성을 향상하는 것을 밝혔다.
제1 저자이자 공동교신 저자인 이영호 박사후연구원은 "PD-1과 TIGIT 신호 차단은 CAR-T 세포가 면역억제 현상을 극복할 수 있도록 고안된 새로운 기술 전략으로 기존 치료제의 효과를 기대하기 힘든 림프종 환자분들에게 꼭 필요한 치료제로 여겨질 것으로 기대한다ˮ라며 "CAR-T 치료제 개발 경험은 고형암을 포함하는 새로운 치료제 개발에 큰 자양분이 될 것이다ˮ라고 말했다.
한편 이번 연구는 한국연구재단 중견연구자 지원사업 및 과학기술정보통신부 신약개발지원센터 R&D 지원 사업의 지원을 받아 수행됐다.
2021.10.21 조회수 13039 모트 전이 반도체로 진성 난수 생성기 개발
우리 대학 신소재공학과 김경민 교수 연구팀이 모트 전이 반도체의 확률적 거동을 이용한 진성 난수(True Random Number) 생성기 개발에 성공했다고 18일 밝혔다.
전자기기들이 초연결되는 메타버스 시대에는 전자기기 간에 대량의 데이터가 실시간으로 오가게 되는데, 이때 더욱 고도화된 데이터의 보안과 암호화 기술이 뒷받침돼야 한다. 현재 대부분의 난수는 소프트웨어로 생성되고 있는데, 이렇게 생성된 일반적인 난수는 소프트웨어의 해독을 통해 쉽게 예측할 수 있고 이는 데이터 보안 및 개인 정보 침해에 매우 큰 위협이 될 수 있다.
이에 반해 진성 난수는 자연의 무작위적인 물리적 현상으로부터 얻어지는 인간이 예측할 수 없는 난수로 이를 얻는 것은 궁극의 보안 기술을 구현하기 위해 필수적이다.
김경민 교수 연구팀은 진성 난수를 추출하기 위해 모트 전이 소재에 주목했다. 모트 전이 소재는 특정 온도에서 전기전도도가 부도체에서 도체로 전이하는 소재로, 이 소재에 전류를 흘려주어 가열하면 부도체 상태와 도체 상태가 주기적으로 변하는 상태의 진동 현상을 관찰할 수 있음이 잘 알려져 있었다. 연구팀은 이 과정에서 주기적으로 소재의 가열과 냉각이 반복될 때 열의 생성과 발산이 예측 불가능함을 이론적으로 입증했다.
연구팀은 이와 같은 모트 전이 소재에서의 예측 불가능한 특성을 진성 난수로 변환해주는 프로토타입의 진성 난수 생성기를 설계 및 제작하여 진성 난수를 성공적으로 수집했다.
공동 제1 저자인 신소재공학과 김광민 석사과정과 인재현 박사과정은 "모트 전이 반도체를 기반으로 하는 진성 난수 생성기는 25 마이크로초(μs) 마다 5.22 나노줄(nJ)의 에너지로 1개의 난수를 생성할 수 있는데 이는 기존 기술에 대비 최소 2.5배 이상 빠르고, 1,800분의 1 수준의 에너지로 저전력 동작이 가능하다ˮ며 "이는 저항 변화 메모리의 셀렉터 등 제한된 분야에서만 사용되던 모트 전이 소재를 진성 난수 생성기에 적합하다는 것을 입증한 결과로 새로운 하드웨어 보안용 소재 개발 분야를 개척한 의의가 있다ˮ 라고 말했다.
이러한 진성 난수 생성기는 반도체 칩의 형태로 제작해 기존 전자기기와 호환할 수 있으며 휴대전화 등 전자기기의 보안을 위한 암호화 하드웨어로 사용할 수 있을 것으로 기대된다.
이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 지난 5월 18일 字에 게재됐으며 산업통상자원부, 한국반도체연구조합, KAIST의 지원을 받아 수행됐다. (논문명 : Self-clocking fast and variation tolerant true random number generator based on a stochastic mott memristor)
2021.08.18 조회수 14527
모트 전이 반도체로 진성 난수 생성기 개발
우리 대학 신소재공학과 김경민 교수 연구팀이 모트 전이 반도체의 확률적 거동을 이용한 진성 난수(True Random Number) 생성기 개발에 성공했다고 18일 밝혔다.
전자기기들이 초연결되는 메타버스 시대에는 전자기기 간에 대량의 데이터가 실시간으로 오가게 되는데, 이때 더욱 고도화된 데이터의 보안과 암호화 기술이 뒷받침돼야 한다. 현재 대부분의 난수는 소프트웨어로 생성되고 있는데, 이렇게 생성된 일반적인 난수는 소프트웨어의 해독을 통해 쉽게 예측할 수 있고 이는 데이터 보안 및 개인 정보 침해에 매우 큰 위협이 될 수 있다.
이에 반해 진성 난수는 자연의 무작위적인 물리적 현상으로부터 얻어지는 인간이 예측할 수 없는 난수로 이를 얻는 것은 궁극의 보안 기술을 구현하기 위해 필수적이다.
김경민 교수 연구팀은 진성 난수를 추출하기 위해 모트 전이 소재에 주목했다. 모트 전이 소재는 특정 온도에서 전기전도도가 부도체에서 도체로 전이하는 소재로, 이 소재에 전류를 흘려주어 가열하면 부도체 상태와 도체 상태가 주기적으로 변하는 상태의 진동 현상을 관찰할 수 있음이 잘 알려져 있었다. 연구팀은 이 과정에서 주기적으로 소재의 가열과 냉각이 반복될 때 열의 생성과 발산이 예측 불가능함을 이론적으로 입증했다.
연구팀은 이와 같은 모트 전이 소재에서의 예측 불가능한 특성을 진성 난수로 변환해주는 프로토타입의 진성 난수 생성기를 설계 및 제작하여 진성 난수를 성공적으로 수집했다.
공동 제1 저자인 신소재공학과 김광민 석사과정과 인재현 박사과정은 "모트 전이 반도체를 기반으로 하는 진성 난수 생성기는 25 마이크로초(μs) 마다 5.22 나노줄(nJ)의 에너지로 1개의 난수를 생성할 수 있는데 이는 기존 기술에 대비 최소 2.5배 이상 빠르고, 1,800분의 1 수준의 에너지로 저전력 동작이 가능하다ˮ며 "이는 저항 변화 메모리의 셀렉터 등 제한된 분야에서만 사용되던 모트 전이 소재를 진성 난수 생성기에 적합하다는 것을 입증한 결과로 새로운 하드웨어 보안용 소재 개발 분야를 개척한 의의가 있다ˮ 라고 말했다.
이러한 진성 난수 생성기는 반도체 칩의 형태로 제작해 기존 전자기기와 호환할 수 있으며 휴대전화 등 전자기기의 보안을 위한 암호화 하드웨어로 사용할 수 있을 것으로 기대된다.
이번 연구는 국제 학술지 `네이처 커뮤니케이션즈(Nature Communications)' 지난 5월 18일 字에 게재됐으며 산업통상자원부, 한국반도체연구조합, KAIST의 지원을 받아 수행됐다. (논문명 : Self-clocking fast and variation tolerant true random number generator based on a stochastic mott memristor)
2021.08.18 조회수 14527 암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27 조회수 31869
암 면역치료를 위한 새로운 세포사멸 유도체 개발
우리 대학 생명화학공학과 김유천 교수와 한양대학교 생명공학과 윤채옥 교수 공동연구팀이 암 치료에 이용되는 면역항암제인 면역관문억제제와 협력 효과를 내는 *펩타이드 기반의 면역원성 세포사멸 유도체를 개발했다고 27일 밝혔다.
☞ 펩타이드(peptide): 아미노산이 2~50개 정도 결합된 물질을 뜻하며, 아미노산이 50개 이상 결합된 물질이 단백질이다.
연구팀이 개발한 펩타이드는 암세포 내의 미토콘드리아 외막을 붕괴시켜 활성산소 농도를 높이고, 이를 통해 형성된 산화적 스트레스가 소포체를 자극해 면역원성 세포사멸을 유도한다.
우리 대학 생명화학공학과 정성동 박사와 한양대학교 생명공학과 정보경 박사가 공동 제1 저자로 참여하고, 한양대학교 생명공학과 윤채옥 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제 학술지 `어드밴스드 사이언스 (Advanced Science)' 4월 7일 字 표지논문(Back cover)으로 게재됐다. (논문명 : Immunogenic Cell Death Inducing Fluorinated Mitochondria-Disrupting Helical Polypeptide Synergizes with PD-L1 Immune Checkpoint Blockade).
면역관문억제제는 T세포(CTLA-4, PD-1)나 암세포(PD-L1)에 발현된 면역세포의 활성을 저해하는 면역관문을 차단해서 면역세포의 작용을 활발하게 하는 치료제다. 2011년 미국 식품 의약국에 최초로 승인을 받은 후, 다양한 면역관문억제제가 환자들에게 이용되고 있다.
하지만 면역관문억제제도 몇 가지 한계점을 가지고 있다. 먼저 이 치료법은 모든 환자에게 효과가 있는 것이 아니라 10~40% 정도의 환자에게만 효과가 있다. 그리고 기존에 존재하는 항암 능력을 갖춘 T세포가 필요하다는 단점이 있다.
연구팀은 이러한 문제점들을 해결하기 위해 항암 면역반응을 유도하는 면역원성 세포사멸 유도체와 면역관문억제제를 병용투여 해 문제점을 해결하고자 했다.
연구팀은 펩타이드 기반의 면역원성 세포사멸 유도체가 미토콘드리아 외막 붕괴를 통해 세포 내의 활성산소를 과잉생산하고, 이렇게 생성된 산화적 스트레스가 소포체를 자극해 최종적으로 면역원성 세포사멸을 유도하는 것을 검증했다.
또한, 동물실험을 통해 펩타이드와 면역관문억제제인 anti-PD-L1을 병용 투여했을 때, 단독 투여에 비해 종양 억제 능력이 향상되고, 활성화된 면역반응을 통해 폐로의 전이가 줄어드는 것을 확인했다.
연구를 주도한 김유천 교수는 "이번 새로운 면역원성 세포사멸 유도체 개발을 통해, 기존 면역관문억제제의 낮은 반응률을 보이는 암에서 치료 효과를 높일 수 있는 다양한 방법을 제시할 것으로 기대한다ˮ고 말했다.
한편, 이번 연구는 한국연구재단 중견연구자사업과 기초연구실 사업을 통해 수행됐다.
2021.04.27 조회수 31869 개인 맞춤형 암 치료에 한 발짝 다가서
우리 연구진이 급성골수성백혈병(Acute myeloid leukemia)과 골수이형성증후군(Myelodysplastic syndromes) 치료에 사용되는 항암 화학 치료제 중 하나인 데시타빈(decitabine)의 인체 내 작용 메커니즘을 규명해 항암제 효과가 있는 환자와 없는 환자를 구별해 낼 수 있는 유전자 발굴에 성공했다.
이번 연구를 통해 환자별로 적합한 치료를 받을 수 있게 되면 환자들이 치료에 드는 경제적 지출과 시간적 소비 또한 확연하게 줄일 수 있을 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 서울대병원 혈액암센터 홍준식 교수 공동 연구팀이 항암 화학치료에서 작용하는 주요 인자를 찾아냈다고 7일 밝혔다.
생명화학공학과 박사과정에 재학 중인 구용석 학생, 서울대병원 박주환 연구원 그리고 우리 대학 조령은 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 3월 30일 字에 게재됐다. (논문명: Noncanonical immune response to the inhibition of DNA methylation via stabilization of endogenous retrovirus dsRNAs)
데시타빈과 같은 DNA 탈메틸화제(DNA demethylating agent)는 DNA 복제과정에 참여하고 DNA상에 존재하는 메틸기(-CH₃)를 제거해 유전자 발현을 조절한다. 특히 암세포에는 일반 세포보다 많은 양의 DNA가 메틸화돼 있으며, 이는 DNA에서 RNA를 생성하는 전사 과정을 억제하는 역할을 한다. 세포에 탈메틸화제 처리를 하면 DNA상에 메틸기가 제거돼 세포 내에 수많은 종류의 RNA들이 생성된다.
이렇게 데시타빈에 의해 조절되는 RNA 중에는 이중나선 RNA (double-stranded RNA, 이하 dsRNA)가 있다. 원래 dsRNA는 바이러스에 감염된 세포에서 많이 생산되며, 인간 세포는 바이러스에서 유래된 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다.
특이하게도 dsRNA를 인지하는 인간의 선천성 면역반응 시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 형태와 같은 구조적 특징을 이용해 dsRNA와 반응한다. 이와 같은 특징 때문에 꼭 바이러스에서 유래된 dsRNA가 아니라 체내에서 생성된 dsRNA 또한 외부 물질로 오인돼 비정상적인 면역반응을 일으킬 수 있다. 암 치료에서는 DNA 탈메틸화제 처리로 dsRNA의 발현량을 증가시키고 이는 dsRNA에 의한 면역 활성으로 이어져 암세포만의 세포사멸이 일어나게 된다.
연구팀은 이러한 데시타빈에 의한 dsRNA 발현증가 그리고 dsRNA에 의한 세포사멸을 조절하는 유전자를 연구했다. 특히, DNA 탈메틸화제를 투여받은 환자 중 많은 수의 환자가 약물의 효과를 보지 못한다는 점에 착안해 dsRNA와 상호작용하는 다양한 dsRNA 결합 단백질을 분석했다.
그 결과로 dsRNA와 직접 결합해 dsRNA의 안정성을 조절하는 단백질인 `스타우펜1(이하 Staufen1)'이 데시타빈에 의한 세포 반응에 중요한 기능을 한다는 것을 최초로 규명했다. Staufen1의 발현이 억제된 세포에서는 dsRNA가 빠르게 제거돼 하위 면역반응이 일어나지 않았으며 암세포의 사멸도 관찰되지 않았다.
연구팀은 데시타빈 뿐만 아니라 아자시티딘(azacitidine)과 같은 DNA 탈메틸화제를 투여받은 급성골수성백혈병과 골수이형성증후군 환자 46명의 골수추출액에서 Staufen1 유전자의 발현양상을 분석했고, 그 결과 약물의 효과를 보지 못한 환자에게서는 Staufen1의 발현이 유의미하게 감소해 있다는 것을 확인했다. 또한, Staufen1의 발현이 낮은 환자는 생존율(overall survival)과 무진행 생존율(progression-free survival)이 모두 낮아 환자의 예후가 좋지 않다는 것을 확인했다.
생명화학공학과 김유식 교수는 "이번 연구에서는 단순 데시타빈 항암제의 작용기전 규명을 넘어서 실제 데시타빈을 투여받은 환자의 검체에서도 그 효과를 검증했다ˮ면서 "추후 이번에 찾은 유전자의 바이오마커화를 통해 데시타빈과 아자시티딘과 같은 DNA 탈메틸화제의 효과를 예측할 수 있어 효과적인 맞춤형 암 치료전략을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원을 받아 수행됐다.
2021.04.07 조회수 80222
개인 맞춤형 암 치료에 한 발짝 다가서
우리 연구진이 급성골수성백혈병(Acute myeloid leukemia)과 골수이형성증후군(Myelodysplastic syndromes) 치료에 사용되는 항암 화학 치료제 중 하나인 데시타빈(decitabine)의 인체 내 작용 메커니즘을 규명해 항암제 효과가 있는 환자와 없는 환자를 구별해 낼 수 있는 유전자 발굴에 성공했다.
이번 연구를 통해 환자별로 적합한 치료를 받을 수 있게 되면 환자들이 치료에 드는 경제적 지출과 시간적 소비 또한 확연하게 줄일 수 있을 것으로 기대된다.
우리 대학 생명화학공학과 김유식 교수와 서울대병원 혈액암센터 홍준식 교수 공동 연구팀이 항암 화학치료에서 작용하는 주요 인자를 찾아냈다고 7일 밝혔다.
생명화학공학과 박사과정에 재학 중인 구용석 학생, 서울대병원 박주환 연구원 그리고 우리 대학 조령은 학생이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `미국국립과학원회보(PNAS)' 3월 30일 字에 게재됐다. (논문명: Noncanonical immune response to the inhibition of DNA methylation via stabilization of endogenous retrovirus dsRNAs)
데시타빈과 같은 DNA 탈메틸화제(DNA demethylating agent)는 DNA 복제과정에 참여하고 DNA상에 존재하는 메틸기(-CH₃)를 제거해 유전자 발현을 조절한다. 특히 암세포에는 일반 세포보다 많은 양의 DNA가 메틸화돼 있으며, 이는 DNA에서 RNA를 생성하는 전사 과정을 억제하는 역할을 한다. 세포에 탈메틸화제 처리를 하면 DNA상에 메틸기가 제거돼 세포 내에 수많은 종류의 RNA들이 생성된다.
이렇게 데시타빈에 의해 조절되는 RNA 중에는 이중나선 RNA (double-stranded RNA, 이하 dsRNA)가 있다. 원래 dsRNA는 바이러스에 감염된 세포에서 많이 생산되며, 인간 세포는 바이러스에서 유래된 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다.
특이하게도 dsRNA를 인지하는 인간의 선천성 면역반응 시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 형태와 같은 구조적 특징을 이용해 dsRNA와 반응한다. 이와 같은 특징 때문에 꼭 바이러스에서 유래된 dsRNA가 아니라 체내에서 생성된 dsRNA 또한 외부 물질로 오인돼 비정상적인 면역반응을 일으킬 수 있다. 암 치료에서는 DNA 탈메틸화제 처리로 dsRNA의 발현량을 증가시키고 이는 dsRNA에 의한 면역 활성으로 이어져 암세포만의 세포사멸이 일어나게 된다.
연구팀은 이러한 데시타빈에 의한 dsRNA 발현증가 그리고 dsRNA에 의한 세포사멸을 조절하는 유전자를 연구했다. 특히, DNA 탈메틸화제를 투여받은 환자 중 많은 수의 환자가 약물의 효과를 보지 못한다는 점에 착안해 dsRNA와 상호작용하는 다양한 dsRNA 결합 단백질을 분석했다.
그 결과로 dsRNA와 직접 결합해 dsRNA의 안정성을 조절하는 단백질인 `스타우펜1(이하 Staufen1)'이 데시타빈에 의한 세포 반응에 중요한 기능을 한다는 것을 최초로 규명했다. Staufen1의 발현이 억제된 세포에서는 dsRNA가 빠르게 제거돼 하위 면역반응이 일어나지 않았으며 암세포의 사멸도 관찰되지 않았다.
연구팀은 데시타빈 뿐만 아니라 아자시티딘(azacitidine)과 같은 DNA 탈메틸화제를 투여받은 급성골수성백혈병과 골수이형성증후군 환자 46명의 골수추출액에서 Staufen1 유전자의 발현양상을 분석했고, 그 결과 약물의 효과를 보지 못한 환자에게서는 Staufen1의 발현이 유의미하게 감소해 있다는 것을 확인했다. 또한, Staufen1의 발현이 낮은 환자는 생존율(overall survival)과 무진행 생존율(progression-free survival)이 모두 낮아 환자의 예후가 좋지 않다는 것을 확인했다.
생명화학공학과 김유식 교수는 "이번 연구에서는 단순 데시타빈 항암제의 작용기전 규명을 넘어서 실제 데시타빈을 투여받은 환자의 검체에서도 그 효과를 검증했다ˮ면서 "추후 이번에 찾은 유전자의 바이오마커화를 통해 데시타빈과 아자시티딘과 같은 DNA 탈메틸화제의 효과를 예측할 수 있어 효과적인 맞춤형 암 치료전략을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 KAIST 미래형 시스템 헬스케어 연구개발사업의 지원을 받아 수행됐다.
2021.04.07 조회수 80222