%EB%B0%94%EC%9D%B4%EC%98%A4
-
 이흥규 교수, 수지상세포 자식작용의 역할 규명
〈 이흥규 교수 〉
세포 항상성을 유지해주는 ‘자식작용’의 또 다른 기능이 보고됐다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 T세포의 항암 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다.
이번 연구결과는 국제학술지 ‘오토파지(Autophagy)’ 3월 22일 자에 게재됐다.
자식작용은 세포 내 노폐물 및 손상된 세포 소기관을 제거해 세포의 항상성을 유지하는 과정이다.
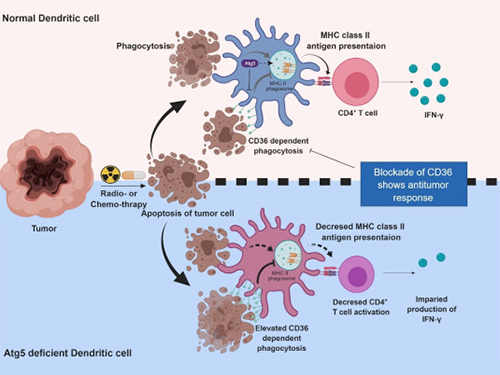
수지상세포는 병원균이나 암 항원을 인지해 T세포의 면역반응을 유도하는 세포이다. 방사선이나 항암제에 의해 암세포가 사멸하면 수지상세포가 이를 흡수‧제거하고, 자신의 표면에 항원을 제시해 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항암 효과를 높일 수 있는 원리를 제시했다.
실험결과 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 T세포 활성화 기능이 떨어지고 항암 면역반응이 감소했다.
Atg5가 결손되면 수지상세포 표면의 CD36 수용체가 월등히 증가하는데, 이로 인해 식세포작용(암 항원의 흡수)만 과활성되고 항원 제시를 통한 T세포 활성화가 정상적으로 이뤄지지 않는다.
이때 항체를 도입해 CD36 수용체를 다시 억제하면 T세포 면역반응이 많이 증가하고 암의 성장이 억제됐다.
이흥규 교수는 “이번 연구를 통해 자식작용이 T세포의 항암 면역반응에 관여하는 기능을 새롭게 규명했다”라 “향후 CD36 수용체를 활용한 표적 항암치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이 연구성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 수지상세포 자식작용의 기전
그림2. 항원제시에서 수지상세포 자식작용의 기능
2019.04.02 조회수 17506
이흥규 교수, 수지상세포 자식작용의 역할 규명
〈 이흥규 교수 〉
세포 항상성을 유지해주는 ‘자식작용’의 또 다른 기능이 보고됐다. 우리 대학 의과학대학원 이흥규 교수 연구팀이 T세포의 항암 활성이 유도되는 과정에서 수지상세포 자식작용이 기여함을 규명했다.
이번 연구결과는 국제학술지 ‘오토파지(Autophagy)’ 3월 22일 자에 게재됐다.
자식작용은 세포 내 노폐물 및 손상된 세포 소기관을 제거해 세포의 항상성을 유지하는 과정이다.
수지상세포는 병원균이나 암 항원을 인지해 T세포의 면역반응을 유도하는 세포이다. 방사선이나 항암제에 의해 암세포가 사멸하면 수지상세포가 이를 흡수‧제거하고, 자신의 표면에 항원을 제시해 T세포에 전달해주는 기능을 한다.
연구팀은 수지상세포의 자식작용이 T세포 활성화에서 핵심 역할을 한다는 것을 밝히고 항암 효과를 높일 수 있는 원리를 제시했다.
실험결과 자식작용을 일으키는 Atg5 유전자가 결손될 때 수지상세포의 T세포 활성화 기능이 떨어지고 항암 면역반응이 감소했다.
Atg5가 결손되면 수지상세포 표면의 CD36 수용체가 월등히 증가하는데, 이로 인해 식세포작용(암 항원의 흡수)만 과활성되고 항원 제시를 통한 T세포 활성화가 정상적으로 이뤄지지 않는다.
이때 항체를 도입해 CD36 수용체를 다시 억제하면 T세포 면역반응이 많이 증가하고 암의 성장이 억제됐다.
이흥규 교수는 “이번 연구를 통해 자식작용이 T세포의 항암 면역반응에 관여하는 기능을 새롭게 규명했다”라 “향후 CD36 수용체를 활용한 표적 항암치료제 개발의 단초가 되길 기대한다”라고 밝혔다.
이 연구성과는 과학기술정보통신부·한국연구재단 바이오‧의료기술개발사업의 지원으로 수행됐다.
□ 그림 설명
그림1. 수지상세포 자식작용의 기전
그림2. 항원제시에서 수지상세포 자식작용의 기능
2019.04.02 조회수 17506 -
 이상엽 특훈교수, 바이오 기반 화학물질 합성 지도 완성
〈 이 상 엽 특훈교수 〉
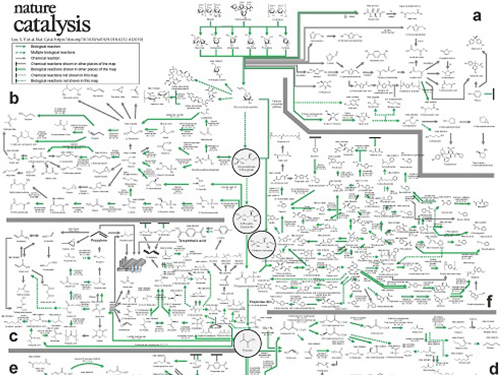
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 바이오매스인 미생물로부터 화학제품을 생산하는 경로를 총정리한 ‘바이오 기반 화학물질 합성 지도’를 개발, 완성했다.
연구팀은 화학물질을 생산하는데 필요한 바이오 및 화학 반응들에 대한 정보를 총망라해 생명공학자들이 쉽게 활용할 수 있게끔 지도 형태로 정리하고, 이에 대한 분석을 수행했다.
이번 연구 결과는 국제학술지 ‘네이처 카탈리시스(Nature Catalysis)’에 표지논문으로 1월 15일 게재됐다.
석유로부터 화학제품을 생산하는 과정에서 온실가스를 배출하기 때문에 지구온난화 등 글로벌 기후변화를 유발하고 있다. 이에 세계는 친환경적 방법으로 화학제품을 생산하기 위해 미생물을 활용한 화학물질 생산기술 개발에 주력하고 있다.
미생물과 같은 바이오매스 원료에 생물공학적 또는 화학적 기술을 적용해 화학원료·연료 등 화학제품을 생산하는 공정을 ‘바이오 리파이너리(Bio-Refinery)’라 한다.
바이오 리파이너리의 생물공학적 방법 중 ‘시스템 대사공학’만을 100% 적용해 화학물질을 생산하는 사례가 점차 늘고 있지만, 생물공학적 방법과 화학반응의 통합공정이나 화학공정만을 활용하는 것이 더욱 효율적인 경우도 많다.
이번에 구축한 ‘바이오 기반 화학물질 합성 지도’는 화학물질 생산을 위한 생물공학적·화학적 반응 전체에 대해 최적의 합성 경로를 구축한 것으로, 앞으로 바이오 기반 화학제품 생산 연구에 귀중한 기초자료로 활용될 수 있을 것으로 보인다.
특히 중요성을 인정받아 네이처 카탈리시스는 ‘바이오 기반 화학물질 합성 지도’를 포스터로 제작해 관련 분야의 산업계, 연구계에서 활용할 수 있도록 전 세계에 배포할 계획이다.
이상엽 특훈교수는 “이번에 개발한 지도는 앞으로 시스템 대사공학이 나아가야 할 방향과 아이디어의 청사진을 제시해 준다는 점에서 의미가 있다”라며, “이는 향후 친환경 화학은 물론 의료·식품·화장품 분야 등 다양한 산업에 매우 유용하게 활용될 수 있을 것이다.”라고 밝혔다.
이번 연구는 과기정통부 ‘기후변화대응기술개발사업’의 ‘바이오 리파이너리를 위한 시스템대사공학 원천기술개발’ 과제 지원을 받아 수행됐다.
□ 그림 설명
그림1. 바이오 기반 화학물질 합성 지도
그림2. 네이처 카탈리시스 표지논문 디자인
2019.01.15 조회수 18979
이상엽 특훈교수, 바이오 기반 화학물질 합성 지도 완성
〈 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 바이오매스인 미생물로부터 화학제품을 생산하는 경로를 총정리한 ‘바이오 기반 화학물질 합성 지도’를 개발, 완성했다.
연구팀은 화학물질을 생산하는데 필요한 바이오 및 화학 반응들에 대한 정보를 총망라해 생명공학자들이 쉽게 활용할 수 있게끔 지도 형태로 정리하고, 이에 대한 분석을 수행했다.
이번 연구 결과는 국제학술지 ‘네이처 카탈리시스(Nature Catalysis)’에 표지논문으로 1월 15일 게재됐다.
석유로부터 화학제품을 생산하는 과정에서 온실가스를 배출하기 때문에 지구온난화 등 글로벌 기후변화를 유발하고 있다. 이에 세계는 친환경적 방법으로 화학제품을 생산하기 위해 미생물을 활용한 화학물질 생산기술 개발에 주력하고 있다.
미생물과 같은 바이오매스 원료에 생물공학적 또는 화학적 기술을 적용해 화학원료·연료 등 화학제품을 생산하는 공정을 ‘바이오 리파이너리(Bio-Refinery)’라 한다.
바이오 리파이너리의 생물공학적 방법 중 ‘시스템 대사공학’만을 100% 적용해 화학물질을 생산하는 사례가 점차 늘고 있지만, 생물공학적 방법과 화학반응의 통합공정이나 화학공정만을 활용하는 것이 더욱 효율적인 경우도 많다.
이번에 구축한 ‘바이오 기반 화학물질 합성 지도’는 화학물질 생산을 위한 생물공학적·화학적 반응 전체에 대해 최적의 합성 경로를 구축한 것으로, 앞으로 바이오 기반 화학제품 생산 연구에 귀중한 기초자료로 활용될 수 있을 것으로 보인다.
특히 중요성을 인정받아 네이처 카탈리시스는 ‘바이오 기반 화학물질 합성 지도’를 포스터로 제작해 관련 분야의 산업계, 연구계에서 활용할 수 있도록 전 세계에 배포할 계획이다.
이상엽 특훈교수는 “이번에 개발한 지도는 앞으로 시스템 대사공학이 나아가야 할 방향과 아이디어의 청사진을 제시해 준다는 점에서 의미가 있다”라며, “이는 향후 친환경 화학은 물론 의료·식품·화장품 분야 등 다양한 산업에 매우 유용하게 활용될 수 있을 것이다.”라고 밝혔다.
이번 연구는 과기정통부 ‘기후변화대응기술개발사업’의 ‘바이오 리파이너리를 위한 시스템대사공학 원천기술개발’ 과제 지원을 받아 수행됐다.
□ 그림 설명
그림1. 바이오 기반 화학물질 합성 지도
그림2. 네이처 카탈리시스 표지논문 디자인
2019.01.15 조회수 18979 -
 조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14 조회수 20654
조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14 조회수 20654 -
 이상엽 교수, 미생물 발효한 친환경 기술로 햄(haem) 생산 기술 개발
〈 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 대장균을 발효시켜 바이오매스로부터 헴(haem)을 생산하고 세포 밖으로 분비할 수 있는 기술을 개발했다.
이는 대사공학 전략을 통해 헴의 생산량을 대폭 높이고 생산된 헴을 효과적으로 세포 바깥에 분비하는 데 성공한 친환경적, 효율적 원천기술로 생산한 헴을 이용해 각종 산업의 확장에 기여할 수 있을 것으로 기대된다.
자오신루이, 최경록 연구원이 참여한 이번 연구는 국제 학술지 ‘네이처 카탈리시스(Nature Catalysis)’ 8월 28일자 온라인 판에 게재됐다.
헴은 생명 유지에 필수적인 철분으로 혈액에서 산소를 운반하는 헤모글로빈이나 세포 호흡에 필수적인 사이토크롬을 비롯한 여러 중요한 단백질 기능에 핵심적 역할을 한다. 특히 인체 흡수율이 높기 때문에 고급 철분제나 약물로 이용된다.
무분별한 가축의 사육이 여러 사회 이슈를 불러일으키는 상황에서 최근 헴이 고기 맛을 내는 핵심 요소로 밝혀지며 콩고기에 미생물이나 식물에서 추출한 헴을 넣어 맛과 영양, 환경 등을 고려한 콩고기 조리법이 주목받기도 했다.
그러나 기존의 헴 생산 방식은 유기 용매를 이용한 동물의 혈액과 일부 식물 조직으로부터의 추출에 의존하고 있기 때문에 비효율적일 뿐 아니라 친환경적이지 않다는 한계가 있다.
대장균을 이용한 헴 생산 기술이 개발된 바 있지만 생산량이 수 밀리그램(mg)에 그치고 생산된 헴이 세포 내에 축적되기 때문에 헴 추출 등의 문제를 해결하지 못했다. 따라서 고농도로 헴을 생산하면서도 세포 바깥으로 헴을 분비해 정제를 용이하게 하는 친환경 생산 시스템 개발이 필요했다.
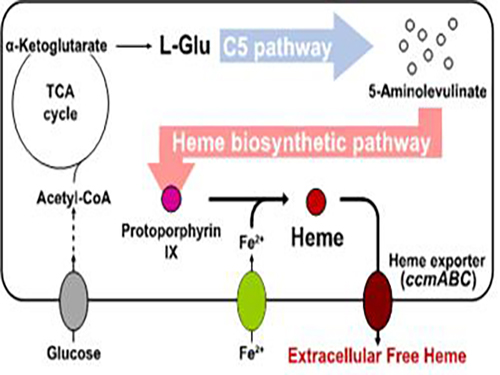
연구팀은 바이오매스를 이용한 고효율 헴 생산 미생물을 제작하기 위해 대장균 고유의 헴 생합성 회로를 구성했다. 또한 기존에 사용되지 않았던 C5 대사회로를 사용해 헴 생산의 전구체인 5-아미노레불린산을 생합성했다.
이를 통해 원가가 비싸고 세포 독성을 일으키는 물질인 글리신을 사용하지 않고도 헴 생산량을 대폭 높였다. 이 과정에서 연구팀은 헴 생산량이 향상됨에 따라 생산된 헴이 상당 비율로 세포 바깥으로 분비되는 것을 발견했다.
연구팀은 구성한 대장균의 헴 분비량을 더욱 높이기 위해 사이토크롬 생합성에 관여한다고 알려진 단백질인 헴 엑스포터를 과발현함으로써 헴 생산량과 세포외 분비량 모두가 향상된 헴 분비생산 균주를 개발했다. 이를 통해 헴 엑스포터와 헴의 세포외 분비 사이의 연관성을 밝혔다.
이번 연구를 통해 개발된 기술을 활용하면 환경, 위생, 윤리적 문제없이 재생 가능한 자원을 통해 헴 생산을 할 수 있다. 향후 의료 및 식품 산업 등 헴을 이용하는 다양한 분야에 중요한 역할을 할 것으로 예상된다.
이 특훈교수는 “건강 보조제, 의약품, 식품 첨가물 등 다양한 활용이 가능한 헴을 미생물발효를 통해 고효율로 생산했다”며 “생산된 헴의 3분의 2 가량을 세포 바깥으로 분비하는 시스템을 개발함으로써 산업적 활용을 위한 헴의 생산 및 정제를 용이하게 했다는 의의를 갖는다”고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 ‘바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제’ 지원을 받아 수행됐다.
□ 그림 설명
그림1. 대장균을 이용한 헴 생산 및 세포외 분비 전체 개념도
2018.09.06 조회수 18704
이상엽 교수, 미생물 발효한 친환경 기술로 햄(haem) 생산 기술 개발
〈 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 대장균을 발효시켜 바이오매스로부터 헴(haem)을 생산하고 세포 밖으로 분비할 수 있는 기술을 개발했다.
이는 대사공학 전략을 통해 헴의 생산량을 대폭 높이고 생산된 헴을 효과적으로 세포 바깥에 분비하는 데 성공한 친환경적, 효율적 원천기술로 생산한 헴을 이용해 각종 산업의 확장에 기여할 수 있을 것으로 기대된다.
자오신루이, 최경록 연구원이 참여한 이번 연구는 국제 학술지 ‘네이처 카탈리시스(Nature Catalysis)’ 8월 28일자 온라인 판에 게재됐다.
헴은 생명 유지에 필수적인 철분으로 혈액에서 산소를 운반하는 헤모글로빈이나 세포 호흡에 필수적인 사이토크롬을 비롯한 여러 중요한 단백질 기능에 핵심적 역할을 한다. 특히 인체 흡수율이 높기 때문에 고급 철분제나 약물로 이용된다.
무분별한 가축의 사육이 여러 사회 이슈를 불러일으키는 상황에서 최근 헴이 고기 맛을 내는 핵심 요소로 밝혀지며 콩고기에 미생물이나 식물에서 추출한 헴을 넣어 맛과 영양, 환경 등을 고려한 콩고기 조리법이 주목받기도 했다.
그러나 기존의 헴 생산 방식은 유기 용매를 이용한 동물의 혈액과 일부 식물 조직으로부터의 추출에 의존하고 있기 때문에 비효율적일 뿐 아니라 친환경적이지 않다는 한계가 있다.
대장균을 이용한 헴 생산 기술이 개발된 바 있지만 생산량이 수 밀리그램(mg)에 그치고 생산된 헴이 세포 내에 축적되기 때문에 헴 추출 등의 문제를 해결하지 못했다. 따라서 고농도로 헴을 생산하면서도 세포 바깥으로 헴을 분비해 정제를 용이하게 하는 친환경 생산 시스템 개발이 필요했다.
연구팀은 바이오매스를 이용한 고효율 헴 생산 미생물을 제작하기 위해 대장균 고유의 헴 생합성 회로를 구성했다. 또한 기존에 사용되지 않았던 C5 대사회로를 사용해 헴 생산의 전구체인 5-아미노레불린산을 생합성했다.
이를 통해 원가가 비싸고 세포 독성을 일으키는 물질인 글리신을 사용하지 않고도 헴 생산량을 대폭 높였다. 이 과정에서 연구팀은 헴 생산량이 향상됨에 따라 생산된 헴이 상당 비율로 세포 바깥으로 분비되는 것을 발견했다.
연구팀은 구성한 대장균의 헴 분비량을 더욱 높이기 위해 사이토크롬 생합성에 관여한다고 알려진 단백질인 헴 엑스포터를 과발현함으로써 헴 생산량과 세포외 분비량 모두가 향상된 헴 분비생산 균주를 개발했다. 이를 통해 헴 엑스포터와 헴의 세포외 분비 사이의 연관성을 밝혔다.
이번 연구를 통해 개발된 기술을 활용하면 환경, 위생, 윤리적 문제없이 재생 가능한 자원을 통해 헴 생산을 할 수 있다. 향후 의료 및 식품 산업 등 헴을 이용하는 다양한 분야에 중요한 역할을 할 것으로 예상된다.
이 특훈교수는 “건강 보조제, 의약품, 식품 첨가물 등 다양한 활용이 가능한 헴을 미생물발효를 통해 고효율로 생산했다”며 “생산된 헴의 3분의 2 가량을 세포 바깥으로 분비하는 시스템을 개발함으로써 산업적 활용을 위한 헴의 생산 및 정제를 용이하게 했다는 의의를 갖는다”고 말했다.
이번 연구는 과학기술정보통신부가 지원하는 기후변화대응기술개발사업의 ‘바이오리파이너리를 위한 시스템대사공학 원천기술개발 과제’ 지원을 받아 수행됐다.
□ 그림 설명
그림1. 대장균을 이용한 헴 생산 및 세포외 분비 전체 개념도
2018.09.06 조회수 18704 -
 김필한 교수 교원창업기업, 3차원 생체현미경 IVM-CM 출시
〈김필한 교수, 아이빔테크놀로지 김인선 CEO〉
우리 대학 나노과학기술대학원/의과학대학원 김필한 교수 연구팀이 소속된 교원창업기업 아이빔테크놀로지(IVIM Technology, Inc)가 3차원 올인원 생체 현미경 ‘IVM-CM’과 ‘IVM-C’를 개발했다.
이는 김필한 교수 연구팀의 혁신적 생체현미경(IntraVital Microscopy, IVM) 원천기술을 토대로 개발한 것으로 미래 글로벌 바이오헬스 시장에 활용될 예정이다.
세계적 현미경 제조사들의 기술을 넘어 혁신적 원천 기술을 기반으로 개발된 ‘IVM-C’와 ‘IVM-CM’은 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
생체현미경은 바이오제약 분야에서 크게 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
인체는 수없이 많은 세포들이 복잡한 상호작용을 통해 동작한다. 그러나 현재 신약개발 전임상 단계에서는 시험관 내(in-vitro)와 생체 외(ex-vivo) 실험처럼 상호작용이 일어나지 않는 방식의 연구가 주로 수행되고 있다.
이러한 실험 결과들로만 얻은 결과로 임상시험에 진입한다면 오류와 실패의 가능성이 높아진다. 따라서 신약개발을 위한 임상시험 전 마지막 단계에서 반드시 살아있는 동물에서의 생체 내(in-vivo) 실험으로 효능 분석이 진행돼야 한다.
생체현미경 기술은 바로 이 과정에서 살아있는 동물 내부의 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 고해상도 영상으로 직접 관찰할 수 있어 시험 결과의 오류, 시간, 비용을 현저히 줄일 수 있다.
기존 현미경 기술을 살아있는 생체에 적용하려면 영상획득 과정 동안 생체를 유지하기 위한 여러 추가적인 장비가 필요하다. 또한 영상 속도와 해상도의 한계로 인해 생체 내부의 세포를 직접 관찰하기 어려웠다.
아이빔테크놀로지의 ‘IVM-C’와 ‘IVM-CM’모델은 최초의 올인원 3차원 생체현미경 제품으로 살아있는 생체 내부조직을 구성하는 세포들을 고해상도로 직접 관찰할 수 있다.
기존 MRI나 CT 등으로 불가능했던 신체의 다양한 장기 내부에서 움직이는 세포들을 하나하나 구별해 관찰하는 것이 가능하다. 이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 ‘IVM-C’와 ‘IVM-CM’모델은 독보적인 초고속 레이저스캐닝 기술을 이용해 기존 기술수준을 크게 뛰어넘는 고해상도와 정밀도로 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화하는 것이 가능하다.
‘IVM-C’모델은 살아있는 생체 내부의 고해상도 공초점 영상을 총 4가지 색으로 동시에 획득할 수 있으며, ‘IVM-CM’모델은 공초점 영상과 더불어 고속펄스레이저를 이용한 다중광자 영상까지 획득할 수 있다.
최고기술책임자(CTO) 김필한 교수는 “‘IVM-C’와 ‘IVM-CM’은 세포치료제, 면역치료제, 신약 및 선도물질 효능 분석 시 다양한 세포들이 존재하는 생체 내 환경에서 단일 세포 단위의 정밀한 효능 분석이 가능한 유일한 장비로 생명 현상을 보다 정밀하게 종합 분석하기 위한 혁신적 원천 기술로 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술 발전을 가속화할 핵심 기술이 될 것이다”고 말했다.
아이빔테크놀로지는 시장성과 성장 가능성을 높게 평가받아 창업 후 3개월 만인 작년 9월 30억 원의 투자 유치를 달성한 바 있다.
대표이사는 김인선 전 제넥신 경영지원본부장, 최고기술책임자는 김필한 교수, 영업 및 마케팅 총괄은 독일 광학 기업인 칼자이스에서 14년간 경험을 쌓은 박수진 이사가 맡고 있다.
또한 우리 대학 박사 출신들로 구성된 기술개발팀과 연구서비스팀이 차세대 후속 장비 개발과 글로벌 바이오헬스 시장 활성화를 위해 노력하고 있다.
김필한 교수 연구팀은 창업원 엔드-런(End-Run) 사업화도약과제에 참여했으며, 아이빔테크놀로지는 창업원의 지원을 받아 설립됐다.
□ 사진 설명
사진1. IVM-CM 장비사진
사진2. IVM-CM 생체영상결과 사진
사진3. IVM-CM 생체 내부 세포 추적 사진
2018.09.05 조회수 15331
김필한 교수 교원창업기업, 3차원 생체현미경 IVM-CM 출시
〈김필한 교수, 아이빔테크놀로지 김인선 CEO〉
우리 대학 나노과학기술대학원/의과학대학원 김필한 교수 연구팀이 소속된 교원창업기업 아이빔테크놀로지(IVIM Technology, Inc)가 3차원 올인원 생체 현미경 ‘IVM-CM’과 ‘IVM-C’를 개발했다.
이는 김필한 교수 연구팀의 혁신적 생체현미경(IntraVital Microscopy, IVM) 원천기술을 토대로 개발한 것으로 미래 글로벌 바이오헬스 시장에 활용될 예정이다.
세계적 현미경 제조사들의 기술을 넘어 혁신적 원천 기술을 기반으로 개발된 ‘IVM-C’와 ‘IVM-CM’은 여러 인간 질환의 복잡한 발생 과정을 밝히기 위한 기초 의․생명 연구의 차세대 첨단 영상장비가 될 것으로 기대된다.
생체현미경은 바이오제약 분야에서 크게 주목받고 있다. 최근 바이오제약 산업은 단순 합성약물개발보다 생체의 미세 구성단위인 세포 수준에서 복합적으로 작용하는 면역치료제, 세포치료제, 유전자치료제, 항체치료제 등 새로운 개념의 바이오의약품 개발에 집중하고 있기 때문이다.
인체는 수없이 많은 세포들이 복잡한 상호작용을 통해 동작한다. 그러나 현재 신약개발 전임상 단계에서는 시험관 내(in-vitro)와 생체 외(ex-vivo) 실험처럼 상호작용이 일어나지 않는 방식의 연구가 주로 수행되고 있다.
이러한 실험 결과들로만 얻은 결과로 임상시험에 진입한다면 오류와 실패의 가능성이 높아진다. 따라서 신약개발을 위한 임상시험 전 마지막 단계에서 반드시 살아있는 동물에서의 생체 내(in-vivo) 실험으로 효능 분석이 진행돼야 한다.
생체현미경 기술은 바로 이 과정에서 살아있는 동물 내부의 목표로 하는 세포, 단백질과 주입된 물질의 움직임을 동시에 3차원 고해상도 영상으로 직접 관찰할 수 있어 시험 결과의 오류, 시간, 비용을 현저히 줄일 수 있다.
기존 현미경 기술을 살아있는 생체에 적용하려면 영상획득 과정 동안 생체를 유지하기 위한 여러 추가적인 장비가 필요하다. 또한 영상 속도와 해상도의 한계로 인해 생체 내부의 세포를 직접 관찰하기 어려웠다.
아이빔테크놀로지의 ‘IVM-C’와 ‘IVM-CM’모델은 최초의 올인원 3차원 생체현미경 제품으로 살아있는 생체 내부조직을 구성하는 세포들을 고해상도로 직접 관찰할 수 있다.
기존 MRI나 CT 등으로 불가능했던 신체의 다양한 장기 내부에서 움직이는 세포들을 하나하나 구별해 관찰하는 것이 가능하다. 이를 통해 다양한 질병이 몸속에서 발생하는 과정에 대해 자세한 세포단위 영상 정보를 제공할 수 있다.
특히 ‘IVM-C’와 ‘IVM-CM’모델은 독보적인 초고속 레이저스캐닝 기술을 이용해 기존 기술수준을 크게 뛰어넘는 고해상도와 정밀도로 살아있는 생체 내부의 다양한 세포 및 주변 미세 환경과 단백질 등의 분자를 동시에 영상화하는 것이 가능하다.
‘IVM-C’모델은 살아있는 생체 내부의 고해상도 공초점 영상을 총 4가지 색으로 동시에 획득할 수 있으며, ‘IVM-CM’모델은 공초점 영상과 더불어 고속펄스레이저를 이용한 다중광자 영상까지 획득할 수 있다.
최고기술책임자(CTO) 김필한 교수는 “‘IVM-C’와 ‘IVM-CM’은 세포치료제, 면역치료제, 신약 및 선도물질 효능 분석 시 다양한 세포들이 존재하는 생체 내 환경에서 단일 세포 단위의 정밀한 효능 분석이 가능한 유일한 장비로 생명 현상을 보다 정밀하게 종합 분석하기 위한 혁신적 원천 기술로 급성장할 글로벌 바이오헬스 시장을 개척할 수 있는 차세대 의료, 의약 기술 발전을 가속화할 핵심 기술이 될 것이다”고 말했다.
아이빔테크놀로지는 시장성과 성장 가능성을 높게 평가받아 창업 후 3개월 만인 작년 9월 30억 원의 투자 유치를 달성한 바 있다.
대표이사는 김인선 전 제넥신 경영지원본부장, 최고기술책임자는 김필한 교수, 영업 및 마케팅 총괄은 독일 광학 기업인 칼자이스에서 14년간 경험을 쌓은 박수진 이사가 맡고 있다.
또한 우리 대학 박사 출신들로 구성된 기술개발팀과 연구서비스팀이 차세대 후속 장비 개발과 글로벌 바이오헬스 시장 활성화를 위해 노력하고 있다.
김필한 교수 연구팀은 창업원 엔드-런(End-Run) 사업화도약과제에 참여했으며, 아이빔테크놀로지는 창업원의 지원을 받아 설립됐다.
□ 사진 설명
사진1. IVM-CM 장비사진
사진2. IVM-CM 생체영상결과 사진
사진3. IVM-CM 생체 내부 세포 추적 사진
2018.09.05 조회수 15331 -
 김준 교수, 난치성 유전질환인 섬모병증 치료제 후보 발굴
〈 김준 교수, 김용준 박사과정 〉
우리 대학 의과학대학원 김준 교수가 연세대학교 생명공학과 권호정 교수 연구팀과의 공동 연구를 통해 난치성 유전질환인 섬모병증의 치료제 후보를 개발했다.
이번 연구 결과는 섬모병증 치료제 개발을 위한 기반이 될 것으로 기대되며 유사한 난치성 유전질환에 대한 저분자 화합물 약물 개발 플랫폼으로도 활용 가능할 것으로 예상된다.
김용준 박사과정이 1저자로 참여하고 정인지, 김성수, 정유주 연구원이 공동 저자로 참여한 이번 연구는 의, 과학 분야 국제 학술지 ‘저널 오브 클리니컬 인베스티게이션(Journal of Clinical Investigation)’ 7월 23일자 온라인 판에 게재됐다.(논문명 Eupatilin rescues ciliary transition zone defects to ameliorate ciliopathy-related phenotypes)
세포 소기관인 일차섬모는 배아가 발생하는 과정에서 세포 간 신호전달에 관여하고 망막 광수용체 세포가 기능하는 역할을 하는 등 인체에 중요한 기관이다.
섬모병증은 이러한 섬모의 형성에 필수적인 유전자들의 돌연변이로 인해 발생되며 소뇌발달 및 신장 이상, 망막 퇴행 등의 증상을 보인다.
현재 섬모병증을 치료하는 약물은 개발되지 않았다. 섬모병증 뿐 아니라 기능손실 유전자 돌연변이가 원인이 되는 대부분의 희귀유전질환은 유전자 치료를 제외하고는 치료 약물의 개발이 이뤄지지 않았다.
연구팀은 문제 해결을 위해 섬모병증 원인의 하나인 CEP290 유전자 돌연변이를 유전자 편집기법으로 모사한 세포를 구축한 뒤 화합물 라이브러리 스크리닝 기법을 통해 섬모병증에서 나타나는 섬모형성 부진 현상을 극복할 수 있는 천연 저분자 화합물을 발굴했다.
발굴된 화합물은 CEP290 단백질과 복합체를 이뤄 섬모형성과 기능에 관여하는 단백질(NPHP5)에 작용하는 것으로 밝혀졌다. CEP290 단백질이 유전자 돌연변이로 인해 만들어지지 않는 경우 NPHP5 단백질도 정상적으로 작용하지 못하는데 이 화합물은 NPHP5의 기능을 정상화시켜 복합체가 담당하던 기능의 일부를 회복함을 확인했다.
또한 연구팀은 발굴한 화합물을 섬모병증 증상을 갖는 동물 모델에 주입했고 망막 퇴행 현상을 지연시키는 효과를 입증했다.
1저자인 김용준 박사과정은 “이번 연구는 기능손실 유전자 돌연변이로 인해 발생하는 유전질환도 저분자 화합물 약물로 치료가 가능함을 규명했다는 의미를 갖는다”고 말했다.
김준 교수는 “발굴된 후보약물의 효과를 동물실험을 통해 확인했기 때문에 인체에서의 효과 또한 증명하는 후속 연구를 진행할 예정이다”고 말했다.
이번 연구는 보건복지부 희귀질환연구센터지원사업, 한국연구재단 바이오의료기술개발사업, 글로벌연구실 사업의 지원으로 수행됐다.
□ 그림 설명
그림1.섬모형성 이상을 회복시키는 약물 발굴
그림2. 발굴된 약물에 의해 섬모병증 모델 생쥐의 망막퇴행이 지연되는 효과 확인
2018.07.30 조회수 15474
김준 교수, 난치성 유전질환인 섬모병증 치료제 후보 발굴
〈 김준 교수, 김용준 박사과정 〉
우리 대학 의과학대학원 김준 교수가 연세대학교 생명공학과 권호정 교수 연구팀과의 공동 연구를 통해 난치성 유전질환인 섬모병증의 치료제 후보를 개발했다.
이번 연구 결과는 섬모병증 치료제 개발을 위한 기반이 될 것으로 기대되며 유사한 난치성 유전질환에 대한 저분자 화합물 약물 개발 플랫폼으로도 활용 가능할 것으로 예상된다.
김용준 박사과정이 1저자로 참여하고 정인지, 김성수, 정유주 연구원이 공동 저자로 참여한 이번 연구는 의, 과학 분야 국제 학술지 ‘저널 오브 클리니컬 인베스티게이션(Journal of Clinical Investigation)’ 7월 23일자 온라인 판에 게재됐다.(논문명 Eupatilin rescues ciliary transition zone defects to ameliorate ciliopathy-related phenotypes)
세포 소기관인 일차섬모는 배아가 발생하는 과정에서 세포 간 신호전달에 관여하고 망막 광수용체 세포가 기능하는 역할을 하는 등 인체에 중요한 기관이다.
섬모병증은 이러한 섬모의 형성에 필수적인 유전자들의 돌연변이로 인해 발생되며 소뇌발달 및 신장 이상, 망막 퇴행 등의 증상을 보인다.
현재 섬모병증을 치료하는 약물은 개발되지 않았다. 섬모병증 뿐 아니라 기능손실 유전자 돌연변이가 원인이 되는 대부분의 희귀유전질환은 유전자 치료를 제외하고는 치료 약물의 개발이 이뤄지지 않았다.
연구팀은 문제 해결을 위해 섬모병증 원인의 하나인 CEP290 유전자 돌연변이를 유전자 편집기법으로 모사한 세포를 구축한 뒤 화합물 라이브러리 스크리닝 기법을 통해 섬모병증에서 나타나는 섬모형성 부진 현상을 극복할 수 있는 천연 저분자 화합물을 발굴했다.
발굴된 화합물은 CEP290 단백질과 복합체를 이뤄 섬모형성과 기능에 관여하는 단백질(NPHP5)에 작용하는 것으로 밝혀졌다. CEP290 단백질이 유전자 돌연변이로 인해 만들어지지 않는 경우 NPHP5 단백질도 정상적으로 작용하지 못하는데 이 화합물은 NPHP5의 기능을 정상화시켜 복합체가 담당하던 기능의 일부를 회복함을 확인했다.
또한 연구팀은 발굴한 화합물을 섬모병증 증상을 갖는 동물 모델에 주입했고 망막 퇴행 현상을 지연시키는 효과를 입증했다.
1저자인 김용준 박사과정은 “이번 연구는 기능손실 유전자 돌연변이로 인해 발생하는 유전질환도 저분자 화합물 약물로 치료가 가능함을 규명했다는 의미를 갖는다”고 말했다.
김준 교수는 “발굴된 후보약물의 효과를 동물실험을 통해 확인했기 때문에 인체에서의 효과 또한 증명하는 후속 연구를 진행할 예정이다”고 말했다.
이번 연구는 보건복지부 희귀질환연구센터지원사업, 한국연구재단 바이오의료기술개발사업, 글로벌연구실 사업의 지원으로 수행됐다.
□ 그림 설명
그림1.섬모형성 이상을 회복시키는 약물 발굴
그림2. 발굴된 약물에 의해 섬모병증 모델 생쥐의 망막퇴행이 지연되는 효과 확인
2018.07.30 조회수 15474 -
 전상용 교수, 건선,아토피 치료용 펩타이드 개발
우리 대학 생명과학과 전상용 교수 연구팀이 피부 전달을 통해 건선을 치료할 수 있는 펩타이드 치료제를 개발했다.
연구팀은 수 년 전 발견한 펩타이드를 나노입자로 제작해 피부를 통해 전달함으로써 동물 모델에서 건선을 치료하는 데 성공했다.
김진용 박사가 1저자로 참여한 이번 연구는 나노분야 국제 학술지 ‘에이시에스 나노(ACS Nano)’ 6월 27일자 온라인 판에 게재됐다.(논문명 :Nanoparticle-Assisted Transcutaneous Delivery of a Signal Transducer and Activator of Transcription 3-Inhibiting Peptide Ameliorates Psoriasis-like Skin Inflammation)
건선은 대표적인 만성 염증성 피부질환으로 전 세계 성인의 약 3%가 앓고 있는 자가 면역질환 중 하나이다. 최근 건선의 원인에 STAT3라는 단백질이 핵심 역할을 한다는 사실이 밝혀졌다.
연구팀은 수 년 전 STAT3라는 단백질의 기능을 저하시킬 수 있는 펩타이드를 최초로 발견해 항암 치료제로 개발한 바 있다. 그러나 건선 피부는 각질층이 매우 두껍기 때문에 피부를 통해 펩타이드를 투과시켜 표적 약물 치료를 하는 데에는 기술적인 한계가 존재했다.
연구팀은 이번 연구에서 길이가 서로 다른 두 개의 인지질과 STAT3 억제 펩타이드가 특정 조건에서 약 30나노미터 크기의 매우 작은 원반 모양의 나노입자를 안정적으로 형성함을 발견했다.
연구팀은 특수 지질성분으로 이뤄진 제형(劑形)을 통해 수십 나노미터 크기의 원판형 나노입자로 이뤄진 STAT3 억제용 펩타이드를 제조했다.
연구팀이 개발한 STAT3 억제 펩타이드는 건선 피부를 가진 동물 모델에 투여했을 때 뛰어난 항염증 효과를 보였고, 건선 발병의 핵심 요소인 각질세포의 과증식과 염증성 싸이토카인인 IL-17 등의 분비를 막는 역할을 했다.
연구팀은 의과학대학원 김필한 교수와의 공동 연구를 통해 펩타이드가 피부 속으로 얼마나 깊이 투과되는지 관찰했고, 이를 통해 나노입자가 각질층을 통과해 진피층 상부까지 전달됨을 확인했다.
전상용 교수는 “STAT3 억제 앱타이드가 난치성 염증성 피부질환인 건선에 대해 우수한 치료 효과를 보이는 바이오 신약 후보물질이 될 수 있음을 확인했다.”며 “효율적인 피부 전달이 가능한 시스템을 구축했다는 점에서 큰 의미가 있으며 향후 임상 적용이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 글로벌연구실사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 앱타이드-지질 나노복합체의 건선 유발 생쥐 귀 모델에서의 치료효능 평가
그림2. 앱타이드-지질 나노복합체의 건선 유발 생쥐모델에서의 피부투과 효능 평가
2018.07.17 조회수 18973
전상용 교수, 건선,아토피 치료용 펩타이드 개발
우리 대학 생명과학과 전상용 교수 연구팀이 피부 전달을 통해 건선을 치료할 수 있는 펩타이드 치료제를 개발했다.
연구팀은 수 년 전 발견한 펩타이드를 나노입자로 제작해 피부를 통해 전달함으로써 동물 모델에서 건선을 치료하는 데 성공했다.
김진용 박사가 1저자로 참여한 이번 연구는 나노분야 국제 학술지 ‘에이시에스 나노(ACS Nano)’ 6월 27일자 온라인 판에 게재됐다.(논문명 :Nanoparticle-Assisted Transcutaneous Delivery of a Signal Transducer and Activator of Transcription 3-Inhibiting Peptide Ameliorates Psoriasis-like Skin Inflammation)
건선은 대표적인 만성 염증성 피부질환으로 전 세계 성인의 약 3%가 앓고 있는 자가 면역질환 중 하나이다. 최근 건선의 원인에 STAT3라는 단백질이 핵심 역할을 한다는 사실이 밝혀졌다.
연구팀은 수 년 전 STAT3라는 단백질의 기능을 저하시킬 수 있는 펩타이드를 최초로 발견해 항암 치료제로 개발한 바 있다. 그러나 건선 피부는 각질층이 매우 두껍기 때문에 피부를 통해 펩타이드를 투과시켜 표적 약물 치료를 하는 데에는 기술적인 한계가 존재했다.
연구팀은 이번 연구에서 길이가 서로 다른 두 개의 인지질과 STAT3 억제 펩타이드가 특정 조건에서 약 30나노미터 크기의 매우 작은 원반 모양의 나노입자를 안정적으로 형성함을 발견했다.
연구팀은 특수 지질성분으로 이뤄진 제형(劑形)을 통해 수십 나노미터 크기의 원판형 나노입자로 이뤄진 STAT3 억제용 펩타이드를 제조했다.
연구팀이 개발한 STAT3 억제 펩타이드는 건선 피부를 가진 동물 모델에 투여했을 때 뛰어난 항염증 효과를 보였고, 건선 발병의 핵심 요소인 각질세포의 과증식과 염증성 싸이토카인인 IL-17 등의 분비를 막는 역할을 했다.
연구팀은 의과학대학원 김필한 교수와의 공동 연구를 통해 펩타이드가 피부 속으로 얼마나 깊이 투과되는지 관찰했고, 이를 통해 나노입자가 각질층을 통과해 진피층 상부까지 전달됨을 확인했다.
전상용 교수는 “STAT3 억제 앱타이드가 난치성 염증성 피부질환인 건선에 대해 우수한 치료 효과를 보이는 바이오 신약 후보물질이 될 수 있음을 확인했다.”며 “효율적인 피부 전달이 가능한 시스템을 구축했다는 점에서 큰 의미가 있으며 향후 임상 적용이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 글로벌연구실사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 앱타이드-지질 나노복합체의 건선 유발 생쥐 귀 모델에서의 치료효능 평가
그림2. 앱타이드-지질 나노복합체의 건선 유발 생쥐모델에서의 피부투과 효능 평가
2018.07.17 조회수 18973 -
 박범순 교수, 유전체 편집의 글로벌 관측소 설립 제안
〈 박 범 순 교수 〉
우리 대학 과학기술정책대학원 박범순 교수 연구팀의 유전체 편집 관련 ‘글로벌 관측소(Global Observatory)’ 설립 제안 논문이 국제학술지 셀의 자매지인 ‘트렌드 인 바이오테크놀로지(Trends in Biotechnology)’ 6월자 온라인 판에 게재됐다.
유전자가위 기술의 발전으로 인간 생식세포의 손쉬운 편집이 가능해지고 인류의 미래에 직접적인 영향을 줄 수 있다는 점에서 새로운 국제적 협치의 장에 대한 필요성이 커지고 있다.
이에 2015년 12월 영국 왕립학회, 중국 과학한림원, 미국 과학한림원의 공둥 주관으로 열린 ‘인간유전체 편집에 대한 국제 회의’에서 유전체 편집기술의 안전성과 효능의 검증, 기술의 적절성에 대한 폭넓은 사회적 합의 확보, 관련 규제 관리 마련 등에 대해 논의한 바 있다.
그러나 여전히 폭넓은 합의가 무엇을 의미하는지, 이를 어떻게 확보할 지에 대한 합의점은 명확하지 않았다.
박 교수 논문은 이 문제를 세 가지로 정리해 제시했다. ▲ 유전체 편집기술에 대한 국제적 논의에는 지정학적 의미에서 많은 국가의 관점이 적절히 고려돼야 하고 ▲ 기술의 적용이 사회를 지탱하는 규범과 법적 권리 및 의무와 깊이 연관돼 있기 때문에 기술의 미래에 대한 질문은 기술적, 윤리적 영역으로 쉽게 구분할 수 없고 ▲ 무엇이 중요한 이슈이고, 우선적으로 무엇을 다뤄야 하는가, 합의를 어떻게 이룰 것인가에 대한 논의가 이뤄져야 한다고 말했다.
이어 글로벌 관측소의 설립 목적과 목표가 소개됐다. 이 관측소는 인간 유전체편집기술에 대해 보다 포괄적이며 ‘코스모폴리탄 윤리’에 기반한 새로운 형태의 숙의의 장으로 제안됐다. 가장 주된 기능으로는 글로벌 인류 공동체 내의 다양한 관점들을 가시화하고 이를 통해 숙의과정에서 보다 확장된 질문들이 다루어질 수 있도록 하는 것이다.
글로벌 관측소는 ▲유전체편집에 대한 글로벌 수준의 윤리적, 정책적 반응들을 수집하고 가시화하는 작업 ▲‘합의’에 대한 개념적 발전, 긴장관계들, 그리고 합의가 필요한 영역들에 대한 실질적 분석을 제공하고 ▲기존의 논의에서 무시되었던 중요한 질문들, 목소리를 높일 수 없었던 행위자들에게 초점을 맞춰 주기적인 논의가 이루어지는 포럼으로서 역할을 수행하게 될 것이라고 설명했다.
박범순 교수는 “크리스퍼(CRISPR) 유전자 가위로 대표되는 유전체편집기술이 가져올 사회적, 법적, 윤리적, 종교적, 철학적 이슈를 각국의 경험을 바탕으로 논의하고 정보를 공유하기 위한 대화의 장을 마련하자는 취지에서 글로벌 관측소 설립을 제안했다”고 말했다.
2018.07.02 조회수 12006
박범순 교수, 유전체 편집의 글로벌 관측소 설립 제안
〈 박 범 순 교수 〉
우리 대학 과학기술정책대학원 박범순 교수 연구팀의 유전체 편집 관련 ‘글로벌 관측소(Global Observatory)’ 설립 제안 논문이 국제학술지 셀의 자매지인 ‘트렌드 인 바이오테크놀로지(Trends in Biotechnology)’ 6월자 온라인 판에 게재됐다.
유전자가위 기술의 발전으로 인간 생식세포의 손쉬운 편집이 가능해지고 인류의 미래에 직접적인 영향을 줄 수 있다는 점에서 새로운 국제적 협치의 장에 대한 필요성이 커지고 있다.
이에 2015년 12월 영국 왕립학회, 중국 과학한림원, 미국 과학한림원의 공둥 주관으로 열린 ‘인간유전체 편집에 대한 국제 회의’에서 유전체 편집기술의 안전성과 효능의 검증, 기술의 적절성에 대한 폭넓은 사회적 합의 확보, 관련 규제 관리 마련 등에 대해 논의한 바 있다.
그러나 여전히 폭넓은 합의가 무엇을 의미하는지, 이를 어떻게 확보할 지에 대한 합의점은 명확하지 않았다.
박 교수 논문은 이 문제를 세 가지로 정리해 제시했다. ▲ 유전체 편집기술에 대한 국제적 논의에는 지정학적 의미에서 많은 국가의 관점이 적절히 고려돼야 하고 ▲ 기술의 적용이 사회를 지탱하는 규범과 법적 권리 및 의무와 깊이 연관돼 있기 때문에 기술의 미래에 대한 질문은 기술적, 윤리적 영역으로 쉽게 구분할 수 없고 ▲ 무엇이 중요한 이슈이고, 우선적으로 무엇을 다뤄야 하는가, 합의를 어떻게 이룰 것인가에 대한 논의가 이뤄져야 한다고 말했다.
이어 글로벌 관측소의 설립 목적과 목표가 소개됐다. 이 관측소는 인간 유전체편집기술에 대해 보다 포괄적이며 ‘코스모폴리탄 윤리’에 기반한 새로운 형태의 숙의의 장으로 제안됐다. 가장 주된 기능으로는 글로벌 인류 공동체 내의 다양한 관점들을 가시화하고 이를 통해 숙의과정에서 보다 확장된 질문들이 다루어질 수 있도록 하는 것이다.
글로벌 관측소는 ▲유전체편집에 대한 글로벌 수준의 윤리적, 정책적 반응들을 수집하고 가시화하는 작업 ▲‘합의’에 대한 개념적 발전, 긴장관계들, 그리고 합의가 필요한 영역들에 대한 실질적 분석을 제공하고 ▲기존의 논의에서 무시되었던 중요한 질문들, 목소리를 높일 수 없었던 행위자들에게 초점을 맞춰 주기적인 논의가 이루어지는 포럼으로서 역할을 수행하게 될 것이라고 설명했다.
박범순 교수는 “크리스퍼(CRISPR) 유전자 가위로 대표되는 유전체편집기술이 가져올 사회적, 법적, 윤리적, 종교적, 철학적 이슈를 각국의 경험을 바탕으로 논의하고 정보를 공유하기 위한 대화의 장을 마련하자는 취지에서 글로벌 관측소 설립을 제안했다”고 말했다.
2018.07.02 조회수 12006 -
 이상엽 특훈교수, 대장균 이용한 나노재료 생물학적 합성법 개발
〈 최 유 진 박사과정, 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 대장균을 이용해 다양한 나노재료를 생물학적으로 합성할 수 있는 기술을 개발했다.
이번 연구를 통해 기존의 물리, 화학적 방법으로 합성되지 않는 새로운 나노재료도 생물학적으로 합성할 수 있는 가능성을 제시했다.
중앙대학교 박태정 교수 팀과 공동으로 진행하고 우리 대학 최유진 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘미국 국립과학원 회보(PNAS)’ 5월 22일자 온라인 판에 게재됐다.
기존의 생물학적 나노재료는 주로 고온, 고압의 조건에서 합성되고 유독한 유기용매와 값비싼 촉매를 사용하기 때문에 환경오염과 높은 에너지 소모의 문제가 있었다.
대안으로 친환경적이고 경제적인 미생물을 활용한 생물 공학적 나노재료 합성법에 대한 연구가 진행되고 있다. 그러나 현재까지 보고된 합성기술은 나노재료의 종류가 다양하지 않고 결정질과 비결정질 나노재료의 합성 원리가 규명되지 않아 다양한 결정질의 나노재료를 만드는 데 어려움이 있다.
이 교수 연구팀은 유전자 재조합 대장균을 이용해 주기율표 기반의 35개 원소로 이뤄진 60가지의 다양한 나노재료를 친환경적으로 생물학적 합성하는 기술을 개발했다.
다양한 금속 이온과 결합할 수 있는 단백질인 메탈로싸이오닌(metallothionein)과 펩타이드인 파이로킬레틴(phytochelatin)을 합성하는 파이오킬레틴 합성효소(phytochelatin synthase)를 대장균 내에서 동시에 발현해 다양한 나노재료를 합성하는 데 성공했다.
연구팀은 각 원소별 푸베 다이어그램(pourbaix diagram)을 분석해 생물학적 나노재료의 합성 과정에서 열역학적 안정성을 갖는 화학종의 상태를 파악했다. 이를 기반으로 생물학적으로 합성 가능한 물질을 예측 및 생산하는 데 성공했다.
또한 용액의 pH를 조절해 기존 생물학적 합성 조건에서 합성이 불가능하거나 비결정질 나노재료로 합성되는 물질을 합성이 가능하게 만들었다.
연구팀의 이번 연구는 화학적 방법으로 합성하기 어렵거나 아직 보고되지 않은 다양한 나노소재의 종류를 확장시켰다는 의의를 갖는다.
이상엽 특훈교수는 “기존의 물리, 화학적인 공정을 통한 나노재료 합성이 아닌 박테리아를 대사공학적으로 개량한 뒤 생물 공학적 배양을 통해 원하는 나노입자를 쉽고 효율적으로 합성 가능한 기술이다”고 말했다.
또한 “생물공학적 방법으로 합성된 60개의 나노재료들은 나노입자, 나노막대, 나노 판상형 등의 모양을 가지며 향후 에너지, 의료, 환경 분야 등 다양한 산업적 응용이 가능하다”고 말했다.
이번 연구는 과학기술정보통신부 기후변화대응사업의 ‘바이오리파이너리를 위한 시스템대사공학 연구과제’의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 재조합 대장균을 이용한 다양한 나노재료들의 생물학적 합성 기술의 전체 모식도 및 이미지
2018.05.23 조회수 17582
이상엽 특훈교수, 대장균 이용한 나노재료 생물학적 합성법 개발
〈 최 유 진 박사과정, 이 상 엽 특훈교수 〉
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 대장균을 이용해 다양한 나노재료를 생물학적으로 합성할 수 있는 기술을 개발했다.
이번 연구를 통해 기존의 물리, 화학적 방법으로 합성되지 않는 새로운 나노재료도 생물학적으로 합성할 수 있는 가능성을 제시했다.
중앙대학교 박태정 교수 팀과 공동으로 진행하고 우리 대학 최유진 박사과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘미국 국립과학원 회보(PNAS)’ 5월 22일자 온라인 판에 게재됐다.
기존의 생물학적 나노재료는 주로 고온, 고압의 조건에서 합성되고 유독한 유기용매와 값비싼 촉매를 사용하기 때문에 환경오염과 높은 에너지 소모의 문제가 있었다.
대안으로 친환경적이고 경제적인 미생물을 활용한 생물 공학적 나노재료 합성법에 대한 연구가 진행되고 있다. 그러나 현재까지 보고된 합성기술은 나노재료의 종류가 다양하지 않고 결정질과 비결정질 나노재료의 합성 원리가 규명되지 않아 다양한 결정질의 나노재료를 만드는 데 어려움이 있다.
이 교수 연구팀은 유전자 재조합 대장균을 이용해 주기율표 기반의 35개 원소로 이뤄진 60가지의 다양한 나노재료를 친환경적으로 생물학적 합성하는 기술을 개발했다.
다양한 금속 이온과 결합할 수 있는 단백질인 메탈로싸이오닌(metallothionein)과 펩타이드인 파이로킬레틴(phytochelatin)을 합성하는 파이오킬레틴 합성효소(phytochelatin synthase)를 대장균 내에서 동시에 발현해 다양한 나노재료를 합성하는 데 성공했다.
연구팀은 각 원소별 푸베 다이어그램(pourbaix diagram)을 분석해 생물학적 나노재료의 합성 과정에서 열역학적 안정성을 갖는 화학종의 상태를 파악했다. 이를 기반으로 생물학적으로 합성 가능한 물질을 예측 및 생산하는 데 성공했다.
또한 용액의 pH를 조절해 기존 생물학적 합성 조건에서 합성이 불가능하거나 비결정질 나노재료로 합성되는 물질을 합성이 가능하게 만들었다.
연구팀의 이번 연구는 화학적 방법으로 합성하기 어렵거나 아직 보고되지 않은 다양한 나노소재의 종류를 확장시켰다는 의의를 갖는다.
이상엽 특훈교수는 “기존의 물리, 화학적인 공정을 통한 나노재료 합성이 아닌 박테리아를 대사공학적으로 개량한 뒤 생물 공학적 배양을 통해 원하는 나노입자를 쉽고 효율적으로 합성 가능한 기술이다”고 말했다.
또한 “생물공학적 방법으로 합성된 60개의 나노재료들은 나노입자, 나노막대, 나노 판상형 등의 모양을 가지며 향후 에너지, 의료, 환경 분야 등 다양한 산업적 응용이 가능하다”고 말했다.
이번 연구는 과학기술정보통신부 기후변화대응사업의 ‘바이오리파이너리를 위한 시스템대사공학 연구과제’의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 재조합 대장균을 이용한 다양한 나노재료들의 생물학적 합성 기술의 전체 모식도 및 이미지
2018.05.23 조회수 17582 -
 이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
2018.05.16 조회수 20726
이해신 교수, 와인성분 통해 심장에 정맥주사로 약물 전달 기술 개발
〈 이 해 신 교수 〉
우리 대학 화학과 이해신 교수 연구팀이 와인의 떫은맛을 내는 성분인 탄닌산(tannic acid)을 이용해 간단한 정맥주사만으로도 약물을 심장 조직에 전달할 수 있는 기술을 개발했다.
연구팀은 탄닌산을 단백질, 펩타이드 등의 약물과 혼합시켜 입자화 하는 방법을 통해 심장조직을 표적할 수 있음을 규명했다. 연구팀의 심장 질환의 효율적 치료를 위한 표적화 약물전달 기술은 단백질 기반의 다양한 신약에 적용 가능할 것으로 기대된다.
안전성평가연구소의 예측모델 연구센터 김기석 박사 연구팀과 공동으로 수행된 이번 연구는 네이처 자매지 ‘네이처 바이오메디컬 엔지니어링(Nature Biomedical Engineering)’ 4월 30일자 온라인 판에 게재됐다.
심장은 인체 내 가장 중요한 기관으로 분당 60~100회의 박동을 하는 동안 약 5리터의 혈액을 뇌를 포함한 전신에 공급하는 역할을 한다. 심장은 심근이라는 근육을 이용해 끊임없이 박동하는 운동성이 높은 기관이다.
심장 및 관련 혈관 질병을 심혈관계-순환계 질환이라고 하는데 이는 우리나라 사망 원인 2위를 차지한다. 고혈압, 당뇨, 고지혈증, 흡연, 비만 등 현대인의 불규칙한 식습관 및 생활습관으로 인해 나타날 수 있다. 대표적으로 심장으로 가는 관상동맥이나 미세한 혈류들이 좁아져 산소 및 영양분 공급이 원활하지 못해 발생하는 심근경색이 있다.
많은 연구자들이 심혈관계 질환 극복을 위한 화학약물요법이나 치료용 단백질 등을 개발하고 있다. 그러나 여전히 직접적인 수술, 카테터 및 스텐트 삽입 등에 의존하고 있으며 일반 정맥주사로 개발된 약물을 심장에 효율적으로 전달하는 기술은 개발되지 않았다.
심장의 강한 운동성으로 인해 정맥으로 주사된 약물이 순환하는 동안 심장으로의 전달 효율이 급격하게 저하되기 때문이다.
문제 해결을 위해 연구팀은 과일 껍질, 견과류, 카카오, 와인 등에 다량으로 존재하는 탄닌산이라는 물질을 이용했다. 탄닌산은 와인의 떫은맛을 내는 폴리페놀 분자의 일종으로 혀에 존재하는 점막 단백질과 결합해 떫은맛을 낸다고 알려져 있다.
연구팀은 탄닌산과 단백질 사이의 강한 분자 간 결합력을 이용해 치료용 단백질, 유전자 전달체인 바이러스 또는 기능성 펩타이드 약물 등을 간단하게 섞어주는 방법으로 입자화에 성공했다. 그리고 이를 주사했을 때 심장을 표적화할 수 있다는 사실을 발견했다.
탄닌산을 이용한 단백질 입자화 기술의 원리는 일종의 ‘분자 수준에서의 코팅’ 기술이다. 입자화된 단백질 복합체 표면에 코팅된 탄닌산이 심장의 기능을 유지하기 위해 밀집돼 있는 엘라스틴 및 콜라겐 단백질과 부가적으로 강한 상호작용을 하며 심장 조직에 부착된 상태로 오랜 시간 머무는 심장 표적화 기술이다.
이러한 탄닌산-단백질 복합체는 단백질만을 주사했을 때와 비교하면 5일 이상 장기적으로 혈관 내에서 순환됨을 확인했다.
이 교수 연구팀은 예전부터 탄닌산을 비롯한 접착성, 코팅성을 갖는 다양한 폴리페놀 재료를 응용해 의료용 생체 재료를 개발해 왔다. 실제로 심근경색 동물 모델에 탄닌산과 섬유아세포 증식인자를 섞어서 만든 약품을 주입하고 4주가 지난 뒤 심근경색이 일어난 크기가 감소했을 뿐 아니라 좌심실 압력 및 심박출량 등이 정상에 가깝게 호전되는 것을 확인했다.
이해신 교수는 “지금까지 심장질환 관련한 많은 약물들이 개발됐음에도 불구하고 상대적으로 약물을 심장에 효율적으로 전달하는 방법은 개발되지 않았다”며 “이번 기술은 기존 약물들을 새롭게 공식화해 개량신약으로 만들 수 있는 원천기술이다”고 말했다.
이번 연구는 연구재단 중견연구자 도약연구, 보건복지부 암정복프로그램, 산업통상자원부의 바이오산업핵심기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 탄닌산으로 제조한 단백질 복합체가 심장 조직에 전달되는 모식도
그림2. 바이러스 유전자 발현 효율 및 치료기능성을 보여주는 연구결과
2018.05.16 조회수 20726 -
 이상엽, 김현욱 교수, 약물 상호작용 예측기술 DeepDDI 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수 공동 연구팀이 약물-약물 및 약물-음식 간 상호작용을 정확하게 예측하기 위해 딥 러닝(deep learning)을 이용해 약물 상호작용 예측 방법론인 딥디디아이 (DeepDDI)를 개발했다.
김현욱 교수, 류재용 연구원이 공동 1저자로 참여한 이번 연구는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 4월 16일자 온라인판에 게재됐다.
기존의 약물 상호작용 예측 방법론은 약물-약물 간의 상호작용 가능성만을 예측할 뿐, 두 약물 간의 구체적인 약리작용에 대한 정보는 제공하지 못했다. 이러한 이유로 맞춤형 약물 처방, 식이요법 등 응용 연구에서 체계적인 근거를 제시하거나 가설을 세우는 데에 한계가 있었다.
연구팀은 딥 러닝(deep learning) 기술을 적용해 19만 2천 284개의 약물-약물 상호작용을 아우르는 86가지의 약물 상호작용을 92.4%의 정확도로 예측하는 시스템 딥디디아이 (DeepDDI)를 개발했다.
딥디디아이는 두 약물 A, B 간의 상호작용에 대한 예측 결과를 다음과 같이 사람이 읽을 수 있는 영문 문장으로 출력한다 : “The metabolism of Drug B can be decreased when combined with Drug A (약물 A를 약물 B와 함께 복용 시 약물 B의 약물 대사가 감소 될 수 있다)”
연구팀은 딥디디아이를 이용해 두 약물 복용 시 일어날 수 있는 유해반응의 원인, 보고된 인체 부작용을 최소화시킬 수 있는 대체 약물, 특정 약물의 약효를 떨어뜨릴 수 있는 음식 및 음식 성분, 지금껏 알려지지 않은 음식 성분의 활성 등을 예측했다.
이번 연구성과로 약물-약물 및 약물-음식 상호작용을 정확하게 예측할 수 있는 시스템을 활용하는 것이 가능해졌으며 이는 신약개발, 복합적 약의 처방, 투약시의 음식조절 등을 포함해 헬스케어, 정밀의료 산업 및 제약 산업에 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 “이번 연구결과는 4차 산업혁명 시대의 정밀의료를 선도할 수 있는 기반 기술을 개발한 것이다”며, “복합 투여되는 약물들의 부작용을 낮추고 환자 맞춤형 약물 처방과 식이요법 제안을 통한 효과적인 약물치료 전략을 수립할 수 있다. 특히 고령화 사회에서 건강한 삶을 유지하는데 필요한 약-음식 궁합에 대한 제안을 해 줄 수 있는 시스템으로 발전해 나갈 것이다”고 말했다.
이 연구성과는 과학기술정보통신부의 바이오리파이너리를 위한 시스템대사공학 연구사업, KAIST의 4차 산업혁명 인공지능 플래그십 이니셔티브 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 딥디디아이 (DeepDDI)의 모식도 및 예측된다양한 약물-음식성분의 상호작용들의 시각화
2018.04.18 조회수 21243
이상엽, 김현욱 교수, 약물 상호작용 예측기술 DeepDDI 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수 공동 연구팀이 약물-약물 및 약물-음식 간 상호작용을 정확하게 예측하기 위해 딥 러닝(deep learning)을 이용해 약물 상호작용 예측 방법론인 딥디디아이 (DeepDDI)를 개발했다.
김현욱 교수, 류재용 연구원이 공동 1저자로 참여한 이번 연구는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 4월 16일자 온라인판에 게재됐다.
기존의 약물 상호작용 예측 방법론은 약물-약물 간의 상호작용 가능성만을 예측할 뿐, 두 약물 간의 구체적인 약리작용에 대한 정보는 제공하지 못했다. 이러한 이유로 맞춤형 약물 처방, 식이요법 등 응용 연구에서 체계적인 근거를 제시하거나 가설을 세우는 데에 한계가 있었다.
연구팀은 딥 러닝(deep learning) 기술을 적용해 19만 2천 284개의 약물-약물 상호작용을 아우르는 86가지의 약물 상호작용을 92.4%의 정확도로 예측하는 시스템 딥디디아이 (DeepDDI)를 개발했다.
딥디디아이는 두 약물 A, B 간의 상호작용에 대한 예측 결과를 다음과 같이 사람이 읽을 수 있는 영문 문장으로 출력한다 : “The metabolism of Drug B can be decreased when combined with Drug A (약물 A를 약물 B와 함께 복용 시 약물 B의 약물 대사가 감소 될 수 있다)”
연구팀은 딥디디아이를 이용해 두 약물 복용 시 일어날 수 있는 유해반응의 원인, 보고된 인체 부작용을 최소화시킬 수 있는 대체 약물, 특정 약물의 약효를 떨어뜨릴 수 있는 음식 및 음식 성분, 지금껏 알려지지 않은 음식 성분의 활성 등을 예측했다.
이번 연구성과로 약물-약물 및 약물-음식 상호작용을 정확하게 예측할 수 있는 시스템을 활용하는 것이 가능해졌으며 이는 신약개발, 복합적 약의 처방, 투약시의 음식조절 등을 포함해 헬스케어, 정밀의료 산업 및 제약 산업에 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 “이번 연구결과는 4차 산업혁명 시대의 정밀의료를 선도할 수 있는 기반 기술을 개발한 것이다”며, “복합 투여되는 약물들의 부작용을 낮추고 환자 맞춤형 약물 처방과 식이요법 제안을 통한 효과적인 약물치료 전략을 수립할 수 있다. 특히 고령화 사회에서 건강한 삶을 유지하는데 필요한 약-음식 궁합에 대한 제안을 해 줄 수 있는 시스템으로 발전해 나갈 것이다”고 말했다.
이 연구성과는 과학기술정보통신부의 바이오리파이너리를 위한 시스템대사공학 연구사업, KAIST의 4차 산업혁명 인공지능 플래그십 이니셔티브 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 딥디디아이 (DeepDDI)의 모식도 및 예측된다양한 약물-음식성분의 상호작용들의 시각화
2018.04.18 조회수 21243 -
 김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17 조회수 22729
김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17 조회수 22729