-
 우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04
조회수 24318
-
 다양한 바이러스 감염병을 쉽고 빠르게 찾아내는 만능 진단기술 개발
우리 연구진이 감염된 세포의 용해액만으로도 바이러스의 존재 여부를 핵산 증폭 없이 판독이 가능한 신기술을 개발했다. 이 기술은 바이러스의 특이적으로 존재한다고 알려진 ‘이중나선 RNA(이하 dsRNA)’검출을 기반으로 한다.
이 기술이 실용화되면 현재의 유전자 증폭(PCR) 검사와는 달리 시료 준비나 핵산 증폭, RNA 핵산 서열 정보가 필요 없어 각종 바이러스 감염병이나 신·변종 바이러스를 쉽고 빠르게 진단하는 기술이나 키트(Kit) 등을 개발하는 데 큰 도움이 될 것으로 기대된다.
우리 대학 생명화학공학과 리섕·김유식 교수 공동연구팀은 바이러스의 특징을 이용해 다양한 종류의 바이러스를 검출할 수 있는 만능 진단기술을 개발했다고 28일 밝혔다. 생명화학공학과 박사과정에 재학 중인 구자영, 김수라 학생이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `바이오마크로몰레큘스(Biomacromolecules' 4월 9일 字 온라인 판에 게재됐다. (논문명: Reactive Polymer Targeting dsRNA as Universal Virus Detection Platform with Enhanced Sensitivity).
RNA(리보핵산)는 일반적으로 DNA(디옥시리보핵산)가 가진 유전정보를 운반해 단백질을 생산하게 한다. 그러나 단백질을 만들지 않는 다양한 `비번역 RNA(non-coding RNA)'가 존재하는데 이들은 세포 내 신호전달, 유전자 발현 조절, 그리고 RNA 효소적 작용 등의 다양한 역할을 맡는다. 이러한 비번역 RNA들에 상보적인 핵산 서열을 가지는 RNA가 결합해 형성된 `dsRNA'는 특히 바이러스에서 특이적으로 많이 발견된다.
dsRNA는 DNA 바이러스의 전사 또는 RNA 바이러스의 복제 과정에서 생산되는데, 인간 세포는 바이러스 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다. 특이하게도 바이러스 dsRNA를 인지하는 인간의 선천성 면역반응시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 구조와 같은 형태적 특징을 이용해 dsRNA와 반응한다. 인간 면역체계가 다양한 종류의 바이러스에 대처를 가능케 하는 이유다.
공동연구팀은 이런 인간 면역체계의 원리에 착안해 바이러스의 특징인 길이가 긴 dsRNA를 검출할 수 있는 기판 제작을 통해 다양한 종류의 바이러스를 핵산 서열 정보 없이 검출할 수 있도록 했다. 실리카 기판 표면에는 펜타 플루오르 페닐 아크릴레이트(PPFPA) 반응성 고분자를 코팅해 높은 효율로 빠르고 간편하게 dsRNA를 인지하는 항체를 고정시켰다. 이렇게 개발된 기판에서 면역반응을 일으키는 76bp(base pair, 염기 쌍 개수를 의미하는 길이 단위) 이상의 긴 길이를 가지는 dsRNA를 검출할 수 있었다. 또한, 감염이 되지 않은 세포에서 발견되는 단일 가닥 RNA와 함께 19bp의 짧은 dsRNA는 전혀 검출되지 않아 바이러스 감염 진단용으로 활용 가능성을 확인했다.
연구팀은 이어 바이러스 dsRNA의 긴 길이를 활용한 2단계 검출 방법을 찾기 위해 많은 도전 끝에 특이도 및 민감도가 향상된 바이러스 dsRNA 검출기술을 개발하는 데 성공했다.
연구팀은 이와 함께 시료 준비과정도 대폭 간편화시켜 세포에서 RNA를 분리하거나 정제 작업 없이 감염된 세포의 용해액만을 이용해 바이러스 dsRNA를 검출할 수 있는 기술을 개발했다. 이 기술을 A형과 C형 간염 바이러스에 감염된 세포에 적용한 결과, 바이러스 dsRNA의 존재 여부를 핵산 증폭 없이 판독하는 데에도 성공했다.
KAIST 생명화학공학과 리섕 교수는 "이번 연구에서는 A형 간염과 C형 간염 dsRNA만을 검출했지만, 바이러스 dsRNA는 다양한 종류의 바이러스에서 발견된다ˮ 면서 "이번에 개발한 dsRNA 검출기술은 다양한 바이러스에 적용 가능해 만능 감염병 진단기술로 발전될 수 있고, 특히 공항·학교 등 공공장소에서도 쉽고 빠르게 감염병을 검출할 수 있어 효과적인 방역대책을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 국방과학연구소 순수기초연구 용역사업에 지원을 받아 수행됐다.
다양한 바이러스 감염병을 쉽고 빠르게 찾아내는 만능 진단기술 개발
우리 연구진이 감염된 세포의 용해액만으로도 바이러스의 존재 여부를 핵산 증폭 없이 판독이 가능한 신기술을 개발했다. 이 기술은 바이러스의 특이적으로 존재한다고 알려진 ‘이중나선 RNA(이하 dsRNA)’검출을 기반으로 한다.
이 기술이 실용화되면 현재의 유전자 증폭(PCR) 검사와는 달리 시료 준비나 핵산 증폭, RNA 핵산 서열 정보가 필요 없어 각종 바이러스 감염병이나 신·변종 바이러스를 쉽고 빠르게 진단하는 기술이나 키트(Kit) 등을 개발하는 데 큰 도움이 될 것으로 기대된다.
우리 대학 생명화학공학과 리섕·김유식 교수 공동연구팀은 바이러스의 특징을 이용해 다양한 종류의 바이러스를 검출할 수 있는 만능 진단기술을 개발했다고 28일 밝혔다. 생명화학공학과 박사과정에 재학 중인 구자영, 김수라 학생이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `바이오마크로몰레큘스(Biomacromolecules' 4월 9일 字 온라인 판에 게재됐다. (논문명: Reactive Polymer Targeting dsRNA as Universal Virus Detection Platform with Enhanced Sensitivity).
RNA(리보핵산)는 일반적으로 DNA(디옥시리보핵산)가 가진 유전정보를 운반해 단백질을 생산하게 한다. 그러나 단백질을 만들지 않는 다양한 `비번역 RNA(non-coding RNA)'가 존재하는데 이들은 세포 내 신호전달, 유전자 발현 조절, 그리고 RNA 효소적 작용 등의 다양한 역할을 맡는다. 이러한 비번역 RNA들에 상보적인 핵산 서열을 가지는 RNA가 결합해 형성된 `dsRNA'는 특히 바이러스에서 특이적으로 많이 발견된다.
dsRNA는 DNA 바이러스의 전사 또는 RNA 바이러스의 복제 과정에서 생산되는데, 인간 세포는 바이러스 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다. 특이하게도 바이러스 dsRNA를 인지하는 인간의 선천성 면역반응시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 구조와 같은 형태적 특징을 이용해 dsRNA와 반응한다. 인간 면역체계가 다양한 종류의 바이러스에 대처를 가능케 하는 이유다.
공동연구팀은 이런 인간 면역체계의 원리에 착안해 바이러스의 특징인 길이가 긴 dsRNA를 검출할 수 있는 기판 제작을 통해 다양한 종류의 바이러스를 핵산 서열 정보 없이 검출할 수 있도록 했다. 실리카 기판 표면에는 펜타 플루오르 페닐 아크릴레이트(PPFPA) 반응성 고분자를 코팅해 높은 효율로 빠르고 간편하게 dsRNA를 인지하는 항체를 고정시켰다. 이렇게 개발된 기판에서 면역반응을 일으키는 76bp(base pair, 염기 쌍 개수를 의미하는 길이 단위) 이상의 긴 길이를 가지는 dsRNA를 검출할 수 있었다. 또한, 감염이 되지 않은 세포에서 발견되는 단일 가닥 RNA와 함께 19bp의 짧은 dsRNA는 전혀 검출되지 않아 바이러스 감염 진단용으로 활용 가능성을 확인했다.
연구팀은 이어 바이러스 dsRNA의 긴 길이를 활용한 2단계 검출 방법을 찾기 위해 많은 도전 끝에 특이도 및 민감도가 향상된 바이러스 dsRNA 검출기술을 개발하는 데 성공했다.
연구팀은 이와 함께 시료 준비과정도 대폭 간편화시켜 세포에서 RNA를 분리하거나 정제 작업 없이 감염된 세포의 용해액만을 이용해 바이러스 dsRNA를 검출할 수 있는 기술을 개발했다. 이 기술을 A형과 C형 간염 바이러스에 감염된 세포에 적용한 결과, 바이러스 dsRNA의 존재 여부를 핵산 증폭 없이 판독하는 데에도 성공했다.
KAIST 생명화학공학과 리섕 교수는 "이번 연구에서는 A형 간염과 C형 간염 dsRNA만을 검출했지만, 바이러스 dsRNA는 다양한 종류의 바이러스에서 발견된다ˮ 면서 "이번에 개발한 dsRNA 검출기술은 다양한 바이러스에 적용 가능해 만능 감염병 진단기술로 발전될 수 있고, 특히 공항·학교 등 공공장소에서도 쉽고 빠르게 감염병을 검출할 수 있어 효과적인 방역대책을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 국방과학연구소 순수기초연구 용역사업에 지원을 받아 수행됐다.
2020.06.01
조회수 16559
-
 알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11
조회수 19281
-
 계층형 다공성 2차원 탄소 나노시트 합성
생명화학공학과 이진우 교수팀이 서로 다른 크기의 기공을 동시에 갖는 계층형 다공성 2차원 탄소 나노시트를 합성하는 기술을 개발했다.연구팀의 합성기술은 다공성 2차원 탄소 소재의 기공 크기와 구조 및 두께 등의 물성을 정밀하게 제어할 수 있는 새로운 원천 기술로 2차전지, 촉매 분야에서 고용량 전극 소재로 활용될 것으로 기대된다.
김성섭 박사, 주미은 석사가 공동 1 저자로 참여한 이번 연구 결과는 화학 분야 국제 학술지 ‘미국화학회지(Journal of the American Chemical Society, JACS)’ 2월 13일 자 온라인판에 게재됐다. (논문명: Polymer Interfacial Self-Assembly Guided Two-Dimensional Engineering of Hierarchically Porous Carbon Nanosheets)
기존의 다공성 2차원 탄소 소재의 합성은 대부분 그래핀 소재에 기공을 형성하는 방식에 의존하지만, 이는 기공의 크기와 구조를 효율적으로 제어할 수 없다는 한계가 있다. 이를 해결하기 위해서 2차원 나노시트를 주형으로 이용해 블록공중합체의 자기조립 방식을 시도했으나 추가적인 주형의 합성이 필수적이기 때문에 합성 과정이 복잡하고 두께의 조절이 쉽지 않다는 문제가 발생한다.따라서 기공의 크기 등 나노 구조의 제어가 가능하면서도 손쉬운 합성을 할 수 있는 다공성 2차원 탄소 나노시트 합성법 개발의 필요성이 커지고 있다.
이 교수 연구팀은 블록공중합체, 단일중합체 고분자 혼합물의 상 거동을 이용해 마이크로 기공과 메조 기공, 그리고 8.5nm의 두께를 갖는 계층형 다공성 2차원 탄소 나노시트를 합성하는 데 성공했다. 서로 섞이지 않는 두 종류의 단일중합체의 계면 사이에서 블록공중합체와 무기 전구체가 자기조립을 통해서 다공성 구조를 형성하는 원리이다.이 합성 방법은 별도의 주형이 필요하지 않은 간단한 방법으로 기존의 복잡한 과정을 혁신적으로 줄여 생산력을 증대했다. 이를 이용해 연구팀은 계층형 다공성 탄소 나노시트를 차세대 전지인 칼륨이온전지(potassium-ion batteries)의 음극에 적용해 용량을 기존 흑연 소재의 8배 이상 높이는 결과를 얻었다.
연구팀의 합성기술은 블록공중합체의 분자량 및 고분자대비 질량을 조절해 손쉽게 나노구조(기공 크기, 구조, 두께)를 조절할 수 있어 맞춤형 나노소재로 활용할 수 있을 것으로 기대된다. 이진우 교수는 “기존 다공성 2차원 무기 소재 합성기술의 문제점을 고분자 블렌드 성질을 이용해 해결할 수 있음을 보여줬다”라며 “이는 고분자 물리학과 무기 소재 합성을 이어주는 중요한 연구가 되며 다양한 에너지 장치에 적용될 수 있을 것이다”라고 설명했다.
이번 연구는 과학기술정통부와 한국연구재단이 추진하는 C1가스리파이너리 사업, 수소에너지혁신기술개발사업, 기후변화대응기술개발사업 및 미래소재디스커버리사업의 지원을 통해 수행됐다.
계층형 다공성 2차원 탄소 나노시트 합성
생명화학공학과 이진우 교수팀이 서로 다른 크기의 기공을 동시에 갖는 계층형 다공성 2차원 탄소 나노시트를 합성하는 기술을 개발했다.연구팀의 합성기술은 다공성 2차원 탄소 소재의 기공 크기와 구조 및 두께 등의 물성을 정밀하게 제어할 수 있는 새로운 원천 기술로 2차전지, 촉매 분야에서 고용량 전극 소재로 활용될 것으로 기대된다.
김성섭 박사, 주미은 석사가 공동 1 저자로 참여한 이번 연구 결과는 화학 분야 국제 학술지 ‘미국화학회지(Journal of the American Chemical Society, JACS)’ 2월 13일 자 온라인판에 게재됐다. (논문명: Polymer Interfacial Self-Assembly Guided Two-Dimensional Engineering of Hierarchically Porous Carbon Nanosheets)
기존의 다공성 2차원 탄소 소재의 합성은 대부분 그래핀 소재에 기공을 형성하는 방식에 의존하지만, 이는 기공의 크기와 구조를 효율적으로 제어할 수 없다는 한계가 있다. 이를 해결하기 위해서 2차원 나노시트를 주형으로 이용해 블록공중합체의 자기조립 방식을 시도했으나 추가적인 주형의 합성이 필수적이기 때문에 합성 과정이 복잡하고 두께의 조절이 쉽지 않다는 문제가 발생한다.따라서 기공의 크기 등 나노 구조의 제어가 가능하면서도 손쉬운 합성을 할 수 있는 다공성 2차원 탄소 나노시트 합성법 개발의 필요성이 커지고 있다.
이 교수 연구팀은 블록공중합체, 단일중합체 고분자 혼합물의 상 거동을 이용해 마이크로 기공과 메조 기공, 그리고 8.5nm의 두께를 갖는 계층형 다공성 2차원 탄소 나노시트를 합성하는 데 성공했다. 서로 섞이지 않는 두 종류의 단일중합체의 계면 사이에서 블록공중합체와 무기 전구체가 자기조립을 통해서 다공성 구조를 형성하는 원리이다.이 합성 방법은 별도의 주형이 필요하지 않은 간단한 방법으로 기존의 복잡한 과정을 혁신적으로 줄여 생산력을 증대했다. 이를 이용해 연구팀은 계층형 다공성 탄소 나노시트를 차세대 전지인 칼륨이온전지(potassium-ion batteries)의 음극에 적용해 용량을 기존 흑연 소재의 8배 이상 높이는 결과를 얻었다.
연구팀의 합성기술은 블록공중합체의 분자량 및 고분자대비 질량을 조절해 손쉽게 나노구조(기공 크기, 구조, 두께)를 조절할 수 있어 맞춤형 나노소재로 활용할 수 있을 것으로 기대된다. 이진우 교수는 “기존 다공성 2차원 무기 소재 합성기술의 문제점을 고분자 블렌드 성질을 이용해 해결할 수 있음을 보여줬다”라며 “이는 고분자 물리학과 무기 소재 합성을 이어주는 중요한 연구가 되며 다양한 에너지 장치에 적용될 수 있을 것이다”라고 설명했다.
이번 연구는 과학기술정통부와 한국연구재단이 추진하는 C1가스리파이너리 사업, 수소에너지혁신기술개발사업, 기후변화대응기술개발사업 및 미래소재디스커버리사업의 지원을 통해 수행됐다.
2020.03.20
조회수 19535
-
 초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
2020.02.21
조회수 15459
-
 조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09
조회수 20457
-
 임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25
조회수 11928
-
 이정용 교수, 유기고분자-양자점 기반 하이브리드 태양전지 개발
〈 이정용 교수 〉
우리 대학 EEWS 대학원 이정용 교수 연구팀과 캐나다 토론토 대학교 전기 및 컴퓨터 공학부 테드 사전트(Ted Sargent) 교수 공동 연구팀이 유기 단분자 물질 도입을 통한 고효율, 고 안정성 유무기 하이브리드 태양전지 제작 기술을 개발했다.
연구팀이 개발한 유기 고분자-양자점 하이브리드 태양전지는 단순 성능 개선을 넘어 기존의 구조에서 성능이 제한된 문제점을 해결할 수 있는 구체적인 방안을 제시하고, 차세대 에너지원으로써 하이브리드 태양전지에 적용할 수 있을 것으로 기대된다.
백세웅, 전선홍 박사, 김병수 박사과정 및 앤드류 프로페(Andrew H. Proppe) 박사가 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 에너지(Nature Energy)’ 11월 11일 자 온라인판에 게재됐다. (논문명: Efficient hybrid colloidal quantum dot/organic solar cells mediated by near-infrared sensitizing small molecules)
높은 기계적 특성 및 흡광 계수를 갖는 유기 고분자와 근적외선 영역을 흡수할 수 있는 콜로이달 양자점을 이용해 제작되는 하이브리드 태양전지는 용액공정으로 제작할 수 있고 두 물질의 장점을 모두 취할 수 있다는 점에서 많은 관심을 받아왔다.
하지만 유기 고분자-양자점 기반의 하이브리드 구조는 낮은 광전변환 효율과 안정성 측면에서 기존의 차세대 태양전지들과 경쟁하기에 부족한 점이 있다.
낮은 전하추출 능력과 그로 인해 발생하는 재결합 문제로 인해 최근까지도 10% 이하의 낮은 광전변환 효율에 머무르는 하이브리드 태양전지의 성능 개선이 필요한 실정이다.
연구팀은 문제 해결을 위해 고분자와 양자점의 매개체 역할을 할 수 있는 새 유기 단분자 구조를 도입했다. 이렇게 유기 단분자 매개체 도입된 유기 고분자-양자점 하이브리드 구조는 기존의 구조보다 다양한 강점을 가진다.
우선 기존의 유기 고분자에서 생성된 엑시톤을 원활하게 추출할 수 있으며, 상호 보완적인 흡광 대역이 형성돼 추가적인 전류 향상을 얻을 수 있고, 계단형 에너지 레벨을 형성해 에너지 및 전하를 효과적으로 운반할 수 있다.
이러한 강점을 통해 연구팀은 13.1%의 광전변환 효율을 달성했으며, 이는 기존의 유기 고분자와 양자점을 이용하는 하이브리드 태양전지보다 30% 이상 높은 효율이다. 그뿐만 아니라 제작 후 약 1천 500시간 이후에도 초기 효율의 90% 성능을 유지했으며, 최대전력조건에서 약 150시간 이후에도 초기 효율의 80% 이상의 성능을 유지했다.
이 교수는 “단분자를 도입해 기존의 하이브리드 구조의 고질적인 한계를 극복하고 고효율의 차세대 태양전지를 구현했다”라며 “개발한 고효율 태양전지는 최근 주목받고 있는 웨어러블 전자기기를 넘어서 모바일, IoT, 드론 및 4차산업에 적용 가능한 차세대 에너지 동력원으로써 주목받게 될 것이다”라고 말했다.
이 연구는 한국연구재단 중견연구자지원사업, 기후변화대응기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 새롭게 제시한 하이브리드 소재 구조의 작동 원리
이정용 교수, 유기고분자-양자점 기반 하이브리드 태양전지 개발
〈 이정용 교수 〉
우리 대학 EEWS 대학원 이정용 교수 연구팀과 캐나다 토론토 대학교 전기 및 컴퓨터 공학부 테드 사전트(Ted Sargent) 교수 공동 연구팀이 유기 단분자 물질 도입을 통한 고효율, 고 안정성 유무기 하이브리드 태양전지 제작 기술을 개발했다.
연구팀이 개발한 유기 고분자-양자점 하이브리드 태양전지는 단순 성능 개선을 넘어 기존의 구조에서 성능이 제한된 문제점을 해결할 수 있는 구체적인 방안을 제시하고, 차세대 에너지원으로써 하이브리드 태양전지에 적용할 수 있을 것으로 기대된다.
백세웅, 전선홍 박사, 김병수 박사과정 및 앤드류 프로페(Andrew H. Proppe) 박사가 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 에너지(Nature Energy)’ 11월 11일 자 온라인판에 게재됐다. (논문명: Efficient hybrid colloidal quantum dot/organic solar cells mediated by near-infrared sensitizing small molecules)
높은 기계적 특성 및 흡광 계수를 갖는 유기 고분자와 근적외선 영역을 흡수할 수 있는 콜로이달 양자점을 이용해 제작되는 하이브리드 태양전지는 용액공정으로 제작할 수 있고 두 물질의 장점을 모두 취할 수 있다는 점에서 많은 관심을 받아왔다.
하지만 유기 고분자-양자점 기반의 하이브리드 구조는 낮은 광전변환 효율과 안정성 측면에서 기존의 차세대 태양전지들과 경쟁하기에 부족한 점이 있다.
낮은 전하추출 능력과 그로 인해 발생하는 재결합 문제로 인해 최근까지도 10% 이하의 낮은 광전변환 효율에 머무르는 하이브리드 태양전지의 성능 개선이 필요한 실정이다.
연구팀은 문제 해결을 위해 고분자와 양자점의 매개체 역할을 할 수 있는 새 유기 단분자 구조를 도입했다. 이렇게 유기 단분자 매개체 도입된 유기 고분자-양자점 하이브리드 구조는 기존의 구조보다 다양한 강점을 가진다.
우선 기존의 유기 고분자에서 생성된 엑시톤을 원활하게 추출할 수 있으며, 상호 보완적인 흡광 대역이 형성돼 추가적인 전류 향상을 얻을 수 있고, 계단형 에너지 레벨을 형성해 에너지 및 전하를 효과적으로 운반할 수 있다.
이러한 강점을 통해 연구팀은 13.1%의 광전변환 효율을 달성했으며, 이는 기존의 유기 고분자와 양자점을 이용하는 하이브리드 태양전지보다 30% 이상 높은 효율이다. 그뿐만 아니라 제작 후 약 1천 500시간 이후에도 초기 효율의 90% 성능을 유지했으며, 최대전력조건에서 약 150시간 이후에도 초기 효율의 80% 이상의 성능을 유지했다.
이 교수는 “단분자를 도입해 기존의 하이브리드 구조의 고질적인 한계를 극복하고 고효율의 차세대 태양전지를 구현했다”라며 “개발한 고효율 태양전지는 최근 주목받고 있는 웨어러블 전자기기를 넘어서 모바일, IoT, 드론 및 4차산업에 적용 가능한 차세대 에너지 동력원으로써 주목받게 될 것이다”라고 말했다.
이 연구는 한국연구재단 중견연구자지원사업, 기후변화대응기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 새롭게 제시한 하이브리드 소재 구조의 작동 원리
2019.11.19
조회수 16675
-
 김재경 교수, 수학 모델 통해 세포 상호작용 원리 규명
〈김재경 교수〉
우리 대학 수리과학과 김재경 교수와 라이스 대학 매튜 베넷(Matthew Bennett), 휴스턴 대학 크레시미르 조식(Kresimir Josic) 교수 공동 연구팀이 합성생물학과 수학적 모델을 이용해 세포들이 넓은 공간에서 효과적으로 의사소통하는 방법을 발견했다.
이번 연구 결과는 국제 학술지 ‘네이처 케미컬 바이올로지(Nature Chemical Biology)’ 10월 14일 자 온라인판에 게재됐다. (논문명 :Long-range temporal coordination of gene expression in synthetic microbial consortia)
〈박테리아들의 복잡한 상호작용을 수학을 이용해 원위의 점들의 상호작용으로 단순화한 모식도〉
세포들은 신호 전달 분자(Signalling molecule)를 이용해 의사소통하는데 이 신호는 보통 아주 짧은 거리만 도달할 수 있다. 그런데도 세포들은 넓은 공간에서도 상호작용하며 동기화를 이뤄낸다.
이는 마치 넓은 축구장에 수만 명의 사람이 주변 3~4명의 박수 소리만 들을 수 있는데도 불구하고 모두가 같은 박자로 손뼉을 치는 것과 비슷한 상황이다. 이러한 현상이 가능한 이유는 무엇일까?
연구팀은 합성생물학을 이용해 만든 전사 회로(Transcriptional circuit)를 박테리아(E. coli)에 구축해 주기적으로 신호 전달 분자를 방출할 수 있도록 했다. 처음엔 제각기 다른 시간에 신호 전달 분자를 방출하던 박테리아들은 의사소통을 통해 같은 시간에 주기적으로 분자를 방출하는 동기화를 이뤄냈다.
하지만 박테리아를 넓은 공간으로 옮겼을 땐 이러한 동기화가 각 박테리아의 신호 전달 분자 전사 회로에 전사적 양성 피드백 룹 (Transcriptional positive feedback loop)이 있을 때만 가능하다는 것을 발견했다.
양성 피드백 룹은 단백질이 스스로 유전자 발현을 유도하는 시스템으로, 전달받은 신호를 증폭하는 역할을 한다. 연구팀은 이러한 역할을 자세히 이해하기 위해 편미분방정식(Partial differential equation)을 이용해 세포 내 신호 전달 분자의 생성과 세포 간 의사소통을 정확하게 묘사하는 수학적 모델을 개발했다.
그러나 전사 회로를 구성하는 다양한 종류의 분자들 사이의 상호작용을 묘사하기 위해서는 고차원의 편미분방정식이 필요했고 이를 분석하기는 쉽지 않았다.
이를 극복하기 위해 연구팀은 시스템이 주기적인 패턴을 반복한다는 점에 착안해 고차원 시스템을 1차원 원 위의 움직임으로 단순화했다. 달은 고차원인 우주 공간에서 움직이지만, 궤도를 따라 주기적으로 움직이기에 달의 움직임을 1차원 원 위에서 나타낼 수 있는 것과 같은 원리이다.
이를 통해 연구팀은 박테리아 사이의 복잡한 상호작용을 원 위를 주기적으로 움직이는 두 점의 상호작용으로 단순화할 수 있었다.
연구팀은 양성 피드백 룹이 있으면 두 점의 위치 차이가 커도 시간이 지날수록 점점 차이가 줄어들어 결국 동시에 움직이는 것을 확인했다. 연구팀은 이러한 수학적 분석 결과를 실험을 통해서 검증함으로써 넓은 공간에서 세포가 효과적으로 상호작용하는 방식을 규명했다.
김재경 교수는 “세포들이 자신의 목소리는 낮추고 상대방의 목소리에는 더 귀 기울일 때만 한목소리를 낼 수 있다는 점이 인상적이다”라며 “이러한 원리는 수학을 이용한 복잡한 시스템의 단순화 없이는 찾지 못했을 것이다. 복잡한 것을 단순하게 볼 수 있도록 해주는 것이 수학의 힘이다”라고 말했다.
김재경 교수, 수학 모델 통해 세포 상호작용 원리 규명
〈김재경 교수〉
우리 대학 수리과학과 김재경 교수와 라이스 대학 매튜 베넷(Matthew Bennett), 휴스턴 대학 크레시미르 조식(Kresimir Josic) 교수 공동 연구팀이 합성생물학과 수학적 모델을 이용해 세포들이 넓은 공간에서 효과적으로 의사소통하는 방법을 발견했다.
이번 연구 결과는 국제 학술지 ‘네이처 케미컬 바이올로지(Nature Chemical Biology)’ 10월 14일 자 온라인판에 게재됐다. (논문명 :Long-range temporal coordination of gene expression in synthetic microbial consortia)
〈박테리아들의 복잡한 상호작용을 수학을 이용해 원위의 점들의 상호작용으로 단순화한 모식도〉
세포들은 신호 전달 분자(Signalling molecule)를 이용해 의사소통하는데 이 신호는 보통 아주 짧은 거리만 도달할 수 있다. 그런데도 세포들은 넓은 공간에서도 상호작용하며 동기화를 이뤄낸다.
이는 마치 넓은 축구장에 수만 명의 사람이 주변 3~4명의 박수 소리만 들을 수 있는데도 불구하고 모두가 같은 박자로 손뼉을 치는 것과 비슷한 상황이다. 이러한 현상이 가능한 이유는 무엇일까?
연구팀은 합성생물학을 이용해 만든 전사 회로(Transcriptional circuit)를 박테리아(E. coli)에 구축해 주기적으로 신호 전달 분자를 방출할 수 있도록 했다. 처음엔 제각기 다른 시간에 신호 전달 분자를 방출하던 박테리아들은 의사소통을 통해 같은 시간에 주기적으로 분자를 방출하는 동기화를 이뤄냈다.
하지만 박테리아를 넓은 공간으로 옮겼을 땐 이러한 동기화가 각 박테리아의 신호 전달 분자 전사 회로에 전사적 양성 피드백 룹 (Transcriptional positive feedback loop)이 있을 때만 가능하다는 것을 발견했다.
양성 피드백 룹은 단백질이 스스로 유전자 발현을 유도하는 시스템으로, 전달받은 신호를 증폭하는 역할을 한다. 연구팀은 이러한 역할을 자세히 이해하기 위해 편미분방정식(Partial differential equation)을 이용해 세포 내 신호 전달 분자의 생성과 세포 간 의사소통을 정확하게 묘사하는 수학적 모델을 개발했다.
그러나 전사 회로를 구성하는 다양한 종류의 분자들 사이의 상호작용을 묘사하기 위해서는 고차원의 편미분방정식이 필요했고 이를 분석하기는 쉽지 않았다.
이를 극복하기 위해 연구팀은 시스템이 주기적인 패턴을 반복한다는 점에 착안해 고차원 시스템을 1차원 원 위의 움직임으로 단순화했다. 달은 고차원인 우주 공간에서 움직이지만, 궤도를 따라 주기적으로 움직이기에 달의 움직임을 1차원 원 위에서 나타낼 수 있는 것과 같은 원리이다.
이를 통해 연구팀은 박테리아 사이의 복잡한 상호작용을 원 위를 주기적으로 움직이는 두 점의 상호작용으로 단순화할 수 있었다.
연구팀은 양성 피드백 룹이 있으면 두 점의 위치 차이가 커도 시간이 지날수록 점점 차이가 줄어들어 결국 동시에 움직이는 것을 확인했다. 연구팀은 이러한 수학적 분석 결과를 실험을 통해서 검증함으로써 넓은 공간에서 세포가 효과적으로 상호작용하는 방식을 규명했다.
김재경 교수는 “세포들이 자신의 목소리는 낮추고 상대방의 목소리에는 더 귀 기울일 때만 한목소리를 낼 수 있다는 점이 인상적이다”라며 “이러한 원리는 수학을 이용한 복잡한 시스템의 단순화 없이는 찾지 못했을 것이다. 복잡한 것을 단순하게 볼 수 있도록 해주는 것이 수학의 힘이다”라고 말했다.
2019.10.15
조회수 16263
-
 김범준 교수, 빛에 반응해 모양과 색 변하는 스마트 마이크로 입자 개발
〈 김범준 교수, 이준혁 박사, 구강희 박사 〉
우리 대학 생명화학공학과 김범준 교수 연구팀이 빛에 의해 모양과 색을 바꿀 수 있는 스마트 마이크로 입자 제작기술을 개발했다.
아주 작은 입자의 모양이나 색을 원하는 대로 가공(fabrication)할 수 있게 되면 군용장비의 위장막(artificial camouflage), 병든 세포만 표적하는 약물전달캡슐, 투명도 및 색이 변하는 스마트 윈도우나 외부 인테리어 등에 활용할 수 있다.
마이크로 입자의 모양과 색 변화 연구는 주로 약물전달이나 암세포 진단과 같은 생물학적 응용을 위해 산도(pH), 온도, 특정 생체분자 같은 물리화학적 자극과 관련해 주로 이뤄졌다.
하지만 이런 자극들은 의도하는 국소부위에만 전달하기 어렵고 자극 스위치를 명확하게 켜고 끄기 어려운 것이 단점이었다.
반면 빛은 원하는 시간 동안 특정부위에만 쬐어줄 수 있고 파장과 세기를 정밀하게 조절, 선택적·순차적으로 입자 모양을 변형시킬 수 있어 해상도 높은 자극으로 주목받는다.
하지만 기존 빛에 감응하는 스마트 입자는 제작방법이 복잡하고, 편광방향으로의 길이 연장만 가능한 등 정밀한 모양변화가 어려워 활용에 한계가 있었다.
연구팀은 빛에 의해 분자구조가 변해 친수성 정도나 광학적 특성을 조절할 수 있는 계면활성제*를 개발하고 이들의 자가조립방식을 기반으로 빛에 반응해 모양과 색깔이 변하는 수 마이크로미터 크기의 스마트 입자를 대량으로 제작하는 데 성공했다.
빛을 쬐어준 시간과 파장에 따라 구형에서 타원체, 튤립, 렌즈형태 등으로 변화시킬 수 있는 한편 입자의 색도 조절할 수 있다.
또한 100μm 이하의 국소 부위에만 빛을 조사함으로써 원하는 위치에서 원하는 모양을 정교하게 유도할 수 있다.
특히 반응하는 빛의 파장이 서로 다른 계면활성제를 활용하면 입자 모양의 변화를 여러 단계로 조절하거나 원래의 모양으로 되돌리는 변화가 가능하다.
이러한 스마트 입자로 만들어진 박막이나 용액은 그 성질을 정밀하게 조절할 수 있어 정보를 담거나 신호를 넣을 수 있는 스마트 소재로도 활용할 수 있다.
과학기술정보통신부와 한국연구재단이 추진하는 미래소재디스커버리사업, 글로벌프론티어사업 및 중견연구자지원사업의 지원으로 수행된 이번 연구의 결과는 화학 분야 국제학술지 잭스(JACS, Journal of the American Chemical Society)에 9월 4일 게재되는 한편 표지 논문으로 선정됐다.
김범준 교수는 “빛을 이용해 모양과 색이 조절되는 스마트 입자 제작 플랫폼을 개발한 것으로 빛을 신호로 국소부위 입자의 성질을 정밀하게 조절할 수 있어 스마트 디스플레이, 센서, 도료, 약물전달 등에 응용될 수 있을 것으로 기대된다.”고 설명했다.
□ 그림 설명
그림1. 김범준 교수 연구성과 개념도
김범준 교수, 빛에 반응해 모양과 색 변하는 스마트 마이크로 입자 개발
〈 김범준 교수, 이준혁 박사, 구강희 박사 〉
우리 대학 생명화학공학과 김범준 교수 연구팀이 빛에 의해 모양과 색을 바꿀 수 있는 스마트 마이크로 입자 제작기술을 개발했다.
아주 작은 입자의 모양이나 색을 원하는 대로 가공(fabrication)할 수 있게 되면 군용장비의 위장막(artificial camouflage), 병든 세포만 표적하는 약물전달캡슐, 투명도 및 색이 변하는 스마트 윈도우나 외부 인테리어 등에 활용할 수 있다.
마이크로 입자의 모양과 색 변화 연구는 주로 약물전달이나 암세포 진단과 같은 생물학적 응용을 위해 산도(pH), 온도, 특정 생체분자 같은 물리화학적 자극과 관련해 주로 이뤄졌다.
하지만 이런 자극들은 의도하는 국소부위에만 전달하기 어렵고 자극 스위치를 명확하게 켜고 끄기 어려운 것이 단점이었다.
반면 빛은 원하는 시간 동안 특정부위에만 쬐어줄 수 있고 파장과 세기를 정밀하게 조절, 선택적·순차적으로 입자 모양을 변형시킬 수 있어 해상도 높은 자극으로 주목받는다.
하지만 기존 빛에 감응하는 스마트 입자는 제작방법이 복잡하고, 편광방향으로의 길이 연장만 가능한 등 정밀한 모양변화가 어려워 활용에 한계가 있었다.
연구팀은 빛에 의해 분자구조가 변해 친수성 정도나 광학적 특성을 조절할 수 있는 계면활성제*를 개발하고 이들의 자가조립방식을 기반으로 빛에 반응해 모양과 색깔이 변하는 수 마이크로미터 크기의 스마트 입자를 대량으로 제작하는 데 성공했다.
빛을 쬐어준 시간과 파장에 따라 구형에서 타원체, 튤립, 렌즈형태 등으로 변화시킬 수 있는 한편 입자의 색도 조절할 수 있다.
또한 100μm 이하의 국소 부위에만 빛을 조사함으로써 원하는 위치에서 원하는 모양을 정교하게 유도할 수 있다.
특히 반응하는 빛의 파장이 서로 다른 계면활성제를 활용하면 입자 모양의 변화를 여러 단계로 조절하거나 원래의 모양으로 되돌리는 변화가 가능하다.
이러한 스마트 입자로 만들어진 박막이나 용액은 그 성질을 정밀하게 조절할 수 있어 정보를 담거나 신호를 넣을 수 있는 스마트 소재로도 활용할 수 있다.
과학기술정보통신부와 한국연구재단이 추진하는 미래소재디스커버리사업, 글로벌프론티어사업 및 중견연구자지원사업의 지원으로 수행된 이번 연구의 결과는 화학 분야 국제학술지 잭스(JACS, Journal of the American Chemical Society)에 9월 4일 게재되는 한편 표지 논문으로 선정됐다.
김범준 교수는 “빛을 이용해 모양과 색이 조절되는 스마트 입자 제작 플랫폼을 개발한 것으로 빛을 신호로 국소부위 입자의 성질을 정밀하게 조절할 수 있어 스마트 디스플레이, 센서, 도료, 약물전달 등에 응용될 수 있을 것으로 기대된다.”고 설명했다.
□ 그림 설명
그림1. 김범준 교수 연구성과 개념도
2019.09.09
조회수 18366
-
 김재경 교수, 수학적 모델링 통해 신약 개발 걸림돌 해소
〈 김대욱 박사과정, 김재경 교수 〉
우리 대학 수리과학과 김재경 교수와 글로벌 제약회사 화이자(Pfizer)의 장 청(Cheng Chang) 박사 공동연구팀이 수학적 모델을 기반으로 동물 실험과 임상 시험 간 차이가 발생하는 원인을 밝히고 그 해결책을 제시했다.
연구팀은 일주기 리듬 수면 장애 신약을 개발하는 과정에서 동물 실험과 임상 시험 간 발생하는 차이 문제를 수학적 모델을 이용해 해결함으로써 신약 개발의 가능성을 높였다. 또한, 동물과 사람 간 차이 뿐 아니라 사람마다 발생하는 약효의 차이 발생 원인도 밝혀냈다.
김대욱 박사과정이 1 저자로 참여한 이번 연구결과는 국제 학술지 ‘분자 시스템 생물학 (Molecular Systems Biology)’ 7월 8일자 온라인판에 게재됐고, 우수성을 인정받아 7월호 표지논문으로 선정됐다. (논문명 : Systems approach reveals photosensitivity and PER2 level as determinants of clock-modulator efficacy)
신약을 개발하기 위해 임상 시험 전 단계로 쥐 등의 동물을 대상으로 전임상 실험을 하게 된다. 이 과정에서 동물에서 보였던 효과가 사람에게선 보이지 않을 때가 종종 있고 사람마다 효과가 다르게 나타나기도 한다. 이러한 약효의 차이가 발생하는 원인을 찾지 못하면 신약 개발에 큰 걸림돌이 된다.
수면 장애는 맞춤형 치료 분야에서 개발이 가장 더딘 질병 중 하나이다. 쥐는 사람과 달리 수면시간이 반대인 야행성 동물이다 보니 수면시간을 조절할 수 있는 치료제가 실험 쥐에게는 효과가 있어도 사람에게는 무효한 경우가 많았다. 하지만 그 원인이 알려지지 않아 신약 개발에 어려움이 있었다.
연구팀은 이러한 차이의 원인을 미분방정식을 이용한 가상실험과 실제 실험을 결합해 연구했고, 주행성인 사람은 야행성인 쥐에 비해 빛 노출 때문에 약효가 더 많이 반감되는 것이 원인임을 밝혔다. 이는 빛 노출 조절을 통해 그동안 사람에게 보이지 않던 약효가 발현되게 할 수 있음을 뜻한다.
수면 장애 치료 약물의 약효가 사람마다 큰 차이를 보이는 것도 신약 개발의 걸림돌이었다. 연구팀은 증상이 비슷해도 환자마다 약효 차이가 나타나는 원인을 밝히기 위해 수리 모델링을 이용한 가상환자를 이용했다.
이를 통해 약효가 달라지는 원인은 수면시간을 결정하는 핵심 역할을 하는 생체시계 단백질인 PER2의 발현량이 달라서임을 규명했다.
또한, PER2의 양이 낮에는 증가하고 밤에는 감소하기 때문에 하루 중 언제 투약하느냐에 따라 약효가 바뀜을 이용해 환자마다 적절한 투약 시간을 찾아 최적의 치료 효과를 가져오는 시간요법(Chronotherapy)를 개발했다.
김재경 교수는 “수학이 실제 의약학 분야에 이바지해 우리가 좀 더 건강하고 행복한 삶을 살 수 있는데 도울 수 있어 행복한 연구였다”라며 “이번 성과를 통해 국내에선 아직은 부족한 의약학과 수학의 교류가 활발해지길 기대한다”라고 말했다.
□ 그림 설명
그림1. 김재경 교수 연구팀 성과 개념도
그림2. 맞춤형 시간 치료법 (Chronotherapy) 개념도
김재경 교수, 수학적 모델링 통해 신약 개발 걸림돌 해소
〈 김대욱 박사과정, 김재경 교수 〉
우리 대학 수리과학과 김재경 교수와 글로벌 제약회사 화이자(Pfizer)의 장 청(Cheng Chang) 박사 공동연구팀이 수학적 모델을 기반으로 동물 실험과 임상 시험 간 차이가 발생하는 원인을 밝히고 그 해결책을 제시했다.
연구팀은 일주기 리듬 수면 장애 신약을 개발하는 과정에서 동물 실험과 임상 시험 간 발생하는 차이 문제를 수학적 모델을 이용해 해결함으로써 신약 개발의 가능성을 높였다. 또한, 동물과 사람 간 차이 뿐 아니라 사람마다 발생하는 약효의 차이 발생 원인도 밝혀냈다.
김대욱 박사과정이 1 저자로 참여한 이번 연구결과는 국제 학술지 ‘분자 시스템 생물학 (Molecular Systems Biology)’ 7월 8일자 온라인판에 게재됐고, 우수성을 인정받아 7월호 표지논문으로 선정됐다. (논문명 : Systems approach reveals photosensitivity and PER2 level as determinants of clock-modulator efficacy)
신약을 개발하기 위해 임상 시험 전 단계로 쥐 등의 동물을 대상으로 전임상 실험을 하게 된다. 이 과정에서 동물에서 보였던 효과가 사람에게선 보이지 않을 때가 종종 있고 사람마다 효과가 다르게 나타나기도 한다. 이러한 약효의 차이가 발생하는 원인을 찾지 못하면 신약 개발에 큰 걸림돌이 된다.
수면 장애는 맞춤형 치료 분야에서 개발이 가장 더딘 질병 중 하나이다. 쥐는 사람과 달리 수면시간이 반대인 야행성 동물이다 보니 수면시간을 조절할 수 있는 치료제가 실험 쥐에게는 효과가 있어도 사람에게는 무효한 경우가 많았다. 하지만 그 원인이 알려지지 않아 신약 개발에 어려움이 있었다.
연구팀은 이러한 차이의 원인을 미분방정식을 이용한 가상실험과 실제 실험을 결합해 연구했고, 주행성인 사람은 야행성인 쥐에 비해 빛 노출 때문에 약효가 더 많이 반감되는 것이 원인임을 밝혔다. 이는 빛 노출 조절을 통해 그동안 사람에게 보이지 않던 약효가 발현되게 할 수 있음을 뜻한다.
수면 장애 치료 약물의 약효가 사람마다 큰 차이를 보이는 것도 신약 개발의 걸림돌이었다. 연구팀은 증상이 비슷해도 환자마다 약효 차이가 나타나는 원인을 밝히기 위해 수리 모델링을 이용한 가상환자를 이용했다.
이를 통해 약효가 달라지는 원인은 수면시간을 결정하는 핵심 역할을 하는 생체시계 단백질인 PER2의 발현량이 달라서임을 규명했다.
또한, PER2의 양이 낮에는 증가하고 밤에는 감소하기 때문에 하루 중 언제 투약하느냐에 따라 약효가 바뀜을 이용해 환자마다 적절한 투약 시간을 찾아 최적의 치료 효과를 가져오는 시간요법(Chronotherapy)를 개발했다.
김재경 교수는 “수학이 실제 의약학 분야에 이바지해 우리가 좀 더 건강하고 행복한 삶을 살 수 있는데 도울 수 있어 행복한 연구였다”라며 “이번 성과를 통해 국내에선 아직은 부족한 의약학과 수학의 교류가 활발해지길 기대한다”라고 말했다.
□ 그림 설명
그림1. 김재경 교수 연구팀 성과 개념도
그림2. 맞춤형 시간 치료법 (Chronotherapy) 개념도
2019.07.09
조회수 24898
-
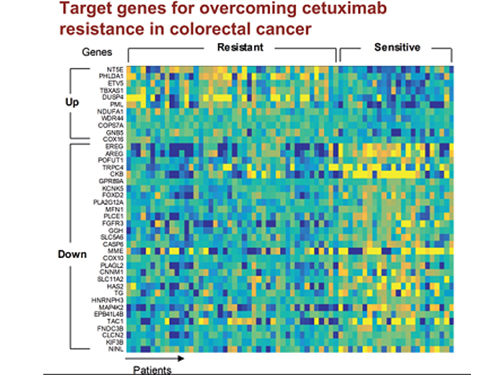 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07
조회수 24164
 우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24318
우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24318 다양한 바이러스 감염병을 쉽고 빠르게 찾아내는 만능 진단기술 개발
우리 연구진이 감염된 세포의 용해액만으로도 바이러스의 존재 여부를 핵산 증폭 없이 판독이 가능한 신기술을 개발했다. 이 기술은 바이러스의 특이적으로 존재한다고 알려진 ‘이중나선 RNA(이하 dsRNA)’검출을 기반으로 한다.
이 기술이 실용화되면 현재의 유전자 증폭(PCR) 검사와는 달리 시료 준비나 핵산 증폭, RNA 핵산 서열 정보가 필요 없어 각종 바이러스 감염병이나 신·변종 바이러스를 쉽고 빠르게 진단하는 기술이나 키트(Kit) 등을 개발하는 데 큰 도움이 될 것으로 기대된다.
우리 대학 생명화학공학과 리섕·김유식 교수 공동연구팀은 바이러스의 특징을 이용해 다양한 종류의 바이러스를 검출할 수 있는 만능 진단기술을 개발했다고 28일 밝혔다. 생명화학공학과 박사과정에 재학 중인 구자영, 김수라 학생이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `바이오마크로몰레큘스(Biomacromolecules' 4월 9일 字 온라인 판에 게재됐다. (논문명: Reactive Polymer Targeting dsRNA as Universal Virus Detection Platform with Enhanced Sensitivity).
RNA(리보핵산)는 일반적으로 DNA(디옥시리보핵산)가 가진 유전정보를 운반해 단백질을 생산하게 한다. 그러나 단백질을 만들지 않는 다양한 `비번역 RNA(non-coding RNA)'가 존재하는데 이들은 세포 내 신호전달, 유전자 발현 조절, 그리고 RNA 효소적 작용 등의 다양한 역할을 맡는다. 이러한 비번역 RNA들에 상보적인 핵산 서열을 가지는 RNA가 결합해 형성된 `dsRNA'는 특히 바이러스에서 특이적으로 많이 발견된다.
dsRNA는 DNA 바이러스의 전사 또는 RNA 바이러스의 복제 과정에서 생산되는데, 인간 세포는 바이러스 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다. 특이하게도 바이러스 dsRNA를 인지하는 인간의 선천성 면역반응시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 구조와 같은 형태적 특징을 이용해 dsRNA와 반응한다. 인간 면역체계가 다양한 종류의 바이러스에 대처를 가능케 하는 이유다.
공동연구팀은 이런 인간 면역체계의 원리에 착안해 바이러스의 특징인 길이가 긴 dsRNA를 검출할 수 있는 기판 제작을 통해 다양한 종류의 바이러스를 핵산 서열 정보 없이 검출할 수 있도록 했다. 실리카 기판 표면에는 펜타 플루오르 페닐 아크릴레이트(PPFPA) 반응성 고분자를 코팅해 높은 효율로 빠르고 간편하게 dsRNA를 인지하는 항체를 고정시켰다. 이렇게 개발된 기판에서 면역반응을 일으키는 76bp(base pair, 염기 쌍 개수를 의미하는 길이 단위) 이상의 긴 길이를 가지는 dsRNA를 검출할 수 있었다. 또한, 감염이 되지 않은 세포에서 발견되는 단일 가닥 RNA와 함께 19bp의 짧은 dsRNA는 전혀 검출되지 않아 바이러스 감염 진단용으로 활용 가능성을 확인했다.
연구팀은 이어 바이러스 dsRNA의 긴 길이를 활용한 2단계 검출 방법을 찾기 위해 많은 도전 끝에 특이도 및 민감도가 향상된 바이러스 dsRNA 검출기술을 개발하는 데 성공했다.
연구팀은 이와 함께 시료 준비과정도 대폭 간편화시켜 세포에서 RNA를 분리하거나 정제 작업 없이 감염된 세포의 용해액만을 이용해 바이러스 dsRNA를 검출할 수 있는 기술을 개발했다. 이 기술을 A형과 C형 간염 바이러스에 감염된 세포에 적용한 결과, 바이러스 dsRNA의 존재 여부를 핵산 증폭 없이 판독하는 데에도 성공했다.
KAIST 생명화학공학과 리섕 교수는 "이번 연구에서는 A형 간염과 C형 간염 dsRNA만을 검출했지만, 바이러스 dsRNA는 다양한 종류의 바이러스에서 발견된다ˮ 면서 "이번에 개발한 dsRNA 검출기술은 다양한 바이러스에 적용 가능해 만능 감염병 진단기술로 발전될 수 있고, 특히 공항·학교 등 공공장소에서도 쉽고 빠르게 감염병을 검출할 수 있어 효과적인 방역대책을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 국방과학연구소 순수기초연구 용역사업에 지원을 받아 수행됐다.
2020.06.01 조회수 16559
다양한 바이러스 감염병을 쉽고 빠르게 찾아내는 만능 진단기술 개발
우리 연구진이 감염된 세포의 용해액만으로도 바이러스의 존재 여부를 핵산 증폭 없이 판독이 가능한 신기술을 개발했다. 이 기술은 바이러스의 특이적으로 존재한다고 알려진 ‘이중나선 RNA(이하 dsRNA)’검출을 기반으로 한다.
이 기술이 실용화되면 현재의 유전자 증폭(PCR) 검사와는 달리 시료 준비나 핵산 증폭, RNA 핵산 서열 정보가 필요 없어 각종 바이러스 감염병이나 신·변종 바이러스를 쉽고 빠르게 진단하는 기술이나 키트(Kit) 등을 개발하는 데 큰 도움이 될 것으로 기대된다.
우리 대학 생명화학공학과 리섕·김유식 교수 공동연구팀은 바이러스의 특징을 이용해 다양한 종류의 바이러스를 검출할 수 있는 만능 진단기술을 개발했다고 28일 밝혔다. 생명화학공학과 박사과정에 재학 중인 구자영, 김수라 학생이 공동 제1 저자로 참여한 이번 연구결과는 국제 학술지 `바이오마크로몰레큘스(Biomacromolecules' 4월 9일 字 온라인 판에 게재됐다. (논문명: Reactive Polymer Targeting dsRNA as Universal Virus Detection Platform with Enhanced Sensitivity).
RNA(리보핵산)는 일반적으로 DNA(디옥시리보핵산)가 가진 유전정보를 운반해 단백질을 생산하게 한다. 그러나 단백질을 만들지 않는 다양한 `비번역 RNA(non-coding RNA)'가 존재하는데 이들은 세포 내 신호전달, 유전자 발현 조절, 그리고 RNA 효소적 작용 등의 다양한 역할을 맡는다. 이러한 비번역 RNA들에 상보적인 핵산 서열을 가지는 RNA가 결합해 형성된 `dsRNA'는 특히 바이러스에서 특이적으로 많이 발견된다.
dsRNA는 DNA 바이러스의 전사 또는 RNA 바이러스의 복제 과정에서 생산되는데, 인간 세포는 바이러스 dsRNA를 외부 물질로 인지해 면역반응을 일으킨다. 특이하게도 바이러스 dsRNA를 인지하는 인간의 선천성 면역반응시스템은 핵산 서열 정보를 무시한 채 dsRNA의 길이나 말단 구조와 같은 형태적 특징을 이용해 dsRNA와 반응한다. 인간 면역체계가 다양한 종류의 바이러스에 대처를 가능케 하는 이유다.
공동연구팀은 이런 인간 면역체계의 원리에 착안해 바이러스의 특징인 길이가 긴 dsRNA를 검출할 수 있는 기판 제작을 통해 다양한 종류의 바이러스를 핵산 서열 정보 없이 검출할 수 있도록 했다. 실리카 기판 표면에는 펜타 플루오르 페닐 아크릴레이트(PPFPA) 반응성 고분자를 코팅해 높은 효율로 빠르고 간편하게 dsRNA를 인지하는 항체를 고정시켰다. 이렇게 개발된 기판에서 면역반응을 일으키는 76bp(base pair, 염기 쌍 개수를 의미하는 길이 단위) 이상의 긴 길이를 가지는 dsRNA를 검출할 수 있었다. 또한, 감염이 되지 않은 세포에서 발견되는 단일 가닥 RNA와 함께 19bp의 짧은 dsRNA는 전혀 검출되지 않아 바이러스 감염 진단용으로 활용 가능성을 확인했다.
연구팀은 이어 바이러스 dsRNA의 긴 길이를 활용한 2단계 검출 방법을 찾기 위해 많은 도전 끝에 특이도 및 민감도가 향상된 바이러스 dsRNA 검출기술을 개발하는 데 성공했다.
연구팀은 이와 함께 시료 준비과정도 대폭 간편화시켜 세포에서 RNA를 분리하거나 정제 작업 없이 감염된 세포의 용해액만을 이용해 바이러스 dsRNA를 검출할 수 있는 기술을 개발했다. 이 기술을 A형과 C형 간염 바이러스에 감염된 세포에 적용한 결과, 바이러스 dsRNA의 존재 여부를 핵산 증폭 없이 판독하는 데에도 성공했다.
KAIST 생명화학공학과 리섕 교수는 "이번 연구에서는 A형 간염과 C형 간염 dsRNA만을 검출했지만, 바이러스 dsRNA는 다양한 종류의 바이러스에서 발견된다ˮ 면서 "이번에 개발한 dsRNA 검출기술은 다양한 바이러스에 적용 가능해 만능 감염병 진단기술로 발전될 수 있고, 특히 공항·학교 등 공공장소에서도 쉽고 빠르게 감염병을 검출할 수 있어 효과적인 방역대책을 마련하는데 유용할 것ˮ 이라고 말했다.
한편 이번 연구는 한국연구재단 신진연구자지원사업과 국방과학연구소 순수기초연구 용역사업에 지원을 받아 수행됐다.
2020.06.01 조회수 16559 알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19281
알츠하이머 치료제 개발을 위한 새로운 가능성 제시
우리 연구진이 알츠하이머 발병 원인을 동시다발적으로 억제 가능한 치료제 개발 원리를 증명하고 또 동물실험에서 효능을 입증하는 등 알츠하이머병에 관한 새로운 치료제 개발에 대한 가능성을 제시함으로써 많은 주목을 받고 있다.
우리 대학 화학과 임미희 교수 연구팀이 알츠하이머 발병의 원인으로 알려진 ‘활성 산소종’과 ‘아밀로이드 베타’, ‘금속 이온’ 등을 손쉽고도 동시다발적으로 억제할 수 있는 치료제 개발 원리를 새롭게 증명하고 알츠하이머 질환에 걸린 동물 모델(실험용 쥐) 치료를 통해 이를 입증하는 데 성공했다고 11일 밝혔다.
이번 연구에는 KAIST 백무현 교수와 서울아산병원 이주영 교수도 함께 참여했으며 저명 국제 학술지인 미국 화학회지(Journal of the American Chemical Society) 4월 1일 字에 게재됐다. 이 논문은 특히 4월 26일 字 ‘편집장 선정 우수 논문(Editors’Choice Paper)’으로 꼽혀 많은 주목을 받고 있다. (논문명 : Minimalistic Principles for Designing Small Molecules with Multiple Reactivities against Pathological Factors in Dementia)
알츠하이머병은 치매를 일으키는 대표적인 뇌 질환이다. 이 질환의 원인으로 다양한 요소들이 제시됐지만, 원인 인자들 사이의 원리들은 아직도 명확하게 밝혀지지 않고 있다.
알츠하이머병을 일으키는 대표적인 원인 인자로는, 활성 산소종과 아밀로이드 베타, 금속 이온이 알려져 있다. 이 요인들은 개별적으로 질병을 유발할 뿐만 아니라, 상호 작용을 통해 뇌 질환을 더욱 악화시킬 수 있다. 예를 들어, 금속 이온들은 아밀로이드 베타와 결합해 아밀로이드 베타의 응집 속도를 촉진시킬 뿐만 아니라, 활성 산소종들을 과다하게 생성하여 신경독성을 유발할 수 있다. 따라서 이처럼 복잡하게 얽힌 여러 원인 인자들을 동시에 겨냥할 수 있는 새로운 알츠하이머병 치료제 개발이 필요하다.
임 교수 연구팀은 단순한 저분자 화합물의 산화 환원 반응을 이용해 알츠하이머병의 원인 인자들을 손쉽게 조절할 수 있음을 증명했다. 임 교수팀은 산화되는 정도가 다른 화합물들의 합리적 설계를 통해 쉽게 산화되는 화합물들은 알츠하이머 질병의 여러 원인 인자들을 한꺼번에 조절할 수 있다는 사실을 확인했다.
연구 결과, 임 교수 연구팀은 저분자 화합물의 산화 환원 반응으로 활성 산소종에 대한 항산화 작용의 가능성을 확인했을 뿐만 아니라 아밀로이드 베타 또는 금속-아밀로이드 베타의 응집 및 섬유 형성 정도 또한 확연히 감소되는 것을 실험적으로 증명했다.
이 밖에 알츠하이머병에 걸린 동물 모델(실험용 쥐)에 체외 반응성이 좋고 바이오 응용에 적합한 성질을 가지고 있는 대표 저분자 화합물을 주입한 한 결과, 뇌 속에 축적된 아밀로이드 베타의 양이 크게 줄어드는 현상과 함께 알츠하이머 동물 모델의 손상된 인지 능력과 기억력이 향상되는 결과를 확인했다.
이번 연구가 크게 주목받는 이유는 알츠하이머병을 치료하기 위한 화합물을 개발하는 데 있어 아주 단순한 방향족 저분자 화합물의 구조변화를 통해 산화 환원 정도를 조절하여 여러 원인 인자들을 동시에 조절할 수 있고 이러한 간단한 원리를 통해 누구나 손쉽게 치료제를 디자인할 수 있기 때문이다.
임미희 교수는“이번 연구는 아주 단순한 방향족 저분자 화합물의 산화 정도의 차이를 이용해 여러 원인 인자들과의 반응성 유무를 확연히 구분할 수 있다는 점을 증명한 데 의미가 있다”며, “이 방법을 신약 개발의 디자인 방법으로 사용한다면, 비용과 시간을 훨씬 단축시켜 최대의 효과를 가질 수 있다”고 덧붙였다. 임 교수는 이와 함께 “제시된 치료제의 디자인 방법은 다양한 퇴행성 뇌 질환 치료제들의 개발 성공 가능성을 높일 것으로 기대된다”라고 강조했다.
한편 이번 연구는 한국연구재단, 기초과학연구원과 서울아산병원 등의 지원을 받아 수행됐다.
2020.05.11 조회수 19281 계층형 다공성 2차원 탄소 나노시트 합성
생명화학공학과 이진우 교수팀이 서로 다른 크기의 기공을 동시에 갖는 계층형 다공성 2차원 탄소 나노시트를 합성하는 기술을 개발했다.연구팀의 합성기술은 다공성 2차원 탄소 소재의 기공 크기와 구조 및 두께 등의 물성을 정밀하게 제어할 수 있는 새로운 원천 기술로 2차전지, 촉매 분야에서 고용량 전극 소재로 활용될 것으로 기대된다.
김성섭 박사, 주미은 석사가 공동 1 저자로 참여한 이번 연구 결과는 화학 분야 국제 학술지 ‘미국화학회지(Journal of the American Chemical Society, JACS)’ 2월 13일 자 온라인판에 게재됐다. (논문명: Polymer Interfacial Self-Assembly Guided Two-Dimensional Engineering of Hierarchically Porous Carbon Nanosheets)
기존의 다공성 2차원 탄소 소재의 합성은 대부분 그래핀 소재에 기공을 형성하는 방식에 의존하지만, 이는 기공의 크기와 구조를 효율적으로 제어할 수 없다는 한계가 있다. 이를 해결하기 위해서 2차원 나노시트를 주형으로 이용해 블록공중합체의 자기조립 방식을 시도했으나 추가적인 주형의 합성이 필수적이기 때문에 합성 과정이 복잡하고 두께의 조절이 쉽지 않다는 문제가 발생한다.따라서 기공의 크기 등 나노 구조의 제어가 가능하면서도 손쉬운 합성을 할 수 있는 다공성 2차원 탄소 나노시트 합성법 개발의 필요성이 커지고 있다.
이 교수 연구팀은 블록공중합체, 단일중합체 고분자 혼합물의 상 거동을 이용해 마이크로 기공과 메조 기공, 그리고 8.5nm의 두께를 갖는 계층형 다공성 2차원 탄소 나노시트를 합성하는 데 성공했다. 서로 섞이지 않는 두 종류의 단일중합체의 계면 사이에서 블록공중합체와 무기 전구체가 자기조립을 통해서 다공성 구조를 형성하는 원리이다.이 합성 방법은 별도의 주형이 필요하지 않은 간단한 방법으로 기존의 복잡한 과정을 혁신적으로 줄여 생산력을 증대했다. 이를 이용해 연구팀은 계층형 다공성 탄소 나노시트를 차세대 전지인 칼륨이온전지(potassium-ion batteries)의 음극에 적용해 용량을 기존 흑연 소재의 8배 이상 높이는 결과를 얻었다.
연구팀의 합성기술은 블록공중합체의 분자량 및 고분자대비 질량을 조절해 손쉽게 나노구조(기공 크기, 구조, 두께)를 조절할 수 있어 맞춤형 나노소재로 활용할 수 있을 것으로 기대된다. 이진우 교수는 “기존 다공성 2차원 무기 소재 합성기술의 문제점을 고분자 블렌드 성질을 이용해 해결할 수 있음을 보여줬다”라며 “이는 고분자 물리학과 무기 소재 합성을 이어주는 중요한 연구가 되며 다양한 에너지 장치에 적용될 수 있을 것이다”라고 설명했다.
이번 연구는 과학기술정통부와 한국연구재단이 추진하는 C1가스리파이너리 사업, 수소에너지혁신기술개발사업, 기후변화대응기술개발사업 및 미래소재디스커버리사업의 지원을 통해 수행됐다.
2020.03.20 조회수 19535
계층형 다공성 2차원 탄소 나노시트 합성
생명화학공학과 이진우 교수팀이 서로 다른 크기의 기공을 동시에 갖는 계층형 다공성 2차원 탄소 나노시트를 합성하는 기술을 개발했다.연구팀의 합성기술은 다공성 2차원 탄소 소재의 기공 크기와 구조 및 두께 등의 물성을 정밀하게 제어할 수 있는 새로운 원천 기술로 2차전지, 촉매 분야에서 고용량 전극 소재로 활용될 것으로 기대된다.
김성섭 박사, 주미은 석사가 공동 1 저자로 참여한 이번 연구 결과는 화학 분야 국제 학술지 ‘미국화학회지(Journal of the American Chemical Society, JACS)’ 2월 13일 자 온라인판에 게재됐다. (논문명: Polymer Interfacial Self-Assembly Guided Two-Dimensional Engineering of Hierarchically Porous Carbon Nanosheets)
기존의 다공성 2차원 탄소 소재의 합성은 대부분 그래핀 소재에 기공을 형성하는 방식에 의존하지만, 이는 기공의 크기와 구조를 효율적으로 제어할 수 없다는 한계가 있다. 이를 해결하기 위해서 2차원 나노시트를 주형으로 이용해 블록공중합체의 자기조립 방식을 시도했으나 추가적인 주형의 합성이 필수적이기 때문에 합성 과정이 복잡하고 두께의 조절이 쉽지 않다는 문제가 발생한다.따라서 기공의 크기 등 나노 구조의 제어가 가능하면서도 손쉬운 합성을 할 수 있는 다공성 2차원 탄소 나노시트 합성법 개발의 필요성이 커지고 있다.
이 교수 연구팀은 블록공중합체, 단일중합체 고분자 혼합물의 상 거동을 이용해 마이크로 기공과 메조 기공, 그리고 8.5nm의 두께를 갖는 계층형 다공성 2차원 탄소 나노시트를 합성하는 데 성공했다. 서로 섞이지 않는 두 종류의 단일중합체의 계면 사이에서 블록공중합체와 무기 전구체가 자기조립을 통해서 다공성 구조를 형성하는 원리이다.이 합성 방법은 별도의 주형이 필요하지 않은 간단한 방법으로 기존의 복잡한 과정을 혁신적으로 줄여 생산력을 증대했다. 이를 이용해 연구팀은 계층형 다공성 탄소 나노시트를 차세대 전지인 칼륨이온전지(potassium-ion batteries)의 음극에 적용해 용량을 기존 흑연 소재의 8배 이상 높이는 결과를 얻었다.
연구팀의 합성기술은 블록공중합체의 분자량 및 고분자대비 질량을 조절해 손쉽게 나노구조(기공 크기, 구조, 두께)를 조절할 수 있어 맞춤형 나노소재로 활용할 수 있을 것으로 기대된다. 이진우 교수는 “기존 다공성 2차원 무기 소재 합성기술의 문제점을 고분자 블렌드 성질을 이용해 해결할 수 있음을 보여줬다”라며 “이는 고분자 물리학과 무기 소재 합성을 이어주는 중요한 연구가 되며 다양한 에너지 장치에 적용될 수 있을 것이다”라고 설명했다.
이번 연구는 과학기술정통부와 한국연구재단이 추진하는 C1가스리파이너리 사업, 수소에너지혁신기술개발사업, 기후변화대응기술개발사업 및 미래소재디스커버리사업의 지원을 통해 수행됐다.
2020.03.20 조회수 19535 초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
2020.02.21 조회수 15459
초음파를 내비게이션으로 사용하는 광학현미경 개발
생체 내부를 꿰뚫어볼 수 있는 새로운 현미경이 나왔다. 바이오 및 뇌공학과 장무석 교수 연구팀이 기초과학연구원 분자 분광학 및 동력학 연구단 최원식 부연구단장 연구팀과의 공동 연구를 통해 초음파를 이용해 기존 현미경으로 볼 수 없었던 생체 내부의 미세구조를 관찰하는 기법을 개발했다.
연구결과는 국제학술지 네이처 커뮤니케이션즈(Nature Communications)2월 5일자 온라인 판에 게재됐다.
사람의 눈은 250㎜ 떨어진 거리에 70㎜의 간격을 두고 놓인 물체를 구분할 수 있다. 이보다 작은 미세구조를 관찰하기 위해서는 광학현미경이 필요하다. 광학현미경은 눈으로 볼 수 없는 작은 미세구조를 확대해서 보여준다. 하지만 생체조직을 관찰할 때는 이야기가 달라진다.
빛이 생체 조직을 투과할 때 직진광과 산란광이라는 두 종류의 빛이 생겨난다. 직진광은 말 그대로 생체 조직의 영향 없이 직진하는 빛이며, 산란광은 생체 조직 내 세포나 세포 내 구조의 영향에 의해 진행 방향이 무작위로 굴절된 빛이다. 광학 현미경으로 생체 조직 깊은 곳을 관찰하려면 직진광에 비해 산란광이 강해져 이미지 정보가 흐려진다는 치명적인 단점이 있다. 안개 속을 볼 수 없듯, 생체 조직의 수많은 세포와 구조들이 빛을 산란시켜 이미지를 흐리게 만들기 때문이다. 반면, 초음파 영상은 태아를 감별할 수 있을 정도로 생체 내부 깊은 곳까지 이미징할 수 있지만, 해상도가 낮아 미세한 구조를 볼 수 없다는 단점이 있다.
연구진은 광학 현미경과 초음파 영상의 장점을 결합하여, 생체 내부 깊은 곳을 높은 해상도로 관찰할 수 있는 초음파 결합 광학 현미경을 개발했다. 초음파 결합 현미경은 생체 조직 내부를 잘 침투하는 초음파를 집속시킨 후, 초음파의 초점을 지나는 빛만 측정하는 방식으로 산란광의 세기를 크게 감쇄시킬 수 있다. 초음파가 광학현미경에게 관찰 경로를 알려주는 일종의 내비게이션 역할을 하는 셈이다.
초음파는 생체 조직을 응축, 팽창시켜 굴절률을 변조하는 방식으로 빛의 진행에 영향을 준다. 연구진은 이런 초음파의 특성을 응용해 초음파의 초점을 통과하는 빛만을 선택적으로 측정하는 기술을 개발하고, 이 기술을 공간 게이팅(space-gating)이라 명명했다. 초음파는 생체 내부의 ‘빛 거름망’ 역할을 하며 무작위로 산란되던 빛을 차폐한다. 공간 게이팅 기술을 통해 연구진은 산란광을 100배 이상 감쇄시키며 생체 조직 내에서 광학 이미지가 흐려지는 문제를 극복할 수 있었다.
장무석 교수는 “촘촘한 거름망을 사용하면 더 고운 가루만 남는 것처럼 초음파의 초점을 작게 할수록 산란광을 더 많이 감쇄시킬 수 있다”며 “향후 산란광을 1000~1만 배 수준까지 감쇄시켜 더 선명한 이미지를 얻게 될 것으로 기대한다”고 말했다.
연구진은 개발한 현미경을 이용해 별도의 형광 표지 없이 부화한지 30일 된 성체 제브라피시의 척추 안쪽 근육 조직 이미지를 얻는데 성공했다. 기존 기술은 제브라피시의 장기, 척추 등 내부 구조에서 산란 현상이 일어나 절단을 통해서만 내부 근육 결을 관찰할 수 있었다. 이와 달리 개발된 현미경은 자연 상태 그대로 살아있는 제브라피쉬 내부 조직을 꿰뚫어볼 수 있다.
연구진은 인체 조직에도 사용할 수 있는 공간 게이팅 기술을 구현해나갈 계획이다. 향후 현미경을 소형화하고 이미징 속도를 증가시키면, 실시간 질병 진단에도 응용할 수 있을 것으로 기대된다. 이번 연구를 이끈 최원식 부연구단장은 “초음파 결합 광학 현미경은 기존 광학 현미경의 얕은 이미징 깊이 문제를 해결하는 획기적인 기술”이라며 “공간 게이팅 기술을 더욱 발전시켜 빛의 산란 현상을 이해하고, 의생명 광학 기술 분야 활용 범위를 넓혀나갈 것”이라고 말했다.
2020.02.21 조회수 15459 조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09 조회수 20457
조광현 교수, 암세포를 정상세포로 되돌리는 초기 원천기술 개발
우리대학 바이오및뇌공학과 조광현 교수 연구팀이 시스템생물학 연구를 통해 대장암세포를 일반적인 정상 세포로 되돌리는 초기 원천기술을 개발하는 데 성공했다.
연구팀은 대장암세포와 정상 대장 세포의 유전자 조절 네트워크를 분석해 대장암세포를 정상 대장 세포로 변환하는데 필요한 핵심 인자를 규명하고, 이를 통해 암세포의 정상 세포화라는 새로운 치료 원리를 개발했다.
KAIST 이수범 연구원, 황채영, 김동산 박사, 한영현 박사과정, 서울삼성병원의 이찬수 박사, 홍성노 교수, 김석형 교수 등이 참여한 이번 연구결과는 미국암학회(AACR)에서 출간하는 국제저널 ‘분자암연구(Molecular Cancer Research)’ 1월 2일 자 표지논문으로 게재됐으며, 하이라이트 특집 기사도 함께 출판됐다. (논문명: Network inference analysis identifies SETDB1 as a key regulator for reverting colorectal cancer cells into differentiated normal-like cells).
현재 항암치료로 가장 널리 사용되는 항암 화학요법은 빠르게 분열하는 암세포를 공격해 죽임으로써 암세포의 증식을 억제하는 방식이다. 이 기술은 신체 내 정상적으로 분열하고 있는 세포들까지도 함께 사멸시켜 구토, 설사, 탈모, 골수 기능장애, 무기력 등의 부작용을 일으킨다.
게다가 암세포들은 항암제에 본질적인 내성을 갖거나 새로운 내성을 갖게 돼 약물에 높은 저항성을 가지는 암세포로 진화하게 된다. 따라서 현재의 항암치료는 내성을 보이는 암세포를 없애기 위해 더 많은 정상 세포의 사멸을 감수해야만 하는 문제를 갖는다.
이를 극복하기 위해 암세포만을 특이적으로 없애는 표적 항암요법과 우리 몸의 면역시스템을 활용한 면역 항암요법이 주목을 받고 있으나 각각 효과와 적용대상이 매우 제한적이며 장기치료 시 여전히 내성 발생의 문제가 보고되고 있다. 이처럼 현재 개발된 항암요법들은 암세포를 죽여야 하는 공통적인 조건 때문에 근본적인 한계를 가진다.
문제 해결을 위해 연구팀은 암세포를 정상 세포로 변환하는 새로운 방식의의 치료전략을 제안했다. 암세포가 정상 세포로 변환되는 현상은 20세기 초부터 간혹 관찰됐지만, 그 원리가 연구되지 않았으며 또한 이를 인위적으로 제어하는 기술도 연구된 바 없었다.
1907년 스위스 병리학자 막스 아스카나지(Max Askanazy)가 난소의 기형종(테라토마)이 정상 세포로 분화되는 현상을 발견한 이래로 다양한 암종에서 정상 세포로 변화되는 현상들이 산발적으로 보고됐고, 이러한 보고에서는 암세포가 돌연변이를 지닌 상태에서 주변 미세환경의 변화나 특정 자극 때문에 정상 세포의 상태로 되돌아가는 현상만이 관찰됐다.
조 교수 연구팀은 시스템생물학 연구방법을 통해 대장암세포를 정상 대장 세포로 변환할 수 있는 핵심조절인자를 탐구했고, 그 결과 다섯 개의 핵심전사인자(CDX2, ELF3, HNF4G, PPARG, VDR)와 이들의 전사 활성도를 억제하고 있는 후성유전학적 조절인자인 SETDB1을 발견했다.
연구팀은 이번 연구를 통해 SETDB1을 억제함으로써 암세포를 효과적으로 정상 세포로 변환할 수 있음을 분자세포실험을 통해 증명했다. 대장암세포에서 SETDB1을 억제했을 때 세포가 분열을 중지하고 정상 대장 세포의 유전자 발현패턴을 회복하는 것을 확인했다.
이번 연구에 따르면 암세포에서는 암 특이적으로 활성화된 후성유전학적 조절인자 SETDB1이 정상 세포의 핵심전사인자를 억제해 암세포가 정상 세포로 변환하는 것을 차단하고 있는 것으로 밝혀졌다. 즉, SETDB1을 조절함으로써 다시 원래의 정상 세포 상태로 되돌릴 수 있음을 증명한 것이다.
조 교수 연구팀은 서울삼성병원과의 협동 연구를 통해 SETDB1이 높게 발현되는 대장암세포를 가진 환자들에게서 더 안 좋은 예후가 나타남을 확인했으며, 환자 유래 대장암 오가노이드(3차원으로 배양한 장기유사체)에서 SETDB1의 발현을 억제했을 때 다시 정상 세포와 같은 형태로 변화함을 관찰했다.
이번 연구에서 찾아낸 타겟 단백질의 활성을 억제할 수 있는 저분자화합물은 아직 개발된 바 없으며 추후 신약개발과 전임상실험을 통해 암세포의 정상 세포화라는 새로운 치료 기술이 본격적으로 실현될 수 있을 것으로 보인다.
이러한 새로운 개념의 치료전략이 적용된다면 현재 항암치료의 많은 부작용과 내성 발생을 모두 최소화함으로써 환자의 고통을 완화해 삶의 질을 크게 높일 수 있을 것으로 기대된다.
조 교수는 “그동안 암은 유전자 변이 축적에 의한 현상이므로 되돌릴 수 없다고 여겨졌으나 이를 되돌릴 가능성을 보여줬다”라며 “이번 연구는 암을 당뇨나 고혈압과 같은 만성질환으로서 잘 관리하면서 삶의 질을 유지할 수 있도록 하는 새로운 항암치료의 서막을 열었다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, KAIST Grand Challenge 30 사업의 지원으로 수행됐다.
□ 그림 설명
조광현 교수 연구팀은 SETDB1 단백질이 대장암세포가 정상대장세포로 분화하는 것을 차단하는 후성유전학적 장애물을 형성하고 있다는 사실을 밝히고 이를 억제함으로써 대장암세포를 정상대장세포로 효과적으로 분화시킬 수 있음을 증명하였다.
□ 분자암연구 표지 이미지
2020.01.09 조회수 20457 임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25 조회수 11928
임미희 교수, 손상된 뇌 신경교세포 회복 물질 개발
우리 대학 화학과 임미희 교수 연구팀이 손상된 뇌의 신경교세포를 회복시키는 저분자 화합물(Small molecule)을 발견했다.
연구팀의 이번 연구는 기억력 등 인지기능이 저하돼 일상생활의 장애를 유발하는 알츠하이머 등 만성질환의 치료 가능성을 제시할 수 있을 것으로 기대된다.
경북대 의대 박민희 교수가 1 저자로 참여하고 경북대 배재성, 진희경 교수가 공동 교신저자로 참여한 이번 연구는 미국 국립과학원에서 발행하는 국제 학술지 ‘PNAS’ 11월 4일 자 온라인판에 게재됐다.
퇴행성 뇌 질환인 치매의 일종인 알츠하이머병은 다양한 원인에 의해 발생된다. 이 질병을 치료하기 위해서 병의 원인을 정확히 파악하고 그에 맞는 치료제들을 개발하는 것이 무엇보다 중요하다.
아밀로이드-베타 펩타이드는 알츠하이머병과 밀접한 관계가 있다고 알려져 있다. 또한, 뇌의 신경 세포이며 면역 세포인 신경교세포는 신경염증 반응에 중추적인 역할을 한다. 최근 들어, 아밀로이드-베타 펩타이드와 신경교세포의 신경염증 반응 사이의 상관관계가 알츠하이머병을 일으킬 수 있는 주요한 원인으로 주목받고 있다.
신경교세포는 뇌에서 면역기능을 담당하는 신경세포의 일종으로, 탐식기능 및 식세포 작용을 통해 노폐물을 처리하는 역할을 한다.
연구팀은 알츠하이머 동물 모델들에게 저분자 화합물을 주입한 후, 동물들의 인지능력과 뇌 속에 존재하는 베타 아밀로이드의 양을 관찰해 알츠하이머 치료제로서 어떠한 유효한 효과가 있는지 실험했다.
이를 통해 ‘저분자 화합물’이 주입된 동물들은 손상된 신경교세포가 회복돼 뇌 속에 존재하는 베타 아밀로이드 단백질이 감소하는 등 인지능력이 향상된다는 사실을 발견했다.
임미희 교수는 “이 연구는 마이크로글리아의 식세포 작용 손상을 복구시켜 알츠하이머병을 치료할 수 있다는 것을 증명했다”라며 “발견된 합성 분자를 바탕으로 다양한 퇴행성 뇌질환의 치료제 개발에 더욱 박차를 가할 것이다”라고 말했다.
이번 연구는 한국보건산업진흥원, 한국연구재단, KAIST, 그리고 국가과학기술연구회 지원으로 수행됐다.
2019.11.25 조회수 11928 이정용 교수, 유기고분자-양자점 기반 하이브리드 태양전지 개발
〈 이정용 교수 〉
우리 대학 EEWS 대학원 이정용 교수 연구팀과 캐나다 토론토 대학교 전기 및 컴퓨터 공학부 테드 사전트(Ted Sargent) 교수 공동 연구팀이 유기 단분자 물질 도입을 통한 고효율, 고 안정성 유무기 하이브리드 태양전지 제작 기술을 개발했다.
연구팀이 개발한 유기 고분자-양자점 하이브리드 태양전지는 단순 성능 개선을 넘어 기존의 구조에서 성능이 제한된 문제점을 해결할 수 있는 구체적인 방안을 제시하고, 차세대 에너지원으로써 하이브리드 태양전지에 적용할 수 있을 것으로 기대된다.
백세웅, 전선홍 박사, 김병수 박사과정 및 앤드류 프로페(Andrew H. Proppe) 박사가 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 에너지(Nature Energy)’ 11월 11일 자 온라인판에 게재됐다. (논문명: Efficient hybrid colloidal quantum dot/organic solar cells mediated by near-infrared sensitizing small molecules)
높은 기계적 특성 및 흡광 계수를 갖는 유기 고분자와 근적외선 영역을 흡수할 수 있는 콜로이달 양자점을 이용해 제작되는 하이브리드 태양전지는 용액공정으로 제작할 수 있고 두 물질의 장점을 모두 취할 수 있다는 점에서 많은 관심을 받아왔다.
하지만 유기 고분자-양자점 기반의 하이브리드 구조는 낮은 광전변환 효율과 안정성 측면에서 기존의 차세대 태양전지들과 경쟁하기에 부족한 점이 있다.
낮은 전하추출 능력과 그로 인해 발생하는 재결합 문제로 인해 최근까지도 10% 이하의 낮은 광전변환 효율에 머무르는 하이브리드 태양전지의 성능 개선이 필요한 실정이다.
연구팀은 문제 해결을 위해 고분자와 양자점의 매개체 역할을 할 수 있는 새 유기 단분자 구조를 도입했다. 이렇게 유기 단분자 매개체 도입된 유기 고분자-양자점 하이브리드 구조는 기존의 구조보다 다양한 강점을 가진다.
우선 기존의 유기 고분자에서 생성된 엑시톤을 원활하게 추출할 수 있으며, 상호 보완적인 흡광 대역이 형성돼 추가적인 전류 향상을 얻을 수 있고, 계단형 에너지 레벨을 형성해 에너지 및 전하를 효과적으로 운반할 수 있다.
이러한 강점을 통해 연구팀은 13.1%의 광전변환 효율을 달성했으며, 이는 기존의 유기 고분자와 양자점을 이용하는 하이브리드 태양전지보다 30% 이상 높은 효율이다. 그뿐만 아니라 제작 후 약 1천 500시간 이후에도 초기 효율의 90% 성능을 유지했으며, 최대전력조건에서 약 150시간 이후에도 초기 효율의 80% 이상의 성능을 유지했다.
이 교수는 “단분자를 도입해 기존의 하이브리드 구조의 고질적인 한계를 극복하고 고효율의 차세대 태양전지를 구현했다”라며 “개발한 고효율 태양전지는 최근 주목받고 있는 웨어러블 전자기기를 넘어서 모바일, IoT, 드론 및 4차산업에 적용 가능한 차세대 에너지 동력원으로써 주목받게 될 것이다”라고 말했다.
이 연구는 한국연구재단 중견연구자지원사업, 기후변화대응기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 새롭게 제시한 하이브리드 소재 구조의 작동 원리
2019.11.19 조회수 16675
이정용 교수, 유기고분자-양자점 기반 하이브리드 태양전지 개발
〈 이정용 교수 〉
우리 대학 EEWS 대학원 이정용 교수 연구팀과 캐나다 토론토 대학교 전기 및 컴퓨터 공학부 테드 사전트(Ted Sargent) 교수 공동 연구팀이 유기 단분자 물질 도입을 통한 고효율, 고 안정성 유무기 하이브리드 태양전지 제작 기술을 개발했다.
연구팀이 개발한 유기 고분자-양자점 하이브리드 태양전지는 단순 성능 개선을 넘어 기존의 구조에서 성능이 제한된 문제점을 해결할 수 있는 구체적인 방안을 제시하고, 차세대 에너지원으로써 하이브리드 태양전지에 적용할 수 있을 것으로 기대된다.
백세웅, 전선홍 박사, 김병수 박사과정 및 앤드류 프로페(Andrew H. Proppe) 박사가 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 에너지(Nature Energy)’ 11월 11일 자 온라인판에 게재됐다. (논문명: Efficient hybrid colloidal quantum dot/organic solar cells mediated by near-infrared sensitizing small molecules)
높은 기계적 특성 및 흡광 계수를 갖는 유기 고분자와 근적외선 영역을 흡수할 수 있는 콜로이달 양자점을 이용해 제작되는 하이브리드 태양전지는 용액공정으로 제작할 수 있고 두 물질의 장점을 모두 취할 수 있다는 점에서 많은 관심을 받아왔다.
하지만 유기 고분자-양자점 기반의 하이브리드 구조는 낮은 광전변환 효율과 안정성 측면에서 기존의 차세대 태양전지들과 경쟁하기에 부족한 점이 있다.
낮은 전하추출 능력과 그로 인해 발생하는 재결합 문제로 인해 최근까지도 10% 이하의 낮은 광전변환 효율에 머무르는 하이브리드 태양전지의 성능 개선이 필요한 실정이다.
연구팀은 문제 해결을 위해 고분자와 양자점의 매개체 역할을 할 수 있는 새 유기 단분자 구조를 도입했다. 이렇게 유기 단분자 매개체 도입된 유기 고분자-양자점 하이브리드 구조는 기존의 구조보다 다양한 강점을 가진다.
우선 기존의 유기 고분자에서 생성된 엑시톤을 원활하게 추출할 수 있으며, 상호 보완적인 흡광 대역이 형성돼 추가적인 전류 향상을 얻을 수 있고, 계단형 에너지 레벨을 형성해 에너지 및 전하를 효과적으로 운반할 수 있다.
이러한 강점을 통해 연구팀은 13.1%의 광전변환 효율을 달성했으며, 이는 기존의 유기 고분자와 양자점을 이용하는 하이브리드 태양전지보다 30% 이상 높은 효율이다. 그뿐만 아니라 제작 후 약 1천 500시간 이후에도 초기 효율의 90% 성능을 유지했으며, 최대전력조건에서 약 150시간 이후에도 초기 효율의 80% 이상의 성능을 유지했다.
이 교수는 “단분자를 도입해 기존의 하이브리드 구조의 고질적인 한계를 극복하고 고효율의 차세대 태양전지를 구현했다”라며 “개발한 고효율 태양전지는 최근 주목받고 있는 웨어러블 전자기기를 넘어서 모바일, IoT, 드론 및 4차산업에 적용 가능한 차세대 에너지 동력원으로써 주목받게 될 것이다”라고 말했다.
이 연구는 한국연구재단 중견연구자지원사업, 기후변화대응기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 새롭게 제시한 하이브리드 소재 구조의 작동 원리
2019.11.19 조회수 16675 김재경 교수, 수학 모델 통해 세포 상호작용 원리 규명
〈김재경 교수〉
우리 대학 수리과학과 김재경 교수와 라이스 대학 매튜 베넷(Matthew Bennett), 휴스턴 대학 크레시미르 조식(Kresimir Josic) 교수 공동 연구팀이 합성생물학과 수학적 모델을 이용해 세포들이 넓은 공간에서 효과적으로 의사소통하는 방법을 발견했다.
이번 연구 결과는 국제 학술지 ‘네이처 케미컬 바이올로지(Nature Chemical Biology)’ 10월 14일 자 온라인판에 게재됐다. (논문명 :Long-range temporal coordination of gene expression in synthetic microbial consortia)
〈박테리아들의 복잡한 상호작용을 수학을 이용해 원위의 점들의 상호작용으로 단순화한 모식도〉
세포들은 신호 전달 분자(Signalling molecule)를 이용해 의사소통하는데 이 신호는 보통 아주 짧은 거리만 도달할 수 있다. 그런데도 세포들은 넓은 공간에서도 상호작용하며 동기화를 이뤄낸다.
이는 마치 넓은 축구장에 수만 명의 사람이 주변 3~4명의 박수 소리만 들을 수 있는데도 불구하고 모두가 같은 박자로 손뼉을 치는 것과 비슷한 상황이다. 이러한 현상이 가능한 이유는 무엇일까?
연구팀은 합성생물학을 이용해 만든 전사 회로(Transcriptional circuit)를 박테리아(E. coli)에 구축해 주기적으로 신호 전달 분자를 방출할 수 있도록 했다. 처음엔 제각기 다른 시간에 신호 전달 분자를 방출하던 박테리아들은 의사소통을 통해 같은 시간에 주기적으로 분자를 방출하는 동기화를 이뤄냈다.
하지만 박테리아를 넓은 공간으로 옮겼을 땐 이러한 동기화가 각 박테리아의 신호 전달 분자 전사 회로에 전사적 양성 피드백 룹 (Transcriptional positive feedback loop)이 있을 때만 가능하다는 것을 발견했다.
양성 피드백 룹은 단백질이 스스로 유전자 발현을 유도하는 시스템으로, 전달받은 신호를 증폭하는 역할을 한다. 연구팀은 이러한 역할을 자세히 이해하기 위해 편미분방정식(Partial differential equation)을 이용해 세포 내 신호 전달 분자의 생성과 세포 간 의사소통을 정확하게 묘사하는 수학적 모델을 개발했다.
그러나 전사 회로를 구성하는 다양한 종류의 분자들 사이의 상호작용을 묘사하기 위해서는 고차원의 편미분방정식이 필요했고 이를 분석하기는 쉽지 않았다.
이를 극복하기 위해 연구팀은 시스템이 주기적인 패턴을 반복한다는 점에 착안해 고차원 시스템을 1차원 원 위의 움직임으로 단순화했다. 달은 고차원인 우주 공간에서 움직이지만, 궤도를 따라 주기적으로 움직이기에 달의 움직임을 1차원 원 위에서 나타낼 수 있는 것과 같은 원리이다.
이를 통해 연구팀은 박테리아 사이의 복잡한 상호작용을 원 위를 주기적으로 움직이는 두 점의 상호작용으로 단순화할 수 있었다.
연구팀은 양성 피드백 룹이 있으면 두 점의 위치 차이가 커도 시간이 지날수록 점점 차이가 줄어들어 결국 동시에 움직이는 것을 확인했다. 연구팀은 이러한 수학적 분석 결과를 실험을 통해서 검증함으로써 넓은 공간에서 세포가 효과적으로 상호작용하는 방식을 규명했다.
김재경 교수는 “세포들이 자신의 목소리는 낮추고 상대방의 목소리에는 더 귀 기울일 때만 한목소리를 낼 수 있다는 점이 인상적이다”라며 “이러한 원리는 수학을 이용한 복잡한 시스템의 단순화 없이는 찾지 못했을 것이다. 복잡한 것을 단순하게 볼 수 있도록 해주는 것이 수학의 힘이다”라고 말했다.
2019.10.15 조회수 16263
김재경 교수, 수학 모델 통해 세포 상호작용 원리 규명
〈김재경 교수〉
우리 대학 수리과학과 김재경 교수와 라이스 대학 매튜 베넷(Matthew Bennett), 휴스턴 대학 크레시미르 조식(Kresimir Josic) 교수 공동 연구팀이 합성생물학과 수학적 모델을 이용해 세포들이 넓은 공간에서 효과적으로 의사소통하는 방법을 발견했다.
이번 연구 결과는 국제 학술지 ‘네이처 케미컬 바이올로지(Nature Chemical Biology)’ 10월 14일 자 온라인판에 게재됐다. (논문명 :Long-range temporal coordination of gene expression in synthetic microbial consortia)
〈박테리아들의 복잡한 상호작용을 수학을 이용해 원위의 점들의 상호작용으로 단순화한 모식도〉
세포들은 신호 전달 분자(Signalling molecule)를 이용해 의사소통하는데 이 신호는 보통 아주 짧은 거리만 도달할 수 있다. 그런데도 세포들은 넓은 공간에서도 상호작용하며 동기화를 이뤄낸다.
이는 마치 넓은 축구장에 수만 명의 사람이 주변 3~4명의 박수 소리만 들을 수 있는데도 불구하고 모두가 같은 박자로 손뼉을 치는 것과 비슷한 상황이다. 이러한 현상이 가능한 이유는 무엇일까?
연구팀은 합성생물학을 이용해 만든 전사 회로(Transcriptional circuit)를 박테리아(E. coli)에 구축해 주기적으로 신호 전달 분자를 방출할 수 있도록 했다. 처음엔 제각기 다른 시간에 신호 전달 분자를 방출하던 박테리아들은 의사소통을 통해 같은 시간에 주기적으로 분자를 방출하는 동기화를 이뤄냈다.
하지만 박테리아를 넓은 공간으로 옮겼을 땐 이러한 동기화가 각 박테리아의 신호 전달 분자 전사 회로에 전사적 양성 피드백 룹 (Transcriptional positive feedback loop)이 있을 때만 가능하다는 것을 발견했다.
양성 피드백 룹은 단백질이 스스로 유전자 발현을 유도하는 시스템으로, 전달받은 신호를 증폭하는 역할을 한다. 연구팀은 이러한 역할을 자세히 이해하기 위해 편미분방정식(Partial differential equation)을 이용해 세포 내 신호 전달 분자의 생성과 세포 간 의사소통을 정확하게 묘사하는 수학적 모델을 개발했다.
그러나 전사 회로를 구성하는 다양한 종류의 분자들 사이의 상호작용을 묘사하기 위해서는 고차원의 편미분방정식이 필요했고 이를 분석하기는 쉽지 않았다.
이를 극복하기 위해 연구팀은 시스템이 주기적인 패턴을 반복한다는 점에 착안해 고차원 시스템을 1차원 원 위의 움직임으로 단순화했다. 달은 고차원인 우주 공간에서 움직이지만, 궤도를 따라 주기적으로 움직이기에 달의 움직임을 1차원 원 위에서 나타낼 수 있는 것과 같은 원리이다.
이를 통해 연구팀은 박테리아 사이의 복잡한 상호작용을 원 위를 주기적으로 움직이는 두 점의 상호작용으로 단순화할 수 있었다.
연구팀은 양성 피드백 룹이 있으면 두 점의 위치 차이가 커도 시간이 지날수록 점점 차이가 줄어들어 결국 동시에 움직이는 것을 확인했다. 연구팀은 이러한 수학적 분석 결과를 실험을 통해서 검증함으로써 넓은 공간에서 세포가 효과적으로 상호작용하는 방식을 규명했다.
김재경 교수는 “세포들이 자신의 목소리는 낮추고 상대방의 목소리에는 더 귀 기울일 때만 한목소리를 낼 수 있다는 점이 인상적이다”라며 “이러한 원리는 수학을 이용한 복잡한 시스템의 단순화 없이는 찾지 못했을 것이다. 복잡한 것을 단순하게 볼 수 있도록 해주는 것이 수학의 힘이다”라고 말했다.
2019.10.15 조회수 16263 김범준 교수, 빛에 반응해 모양과 색 변하는 스마트 마이크로 입자 개발
〈 김범준 교수, 이준혁 박사, 구강희 박사 〉
우리 대학 생명화학공학과 김범준 교수 연구팀이 빛에 의해 모양과 색을 바꿀 수 있는 스마트 마이크로 입자 제작기술을 개발했다.
아주 작은 입자의 모양이나 색을 원하는 대로 가공(fabrication)할 수 있게 되면 군용장비의 위장막(artificial camouflage), 병든 세포만 표적하는 약물전달캡슐, 투명도 및 색이 변하는 스마트 윈도우나 외부 인테리어 등에 활용할 수 있다.
마이크로 입자의 모양과 색 변화 연구는 주로 약물전달이나 암세포 진단과 같은 생물학적 응용을 위해 산도(pH), 온도, 특정 생체분자 같은 물리화학적 자극과 관련해 주로 이뤄졌다.
하지만 이런 자극들은 의도하는 국소부위에만 전달하기 어렵고 자극 스위치를 명확하게 켜고 끄기 어려운 것이 단점이었다.
반면 빛은 원하는 시간 동안 특정부위에만 쬐어줄 수 있고 파장과 세기를 정밀하게 조절, 선택적·순차적으로 입자 모양을 변형시킬 수 있어 해상도 높은 자극으로 주목받는다.
하지만 기존 빛에 감응하는 스마트 입자는 제작방법이 복잡하고, 편광방향으로의 길이 연장만 가능한 등 정밀한 모양변화가 어려워 활용에 한계가 있었다.
연구팀은 빛에 의해 분자구조가 변해 친수성 정도나 광학적 특성을 조절할 수 있는 계면활성제*를 개발하고 이들의 자가조립방식을 기반으로 빛에 반응해 모양과 색깔이 변하는 수 마이크로미터 크기의 스마트 입자를 대량으로 제작하는 데 성공했다.
빛을 쬐어준 시간과 파장에 따라 구형에서 타원체, 튤립, 렌즈형태 등으로 변화시킬 수 있는 한편 입자의 색도 조절할 수 있다.
또한 100μm 이하의 국소 부위에만 빛을 조사함으로써 원하는 위치에서 원하는 모양을 정교하게 유도할 수 있다.
특히 반응하는 빛의 파장이 서로 다른 계면활성제를 활용하면 입자 모양의 변화를 여러 단계로 조절하거나 원래의 모양으로 되돌리는 변화가 가능하다.
이러한 스마트 입자로 만들어진 박막이나 용액은 그 성질을 정밀하게 조절할 수 있어 정보를 담거나 신호를 넣을 수 있는 스마트 소재로도 활용할 수 있다.
과학기술정보통신부와 한국연구재단이 추진하는 미래소재디스커버리사업, 글로벌프론티어사업 및 중견연구자지원사업의 지원으로 수행된 이번 연구의 결과는 화학 분야 국제학술지 잭스(JACS, Journal of the American Chemical Society)에 9월 4일 게재되는 한편 표지 논문으로 선정됐다.
김범준 교수는 “빛을 이용해 모양과 색이 조절되는 스마트 입자 제작 플랫폼을 개발한 것으로 빛을 신호로 국소부위 입자의 성질을 정밀하게 조절할 수 있어 스마트 디스플레이, 센서, 도료, 약물전달 등에 응용될 수 있을 것으로 기대된다.”고 설명했다.
□ 그림 설명
그림1. 김범준 교수 연구성과 개념도
2019.09.09 조회수 18366
김범준 교수, 빛에 반응해 모양과 색 변하는 스마트 마이크로 입자 개발
〈 김범준 교수, 이준혁 박사, 구강희 박사 〉
우리 대학 생명화학공학과 김범준 교수 연구팀이 빛에 의해 모양과 색을 바꿀 수 있는 스마트 마이크로 입자 제작기술을 개발했다.
아주 작은 입자의 모양이나 색을 원하는 대로 가공(fabrication)할 수 있게 되면 군용장비의 위장막(artificial camouflage), 병든 세포만 표적하는 약물전달캡슐, 투명도 및 색이 변하는 스마트 윈도우나 외부 인테리어 등에 활용할 수 있다.
마이크로 입자의 모양과 색 변화 연구는 주로 약물전달이나 암세포 진단과 같은 생물학적 응용을 위해 산도(pH), 온도, 특정 생체분자 같은 물리화학적 자극과 관련해 주로 이뤄졌다.
하지만 이런 자극들은 의도하는 국소부위에만 전달하기 어렵고 자극 스위치를 명확하게 켜고 끄기 어려운 것이 단점이었다.
반면 빛은 원하는 시간 동안 특정부위에만 쬐어줄 수 있고 파장과 세기를 정밀하게 조절, 선택적·순차적으로 입자 모양을 변형시킬 수 있어 해상도 높은 자극으로 주목받는다.
하지만 기존 빛에 감응하는 스마트 입자는 제작방법이 복잡하고, 편광방향으로의 길이 연장만 가능한 등 정밀한 모양변화가 어려워 활용에 한계가 있었다.
연구팀은 빛에 의해 분자구조가 변해 친수성 정도나 광학적 특성을 조절할 수 있는 계면활성제*를 개발하고 이들의 자가조립방식을 기반으로 빛에 반응해 모양과 색깔이 변하는 수 마이크로미터 크기의 스마트 입자를 대량으로 제작하는 데 성공했다.
빛을 쬐어준 시간과 파장에 따라 구형에서 타원체, 튤립, 렌즈형태 등으로 변화시킬 수 있는 한편 입자의 색도 조절할 수 있다.
또한 100μm 이하의 국소 부위에만 빛을 조사함으로써 원하는 위치에서 원하는 모양을 정교하게 유도할 수 있다.
특히 반응하는 빛의 파장이 서로 다른 계면활성제를 활용하면 입자 모양의 변화를 여러 단계로 조절하거나 원래의 모양으로 되돌리는 변화가 가능하다.
이러한 스마트 입자로 만들어진 박막이나 용액은 그 성질을 정밀하게 조절할 수 있어 정보를 담거나 신호를 넣을 수 있는 스마트 소재로도 활용할 수 있다.
과학기술정보통신부와 한국연구재단이 추진하는 미래소재디스커버리사업, 글로벌프론티어사업 및 중견연구자지원사업의 지원으로 수행된 이번 연구의 결과는 화학 분야 국제학술지 잭스(JACS, Journal of the American Chemical Society)에 9월 4일 게재되는 한편 표지 논문으로 선정됐다.
김범준 교수는 “빛을 이용해 모양과 색이 조절되는 스마트 입자 제작 플랫폼을 개발한 것으로 빛을 신호로 국소부위 입자의 성질을 정밀하게 조절할 수 있어 스마트 디스플레이, 센서, 도료, 약물전달 등에 응용될 수 있을 것으로 기대된다.”고 설명했다.
□ 그림 설명
그림1. 김범준 교수 연구성과 개념도
2019.09.09 조회수 18366 김재경 교수, 수학적 모델링 통해 신약 개발 걸림돌 해소
〈 김대욱 박사과정, 김재경 교수 〉
우리 대학 수리과학과 김재경 교수와 글로벌 제약회사 화이자(Pfizer)의 장 청(Cheng Chang) 박사 공동연구팀이 수학적 모델을 기반으로 동물 실험과 임상 시험 간 차이가 발생하는 원인을 밝히고 그 해결책을 제시했다.
연구팀은 일주기 리듬 수면 장애 신약을 개발하는 과정에서 동물 실험과 임상 시험 간 발생하는 차이 문제를 수학적 모델을 이용해 해결함으로써 신약 개발의 가능성을 높였다. 또한, 동물과 사람 간 차이 뿐 아니라 사람마다 발생하는 약효의 차이 발생 원인도 밝혀냈다.
김대욱 박사과정이 1 저자로 참여한 이번 연구결과는 국제 학술지 ‘분자 시스템 생물학 (Molecular Systems Biology)’ 7월 8일자 온라인판에 게재됐고, 우수성을 인정받아 7월호 표지논문으로 선정됐다. (논문명 : Systems approach reveals photosensitivity and PER2 level as determinants of clock-modulator efficacy)
신약을 개발하기 위해 임상 시험 전 단계로 쥐 등의 동물을 대상으로 전임상 실험을 하게 된다. 이 과정에서 동물에서 보였던 효과가 사람에게선 보이지 않을 때가 종종 있고 사람마다 효과가 다르게 나타나기도 한다. 이러한 약효의 차이가 발생하는 원인을 찾지 못하면 신약 개발에 큰 걸림돌이 된다.
수면 장애는 맞춤형 치료 분야에서 개발이 가장 더딘 질병 중 하나이다. 쥐는 사람과 달리 수면시간이 반대인 야행성 동물이다 보니 수면시간을 조절할 수 있는 치료제가 실험 쥐에게는 효과가 있어도 사람에게는 무효한 경우가 많았다. 하지만 그 원인이 알려지지 않아 신약 개발에 어려움이 있었다.
연구팀은 이러한 차이의 원인을 미분방정식을 이용한 가상실험과 실제 실험을 결합해 연구했고, 주행성인 사람은 야행성인 쥐에 비해 빛 노출 때문에 약효가 더 많이 반감되는 것이 원인임을 밝혔다. 이는 빛 노출 조절을 통해 그동안 사람에게 보이지 않던 약효가 발현되게 할 수 있음을 뜻한다.
수면 장애 치료 약물의 약효가 사람마다 큰 차이를 보이는 것도 신약 개발의 걸림돌이었다. 연구팀은 증상이 비슷해도 환자마다 약효 차이가 나타나는 원인을 밝히기 위해 수리 모델링을 이용한 가상환자를 이용했다.
이를 통해 약효가 달라지는 원인은 수면시간을 결정하는 핵심 역할을 하는 생체시계 단백질인 PER2의 발현량이 달라서임을 규명했다.
또한, PER2의 양이 낮에는 증가하고 밤에는 감소하기 때문에 하루 중 언제 투약하느냐에 따라 약효가 바뀜을 이용해 환자마다 적절한 투약 시간을 찾아 최적의 치료 효과를 가져오는 시간요법(Chronotherapy)를 개발했다.
김재경 교수는 “수학이 실제 의약학 분야에 이바지해 우리가 좀 더 건강하고 행복한 삶을 살 수 있는데 도울 수 있어 행복한 연구였다”라며 “이번 성과를 통해 국내에선 아직은 부족한 의약학과 수학의 교류가 활발해지길 기대한다”라고 말했다.
□ 그림 설명
그림1. 김재경 교수 연구팀 성과 개념도
그림2. 맞춤형 시간 치료법 (Chronotherapy) 개념도
2019.07.09 조회수 24898
김재경 교수, 수학적 모델링 통해 신약 개발 걸림돌 해소
〈 김대욱 박사과정, 김재경 교수 〉
우리 대학 수리과학과 김재경 교수와 글로벌 제약회사 화이자(Pfizer)의 장 청(Cheng Chang) 박사 공동연구팀이 수학적 모델을 기반으로 동물 실험과 임상 시험 간 차이가 발생하는 원인을 밝히고 그 해결책을 제시했다.
연구팀은 일주기 리듬 수면 장애 신약을 개발하는 과정에서 동물 실험과 임상 시험 간 발생하는 차이 문제를 수학적 모델을 이용해 해결함으로써 신약 개발의 가능성을 높였다. 또한, 동물과 사람 간 차이 뿐 아니라 사람마다 발생하는 약효의 차이 발생 원인도 밝혀냈다.
김대욱 박사과정이 1 저자로 참여한 이번 연구결과는 국제 학술지 ‘분자 시스템 생물학 (Molecular Systems Biology)’ 7월 8일자 온라인판에 게재됐고, 우수성을 인정받아 7월호 표지논문으로 선정됐다. (논문명 : Systems approach reveals photosensitivity and PER2 level as determinants of clock-modulator efficacy)
신약을 개발하기 위해 임상 시험 전 단계로 쥐 등의 동물을 대상으로 전임상 실험을 하게 된다. 이 과정에서 동물에서 보였던 효과가 사람에게선 보이지 않을 때가 종종 있고 사람마다 효과가 다르게 나타나기도 한다. 이러한 약효의 차이가 발생하는 원인을 찾지 못하면 신약 개발에 큰 걸림돌이 된다.
수면 장애는 맞춤형 치료 분야에서 개발이 가장 더딘 질병 중 하나이다. 쥐는 사람과 달리 수면시간이 반대인 야행성 동물이다 보니 수면시간을 조절할 수 있는 치료제가 실험 쥐에게는 효과가 있어도 사람에게는 무효한 경우가 많았다. 하지만 그 원인이 알려지지 않아 신약 개발에 어려움이 있었다.
연구팀은 이러한 차이의 원인을 미분방정식을 이용한 가상실험과 실제 실험을 결합해 연구했고, 주행성인 사람은 야행성인 쥐에 비해 빛 노출 때문에 약효가 더 많이 반감되는 것이 원인임을 밝혔다. 이는 빛 노출 조절을 통해 그동안 사람에게 보이지 않던 약효가 발현되게 할 수 있음을 뜻한다.
수면 장애 치료 약물의 약효가 사람마다 큰 차이를 보이는 것도 신약 개발의 걸림돌이었다. 연구팀은 증상이 비슷해도 환자마다 약효 차이가 나타나는 원인을 밝히기 위해 수리 모델링을 이용한 가상환자를 이용했다.
이를 통해 약효가 달라지는 원인은 수면시간을 결정하는 핵심 역할을 하는 생체시계 단백질인 PER2의 발현량이 달라서임을 규명했다.
또한, PER2의 양이 낮에는 증가하고 밤에는 감소하기 때문에 하루 중 언제 투약하느냐에 따라 약효가 바뀜을 이용해 환자마다 적절한 투약 시간을 찾아 최적의 치료 효과를 가져오는 시간요법(Chronotherapy)를 개발했다.
김재경 교수는 “수학이 실제 의약학 분야에 이바지해 우리가 좀 더 건강하고 행복한 삶을 살 수 있는데 도울 수 있어 행복한 연구였다”라며 “이번 성과를 통해 국내에선 아직은 부족한 의약학과 수학의 교류가 활발해지길 기대한다”라고 말했다.
□ 그림 설명
그림1. 김재경 교수 연구팀 성과 개념도
그림2. 맞춤형 시간 치료법 (Chronotherapy) 개념도
2019.07.09 조회수 24898 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 24164
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 24164