%EB%B0%94%EC%9D%B4%EC%98%A4%EB%B0%8F%EB%87%8C%EA%B3%B5%ED%95%99%EA%B3%BC
-
 조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10 조회수 23527
조광현 교수, 뇌의 제어구조 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌 영역 간 복잡한 연결 네트워크에 내재된 뇌의 제어구조를 규명했다.
이번 연구를 통해 뇌의 동작 원리에 대한 이해를 높이고, 뇌의 제어구조 분석을 통해 뇌 질환 연구 및 치료에 응용될 수 있을 것으로 기대된다. 또한 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학을 통해 규명했다는 의의가 있다.
이병욱 박사, 강의룡, 장홍준 박사과정이 참여한 이번 연구는 셀(Cell) 출판사가 펴내는 융합과학 국제학술지 ‘아이사이언스(iScience)’ 3월 29일 자에 게재됐다.
뇌의 다양한 인지기능은 뇌 영역들 사이의 복잡한 연결을 통한 영역 간 상호작용으로 이뤄진다. 최근 뇌의 연결성에 대한 정보가 뇌의 동작 원리를 파악하는 핵심이라는 의견이 대두되면서 세계적으로 뇌 연결성을 파악하기 위한 커넥톰(Connectome) 연구가 활발히 이뤄지고 있다.
이를 통해 뇌 영역 사이의 구체적 연결성이 파악되고 있지만 복잡한 연결성에 내재된 뇌의 동작 원리에 대한 이해는 아직 매우 부족한 상황이다. 특히 뇌의 강건하면서 효율적 정보처리 능력의 기반이 되는 뇌의 숨겨진 제어구조는 파악된 내용이 없다.
조 교수 연구팀은 뇌의 제어구조 분석을 위해 ‘미국국립보건원(NIH) 휴먼 커넥톰 프로젝트(Human Connectome Project)’에서 제공하는 정상인의 뇌 영상 이미지 데이터를 활용해 뇌 영영 간 네트워크를 구축했다.
이후 연구팀은 그래프 이론의 최소지배집합(minimum dominating set) 개념을 활용해 뇌 영역 간 복잡한 연결 네트워크의 제어구조를 분석했다.
최소지배집합이란 네트워크의 각 노드(뇌의 각 영역)가 링크(뇌의 서로 다른 영역간의 연결)로 연결된 이웃 노드에 직접적 영향을 줘 기능을 제어할 수 있다고 가정할 때, 네트워크를 구성하는 모든 노드를 제어하는 데 필요한 최소한의 노드 집합을 말한다.
기존 여러 연구를 통해 다양한 생체 네트워크 및 통신망, 전력망 등의 복잡계 네트워크를 제어하는 데 있어서 최소지배집합이 핵심적인 역할을 한다는 것이 보고된 바 있다.
연구팀은 최소지배집합을 기반으로 ‘제어영역의 분포(distribution of control)’와 ‘제어영역의 중첩(overlap in control area)’이라는 두 가지 지표를 정의한 뒤 이를 기준으로 총 네 종류의 제어구조를 정의했다.
이후 연구팀은 브레인 네트워크를 비롯해 도로망, 통신망, 소셜 네트워크 등 실존하는 다양한 복잡계 네트워크가 어떤 제어구조를 갖는지 분석했다. 분석 결과 뇌는 다른 대부분 네트워크와는 달리 제어영역이 분산된 동시에 서로 중첩된 특이한 구조로 이뤄짐을 밝혀냈다.
뇌의 이러한 제어구조는 외부 섭동에 의한 네트워크의 높은 강건성을 유지하면서 동시에 여러 인지기능을 효율적으로 수행하기 위한 영역들의 상호 활성화를 다양하게 하기 위한 것임을 밝혔다.
IT와 BT가 융합된 시스템생물학 접근을 통한 브레인 네트워크의 구조분석은 인공지능의 발전에도 기여할 것으로 보인다. 브레인 네트워크의 진화적 설계원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다.
조 교수는 “지금껏 뇌의 제어구조가 밝혀진 바가 없었다”라며 “복잡한 연결성에 숨겨진 브레인 네트워크의 진화적 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작 원리를 파악할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뇌의 제어구조 규명
그림2. 뇌 영역 간 네트워크 구축
2019.04.10 조회수 23527 -
 이상완 교수, 신경과학-인공지능 융합으로 공학적 난제 해결
〈 (왼쪽부터) 안수진 박사과정, 이지항 박사, 이상완 교수 〉
우리 대학 바이오및뇌공학과 이상완 교수 연구팀이 영국 케임브리지 대학, 구글 딥마인드와의 공동 연구를 통해 차세대 뇌 기반 인공지능 시스템 설계의 방향을 제시했다.
이번 연구는 인간의 두뇌가 기존의 인공지능 알고리즘이 해결하지 못하는 부분을 해결할 수 있다는 사실에 기반한 신경과학-인공지능 융합 연구이다.
성능, 효율, 속도의 균형적 설계와 같은 다양한 공학적 난제를 해결할 수 있는 신경과학 기반 강화학습 이론을 제안한 것으로 새로운 인공지능 알고리즘 설계에 긍정적인 영향을 줄 것으로 기대된다.
이상완 교수와 함께 이지항 박사, 안수진 박사과정이 주도한 이번 연구는 국제 학술지 사이언스의 자매지 ‘사이언스 로보틱스(Science Robotics)’ 1월 16일 자 온라인판에 포커스 형식으로 게재됐다.
최적제어 이론에서 출발한 강화학습은 기계 학습의 한 영역으로 지난 20여 년 동안 꾸준히 연구된 분야이다. 특히 지난 5년 동안은 딥러닝 기술을 발전과 맞물려 급격한 성장을 이뤘다.
딥러닝 기반 강화학습 알고리즘은 최근 알파고와 같은 전략 탐색 문제, 로봇 제어, 응급실 비상 대응 시스템과 같은 의료 진단 등 다양한 분야에 적용되고 있다. 그러나 주어진 문제에 맞게 시스템을 설계해야 하는 점, 불확실성이 높은 환경에서는 성능이 보장되지 않는 점 등이 근본적인 해결책으로 남아있다.
강화학습은 의사 결정 및 계산신경과학 분야에서도 지난 20년간 꾸준히 연구되고 있다. 이상완 교수는 2014년 인간의 전두엽-기저핵 뇌 회로에서 이종 강화학습을 제어한다는 신경과학적 증거를 학계에 발표한 바 있다. 2015년에는 같은 뇌 회로에서 고속 추론 과정을 제어한다는 연구를 발표했다.
연구팀은 이번 연구에서 강화학습 등의 개별 인공지능 알고리즘이 해결하지 못하는 공학적 문제를 인간의 두뇌가 이미 해결하고 있다는 사실에 기반한 ‘전두엽 메타 제어’ 이론을 제안했다.
중뇌 도파민-복외측전전두피질 네트워크에서 외부 환경에 대한 학습의 신뢰도를 스스로 평가할 수 있는 보상 예측 신호나 상태 예측 신호와 같은 정보를 처리하며, 인간의 두뇌는 이 정보들을 경쟁적-협력적으로 통합하는 프로세스를 통해 외부 환경에 가장 적합한 학습 및 추론 전략을 찾는다는 것이 이론의 핵심이다.
이러한 원리를 단일 인공지능 알고리즘이나 로봇설계에 적용하면 외부 상황변화에 강인하게 성능, 효율, 속도 세 조건(performance-efficiency-speed tradeoff) 사이의 균형점을 유지하는 최적의 제어 시스템을 설계할 수 있다. 더 나아가 다수의 인공지능 개체가 협력하는 상황에서는 서로의 전략을 이용함으로 협력-경쟁 사이의 균형점을 유지할 수 있다.
1 저자인 이지항 박사는 “현대 인공지능의 우수한 성능은 사람의 행동 수준 관찰뿐 아니라 두뇌의 저수준 신경 시스템을 알고리즘으로 구현해 적극적으로 발전시킨 결과라고 보고 있다”라며 “이번 연구는 계산신경과학에 기반한 결과로 현대 딥러닝과 강화학습에서 겪는 성능, 효율, 속도 사이의 난제를 해결하는 실마리가 될 수 있고, 새로운 인공지능 알고리즘 설계에 많은 영감을 줄 것이다”라고 말했다.
이상완 교수는 “연구를 하다 보면 우리의 두뇌는 공학적 난제를 의외로 쉽게 해결하고 있음을 알 수 있다. 이 원리를 인공지능 알고리즘 설계에 적용하는 뇌 기반 인공지능 연구는 구글 딥마인드, MIT, 캘리포니아 공과대학, UCL 등 해외 유수 기관에서도 관심을 두는 신경과학-인공지능 융합 연구 분야이다”라며 “장기적으로는 차세대 인공지능 핵심 연구 분야 중의 하나로 자리를 잡을 것으로 기대한다”라고 말했다.
이번 연구는 과학기술정보통신부 및 정보통신기술진흥센터 연구개발 사업, 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 외부 환경에 따라 성능-효율-속도 문제 균형점을 찾는 뇌기반 강화학습 이론 (좌), 이를 최적 제어하는 ‘전두엽 메타 제어’(중) 및 로보틱스 분야 문제 해결 적용 사례 (우)
2019.01.24 조회수 13501
이상완 교수, 신경과학-인공지능 융합으로 공학적 난제 해결
〈 (왼쪽부터) 안수진 박사과정, 이지항 박사, 이상완 교수 〉
우리 대학 바이오및뇌공학과 이상완 교수 연구팀이 영국 케임브리지 대학, 구글 딥마인드와의 공동 연구를 통해 차세대 뇌 기반 인공지능 시스템 설계의 방향을 제시했다.
이번 연구는 인간의 두뇌가 기존의 인공지능 알고리즘이 해결하지 못하는 부분을 해결할 수 있다는 사실에 기반한 신경과학-인공지능 융합 연구이다.
성능, 효율, 속도의 균형적 설계와 같은 다양한 공학적 난제를 해결할 수 있는 신경과학 기반 강화학습 이론을 제안한 것으로 새로운 인공지능 알고리즘 설계에 긍정적인 영향을 줄 것으로 기대된다.
이상완 교수와 함께 이지항 박사, 안수진 박사과정이 주도한 이번 연구는 국제 학술지 사이언스의 자매지 ‘사이언스 로보틱스(Science Robotics)’ 1월 16일 자 온라인판에 포커스 형식으로 게재됐다.
최적제어 이론에서 출발한 강화학습은 기계 학습의 한 영역으로 지난 20여 년 동안 꾸준히 연구된 분야이다. 특히 지난 5년 동안은 딥러닝 기술을 발전과 맞물려 급격한 성장을 이뤘다.
딥러닝 기반 강화학습 알고리즘은 최근 알파고와 같은 전략 탐색 문제, 로봇 제어, 응급실 비상 대응 시스템과 같은 의료 진단 등 다양한 분야에 적용되고 있다. 그러나 주어진 문제에 맞게 시스템을 설계해야 하는 점, 불확실성이 높은 환경에서는 성능이 보장되지 않는 점 등이 근본적인 해결책으로 남아있다.
강화학습은 의사 결정 및 계산신경과학 분야에서도 지난 20년간 꾸준히 연구되고 있다. 이상완 교수는 2014년 인간의 전두엽-기저핵 뇌 회로에서 이종 강화학습을 제어한다는 신경과학적 증거를 학계에 발표한 바 있다. 2015년에는 같은 뇌 회로에서 고속 추론 과정을 제어한다는 연구를 발표했다.
연구팀은 이번 연구에서 강화학습 등의 개별 인공지능 알고리즘이 해결하지 못하는 공학적 문제를 인간의 두뇌가 이미 해결하고 있다는 사실에 기반한 ‘전두엽 메타 제어’ 이론을 제안했다.
중뇌 도파민-복외측전전두피질 네트워크에서 외부 환경에 대한 학습의 신뢰도를 스스로 평가할 수 있는 보상 예측 신호나 상태 예측 신호와 같은 정보를 처리하며, 인간의 두뇌는 이 정보들을 경쟁적-협력적으로 통합하는 프로세스를 통해 외부 환경에 가장 적합한 학습 및 추론 전략을 찾는다는 것이 이론의 핵심이다.
이러한 원리를 단일 인공지능 알고리즘이나 로봇설계에 적용하면 외부 상황변화에 강인하게 성능, 효율, 속도 세 조건(performance-efficiency-speed tradeoff) 사이의 균형점을 유지하는 최적의 제어 시스템을 설계할 수 있다. 더 나아가 다수의 인공지능 개체가 협력하는 상황에서는 서로의 전략을 이용함으로 협력-경쟁 사이의 균형점을 유지할 수 있다.
1 저자인 이지항 박사는 “현대 인공지능의 우수한 성능은 사람의 행동 수준 관찰뿐 아니라 두뇌의 저수준 신경 시스템을 알고리즘으로 구현해 적극적으로 발전시킨 결과라고 보고 있다”라며 “이번 연구는 계산신경과학에 기반한 결과로 현대 딥러닝과 강화학습에서 겪는 성능, 효율, 속도 사이의 난제를 해결하는 실마리가 될 수 있고, 새로운 인공지능 알고리즘 설계에 많은 영감을 줄 것이다”라고 말했다.
이상완 교수는 “연구를 하다 보면 우리의 두뇌는 공학적 난제를 의외로 쉽게 해결하고 있음을 알 수 있다. 이 원리를 인공지능 알고리즘 설계에 적용하는 뇌 기반 인공지능 연구는 구글 딥마인드, MIT, 캘리포니아 공과대학, UCL 등 해외 유수 기관에서도 관심을 두는 신경과학-인공지능 융합 연구 분야이다”라며 “장기적으로는 차세대 인공지능 핵심 연구 분야 중의 하나로 자리를 잡을 것으로 기대한다”라고 말했다.
이번 연구는 과학기술정보통신부 및 정보통신기술진흥센터 연구개발 사업, 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 외부 환경에 따라 성능-효율-속도 문제 균형점을 찾는 뇌기반 강화학습 이론 (좌), 이를 최적 제어하는 ‘전두엽 메타 제어’(중) 및 로보틱스 분야 문제 해결 적용 사례 (우)
2019.01.24 조회수 13501 -
 정기훈 교수, 곤충 눈 구조 모방한 초박형 카메라 개발
〈 왼쪽부터 장경원 박사과정, 정기훈 교수, 황순홍 박사과정 〉
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 독특한 눈 구조를 가진 곤충인 제노스 페키(Xenos peckii)를 모사한 초박형 디지털카메라를 개발했다.
제노스 페키를 모사해 개발한 초박형 디지털카메라는 기존 이미징 시스템보다 더 얇으면서 상대적으로 넓은 광시야각과 높은 분해능을 갖는다. 감시 및 정찰 장비, 의료용 영상기기, 모바일 등 다양한 소형 이미징 시스템에 적용 가능할 것으로 기대된다.
금동민, 장경원 박사과정이 주도한 이번 연구결과는 국제 학술지 ‘빛 : 과학과 응용(Light : Science & Applications)’ 10월 24일 자에 게재됐다. (논문명: 제노스 페키의 시각기관을 모사한 초박형 디지털카메라, Xenos peckii vision inspires an ultrathin digital camera)
정 교수 연구팀은 자연계에서 발견되는 광학 구조를 모방하는 연구를 꾸준히 진행해 왔다. 반딧불이의 배 마디 구조를 분석해 광효율을 높은 LED 렌즈를 개발한 바 있고, 생체모사를 통한 무반사 기판을 제작하는 등 해당 분야를 선도하고 있다.
최근 전자기기 및 광학기기의 소형화로 초박형 디지털카메라에 대한 수요가 증가하고 있다. 그러나 기존의 카메라 모듈은 광학적 수차를 줄이기 위해 광축을 따라 복수의 렌즈로 구성돼 있어 부피가 매우 크다는 단점이 있다. 이런 모듈을 단순히 크기만 줄여 소형기기에 적용하면 분해능과 감도가 떨어지게 된다.
연구팀은 문제 해결을 위해 곤충인 제노스 페키의 시각구조를 적용한 렌즈를 제작했고 이를 이미지 센서와 결합한 초박형 디지털카메라를 개발했다.
곤충의 겹눈구조는 수백, 수천 개의 오마티디아라 불리는 아주 작은 광학 구조로 이뤄져 있다. 일반적인 겹눈구조는 수백, 수천 개의 오마티디아에서 한 개의 영상을 얻지만, 제노스 페키는 다른 곤충과는 달리 각 오마티디아에서 개별의 영상을 획득할 수 있다. 또한 오마티디아 사이에 빛을 흡수할 수 있는 독특한 구조를 가져 각 영상 간 간섭을 막는다.
연구팀이 개발한 카메라는 2mm 이내의 매우 작은 크기로 제노스 페키의 겹눈구조를 모방해 수십 개의 마이크로프리즘 어레이와 마이크로렌즈 어레이로 구성된다. 마이크로프리즘과 마이크로렌즈가 한 쌍으로 채널을 이루고 있으며 각각의 채널 사이에는 빛을 흡수하는 중합체가 존재하며 각 채널 간 간섭을 막는다.
각각의 채널은 화면의 다른 부분들을 보고 있으며 각 채널에서 관측된 영상들은 영상처리를 통해 하나의 영상으로 복원돼 넓은 광시야각과 높은 분해능을 확보할 수 있다.
정기훈 교수는 “초박형 카메라를 제작하는 새로운 방법을 제시했다”며 “이 연구는 기존의 평면 CMOS 이미지 센서 어레이에 마이크로 카메라를 완전히 장착한 초박형 곤충 눈 카메라의 첫 번째 데모이며 다양한 광학 분야에 큰 영향을 미칠 것으로 확신한다.”라고 말했다.
□ 그림 설명
그림1. (좌) 제노스 페키의 SEM 영상. (우) 형광 염색된 제노스 페키의 시각구조
그림2. (좌) MEMS 공정을 통해 제작된 마이크로프리즘 어레이의 SEM 영상. (우) 완성된 초박형 디지털 카메라의 광학 영상
그림3. (좌) Xenos peckii의 시각기관을 통해 얻은 영상. (우) 초박형 디지털 카메라를 통해 얻은 영상
2018.11.20 조회수 11481
정기훈 교수, 곤충 눈 구조 모방한 초박형 카메라 개발
〈 왼쪽부터 장경원 박사과정, 정기훈 교수, 황순홍 박사과정 〉
우리 대학 바이오및뇌공학과 정기훈 교수 연구팀이 독특한 눈 구조를 가진 곤충인 제노스 페키(Xenos peckii)를 모사한 초박형 디지털카메라를 개발했다.
제노스 페키를 모사해 개발한 초박형 디지털카메라는 기존 이미징 시스템보다 더 얇으면서 상대적으로 넓은 광시야각과 높은 분해능을 갖는다. 감시 및 정찰 장비, 의료용 영상기기, 모바일 등 다양한 소형 이미징 시스템에 적용 가능할 것으로 기대된다.
금동민, 장경원 박사과정이 주도한 이번 연구결과는 국제 학술지 ‘빛 : 과학과 응용(Light : Science & Applications)’ 10월 24일 자에 게재됐다. (논문명: 제노스 페키의 시각기관을 모사한 초박형 디지털카메라, Xenos peckii vision inspires an ultrathin digital camera)
정 교수 연구팀은 자연계에서 발견되는 광학 구조를 모방하는 연구를 꾸준히 진행해 왔다. 반딧불이의 배 마디 구조를 분석해 광효율을 높은 LED 렌즈를 개발한 바 있고, 생체모사를 통한 무반사 기판을 제작하는 등 해당 분야를 선도하고 있다.
최근 전자기기 및 광학기기의 소형화로 초박형 디지털카메라에 대한 수요가 증가하고 있다. 그러나 기존의 카메라 모듈은 광학적 수차를 줄이기 위해 광축을 따라 복수의 렌즈로 구성돼 있어 부피가 매우 크다는 단점이 있다. 이런 모듈을 단순히 크기만 줄여 소형기기에 적용하면 분해능과 감도가 떨어지게 된다.
연구팀은 문제 해결을 위해 곤충인 제노스 페키의 시각구조를 적용한 렌즈를 제작했고 이를 이미지 센서와 결합한 초박형 디지털카메라를 개발했다.
곤충의 겹눈구조는 수백, 수천 개의 오마티디아라 불리는 아주 작은 광학 구조로 이뤄져 있다. 일반적인 겹눈구조는 수백, 수천 개의 오마티디아에서 한 개의 영상을 얻지만, 제노스 페키는 다른 곤충과는 달리 각 오마티디아에서 개별의 영상을 획득할 수 있다. 또한 오마티디아 사이에 빛을 흡수할 수 있는 독특한 구조를 가져 각 영상 간 간섭을 막는다.
연구팀이 개발한 카메라는 2mm 이내의 매우 작은 크기로 제노스 페키의 겹눈구조를 모방해 수십 개의 마이크로프리즘 어레이와 마이크로렌즈 어레이로 구성된다. 마이크로프리즘과 마이크로렌즈가 한 쌍으로 채널을 이루고 있으며 각각의 채널 사이에는 빛을 흡수하는 중합체가 존재하며 각 채널 간 간섭을 막는다.
각각의 채널은 화면의 다른 부분들을 보고 있으며 각 채널에서 관측된 영상들은 영상처리를 통해 하나의 영상으로 복원돼 넓은 광시야각과 높은 분해능을 확보할 수 있다.
정기훈 교수는 “초박형 카메라를 제작하는 새로운 방법을 제시했다”며 “이 연구는 기존의 평면 CMOS 이미지 센서 어레이에 마이크로 카메라를 완전히 장착한 초박형 곤충 눈 카메라의 첫 번째 데모이며 다양한 광학 분야에 큰 영향을 미칠 것으로 확신한다.”라고 말했다.
□ 그림 설명
그림1. (좌) 제노스 페키의 SEM 영상. (우) 형광 염색된 제노스 페키의 시각구조
그림2. (좌) MEMS 공정을 통해 제작된 마이크로프리즘 어레이의 SEM 영상. (우) 완성된 초박형 디지털 카메라의 광학 영상
그림3. (좌) Xenos peckii의 시각기관을 통해 얻은 영상. (우) 초박형 디지털 카메라를 통해 얻은 영상
2018.11.20 조회수 11481 -
 조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14 조회수 20602
조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14 조회수 20602 -
 강승균 교수, 신경치료 후 몸에서 자연 분해되는 전자약 개발
〈 강 승 균 교수 〉
우리 대학 바이오및뇌공학과 강승균 교수 연구팀이 美 노스웨스턴 대학 구자현 박사와의 공동 연구를 통해 절단된 말초신경을 전기치료하고 역할이 끝나면 몸에서 스스로 분해돼 사라지는 전자약을 개발했다.
몸에 녹는 수술용 실이 대중화된 것처럼 생분해성 무선 전자약을 통해 앞으로는 병원을 찾지 않고도 집에서 물리치료를 받듯 전기치료를 받는 시대를 맞이할 수 있을 것으로 기대된다.
이번 연구결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 10월 8일자 온라인 판에 게재됐다. (논문명 : 비약리학적 신경재생 치료를 위한 생분해성 무선전자 시스템, Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy)
말초신경 손상은 국내에서 연간 1만 건 이상 발생할 정도로 빈도가 높은 외상 중 하나이다. 신경의 재생 속도가 얼마나 신속하게 이뤄지느냐가 근육 회복율 및 후유증을 결정하는 중요 요소이며 재생속도가 현저히 저하되면 슈반세포의 소멸로 신경재생이 불가능해지거나 탈 신경 지연에 의한 영구 근육장애를 유발한다.
따라서 신경재생을 가속하기 위한 노력이 지속돼 왔고 전기적 자극을 통해 신경재생을 촉진시키는 전자약의 효능이 주목을 받고 있다.
전자약이란 전기 신호를 통해 체내의 장기, 조직, 신경 등을 자극해 세포의 활성도를 높여 재생속도 향상과 생체반응이 활발히 이뤄지도록 치료하는 기술이다. 전자약을 통해 손상된 신경을 전기자극하면 신경 세포가 활성화되며 축색돌기의 분화가 가속돼 신경재생이 빨라져 치료효과를 극대화할 수 있다.
이러한 전자약의 효과적인 성능에도 불구하고 치료 수술의 복잡성과 이로 인한 2차 손상의 위험성이 커 신경 치료에 직접적으로 활용하지 못했다.
전기 신호를 전달하기 위해서는 전선으로 머리카락 두께의 신경을 감싸야 하는데 치료 후에 신경을 감쌌던 전선을 다시 제거하는 과정이 매우 어렵고 자칫하면 제거 과정에서 2차 신경손상으로 이어질 수 있다. 또한 장기적인 전기 치료가 필요한 경우에는 매번 수술을 반복해야하는 한계가 있었다.
연구팀은 문제 해결을 위해 초박막형 실리콘과 유연성을 갖춘 생분해성 고분자를 이용해 300마이크로 수준 두께의 매우 얇고 유연성을 갖추고 있을 뿐 아니라 체내에서 수개월 내에 분해되는 전자약을 개발했다.
개발한 전자약은 체내에서 무선으로 작동되고 사용이 종료된 후 몸속에서 녹아 흡수되기 때문에 별도의 제거수술이 필요하지 않다. 따라서 추가 수술 없이도 반복적인 전기치료를 할 수 있으며 제거를 위한 수술도 필요하지 않아 2차 위험성과 번거로움을 근본적으로 해결할 수 있는 기술이다.
연구팀은 생분해성 무선 전자약 기술이 말초신경의 치료와 더불어 외상성 뇌손상 및 척추손상 등 중추신경의 재활과 부정맥 치료 등을 위한 단기 심장 박동기에도 응용 가능할 것으로 예상했다.
강 교수는 “최초로 생분해성 뇌압측정기를 개발해 2016년 네이처 紙에 논문을 게재한 뒤 약 2년 만에 치료기술로서의 의료소자를 성공적으로 제시했다”며 “생분해성 전자소자의 시장에서 우리나라가 중추적인 역할을 수행할 수 있을 것이다”고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 생분해성 무선 전자소자의 생분해성 데모 예시
그림2. 다리신경 모델에 적용된 생분해성 무선 전자약의 삽입 모형도
그림3. 생분해성 전자약의 신경치료 시나리오 모식도
2018.10.22 조회수 13261
강승균 교수, 신경치료 후 몸에서 자연 분해되는 전자약 개발
〈 강 승 균 교수 〉
우리 대학 바이오및뇌공학과 강승균 교수 연구팀이 美 노스웨스턴 대학 구자현 박사와의 공동 연구를 통해 절단된 말초신경을 전기치료하고 역할이 끝나면 몸에서 스스로 분해돼 사라지는 전자약을 개발했다.
몸에 녹는 수술용 실이 대중화된 것처럼 생분해성 무선 전자약을 통해 앞으로는 병원을 찾지 않고도 집에서 물리치료를 받듯 전기치료를 받는 시대를 맞이할 수 있을 것으로 기대된다.
이번 연구결과는 국제 학술지 ‘네이처 메디슨(Nature Medicine)’ 10월 8일자 온라인 판에 게재됐다. (논문명 : 비약리학적 신경재생 치료를 위한 생분해성 무선전자 시스템, Wireless bioresorbable electronic system enables sustained nonpharmacological neuroregenerative therapy)
말초신경 손상은 국내에서 연간 1만 건 이상 발생할 정도로 빈도가 높은 외상 중 하나이다. 신경의 재생 속도가 얼마나 신속하게 이뤄지느냐가 근육 회복율 및 후유증을 결정하는 중요 요소이며 재생속도가 현저히 저하되면 슈반세포의 소멸로 신경재생이 불가능해지거나 탈 신경 지연에 의한 영구 근육장애를 유발한다.
따라서 신경재생을 가속하기 위한 노력이 지속돼 왔고 전기적 자극을 통해 신경재생을 촉진시키는 전자약의 효능이 주목을 받고 있다.
전자약이란 전기 신호를 통해 체내의 장기, 조직, 신경 등을 자극해 세포의 활성도를 높여 재생속도 향상과 생체반응이 활발히 이뤄지도록 치료하는 기술이다. 전자약을 통해 손상된 신경을 전기자극하면 신경 세포가 활성화되며 축색돌기의 분화가 가속돼 신경재생이 빨라져 치료효과를 극대화할 수 있다.
이러한 전자약의 효과적인 성능에도 불구하고 치료 수술의 복잡성과 이로 인한 2차 손상의 위험성이 커 신경 치료에 직접적으로 활용하지 못했다.
전기 신호를 전달하기 위해서는 전선으로 머리카락 두께의 신경을 감싸야 하는데 치료 후에 신경을 감쌌던 전선을 다시 제거하는 과정이 매우 어렵고 자칫하면 제거 과정에서 2차 신경손상으로 이어질 수 있다. 또한 장기적인 전기 치료가 필요한 경우에는 매번 수술을 반복해야하는 한계가 있었다.
연구팀은 문제 해결을 위해 초박막형 실리콘과 유연성을 갖춘 생분해성 고분자를 이용해 300마이크로 수준 두께의 매우 얇고 유연성을 갖추고 있을 뿐 아니라 체내에서 수개월 내에 분해되는 전자약을 개발했다.
개발한 전자약은 체내에서 무선으로 작동되고 사용이 종료된 후 몸속에서 녹아 흡수되기 때문에 별도의 제거수술이 필요하지 않다. 따라서 추가 수술 없이도 반복적인 전기치료를 할 수 있으며 제거를 위한 수술도 필요하지 않아 2차 위험성과 번거로움을 근본적으로 해결할 수 있는 기술이다.
연구팀은 생분해성 무선 전자약 기술이 말초신경의 치료와 더불어 외상성 뇌손상 및 척추손상 등 중추신경의 재활과 부정맥 치료 등을 위한 단기 심장 박동기에도 응용 가능할 것으로 예상했다.
강 교수는 “최초로 생분해성 뇌압측정기를 개발해 2016년 네이처 紙에 논문을 게재한 뒤 약 2년 만에 치료기술로서의 의료소자를 성공적으로 제시했다”며 “생분해성 전자소자의 시장에서 우리나라가 중추적인 역할을 수행할 수 있을 것이다”고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 생분해성 무선 전자소자의 생분해성 데모 예시
그림2. 다리신경 모델에 적용된 생분해성 무선 전자약의 삽입 모형도
그림3. 생분해성 전자약의 신경치료 시나리오 모식도
2018.10.22 조회수 13261 -
 조영호 교수, 소름돋는 현상 분석해 열적 쾌적감 지표 발굴
〈 조영호 교수, 윤성현 연구원 〉
우리대학 바이오및뇌공학과 조영호 교수 연구팀이 피부의 경도를 근거로 인간의 열적 쾌적감을 예측할 수 있는 지표를 발굴했다.
윤성현, 심재경 연구원의 주도로 개발한 이번 연구는 네이처 자매지 ‘사이언티픽 리포트(Scientific Reports)’ 8월 13일자 온라인 판에 게재됐다.
인간은 개인별 체질과 기후 환경에 따라 동일한 온도와 습도에서도 느끼는 더위와 추위, 즉 열적 쾌적감이 다르다. 각 개인별 체질과 무관하게 인간이 실제 느끼는 열적 쾌적감을 알아내고 쾌적한 상태를 유지할 수 있는 새 개념의 개인별 맞춤형 냉난방시스템 연구가 활발히 진행 중이다.
인간이라면 누구나 더위를 느끼는 상황에서 피부온도와 땀 발생량이 올라가고 반대로 추위를 느끼면 피부온도와 땀 발생량이 감소한다. 연구팀은 지난 2월 이러한 피부온도와 땀 발생률의 두 가지 지표를 통해 인간의 열적 쾌적감을 측정할 수 있는 기기를 개발한 바 있다.
그러나 피부 온도와 땀 발생률만으로는 신뢰도가 충분하지 못해 정확성과 신뢰도를 높일 수 있는 지표가 요구되고 있다.
연구팀은 기존의 열적 쾌적감 지표 외에 인간의 피부 경도(硬度)를 추가적인 지표로 활용할 수 있음을 처음으로 발견했다.
인간이 추위나 더위를 느낄 때 모근에 붙어있는 아주 작은 근육인 입모근(立毛筋)이 수축되거나 이완된다. 우리가 추위를 느낄 때 흔히 ‘소름이 돋는다’고 말하는 신체 반응도 입모근이 수축해 피부가 단단해지며 발생한다. 반대로 더위를 느낄 때 모공에서 땀이 나는 반응도 입모근이 이완되면서 발생하는 현상이다.
연구팀은 입모근에 의해 피부의 경도가 변한다는 점에 착안해 피부 경도를 인간 열적 쾌적감의 새로운 지표로 제안했다.
조 교수 연구팀은 기존의 지표인 피부 온도와 땀 발생률과 피부 경도는 인간의 열적 쾌적감을 판단할 수 있는 각각의 독립적인 지표이며, 기존의 두 지표에 더해 피부 경도를 추가하면 쾌적감 판단 신뢰도가 23.5% 향상됨을 피험자 실험을 통해 입증했다.
이를 통해 피부 경도를 측정할 수 있는 센서를 개발하고 이를 적용해 자동차, 실내 등에서 기존의 냉, 난방기보다 인간과 교감 기능이 뛰어난 개인별 맞춤형 냉, 난방기를 개발할 예정이다.
조 교수는 “새로 발굴한 지표인 피부 경도를 도입해 인간의 개인별 체질, 기후 환경과 무관하게 실제 느끼는 열적 쾌적감 예측의 신뢰도를 높여 개인별 맞춤형 냉, 난방기의 개발에 힘쓸 예정이다”며 “신체적 건강 상태 뿐 아니라 정신적 건강과 감정 상태 교감을 통해 인간과 기계 간 정서적 교감도 이룰 수 있을 것이다”고 말했다.
이번 연구는 과학기술정보통신부 중견연구자지원사업을 통해 수행됐다.
□ 그림 설명
그림1. 피부경도를 통한 인간 열적 쾌적감 측정
그림2. 피부경도를 통한 인간 열적 쾌적감 측정기
2018.08.29 조회수 10910
조영호 교수, 소름돋는 현상 분석해 열적 쾌적감 지표 발굴
〈 조영호 교수, 윤성현 연구원 〉
우리대학 바이오및뇌공학과 조영호 교수 연구팀이 피부의 경도를 근거로 인간의 열적 쾌적감을 예측할 수 있는 지표를 발굴했다.
윤성현, 심재경 연구원의 주도로 개발한 이번 연구는 네이처 자매지 ‘사이언티픽 리포트(Scientific Reports)’ 8월 13일자 온라인 판에 게재됐다.
인간은 개인별 체질과 기후 환경에 따라 동일한 온도와 습도에서도 느끼는 더위와 추위, 즉 열적 쾌적감이 다르다. 각 개인별 체질과 무관하게 인간이 실제 느끼는 열적 쾌적감을 알아내고 쾌적한 상태를 유지할 수 있는 새 개념의 개인별 맞춤형 냉난방시스템 연구가 활발히 진행 중이다.
인간이라면 누구나 더위를 느끼는 상황에서 피부온도와 땀 발생량이 올라가고 반대로 추위를 느끼면 피부온도와 땀 발생량이 감소한다. 연구팀은 지난 2월 이러한 피부온도와 땀 발생률의 두 가지 지표를 통해 인간의 열적 쾌적감을 측정할 수 있는 기기를 개발한 바 있다.
그러나 피부 온도와 땀 발생률만으로는 신뢰도가 충분하지 못해 정확성과 신뢰도를 높일 수 있는 지표가 요구되고 있다.
연구팀은 기존의 열적 쾌적감 지표 외에 인간의 피부 경도(硬度)를 추가적인 지표로 활용할 수 있음을 처음으로 발견했다.
인간이 추위나 더위를 느낄 때 모근에 붙어있는 아주 작은 근육인 입모근(立毛筋)이 수축되거나 이완된다. 우리가 추위를 느낄 때 흔히 ‘소름이 돋는다’고 말하는 신체 반응도 입모근이 수축해 피부가 단단해지며 발생한다. 반대로 더위를 느낄 때 모공에서 땀이 나는 반응도 입모근이 이완되면서 발생하는 현상이다.
연구팀은 입모근에 의해 피부의 경도가 변한다는 점에 착안해 피부 경도를 인간 열적 쾌적감의 새로운 지표로 제안했다.
조 교수 연구팀은 기존의 지표인 피부 온도와 땀 발생률과 피부 경도는 인간의 열적 쾌적감을 판단할 수 있는 각각의 독립적인 지표이며, 기존의 두 지표에 더해 피부 경도를 추가하면 쾌적감 판단 신뢰도가 23.5% 향상됨을 피험자 실험을 통해 입증했다.
이를 통해 피부 경도를 측정할 수 있는 센서를 개발하고 이를 적용해 자동차, 실내 등에서 기존의 냉, 난방기보다 인간과 교감 기능이 뛰어난 개인별 맞춤형 냉, 난방기를 개발할 예정이다.
조 교수는 “새로 발굴한 지표인 피부 경도를 도입해 인간의 개인별 체질, 기후 환경과 무관하게 실제 느끼는 열적 쾌적감 예측의 신뢰도를 높여 개인별 맞춤형 냉, 난방기의 개발에 힘쓸 예정이다”며 “신체적 건강 상태 뿐 아니라 정신적 건강과 감정 상태 교감을 통해 인간과 기계 간 정서적 교감도 이룰 수 있을 것이다”고 말했다.
이번 연구는 과학기술정보통신부 중견연구자지원사업을 통해 수행됐다.
□ 그림 설명
그림1. 피부경도를 통한 인간 열적 쾌적감 측정
그림2. 피부경도를 통한 인간 열적 쾌적감 측정기
2018.08.29 조회수 10910 -
 조광현 교수, 섬유아세포 과활성 유발 분자피드백 회로 규명
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 삼성병원 김석형 교수 연구팀과 공동연구를 통해 섬유증 및 암 악성화의 원인이 되는 섬유아세포 과활성을 유발하는 분자피드백 회로를 최초로 규명했다.
신동관 박사와 안수균 학생 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 1일자 온라인 판에 게재됐다.
( https://www.nature.com/articles/s41467-018-05274-6 )
인간의 섬유아세포는 대부분의 정상조직에 비활성화된 상태로 존재하다가 상처회복을 위해 필요할 때 급진적으로 활성화된다. 하지만 이러한 급진적 활성화가 유발되는 원리는 아직 밝혀지지 않았다.
조광현 교수 연구팀은 삼성병원 김석형 교수팀과 공동연구를 통해 Twist1, Prrx1, TNC 분자들이 연쇄적으로 활성을 유발하는 양성피드백회로를 구성함으로서 그와 같은 급진적인 섬유아세포의 활성을 유발한다는 것을 분자생물학실험과 수학모델링, 컴퓨터시뮬레이션 분석, 그리고 동물실험과 임상데이터 분석을 통해 밝혔다.
활성화된 섬유아세포는 상처가 치유된 뒤 다시 비활성화된 상태로 전환돼야 하는데 이 때 피드백회로가 계속 작동하면 섬유증의 발생이나 암 악성화의 원인이 된다.
따라서 이번에 밝혀낸 Twist1-Prrx1-TNC 분자피드백회로는 섬유증과 암의 새로운 치료 타겟으로 활용될 수 있을 것으로 기대된다.
□ 그림 설명
그림1. 섬유아세포의 급진적 활성화를 유발하는 Twist1-Prrx1-TNC 분자피드백회로 규명 과정
그림2. 정상적인 섬유아세포의 활성화 조절과 피드백회로의 비가역적 활성화에 따른 비정상적인 섬유아세포 활성화 조절과정의 비교
2018.08.10 조회수 13424
조광현 교수, 섬유아세포 과활성 유발 분자피드백 회로 규명
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 삼성병원 김석형 교수 연구팀과 공동연구를 통해 섬유증 및 암 악성화의 원인이 되는 섬유아세포 과활성을 유발하는 분자피드백 회로를 최초로 규명했다.
신동관 박사와 안수균 학생 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 8월 1일자 온라인 판에 게재됐다.
( https://www.nature.com/articles/s41467-018-05274-6 )
인간의 섬유아세포는 대부분의 정상조직에 비활성화된 상태로 존재하다가 상처회복을 위해 필요할 때 급진적으로 활성화된다. 하지만 이러한 급진적 활성화가 유발되는 원리는 아직 밝혀지지 않았다.
조광현 교수 연구팀은 삼성병원 김석형 교수팀과 공동연구를 통해 Twist1, Prrx1, TNC 분자들이 연쇄적으로 활성을 유발하는 양성피드백회로를 구성함으로서 그와 같은 급진적인 섬유아세포의 활성을 유발한다는 것을 분자생물학실험과 수학모델링, 컴퓨터시뮬레이션 분석, 그리고 동물실험과 임상데이터 분석을 통해 밝혔다.
활성화된 섬유아세포는 상처가 치유된 뒤 다시 비활성화된 상태로 전환돼야 하는데 이 때 피드백회로가 계속 작동하면 섬유증의 발생이나 암 악성화의 원인이 된다.
따라서 이번에 밝혀낸 Twist1-Prrx1-TNC 분자피드백회로는 섬유증과 암의 새로운 치료 타겟으로 활용될 수 있을 것으로 기대된다.
□ 그림 설명
그림1. 섬유아세포의 급진적 활성화를 유발하는 Twist1-Prrx1-TNC 분자피드백회로 규명 과정
그림2. 정상적인 섬유아세포의 활성화 조절과 피드백회로의 비가역적 활성화에 따른 비정상적인 섬유아세포 활성화 조절과정의 비교
2018.08.10 조회수 13424 -
 예종철 교수, 인공지능 블랙박스의 원리 밝혀
〈 예종철 교수, 한요섭 연구원, 차은주 연구원 〉
우리 대학 바이오및뇌공학과 예종철 석좌교수 연구팀이 인공지능의 기하학적인 구조를 규명하고 이를 통해 의료영상 및 정밀분야에 활용 가능한 고성능 인공신경망 제작의 수학적인 원리를 밝혔다.
연구팀의 ‘심층 합성곱 프레임렛(Deep Convolutional Framelets)’이라는 새로운 조화분석학적 기술은 인공지능의 블랙박스로 알려진 심층 신경망의 수학적 원리를 밝혀 기존 심층 신경망 구조의 단점을 보완하고 이를 다양하게 응용 가능할 것으로 기대된다.
예종철 석좌교수가 주도하고 한요섭, 차은주 박사과정이 참여한 이번 연구는 응용수학 분야 국제 학술지 ‘사이암 저널 온 이매징 사이언스(SIAM Journal on Imaging Sciences)’ 4월 26일자 온라인 판에 게재됐다.
심층신경망은 최근 폭발적으로 성장하는 인공지능의 핵심을 이루는 딥 러닝의 대표적인 구현 방법이다. 이를 이용한 영상, 음성 인식 및 영상처리 기법, 바둑, 체스 등은 이미 사람의 능력을 뛰어넘고 있으며 현재 4차 산업혁명의 핵심기술로 알려져 있다.
그러나 이러한 심층신경망은 그 뛰어난 성능에도 불구하고 정확한 동작원리가 밝혀지지 않아 예상하지 못한 결과가 나오거나 오류가 발생하는 문제가 있다. 이로 인해 ‘설명 가능한 인공지능(explainable AI: XAI)’에 대한 사회적, 기술적 요구가 커지고 있다.
연구팀은 심층신경망의 구조가 얻어지는 고차원 공간에서의 기하학적 구조를 찾기 위해 노력했다. 그 결과 기존의 신호처리 분야에서 집중 연구된 고차원 구조인 행켈구조 행렬(Hankel matrix)을 기저함수로 분해하는 과정에서 심층신경망 구조가 나오는 것을 발견했다.
행켈 행렬이 분해되는 과정에서 기저함수는 국지기저함수(local basis)와 광역기저함수(non-local basis)로 나눠진다. 연구팀은 광역기저함수와 국지기저함수가 각각 인공지능의 풀링(pooling)과 필터링(filtering) 역할을 한다는 것을 밝혔다.
기존에는 인공지능을 구현하기 위한 심층신경망을 구성할 때 구체적인 작동 원리를 모른 채 실험적으로 구현했다면, 연구팀은 신호를 효과적으로 나타내는 고차원 공간인 행켈 행렬를 찾고 이를 분리하는 방식을 통해 필터링, 풀링 구조를 얻는 이론적인 구조를 제시한 것이다.
이러한 성질을 이용하면 입력신호의 복잡성에 따라 기저함수의 개수와 심층신경망의 깊이를 정해 원하는 심층신경망의 구조를 제시할 수 있다.
연구팀은 수학적 원리를 통해 제안된 인공신경망 구조를 영상잡음제거, 영상 화소복원 및 의료영상 복원 문제에 적용했고 매우 우수한 성능을 보임을 확인했다.
예종철 교수는 “시행착오를 반복해 설계하는 기존의 심층신경망과는 달리 원하는 응용에 따라 최적화된 심층신경망구조를 수학적 원리로 디자인하고 그 영향을 예측할 수 있다”며 “이 결과를 통해 의료 영상 등 설명 가능한 인공지능이 필요한 다양한 분야에 응용될 수 있다”고 말했다.
이번 연구는 과학기술정보통신부의 중견연구자지원사업(도약연구) 및 뇌과학원천기술사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학적인 원리를 이용한 심층신경망의 설계 예시
그림2. 영상잡음제거 결과
그림3. 영상에서 80% 화소가 사라진 경우 인공신경망을 통해 복원한 결과
2018.05.10 조회수 22237
예종철 교수, 인공지능 블랙박스의 원리 밝혀
〈 예종철 교수, 한요섭 연구원, 차은주 연구원 〉
우리 대학 바이오및뇌공학과 예종철 석좌교수 연구팀이 인공지능의 기하학적인 구조를 규명하고 이를 통해 의료영상 및 정밀분야에 활용 가능한 고성능 인공신경망 제작의 수학적인 원리를 밝혔다.
연구팀의 ‘심층 합성곱 프레임렛(Deep Convolutional Framelets)’이라는 새로운 조화분석학적 기술은 인공지능의 블랙박스로 알려진 심층 신경망의 수학적 원리를 밝혀 기존 심층 신경망 구조의 단점을 보완하고 이를 다양하게 응용 가능할 것으로 기대된다.
예종철 석좌교수가 주도하고 한요섭, 차은주 박사과정이 참여한 이번 연구는 응용수학 분야 국제 학술지 ‘사이암 저널 온 이매징 사이언스(SIAM Journal on Imaging Sciences)’ 4월 26일자 온라인 판에 게재됐다.
심층신경망은 최근 폭발적으로 성장하는 인공지능의 핵심을 이루는 딥 러닝의 대표적인 구현 방법이다. 이를 이용한 영상, 음성 인식 및 영상처리 기법, 바둑, 체스 등은 이미 사람의 능력을 뛰어넘고 있으며 현재 4차 산업혁명의 핵심기술로 알려져 있다.
그러나 이러한 심층신경망은 그 뛰어난 성능에도 불구하고 정확한 동작원리가 밝혀지지 않아 예상하지 못한 결과가 나오거나 오류가 발생하는 문제가 있다. 이로 인해 ‘설명 가능한 인공지능(explainable AI: XAI)’에 대한 사회적, 기술적 요구가 커지고 있다.
연구팀은 심층신경망의 구조가 얻어지는 고차원 공간에서의 기하학적 구조를 찾기 위해 노력했다. 그 결과 기존의 신호처리 분야에서 집중 연구된 고차원 구조인 행켈구조 행렬(Hankel matrix)을 기저함수로 분해하는 과정에서 심층신경망 구조가 나오는 것을 발견했다.
행켈 행렬이 분해되는 과정에서 기저함수는 국지기저함수(local basis)와 광역기저함수(non-local basis)로 나눠진다. 연구팀은 광역기저함수와 국지기저함수가 각각 인공지능의 풀링(pooling)과 필터링(filtering) 역할을 한다는 것을 밝혔다.
기존에는 인공지능을 구현하기 위한 심층신경망을 구성할 때 구체적인 작동 원리를 모른 채 실험적으로 구현했다면, 연구팀은 신호를 효과적으로 나타내는 고차원 공간인 행켈 행렬를 찾고 이를 분리하는 방식을 통해 필터링, 풀링 구조를 얻는 이론적인 구조를 제시한 것이다.
이러한 성질을 이용하면 입력신호의 복잡성에 따라 기저함수의 개수와 심층신경망의 깊이를 정해 원하는 심층신경망의 구조를 제시할 수 있다.
연구팀은 수학적 원리를 통해 제안된 인공신경망 구조를 영상잡음제거, 영상 화소복원 및 의료영상 복원 문제에 적용했고 매우 우수한 성능을 보임을 확인했다.
예종철 교수는 “시행착오를 반복해 설계하는 기존의 심층신경망과는 달리 원하는 응용에 따라 최적화된 심층신경망구조를 수학적 원리로 디자인하고 그 영향을 예측할 수 있다”며 “이 결과를 통해 의료 영상 등 설명 가능한 인공지능이 필요한 다양한 분야에 응용될 수 있다”고 말했다.
이번 연구는 과학기술정보통신부의 중견연구자지원사업(도약연구) 및 뇌과학원천기술사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학적인 원리를 이용한 심층신경망의 설계 예시
그림2. 영상잡음제거 결과
그림3. 영상에서 80% 화소가 사라진 경우 인공신경망을 통해 복원한 결과
2018.05.10 조회수 22237 -
 김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17 조회수 22669
김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17 조회수 22669 -
 남윤기 교수, 뇌질환 치료용 나노입자 프린팅 기술 개발
우리 대학 바이오및뇌공학과 남윤기 교수 연구팀이 잉크젯 프린팅으로 마이크로미터 수준의 열 패턴을 마음대로 찍어내고, 이를 이용해 원격으로 신경세포의 전기적 활성을 제어할 수 있는 기술을 개발했다.
선택적 나노 광열 신경자극이라 할 수 있는 이 기술은 잉크젯 프린팅 기술과 나노입자 기술을 융합한 것으로 뇌전증 등의 뇌질환 환자들에게 맞춤형 정밀 광열 자극을 도입할 수 있는 기반기술이 될 것으로 기대된다.
강홍기 박사가 주도하고 이구행, 정현준, 이지웅 박사과정이 참여한 이번 연구는 국제 학술지 ‘에이씨에스 나노(ACS Nano)’ 2월 5일자에 게재됐다.
나노 광열자극 기술은 금속 나노 입자의 열-플라즈모닉 현상을 이용해 신경 세포의 활성을 조절한다. 연구팀은 지난 4년간 연구를 통해 나노 광열효과에 의한 신경세포 활성 억제 현상을 발견했고, 이를 이용해 뇌전증 등의 뇌질환에서 발생하는 신경세포의 비정상적 활동을 조절하기 위한 기술을 연구했다.
연구팀은 기존의 나노 광열자극 기술이 갖는 공간적인 선택성의 한계와 해상도의 제약을 극복하기 위해 잉크젯 프린팅 기술을 이용한 나노 입자의 미세 패턴 작업을 통해 나노 광열자극 기술을 선택적인 부분에만 가할 수 있는 기술을 개발했다.
정밀 잉크젯 프린팅과 고분자전해질 적층 코팅법을 결합해 고해상도의 선택적 광열 자극 기술을 구현했다. 이 기술은 정밀 잉크젯 프린팅 기술은 금속 나노 입자를 잉크로 사용해 수십 마이크로미터 크기의 나노입자 패턴을 만들 수 있다.
이 기술과 고분자전해질 적층 코팅법을 결합하면 원하는 모양을 보다 정밀하게 인쇄할 수 있고 안정성이 높아 다양한 기판에 적용할 수 있다. 또한 고분자전해질 코팅법은 세포 친화적이기 때문에 세포실험 및 생체 기술에 적용 가능하다.
연구팀은 이 기술을 통해 금 나노막대 입자를 수십 마이크로미터 해상도로 인쇄해 수 센티미터 이상의 정밀한 나노입자 패턴을 손쉽게 제작했다. 이 패턴에 빛을 조사하면 인쇄한 모양대로 정밀한 열 패턴을 형성할 수 있다.
또한 이 기술로 배양된 뇌신경세포의 활동을 선택적, 일시적으로 빛 조사를 통해 억제할 수 있음을 실험을 통해 확인했다.
이 열 패턴 기술을 이용하면 신경세포의 전기적 활성을 열 발생 부분에만 일시적으로 억제할 수 있어 선택적으로 광열 신경자극을 줄 수 있다. 이를 통해 원하는 세포 영역만 구분해 활동을 억제시켜 환자에게 맞춤형 광열 신경자극 치료를 제공할 수 있다.
연구팀의 기술은 얇고 유연한 기판에도 적용 가능해 체내 이식용 뇌질환 치료 장치나 웨어러블 의료 장치에 응용 가능할 것으로 기대된다.
남 교수는 “원하는 형태의 열 모양을 손쉽게 어디든지 인쇄할 수 있다는 점에서 공학적으로 폭넓게 활용 가능하다”며 “바이오공학 분야에서 생체기능 조절을 위해 빛과 열을 이용한 다양한 인터페이스 제작에 적용할 수 있고 새로운 위조 방지 기술 등에도 적용 가능할 것이다”고 말했다.
이번 연구는 과학기술정보통신부의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 기술을 통해 제작한 사례들
그림2. 잉크젯 프린팅을 이용한 광열 효과 패턴 방식 및 이를 이용한 뇌신경세포의 선택적 활동 조절 기술
2018.02.27 조회수 19781
남윤기 교수, 뇌질환 치료용 나노입자 프린팅 기술 개발
우리 대학 바이오및뇌공학과 남윤기 교수 연구팀이 잉크젯 프린팅으로 마이크로미터 수준의 열 패턴을 마음대로 찍어내고, 이를 이용해 원격으로 신경세포의 전기적 활성을 제어할 수 있는 기술을 개발했다.
선택적 나노 광열 신경자극이라 할 수 있는 이 기술은 잉크젯 프린팅 기술과 나노입자 기술을 융합한 것으로 뇌전증 등의 뇌질환 환자들에게 맞춤형 정밀 광열 자극을 도입할 수 있는 기반기술이 될 것으로 기대된다.
강홍기 박사가 주도하고 이구행, 정현준, 이지웅 박사과정이 참여한 이번 연구는 국제 학술지 ‘에이씨에스 나노(ACS Nano)’ 2월 5일자에 게재됐다.
나노 광열자극 기술은 금속 나노 입자의 열-플라즈모닉 현상을 이용해 신경 세포의 활성을 조절한다. 연구팀은 지난 4년간 연구를 통해 나노 광열효과에 의한 신경세포 활성 억제 현상을 발견했고, 이를 이용해 뇌전증 등의 뇌질환에서 발생하는 신경세포의 비정상적 활동을 조절하기 위한 기술을 연구했다.
연구팀은 기존의 나노 광열자극 기술이 갖는 공간적인 선택성의 한계와 해상도의 제약을 극복하기 위해 잉크젯 프린팅 기술을 이용한 나노 입자의 미세 패턴 작업을 통해 나노 광열자극 기술을 선택적인 부분에만 가할 수 있는 기술을 개발했다.
정밀 잉크젯 프린팅과 고분자전해질 적층 코팅법을 결합해 고해상도의 선택적 광열 자극 기술을 구현했다. 이 기술은 정밀 잉크젯 프린팅 기술은 금속 나노 입자를 잉크로 사용해 수십 마이크로미터 크기의 나노입자 패턴을 만들 수 있다.
이 기술과 고분자전해질 적층 코팅법을 결합하면 원하는 모양을 보다 정밀하게 인쇄할 수 있고 안정성이 높아 다양한 기판에 적용할 수 있다. 또한 고분자전해질 코팅법은 세포 친화적이기 때문에 세포실험 및 생체 기술에 적용 가능하다.
연구팀은 이 기술을 통해 금 나노막대 입자를 수십 마이크로미터 해상도로 인쇄해 수 센티미터 이상의 정밀한 나노입자 패턴을 손쉽게 제작했다. 이 패턴에 빛을 조사하면 인쇄한 모양대로 정밀한 열 패턴을 형성할 수 있다.
또한 이 기술로 배양된 뇌신경세포의 활동을 선택적, 일시적으로 빛 조사를 통해 억제할 수 있음을 실험을 통해 확인했다.
이 열 패턴 기술을 이용하면 신경세포의 전기적 활성을 열 발생 부분에만 일시적으로 억제할 수 있어 선택적으로 광열 신경자극을 줄 수 있다. 이를 통해 원하는 세포 영역만 구분해 활동을 억제시켜 환자에게 맞춤형 광열 신경자극 치료를 제공할 수 있다.
연구팀의 기술은 얇고 유연한 기판에도 적용 가능해 체내 이식용 뇌질환 치료 장치나 웨어러블 의료 장치에 응용 가능할 것으로 기대된다.
남 교수는 “원하는 형태의 열 모양을 손쉽게 어디든지 인쇄할 수 있다는 점에서 공학적으로 폭넓게 활용 가능하다”며 “바이오공학 분야에서 생체기능 조절을 위해 빛과 열을 이용한 다양한 인터페이스 제작에 적용할 수 있고 새로운 위조 방지 기술 등에도 적용 가능할 것이다”고 말했다.
이번 연구는 과학기술정보통신부의 중견연구자지원사업(도약연구)의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 기술을 통해 제작한 사례들
그림2. 잉크젯 프린팅을 이용한 광열 효과 패턴 방식 및 이를 이용한 뇌신경세포의 선택적 활동 조절 기술
2018.02.27 조회수 19781 -
 조영호 교수, 손목시계형 개인별 열적 쾌적감 측정기 개발
〈 조 영 호 교수, 윤 성 현 연구원 〉
우리 대학 바이오및뇌공학과 조영호 교수 연구팀이 손목의 땀을 측정해 인간의 개인별 열적 쾌적감을 측정할 수 있는 손목시계형 쾌적감 측정기를 개발했다.
심재경, 윤성현 연구원의 주도로 개발한 이번 연구 성과는 융합, 과학 분야의 네이처 자매지 ‘사이언티픽 리포트(Scientific Reports)’ 1월 19일자에 게재됐다.
인간이라면 누구나 더위를 느끼면 땀 발생률이 증가하며 추위를 느끼면 땀 발생률이 감소한다. 따라서 동일한 환경에서도 개인별 땀 발생률을 측정하면 개인마다 느끼는 더위와 추위 상태를 판별해 열적 쾌적감을 측정할 수 있다.
일반적인 냉, 난방기는 공기의 습도와 온도를 일정하게 유지하도록 동작하고 있기 때문에 동일한 온도와 습도여도 개인별 체질과 기후환경에 따라 개인마다 느끼는 추위와 더위 상태는 모두 다르다.
기존의 땀 발생률 측정기는 생리학 실험용으로 사용돼 펌프 및 냉각기 등의 큰 크기를 갖는 외부 장치가 필요하다. 피부 미용 용도는 크기가 작지만 장시간의 회복 시간을 필요로 하는 문제점이 있다.
연구팀은 작은 크기를 가지며 인간의 피부에 착용 가능하면서 환기구동기를 집적해 연속적으로 땀 발생률 측정이 가능한 손목시계형 쾌적감 측정기를 개발했다.
연구팀이 개발한 손목시계형 쾌적감 측정기는 인간이 느끼는 더위나 추위의 정도에 따라 땀 발생률이 변화하는 점에 착안해 땀 발생률을 측정해 주어진 환경 내에서 인간의 체감 더위와 추위를 파악할 수 있는 기술이다.
연구팀은 밀폐된 챔버가 피부에 부착됐을 때 습도가 증가하는 비율을 통해 땀 발생률을 측정하는 방식을 이용했다. 이 측정기는 피부에 챔버가 완전히 부착된 후 측정하기 때문에 외부 공기나 인간의 움직임에도 안정적인 땀 발생률 측정이 가능하다.
또한 소형 열공압 구동기를 집적해 챔버를 피부 위로 들어올려 자동 환기가 가능하다.
연구팀의 손목시계형 쾌적감 측정기는 주위의 온도나 습도에 관계없이 인간의 인지기능에 따라 변화하는 땀 발생률을 측정할 수 있어 개인별 맞춤형 냉난방을 실현할 수 있다.
연구팀의 측정기는 직경 35mm, 두께 25mm, 배터리 포함 무게 30g으로 자동 환기기능을 갖추고 있으며 기존 측정기 대비 무게는 절반 이하(47.6%) 47.6%, 소비전력은 12.8%에 불과하다.
6V 소형 손목시계용 배터리로 4시간 동작이 가능하며 사람의 걸음에 해당하는 공기흐름인 0~1.5m/s에서 안정적으로 작동하기 때문에 움직이는 상태에서 성능을 유지하여야 하는 포터블, 웨어러블 기기로 사용가능하다는 장점이 있다.
이를 이용해 연구팀은 실내 또는 자동차 내에서 기존의 냉, 난방기에 비해 훨씬 더 인간과 교감 기능이 뛰어난 새로운 개념의 인지형 냉, 난방기를 제작할 예정이다.
조영호 교수는 “기존 냉난방기는 주변의 온, 습도 기준으로 쾌적감을 판단해 개인적으로 느끼는 쾌적감과 무관하지만 우리가 개발한 쾌적감 측정기는 개인적 쾌적감을 판단할 수 있어 새 개념의 개인맞춤형 지능형 냉, 난방기로 활용 가능하다”며 “나아가 미래사회에서는 인간의 신체적 건강 뿐 아니라 정신적 건강과 감정 상태의 관리가 필요하기에 향후 인간과 기계의 감성 교감을 이룰 수 있을 것이다”고 말했다.
이번 연구는 과학기술정보통신부의 중견연구자지원사업을 통해 수행됐으며 국내특허로 등록을 완료했다.
□ 그림 설명
그림1. 인간 열적 쾌적감 측정이 가능한 손목시계형 쾌적감 측정기
그림2. 손목시계형 쾌적감 측정기
그림3. 손목시계형 쾌적감 측정기의 동작 원리
2018.02.01 조회수 15799
조영호 교수, 손목시계형 개인별 열적 쾌적감 측정기 개발
〈 조 영 호 교수, 윤 성 현 연구원 〉
우리 대학 바이오및뇌공학과 조영호 교수 연구팀이 손목의 땀을 측정해 인간의 개인별 열적 쾌적감을 측정할 수 있는 손목시계형 쾌적감 측정기를 개발했다.
심재경, 윤성현 연구원의 주도로 개발한 이번 연구 성과는 융합, 과학 분야의 네이처 자매지 ‘사이언티픽 리포트(Scientific Reports)’ 1월 19일자에 게재됐다.
인간이라면 누구나 더위를 느끼면 땀 발생률이 증가하며 추위를 느끼면 땀 발생률이 감소한다. 따라서 동일한 환경에서도 개인별 땀 발생률을 측정하면 개인마다 느끼는 더위와 추위 상태를 판별해 열적 쾌적감을 측정할 수 있다.
일반적인 냉, 난방기는 공기의 습도와 온도를 일정하게 유지하도록 동작하고 있기 때문에 동일한 온도와 습도여도 개인별 체질과 기후환경에 따라 개인마다 느끼는 추위와 더위 상태는 모두 다르다.
기존의 땀 발생률 측정기는 생리학 실험용으로 사용돼 펌프 및 냉각기 등의 큰 크기를 갖는 외부 장치가 필요하다. 피부 미용 용도는 크기가 작지만 장시간의 회복 시간을 필요로 하는 문제점이 있다.
연구팀은 작은 크기를 가지며 인간의 피부에 착용 가능하면서 환기구동기를 집적해 연속적으로 땀 발생률 측정이 가능한 손목시계형 쾌적감 측정기를 개발했다.
연구팀이 개발한 손목시계형 쾌적감 측정기는 인간이 느끼는 더위나 추위의 정도에 따라 땀 발생률이 변화하는 점에 착안해 땀 발생률을 측정해 주어진 환경 내에서 인간의 체감 더위와 추위를 파악할 수 있는 기술이다.
연구팀은 밀폐된 챔버가 피부에 부착됐을 때 습도가 증가하는 비율을 통해 땀 발생률을 측정하는 방식을 이용했다. 이 측정기는 피부에 챔버가 완전히 부착된 후 측정하기 때문에 외부 공기나 인간의 움직임에도 안정적인 땀 발생률 측정이 가능하다.
또한 소형 열공압 구동기를 집적해 챔버를 피부 위로 들어올려 자동 환기가 가능하다.
연구팀의 손목시계형 쾌적감 측정기는 주위의 온도나 습도에 관계없이 인간의 인지기능에 따라 변화하는 땀 발생률을 측정할 수 있어 개인별 맞춤형 냉난방을 실현할 수 있다.
연구팀의 측정기는 직경 35mm, 두께 25mm, 배터리 포함 무게 30g으로 자동 환기기능을 갖추고 있으며 기존 측정기 대비 무게는 절반 이하(47.6%) 47.6%, 소비전력은 12.8%에 불과하다.
6V 소형 손목시계용 배터리로 4시간 동작이 가능하며 사람의 걸음에 해당하는 공기흐름인 0~1.5m/s에서 안정적으로 작동하기 때문에 움직이는 상태에서 성능을 유지하여야 하는 포터블, 웨어러블 기기로 사용가능하다는 장점이 있다.
이를 이용해 연구팀은 실내 또는 자동차 내에서 기존의 냉, 난방기에 비해 훨씬 더 인간과 교감 기능이 뛰어난 새로운 개념의 인지형 냉, 난방기를 제작할 예정이다.
조영호 교수는 “기존 냉난방기는 주변의 온, 습도 기준으로 쾌적감을 판단해 개인적으로 느끼는 쾌적감과 무관하지만 우리가 개발한 쾌적감 측정기는 개인적 쾌적감을 판단할 수 있어 새 개념의 개인맞춤형 지능형 냉, 난방기로 활용 가능하다”며 “나아가 미래사회에서는 인간의 신체적 건강 뿐 아니라 정신적 건강과 감정 상태의 관리가 필요하기에 향후 인간과 기계의 감성 교감을 이룰 수 있을 것이다”고 말했다.
이번 연구는 과학기술정보통신부의 중견연구자지원사업을 통해 수행됐으며 국내특허로 등록을 완료했다.
□ 그림 설명
그림1. 인간 열적 쾌적감 측정이 가능한 손목시계형 쾌적감 측정기
그림2. 손목시계형 쾌적감 측정기
그림3. 손목시계형 쾌적감 측정기의 동작 원리
2018.02.01 조회수 15799 -
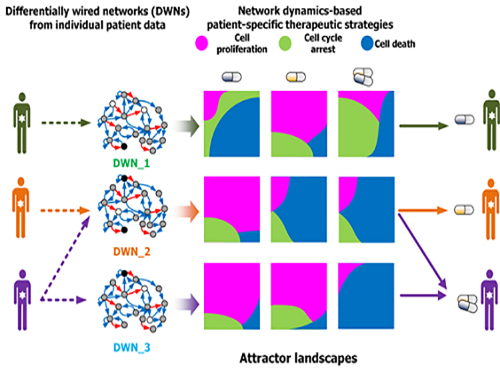 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 24202
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 24202