%EC%83%9D%EB%AA%85%EA%B3%BC%ED%95%99%EA%B3%BC
-
 도파민의 성질로 박테리아 생장의 실시간 탐지 기술 개발
우리 몸의 신경전달물질인 도파민의 성질을 이용해 박테리아(병원균)를 쉽게 검출할 수 있는 기술이 우리 대학 연구진에 의해 개발됐다.
생명과학과 정현정 교수, 화학과 이해신 교수 공동연구팀이 도파민의 반응을 이용해 병원균의 생장과 항생제 내성을 광학적으로 측정하고 맨눈으로 실시간 검출하는 기술을 개발했다고 7일 밝혔다.
박테리아의 항생제 내성 문제는 현대인의 건강을 위협하는 위험요인으로 꼽히고 있다. 항생제 내성에 대한 적절한 대처가 없다면 30년 이내에 항생제 내성균에 의한 피해가 암보다 더 현대인의 수명을 줄일 수 있다는 보고서가 발표되기도 했다. 항생제 내성균의 종류가 점차 늘어나면서 미국 질병통제예방센터(CDC)는 연간 최소 200만 명 이상의 환자가 항생제 내성 병원균에 의해 발생하고 있다고 보고했다.
도파민은 대다수 생명체에서 신경전달물질로 사용되며, 산소가 존재하는 환경에서 다른 물질의 도움 없이 자체 중합반응(두 개 이상 결합해 큰 화합물이 되는 일)이 일어난다. 이렇게 중합된 도파민 고분자는 짙은 갈색을 나타내고, 다양한 물질 표면에 흡착해 층을 형성한다.
연구팀은 이러한 도파민의 성질을 이용해 병원균이 생장하는지와 항생제 내성을 갖는지를 육안과 형광으로 동시에 탐지 가능한 기술을 개발했다. 이 기술은 현재 사용되는 디스크 확산 검사나 균 배양 분석에 대비해 시간이 짧고 중합효소 연쇄 반응(PCR 검사)과 비교할 때도 전처리 과정이 필요 없는 간편한 기술이라는 점이 큰 장점이다.
우리 대학 나노과학기술대학원 석박사통합과정 이주훈 학생이 제1 저자로, 나노과학기술대학원 석박사통합과정 류제성 학생과 생명과학과 강유경 박사가 공동 저자로 참여한 이번 연구 결과는 재료과학 분야 국제학술지 `어드밴스드 펑셔널 머티리얼즈(Advanced Functional Materials, IF 16.836)'에 11월 3일 字 온라인 게재됐다. (논문명 : Polydopamine Sensors of Bacterial Hypoxia via Fluorescence Coupling)
도파민의 자체 중합반응에서는 개시제 역할을 하는 산소가 필수적인 존재다. 연구팀은 박테리아가 생장함에 따라 용액 내의 산소를 소모하는 현상을 이용, 박테리아의 생장 정도를 도파민의 중합반응과 연관 지어 관측하는 방법을 개발했다.
또 박테리아의 생장에 영향을 끼치지 않는 소재인 덱스트란으로 형광나노입자를 제조해 실험에 사용했다. 도파민의 자체 중합반응은 용액 내에 존재하는 형광나노입자 표면에 흡착하고 층을 형성해 입자의 화학적, 물리적 성질에 큰 변화를 일으키고 기존에 발생하던 강한 형광 신호를 약하게 만든다. 또한, 도파민과 나노입자가 첨가된 용액 내에서는 도파민의 산화와 자체 중합반응 때문에 용액의 색이 짙은 갈색으로 변한다.
하지만 박테리아가 용액 내에 존재하는 경우 박테리아 생장 때문에 산소가 소모돼 도파민의 자체 중합반응은 저해되고 용액의 색깔은 투명하게 유지된다. 나노입자의 형광 신호 역시 원래의 신호를 유지하게 된다.
연구팀은 이러한 현상을 박테리아의 생장 및 항생제 내성을 탐지하는데 적용할 수 있다는 점에 착안, 항생제에 내성을 가지는 `뉴 델리 메탈로-베타락타마제 1 (NDM-1)'을 발현하는 대장균(E. coli)을 대상으로 실험을 진행했다.
일반적인 대장균의 경우 카바페넴 계열의 항생제인 암피실린에 의해 생장이 크게 저해되는데, 항생제에 내성을 갖는 대장균은 생장이 잘 이뤄진다. 즉 항생제 내성을 가지는지에 따라 소모하는 산소의 양이 달라지고, 이 차이 때문에 도파민의 중합반응 여부를 육안과 광학적 측정으로 확인할 수 있다.
이렇게 살아있는 세포의 활성에 따라 일어나는 도파민의 자체 중합반응은 실제로 인체에 존재하는 다양한 `카테콜아민' 물질에서 나타나는 반응과 깊은 관련이 있다. 일례로 피부에 존재하는 카테콜아민은 자체 중합반응이 왕성하게 일어나 피부의 색에 큰 영향을 주는 멜라닌 색소를 형성하게 되는데 신경계에 존재하는 카테콜아민은 자체 중합반응이 거의 일어나지 않고 단일분자 형태로 존재하여 작용하는 것으로 알려져 있다. 연구팀은 이번 연구 결과를 향후 생체 내에서 도파민 등 카테콜아민의 역할과 작용을 다양한 생체 모델에서 밝히는 연구로 발전시킨다면 매우 흥미로운 연구 결과를 얻을 것으로 기대하고 있다.
정현정 교수는 “이번 연구는 도파민의 자체 중합반응을 생체 시스템에서 규명한 연구로 큰 의미를 가지며, 이를 박테리아 생장 및 항생제 내성의 실시간 검출에 적용할 수 있어 기존의 미생물 배양법보다 신속하게, 그리고 PCR 검사보다 간편하게 진단이 가능해 감염병 확산 예방에 크게 기여할 것으로 기대된다”고 말했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업 및 KAIST 그랜드 챌린지 사업의 지원을 통해 이뤄졌다.
2020.12.07 조회수 47241
도파민의 성질로 박테리아 생장의 실시간 탐지 기술 개발
우리 몸의 신경전달물질인 도파민의 성질을 이용해 박테리아(병원균)를 쉽게 검출할 수 있는 기술이 우리 대학 연구진에 의해 개발됐다.
생명과학과 정현정 교수, 화학과 이해신 교수 공동연구팀이 도파민의 반응을 이용해 병원균의 생장과 항생제 내성을 광학적으로 측정하고 맨눈으로 실시간 검출하는 기술을 개발했다고 7일 밝혔다.
박테리아의 항생제 내성 문제는 현대인의 건강을 위협하는 위험요인으로 꼽히고 있다. 항생제 내성에 대한 적절한 대처가 없다면 30년 이내에 항생제 내성균에 의한 피해가 암보다 더 현대인의 수명을 줄일 수 있다는 보고서가 발표되기도 했다. 항생제 내성균의 종류가 점차 늘어나면서 미국 질병통제예방센터(CDC)는 연간 최소 200만 명 이상의 환자가 항생제 내성 병원균에 의해 발생하고 있다고 보고했다.
도파민은 대다수 생명체에서 신경전달물질로 사용되며, 산소가 존재하는 환경에서 다른 물질의 도움 없이 자체 중합반응(두 개 이상 결합해 큰 화합물이 되는 일)이 일어난다. 이렇게 중합된 도파민 고분자는 짙은 갈색을 나타내고, 다양한 물질 표면에 흡착해 층을 형성한다.
연구팀은 이러한 도파민의 성질을 이용해 병원균이 생장하는지와 항생제 내성을 갖는지를 육안과 형광으로 동시에 탐지 가능한 기술을 개발했다. 이 기술은 현재 사용되는 디스크 확산 검사나 균 배양 분석에 대비해 시간이 짧고 중합효소 연쇄 반응(PCR 검사)과 비교할 때도 전처리 과정이 필요 없는 간편한 기술이라는 점이 큰 장점이다.
우리 대학 나노과학기술대학원 석박사통합과정 이주훈 학생이 제1 저자로, 나노과학기술대학원 석박사통합과정 류제성 학생과 생명과학과 강유경 박사가 공동 저자로 참여한 이번 연구 결과는 재료과학 분야 국제학술지 `어드밴스드 펑셔널 머티리얼즈(Advanced Functional Materials, IF 16.836)'에 11월 3일 字 온라인 게재됐다. (논문명 : Polydopamine Sensors of Bacterial Hypoxia via Fluorescence Coupling)
도파민의 자체 중합반응에서는 개시제 역할을 하는 산소가 필수적인 존재다. 연구팀은 박테리아가 생장함에 따라 용액 내의 산소를 소모하는 현상을 이용, 박테리아의 생장 정도를 도파민의 중합반응과 연관 지어 관측하는 방법을 개발했다.
또 박테리아의 생장에 영향을 끼치지 않는 소재인 덱스트란으로 형광나노입자를 제조해 실험에 사용했다. 도파민의 자체 중합반응은 용액 내에 존재하는 형광나노입자 표면에 흡착하고 층을 형성해 입자의 화학적, 물리적 성질에 큰 변화를 일으키고 기존에 발생하던 강한 형광 신호를 약하게 만든다. 또한, 도파민과 나노입자가 첨가된 용액 내에서는 도파민의 산화와 자체 중합반응 때문에 용액의 색이 짙은 갈색으로 변한다.
하지만 박테리아가 용액 내에 존재하는 경우 박테리아 생장 때문에 산소가 소모돼 도파민의 자체 중합반응은 저해되고 용액의 색깔은 투명하게 유지된다. 나노입자의 형광 신호 역시 원래의 신호를 유지하게 된다.
연구팀은 이러한 현상을 박테리아의 생장 및 항생제 내성을 탐지하는데 적용할 수 있다는 점에 착안, 항생제에 내성을 가지는 `뉴 델리 메탈로-베타락타마제 1 (NDM-1)'을 발현하는 대장균(E. coli)을 대상으로 실험을 진행했다.
일반적인 대장균의 경우 카바페넴 계열의 항생제인 암피실린에 의해 생장이 크게 저해되는데, 항생제에 내성을 갖는 대장균은 생장이 잘 이뤄진다. 즉 항생제 내성을 가지는지에 따라 소모하는 산소의 양이 달라지고, 이 차이 때문에 도파민의 중합반응 여부를 육안과 광학적 측정으로 확인할 수 있다.
이렇게 살아있는 세포의 활성에 따라 일어나는 도파민의 자체 중합반응은 실제로 인체에 존재하는 다양한 `카테콜아민' 물질에서 나타나는 반응과 깊은 관련이 있다. 일례로 피부에 존재하는 카테콜아민은 자체 중합반응이 왕성하게 일어나 피부의 색에 큰 영향을 주는 멜라닌 색소를 형성하게 되는데 신경계에 존재하는 카테콜아민은 자체 중합반응이 거의 일어나지 않고 단일분자 형태로 존재하여 작용하는 것으로 알려져 있다. 연구팀은 이번 연구 결과를 향후 생체 내에서 도파민 등 카테콜아민의 역할과 작용을 다양한 생체 모델에서 밝히는 연구로 발전시킨다면 매우 흥미로운 연구 결과를 얻을 것으로 기대하고 있다.
정현정 교수는 “이번 연구는 도파민의 자체 중합반응을 생체 시스템에서 규명한 연구로 큰 의미를 가지며, 이를 박테리아 생장 및 항생제 내성의 실시간 검출에 적용할 수 있어 기존의 미생물 배양법보다 신속하게, 그리고 PCR 검사보다 간편하게 진단이 가능해 감염병 확산 예방에 크게 기여할 것으로 기대된다”고 말했다.
한편 이번 연구는 한국연구재단 중견연구자지원사업 및 KAIST 그랜드 챌린지 사업의 지원을 통해 이뤄졌다.
2020.12.07 조회수 47241 -
 커피링 효과로 감염성 병원균 신속 진단키트 개발
감염성 병원균을 현장에서 육안으로 신속하고 정확하게 검출할 수 있는 기술이 우리 연구진에 의해 개발됐다. 의료시설 접근이 어려운 환경에서, 그리고 분자진단(RT-PCR) 장비의 대안으로 빠른 사용과 활용이 기대된다.
우리 대학 생명과학과 정현정 교수 연구팀이 '커피링 등온 유전자 검출법(i-CoRi, isothermal coffee ring assay)' 개발에 성공했다고 16일 밝혔다.
'커피링 효과'란 사물 표면에 떨어진 커피 방울이 증발하면서 특징적인 링(ring) 모양이 생기는 효과다. 연구팀은 이 효과에서 아이디어를 얻어 상온에서 육안으로 병원균 유전자를 선택적으로 감별 및 고감도 검출이 가능한 기술을 개발했다. 이 기술은 RT-PCR 등 기존 분자진단 기술처럼 고가의 정밀한 장비가 필요한 문제점을 해소할 수 있다. 즉, 정 교수팀이 개발한 기술은 쉽고 간단한 POCT(point-of-care testing) 기술로 저가라는 게 큰 장점이다.
우리 대학 생명과학과 강유경 박사가 제1 저자로, 생명과학과 석박사통합과정 임산해, 나노과학기술대학원 석박사통합과정 류제성 학생이 공동저자로 참여한 이번 연구 결과는 바이오센서 분야 국제학술지 '바이오센서 앤 바이오일렉트로닉스(Biosensors & Bioelectronics, IF 10.257)' 9월 6일 字 온라인에 게재됐다. (논문명: Simple visualized readout of suppressed coffee ring patterns for rapid and isothermal genetic testing of antibacterial resistance)
정 교수 연구팀이 개발한 '커피링 등온 유전자 검출법'은 병원균 감염의 빠른 판별을 위해 시료를 표면에 떨어뜨려 커피링 패턴을 유도, 육안으로 관찰함으로써 병원균의 내성 종류를 선택적으로 정확하게 검출이 가능할 뿐 아니라 스마트폰 등을 이용한 모바일 진단이 가능한 기술이다.
콜로이드 용액이 기판 표면에서 증발할 때, 표면장력과 모세관 운동에 따라 미세입자들이 이를 포함하는 용액 방울 주변으로 이동해 특징적인 링 패턴을 형성한다. 연구팀은 표적 유전자 물질이 존재할 경우 미세입자와 유전자 물질의 선택적 인식에 의한 입자-핵산 물질 간 상호 응축을 유도해 링 패턴을 억제함으로써 병원균을 감별했다.
연구팀은 또 커피링 현상에 회전 환 증폭(rolling circle amplification) 기반의 등온 증폭기술을 융합했는데 융합과정에서 생성된 긴 단일 가닥의 표적 DNA 물질이 미세입자(직경 0.1~10 마이크로미터 가량) 크기로 응축되도록 효과를 극대화했다. 연구팀은 이밖에 *젭토 몰 농도 이하의 범위(sub-zeptomolar)에서도 병원균 표적 물질을 육안으로 검출하거나 스마트폰 등 모바일 장치를 통해 기록과 판독이 모두 가능한 기술을 개발했다.
☞ 젭토(zepto): 10^(-21) 을 뜻하는 접두어. 1 젭토 몰 농도는 용액 10 cc에 분자 6개가 존재하는 농도로, 기존의 현장 진단키트의 경우는 1 젭토 몰 농도의 약 1,000배 이상의 표적 물질이 존재해야 검출이 가능하다.
연구팀에서 개발한 '커피링 등온 유전자 검출' 기술은 신속하고 높은 선택성과 민감도를 지니고 있어 유전자상 2개 염기의 차이를 구별하며 별도의 분석 장비 없이 30분 이내에 항생제 내성 유전자 검출과 함께 혈청 등 복잡한 시료에서도 검출이 가능한 게 특징이다.
연구팀은 이와 함께 자동판독을 위한 진단키트로의 활용을 위해 미세입자에 의해 나타나는 공간 패턴의 이미지를 판독할 수 있는 알고리즘을 정립했고, 이를 통해 커피링 형성에 따른 감염 여부를 판별하는 데 성공했다.
정현정 교수는 "연구팀이 개발한 `커피링 등온 유전자 검출법'은 진료소나 클리닉 등에서 병상 분석을 위해서 유용하게 적용될 수 있을 것으로 기대된다ˮ면서 "현재 코로나바이러스감염증(COVID-19)을 진단하는 데 적용하기 위한 연구를 진행 중이다ˮ고 밝혔다.
이번 연구는 한국보건산업진흥원 감염병위기대응기술개발사업 및 한국연구재단의 중견연구자지원사업 지원을 통해 이뤄졌다.
2020.09.16 조회수 31431
커피링 효과로 감염성 병원균 신속 진단키트 개발
감염성 병원균을 현장에서 육안으로 신속하고 정확하게 검출할 수 있는 기술이 우리 연구진에 의해 개발됐다. 의료시설 접근이 어려운 환경에서, 그리고 분자진단(RT-PCR) 장비의 대안으로 빠른 사용과 활용이 기대된다.
우리 대학 생명과학과 정현정 교수 연구팀이 '커피링 등온 유전자 검출법(i-CoRi, isothermal coffee ring assay)' 개발에 성공했다고 16일 밝혔다.
'커피링 효과'란 사물 표면에 떨어진 커피 방울이 증발하면서 특징적인 링(ring) 모양이 생기는 효과다. 연구팀은 이 효과에서 아이디어를 얻어 상온에서 육안으로 병원균 유전자를 선택적으로 감별 및 고감도 검출이 가능한 기술을 개발했다. 이 기술은 RT-PCR 등 기존 분자진단 기술처럼 고가의 정밀한 장비가 필요한 문제점을 해소할 수 있다. 즉, 정 교수팀이 개발한 기술은 쉽고 간단한 POCT(point-of-care testing) 기술로 저가라는 게 큰 장점이다.
우리 대학 생명과학과 강유경 박사가 제1 저자로, 생명과학과 석박사통합과정 임산해, 나노과학기술대학원 석박사통합과정 류제성 학생이 공동저자로 참여한 이번 연구 결과는 바이오센서 분야 국제학술지 '바이오센서 앤 바이오일렉트로닉스(Biosensors & Bioelectronics, IF 10.257)' 9월 6일 字 온라인에 게재됐다. (논문명: Simple visualized readout of suppressed coffee ring patterns for rapid and isothermal genetic testing of antibacterial resistance)
정 교수 연구팀이 개발한 '커피링 등온 유전자 검출법'은 병원균 감염의 빠른 판별을 위해 시료를 표면에 떨어뜨려 커피링 패턴을 유도, 육안으로 관찰함으로써 병원균의 내성 종류를 선택적으로 정확하게 검출이 가능할 뿐 아니라 스마트폰 등을 이용한 모바일 진단이 가능한 기술이다.
콜로이드 용액이 기판 표면에서 증발할 때, 표면장력과 모세관 운동에 따라 미세입자들이 이를 포함하는 용액 방울 주변으로 이동해 특징적인 링 패턴을 형성한다. 연구팀은 표적 유전자 물질이 존재할 경우 미세입자와 유전자 물질의 선택적 인식에 의한 입자-핵산 물질 간 상호 응축을 유도해 링 패턴을 억제함으로써 병원균을 감별했다.
연구팀은 또 커피링 현상에 회전 환 증폭(rolling circle amplification) 기반의 등온 증폭기술을 융합했는데 융합과정에서 생성된 긴 단일 가닥의 표적 DNA 물질이 미세입자(직경 0.1~10 마이크로미터 가량) 크기로 응축되도록 효과를 극대화했다. 연구팀은 이밖에 *젭토 몰 농도 이하의 범위(sub-zeptomolar)에서도 병원균 표적 물질을 육안으로 검출하거나 스마트폰 등 모바일 장치를 통해 기록과 판독이 모두 가능한 기술을 개발했다.
☞ 젭토(zepto): 10^(-21) 을 뜻하는 접두어. 1 젭토 몰 농도는 용액 10 cc에 분자 6개가 존재하는 농도로, 기존의 현장 진단키트의 경우는 1 젭토 몰 농도의 약 1,000배 이상의 표적 물질이 존재해야 검출이 가능하다.
연구팀에서 개발한 '커피링 등온 유전자 검출' 기술은 신속하고 높은 선택성과 민감도를 지니고 있어 유전자상 2개 염기의 차이를 구별하며 별도의 분석 장비 없이 30분 이내에 항생제 내성 유전자 검출과 함께 혈청 등 복잡한 시료에서도 검출이 가능한 게 특징이다.
연구팀은 이와 함께 자동판독을 위한 진단키트로의 활용을 위해 미세입자에 의해 나타나는 공간 패턴의 이미지를 판독할 수 있는 알고리즘을 정립했고, 이를 통해 커피링 형성에 따른 감염 여부를 판별하는 데 성공했다.
정현정 교수는 "연구팀이 개발한 `커피링 등온 유전자 검출법'은 진료소나 클리닉 등에서 병상 분석을 위해서 유용하게 적용될 수 있을 것으로 기대된다ˮ면서 "현재 코로나바이러스감염증(COVID-19)을 진단하는 데 적용하기 위한 연구를 진행 중이다ˮ고 밝혔다.
이번 연구는 한국보건산업진흥원 감염병위기대응기술개발사업 및 한국연구재단의 중견연구자지원사업 지원을 통해 이뤄졌다.
2020.09.16 조회수 31431 -
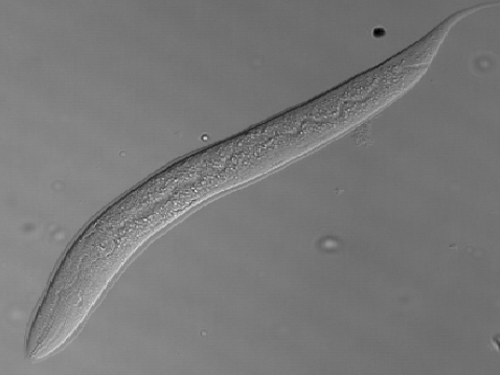 1mm 크기 예쁜꼬마선충에서 노화 늦추는 단백질 찾았다
우리 대학 연구진이 '예쁜꼬마선충'(C. elegans)에서 수명 연장을 돕는 단백질을 찾아냈다.
우리 대학 생명과학과 이승재 교수와 포항공대 김경태 교수 연구팀이 예쁜꼬마선충에서 세포 내 에너지 조절 센서인 'AMPK'를 활성화해 노화를 지연시키는 단백질 'VRK-1'을 발견했다.
예쁜꼬마선충은 몸길이 1㎜ 정도의 선충류다. 배양이 쉽고 사람과 유전 정보 특성이 닮아 실험동물로 널리 활용된다.
한편 에너지 센서라 불리는 AMPK는 공복이나 운동 등으로 에너지 수준이 낮아질 때 활성화돼 세포가 항상성을 유지하도록 돕는다.
예쁜꼬마선충과 생쥐, 초파리 등에서 AMPK가 식이를 제한해 수명 연장을 돕는 역할을 한다는 연구는 그동안 활발히 진행되어 왔지만, AMPK를 자극하는 상위 조절 인자는 알려지지 않았다.
연구팀은 VRK1이 활성화될 때 2만여개의 예쁜꼬마선충 유전자가 단백질로 발현되는 패턴이 AMPK가 활성화될 때의 패턴과 비슷하다는 사실을 발견했다.
VRK1은 AMPK를 인산화시키고, 인산화된 AMPK는 미토콘드리아가 세포에 에너지를 공급하는 데 필수적인 과정인 '전자 전달계'의 기능을 억제함으로써 노화를 늦춘다는 것도 확인했다.
실제 VRK1의 자극에 반응하지 않는 AMPK 돌연변이 예쁜꼬마선충에서는 수명 연장 효과가 나타나지 않았다.
생명과학과 이승재 교수는 "이번 연구 결과는 AMPK 이상으로 인한 대사질환 치료와 항노화 약물 개발에 기여할 것"이라고 말했다.
한편, 이번 연구 결과는 국제 학술지 '사이언스 어드밴시스'(Science Advances) 7월 2일 자에 실렸다.
2020.07.16 조회수 29740
1mm 크기 예쁜꼬마선충에서 노화 늦추는 단백질 찾았다
우리 대학 연구진이 '예쁜꼬마선충'(C. elegans)에서 수명 연장을 돕는 단백질을 찾아냈다.
우리 대학 생명과학과 이승재 교수와 포항공대 김경태 교수 연구팀이 예쁜꼬마선충에서 세포 내 에너지 조절 센서인 'AMPK'를 활성화해 노화를 지연시키는 단백질 'VRK-1'을 발견했다.
예쁜꼬마선충은 몸길이 1㎜ 정도의 선충류다. 배양이 쉽고 사람과 유전 정보 특성이 닮아 실험동물로 널리 활용된다.
한편 에너지 센서라 불리는 AMPK는 공복이나 운동 등으로 에너지 수준이 낮아질 때 활성화돼 세포가 항상성을 유지하도록 돕는다.
예쁜꼬마선충과 생쥐, 초파리 등에서 AMPK가 식이를 제한해 수명 연장을 돕는 역할을 한다는 연구는 그동안 활발히 진행되어 왔지만, AMPK를 자극하는 상위 조절 인자는 알려지지 않았다.
연구팀은 VRK1이 활성화될 때 2만여개의 예쁜꼬마선충 유전자가 단백질로 발현되는 패턴이 AMPK가 활성화될 때의 패턴과 비슷하다는 사실을 발견했다.
VRK1은 AMPK를 인산화시키고, 인산화된 AMPK는 미토콘드리아가 세포에 에너지를 공급하는 데 필수적인 과정인 '전자 전달계'의 기능을 억제함으로써 노화를 늦춘다는 것도 확인했다.
실제 VRK1의 자극에 반응하지 않는 AMPK 돌연변이 예쁜꼬마선충에서는 수명 연장 효과가 나타나지 않았다.
생명과학과 이승재 교수는 "이번 연구 결과는 AMPK 이상으로 인한 대사질환 치료와 항노화 약물 개발에 기여할 것"이라고 말했다.
한편, 이번 연구 결과는 국제 학술지 '사이언스 어드밴시스'(Science Advances) 7월 2일 자에 실렸다.
2020.07.16 조회수 29740 -
 우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24311
우리 대학 졸업생 김광수 미 하버드 의대 교수, 맞춤형 줄기세포로 파킨슨병 임상 치료에 세계 최초로 성공
우리 대학 생명과학과 석·박사 졸업생(1983년)이면서 미국 하버드 의대 교수로 재직 중인 재미 한인 과학자가 지난 5월, 세계 최초로 파킨슨병을 앓고 있는 환자 본인의 피부세포를 도파민 신경세포로 변형해 뇌에 이식하는 방법으로 환자 맞춤형 줄기세포 임상 치료에 성공해 화제가 되고 있다.
세계 최고의 권위를 자랑하는 의학 분야 저널인 뉴잉글랜드 의학 저널(New England Journal of Medicine, 이하 NEJM, IF=70) 誌는 환자의 피부세포를 변형, 신경전달물질 도파민을 생성케 한 후 이를 파킨슨병 환자의 뇌 깊숙이 주입 시킨 결과, 면역체계의 거부반응 없이 구두끈을 다시 묶을 수 있을 뿐만 아니라 수영과 자전거를 탈 정도로 운동능력을 회복했다고 지난달 14일 소개했다. 이 파킨슨병 환자의 임상 치료 성공 소식은 뉴욕타임스, 로이터, 뉴스위크, 사이언스데일리, USNEWS 등 전 세계 유명 일간지를 통해 일제히 보도돼 큰 주목을 받았다.
화제의 주인공은 美 하버드 의대 맥린병원(McLean Hospital, Harvard Medical School) 분자신경생물학 실험실 소장 김광수 교수다. 우리 대학 대학원 석·박사 졸업생인 김광수 교수는 신경과학과 줄기세포 분야의 세계적인 석학이며, 현재 모교인 우리 대학에서 해외초빙 석좌교수와 총장 자문위원을 맡고 있다.
파킨슨병은 치매, 뇌졸중과 더불어 3대 만성 퇴행성 뇌 신경계 질환으로 꼽히는데 국내에만 11만 명에 달하는 환자가 있으며 그 수는 매년 꾸준히 증가하고 있다. 영화배우 마이클 제이 폭스, 前 세계 헤비급 챔피언 무하마드 알리와 264대 교황 요한 바오로 2세(재위 1978~2005년) 등 유명 인사들이 투병했으며 전 세계적으로 600만~1천만 명의 환자가 있다.
이 병의 발병 원인은 뇌에서 신경 전달 물질 도파민을 분비하는 신경세포가 사멸하기 때문이며 근육의 떨림, 느린 움직임, 신체의 경직, 보행 및 언어 장애 등의 증상을 가진다. 김광수 교수 연구팀은 세계 최초로 환자의 피부세포를 도파민 신경세포로 만드는 `역분화 줄기세포' 기술로 파킨슨병 환자를 임상 치료하는 데 성공했다.
2012년 노벨 생리의학상 수상자인 일본의 신야 야마나카(Shinya Yamanaka) 교수가 `유도만능 줄기세포(induced pluripotent stem cells, 이하 iPS)' 제조 기술을 개발했지만, 이 기술이 뇌 질환 환자치료에 적용돼 성공한 사례는 아직 없다. 전 세계적으로 단 한 명의 환자(황반변성증)가 자신의 iPS를 이용해 세포치료를 받은 적이 있긴 하지만(2017년 New England Journal of Medicine에 발표), 이 경우 병의 호전은 일어나지 않았다. 따라서 iPS를 사용해 피킨슨병 환자 맞춤형 치료를 시도한 것도, 성공한 사례도 김광수 교수 연구팀이 세계에서 맨 처음으로 꼽힌다.
파킨슨병의 맞춤형 줄기세포 치료를 위해서는 환자의 체세포를 안정적으로 줄기세포로 전환한 뒤 이를 다시 도파민 세포로 분화시킨 후 뇌에 이식해야 한다. 이 모든 과정은 고효율로 진행돼야 하며 유해성이나 부작용이 없어야만 가능하다. 이런 난관을 극복하기 위해 김광수 교수는 맞춤형 줄기세포 치료를 위한 연구에 오랫동안 집중해 왔다.
김광수 교수 연구팀은 지난 2009년과 2011년에 각각 바이러스를 사용하지 않고 환자의 세포로부터 유도만능 줄기세포를 제작하는 기술을 최초로 개발해 파킨슨병 동물 모델에 적용할 수 있음을 보고한 바 있다(Cell Stem Cell 2009a; Journal of Clinical Investigation, 2011).
연구팀은 또 도파민 신경의 분화 메커니즘을 밝혀 줄기세포를 효율적으로 분화하는 원리를 제시했다(Cell Sem Cell, 2009b). 이와 함께 2017년에는 역분화 과정에서 발생하는 대사 변화의 메커니즘 규명을 통해 임상 적용이 가능한 새로운 역분화 기술을 개발했다(Nature Cell Biology, 2017). 또 그간 개발한 기술을 기반으로 제조된 도파민 신경세포를 파킨슨 동물 모델에 이식했을 때 암세포 등의 부작용 없이 파킨슨 증상이 현저하게 호전되는 것을 입증하는데 성공했다(Journal of Clinical Investigation, 2020).
김 교수는 20여 년간 연구해온 기술을 활용해 까다롭기로 유명한 미국 식품의약국(FDA)의 최종 승인을 받고 FDA 요청에 의해 지난 2017년과 2018년 2차례에 걸쳐 69세 파킨슨병 환자에게 도파민 신경세포를 면역체계의 거부반응 없이 작용토록 세계 최초로 이식 수술을 진행했다. 이후 2년 동안 PET, MRI 영상 등 후속 테스트를 마친 후, 올 5월 임상 치료에 성공했음을 발표했다. 이식 수술을 받은 환자는 조지 로페즈(George Lopez) 氏로 의사이자 사업가이며 발명가다. 그는 맞춤형 줄기세포의 신속한 연구와 파킨슨병 정복을 위해 애써 달라며 김광수 교수 연구팀을 꾸준히 지원해 오고 있는 것으로 알려졌다.
뉴잉글랜드 의학 저널(New England Journal of Medicine(IF=70))이 맞춤형 줄기세포로 파킨슨병 임상 치료에 성공했다고 밝혀 화제가 된 로페즈 氏의 뇌 이식 수술을 직접 집도한 의사인 매사추세츠 제너럴 병원(Massachusetts General Hospital) 제프리 슈바이처 박사는 "매우 고무적인 임상 치료결과ˮ라고 말했다.
김광수 교수는 "향후 안정성과 효능성 입증을 위해 더 많은 환자를 대상으로 임상실험이 필요하며 FDA의 승인을 위해 필요한 절차를 밟고 있다ˮ고 말했다. 김 교수는 이어 "10여 년 정도 후속 연구를 계속 성공적으로 수행하면 맞춤형 세포치료가 파킨슨병 치료를 위한 또 하나의 보편적인 치료 방법으로 자리 잡게 될 것ˮ이라고 기대했다.
2020.06.04 조회수 24311 -
 머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27 조회수 15782
머리에 빛을 비춰 신경세포 재생과 공간기억 향상
뇌질환 상태에서 신경재생으로 일시적인 기억향상이 일어나는 기전이 밝혀졌다.
우리 대학 생명과학과 허원도 교수 연구팀은 머리에 빛을 비춰 뇌신경세포 내 Fas 수용체의 활성을 조절함으로써 신경재생과 공간기억 능력이 향상됨을 보였다.
Fas 수용체는 허혈성 뇌질환, 염증성 뇌질환, 퇴행성 신경질환 등 다양한 대뇌질환에 걸린 경우 발현이 유도되는 단백질이다. 일반적으로는 세포를 죽음에 이르게 하지만, 신경계의 다양한 세포들에서는 세포증식 관련 신호전달 경로를 활성화시켜 세포를 재생시킨다. 특히, 뇌질환에 걸린 경우 대뇌 해마의 신경재생에 Fas 수용체가 관련되어 있다는 사실이 알려져 왔으나, 연구방법의 한계로 세부적인 기전에 대해서는 아직 자세히 알려진 바가 없다. 또한, 질환이 있는 뇌에서 해마가 관장하는 공간기억이 Fas 단백질에 의해 어떻게 영향받는지에 대해서도 논란이 되어 왔다.
연구팀은 광수용체 단백질의 유전자에 Fas 수용체 단백질의 유전자를 결합시킴으로써 청색광을 쬐어주면 Fas 단백질의 활성이 유도되는 옵토파스(OptoFAS) 기술을 개발했다. 살아있는 생쥐 대뇌에 다양한 시간동안 빛을 쬐어주면서 시공간적으로 Fas 수용체 단백질의 활성을 조절함으로써 대뇌 해마에서 여러 신호전달 경로들이 순차적으로 활성화되고, 그 결과로 신경재생과 공간기억 능력이 향상된다는 것을 확인했다.
옵토파스(OptoFAS) 기술은 빛을 이용하여 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 배양시킨 세포나 살아있는 생쥐 머리에 청색광을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 하위 신호전달경로들을 활성화시킨다. 생체 내에 광섬유를 삽입하여 원하는 시간에 빛을 뇌 조직 내로 전달하는 방식으로 선택적으로 단백질을 활성화시킬 수 있다.
연구팀은 빛을 이용해 대뇌 해마의 치아이랑에 존재하는 미성숙신경세포에서 옵토파스를 활성화시키고, 빛을 쬐어주는 시간에 따라 미성숙신경세포와 신경줄기세포에서 각각 서로 다른 하위 신호전달경로가 활성화됨을 관찰했다. 또한 이 현상에 특정 뇌유래 신경성장인자가 관여함을 밝혀내었다. 반복적으로 충분한 시간동안 빛을 쬐어주면 해마 치아이랑의 신경줄기세포가 증식하는 성체 신경재생이 관찰되었으며, 실험 대상 쥐에서는 일시적으로 공간기억 능력이 향상됨을 밝혔다.
옵토파스 기술을 이용하면 약물을 처리하거나 유전자변형 쥐를 사용하였을 때 발생하는 여러 부작용이 없이 빛 자극만으로 쥐의 생리현상에 지장을 주지 않으면서 뇌신경세포에서 Fas 단백질의 활성을 실시간으로 조절할 수 있다. 질환이 있는 뇌에서 Fas 단백질이 활성화되어 질병에 맞서 대뇌의 기능을 보호하는 여러 가지 역할을 한다는 사실을 생각해볼 때, 향후 세포 수준을 물론 개체 수준까지 뇌질환 상태에서의 신경행동적인 변화를 규명하는 연구에 활용될 것으로 기대한다.
허원도 교수는 “옵토파스(OptoFAS) 기술을 이용하면 빛만으로 살아있는 개체의 신경세포 내에서 단백질의 활성과 신호전달 경로를 쉽게 조절할 수 있다”며 “이 기술이 뇌인지 과학 연구를 비롯해 향후 대뇌질환 치료제 개발 등에 다양하게 적용되길 바란다”고 말했다.
이번 연구결과는 국제 학술지 사이언스 어드밴시즈(Science Advances, IF 12.80)에 4월 23일 오전 3시(한국시간) 온라인 게재됐다.
2020.04.27 조회수 15782 -
 두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
2020.04.23 조회수 17390
두뇌 인지 기능 조절하는 신경 펩타이드 발견
우리 대학 생명과학과 이승희 교수 연구팀이 두뇌에 존재하는 신경 펩타이드 중 하나인 소마토스타틴(somatostatin)이 두뇌 인지 기능을 높일 수 있음을 밝혔다.
이 교수 연구팀은 특정 가바(뇌세포 대사 기능을 억제 신경 안정 작용을 하는 신경 전달 억제 물질) 분비 신경 세포에서 분비되는 펩타이드 중 하나인 소마토스태틴이 시각 피질의 정보 처리 과정을 조절하고 높일 수 있음을 규명했다. 이번 연구 성과는 치매 등의 뇌 질환에서 인지 능력 회복을 위한 치료제 개발의 계기가 될 것으로 기대된다.
생명과학과 송유향 박사, 황양선 석사, 바이오및뇌공학과 김관수 박사과정, 서울대학교 의과학대학 이형로 박사과정이 공동 1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘사이언스 어드밴시스 (Science Advances)’ 4월 22일 자 온라인판에 게재됐다(논문명 : Somatostatin enhances visual processing and perception by modulating excitatory inputs to the parvalbumin-positive interneurons in V1).
2019년 기준 국내 65세 이상 노인 중 10명 중 1명은 치매 질환을 갖고 있다. 치매는 기억력 손실, 인지 기능 및 운동기능 저하 등의 일상생활 장애를 유발해 그 심각성은 나날이 두드러지고 있다.
이승희 교수 연구팀은 치매의 한 종류인 알츠하이머 질환 환자의 뇌척수액에서 소마토스타틴의 발현율이 현저히 감소했다는 점에 주목해 소마토스타틴에 의한 인지 능력 회복 가능성을 밝히는 연구를 수행했다.
소마토스타틴은 인간을 포함한 포유류의 중추신경계에서 존재한다. 특히 정상적인 포유류의 대뇌 피질에서 소마토스타틴을 발현하는 신경 세포인 가바(GABA, γ-aminobutyric acid)를 신경전달물질로 분비해 흥분성 신경 세포의 활성을 억제함으로써 정보 처리 정도를 조율한다.
그러나 기존 연구는 가바의 효과에만 국한돼, 동시에 분비될 수 있는 신경 펩타이드인 소마토스타틴의 고유한 효과 관련 연구는 부족한 상황이다.
연구팀은 자유롭게 움직이는 실험용 생쥐에서 시각정보 인지 및 식별 능력을 측정할 수 있는 실험 장비를 개발 및 도입했다. 이를 통해 생쥐의 시각피질 또는 뇌척수액에 소마토스타틴을 직접 주입한 후 이를 관찰해 생쥐의 시각정보 인지 능력이 현저히 증가함을 발견했다.
나아가 소마토스타틴의 처리에 따른 생체 내 또는 뇌 절편에서의 신경 세포 간 신경전달 효율의 변화를 측정하고, 해당 신경망을 연속 볼록면 주사전자현미경(SBEM)으로 관찰해 소마토스타틴에 의한 시각인지 기능의 향상이 이루어지는 생체 내 신경 생리적 원리를 규명했다.
이러한 연구 성과는 향후 인간을 비롯한 포유류의 두뇌 인지 기능을 조절 가능할 수 있을 뿐 아니라 퇴행성 뇌 질환 등에서 나타나는 인지 기능 장애 치료에 폭넓게 응용 및 적용될 수 있을 것으로 기대된다.
이승희 교수는 “이번 연구는 두뇌 기능을 높이고, 뇌 질환을 치료할 수 있는 새로운 약물 개발로 이어질 수 있을 것으로 기대한다”라고 말했다.
이번 연구는 한국연구재단 중견연구자 지원사업의 지원을 받아 수행됐다.
2020.04.23 조회수 17390 -
 미생물의 새로운 C1 가스 흡수 대사회로 규명
생명과학과 조병관 교수 연구팀이 미생물이 C1 가스(이산화탄소, 일산화탄소 등 단일 탄소로 이뤄진 가스)를 활용하는 새로운 대사 회로 메커니즘을 규명했다. 연구팀이 규명한 새 대사회로는 현재까지 알려진 관련 대사회로 중 가장 우수한 효율을 갖고 있어 향후 C1 가스를 고부가가치 생화학물질로 전환하는 산업적 응용에 활용 가능할 것으로 기대된다.
조병관 교수와 UNIST 김동혁 교수 공동 연구팀이 수행하고 KAIST 송요셉 박사가 1 저자로 참여한 이번 연구결과는 국제 학술지 미국국립과학원회보(PNAS) 3월 13일 자 온라인판에 게재됐다.(논문명 : Functional cooperation of the glycine synthase-reductase and Wood-Ljungdahl pathways for autotrophic growth of Clostridium drakei)
현재까지 자연계에 알려진 C1 가스를 유기물로 전환하는 대사회로는 총 6개이며, 대표적인 예로 식물의 광합성을 들 수 있다. 그중 미생물인 아세토젠 내에서 발견되는 우드-융달 대사회로는 C1 가스의 흡수 대사회로 중 가장 효율적인 회로로 알려져 있다. 특히 아세토젠은 다양한 환경에서 서식할 수 있어 1년에 1천억kg의 아세틸산(아세토젠의 생산물)을 생산하며 지구 탄소 순환에 큰 영향을 끼친다.
그러나 아세토젠 미생물은 대장균과 같은 산업 미생물과 비교했을 때 생장 속도가 10배 이상 느리다. 이는 C1 가스를 유용한 생화학물질로 변환하기 위한 산업적 미생물로 이용되기에 한계점으로 작용한다. 이에 C1 가스 고정을 더욱 효율적으로 할 수 있는 새로운 대사경로 연구가 활발히 이뤄지고 있다.
연구팀은 문제 해결을 위해 아세토젠 미생물 중 하나인 클로스트리디움 드라케이(Clostridium drakei)가 이산화탄소 흡수 시 다른 미생물에 비해 빠른 성장 속도를 나타내는 점에 주목해, C1 가스 전환효율을 높일 실마리를 찾아낼 수 있을 것으로 예측했다. 연구팀은 차세대시퀀싱 기술을 이용한 게놈서열 및 유전자 분석을 통해 디지털 가상 세포를 구축하고 C1 가스의 흡수 대사경로 효율을 예측했다. 이 결과 현재까지 보고되지 않은 새로운 7번째 대사회로의 존재를 발견했다.
우드-융달 대사 회로와 글리신 생합성 대사회로가 결합돼 C1 가스 고정과 동시에 세포 생장에 필요한 에너지를 획득하는 새로운 형태의 대사회로의 존재를 규명했다. 연구팀은 대사 회로를 구성하는 유전자의 발현량, 동위원소를 이용한 대사경로 흐름 추적, 유전자가위 기술 등을 통해 클로스트리디움 드라케이 미생물이 실제로 새로운 대사 회로를 사용해 C1 가스를 흡수하는 것을 증명했다. 더불어 관련 유전자들을 세포 생장 속도가 느린 다른 아세토젠 미생물에 도입한 결과 빠른 속도로 C1 가스를 사용하여 생장함을 확인했다.
조 교수는 “연구팀이 발굴한 신규 C1 가스 고정 대사 회로를 이용해 아세토젠 미생물의 느린 생장 속도로 인한 고부가가치 생화학물질 생합성 한계를 극복할 수 있기를 기대한다”라고 말했다.
이번 연구결과는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 사업 및 지능형바이오시스템 설계 및 합성 연구단(글로벌프론티어사업)의 지원과 KAIST 초세대 협력연구실 사업(바이오디자인 연구실)의 지원을 받아 수행됐다.
2020.03.26 조회수 19395
미생물의 새로운 C1 가스 흡수 대사회로 규명
생명과학과 조병관 교수 연구팀이 미생물이 C1 가스(이산화탄소, 일산화탄소 등 단일 탄소로 이뤄진 가스)를 활용하는 새로운 대사 회로 메커니즘을 규명했다. 연구팀이 규명한 새 대사회로는 현재까지 알려진 관련 대사회로 중 가장 우수한 효율을 갖고 있어 향후 C1 가스를 고부가가치 생화학물질로 전환하는 산업적 응용에 활용 가능할 것으로 기대된다.
조병관 교수와 UNIST 김동혁 교수 공동 연구팀이 수행하고 KAIST 송요셉 박사가 1 저자로 참여한 이번 연구결과는 국제 학술지 미국국립과학원회보(PNAS) 3월 13일 자 온라인판에 게재됐다.(논문명 : Functional cooperation of the glycine synthase-reductase and Wood-Ljungdahl pathways for autotrophic growth of Clostridium drakei)
현재까지 자연계에 알려진 C1 가스를 유기물로 전환하는 대사회로는 총 6개이며, 대표적인 예로 식물의 광합성을 들 수 있다. 그중 미생물인 아세토젠 내에서 발견되는 우드-융달 대사회로는 C1 가스의 흡수 대사회로 중 가장 효율적인 회로로 알려져 있다. 특히 아세토젠은 다양한 환경에서 서식할 수 있어 1년에 1천억kg의 아세틸산(아세토젠의 생산물)을 생산하며 지구 탄소 순환에 큰 영향을 끼친다.
그러나 아세토젠 미생물은 대장균과 같은 산업 미생물과 비교했을 때 생장 속도가 10배 이상 느리다. 이는 C1 가스를 유용한 생화학물질로 변환하기 위한 산업적 미생물로 이용되기에 한계점으로 작용한다. 이에 C1 가스 고정을 더욱 효율적으로 할 수 있는 새로운 대사경로 연구가 활발히 이뤄지고 있다.
연구팀은 문제 해결을 위해 아세토젠 미생물 중 하나인 클로스트리디움 드라케이(Clostridium drakei)가 이산화탄소 흡수 시 다른 미생물에 비해 빠른 성장 속도를 나타내는 점에 주목해, C1 가스 전환효율을 높일 실마리를 찾아낼 수 있을 것으로 예측했다. 연구팀은 차세대시퀀싱 기술을 이용한 게놈서열 및 유전자 분석을 통해 디지털 가상 세포를 구축하고 C1 가스의 흡수 대사경로 효율을 예측했다. 이 결과 현재까지 보고되지 않은 새로운 7번째 대사회로의 존재를 발견했다.
우드-융달 대사 회로와 글리신 생합성 대사회로가 결합돼 C1 가스 고정과 동시에 세포 생장에 필요한 에너지를 획득하는 새로운 형태의 대사회로의 존재를 규명했다. 연구팀은 대사 회로를 구성하는 유전자의 발현량, 동위원소를 이용한 대사경로 흐름 추적, 유전자가위 기술 등을 통해 클로스트리디움 드라케이 미생물이 실제로 새로운 대사 회로를 사용해 C1 가스를 흡수하는 것을 증명했다. 더불어 관련 유전자들을 세포 생장 속도가 느린 다른 아세토젠 미생물에 도입한 결과 빠른 속도로 C1 가스를 사용하여 생장함을 확인했다.
조 교수는 “연구팀이 발굴한 신규 C1 가스 고정 대사 회로를 이용해 아세토젠 미생물의 느린 생장 속도로 인한 고부가가치 생화학물질 생합성 한계를 극복할 수 있기를 기대한다”라고 말했다.
이번 연구결과는 과학기술정보통신부와 한국연구재단이 추진하는 C1 가스 리파이너리 사업 및 지능형바이오시스템 설계 및 합성 연구단(글로벌프론티어사업)의 지원과 KAIST 초세대 협력연구실 사업(바이오디자인 연구실)의 지원을 받아 수행됐다.
2020.03.26 조회수 19395 -
 빛으로 RNA 이동과 단백질 합성 조절한다
빛으로 세포 내 특정 RNA 이동과 단백질 합성을 조절할 수 있는 기술이 개발됐다. 생명과학과 허원도 교수 연구팀이 빛을 이용해 유전정보를 전달하는 전령RNA와 단백질을 생성하는 리보솜의 결합을 제어해 단백질 합성을 조절하는데 성공했다.
이번 연구성과는 네이처 셀 바이올로지(Nature Cell Biology, IF 17.728)에 2월 18일 오전 1시(한국시간)자 온라인 판에 실렸으며, Nature Reviews Genetics에 하이라이트 논문으로 소개됐다.
DNA의 유전정보는 RNA를 거쳐 단백질로 전달된다. 이때 중간에서 유전정보를 전달하는 RNA를 ‘전령RNA’라고 한다. 단백질 생성공장인 리보솜이 전령RNA의 유전정보를 읽어 단백질을 합성한다. 단백질 합성에 있어 전령RNA는 DNA 유전정보의 중간 전달자, 리보솜은 생성공장, 단백질은 완성품인 셈이다.
이전에는 화학물질을 처리해 전령RNA를 조절하는 방법으로 모든 전령RNA를 한꺼번에 조절하기 때문에 특정 종류의 전령RNA만을 세밀하게 조절하기 어려웠다. 이번 연구에서는 살아있는 세포에 청색광을 비춰줌으로써 세포 내 특정 전령RNA 이동 및 단백질 합성을 시공간 특이적으로 조절하는 mRNA-LARIAT 광유전학 기술을 개발했다.
연구팀은 이전 연구로 개발한 라리아트 올가미(LARIAT, Light-Activated Reversible Inhibition by Assembled Trap) 기술과 RNA 이미징 기술을 융합해 mRNA-LARIAT 기술을 개발했다. mRNA-LARIAT 광유전학 기술을 이용하면 빛의 유무에 따라 라리아트 올가미에 전령RNA를 가두거나 분리하고, 이를 실시간으로 관찰하는 것이 가능하다.
연구팀은 헬라 세포에 청색광을 비춰주면 라리아트 올가미에 전령RNA가 가둬지면서 리보솜과 격리되고 단백질 합성이 감소함을 관찰했다. 이어 청색광을 차단하면 라리아트 올가미로부터 전령RNA가 빠져나오면서 리보솜과 단백질 합성을 다시 시작함을 확인했다. 이는 mRNA-LARIAT 광유전학 기술로 빛의 유무에 따라 매우 빠르고 가역적으로 단백질 합성을 조절할 수 있음을 의미한다.
대부분 단백질은 전령RNA와 리보솜에 의해 합성된 후, 각 단백질이 작용하는 위치로 이동한다. 하지만 전령RNA가 라리아트 올가미에 가둬지면 전령RNA가 향후 단백질이 작용하는 위치까지 이동이 멈추고 단백질 합성이 차단된다. 전령RNA는 단백질보다 비교적 작은 분자로, 세포 내 이동이 더 효율적이고 빠르다. 이처럼 mRNA-LARIAT 광유전학 기술로 전령RNA 이동 및 단백질 합성을 빛으로 조절하면 살아있는 세포에서의 RNA의 위치 및 합성되는 신생 단백질의 기능을 효율적으로 연구할 수 있게 되었다.
연구팀은 베타액틴(β-actin) 단백질 합성에 관여하는 전령RNA에 mRNA-LARIAT 기술을 적용했다. 베타액틴 단백질 합성에 관여하는 전령RNA에 청색광을 비추니 세포 골격 구성 및 이동 기능이 제대로 이뤄지지 않음을 관찰했다. 또한 베타액틴 단백질 합성 효율이 최대 90%까지 감소됨을 확인했다.
허원도 교수는 “mRNA-LARIAT 광유전학 기술을 활용하면 암세포, 신경세포 등 다양한 세포 내 전령RNA 이동 및 단백질 합성을 빛으로 조절할 수 있다”라며 “앞으로 암세포 전이, 신경질환 등 전령 RNA 관련 질병 연구에 응용 가능할 것이다”라고 말했다.
2020.02.21 조회수 20842
빛으로 RNA 이동과 단백질 합성 조절한다
빛으로 세포 내 특정 RNA 이동과 단백질 합성을 조절할 수 있는 기술이 개발됐다. 생명과학과 허원도 교수 연구팀이 빛을 이용해 유전정보를 전달하는 전령RNA와 단백질을 생성하는 리보솜의 결합을 제어해 단백질 합성을 조절하는데 성공했다.
이번 연구성과는 네이처 셀 바이올로지(Nature Cell Biology, IF 17.728)에 2월 18일 오전 1시(한국시간)자 온라인 판에 실렸으며, Nature Reviews Genetics에 하이라이트 논문으로 소개됐다.
DNA의 유전정보는 RNA를 거쳐 단백질로 전달된다. 이때 중간에서 유전정보를 전달하는 RNA를 ‘전령RNA’라고 한다. 단백질 생성공장인 리보솜이 전령RNA의 유전정보를 읽어 단백질을 합성한다. 단백질 합성에 있어 전령RNA는 DNA 유전정보의 중간 전달자, 리보솜은 생성공장, 단백질은 완성품인 셈이다.
이전에는 화학물질을 처리해 전령RNA를 조절하는 방법으로 모든 전령RNA를 한꺼번에 조절하기 때문에 특정 종류의 전령RNA만을 세밀하게 조절하기 어려웠다. 이번 연구에서는 살아있는 세포에 청색광을 비춰줌으로써 세포 내 특정 전령RNA 이동 및 단백질 합성을 시공간 특이적으로 조절하는 mRNA-LARIAT 광유전학 기술을 개발했다.
연구팀은 이전 연구로 개발한 라리아트 올가미(LARIAT, Light-Activated Reversible Inhibition by Assembled Trap) 기술과 RNA 이미징 기술을 융합해 mRNA-LARIAT 기술을 개발했다. mRNA-LARIAT 광유전학 기술을 이용하면 빛의 유무에 따라 라리아트 올가미에 전령RNA를 가두거나 분리하고, 이를 실시간으로 관찰하는 것이 가능하다.
연구팀은 헬라 세포에 청색광을 비춰주면 라리아트 올가미에 전령RNA가 가둬지면서 리보솜과 격리되고 단백질 합성이 감소함을 관찰했다. 이어 청색광을 차단하면 라리아트 올가미로부터 전령RNA가 빠져나오면서 리보솜과 단백질 합성을 다시 시작함을 확인했다. 이는 mRNA-LARIAT 광유전학 기술로 빛의 유무에 따라 매우 빠르고 가역적으로 단백질 합성을 조절할 수 있음을 의미한다.
대부분 단백질은 전령RNA와 리보솜에 의해 합성된 후, 각 단백질이 작용하는 위치로 이동한다. 하지만 전령RNA가 라리아트 올가미에 가둬지면 전령RNA가 향후 단백질이 작용하는 위치까지 이동이 멈추고 단백질 합성이 차단된다. 전령RNA는 단백질보다 비교적 작은 분자로, 세포 내 이동이 더 효율적이고 빠르다. 이처럼 mRNA-LARIAT 광유전학 기술로 전령RNA 이동 및 단백질 합성을 빛으로 조절하면 살아있는 세포에서의 RNA의 위치 및 합성되는 신생 단백질의 기능을 효율적으로 연구할 수 있게 되었다.
연구팀은 베타액틴(β-actin) 단백질 합성에 관여하는 전령RNA에 mRNA-LARIAT 기술을 적용했다. 베타액틴 단백질 합성에 관여하는 전령RNA에 청색광을 비추니 세포 골격 구성 및 이동 기능이 제대로 이뤄지지 않음을 관찰했다. 또한 베타액틴 단백질 합성 효율이 최대 90%까지 감소됨을 확인했다.
허원도 교수는 “mRNA-LARIAT 광유전학 기술을 활용하면 암세포, 신경세포 등 다양한 세포 내 전령RNA 이동 및 단백질 합성을 빛으로 조절할 수 있다”라며 “앞으로 암세포 전이, 신경질환 등 전령 RNA 관련 질병 연구에 응용 가능할 것이다”라고 말했다.
2020.02.21 조회수 20842 -
 소금 섭취 제어할 수 있는 신체 메커니즘 규명
우리 대학 생명과학과 손종우 교수 연구팀이 각종 성인병의 원인으로 알려진 과도한 소금 섭취를 제어할 수 있는 메커니즘을 규명하는 데 성공했다.
이번 연구를 통해 향후 소금의 섭취를 적절하게 제한하는 전략 수립에 도움을 줌으로써 고혈압, 신부전 등 소금 섭취와 밀접하게 관련된 각종 질병 치료에 이바지할 수 있을 것으로 기대된다.
박시형 박사과정이 1 저자로 참여하고, 미국 텍사스 주립대학 사우스웨스턴 메디컬 센터 첸 리우(Chen Liu) 교수와의 공동연구로 진행한 이번 연구 결과는 국제 학술지 ‘네이처 뉴로사이언스(Nature Neuroscience)’ 1월 20일 자 온라인판에 게재됐다. (논문명 : A Neural Basis for Tonic Suppression of Sodium Appetite)
우리 몸의 체액은 혈액, 간질액 등을 포함하는 세포외액과 세포내액으로 구성돼 있다. 소금의 주요 성분인 나트륨 이온은 세포외액에 분포돼 삼투 현상에 의해 세포내액에 있는 수분을 끌어당긴다.
체내에 나트륨 이온이 과량 존재하면 혈액과 간질액의 부피가 증가해 혈압 상승, 부종 발생 등이 일어날 수 있어 적정한 수준으로 소금을 섭취하는 것이 중요하다.
특히 신부전 등과 같이 체액량 조절이 중요한 질병이 있는 환자의 경우 과도한 소금 섭취가 치명적임에도 적절한 조절이 어려운 것이 현실이다. 따라서 많은 의사와 과학자들이 소금 섭취를 효과적으로 제어할 방법에 대해 고민해 왔다.
손종우 교수 연구팀은 중요한 신경 전달 물질 중 하나인 세로토닌의 기능에 주목했다. 뇌줄기 안에 있는 세로토닌 반응성 신경 세포가 평상시에도 활성화돼 있어 이 세포가 소금의 섭취를 억제한다는 사실을 밝혀냈다. 그리고 세로토닌에 반응하는 현상을 재현하면 이 신경 세포의 활성이 억제돼 소금 섭취가 증가하는 현상을 확인했다.
최근 미국의 연구팀 등이 체액량이 감소했을 때 활성화돼 소금의 섭취를 증가시키는 신경 회로를 제시한 바 있으나, 평상시에 소금 섭취를 억제하는 메커니즘이 존재하고 이를 활용해 소금 섭취를 제어할 수 있다는 것은 손 교수 연구팀이 최초로 발견했다.
손종우 교수는 "소금 섭취를 제어할 수 있는 메커니즘을 분자 수준에서 규명한 것으로 향후 고혈압, 신부전 등 과도한 소금 섭취와 관련된 각종 질환 치료에 도움이 될 것으로 기대된다"라고 말했다.
또한, "소금 섭취 욕구와 세로토닌 신경회로 간의 상관관계를 규명했으나, 어떤 상황에서 세로토닌이 분비되는지는 아직 밝혀지지 않아 이 부분에 대한 연구에 집중할 계획이다"라고 밝혔다.
이번 연구는 삼성미래기술육성재단과 KAIST 시스템헬스케어사업 및 석박사모험연구사업의 지원을 통해 수행됐다.
□ 그림 설명
2020.02.12 조회수 10082
소금 섭취 제어할 수 있는 신체 메커니즘 규명
우리 대학 생명과학과 손종우 교수 연구팀이 각종 성인병의 원인으로 알려진 과도한 소금 섭취를 제어할 수 있는 메커니즘을 규명하는 데 성공했다.
이번 연구를 통해 향후 소금의 섭취를 적절하게 제한하는 전략 수립에 도움을 줌으로써 고혈압, 신부전 등 소금 섭취와 밀접하게 관련된 각종 질병 치료에 이바지할 수 있을 것으로 기대된다.
박시형 박사과정이 1 저자로 참여하고, 미국 텍사스 주립대학 사우스웨스턴 메디컬 센터 첸 리우(Chen Liu) 교수와의 공동연구로 진행한 이번 연구 결과는 국제 학술지 ‘네이처 뉴로사이언스(Nature Neuroscience)’ 1월 20일 자 온라인판에 게재됐다. (논문명 : A Neural Basis for Tonic Suppression of Sodium Appetite)
우리 몸의 체액은 혈액, 간질액 등을 포함하는 세포외액과 세포내액으로 구성돼 있다. 소금의 주요 성분인 나트륨 이온은 세포외액에 분포돼 삼투 현상에 의해 세포내액에 있는 수분을 끌어당긴다.
체내에 나트륨 이온이 과량 존재하면 혈액과 간질액의 부피가 증가해 혈압 상승, 부종 발생 등이 일어날 수 있어 적정한 수준으로 소금을 섭취하는 것이 중요하다.
특히 신부전 등과 같이 체액량 조절이 중요한 질병이 있는 환자의 경우 과도한 소금 섭취가 치명적임에도 적절한 조절이 어려운 것이 현실이다. 따라서 많은 의사와 과학자들이 소금 섭취를 효과적으로 제어할 방법에 대해 고민해 왔다.
손종우 교수 연구팀은 중요한 신경 전달 물질 중 하나인 세로토닌의 기능에 주목했다. 뇌줄기 안에 있는 세로토닌 반응성 신경 세포가 평상시에도 활성화돼 있어 이 세포가 소금의 섭취를 억제한다는 사실을 밝혀냈다. 그리고 세로토닌에 반응하는 현상을 재현하면 이 신경 세포의 활성이 억제돼 소금 섭취가 증가하는 현상을 확인했다.
최근 미국의 연구팀 등이 체액량이 감소했을 때 활성화돼 소금의 섭취를 증가시키는 신경 회로를 제시한 바 있으나, 평상시에 소금 섭취를 억제하는 메커니즘이 존재하고 이를 활용해 소금 섭취를 제어할 수 있다는 것은 손 교수 연구팀이 최초로 발견했다.
손종우 교수는 "소금 섭취를 제어할 수 있는 메커니즘을 분자 수준에서 규명한 것으로 향후 고혈압, 신부전 등 과도한 소금 섭취와 관련된 각종 질환 치료에 도움이 될 것으로 기대된다"라고 말했다.
또한, "소금 섭취 욕구와 세로토닌 신경회로 간의 상관관계를 규명했으나, 어떤 상황에서 세로토닌이 분비되는지는 아직 밝혀지지 않아 이 부분에 대한 연구에 집중할 계획이다"라고 밝혔다.
이번 연구는 삼성미래기술육성재단과 KAIST 시스템헬스케어사업 및 석박사모험연구사업의 지원을 통해 수행됐다.
□ 그림 설명
2020.02.12 조회수 10082 -
 허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
2020.01.22 조회수 10445
허원도 교수, 머리에 빛 비춰 기억 및 공감능력 향상 기술 개발
우리 대학 생명과학과 허원도 교수 연구팀이 머리에 빛을 비춰 뇌신경세포 내 칼슘 농도를 조절함으로써 공간기억 및 공감 능력을 높이는 비침습적인 기술을 개발했다.
이번 연구결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 1월 10일 자 온라인 판에 게재됐다.
칼슘은 세포 기능에 중요한 물질로, 세포 이동, 분열, 유전자 발현, 신경 전달 물질 분비, 항상성 유지 등에 폭넓게 관여한다. 세포가 제 기능을 잘 수행하기 위해서는 세포 내 칼슘 농도가 적절하게 조절돼야 한다.
세포 내 칼슘 양이 부족해지면 인지장애, 심장부정맥 등 다양한 질환으로 이어질 수 있다. 허원도 교수 연구팀은 이전 연구에서 세포에 빛을 비춰 세포 내 칼슘 농도를 조절하는 옵토스팀원(OptoSTIM1) 기술을 개발하여 네이처 바오이테크놀로지(Nature Biotechnology) 2015년 9월호 표지논문으로 보고한 바 있다.
옵토스팀원(OptoSTIM1) 기술은 빛을 이용하여 비침습적으로 세포의 기능을 조절하는 광유전학(Optogenetics) 기술이다. 쥐 머리에 청색 빛을 쬐어주면 광수용체 단백질 여러 개가 결합되며, 이 단백질 복합체가 세포의 칼슘 통로를 열면 세포 내로 칼슘이 유입된다. 외과적 시술에 비해 비침습적이긴 하나, 옵토스팀원(OptoSTIM1) 기술을 이용하려면 생체 내에 광섬유를 삽입해 빛을 뇌 조직 내로 전달하는 과정이 필요하다. 광섬유 삽입은 털, 피부, 머리뼈, 생체 조직 손상 및 면역력 약화 등 부작용을 유발한다는 문제점이 있다.
연구진은 옵토스팀원 기술에서 사용했던 광수용체 단백질의 유전자를 변형시킴으로써 빛에 민감도를 55배 증가시킨 몬스팀원(monSTIM1) 기술을 개발했다. 청색 빛에 대한 민감도를 크게 높여 광섬유 삽입 없이 살아있는 쥐의 머리에 손전등 강도의 빛을 쬐어주는 것만으로도 뇌신경세포의 칼슘 조절이 가능해졌다. 이를 이용해 수술 없이 살아있는 동물의 뇌신경세포의 활성화를 유도할 수 있기 때문에 향후 세포 수준뿐만 아니라 개체 수준에서의 칼슘 역할 규명이 가능할 것으로 기대된다.
연구진은 쥐의 뇌세포에 몬스팀원을 발현시키고, 뇌가 손상되지 않은 쥐의 머리 위에 청색광을 쬐어 비침습적으로 칼슘 신호를 활성화했다. 머리뼈 근처에 위치하는 뇌 피질뿐만 아니라 뇌 깊숙하게 위치한 해마와 시상까지도 칼슘 신호가 활성화됐다. 추가적으로 뇌 전대상 피질의 흥분성 신경세포에 몬스팀원 기술을 적용하여 행동 변화를 관찰했다. 살아있는 쥐에서 빛 자극을 통해 칼슘 신호가 증가하고 생쥐의 공간기억이 증가하고 공감능력이 향상됨을 관찰했다.
비침습적인 빛 자극으로 쥐의 생리학적 현상에 지장을 주지 않는 상태에서 뇌의 칼슘 신호를 실시간으로 조절할 수 있어 뇌 연구에 다양하게 적용 가능하다. 칼슘에 의한 신경 행동적인 변화에 대한 연구를 생체 모델에서 하기 위해 더 향상된 기술이다.
허원도 교수는“몬스팀원(monSTIM1) 기술을 이용하면 빛을 이용하면 뇌를 손상하지 않고 비침습적으로 세포 내 칼슘 신호를 쉽게 조작할 수 있다”라며 “이 기술이 뇌세포 칼슘 연구, 뇌인지 과학 연구 등에 다양하게 적용 되길 바란다”라고 말했다.
2020.01.22 조회수 10445 -
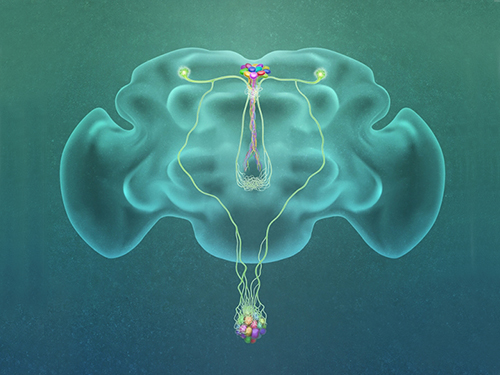 서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
2019.10.24 조회수 16059
서성배 교수, 당뇨에 큰 영향 미치는 뇌 혈당조절 신경세포 발견
〈 오양균 박사, 서성배 교수 〉
우리 대학 생명과학과 서성배 교수와 뉴욕대학교(NYU) 오양균 박사 공동연구팀이 초파리 모델 시스템을 이용해 뇌 속에 체내 혈당에 직접적인 기능을 하는 포도당 감지 신경세포를 발견하고 그 구체적인 원리를 밝혔다.
이번 연구는 초파리 뇌 속의 포도당 감지 신경세포가 인슐린 생산 조직 활성화, 글루카곤 생산 조직 활동 억제 등을 통해 체내 혈당 조절에 어떻게 관여하는지를 처음으로 밝혀낸 중요한 단서로, 당뇨병의 진단 및 치료에 새로운 가능성을 열 것으로 기대된다.
생명과학과 출신의 오양균 박사가 1 저자로 참여하고 서성배 교수가 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘네이처(Nature)’ 10월 23일 자 온라인판에 게재됐다. (논문명 :A glucose-sensing neuron pair regulates insulin and glucagon in Drosophila)
한국인의 당뇨병 유병률은 14%로 2018년 기준 환자 500만 명을 돌파했다. 당뇨병 증가속도 세계 1위, 잠재적 환자는 4명 중 1명꼴이지만 발병원인은 정확하게 규명되지 않았다. 유전적 요인과 환경적 요인이 존재하지만 대부분 췌장 인슐린 분비세포 기능이 저하되면서 병이 시작되는 것으로 알려져 있다.
최근에는 뇌가 당뇨병의 정도에 영향을 미칠 수 있다는 사실이 밝혀지기도 했다. 대부분 당뇨병 환자에게 스트레스가 당뇨병 증세에 영향을 미치고 혈당 조절을 어렵게 하는데 뇌 어딘가에 존재하는, 알려지지 않은 혈당 조절 능력 때문이라는 것이 학계 주장이다.
서성배 교수 연구팀은 오래전부터 초파리를 이용해 혀나 내장기관뿐 아니라 동물의 뇌 속에도 포도당을 감지하는 세포와 수용체가 존재한다는 사실을 연구해왔다. 인간 두뇌의 시상하부나 후뇌 등에 포도당을 감지하는 신경세포가 존재할 것이라는 점은 예측돼왔지만, 이런 세포들이 어떻게 포도당을 감지해 몸의 각 부위에 명령을 내리는지에 대한 연구는 지금까지 없었다.
연구팀은 초파리 전체 뇌 신경조직을 대상으로 한 광범위한 스크리닝을 통해 초파리가 포도당의 영양적 가치를 판단하는데 필수적인 한 쌍의 신경세포를 발견했다. 이 한 쌍의 신경세포가 체내 포도당 농도 증가에 반응해 활성화되는 특징을 가지고 있음을 파악했다.
연구팀은 약학적, 유전학적 방식을 사용해 이들 세포가 인간의 췌장 세포와 유사한 분자적 시스템을 통해 포도당을 인지한다는 사실을 확인했다. 이를 기반으로 연구팀은 포도당 감지 신경세포가 어떠한 신경세포 및 조직에 신호를 전달하는지에 대해 연구했다.
연구팀은 해당 신경세포가 초파리의 인슐린 생산을 담당하는 신경조직(insulin-producing cells, IPCs)과 글루카곤의 기능을 하는 단백질을 생산하는 조직(AKH-producing cells)에 각각 축삭돌기(Axon, 신경 세포체에서 뻗어 나온 돌기)를 이루고 있음을 확인했다.
이 결과는 한 쌍의 포도당 감지 신경세포가 체내 혈당 조절에 중요한 호르몬을 생산하는 조직들에 직접 체내 영양 정보를 전달할 수 있다는 가능성을 발견한 것이다.
이를 확인하기 위해서 연구팀은 포도당 감지 신경세포와 두 호르몬 분비 조직들 사이의 물리적, 기능적 상호작용들을 확인했다. 그 결과 한 쌍의 포도당 감지 신경세포가 활성화된 경우 인슐린 생산 조직 역시 활성화되며 반면에 글루카곤 생산 조직의 활동은 억제됨을 확인했다.
또한, 연구팀은 포도당 감지 신경세포를 억제할 경우 인슐린 생산 조직의 억제로 인해 혈중 인슐린 농도가 감소하며, 글루카곤 생산 조직에 대한 억제가 사라짐에 따라 혈중 글루카곤 농도가 증가 됨을 확인했다. 이들 호르몬의 변화로 인해 혈중 포도당 농도가 유의미하게 증가함을 최종적으로 확인했다.
뇌 속에 단 한 쌍의 포도당 감지 신경세포만의 활동을 조절함으로써 당뇨병의 증상을 가지는 초파리를 인위적으로 만들 수 있는 것이다.
한발 더 나아가 연구팀은 초파리에서 신경전달 기능을 하는 짧은 단백질의 한 종류인 sNPF(small Neuropeptide F)가 해당 포도당 감지 신경세포에서 발현됨을 파악하고 포도당에 노출됐을 때 이 신경전달물질이 분비됨을 확인했다. 또한, 연구팀은 인슐린 생산 조직과 글루카곤 생산 조직에서 sNPF 의 수용체가 포도당 감지 신경세포의 신호를 받는데 필수적인 역할을 함을 증명했다.
서성배 교수는 “이번 연구 결과는 초파리에서 의미 있는 발견을 했다는 사실을 넘어 당뇨병 원인 규명과 치료의 패러다임을 근본적으로 바꿀 수 있는 계기를 마련한 것이다”라며 “뇌에서 만들어지는 신호가 체내 혈당 조절에 근본적인 역할을 함이 구체적으로 규명되면 한 단계 진보된 당뇨병의 진단 및 치료뿐 아니라 비만, 대사질환 치료도 가능해질 것이다”라고 말했다.
□ 그림 설명
그림1,2. 서성배 교수 연구성과 개념도. 혈당에 반응하는 CN neuron의 Axon이 두 갈래로 갈라지며 갈라진 axonal branch는 인슐린을 만드는 세포를 활성화시키고 다른 갈라진 axonal branch는 글루카곤을 만드는 세포를 억제시킴
2019.10.24 조회수 16059 -
 허원도 교수, 항체를 빛으로 활성화 시키는 항체광유전학 기술 개발
〈 (좌측부터) 허원도 KAIST 생명과학과 교수, 유다슬이 KAIST 생명과학과 석박통학과정〉
빛으로 면역 반응을 조절할 수 있는 길이 열렸다. 우리대학 생명과학과 허원도 교수 연구팀은 항체를 빛으로 활성화시켜 특정 단백질을 억제하도록 만드는 광유전학 광유전학(Optogenetics) 기술을 개발하였다.
감염이나 질병으로부터 우리 몸을 보호하는 방어 체계를 면역이라고 한다. 항체는 Y자 형태의 단백질로, 면역에서 가장 중요한 역할을 하는 물질 중 하나다. 각설탕보다 가루설탕이 물에 더 잘 녹는 것처럼, 긴 항체보다 짧은 항체 조각이 세포 내에서 더 잘 녹는다. 이런 특징 때문에 항체 조각들은 오래전부터 생물학적 도구나 의약품 재료로 사용되어왔다.
연구진은 빛을 이용해 항체의 활성화를 조절하는 옵토바디(Optobody, Optogenetically activated intracellular antibody) 기술을 개발하였다. 녹색형광단백질(GFP)을 인지하는 가장 작은 항체 조각인 ‘GFP 나노바디’에 청색광을 쬐어주면 재결합되어 활성화됨을 관찰하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제함을 확인하였다. 또한 옵토바디 기술을 GFP 나노바디 이외에도 기존에 널리 사용 중인 항체 조각들에 다양하게 적용하였다.
〈 항체 조각과 Optobody 모식도〉
또한 연구진은 화학물질을 이용해 항체의 활성화를 조절하는 케모바디(Chemobody, Chemically activated intracellular antibody) 기술을 추가로 개발하였다. 둘로 쪼개져 있던 항체 조각을 라파마이신(Rapamysin) 으로 재결합시켜 활성화됨을 확인하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제하는 것을 관찰하였다.
이번 연구는 항체광유전학 기술을 개발하여, 항체 조각이 쪼개지면 비활성화되고 재결합하면 활성화된다는 것을 밝혔다는 데 의의가 있다. 각각의 단백질은 자신만의 기능을 갖는다. 활성화된 항체가 특정 단백질을 억제했을 때 감소되는 기능을 추적하면, 해당 단백질의 기능을 알 수 있다. 또한 활성화된 항체를 단백질의 실시간 활성 및 이동을 관찰하는 바이오센서로도 이용할 수 있다.
기존의 항체 활성을 조절하는 방법은 화학물질을 이용해 항체의 발현을 유도하는 방법에 국한되어 있었으며, 항체 활성을 정밀하게 조절하기 어려웠다. 이번 연구로 빛을 이용하여 항체 활성을 빠른 시간 내에 시공간적으로 세밀하게 조절하는 것이 가능해졌다. 향후 이 기술은 항체광유전학 분야 및 항체의약품에 크게 응용될 것으로 보인다.
허원도 교수는 “이번 연구로 개발한 항체광유전학기술은 빛으로 세포 내 단백질의 기능을 제어하는 연구에 적용할 수 있고, 더 나아가 앞으로 다양한 질병을 치료하는 항체개발과 차세대 면역항암제 개발에 많이 활용되리라 기대한다”고 말했다.
이번 연구는 기초과학연구원(IBS, 원장 대행 김영덕) 인지 및 사회성 연구단(단장 신희섭, 이창준) 산하에서 시행되었으며 연구결과는 세계적 학술지 네이처 메소드(Nature Methods, IF 28.467)에 10월 15일 0시(한국시간)에 게재되었다.
2019.10.15 조회수 17170
허원도 교수, 항체를 빛으로 활성화 시키는 항체광유전학 기술 개발
〈 (좌측부터) 허원도 KAIST 생명과학과 교수, 유다슬이 KAIST 생명과학과 석박통학과정〉
빛으로 면역 반응을 조절할 수 있는 길이 열렸다. 우리대학 생명과학과 허원도 교수 연구팀은 항체를 빛으로 활성화시켜 특정 단백질을 억제하도록 만드는 광유전학 광유전학(Optogenetics) 기술을 개발하였다.
감염이나 질병으로부터 우리 몸을 보호하는 방어 체계를 면역이라고 한다. 항체는 Y자 형태의 단백질로, 면역에서 가장 중요한 역할을 하는 물질 중 하나다. 각설탕보다 가루설탕이 물에 더 잘 녹는 것처럼, 긴 항체보다 짧은 항체 조각이 세포 내에서 더 잘 녹는다. 이런 특징 때문에 항체 조각들은 오래전부터 생물학적 도구나 의약품 재료로 사용되어왔다.
연구진은 빛을 이용해 항체의 활성화를 조절하는 옵토바디(Optobody, Optogenetically activated intracellular antibody) 기술을 개발하였다. 녹색형광단백질(GFP)을 인지하는 가장 작은 항체 조각인 ‘GFP 나노바디’에 청색광을 쬐어주면 재결합되어 활성화됨을 관찰하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제함을 확인하였다. 또한 옵토바디 기술을 GFP 나노바디 이외에도 기존에 널리 사용 중인 항체 조각들에 다양하게 적용하였다.
〈 항체 조각과 Optobody 모식도〉
또한 연구진은 화학물질을 이용해 항체의 활성화를 조절하는 케모바디(Chemobody, Chemically activated intracellular antibody) 기술을 추가로 개발하였다. 둘로 쪼개져 있던 항체 조각을 라파마이신(Rapamysin) 으로 재결합시켜 활성화됨을 확인하고, 활성화된 항체 조각이 세포 이동에 관여하는 단백질을 억제하는 것을 관찰하였다.
이번 연구는 항체광유전학 기술을 개발하여, 항체 조각이 쪼개지면 비활성화되고 재결합하면 활성화된다는 것을 밝혔다는 데 의의가 있다. 각각의 단백질은 자신만의 기능을 갖는다. 활성화된 항체가 특정 단백질을 억제했을 때 감소되는 기능을 추적하면, 해당 단백질의 기능을 알 수 있다. 또한 활성화된 항체를 단백질의 실시간 활성 및 이동을 관찰하는 바이오센서로도 이용할 수 있다.
기존의 항체 활성을 조절하는 방법은 화학물질을 이용해 항체의 발현을 유도하는 방법에 국한되어 있었으며, 항체 활성을 정밀하게 조절하기 어려웠다. 이번 연구로 빛을 이용하여 항체 활성을 빠른 시간 내에 시공간적으로 세밀하게 조절하는 것이 가능해졌다. 향후 이 기술은 항체광유전학 분야 및 항체의약품에 크게 응용될 것으로 보인다.
허원도 교수는 “이번 연구로 개발한 항체광유전학기술은 빛으로 세포 내 단백질의 기능을 제어하는 연구에 적용할 수 있고, 더 나아가 앞으로 다양한 질병을 치료하는 항체개발과 차세대 면역항암제 개발에 많이 활용되리라 기대한다”고 말했다.
이번 연구는 기초과학연구원(IBS, 원장 대행 김영덕) 인지 및 사회성 연구단(단장 신희섭, 이창준) 산하에서 시행되었으며 연구결과는 세계적 학술지 네이처 메소드(Nature Methods, IF 28.467)에 10월 15일 0시(한국시간)에 게재되었다.
2019.10.15 조회수 17170