%EC%9D%98%EA%B3%BC%ED%95%99%EB%8C%80%ED%95%99%EC%9B%90
-
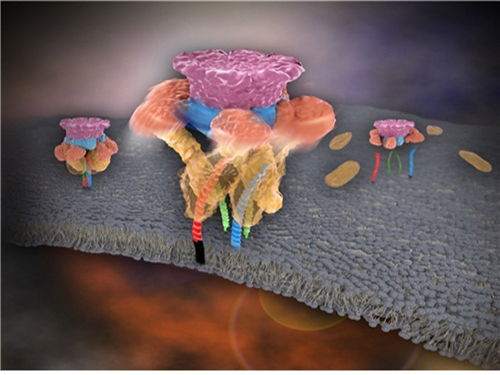 신경세포 전달 후 분해 원리 30년 만에 규명
윤태영 교수
2013년도의 노벨 생리의학상은 제임스 로스먼, 랜디 셰크먼, 토마스 쥐트호프에게 돌아갔다. 그들은 신경전달물질, 호르몬 등의 주요 물질이 자루 모양의 지질막인 소포(vesicles)에 담겨 택배처럼 전달되는 과정을 발생시키는 단백질을 발견한 공로를 인정받았다.
수상자들은 소포의 막을 열어 세포막과 융합해 물질을 분출하는 방식으로 에너지를 전달하는 역할인 스네어(SNARE)라는 단백질과, 물질을 분출한 후의 스네어 단백질 재활용을 위해 기능하는 NSF라는 단백질을 발견했다.
우리에게 잘 알려진 보톡스도 스네어 단백질의 작용 과정을 역으로 이용한 것이다. 보톡스가 스네어를 절단해 소포가 세포막과 융합하지 못하게 만들어 신경전달물질의 방출을 막고, 그로인해 근육의 수축을 방해하는 것이다.
이런 운송 업무가 있기 때문에 우리 세포는 신체 곳곳에 단백질과 같은 물질이 공급돼 정상적인 기능을 할 수 있다.
우리 대학 물리학과 윤태영 교수 연구팀은 그간 명확하지 않았던 NSF가 스네어 결합체를 분해해 세포수송을 지속시키는 원리를 규명했다고 밝혔다.
이번 연구 결과는 저명 학술지 사이언스지 3월 27일자에 게재됐다.
NSF와 스네어 단백질은 30여 년 전에 발견됐지만 각각의 물질이 작용하는 방식은 명확히 규명되지 않았다. 특히 세포막과 결합한 스네어 결합체를 NSF가 어떤 방법으로 분해해 재활용하는지에 대해선 의견이 분분했다.
지금까지 과학자들은 NSF가 스네어 결합체를 분해할 때 끈을 조금씩 푸는 것처럼 점진적인 과정을 통해 분해가 이뤄지고, 하나의 스네어 결합체를 분해하는 데 ATP라는 연료 역할을 하는 유기화합물 수십 개가 필요하다는 가설을 주장했다.
하지만 윤 교수팀의 연구는 단분자 형광 기법과 자기집게 기술(magnetic tweezers)을 사용해 가설을 반박했다. 마치 매듭의 양 끝을 잡고 당기면 한 번에 풀리듯, ATP를 주입하면 NSF가 스프링처럼 에너지를 저장했다가 스네어 결합체 전체를 단번에 폭발적으로 풀어냄을 증명한 것이다.
이번에 규명된 NSF는 근육의 이동, 단백질 분해, DNA의 복제 및 이동 등 신체에서 중요한 역할을 하는 AAA+ 단백질 그룹에 속해있다. 따라서 NSF와 비슷한 구조의 AAA+ 단백질 그룹은 함께 동작할 것으로 예상되며, 앞으로 많은 생물 현상 이해의 주춧돌이 될 것으로 보인다.
스네어 단백질은 신경세포 통신과 인슐린 분비 등에 중추적 역할을 하고 있어 윤 교수팀의 성과는 알츠하이머와 같은 퇴행성 뇌질환, 당뇨병과 같은 대사질환 관련 연구 뿐 아니라 피부미용 연구에도 이바지 할 것으로 기대된다.
윤 교수는 “생물 물리 분야에서 우리나라가 최고수준의 기초과학 연구력을 보유하고 있음을 증명했다”며 “이번 연구결과는 여러 대사질환을 분자수준에서 이해할 수 있는 토대가 될 것”이라고 말했다.
이번 연구는 고등과학원의 현창봉 교수팀, 독일 막스 플랑크 연구소 라인하르트 얀(Reinhard Jahn) 교수팀, 우리 대학 의과학대학원 김호민 교수팀과의 공동 연구로 진행됐으며, 윤 교수 연구팀의 류제경, 민두영 박사, 나상현 학생의 주도로 이뤄졌다.
□ 그림 설명
그림 1. 신경전달물질의 분비가 끝난 후 NSF가 SNARE 단백질 복합체를 한 번에 분해하는 모습
그림 2. NSF 가 SNARE 복합체를 풀어내는 모습
2015.03.27 조회수 14702
신경세포 전달 후 분해 원리 30년 만에 규명
윤태영 교수
2013년도의 노벨 생리의학상은 제임스 로스먼, 랜디 셰크먼, 토마스 쥐트호프에게 돌아갔다. 그들은 신경전달물질, 호르몬 등의 주요 물질이 자루 모양의 지질막인 소포(vesicles)에 담겨 택배처럼 전달되는 과정을 발생시키는 단백질을 발견한 공로를 인정받았다.
수상자들은 소포의 막을 열어 세포막과 융합해 물질을 분출하는 방식으로 에너지를 전달하는 역할인 스네어(SNARE)라는 단백질과, 물질을 분출한 후의 스네어 단백질 재활용을 위해 기능하는 NSF라는 단백질을 발견했다.
우리에게 잘 알려진 보톡스도 스네어 단백질의 작용 과정을 역으로 이용한 것이다. 보톡스가 스네어를 절단해 소포가 세포막과 융합하지 못하게 만들어 신경전달물질의 방출을 막고, 그로인해 근육의 수축을 방해하는 것이다.
이런 운송 업무가 있기 때문에 우리 세포는 신체 곳곳에 단백질과 같은 물질이 공급돼 정상적인 기능을 할 수 있다.
우리 대학 물리학과 윤태영 교수 연구팀은 그간 명확하지 않았던 NSF가 스네어 결합체를 분해해 세포수송을 지속시키는 원리를 규명했다고 밝혔다.
이번 연구 결과는 저명 학술지 사이언스지 3월 27일자에 게재됐다.
NSF와 스네어 단백질은 30여 년 전에 발견됐지만 각각의 물질이 작용하는 방식은 명확히 규명되지 않았다. 특히 세포막과 결합한 스네어 결합체를 NSF가 어떤 방법으로 분해해 재활용하는지에 대해선 의견이 분분했다.
지금까지 과학자들은 NSF가 스네어 결합체를 분해할 때 끈을 조금씩 푸는 것처럼 점진적인 과정을 통해 분해가 이뤄지고, 하나의 스네어 결합체를 분해하는 데 ATP라는 연료 역할을 하는 유기화합물 수십 개가 필요하다는 가설을 주장했다.
하지만 윤 교수팀의 연구는 단분자 형광 기법과 자기집게 기술(magnetic tweezers)을 사용해 가설을 반박했다. 마치 매듭의 양 끝을 잡고 당기면 한 번에 풀리듯, ATP를 주입하면 NSF가 스프링처럼 에너지를 저장했다가 스네어 결합체 전체를 단번에 폭발적으로 풀어냄을 증명한 것이다.
이번에 규명된 NSF는 근육의 이동, 단백질 분해, DNA의 복제 및 이동 등 신체에서 중요한 역할을 하는 AAA+ 단백질 그룹에 속해있다. 따라서 NSF와 비슷한 구조의 AAA+ 단백질 그룹은 함께 동작할 것으로 예상되며, 앞으로 많은 생물 현상 이해의 주춧돌이 될 것으로 보인다.
스네어 단백질은 신경세포 통신과 인슐린 분비 등에 중추적 역할을 하고 있어 윤 교수팀의 성과는 알츠하이머와 같은 퇴행성 뇌질환, 당뇨병과 같은 대사질환 관련 연구 뿐 아니라 피부미용 연구에도 이바지 할 것으로 기대된다.
윤 교수는 “생물 물리 분야에서 우리나라가 최고수준의 기초과학 연구력을 보유하고 있음을 증명했다”며 “이번 연구결과는 여러 대사질환을 분자수준에서 이해할 수 있는 토대가 될 것”이라고 말했다.
이번 연구는 고등과학원의 현창봉 교수팀, 독일 막스 플랑크 연구소 라인하르트 얀(Reinhard Jahn) 교수팀, 우리 대학 의과학대학원 김호민 교수팀과의 공동 연구로 진행됐으며, 윤 교수 연구팀의 류제경, 민두영 박사, 나상현 학생의 주도로 이뤄졌다.
□ 그림 설명
그림 1. 신경전달물질의 분비가 끝난 후 NSF가 SNARE 단백질 복합체를 한 번에 분해하는 모습
그림 2. NSF 가 SNARE 복합체를 풀어내는 모습
2015.03.27 조회수 14702 -
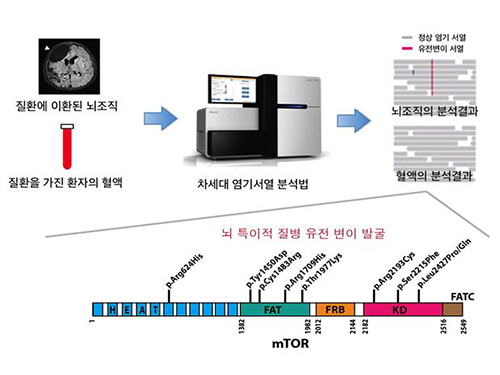 약물로 조절되지 않는 뇌전증(간질) 원인 밝혀
<이정호 교수>
우리 대학 의과학대학원 이정호 교수팀이 약물로 조절되지 않는 난치성 뇌전증(간질 발작)의 원인을 밝히고 새로운 치료법의 발판을 마련했다.
세브란스 병원 김동석 교수 연구팀과 공동으로 진행한 이번 연구는 의과학 분야 학술지 ‘네이처 메디슨(Nature Medicine)’ 24일자 온라인 판에 게재됐다.
뇌전증은 세계적으로 5천만 명 이상에게 발생하는 주요 뇌질환이다. 이는 약물로 발작 조절이 가능하지만, 30% 가량의 환자는 어떠한 약물도 효과가 없는 난치성 뇌전증을 앓고 있다.
기존 뇌전증 치료제는 실험동물에게 특정 물질이나 전기 자극을 주고난 뒤, 약물을 투여해 증상이 완화되면 치료제로 승인받는 방식으로 개발됐다. 하지만 실험의 방향과 다른 원인의 뇌전증이 발병하면 약물 치료제가 전혀 반응하지 않는 문제가 있었다.
이에 연구팀은 약물 치료 효과가 없어 간질 수술을 받은 환자 77명의 뇌 유전체 정보와 임상 자료를 심층 분석했다. 그 결과 약 16%의 환자는 마치 백설기 안의 건포도처럼 뇌의 특정 부분에만 돌연변이가 존재하고 나머지 신체 부위는 정상인 것으로 밝혀졌다.
이 과정을 통해 뇌전증을 일으키는 변이 유전자를 발견해 약물로 조절되지 않는 난치성 뇌전증의 원인을 밝혔다. 또한 같은 형태의 돌연변이를 실험용 쥐에 주입한 후 유전 변이에 따른 맞춤형 치료법 개발에 성공했다.
연구팀의 핵심 성과는 기존에 발견되지 않던 난치성 뇌전증의 원인을 파악해 맞춤형 치료법을 개발할 수 있는 발판을 마련한 것이다.
연구팀은 함께 참여했던 병원 측과 임상을 계획 중이다.
이정호 교수는 “선천적으로 몸 전체에 돌연변이가 분포한다는 기존 학설을 뒤집고, 뇌에만 돌연변이가 발생해 난치성 뇌질환을 유발함을 증명한 최초의 연구”라고 말했다.
마크로젠 (대표: 정현용) 이환석 박사 팀과 공동 진행한 이번 연구는 보건복지부 질병중심 중개 중점연구와 세계선도 의생명과학자 육성 사업, 미래창조과학부 뇌과학 원천기술 개발사업, KAIST 미래형 시스템 헬스케어 연구개발 지원으로 수행됐다.
□ 그림 설명
그림 1. 차세대 염기서열 분석법을 이용한 뇌특이적 질병유전변이의 발굴
국소 대뇌 피질 이형성증에 의한 난치성 뇌전증 환자의 뇌조직과 혈액샘플에서 얻은 DNA를 차세대 염기서열 분석법으로 비교분석해 뇌 특이적 질병 유전 변이를 발견.
그림 2. 난치성 뇌전증 실험용 쥐 제작 및 약물치료
대뇌 발달이 진행 중인 생쥐 배아에 질병유전변이를 주입. 성장 완료 후 뇌전도검사를 통해 뇌전증 발생 여부 및 빈도를 확인하고 약물 투여를 통해 치료여부를 확인.
그림 3. 맞춤형 약물 치료 효과
질병 유전변이를 발현하는 생쥐의 뇌조직 단면에서 환자와 같은 거대신경세포가 관찰되고 약물치료를 통해 거대신경세포가 정상세포로 변화하는 과정.
2015.03.24 조회수 20956
약물로 조절되지 않는 뇌전증(간질) 원인 밝혀
<이정호 교수>
우리 대학 의과학대학원 이정호 교수팀이 약물로 조절되지 않는 난치성 뇌전증(간질 발작)의 원인을 밝히고 새로운 치료법의 발판을 마련했다.
세브란스 병원 김동석 교수 연구팀과 공동으로 진행한 이번 연구는 의과학 분야 학술지 ‘네이처 메디슨(Nature Medicine)’ 24일자 온라인 판에 게재됐다.
뇌전증은 세계적으로 5천만 명 이상에게 발생하는 주요 뇌질환이다. 이는 약물로 발작 조절이 가능하지만, 30% 가량의 환자는 어떠한 약물도 효과가 없는 난치성 뇌전증을 앓고 있다.
기존 뇌전증 치료제는 실험동물에게 특정 물질이나 전기 자극을 주고난 뒤, 약물을 투여해 증상이 완화되면 치료제로 승인받는 방식으로 개발됐다. 하지만 실험의 방향과 다른 원인의 뇌전증이 발병하면 약물 치료제가 전혀 반응하지 않는 문제가 있었다.
이에 연구팀은 약물 치료 효과가 없어 간질 수술을 받은 환자 77명의 뇌 유전체 정보와 임상 자료를 심층 분석했다. 그 결과 약 16%의 환자는 마치 백설기 안의 건포도처럼 뇌의 특정 부분에만 돌연변이가 존재하고 나머지 신체 부위는 정상인 것으로 밝혀졌다.
이 과정을 통해 뇌전증을 일으키는 변이 유전자를 발견해 약물로 조절되지 않는 난치성 뇌전증의 원인을 밝혔다. 또한 같은 형태의 돌연변이를 실험용 쥐에 주입한 후 유전 변이에 따른 맞춤형 치료법 개발에 성공했다.
연구팀의 핵심 성과는 기존에 발견되지 않던 난치성 뇌전증의 원인을 파악해 맞춤형 치료법을 개발할 수 있는 발판을 마련한 것이다.
연구팀은 함께 참여했던 병원 측과 임상을 계획 중이다.
이정호 교수는 “선천적으로 몸 전체에 돌연변이가 분포한다는 기존 학설을 뒤집고, 뇌에만 돌연변이가 발생해 난치성 뇌질환을 유발함을 증명한 최초의 연구”라고 말했다.
마크로젠 (대표: 정현용) 이환석 박사 팀과 공동 진행한 이번 연구는 보건복지부 질병중심 중개 중점연구와 세계선도 의생명과학자 육성 사업, 미래창조과학부 뇌과학 원천기술 개발사업, KAIST 미래형 시스템 헬스케어 연구개발 지원으로 수행됐다.
□ 그림 설명
그림 1. 차세대 염기서열 분석법을 이용한 뇌특이적 질병유전변이의 발굴
국소 대뇌 피질 이형성증에 의한 난치성 뇌전증 환자의 뇌조직과 혈액샘플에서 얻은 DNA를 차세대 염기서열 분석법으로 비교분석해 뇌 특이적 질병 유전 변이를 발견.
그림 2. 난치성 뇌전증 실험용 쥐 제작 및 약물치료
대뇌 발달이 진행 중인 생쥐 배아에 질병유전변이를 주입. 성장 완료 후 뇌전도검사를 통해 뇌전증 발생 여부 및 빈도를 확인하고 약물 투여를 통해 치료여부를 확인.
그림 3. 맞춤형 약물 치료 효과
질병 유전변이를 발현하는 생쥐의 뇌조직 단면에서 환자와 같은 거대신경세포가 관찰되고 약물치료를 통해 거대신경세포가 정상세포로 변화하는 과정.
2015.03.24 조회수 20956 -
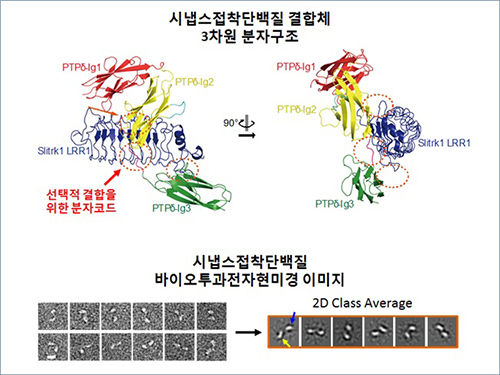 신경세포 연결해주는 접착단백질 결합구조 규명
국내 연구진이 신경세포 연결을 주관하는 시냅스접착단백질**의 3차원 복합체 구조를 규명함으로써, 시냅스* 형성초기 기전을 제시하였다. 시냅스 이상으로 인한 강박증이나 조울증 등 다양한 뇌질환의 발병기전 규명과 치료제 개발에 활용될 것으로 기대된다.
* 시냅스 : 신경전달물질의 분비와 흡수가 일어나는 1,000억 여 개에 달하는 신경세포의 접합부위로 학습과 기억, 감각, 운동 등을 조절하는 뇌 활동의 기본단위이다. ** 시냅스접착단백질 : 벨크로처럼 두 개의 신경세포를 단단하게 연결해 시냅스 형성을 돕는 신경세포막에 존재하는 단백질
우리 학교 의과학대학원 김호민 교수와 연세대 생화학과 고재원 교수 (이상 교신저자)가 주도하고, 연세대 엄지원 연구교수, KAIST 김기훈 석사과정 연구원 및 을지대 박범석 교수(이상 제1저자)가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 지원하는 신진연구자지원사업, 중견연구자지원사업(핵심연구) 및 교육부 학문후속세대양성사업의 지원으로 수행되었고 자연과학 분야 국제학술지 네이처 커뮤니케이션스(Nature Communications)지 온라인판 11월 14일자에 게재되었다. (논문명 : Structural basis for LAR-RPTP/Slitrk complex-mediated synaptic adhesion)
신경세포막에 존재하는 단백질 슬릿트랙*은 다른 신경세포의 막에 존재하는 단백질 LAR-RPTP**와 복합체를 이뤄 초기 시냅스 형성과 신경세포의 흥분과 억제간의 균형 유지에 관여하는 것으로 알려져 있었다.
* 슬릿트랙(Slitrk) : 뇌의 중추신경계에서 강하게 발현되는 단백질. 이 유전자가 결핍된 형질전환생쥐의 경우 다양한 뇌질환 표현형을 나타냄. 최근 LAR-RPTP와 결합하여 시냅스 형성을 조절하는 시냅스접착단백질임이 밝혀짐
** LAR-RPTP : 신경세포의 초기 발달과정에서 중요한 역할을 하는 단백질 군. 최근 시냅스 형성에 관계된 주요 기능들이 조금씩 밝혀지면서 새롭게 주목 받기 시작한시냅스접착단백질
이들 두 단백질의 이상은 시냅스의 기능이상을 유발해 자폐증, 정신분열증, 간질, 강박증 및 조울증 같은 다양한 신경·정신질환을 유발하는 것으로 알려져 있지만 두 단백질의 결합구조와 구체적인 작용기전이 규명되지 않아 치료제 개발에 한계가 있었다.
연구팀은 단백질 결정학기술과 바이오투과전자현미경을 활용해 두 시냅스접착단백질(슬릿트랙(Slitrk)과 LAR-RPTP)이 결합된 3차원 구조를 밝혀내고 이들 상호간의 결합의 핵심이 되는 부위를 찾아냈다.
나아가 두 시냅스접착 단백질이 결합한 후 클러스터를 형성하면서 시냅스 생성이 유도된다는 것을 규명하였다.
김호민 교수는 “시냅스접착단백질의 기능 이상으로 나타나는 다양한 뇌질환의 발병기전 이해에 큰 밑거름이 될 것. 특히, 단백질 구조생물학과 신경생물학의 유기적인 협력연구를 통하여 우수한 성과를 거둔 대표적 사례가 될 것”이라고 밝혔다. 고재원 교수는 “시냅스접착단백질 분자기전을 이해함으로써 시냅스 형성 관련 연구의 새로운 방향을 제시할 것”이라고 연구의의를 밝혔다.
그림 1. 시냅스접착단백질 결합체 구조 및 슬릿트랫 바이오투과전자현미경 이미지
(위) 시냅스접착단백질 슬릿트랙(Slitrk)과 LAR-RPTP 결합체 분자구조
단백질결정학을 통해 시냅스접착단백질 결합체 분자구조를 분석한 결과 두 시냅스접착단백질의 결합에 중추적인 역할을 하는 핵심적인 아미노산을 도출할 수 있었다.
특히 LAR-RPTP 단백질에 위치한 선택적 접합(Alternative splicing) 부위(붉은색 화살표)가 슬릿트랙 (Slitrk)과 선택적으로 결합하기 위한 분자코드임을 규명하였다.
(아래) 슬릿트랙의 바이오투과전자현미경 이미지 단백질결정학으로는 규명이 어려운 전체 슬릿트랙 단백질 구조(세포막 바깥쪽부위)를 바이오투과전자현미경을 사용하여 분석하였다. 그림에서 보듯 전체 슬릿트랙은 땅콩처럼 생긴 비슷한 두 개의 단백질 모듈(푸른색, 노란색 화살표)로 구성되어 있고, 이들 중 한 부분(파란색 화살표)만 LAR-RPTP와 결합하게 된다는 것을 규명하였다.
그림 2. 시냅스접착단백질 결합에 의해 유도되는 시냅스형성 분자기전
전시냅스의 LAR-RPTP과 후시냅스의 슬릿트랙(Slitrk)의 결합이 단순한 결합에 그치는 것이 아니라 결합 이후 신경세포 막에서의 배열변화를 통해 단백질 클러스터 형성을 유도할 수 있음을 보였다.
그림 3. 시냅스 및 시냅스접착단백질 개요
시냅스는 1000 억여 개에 달하는 신경세포들의 접합 부위인 뇌기능의 기본단위로서 신경세포 간 교환되는 신경전달물질들에 의하여 학습 및 기억, 감각, 운동 등이 원활히 조절된다. 시냅스에는 약 1,000여종 단백질이 존재하며, 이들 중 신경세포 막에 존재하며 벨크로처럼 두 개의 신경세포를 단단하게 연결하여 시냅스 형성을 돕는 단백질을 시냅스접착단백질이라 한다. 현재 불과 10여개의 시냅스접착단백질만이 밝혀져 있고, 이중 최근에 주목받기 시작한 시냅스접착단백질이 슬릿트랫과 LAR-RPTP이다.
2014.11.20 조회수 20488
신경세포 연결해주는 접착단백질 결합구조 규명
국내 연구진이 신경세포 연결을 주관하는 시냅스접착단백질**의 3차원 복합체 구조를 규명함으로써, 시냅스* 형성초기 기전을 제시하였다. 시냅스 이상으로 인한 강박증이나 조울증 등 다양한 뇌질환의 발병기전 규명과 치료제 개발에 활용될 것으로 기대된다.
* 시냅스 : 신경전달물질의 분비와 흡수가 일어나는 1,000억 여 개에 달하는 신경세포의 접합부위로 학습과 기억, 감각, 운동 등을 조절하는 뇌 활동의 기본단위이다. ** 시냅스접착단백질 : 벨크로처럼 두 개의 신경세포를 단단하게 연결해 시냅스 형성을 돕는 신경세포막에 존재하는 단백질
우리 학교 의과학대학원 김호민 교수와 연세대 생화학과 고재원 교수 (이상 교신저자)가 주도하고, 연세대 엄지원 연구교수, KAIST 김기훈 석사과정 연구원 및 을지대 박범석 교수(이상 제1저자)가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 지원하는 신진연구자지원사업, 중견연구자지원사업(핵심연구) 및 교육부 학문후속세대양성사업의 지원으로 수행되었고 자연과학 분야 국제학술지 네이처 커뮤니케이션스(Nature Communications)지 온라인판 11월 14일자에 게재되었다. (논문명 : Structural basis for LAR-RPTP/Slitrk complex-mediated synaptic adhesion)
신경세포막에 존재하는 단백질 슬릿트랙*은 다른 신경세포의 막에 존재하는 단백질 LAR-RPTP**와 복합체를 이뤄 초기 시냅스 형성과 신경세포의 흥분과 억제간의 균형 유지에 관여하는 것으로 알려져 있었다.
* 슬릿트랙(Slitrk) : 뇌의 중추신경계에서 강하게 발현되는 단백질. 이 유전자가 결핍된 형질전환생쥐의 경우 다양한 뇌질환 표현형을 나타냄. 최근 LAR-RPTP와 결합하여 시냅스 형성을 조절하는 시냅스접착단백질임이 밝혀짐
** LAR-RPTP : 신경세포의 초기 발달과정에서 중요한 역할을 하는 단백질 군. 최근 시냅스 형성에 관계된 주요 기능들이 조금씩 밝혀지면서 새롭게 주목 받기 시작한시냅스접착단백질
이들 두 단백질의 이상은 시냅스의 기능이상을 유발해 자폐증, 정신분열증, 간질, 강박증 및 조울증 같은 다양한 신경·정신질환을 유발하는 것으로 알려져 있지만 두 단백질의 결합구조와 구체적인 작용기전이 규명되지 않아 치료제 개발에 한계가 있었다.
연구팀은 단백질 결정학기술과 바이오투과전자현미경을 활용해 두 시냅스접착단백질(슬릿트랙(Slitrk)과 LAR-RPTP)이 결합된 3차원 구조를 밝혀내고 이들 상호간의 결합의 핵심이 되는 부위를 찾아냈다.
나아가 두 시냅스접착 단백질이 결합한 후 클러스터를 형성하면서 시냅스 생성이 유도된다는 것을 규명하였다.
김호민 교수는 “시냅스접착단백질의 기능 이상으로 나타나는 다양한 뇌질환의 발병기전 이해에 큰 밑거름이 될 것. 특히, 단백질 구조생물학과 신경생물학의 유기적인 협력연구를 통하여 우수한 성과를 거둔 대표적 사례가 될 것”이라고 밝혔다. 고재원 교수는 “시냅스접착단백질 분자기전을 이해함으로써 시냅스 형성 관련 연구의 새로운 방향을 제시할 것”이라고 연구의의를 밝혔다.
그림 1. 시냅스접착단백질 결합체 구조 및 슬릿트랫 바이오투과전자현미경 이미지
(위) 시냅스접착단백질 슬릿트랙(Slitrk)과 LAR-RPTP 결합체 분자구조
단백질결정학을 통해 시냅스접착단백질 결합체 분자구조를 분석한 결과 두 시냅스접착단백질의 결합에 중추적인 역할을 하는 핵심적인 아미노산을 도출할 수 있었다.
특히 LAR-RPTP 단백질에 위치한 선택적 접합(Alternative splicing) 부위(붉은색 화살표)가 슬릿트랙 (Slitrk)과 선택적으로 결합하기 위한 분자코드임을 규명하였다.
(아래) 슬릿트랙의 바이오투과전자현미경 이미지 단백질결정학으로는 규명이 어려운 전체 슬릿트랙 단백질 구조(세포막 바깥쪽부위)를 바이오투과전자현미경을 사용하여 분석하였다. 그림에서 보듯 전체 슬릿트랙은 땅콩처럼 생긴 비슷한 두 개의 단백질 모듈(푸른색, 노란색 화살표)로 구성되어 있고, 이들 중 한 부분(파란색 화살표)만 LAR-RPTP와 결합하게 된다는 것을 규명하였다.
그림 2. 시냅스접착단백질 결합에 의해 유도되는 시냅스형성 분자기전
전시냅스의 LAR-RPTP과 후시냅스의 슬릿트랙(Slitrk)의 결합이 단순한 결합에 그치는 것이 아니라 결합 이후 신경세포 막에서의 배열변화를 통해 단백질 클러스터 형성을 유도할 수 있음을 보였다.
그림 3. 시냅스 및 시냅스접착단백질 개요
시냅스는 1000 억여 개에 달하는 신경세포들의 접합 부위인 뇌기능의 기본단위로서 신경세포 간 교환되는 신경전달물질들에 의하여 학습 및 기억, 감각, 운동 등이 원활히 조절된다. 시냅스에는 약 1,000여종 단백질이 존재하며, 이들 중 신경세포 막에 존재하며 벨크로처럼 두 개의 신경세포를 단단하게 연결하여 시냅스 형성을 돕는 단백질을 시냅스접착단백질이라 한다. 현재 불과 10여개의 시냅스접착단백질만이 밝혀져 있고, 이중 최근에 주목받기 시작한 시냅스접착단백질이 슬릿트랫과 LAR-RPTP이다.
2014.11.20 조회수 20488 -
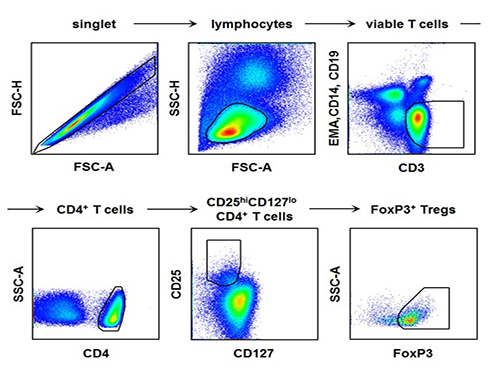 A형 간염 환자의 간 손상 해결 단초 마련
우리 학교 의과학대학원 신의철 교수팀은 인체 면역계의 균형유지를 담당하는 조절 T 세포가 A형 간염 환자의 간 손상에 끼친 영향을 밝혔다.
연구결과는 세계적으로 저명한 소화기학 학술지인 ‘거트(Gut)’ 7월 9일자 온라인판에 게재됐다.
A형 간염은 A형 간염 바이러스에 의해 발생하는 급성 간염이다. 날씨가 더운 여름철에 발병률이 높고 바이러스가 입을 통해 소화기로 침입해 전파된다.
A형 간염은 환자의 발병초기와 회복기를 순차적으로 관찰할 수 있고 다양한 임상적 양상을 나타내 급성 바이러스 감염에 대한 인체의 면역반응을 연구하기에 적당한 질환이기 때문에 연구팀은 A형 간염을 선택했다.
인체 내에서 조절 T 세포는 다른 면역세포의 활성화를 억제함으로써 면역체계의 항상성을 유지하는데 중요한 역할을 한다. 만성 바이러스 감염의 경우 조절 T 세포는 바이러스에 대한 면역반응을 약화시켜 감염상태를 지속시키는데 기여한다고 알려져 있다. 그러나 급성 바이러스 감염에서는 조절 T 세포가 인체에서 어떠한 역할을 수행하는지 밝혀진 바가 없었다.
연구팀은 A형 간염 환자로부터 얻어진 혈액에서 조절 T 세포를 포함한 다양한 면역세포의 숫자와 특성을 파악하기 위해 형광 유세포 분석(fluorescence flow cytometry) 기법을 활용했다.
연구팀은 A형 간염 환자의 혈액에서 조절 T 세포의 현저한 감소와 함께 조절 T 세포의 면역 억제능이 감소되어 있음을 확인했다. 또 조절 T 세포의 감소가 더 현저하게 나타난 환자일수록 간 손상은 더욱 극심하게 발생함을 밝혔다.
연구팀은 세포사멸을 유도하는 세포표면 단백질인 ‘Fas’의 발현 증가에 의한 세포사멸 현상이 이러한 조절 T 세포의 수적, 기능적인 감소의 원인임을 실제 환자의 혈액을 분석해 입증했다.
신의철 교수는 이번 연구에 대해 “A형 간염 뿐만 아니라 급성 바이러스 감염증에서 임상 양상의 심화 기전을 제시한 첫 사례”라며 “향후 바이러스 자체에 대한 효과적인 치료가 없는 다양한 중증 급성 바이러스 감염질환에서 조절 T 세포의 세포사멸을 억제함으로써 조직 손상을 예방할 수 있을 것”이라고 의의를 밝혔다.
논문의 제1저자인 최윤석 박사는 의과대학을 졸업한 내과 의사로서 전문의 취득 후 KAIST 의과학대학원 박사과정에 진학했다. ‘인체 T 세포에 의한 면역반응의 조절에 대한 연구’를 수행하며 ‘의사-과학자’ 훈련을 5년간 받은 연구자로 ‘KAIST가 배출한 1세대 중개연구전문가’의 성공적 사례다.
KAIST에서의 연구 경험 및 심도 있는 교육을 바탕으로, 박사 학위 취득 후 충남대학교병원 혈액종양내과에서 진료교수로 재직하며 현재 신의철 교수와 함께 림프계 악성질환(악성림프종 및 다발성골수종)에서 종양특이 T 세포의 기능적 변화 및 그 임상적 의의에 대한 연구를 통해 난치성 질환에 대한 새로운 치료 타겟 발굴을 위한 연구를 진행 중이다.
□ 그림설명
혈액에서 형광 항체를 이용하여 조절 T 세포 및 다양한 면역세포를 형광염색하고 유세포 분석(flow cytometry)을 수행하여 그 숫자 및 특성을 분석한 데이터로서, 실제 A형 간염 환자의 혈액에서 이러한 분석을 수행하여 조절 T 세포의 감소를 규명하였음.
2014.07.31 조회수 18896
A형 간염 환자의 간 손상 해결 단초 마련
우리 학교 의과학대학원 신의철 교수팀은 인체 면역계의 균형유지를 담당하는 조절 T 세포가 A형 간염 환자의 간 손상에 끼친 영향을 밝혔다.
연구결과는 세계적으로 저명한 소화기학 학술지인 ‘거트(Gut)’ 7월 9일자 온라인판에 게재됐다.
A형 간염은 A형 간염 바이러스에 의해 발생하는 급성 간염이다. 날씨가 더운 여름철에 발병률이 높고 바이러스가 입을 통해 소화기로 침입해 전파된다.
A형 간염은 환자의 발병초기와 회복기를 순차적으로 관찰할 수 있고 다양한 임상적 양상을 나타내 급성 바이러스 감염에 대한 인체의 면역반응을 연구하기에 적당한 질환이기 때문에 연구팀은 A형 간염을 선택했다.
인체 내에서 조절 T 세포는 다른 면역세포의 활성화를 억제함으로써 면역체계의 항상성을 유지하는데 중요한 역할을 한다. 만성 바이러스 감염의 경우 조절 T 세포는 바이러스에 대한 면역반응을 약화시켜 감염상태를 지속시키는데 기여한다고 알려져 있다. 그러나 급성 바이러스 감염에서는 조절 T 세포가 인체에서 어떠한 역할을 수행하는지 밝혀진 바가 없었다.
연구팀은 A형 간염 환자로부터 얻어진 혈액에서 조절 T 세포를 포함한 다양한 면역세포의 숫자와 특성을 파악하기 위해 형광 유세포 분석(fluorescence flow cytometry) 기법을 활용했다.
연구팀은 A형 간염 환자의 혈액에서 조절 T 세포의 현저한 감소와 함께 조절 T 세포의 면역 억제능이 감소되어 있음을 확인했다. 또 조절 T 세포의 감소가 더 현저하게 나타난 환자일수록 간 손상은 더욱 극심하게 발생함을 밝혔다.
연구팀은 세포사멸을 유도하는 세포표면 단백질인 ‘Fas’의 발현 증가에 의한 세포사멸 현상이 이러한 조절 T 세포의 수적, 기능적인 감소의 원인임을 실제 환자의 혈액을 분석해 입증했다.
신의철 교수는 이번 연구에 대해 “A형 간염 뿐만 아니라 급성 바이러스 감염증에서 임상 양상의 심화 기전을 제시한 첫 사례”라며 “향후 바이러스 자체에 대한 효과적인 치료가 없는 다양한 중증 급성 바이러스 감염질환에서 조절 T 세포의 세포사멸을 억제함으로써 조직 손상을 예방할 수 있을 것”이라고 의의를 밝혔다.
논문의 제1저자인 최윤석 박사는 의과대학을 졸업한 내과 의사로서 전문의 취득 후 KAIST 의과학대학원 박사과정에 진학했다. ‘인체 T 세포에 의한 면역반응의 조절에 대한 연구’를 수행하며 ‘의사-과학자’ 훈련을 5년간 받은 연구자로 ‘KAIST가 배출한 1세대 중개연구전문가’의 성공적 사례다.
KAIST에서의 연구 경험 및 심도 있는 교육을 바탕으로, 박사 학위 취득 후 충남대학교병원 혈액종양내과에서 진료교수로 재직하며 현재 신의철 교수와 함께 림프계 악성질환(악성림프종 및 다발성골수종)에서 종양특이 T 세포의 기능적 변화 및 그 임상적 의의에 대한 연구를 통해 난치성 질환에 대한 새로운 치료 타겟 발굴을 위한 연구를 진행 중이다.
□ 그림설명
혈액에서 형광 항체를 이용하여 조절 T 세포 및 다양한 면역세포를 형광염색하고 유세포 분석(flow cytometry)을 수행하여 그 숫자 및 특성을 분석한 데이터로서, 실제 A형 간염 환자의 혈액에서 이러한 분석을 수행하여 조절 T 세포의 감소를 규명하였음.
2014.07.31 조회수 18896 -
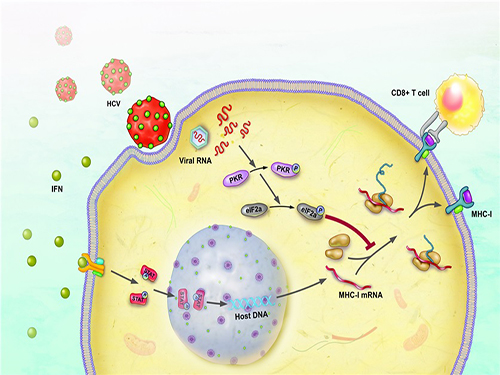 C형간염바이러스의 면역회피 기전 밝혀
C형간염은 우리나라 국민의 약 1~2%가 감염된 것으로 알려져 있다. C형간염바이러스에 감염되면 대부분 만성으로 진행되며 간경변증 및 간암이 발생해 사망에 이를 수도 있다.
A형이나 B형간염과는 달리 예방백신이 없어 감염원 노출을 피하는 것만이 최선의 예방법으로 알려진 가운데 우리학교 연구진이 백신 개발에 탄력을 받을 만한 연구 성과를 냈다.
우리학교 의과학대학원 신의철 교수팀은 C형간염바이러스가 체내에서 면역반응을 일으키지 않는 원인을 규명했다. 연구결과는 소화기병 분야 세계적 학술지 ‘위장병학(Gastroenterology)’ 5월호에 게재됐다.
우리 몸에서는 외부로부터 침입한 바이러스를 제거하기 위해 면역반응이 일어난다. 이 과정에서 바이러스에 감염된 세포의 제거에 필요한 T세포 반응을 적절하게 유도하는데 제1형 주조직복합체가 핵심적인 역할을 한다.
세포가 바이러스에 감염되면 인터페론이라는 물질에 의해 제1형 주조직복합체 발현이 증가되고 T세포는 증가된 제1형 주조직복합체를 인식해 바이러스에 감염된 세포를 찾아낼 수 있다.
그러나 그동안 C형간염바이러스의 경우 제1형 주조직복합체 발현에 어떤 영향을 미치는지 명확히 밝혀지지 않았다.
연구팀은 세포배양을 이용한 감염시스템을 통해 C형간염바이러스가 제1형 주조직복합체 단백질 발현을 억제함을 밝혔다. 또 이에 대한 메커니즘을 분자 수준에서 규명, C형간염바이러스가 세포내의 PKR이라는 단백질을 활성화시켜 제1형 주조직복합체 단백질 발현을 억제하는 사실도 입증했다.
이와 함께 실제 C형간염바이러스 환자로부터 분리한 T세포 배양 기술을 이용해 C형간염바이러스가 제1형 주조직복합체 단백질 발현을 억제함으로써 T세포 면역반응을 회피한다는 사실을 세계 최초로 규명했다.
이러한 연구를 통해 연구팀은 세포내 PKR 단백질을 조절하면 T세포 면역반응을 증강시킬 수 있다는 가설을 세우고 이를 실험을 통해 증명했다.
신의철 교수는 “C형간염바이러스를 치료하는 신약들은 많이 개발된 반면 백신은 아직 개발되지 않은 상태”라며 “C형간염바이러스의 면역회피 기전을 밝혀내 백신 개발에 탄력을 받을 것”이라고 이번 연구의 의의를 말했다.
그림1. 세포배양을 이용한 C형간염바이러스 감염 시스템을 유세포분석 기법으로 관찰, C형간염바이러스에 감염된 간세포에서는 인터페론에 의한 제1형 주조직복합체 단백질 증가가 억제됨을 밝혔다.
그림2. C형간염바이러스에 감염된 간세포에서는 인터페론에 의한 제1형 주조직복합체 단백질의 증가가 억제된다.
그림3. C형간염바이러스가 PKR-eIF2a 전달체계를 활성화시켜 제1형 주조직복합체 단백질 발현을 억제함으로써 바이러스에 대한 T세포의 활성이 약화된다.
2014.05.19 조회수 17582
C형간염바이러스의 면역회피 기전 밝혀
C형간염은 우리나라 국민의 약 1~2%가 감염된 것으로 알려져 있다. C형간염바이러스에 감염되면 대부분 만성으로 진행되며 간경변증 및 간암이 발생해 사망에 이를 수도 있다.
A형이나 B형간염과는 달리 예방백신이 없어 감염원 노출을 피하는 것만이 최선의 예방법으로 알려진 가운데 우리학교 연구진이 백신 개발에 탄력을 받을 만한 연구 성과를 냈다.
우리학교 의과학대학원 신의철 교수팀은 C형간염바이러스가 체내에서 면역반응을 일으키지 않는 원인을 규명했다. 연구결과는 소화기병 분야 세계적 학술지 ‘위장병학(Gastroenterology)’ 5월호에 게재됐다.
우리 몸에서는 외부로부터 침입한 바이러스를 제거하기 위해 면역반응이 일어난다. 이 과정에서 바이러스에 감염된 세포의 제거에 필요한 T세포 반응을 적절하게 유도하는데 제1형 주조직복합체가 핵심적인 역할을 한다.
세포가 바이러스에 감염되면 인터페론이라는 물질에 의해 제1형 주조직복합체 발현이 증가되고 T세포는 증가된 제1형 주조직복합체를 인식해 바이러스에 감염된 세포를 찾아낼 수 있다.
그러나 그동안 C형간염바이러스의 경우 제1형 주조직복합체 발현에 어떤 영향을 미치는지 명확히 밝혀지지 않았다.
연구팀은 세포배양을 이용한 감염시스템을 통해 C형간염바이러스가 제1형 주조직복합체 단백질 발현을 억제함을 밝혔다. 또 이에 대한 메커니즘을 분자 수준에서 규명, C형간염바이러스가 세포내의 PKR이라는 단백질을 활성화시켜 제1형 주조직복합체 단백질 발현을 억제하는 사실도 입증했다.
이와 함께 실제 C형간염바이러스 환자로부터 분리한 T세포 배양 기술을 이용해 C형간염바이러스가 제1형 주조직복합체 단백질 발현을 억제함으로써 T세포 면역반응을 회피한다는 사실을 세계 최초로 규명했다.
이러한 연구를 통해 연구팀은 세포내 PKR 단백질을 조절하면 T세포 면역반응을 증강시킬 수 있다는 가설을 세우고 이를 실험을 통해 증명했다.
신의철 교수는 “C형간염바이러스를 치료하는 신약들은 많이 개발된 반면 백신은 아직 개발되지 않은 상태”라며 “C형간염바이러스의 면역회피 기전을 밝혀내 백신 개발에 탄력을 받을 것”이라고 이번 연구의 의의를 말했다.
그림1. 세포배양을 이용한 C형간염바이러스 감염 시스템을 유세포분석 기법으로 관찰, C형간염바이러스에 감염된 간세포에서는 인터페론에 의한 제1형 주조직복합체 단백질 증가가 억제됨을 밝혔다.
그림2. C형간염바이러스에 감염된 간세포에서는 인터페론에 의한 제1형 주조직복합체 단백질의 증가가 억제된다.
그림3. C형간염바이러스가 PKR-eIF2a 전달체계를 활성화시켜 제1형 주조직복합체 단백질 발현을 억제함으로써 바이러스에 대한 T세포의 활성이 약화된다.
2014.05.19 조회수 17582 -
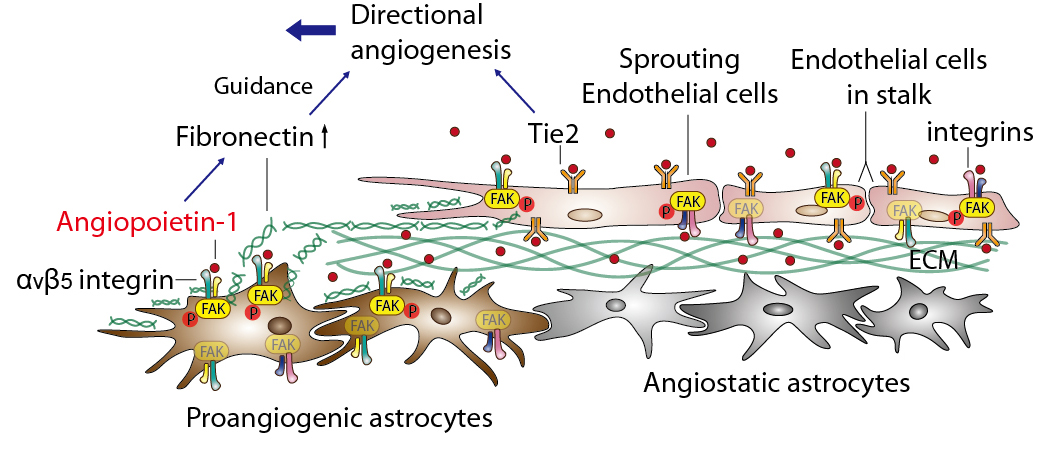 건강한 망막혈관 생성을 유도하는 치료방법 개발
- 향후 당뇨망막병증 치료방법으로 적용 기대
우리 학교 연구진이 실명으로 이어질 수 있는 망막혈관 질환치료의 실마리를 찾아냈다. 혈액공급이 잘되지 않는 망막 부위로 건강한 망막혈관이 생성되도록 하여 망막신경을 보호하는 혈관생성단백질을 찾아낸 것. 향후 당뇨망막병증*과 미숙아망막병증**의 치료방법 개선을 위한 연구의 단초가 될 것으로 기대된다.
이번 연구결과는 국내에서 전문적인 기초과학 교육을 받고 있는 안과 전문의 연구원에 의해 이루어진 대표적인 중개연구의 결과여서 더욱 주목받고 있다.
* 미숙아망막병증 : 망막 혈관의 발달이 완성되지 않은 시기에 출생한 미숙아에서 발생하는 망막 혈관질환으로 소아실명의 가장 흔한 원인 질환이다.
* 당뇨망막병증 : 당뇨병의 합병증으로 망막조직으로의 불충분한 혈액공급으로 생기는 망막 혈관질환으로 성인실명의 중요한 원인 질환이다.
우리 학교 의과학대학원 이준엽 연구원이(안과 전문의, 지도교수: 고규영,유욱준) 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약)의 지원으로 수행되었고, 연구결과는 사이언스 중개의학(Science Translational Medicine) 표지논문(9월 18일자)으로 소개되었다. 이 학술지는 임상의학과 기초과학을 연계하는 중개의학 분야 권위지로 사이언스지 자매지이다.
(논문명 : Angiopoietin-1 Guides Directional Angiogenesis Through Integrin αvβ5 Signaling for Recovery of Ischemic Retinopathy)
당뇨망막병증의 치료에는 망막조직을 파괴하는 레이저광응고술이나혈관증식과 혈액누출을 억제하는 항체치료제*가 적용되고 있다.
항체치료제는 망막신경을 파괴하지 않는 장점이 있지만 한시적으로 혈관증식을 억제할 뿐, 근본적인 해결이 아니어서 반복적인 치료가 필요하다는 한계가 있었다.
* 항체치료제 : 비정상적인 혈관증식과 혈액누출을 선택적으로 억제하기 위하여 개발된 항체로서, 현재 혈관내피세포성장인자 (VEGF)를 저해하는 아바스틴 (Avastin) 과 루센티스 (Lucentis) 가 대표적인 항체치료제이다.
연구팀은 개체의 발달과정에서 혈관의 생성과 안정화에 필수적이라고 알려진 안지오포이에틴-1* 단백질이 망막혈관의 생성과정에도 중요한 역할을 함을 동물실험을 통해 규명해냈다.
망막출혈에 의한 시력상실의 근본 원인이 되는 망막허혈**을 개선하고 망막신경을 보호하는 단백질을 알아낸 것이다.
망막조직으로 충분한 혈액을 공급해 망막신경의 기능을 보존하는 방식의 근본적인 치료방법 개발의 실마리가 될 것으로 기대된다.
* 망막허혈 : 망막 조직에 충분한 혈액 공급이 되지 않는 상태
* 안지오포이에틴-1(Angiopoietin-1) : 건강한 혈관의 생성을 유도하고 생성된 혈관의 안정화를 유지하는 데 중요한 성장인자.
실제 안지오포이에틴-1을 망막병증 생쥐모델의 안구에 투약한 결과 건강한 망막혈관의 생성이 촉진되어, 망막허혈에 따르는 비정상적인 혈관증식이나 망막출혈, 시력상실이 예방되었다.
이준엽 연구원은 “이번 연구는 안지오포이에틴-1이 망막혈관의 생성과 안정화에 중요한 인자라는 사실을 새롭게 규명함으로써 혈관생성을 억제하는 현재의 치료법에서 건강한 혈관을 생성하고 혈관의 기능을 강화하는 방식의 치료법으로 패러다임이 전환될 것을 기대한다”고 연구 의의를 밝혔다.
그림 1. 망막병증 생쥐모델에서의 안구 내 투여한 Angiopoietin-1의 역할 대조군에 비해 VEGF-Trap 치료군과 Angiopoietin-1 (Ang1) 치료군은 병적인 혈관의 증식을 유의하게 억제함 (아래), 추가적으로 Ang1 치료군은 망막 중심부의 무혈관부위(망막허혈)를 향하여 혈관이 생성되었고, 이러한 현상은 VEGF-Trap 치료군에서는 관찰되지 않음 (위).
그림 2. Angiopoietin-1에 의한 망막허혈과 망막 출혈의 감소 및 혈관의 정상화 (좌) 대조군에 비해 Angiopoietin-1 (Ang1) 치료군은 망막허혈부위 면적(화살표)을 유의하게 감소시켰으며, 망막 출혈의 양도 Ang1 치료에 의해 감소함. (우) Ang1 에 의해 새롭게 형성된 혈관은 정상 망막 혈관과 같이 혈관주위세포에 의한 지지를 받는 구조적으로 안정된 혈관임.
그림 3. Angiopoietin-1에 의한 망막 신경 보호 효과 (위) 대조군에 비해 Angiopoietin-1 (Ang1) 치료군은 망막 중앙부 와 주변부의 신경세포의 세포자멸사를 유의하게 억제함. (아래) 이러한 Ang1에 의한 망막 신경 보호 효과는 전기 생리학적 검사인 망막전위도 검사를 통해 확인됨.
그림 4. Angiopoietin-1 이 망막 혈관 생성을 유도하는 기전 Angiopoietin-1은 망막 혈관의 내피세포 (Endothelial cell) 에 작용하여 혈관의 안정성 유지에 중요한 역할을 할 뿐만 아니라 망막의 별아교세포 (Astrocyte) 의 integrin 수용체를 통하여 fibronectin 이라는 세포외기질의 생성을 증가시켜 망막 조직 내로의 혈관 생성의 경로를 안내하는 역할을 함.
2013.09.22 조회수 22270
건강한 망막혈관 생성을 유도하는 치료방법 개발
- 향후 당뇨망막병증 치료방법으로 적용 기대
우리 학교 연구진이 실명으로 이어질 수 있는 망막혈관 질환치료의 실마리를 찾아냈다. 혈액공급이 잘되지 않는 망막 부위로 건강한 망막혈관이 생성되도록 하여 망막신경을 보호하는 혈관생성단백질을 찾아낸 것. 향후 당뇨망막병증*과 미숙아망막병증**의 치료방법 개선을 위한 연구의 단초가 될 것으로 기대된다.
이번 연구결과는 국내에서 전문적인 기초과학 교육을 받고 있는 안과 전문의 연구원에 의해 이루어진 대표적인 중개연구의 결과여서 더욱 주목받고 있다.
* 미숙아망막병증 : 망막 혈관의 발달이 완성되지 않은 시기에 출생한 미숙아에서 발생하는 망막 혈관질환으로 소아실명의 가장 흔한 원인 질환이다.
* 당뇨망막병증 : 당뇨병의 합병증으로 망막조직으로의 불충분한 혈액공급으로 생기는 망막 혈관질환으로 성인실명의 중요한 원인 질환이다.
우리 학교 의과학대학원 이준엽 연구원이(안과 전문의, 지도교수: 고규영,유욱준) 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약)의 지원으로 수행되었고, 연구결과는 사이언스 중개의학(Science Translational Medicine) 표지논문(9월 18일자)으로 소개되었다. 이 학술지는 임상의학과 기초과학을 연계하는 중개의학 분야 권위지로 사이언스지 자매지이다.
(논문명 : Angiopoietin-1 Guides Directional Angiogenesis Through Integrin αvβ5 Signaling for Recovery of Ischemic Retinopathy)
당뇨망막병증의 치료에는 망막조직을 파괴하는 레이저광응고술이나혈관증식과 혈액누출을 억제하는 항체치료제*가 적용되고 있다.
항체치료제는 망막신경을 파괴하지 않는 장점이 있지만 한시적으로 혈관증식을 억제할 뿐, 근본적인 해결이 아니어서 반복적인 치료가 필요하다는 한계가 있었다.
* 항체치료제 : 비정상적인 혈관증식과 혈액누출을 선택적으로 억제하기 위하여 개발된 항체로서, 현재 혈관내피세포성장인자 (VEGF)를 저해하는 아바스틴 (Avastin) 과 루센티스 (Lucentis) 가 대표적인 항체치료제이다.
연구팀은 개체의 발달과정에서 혈관의 생성과 안정화에 필수적이라고 알려진 안지오포이에틴-1* 단백질이 망막혈관의 생성과정에도 중요한 역할을 함을 동물실험을 통해 규명해냈다.
망막출혈에 의한 시력상실의 근본 원인이 되는 망막허혈**을 개선하고 망막신경을 보호하는 단백질을 알아낸 것이다.
망막조직으로 충분한 혈액을 공급해 망막신경의 기능을 보존하는 방식의 근본적인 치료방법 개발의 실마리가 될 것으로 기대된다.
* 망막허혈 : 망막 조직에 충분한 혈액 공급이 되지 않는 상태
* 안지오포이에틴-1(Angiopoietin-1) : 건강한 혈관의 생성을 유도하고 생성된 혈관의 안정화를 유지하는 데 중요한 성장인자.
실제 안지오포이에틴-1을 망막병증 생쥐모델의 안구에 투약한 결과 건강한 망막혈관의 생성이 촉진되어, 망막허혈에 따르는 비정상적인 혈관증식이나 망막출혈, 시력상실이 예방되었다.
이준엽 연구원은 “이번 연구는 안지오포이에틴-1이 망막혈관의 생성과 안정화에 중요한 인자라는 사실을 새롭게 규명함으로써 혈관생성을 억제하는 현재의 치료법에서 건강한 혈관을 생성하고 혈관의 기능을 강화하는 방식의 치료법으로 패러다임이 전환될 것을 기대한다”고 연구 의의를 밝혔다.
그림 1. 망막병증 생쥐모델에서의 안구 내 투여한 Angiopoietin-1의 역할 대조군에 비해 VEGF-Trap 치료군과 Angiopoietin-1 (Ang1) 치료군은 병적인 혈관의 증식을 유의하게 억제함 (아래), 추가적으로 Ang1 치료군은 망막 중심부의 무혈관부위(망막허혈)를 향하여 혈관이 생성되었고, 이러한 현상은 VEGF-Trap 치료군에서는 관찰되지 않음 (위).
그림 2. Angiopoietin-1에 의한 망막허혈과 망막 출혈의 감소 및 혈관의 정상화 (좌) 대조군에 비해 Angiopoietin-1 (Ang1) 치료군은 망막허혈부위 면적(화살표)을 유의하게 감소시켰으며, 망막 출혈의 양도 Ang1 치료에 의해 감소함. (우) Ang1 에 의해 새롭게 형성된 혈관은 정상 망막 혈관과 같이 혈관주위세포에 의한 지지를 받는 구조적으로 안정된 혈관임.
그림 3. Angiopoietin-1에 의한 망막 신경 보호 효과 (위) 대조군에 비해 Angiopoietin-1 (Ang1) 치료군은 망막 중앙부 와 주변부의 신경세포의 세포자멸사를 유의하게 억제함. (아래) 이러한 Ang1에 의한 망막 신경 보호 효과는 전기 생리학적 검사인 망막전위도 검사를 통해 확인됨.
그림 4. Angiopoietin-1 이 망막 혈관 생성을 유도하는 기전 Angiopoietin-1은 망막 혈관의 내피세포 (Endothelial cell) 에 작용하여 혈관의 안정성 유지에 중요한 역할을 할 뿐만 아니라 망막의 별아교세포 (Astrocyte) 의 integrin 수용체를 통하여 fibronectin 이라는 세포외기질의 생성을 증가시켜 망막 조직 내로의 혈관 생성의 경로를 안내하는 역할을 함.
2013.09.22 조회수 22270 -
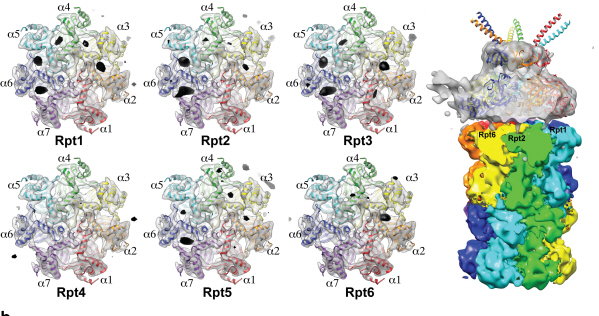 세포 내 단백질분해 복합체 조립과정 규명
- 바이오 투과전자현미경을 사용한 고해상도 3차원 구조분석 성공 -
- “신규 항암제 개발에 커다란 도움 될 것” -- 네이처(Nature) 5월 5일자 게재 -
단백질분자도 전자현미경을 이용해 관찰하고, 고해상도 3차원 구조를 분석하는 것이 가능해졌다.
우리 학교 의과학대학원 김호민 교수가 바이오 투과전자현미경을 이용해 세포 내 단백질의 분해를 담당하는 프로테아좀(proteasome) 복합체의 고해상도 구조를 규명했다.
이번 연구는 세계 최고 권위 학술지 ‘네이처(Nature, IF= 36.28)’ 5월 5일자 온라인판에 게재됐다.
우리 몸은 단백질의 생성과 소멸을 통해 세포 내 여러 가지 작용을 조절하고, 항상성을 유지한다. 프로테아좀 복합체는 폐기물 처리시설처럼 세포 내부에 있는 필요 없는 단백질들을 적절한 시기에 없애주면서 생체 조절의 핵심기능을 맡고 있다.
그러나 프로테아좀 복합체에 돌연변이가 생기면 사람에게 발생하는 주요 질병인 암, 퇴행성 뇌질환, 면역질환 등으로 이어질 수 있다.
현재 혈액암의 일종인 다발성 골수종의 치료제로 사용되고 있는 벨케이드(Velcade)가 바로 이 프로테아좀의 기능을 억제해 암세포 분열을 억제하는 항암제인데, 보다 더 약효가 좋고 부작용이 적은 항암제 및 질병치료제 개발을 위해 프로테아좀 복합체 관련 연구가 20년 이상 꾸준히 진행되고 있다.
30여개의 단백질이 모여서 만들어진 프로테아좀 복합체의 경우 크기가 매우 크고 구조가 복잡하기 때문에 기능을 이해하기 위한 3차원 구조 분석에 많은 어려움을 겪어왔다.
연구팀은 기존에 널리 사용되던 단백질 구조분석기술인 단백질결정학 기술 대신, 바이오 투과전자현미경 안에 얼려진 단백질샘플을 넣고 수백 장의 사진을 찍은 후 여러 각도에서 찍힌 단백질 사진을 고성능 컴퓨터를 이용해 분석함으로써 프로테아좀 복합체의 3차원 구조를 규명하는데 성공했다.
이 기술은 단백질결정학을 이용한 방법 보다 적은 단백질 샘플로 분석이 가능하며, 크기가 아주 큰 복합체 분석에 용이하다는 장점이 있다.
김호민 교수는 이번 연구에 대해 “프로테아좀 복합체 조립과정 이해 및 3차원 구조 규명은 생체 내 단백질 소멸 조절 과정에 대한 이해를 높일 뿐 아니라 이를 활용한 신약 개발이 활발히 이루어 질 것”이라고 말했다.
또 “국내 처음으로 도입된 바이오 투과전자현미경을 이용한 고해상도 단백질 구조분석은 기존의 단백질 결정학 기술로 접근이 어려웠던 매우 큰 단백질 복합체의 구조 분석을 가능케 할 것”이라며 “단백질결정학 기술과 바이오 투과전자현미경기술을 상호보완적으로 사용한다면 향후 여러 단백질복합체 3차 구조 연구에 큰 시너지효과를 가져올 수 있을 것으로 기대된다”고 말했다.
이번 연구는 KAIST 김호민 교수가 미국 캘리포니아대학 샌프란시스코 캠퍼스에서 박사 후 연구원으로 있을 당시부터 수행해 온 연구로 이판 쳉(Yifan Cheng) 교수의 지도를 받았으며, 하버드대, 콜로라도대와 공동으로 수행됐다.
그림1. 바이오 투과전자현미경으로 찍은 얼려진 상태의 단백질 샘플(프로테아좀 복합체) 사진
그림2. 바이오 투과전자현미경 이미지 분석을 통한 단백질 3차 구조
2013.05.06 조회수 16590
세포 내 단백질분해 복합체 조립과정 규명
- 바이오 투과전자현미경을 사용한 고해상도 3차원 구조분석 성공 -
- “신규 항암제 개발에 커다란 도움 될 것” -- 네이처(Nature) 5월 5일자 게재 -
단백질분자도 전자현미경을 이용해 관찰하고, 고해상도 3차원 구조를 분석하는 것이 가능해졌다.
우리 학교 의과학대학원 김호민 교수가 바이오 투과전자현미경을 이용해 세포 내 단백질의 분해를 담당하는 프로테아좀(proteasome) 복합체의 고해상도 구조를 규명했다.
이번 연구는 세계 최고 권위 학술지 ‘네이처(Nature, IF= 36.28)’ 5월 5일자 온라인판에 게재됐다.
우리 몸은 단백질의 생성과 소멸을 통해 세포 내 여러 가지 작용을 조절하고, 항상성을 유지한다. 프로테아좀 복합체는 폐기물 처리시설처럼 세포 내부에 있는 필요 없는 단백질들을 적절한 시기에 없애주면서 생체 조절의 핵심기능을 맡고 있다.
그러나 프로테아좀 복합체에 돌연변이가 생기면 사람에게 발생하는 주요 질병인 암, 퇴행성 뇌질환, 면역질환 등으로 이어질 수 있다.
현재 혈액암의 일종인 다발성 골수종의 치료제로 사용되고 있는 벨케이드(Velcade)가 바로 이 프로테아좀의 기능을 억제해 암세포 분열을 억제하는 항암제인데, 보다 더 약효가 좋고 부작용이 적은 항암제 및 질병치료제 개발을 위해 프로테아좀 복합체 관련 연구가 20년 이상 꾸준히 진행되고 있다.
30여개의 단백질이 모여서 만들어진 프로테아좀 복합체의 경우 크기가 매우 크고 구조가 복잡하기 때문에 기능을 이해하기 위한 3차원 구조 분석에 많은 어려움을 겪어왔다.
연구팀은 기존에 널리 사용되던 단백질 구조분석기술인 단백질결정학 기술 대신, 바이오 투과전자현미경 안에 얼려진 단백질샘플을 넣고 수백 장의 사진을 찍은 후 여러 각도에서 찍힌 단백질 사진을 고성능 컴퓨터를 이용해 분석함으로써 프로테아좀 복합체의 3차원 구조를 규명하는데 성공했다.
이 기술은 단백질결정학을 이용한 방법 보다 적은 단백질 샘플로 분석이 가능하며, 크기가 아주 큰 복합체 분석에 용이하다는 장점이 있다.
김호민 교수는 이번 연구에 대해 “프로테아좀 복합체 조립과정 이해 및 3차원 구조 규명은 생체 내 단백질 소멸 조절 과정에 대한 이해를 높일 뿐 아니라 이를 활용한 신약 개발이 활발히 이루어 질 것”이라고 말했다.
또 “국내 처음으로 도입된 바이오 투과전자현미경을 이용한 고해상도 단백질 구조분석은 기존의 단백질 결정학 기술로 접근이 어려웠던 매우 큰 단백질 복합체의 구조 분석을 가능케 할 것”이라며 “단백질결정학 기술과 바이오 투과전자현미경기술을 상호보완적으로 사용한다면 향후 여러 단백질복합체 3차 구조 연구에 큰 시너지효과를 가져올 수 있을 것으로 기대된다”고 말했다.
이번 연구는 KAIST 김호민 교수가 미국 캘리포니아대학 샌프란시스코 캠퍼스에서 박사 후 연구원으로 있을 당시부터 수행해 온 연구로 이판 쳉(Yifan Cheng) 교수의 지도를 받았으며, 하버드대, 콜로라도대와 공동으로 수행됐다.
그림1. 바이오 투과전자현미경으로 찍은 얼려진 상태의 단백질 샘플(프로테아좀 복합체) 사진
그림2. 바이오 투과전자현미경 이미지 분석을 통한 단백질 3차 구조
2013.05.06 조회수 16590 -
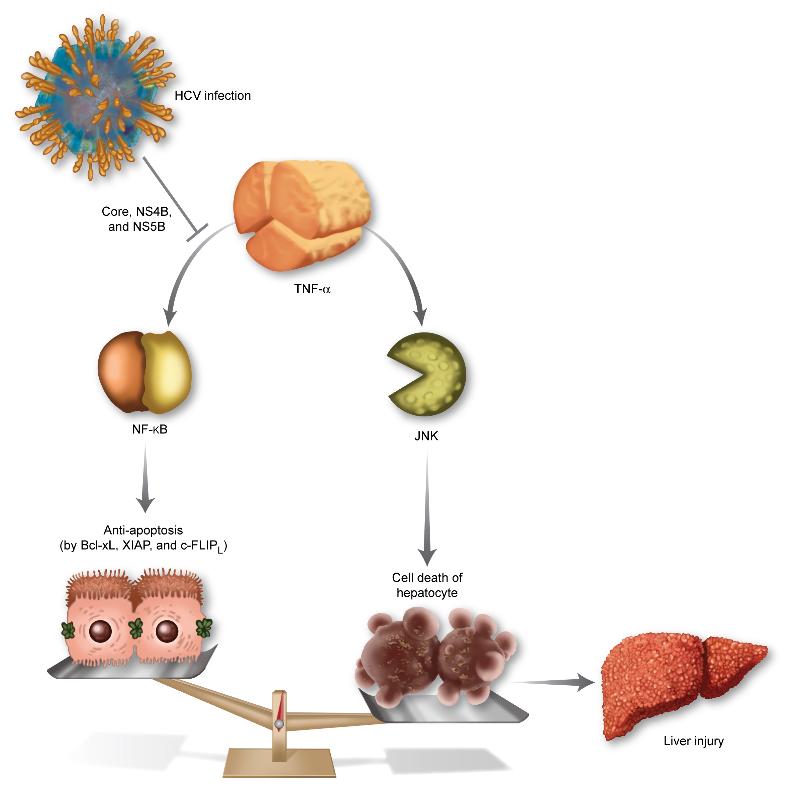 C형 간염 바이러스의 간 손상 메카니즘 규명
- 부작용 없이 간세포 손상 억제하는 치료제 개발 길 열어 -- 의학분야 세계 최고수준 학술지 ‘헤파톨로지’ 9월호 표지논문 장식 -
의사출신으로 구성된 KAIST 연구진이 C형 간염 바이러스 기전을 밝혀내 치료제 개발에 탄력을 받게 됐다.
우리 학교 바이오및뇌공학과 최철희 교수와 의과학대학원 신의철 교수팀이 공동으로 C형 간염 바이러스에 감염된 환자의 간 손상에 대한 메카니즘을 세계 최초로 규명했다.
이번 연구결과로 앞으로 부작용이 없으면서도 간세포 손상이 적은 C형 간염 바이러스 치료제가 개발될 수 있을 것으로 기대된다.
C형 간염은 C형 간염 바이러스(HCV, Hepatitis C virus)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환이다.
C형 간염 바이러스는 전 세계적으로 약 1억 7천만 명, 그리고 우리나라에서도 1%정도가 감염되어 있는 것으로 추정된다. 감염되면 대부분 만성으로 변하며, 간경변증이나 간암을 유발해 사망할 수 있는 무서운 질병이다.
하지만 2005년 시험관 내 세포에서 C형 간염 바이러스의 감염이 성공하기 전까지는 세포실험이 불가능했고, 침팬지 이외에는 감염시키는 동물이 없어 동물실험이 어려워 연구에 한계가 있었다.
연구팀은 C형 간염 바이러스에 감염시킨 세포주를 이용해 바이러스가 면역을 담당하는 세포에 의해 분비되는 단백질인 종양괴사인자(TNF-α)에 의한 세포의 사멸이 크게 증가하는 메카니즘을 세계 최초로 밝혀냈다.
이와 함께 이러한 작용을 일으키는 바이러스 구성 단백질도 규명에도 성공했다.
기존에는 C형 간염 바이러스가 간 손상을 일으키는 기전을 밝혀내지 못해 주로 바이러스의 증식을 억제하는 데 초점을 맞춰 신약이 개발돼 부작용이 많았다.
이번 연구결과를 통해 바이러스에 의한 간세포 손상을 억제하는 부작용 없는 신약개발이 가능하게 될 것으로 전망된다.
최철희 교수는 “이번 연구를 통해 C형 간염 바이러스가 숙주의 간세포와 어떤 상호 작용을 하는지 밝혀내 감염 환자의 치료법을 획기적으로 개선할 수 있을 것”이라고 말했다.
신의철 교수는 “이번 연구는 기초의학과 응용의학의 융합연구가 성공한 대표적 사례”라며 “앞으로도 다학제간 융합연구를 실시하면 그동안 풀지 못했던 난제들을 효율적으로 해결할 수 있을 것”이라고 강조했다.
한편, 교육과학기술부 미래기반기술개발사업(신약타겟검증연구사업)의 지원을 받아 수행된 이번 연구 결과는 의학 분야의 세계적 학술지인 헤파톨로지(Hepatolog, Impact Factor=11.665) 9월호 표지 논문으로 선정됐다.
□ 연구 세부사항 설명
TNF-α(종양괴사인자)는 면역을 담당하는 세포에 의해 분비되는 단백질이다. HCV에 감염되면 바이러스의 증식을 억제하기 위해 체내의 면역작용이 활발해지고 TNF-α의 분비도 늘어난다.
TNF-α는 세포의 생존을 담당하는 NF-κB 신호전달과 세포의 죽음을 담당하는 JNK 신호 전달을 동시에 활성화시킨다. HCV에 감염되면, 세포의 생존을 담당하는 NF-κB 쪽 신호전달 경로만 선택적으로 활성을 억제하게 되고, TNF-α의 역할은 세포의 죽음 쪽으로 균형이 기울게 된다.
바이러스의 증식을 억제하기 위해 분비된 TNF-α가 오히려 간세포를 죽이게 되는 것이다. 이는 곧 간 손상을 뜻하며, HCV를 구성하는 10가지의 단백질 중 core, NF4B, NS5B 라는 단백질이 이러한 작용을 한다고 규명해냈다.
2012.09.04 조회수 18516
C형 간염 바이러스의 간 손상 메카니즘 규명
- 부작용 없이 간세포 손상 억제하는 치료제 개발 길 열어 -- 의학분야 세계 최고수준 학술지 ‘헤파톨로지’ 9월호 표지논문 장식 -
의사출신으로 구성된 KAIST 연구진이 C형 간염 바이러스 기전을 밝혀내 치료제 개발에 탄력을 받게 됐다.
우리 학교 바이오및뇌공학과 최철희 교수와 의과학대학원 신의철 교수팀이 공동으로 C형 간염 바이러스에 감염된 환자의 간 손상에 대한 메카니즘을 세계 최초로 규명했다.
이번 연구결과로 앞으로 부작용이 없으면서도 간세포 손상이 적은 C형 간염 바이러스 치료제가 개발될 수 있을 것으로 기대된다.
C형 간염은 C형 간염 바이러스(HCV, Hepatitis C virus)에 감염되었을 때 이에 대응하기 위한 신체의 면역반응으로 인해 간에 염증이 생기는 질환이다.
C형 간염 바이러스는 전 세계적으로 약 1억 7천만 명, 그리고 우리나라에서도 1%정도가 감염되어 있는 것으로 추정된다. 감염되면 대부분 만성으로 변하며, 간경변증이나 간암을 유발해 사망할 수 있는 무서운 질병이다.
하지만 2005년 시험관 내 세포에서 C형 간염 바이러스의 감염이 성공하기 전까지는 세포실험이 불가능했고, 침팬지 이외에는 감염시키는 동물이 없어 동물실험이 어려워 연구에 한계가 있었다.
연구팀은 C형 간염 바이러스에 감염시킨 세포주를 이용해 바이러스가 면역을 담당하는 세포에 의해 분비되는 단백질인 종양괴사인자(TNF-α)에 의한 세포의 사멸이 크게 증가하는 메카니즘을 세계 최초로 밝혀냈다.
이와 함께 이러한 작용을 일으키는 바이러스 구성 단백질도 규명에도 성공했다.
기존에는 C형 간염 바이러스가 간 손상을 일으키는 기전을 밝혀내지 못해 주로 바이러스의 증식을 억제하는 데 초점을 맞춰 신약이 개발돼 부작용이 많았다.
이번 연구결과를 통해 바이러스에 의한 간세포 손상을 억제하는 부작용 없는 신약개발이 가능하게 될 것으로 전망된다.
최철희 교수는 “이번 연구를 통해 C형 간염 바이러스가 숙주의 간세포와 어떤 상호 작용을 하는지 밝혀내 감염 환자의 치료법을 획기적으로 개선할 수 있을 것”이라고 말했다.
신의철 교수는 “이번 연구는 기초의학과 응용의학의 융합연구가 성공한 대표적 사례”라며 “앞으로도 다학제간 융합연구를 실시하면 그동안 풀지 못했던 난제들을 효율적으로 해결할 수 있을 것”이라고 강조했다.
한편, 교육과학기술부 미래기반기술개발사업(신약타겟검증연구사업)의 지원을 받아 수행된 이번 연구 결과는 의학 분야의 세계적 학술지인 헤파톨로지(Hepatolog, Impact Factor=11.665) 9월호 표지 논문으로 선정됐다.
□ 연구 세부사항 설명
TNF-α(종양괴사인자)는 면역을 담당하는 세포에 의해 분비되는 단백질이다. HCV에 감염되면 바이러스의 증식을 억제하기 위해 체내의 면역작용이 활발해지고 TNF-α의 분비도 늘어난다.
TNF-α는 세포의 생존을 담당하는 NF-κB 신호전달과 세포의 죽음을 담당하는 JNK 신호 전달을 동시에 활성화시킨다. HCV에 감염되면, 세포의 생존을 담당하는 NF-κB 쪽 신호전달 경로만 선택적으로 활성을 억제하게 되고, TNF-α의 역할은 세포의 죽음 쪽으로 균형이 기울게 된다.
바이러스의 증식을 억제하기 위해 분비된 TNF-α가 오히려 간세포를 죽이게 되는 것이다. 이는 곧 간 손상을 뜻하며, HCV를 구성하는 10가지의 단백질 중 core, NF4B, NS5B 라는 단백질이 이러한 작용을 한다고 규명해냈다.
2012.09.04 조회수 18516 -
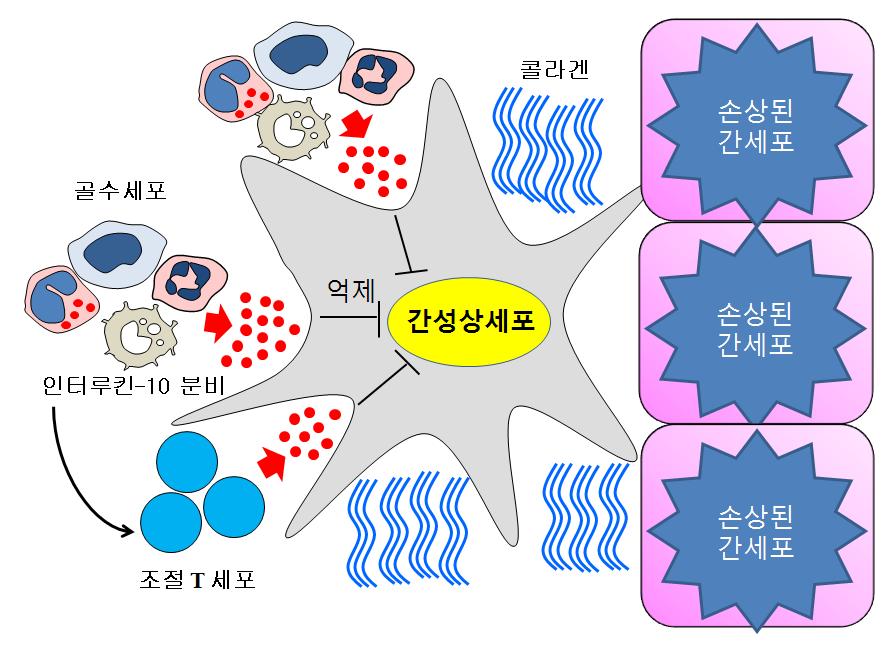 부작용 없는 간경변 치료법 개발
- 환자 중 70% 증상 호전돼, 간이식 외 치료법이 없던 간경변 치료길 열려 -- KAIST 의과학대학원, 연세대학교 의과대학과 공동으로 기초와 임상을 연계한 중개연구의 쾌거 -
새로운 방식의 간경변 치료법이 개발됐다. 환자 중 70%가 증상이 호전되는 것을 발견했으며, 자신의 골수를 이용하기 때문에 간이식이 어려운 중증 간질환자들에게 시도해 볼 수 있는 치료가 가능해 질 것으로 기대된다.
우리 학교 의과학대학원 정원일 교수와 연세대학교 의과대학 김자경 교수 연구팀이 공동으로 자가골수세포를 이용해 부작용 없는 간경변 치료법을 개발했다.
간경변증은 간염바이러스 또는 알코올 등에 의한 간 손상시 간성상세포들이 비정상적으로 콜라겐을 분비해서 간이 딱딱해지는 것을 말한다.
이 질병은 전 세계적으로 높은 사망률을 보이는 질환으로써 치료약이 개발돼 있지 않다. 따라서 환자들은 간 이식을 통해 수명을 연장할 수 있으나 이식할 수 있는 간의 부족, 높은 수술비용, 그리고 면역억제제 부작용 등의 어려움이 있었다.
연구팀은 자가골수세포를 투여한 간경변 환자들이 24시간 이후부터 혈중 인터류킨-10이라는 생체물질이 증가하는 것을 관찰했다. 인터류킨-10은 간성상세포들의 콜라겐 분비를 억제하고, 염증을 억제하는 조절 T세포를 증가시켜 결과적으로 간기능을 호전시켰다.
임상연구결과 간경변 환자 15명 중 10명의 증상이 호전되는 것을 관찰해 간경변 환자들을 치료 할 수 있는 길이 열리는 근거를 제시했다.
자가골수세포를 이용한 간경변 치료는 면역부작용이 없고, 환자 자신의 몸에서 쉽게 얻어낼 수 있고, 현재 한 번의 시술만으로도 그 효과를 볼 수 있는 게 커다란 장점이다.
또한, 기존에 실시해오던 간이식과 같은 시술법보다 훨씬 더 저렴하기 때문에 환자들의 부담도 크게 감소될 것으로 전망된다.
이와 함께 효능이 없는 나머지 30%의 환자들은 빠른 시간 내에 간이식과 같은 다른 치료법으로 유도할 수 있는 큰 장점을 가지고 있다.
정원일 교수는 “증가하는 지방간과 C형간염 환자 및 비정상적인 음주문화로 인한 간질환이 심각한 문제로 다가오고 있지만 간이식 외에 마땅한 치료법이 없다”며 “이번 연구결과를 기반으로 미래를 준비한다면 막대한 사회적 및 경제적 파급효과가 있을 것으로 예상 된다”고 말했다.
또 유욱준 KAIST 의과학대학원 책임교수는 “이번 연구는 기초와 임상연구를 접목한 대표적 중개연구로 ‘기초 의과학 연구를 통해 의과대학을 졸업한 의사학생들을 훌륭한 박사로 성장시킨다’는 학과의 설립취지와 맞물리는 성공적인 사례”라고 말했다.
한편, 2009년부터 보건복지부 중개연구 및 교육과학기술부 핵심공동연구 사업 등의 일환으로 지난 3년간 수행된 이번 연구는 간 치료 분야에서 권위 있는 학술지인 ‘헤파톨로지(Hepatology, IF=10.885)’ 온라인판에 4월 27일자로 게재됐다.
붙임 : 보충자료, 그림설명
□ 보충자료
【기초와 임상을 연계한 중개연구】이번 연구는 기초와 임상 연구를 접목한 대표적인 중개연구(translational research)로써 ‘기초 의과학 연구를 통해 의과대학을 졸업한 의사학생들을 훌륭한 M.D.-Ph.D.로 성장시킨다’는 카이스트 의과학대학원의 설립취지와 맞물리는 성공적인 사례이다.
본 연구의 제일 저자인 ▲ 서양권 학생(2009년 입학)은 연세대학교 의과대학을 졸업하고 세브란스 병원에서 전문의 수련을 받은 후 본 카이스트 의과학대학원의 박사과정으로 입학한 학생으로 3년간의 고된 연구과정을 모범적으로 수행하여 왔으며 카이스트 의과학대학원 ▲ 정원일 교수는 수의사이자 동물실험 전문가로서 임상적 결과와 동물실험의 결과를 접목해 비교 및 분석을 실시하였으며 본 연구를 주도하였다.
▲ 연세대학교 의과대학 김자경 교수팀은 환자의 자가골수세포 치료를 한국에서 유일하게 수행중인 팀으로써 지난 3년간 환자의 선별, 시술 및 임상적 자료를 수집하고 분석하는 실험을 실시하여 왔다.
따라서 본 연구결과는 이들의 연구가 삼위일체되어 수행된 성공적인 중개연구로써 이러한 결과들을 활용하여 앞으로 본격적인 임상시술 및 추가 연구가 수행될 것으로 예상된다.
【경제적 가치 및 파급효과】우리나라에서 간질환의 사회적 경제적 지출액은 연간 약 2조 6,000억원 정도이며, 요양급여 지출액은 년간 약 3,550억원, 그 수혜자들은 166만명에 다다른다. 여기에 반해 아직까지 마땅한 치료법이 없어 환자들 스스로가 민간치료법에 의존하거나 간이식을 받는 것이 대부분이다.
현재 국내에서는 B형간염 예방접종에 따라 앞으로 B형간염유래 간경변증은 점차 줄게 될 것이나, 증가하는 C형간염 및 비정상적인 음주문화로 인한 간질환은 향후 20-30년 이후에 가장 심각한 문제가 될 것이라 예상된다.
따라서 본 연구결과의 가시적인 성과들을 기반으로 하여 미래를 준비할 수 있다면 막대한 사회적 및 경제적 이익이 있을 것으로 예측된다.
□ 그림설명
그림 1. 혈관으로 주입된 골수세포(녹색)가 간 내로 이동하여 간성상세포(붉은색)를 억제하는 것이 관찰됨(간조직 사진)
그림 2. 세포배양 실험에서도 간성상세포와 골수세포를 공동배양 시 강력하게 밀착하여 작용하는 것을 관찰(좌측 골수세포 주입직후, 우측 12시간 경과후)
그림 3. 간성상세포와 결합한 골수세포들이 IL-10을 분비하고 (좌측) 이들 세포들의 모양을 관찰한 바 우측에서와 같이 CD11b와 Gr1을 발현하는 미성숙 골수세포임을 확인함
그림 4. 골수에 들어있는 여러 종류의 골수세포들 중 특정 세포마커(CD11b와 Gr1)를 발현하는 골수세포들이 간으로 이동을 하게 된 후, 인터류킨-10이라는 물질을 분비함으로써 간경변을 유발시키는 간성상세포를 직접적으로 억제하거나 수여자 몸속에 존재하는 조절 T 세포의 활성을 유도하여 간접적으로 간성상세포의 활성을 억제하여 간경변을 치료하는 기전임.
2012.05.23 조회수 19218
부작용 없는 간경변 치료법 개발
- 환자 중 70% 증상 호전돼, 간이식 외 치료법이 없던 간경변 치료길 열려 -- KAIST 의과학대학원, 연세대학교 의과대학과 공동으로 기초와 임상을 연계한 중개연구의 쾌거 -
새로운 방식의 간경변 치료법이 개발됐다. 환자 중 70%가 증상이 호전되는 것을 발견했으며, 자신의 골수를 이용하기 때문에 간이식이 어려운 중증 간질환자들에게 시도해 볼 수 있는 치료가 가능해 질 것으로 기대된다.
우리 학교 의과학대학원 정원일 교수와 연세대학교 의과대학 김자경 교수 연구팀이 공동으로 자가골수세포를 이용해 부작용 없는 간경변 치료법을 개발했다.
간경변증은 간염바이러스 또는 알코올 등에 의한 간 손상시 간성상세포들이 비정상적으로 콜라겐을 분비해서 간이 딱딱해지는 것을 말한다.
이 질병은 전 세계적으로 높은 사망률을 보이는 질환으로써 치료약이 개발돼 있지 않다. 따라서 환자들은 간 이식을 통해 수명을 연장할 수 있으나 이식할 수 있는 간의 부족, 높은 수술비용, 그리고 면역억제제 부작용 등의 어려움이 있었다.
연구팀은 자가골수세포를 투여한 간경변 환자들이 24시간 이후부터 혈중 인터류킨-10이라는 생체물질이 증가하는 것을 관찰했다. 인터류킨-10은 간성상세포들의 콜라겐 분비를 억제하고, 염증을 억제하는 조절 T세포를 증가시켜 결과적으로 간기능을 호전시켰다.
임상연구결과 간경변 환자 15명 중 10명의 증상이 호전되는 것을 관찰해 간경변 환자들을 치료 할 수 있는 길이 열리는 근거를 제시했다.
자가골수세포를 이용한 간경변 치료는 면역부작용이 없고, 환자 자신의 몸에서 쉽게 얻어낼 수 있고, 현재 한 번의 시술만으로도 그 효과를 볼 수 있는 게 커다란 장점이다.
또한, 기존에 실시해오던 간이식과 같은 시술법보다 훨씬 더 저렴하기 때문에 환자들의 부담도 크게 감소될 것으로 전망된다.
이와 함께 효능이 없는 나머지 30%의 환자들은 빠른 시간 내에 간이식과 같은 다른 치료법으로 유도할 수 있는 큰 장점을 가지고 있다.
정원일 교수는 “증가하는 지방간과 C형간염 환자 및 비정상적인 음주문화로 인한 간질환이 심각한 문제로 다가오고 있지만 간이식 외에 마땅한 치료법이 없다”며 “이번 연구결과를 기반으로 미래를 준비한다면 막대한 사회적 및 경제적 파급효과가 있을 것으로 예상 된다”고 말했다.
또 유욱준 KAIST 의과학대학원 책임교수는 “이번 연구는 기초와 임상연구를 접목한 대표적 중개연구로 ‘기초 의과학 연구를 통해 의과대학을 졸업한 의사학생들을 훌륭한 박사로 성장시킨다’는 학과의 설립취지와 맞물리는 성공적인 사례”라고 말했다.
한편, 2009년부터 보건복지부 중개연구 및 교육과학기술부 핵심공동연구 사업 등의 일환으로 지난 3년간 수행된 이번 연구는 간 치료 분야에서 권위 있는 학술지인 ‘헤파톨로지(Hepatology, IF=10.885)’ 온라인판에 4월 27일자로 게재됐다.
붙임 : 보충자료, 그림설명
□ 보충자료
【기초와 임상을 연계한 중개연구】이번 연구는 기초와 임상 연구를 접목한 대표적인 중개연구(translational research)로써 ‘기초 의과학 연구를 통해 의과대학을 졸업한 의사학생들을 훌륭한 M.D.-Ph.D.로 성장시킨다’는 카이스트 의과학대학원의 설립취지와 맞물리는 성공적인 사례이다.
본 연구의 제일 저자인 ▲ 서양권 학생(2009년 입학)은 연세대학교 의과대학을 졸업하고 세브란스 병원에서 전문의 수련을 받은 후 본 카이스트 의과학대학원의 박사과정으로 입학한 학생으로 3년간의 고된 연구과정을 모범적으로 수행하여 왔으며 카이스트 의과학대학원 ▲ 정원일 교수는 수의사이자 동물실험 전문가로서 임상적 결과와 동물실험의 결과를 접목해 비교 및 분석을 실시하였으며 본 연구를 주도하였다.
▲ 연세대학교 의과대학 김자경 교수팀은 환자의 자가골수세포 치료를 한국에서 유일하게 수행중인 팀으로써 지난 3년간 환자의 선별, 시술 및 임상적 자료를 수집하고 분석하는 실험을 실시하여 왔다.
따라서 본 연구결과는 이들의 연구가 삼위일체되어 수행된 성공적인 중개연구로써 이러한 결과들을 활용하여 앞으로 본격적인 임상시술 및 추가 연구가 수행될 것으로 예상된다.
【경제적 가치 및 파급효과】우리나라에서 간질환의 사회적 경제적 지출액은 연간 약 2조 6,000억원 정도이며, 요양급여 지출액은 년간 약 3,550억원, 그 수혜자들은 166만명에 다다른다. 여기에 반해 아직까지 마땅한 치료법이 없어 환자들 스스로가 민간치료법에 의존하거나 간이식을 받는 것이 대부분이다.
현재 국내에서는 B형간염 예방접종에 따라 앞으로 B형간염유래 간경변증은 점차 줄게 될 것이나, 증가하는 C형간염 및 비정상적인 음주문화로 인한 간질환은 향후 20-30년 이후에 가장 심각한 문제가 될 것이라 예상된다.
따라서 본 연구결과의 가시적인 성과들을 기반으로 하여 미래를 준비할 수 있다면 막대한 사회적 및 경제적 이익이 있을 것으로 예측된다.
□ 그림설명
그림 1. 혈관으로 주입된 골수세포(녹색)가 간 내로 이동하여 간성상세포(붉은색)를 억제하는 것이 관찰됨(간조직 사진)
그림 2. 세포배양 실험에서도 간성상세포와 골수세포를 공동배양 시 강력하게 밀착하여 작용하는 것을 관찰(좌측 골수세포 주입직후, 우측 12시간 경과후)
그림 3. 간성상세포와 결합한 골수세포들이 IL-10을 분비하고 (좌측) 이들 세포들의 모양을 관찰한 바 우측에서와 같이 CD11b와 Gr1을 발현하는 미성숙 골수세포임을 확인함
그림 4. 골수에 들어있는 여러 종류의 골수세포들 중 특정 세포마커(CD11b와 Gr1)를 발현하는 골수세포들이 간으로 이동을 하게 된 후, 인터류킨-10이라는 물질을 분비함으로써 간경변을 유발시키는 간성상세포를 직접적으로 억제하거나 수여자 몸속에 존재하는 조절 T 세포의 활성을 유도하여 간접적으로 간성상세포의 활성을 억제하여 간경변을 치료하는 기전임.
2012.05.23 조회수 19218 -
 면역기능 촉진 新메커니즘 규명
- ‘이뮤니티(면역)’지 게재, “기존 면역효과를 획기적으로 증진시킨 백신 개발 가능성 열어”-
면역기능을 유지‧촉진하는데 필수적인 과정인 ‘림프관신생* 조절’에 관여하는 새로운 메커니즘이 국내 연구진에 의해 규명되어, 기존보다 면역효과를 획기적으로 증진시키는 백신 개발 가능성을 열었다.
* 림프관신생(lymphangiogenesis) : 몸속에 새로운 림프관이 만들어지는 현상으로, 면역기능 유지와 염증 억제에 매우 중요한 과정
한국과학기술원(KAIST) 고규영, 이승효 교수가 주도하고 라구 카타루(Raghu Kataru) 박사와 김한솔 대학원생이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구) 및 세계수준의 연구중심대학(WCU) 육성사업의 지원을 받아 수행되었다.
특히 이번 연구결과는 면역학 분야에서 세계적으로 권위 있는 학술지인 ‘이뮤니티[Immunity(면역), Cell 자매지, IF=20.589]’지 표지논문(1월 20일자)으로 선정되는 등 연구의 우수성을 인정받았다. (논문명 : T Lymphocytes Negatively Regulate Lymph Node Lymphatic Vessel Formation)
고규영, 이승효 교수 연구팀은 우리 몸의 면역을 담당하는 세포(T 임파구)에서 분비되는 물질(인터페론*)이 림프관신생을 억제한다는 사실을 동물실험(쥐)을 통해 새롭게 발견하고, 이 물질을 효과적으로 조절하면 면역기능을 촉진시켜 백신치료 효과를 향상시킬 수 있다는 점을 밝혀냈다.
* 인터페론 : T 임파구가 활성화되면 분비되는 것으로, 체내의 면역을 담당하는 주요 인자
지금까지 전 세계 의학자들은 백신 접종으로 감기 등 감염성 질환뿐만 아니라 다양한 면역성 질병도 예방하고자 다각적인 노력을 기울여 왔다. 그러나 일부 백신은 효과가 미미하거나 오히려 효과가 전혀 없는 등 질병 예방과 치료에 많은 어려움이 있었다.
연구팀은 T 임파구와 인터페론이 결여된 생쥐에 면역 증강제를 투여하자 림프관신생이 급격히 증가한다는 사실을 확인하고, T 임파구나 인터페론의 기능을 조절하여 백신의 효과를 극대화시킬 수 있을 뿐만 아니라 면역 기능을 높인 백신 개발의 가능성을 제시하였다.
고규영 교수는 “이번 연구는 T 임파구에서 분비되는 인터페론이 림프관 신생을 조절하는 중요한 인자라는 사실을 새롭게 규명하고, 이 인자를 적절히 조절하면 면역기능을 효과적으로 증진시킬 수 있음을 증명하였다. 이번 연구를 통해 예방과 치료에 획기적인 효과를 지닌 백신 개발에 새로운 전기를 마련할 것으로 기대한다”고 연구 의의를 밝혔다.
2011.01.24 조회수 17102
면역기능 촉진 新메커니즘 규명
- ‘이뮤니티(면역)’지 게재, “기존 면역효과를 획기적으로 증진시킨 백신 개발 가능성 열어”-
면역기능을 유지‧촉진하는데 필수적인 과정인 ‘림프관신생* 조절’에 관여하는 새로운 메커니즘이 국내 연구진에 의해 규명되어, 기존보다 면역효과를 획기적으로 증진시키는 백신 개발 가능성을 열었다.
* 림프관신생(lymphangiogenesis) : 몸속에 새로운 림프관이 만들어지는 현상으로, 면역기능 유지와 염증 억제에 매우 중요한 과정
한국과학기술원(KAIST) 고규영, 이승효 교수가 주도하고 라구 카타루(Raghu Kataru) 박사와 김한솔 대학원생이 참여한 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구) 및 세계수준의 연구중심대학(WCU) 육성사업의 지원을 받아 수행되었다.
특히 이번 연구결과는 면역학 분야에서 세계적으로 권위 있는 학술지인 ‘이뮤니티[Immunity(면역), Cell 자매지, IF=20.589]’지 표지논문(1월 20일자)으로 선정되는 등 연구의 우수성을 인정받았다. (논문명 : T Lymphocytes Negatively Regulate Lymph Node Lymphatic Vessel Formation)
고규영, 이승효 교수 연구팀은 우리 몸의 면역을 담당하는 세포(T 임파구)에서 분비되는 물질(인터페론*)이 림프관신생을 억제한다는 사실을 동물실험(쥐)을 통해 새롭게 발견하고, 이 물질을 효과적으로 조절하면 면역기능을 촉진시켜 백신치료 효과를 향상시킬 수 있다는 점을 밝혀냈다.
* 인터페론 : T 임파구가 활성화되면 분비되는 것으로, 체내의 면역을 담당하는 주요 인자
지금까지 전 세계 의학자들은 백신 접종으로 감기 등 감염성 질환뿐만 아니라 다양한 면역성 질병도 예방하고자 다각적인 노력을 기울여 왔다. 그러나 일부 백신은 효과가 미미하거나 오히려 효과가 전혀 없는 등 질병 예방과 치료에 많은 어려움이 있었다.
연구팀은 T 임파구와 인터페론이 결여된 생쥐에 면역 증강제를 투여하자 림프관신생이 급격히 증가한다는 사실을 확인하고, T 임파구나 인터페론의 기능을 조절하여 백신의 효과를 극대화시킬 수 있을 뿐만 아니라 면역 기능을 높인 백신 개발의 가능성을 제시하였다.
고규영 교수는 “이번 연구는 T 임파구에서 분비되는 인터페론이 림프관 신생을 조절하는 중요한 인자라는 사실을 새롭게 규명하고, 이 인자를 적절히 조절하면 면역기능을 효과적으로 증진시킬 수 있음을 증명하였다. 이번 연구를 통해 예방과 치료에 획기적인 효과를 지닌 백신 개발에 새로운 전기를 마련할 것으로 기대한다”고 연구 의의를 밝혔다.
2011.01.24 조회수 17102 -
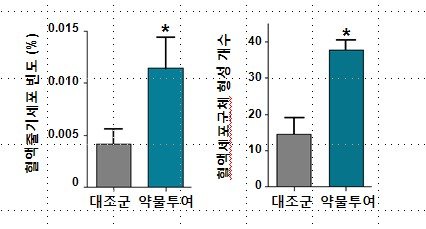 새로운 혈액줄기세포 공급원으로 지방조직 이용가능성 규명
카이스트 생명과학과 고규영교수(및 연구원 한진아)팀, Blood지(IF=10.4)에 실려-
교육과학기술부(장관 안병만)의 21세기 프론티어연구개발사업 지원을 받는 세포응용연구사업단(단장:김동욱 연세대 교수)의 연구팀(책임자:고규영 카이스트 교수, 연구원:한진아)이 지방조직으로부터 백혈병 등 혈액계 난치병 치료에 이용가능한 혈액줄기세포를 분리해 낼 수 있음을 입증하였다. 이로써, 보다 적은 비용과 쉬운 방법으로 혈액줄기세포를 공급할 수 있는 길이 열릴 것으로 기대된다.
이번 연구 결과는 그 중요성을 인정받아 세계적인 학회지인 Blood의 2010년 2월 4일자 표지논문으로 선정되었으며, 이례적으로 학회지를 주관하는 미국 혈액학회 (American Society of Hematology, ASH)가 세계매체를 통해 일반인에게 홍보하기로 하였다.
혈액줄기세포는 다양한 종류의 혈액세포로 분화할 수 있는 분화능을 보유하고 있는 대표적인 성체 줄기세포로, 백혈병 등의 혈액계 난치병 치료에 이용된다. 혈액줄기세포는 주로 성체의 골수 내에 존재하는데, 그 양이 제한적이고 생체외 증식이 어려워 연구 및 치료목적으로의 사용에 걸림돌이 되어 왔다.
우리대학 생명과학과 고규영 교수 연구팀은 지방조직과 골수조직이 다양한 공통점을 갖는다는 점에 착안하여, 골수를 손상시킨 동물에게 지방 조직에 존재하는 비지방세포를 정맥주사한 후, 이 세포로부터 유래한 혈액세포가 장기간 동물의 혈액 내에 존재한다는 것을 입증함으로써, 주입한 지방조직의 비지방세포에 손상된 골수를 재생시킬 수 있는 능력을 가진 혈액줄기세포가 존재한다는 사실을 밝혔다.
김동욱 단장은 “혈액줄기세포를 골수나 혈액으로부터 분리할 수 있는 것은 이미 널리 알려진 방법이지만, 흔히 쓸모없는 조직으로 생각하는 지방조직을 혈액줄기세포의 공급원으로 규명한 것은 이번이 처음이다”라며 재생의학의 새로운 세포공급원으로서 지방조직 이용 가능성을 밝혔다. 이 연구는 혈액줄기세포의 자가이식에 있어 새로운 방법을 제공할 수 있을 것으로 기대된다.
1. 연구내용 요약
혈액줄기세포는 혈액계의 항상성을 유지하는 역할을 담당하는 대표적인 성체줄기세포의 일종으로, 대부분의 혈액줄기세포는 골수에 존재하고 있다. 그러나 소량의 혈액줄기세포는 혈액 내에 포함되어 체내를 순환하다가, 다시 골수로 되돌아오게 된다. 한진아 연구원, 김인준 교수, 고규영 교수 연구팀은 이 과정에서 혈액줄기세포가 골수조직 뿐만 아니라 골수와 비슷한 조건을 제공하여 적절한 환경이 조성되어 있는 조직으로, 골수와 다양한 특성을 공유하고 있는 지방조직을 연구하였다.
지방조직은 지방세포와 비지방세포로 구성되어 있는데, 우리는 생쥐의 지방조직으로부터 비지방세포를 분리하여 유세포분석기 (FACS), 세포배양 군체형성 등의 생체외 실험과 방사선 조사 후 골수이식 등의 생체실험을 실시하였다. 줄기세포를 세포치료 목적으로 이용하고자 할 때, 가장 중요한 것은 생체 내에서의 활동성이다. 우리는 방사선을 조사하여 골수를 손상시킨 동물에 비지방세포를 정맥주사하여, 이 세포로부터 유래한 혈액세포가 장기간 동물의 혈액 내에 존재한다는 사실을 입증하였다. 이는 주입된 세포군 내에 손상된 골수를 재생시킬 수 있는 능력을 가진 혈액줄기세포가 포함되어 있다는 것을 직접적으로 보여주는 증거이다. 더불어 비지방세포에 포함된 혈액줄기세포가 골수에서 유래한 것이며, 약물을 이용하여 골수 혈액줄기세포의 순환계로의 유출을 촉진시켰을 때, 보다 많은 양의 세포를 지방조직으로부터 얻을 수 있음을 입증하였다.
생쥐의 지방조직으로부터 혈액줄기세포를 얻을 수 있다는 사실을 입증함으로써 이용가능한 혈액줄기세포의 또 다른 원천을 밝혀낸 것이다. 이에 인간 지방조직에 대한 연구가 개발, 확립된다면, 연구 및 치료목적으로 응용 가능성이 매우 높을 것으로 기대된다.
이번 연구의 자세한 내용은 2010년 2월 4일자 Blood 저널에 표지논문으로 발표되며, 이례적으로 이 학회지를 주관하는 미국 혈액학회 (American Society of Hematology, ASH)가 세계매체를 통해 일반인에게 홍보하기로 하였다.
2. 용어설명
∙성체줄기세포 : 배아발달 단계 이후 체내에 존재하는 줄기세포로, 주로 손상된 조직을 재생, 성장시키는 역할을 담당하여 필요한 때에 특정한 조직의 세포로 분화하게 되는 미분화 상태의 세포이다. 배아줄기세포와 달리 윤리적 문제가 없고, 자가면역 반응을 일으키지 않는다는 장점이 있다.
∙비지방세포 : 지방조직에서 지방세포를 제외한 나머지 세포군을 말하며 면역세포, 혈관내피세포와 더불어 그 성격이 완전히 규명되지 않은 줄기세포들을 포함하고 있다. 지방, 연골, 근육 조직 등으로의 분화능을 보유하고 있는 등 골수 중간엽줄기세포 (mesenchymal stem cell)와 유사한 특성을 가지고 있다.
그림 1. Blood 학회지에 표지로 실린 사진. 지방조직에서 발견되는 혈액줄기세포 분포양상.(파란색 : 혈액 / 분홍색 : 혈액줄기세포)
그림 2. 생체외 세포군체형성. 배양된 비지방세포로부터 유래된 혈액세포군체.
그림 3. 약물투여 후 비지방세포에서 혈액줄기세포의 양이 증가함을 나타내는 결과.
2010.02.04 조회수 23619
새로운 혈액줄기세포 공급원으로 지방조직 이용가능성 규명
카이스트 생명과학과 고규영교수(및 연구원 한진아)팀, Blood지(IF=10.4)에 실려-
교육과학기술부(장관 안병만)의 21세기 프론티어연구개발사업 지원을 받는 세포응용연구사업단(단장:김동욱 연세대 교수)의 연구팀(책임자:고규영 카이스트 교수, 연구원:한진아)이 지방조직으로부터 백혈병 등 혈액계 난치병 치료에 이용가능한 혈액줄기세포를 분리해 낼 수 있음을 입증하였다. 이로써, 보다 적은 비용과 쉬운 방법으로 혈액줄기세포를 공급할 수 있는 길이 열릴 것으로 기대된다.
이번 연구 결과는 그 중요성을 인정받아 세계적인 학회지인 Blood의 2010년 2월 4일자 표지논문으로 선정되었으며, 이례적으로 학회지를 주관하는 미국 혈액학회 (American Society of Hematology, ASH)가 세계매체를 통해 일반인에게 홍보하기로 하였다.
혈액줄기세포는 다양한 종류의 혈액세포로 분화할 수 있는 분화능을 보유하고 있는 대표적인 성체 줄기세포로, 백혈병 등의 혈액계 난치병 치료에 이용된다. 혈액줄기세포는 주로 성체의 골수 내에 존재하는데, 그 양이 제한적이고 생체외 증식이 어려워 연구 및 치료목적으로의 사용에 걸림돌이 되어 왔다.
우리대학 생명과학과 고규영 교수 연구팀은 지방조직과 골수조직이 다양한 공통점을 갖는다는 점에 착안하여, 골수를 손상시킨 동물에게 지방 조직에 존재하는 비지방세포를 정맥주사한 후, 이 세포로부터 유래한 혈액세포가 장기간 동물의 혈액 내에 존재한다는 것을 입증함으로써, 주입한 지방조직의 비지방세포에 손상된 골수를 재생시킬 수 있는 능력을 가진 혈액줄기세포가 존재한다는 사실을 밝혔다.
김동욱 단장은 “혈액줄기세포를 골수나 혈액으로부터 분리할 수 있는 것은 이미 널리 알려진 방법이지만, 흔히 쓸모없는 조직으로 생각하는 지방조직을 혈액줄기세포의 공급원으로 규명한 것은 이번이 처음이다”라며 재생의학의 새로운 세포공급원으로서 지방조직 이용 가능성을 밝혔다. 이 연구는 혈액줄기세포의 자가이식에 있어 새로운 방법을 제공할 수 있을 것으로 기대된다.
1. 연구내용 요약
혈액줄기세포는 혈액계의 항상성을 유지하는 역할을 담당하는 대표적인 성체줄기세포의 일종으로, 대부분의 혈액줄기세포는 골수에 존재하고 있다. 그러나 소량의 혈액줄기세포는 혈액 내에 포함되어 체내를 순환하다가, 다시 골수로 되돌아오게 된다. 한진아 연구원, 김인준 교수, 고규영 교수 연구팀은 이 과정에서 혈액줄기세포가 골수조직 뿐만 아니라 골수와 비슷한 조건을 제공하여 적절한 환경이 조성되어 있는 조직으로, 골수와 다양한 특성을 공유하고 있는 지방조직을 연구하였다.
지방조직은 지방세포와 비지방세포로 구성되어 있는데, 우리는 생쥐의 지방조직으로부터 비지방세포를 분리하여 유세포분석기 (FACS), 세포배양 군체형성 등의 생체외 실험과 방사선 조사 후 골수이식 등의 생체실험을 실시하였다. 줄기세포를 세포치료 목적으로 이용하고자 할 때, 가장 중요한 것은 생체 내에서의 활동성이다. 우리는 방사선을 조사하여 골수를 손상시킨 동물에 비지방세포를 정맥주사하여, 이 세포로부터 유래한 혈액세포가 장기간 동물의 혈액 내에 존재한다는 사실을 입증하였다. 이는 주입된 세포군 내에 손상된 골수를 재생시킬 수 있는 능력을 가진 혈액줄기세포가 포함되어 있다는 것을 직접적으로 보여주는 증거이다. 더불어 비지방세포에 포함된 혈액줄기세포가 골수에서 유래한 것이며, 약물을 이용하여 골수 혈액줄기세포의 순환계로의 유출을 촉진시켰을 때, 보다 많은 양의 세포를 지방조직으로부터 얻을 수 있음을 입증하였다.
생쥐의 지방조직으로부터 혈액줄기세포를 얻을 수 있다는 사실을 입증함으로써 이용가능한 혈액줄기세포의 또 다른 원천을 밝혀낸 것이다. 이에 인간 지방조직에 대한 연구가 개발, 확립된다면, 연구 및 치료목적으로 응용 가능성이 매우 높을 것으로 기대된다.
이번 연구의 자세한 내용은 2010년 2월 4일자 Blood 저널에 표지논문으로 발표되며, 이례적으로 이 학회지를 주관하는 미국 혈액학회 (American Society of Hematology, ASH)가 세계매체를 통해 일반인에게 홍보하기로 하였다.
2. 용어설명
∙성체줄기세포 : 배아발달 단계 이후 체내에 존재하는 줄기세포로, 주로 손상된 조직을 재생, 성장시키는 역할을 담당하여 필요한 때에 특정한 조직의 세포로 분화하게 되는 미분화 상태의 세포이다. 배아줄기세포와 달리 윤리적 문제가 없고, 자가면역 반응을 일으키지 않는다는 장점이 있다.
∙비지방세포 : 지방조직에서 지방세포를 제외한 나머지 세포군을 말하며 면역세포, 혈관내피세포와 더불어 그 성격이 완전히 규명되지 않은 줄기세포들을 포함하고 있다. 지방, 연골, 근육 조직 등으로의 분화능을 보유하고 있는 등 골수 중간엽줄기세포 (mesenchymal stem cell)와 유사한 특성을 가지고 있다.
그림 1. Blood 학회지에 표지로 실린 사진. 지방조직에서 발견되는 혈액줄기세포 분포양상.(파란색 : 혈액 / 분홍색 : 혈액줄기세포)
그림 2. 생체외 세포군체형성. 배양된 비지방세포로부터 유래된 혈액세포군체.
그림 3. 약물투여 후 비지방세포에서 혈액줄기세포의 양이 증가함을 나타내는 결과.
2010.02.04 조회수 23619 -
 KAIST 고규영교수팀, 당뇨병 족부궤양 치료단백질 개발
손발이 부패하는 당뇨병 합병증을 치료하는 획기적인 신물질
KAIST 의과학센터와 바이오벤처 제넥셀세인(주)의 고규영 교수와 조정현 박사 연구팀은 혈관생성을 촉진시키는 치료단백질인 콤프앤지원 을 개발하여 이 단백질이 당뇨병 합병증인 족부궤양을 획기적으로 치료한다는 것을 당뇨병 실험동물을 통해 밝혔다.
이번 연구 결과의 자세한 내용은 세계적인 학술지인 미국국립학술원회보지(Proceedings National Academy Sciences, 일명 PNAS)에 조기출간 (2006년 3월 셋째주)으로 게재된다. 미국국립학술원에서는 이 내용의 중요성이 당뇨병 족부궤양 환자에게 희망을 줄 것이라는 판단 하에 이례적으로 일반인을 대상으로 하는 월드사이언스뉴스 홍보물로 채택하였다.
이 연구내용을 근거로 하여 콤프앤지원 치료단백질의 물질 및 임상응용 특허권을 가지고 있는 제넥셀세인(주)는 현재 전임상 실험을 진행하고 있으며 조만간에 상처 합병증이 있는 당뇨병환자를 대상으로 임상실험을 실시하여 실용화할 예정이다.
우리나라를 비롯한 서구 선진국 국가에서 당뇨병의 환자수는 현재 2억명 으로 추산되며 급속도로 증가하여 2020년도에는 3억명에 이르면서 "당뇨대란“이 일어 날것이라고 의학자들은 예고하고 있다. 말기 당뇨병 환자의 약 10%는 손발의 상처가 낫지 않고 썩어 들어가서 결국 손발을 잘라내야 하는 족부궤양에 시달리게 된다.
당뇨병성 족부궤양은 장기 당뇨병에 의한 족부의 미세혈관이 망가져 피부상처가 회복되지 않고 궤양으로 진행되는 치료가 어려운 질환이다. 따라서 이 족부 상처 부위의 망가진 미세혈관에 콤프앤지원을 투여하여 건강한 혈관생성을 촉진 시켜 준다면 상처와 궤양의 회복을 촉진할 것이라는 확신을 하게 되었다.
당뇨병성 생쥐의 꼬리에 궤양과 동일한 상처를 낸 후 콤프엔지원을 전신투여 하거나 상처부위에 국부투여하여 탁월한 상처치유 효과가 있다는 것을 확인하였다. 조직학적 검사를 해보니 콤프앤지원이 상처부위의 건강한 미세혈관과 임파관 생성을 촉진할 뿐만 아니라 혈류량도 증가시켜 상처치유 효과를 일으킨다는 사실을 알게 되었다. 아직까지 이러한 족부궤양을 치료할 수 있는 치료제가 없었으나 이번에 고규영 교수팀의 연구 결과로 인해 손발을 잘라내지 않고 콤프앤지원을 국부투여하여 족부궤양을 치료할 수 있는 길이 열린 것이다.
콤프앤지원 (COMP-Ang1)은 고규영 교수 연구팀이 2년전에 최초로 개발한 건강한 혈관생성촉진 단백질이다. 콤프앤지원은 건강한 혈관생성을 촉진하므로 혈관질환이 동반하는 심장병 (심근경색과 심장허혈증)과 뇌졸중 치료에 적용할 목적으로 제넥셀세인(주)은 현재 전임상 실험을 진행하고 있다. 콤프앤지원은 연간 2조원 이상이 될 것으로 추정되는 세계 혈관형성 촉진제 시장을 석권할 최초의 단백질 치료제가 될 것으로 기대된다.
그림설명: 당뇨병성 생쥐의 꼬리에 궤양과 동일한 상처를 낸 후 콤프엔지원을 투여 하고 상처치유정도를 날짜 별로 사진을 찍음. 대조약물을 투여받은 생쥐의 꼬리 상처는 8가 지나도록 치유가 되지 않는 반면, 콤프앤지원을 투여 받은 생쥐의 꼬리 상처는 4-8주 사이에 거의 완치됨.
2006.03.15 조회수 19820
KAIST 고규영교수팀, 당뇨병 족부궤양 치료단백질 개발
손발이 부패하는 당뇨병 합병증을 치료하는 획기적인 신물질
KAIST 의과학센터와 바이오벤처 제넥셀세인(주)의 고규영 교수와 조정현 박사 연구팀은 혈관생성을 촉진시키는 치료단백질인 콤프앤지원 을 개발하여 이 단백질이 당뇨병 합병증인 족부궤양을 획기적으로 치료한다는 것을 당뇨병 실험동물을 통해 밝혔다.
이번 연구 결과의 자세한 내용은 세계적인 학술지인 미국국립학술원회보지(Proceedings National Academy Sciences, 일명 PNAS)에 조기출간 (2006년 3월 셋째주)으로 게재된다. 미국국립학술원에서는 이 내용의 중요성이 당뇨병 족부궤양 환자에게 희망을 줄 것이라는 판단 하에 이례적으로 일반인을 대상으로 하는 월드사이언스뉴스 홍보물로 채택하였다.
이 연구내용을 근거로 하여 콤프앤지원 치료단백질의 물질 및 임상응용 특허권을 가지고 있는 제넥셀세인(주)는 현재 전임상 실험을 진행하고 있으며 조만간에 상처 합병증이 있는 당뇨병환자를 대상으로 임상실험을 실시하여 실용화할 예정이다.
우리나라를 비롯한 서구 선진국 국가에서 당뇨병의 환자수는 현재 2억명 으로 추산되며 급속도로 증가하여 2020년도에는 3억명에 이르면서 "당뇨대란“이 일어 날것이라고 의학자들은 예고하고 있다. 말기 당뇨병 환자의 약 10%는 손발의 상처가 낫지 않고 썩어 들어가서 결국 손발을 잘라내야 하는 족부궤양에 시달리게 된다.
당뇨병성 족부궤양은 장기 당뇨병에 의한 족부의 미세혈관이 망가져 피부상처가 회복되지 않고 궤양으로 진행되는 치료가 어려운 질환이다. 따라서 이 족부 상처 부위의 망가진 미세혈관에 콤프앤지원을 투여하여 건강한 혈관생성을 촉진 시켜 준다면 상처와 궤양의 회복을 촉진할 것이라는 확신을 하게 되었다.
당뇨병성 생쥐의 꼬리에 궤양과 동일한 상처를 낸 후 콤프엔지원을 전신투여 하거나 상처부위에 국부투여하여 탁월한 상처치유 효과가 있다는 것을 확인하였다. 조직학적 검사를 해보니 콤프앤지원이 상처부위의 건강한 미세혈관과 임파관 생성을 촉진할 뿐만 아니라 혈류량도 증가시켜 상처치유 효과를 일으킨다는 사실을 알게 되었다. 아직까지 이러한 족부궤양을 치료할 수 있는 치료제가 없었으나 이번에 고규영 교수팀의 연구 결과로 인해 손발을 잘라내지 않고 콤프앤지원을 국부투여하여 족부궤양을 치료할 수 있는 길이 열린 것이다.
콤프앤지원 (COMP-Ang1)은 고규영 교수 연구팀이 2년전에 최초로 개발한 건강한 혈관생성촉진 단백질이다. 콤프앤지원은 건강한 혈관생성을 촉진하므로 혈관질환이 동반하는 심장병 (심근경색과 심장허혈증)과 뇌졸중 치료에 적용할 목적으로 제넥셀세인(주)은 현재 전임상 실험을 진행하고 있다. 콤프앤지원은 연간 2조원 이상이 될 것으로 추정되는 세계 혈관형성 촉진제 시장을 석권할 최초의 단백질 치료제가 될 것으로 기대된다.
그림설명: 당뇨병성 생쥐의 꼬리에 궤양과 동일한 상처를 낸 후 콤프엔지원을 투여 하고 상처치유정도를 날짜 별로 사진을 찍음. 대조약물을 투여받은 생쥐의 꼬리 상처는 8가 지나도록 치유가 되지 않는 반면, 콤프앤지원을 투여 받은 생쥐의 꼬리 상처는 4-8주 사이에 거의 완치됨.
2006.03.15 조회수 19820