-
 김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17
조회수 22702
-
 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07
조회수 24241
-
 조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07
조회수 24663
-
 전상용 교수, 인체 담석형성반응 이용한 항암치료 시스템 개발
〈 전상용 교수, 이동윤 박사과정 〉
우리 대학 생명과학과 전상용 교수 연구팀이 인간 체내의 물질을 이용해 광학영상 진단 및 광열 치료가 가능한 항암시스템을 개발했다.
연구팀은 빌리루빈이라는 체내 물질과 그 빌리루빈으로 인해 발생하는 담석형성반응을 응용했다. 인체 내 강력한 항산화제인 빌리루빈의 담석 형성 과정에서 관찰되는 자체 금속 결합 기능과 신생아 황달 치료에 쓰이는 푸른빛에 반응하는 성질을 동시에 이용했다.
이를 통해 높은 생체 적합성과 우수한 광음향 진단 기능 및 광열 치료 효능을 보여 항암 치료 분야에서 적합한 치료 시스템이 될 것으로 기대된다.
이동윤 박사과정이 1저자로 참여한 이번 연구는 응용화학분야 저명학술지 앙케반테 케미(Angewandte Chemie International Edition) 9월 4일자 온라인 판에 게재됐다.
전 교수 연구팀은 과거 연구에서 물과 화합하지 않는 소수성을 갖는 빌리루빈과, 그 반대로 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’ 기반의 나노입자 시스템을 개발한 경험이 있다.
이는 빌리루빈의 항산화 기능을 그대로 유지하면서 체내로 축적되지 않게 해 빌리루빈의 장점만을 취하는 기술이다. 이를 바탕으로 염증성 장 질환, 허혈/재관류, 췌도세포 이식, 천식 등의 동물 질병 모델에서 효능 및 안정성을 확인했다.
이번 연구에서는 앞선 연구의 접근 방식과 다르게 빌리루빈이 갖고 있는 다른 물리 화학적 성질을 이용해 항암 치료에 적용했다.
먼저 황달의 주요 원인체인 노란색 빌리루빈에 특정 파장대의 빛(푸른 빛)을 쬐어주면 이에 반응해 광이성질체(빛에 의해 모양이 변형된 물체)가 되고 배설이 활성화돼 신생아 황달 치료에 널리 쓰일 수 있는 광학물질인 점을 첫 번째 근거로 활용했다.
두 번째로는 인체 내의 쓸개관 혹은 쓸개 등에서 병이 생길 때 종종 발견할 수 있는 검은 색소 담석의 주성분 또한 빌리루빈이라는 점에 주목했다. 빌리루빈이 칼슘이나 구리 등 양이온과 중간 매개체 없이도 결합할 때 검은 색소 담석이 형성되는 점을 응용했다.
연구팀은 구리나 칼슘 대신 시스플라틴이라는 백금 금속 기반 항암제와 빌리루빈을 결합해 노란색의 빌리루빈을 보라색의 복합체로 변환시켰다.
이후 근적외선 파장대의 빛을 쬐었을 때 기존에 비해 크게 향상된 광감응성을 보였고, 실제 정맥 주사된 대장암 동물 모델에서도 종양 부분에서의 유의미한 광음향 신호 증가를 확인했다. 이 기술로 향후 더 향상된 종양 진단을 할 수 있을 것으로 기대된다.
또한 종양 부위에 근적외선 빛을 쬐었을 때 광열 효과에 의해 5분 내에 25℃ 이상의 온도 상승을 확인했고, 2주 후 다른 그룹에 비해 종양 크기의 감소 및 괴사를 확인했다.
전 교수는 “현재 개발된 물질들은 생체 적합성이 낮고 잠재적 생체 독성 가능성이 있는 인공소재 위주이기 때문에 임상으로 이어지는 데 한계가 있었다”며 “이번에 개발한 인체 유래 빌리루빈 기반의 광학물질은 광음향 영상 및 광열 치료의 전임상 중개연구 및 임상 적용에 새로운 플랫폼이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈의 담석형성반응 및 광감응성을 이용한 본 연구의 모식도
그림2. 빌리루빈 나노입자 (왼쪽)와 시스플라틴이 결합된 빌리루빈 나노입자 (오른쪽) 수용액
전상용 교수, 인체 담석형성반응 이용한 항암치료 시스템 개발
〈 전상용 교수, 이동윤 박사과정 〉
우리 대학 생명과학과 전상용 교수 연구팀이 인간 체내의 물질을 이용해 광학영상 진단 및 광열 치료가 가능한 항암시스템을 개발했다.
연구팀은 빌리루빈이라는 체내 물질과 그 빌리루빈으로 인해 발생하는 담석형성반응을 응용했다. 인체 내 강력한 항산화제인 빌리루빈의 담석 형성 과정에서 관찰되는 자체 금속 결합 기능과 신생아 황달 치료에 쓰이는 푸른빛에 반응하는 성질을 동시에 이용했다.
이를 통해 높은 생체 적합성과 우수한 광음향 진단 기능 및 광열 치료 효능을 보여 항암 치료 분야에서 적합한 치료 시스템이 될 것으로 기대된다.
이동윤 박사과정이 1저자로 참여한 이번 연구는 응용화학분야 저명학술지 앙케반테 케미(Angewandte Chemie International Edition) 9월 4일자 온라인 판에 게재됐다.
전 교수 연구팀은 과거 연구에서 물과 화합하지 않는 소수성을 갖는 빌리루빈과, 그 반대로 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’ 기반의 나노입자 시스템을 개발한 경험이 있다.
이는 빌리루빈의 항산화 기능을 그대로 유지하면서 체내로 축적되지 않게 해 빌리루빈의 장점만을 취하는 기술이다. 이를 바탕으로 염증성 장 질환, 허혈/재관류, 췌도세포 이식, 천식 등의 동물 질병 모델에서 효능 및 안정성을 확인했다.
이번 연구에서는 앞선 연구의 접근 방식과 다르게 빌리루빈이 갖고 있는 다른 물리 화학적 성질을 이용해 항암 치료에 적용했다.
먼저 황달의 주요 원인체인 노란색 빌리루빈에 특정 파장대의 빛(푸른 빛)을 쬐어주면 이에 반응해 광이성질체(빛에 의해 모양이 변형된 물체)가 되고 배설이 활성화돼 신생아 황달 치료에 널리 쓰일 수 있는 광학물질인 점을 첫 번째 근거로 활용했다.
두 번째로는 인체 내의 쓸개관 혹은 쓸개 등에서 병이 생길 때 종종 발견할 수 있는 검은 색소 담석의 주성분 또한 빌리루빈이라는 점에 주목했다. 빌리루빈이 칼슘이나 구리 등 양이온과 중간 매개체 없이도 결합할 때 검은 색소 담석이 형성되는 점을 응용했다.
연구팀은 구리나 칼슘 대신 시스플라틴이라는 백금 금속 기반 항암제와 빌리루빈을 결합해 노란색의 빌리루빈을 보라색의 복합체로 변환시켰다.
이후 근적외선 파장대의 빛을 쬐었을 때 기존에 비해 크게 향상된 광감응성을 보였고, 실제 정맥 주사된 대장암 동물 모델에서도 종양 부분에서의 유의미한 광음향 신호 증가를 확인했다. 이 기술로 향후 더 향상된 종양 진단을 할 수 있을 것으로 기대된다.
또한 종양 부위에 근적외선 빛을 쬐었을 때 광열 효과에 의해 5분 내에 25℃ 이상의 온도 상승을 확인했고, 2주 후 다른 그룹에 비해 종양 크기의 감소 및 괴사를 확인했다.
전 교수는 “현재 개발된 물질들은 생체 적합성이 낮고 잠재적 생체 독성 가능성이 있는 인공소재 위주이기 때문에 임상으로 이어지는 데 한계가 있었다”며 “이번에 개발한 인체 유래 빌리루빈 기반의 광학물질은 광음향 영상 및 광열 치료의 전임상 중개연구 및 임상 적용에 새로운 플랫폼이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈의 담석형성반응 및 광감응성을 이용한 본 연구의 모식도
그림2. 빌리루빈 나노입자 (왼쪽)와 시스플라틴이 결합된 빌리루빈 나노입자 (오른쪽) 수용액
2017.09.20
조회수 20782
-
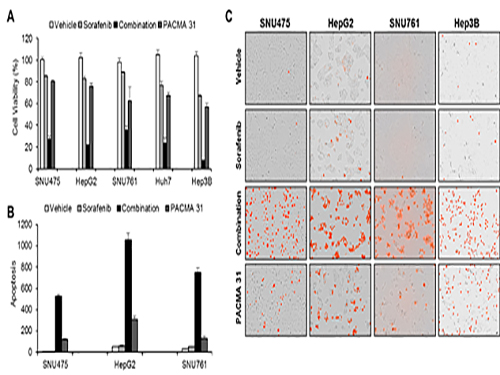 조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24
조회수 22013
-
 박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06
조회수 19848
-
 김재경 교수, 수학 통해 암과 생체시계의 핵심 연결고리 발견
〈 이번 연구에 참여한 김재경 교수와 버지니아 공대 연구팀 〉
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 생체시계가 암 억제 핵심 물질인 p53을 24시간 주기로 변화시키는 원리를 예측했다.
그리고 김재경 교수의 수학적 모델링은 미국 버지니아 공대 칼라 핀키엘스타인(Carla Finkielstein, 아르헨티나) 교수 연구팀의 실험을 통해 검증돼 생체시계와 암 사이에 중요한 연결고리가 있음이 증명됐다.
이번 연구 결과는 미국의 저명 학술지 미국국립과학원회보(PNAS) 11월 9일자 온라인 판에 게재됐다.
뇌 속의 생체 시계는 우리가 24시간 주기에 맞춰 살 수 있도록 행동과 생리작용을 조절한다. 밤 9시가 되면 뇌 속의 멜라토닌 호르몬이 분비를 유발해 일정 시간에 수면을 취하게 하는 등 세포분열부터 운동 및 학습 능력 등 다양한 생리 작용에 관여한다.
만성적 야근, 교대 근무 등으로 인해 생체 시계와 실제 시간이 충돌해 생체 시계의 교란이 생기면 당뇨, 암, 심장병 등 다양한 질병을 유발할 수 있다.
지난 2014년 김 교수가 버지니아 공대의 칼라 핀키엘스타인 교수 연구팀과 만났을 때 핀키엘스타인 교수 연구팀은 암 억제물질인 p53이 24시간을 주기로 변화함을 관찰했지만 어떤 원리로 생체시계가 p53의 24시간 주기 리듬을 만들어내는지는 알지 못하는 상태였다.
p53이 세포의 조절 시스템 중에서도 매우 복잡한 시스템으로 구성돼 실험만을 통해 원리를 밝혀내기엔 많은 시간과 인력이 소모되기 때문이다.
김 교수는 문제 해결을 위해 수리모델링을 이용한 컴퓨터 시뮬레이션을 통해 수백만 경우의 가상 실험을 실시했다. 시행착오에 기반한 전통적 실험 대신 수리모델을 이용함으로써 비용, 시간, 인력 등을 줄일 수 있었다.
김 교수는 이 과정에서 생체 시계의 핵심 역할을 하는 물질인 Period2 단백질이 p53의 생체리듬과 깊은 관련이 있음을 밝혔다. 세포는 크게 핵과 세포질 두 가지 성분으로 나뉜다. p53은 핵과 세포질에 모두 존재할 수 있는데 이 중 핵 안으로 p53이 들어가면 안정화돼 분해가 느리게 일어난다.
김 교수는 p53 단백질을 핵 안으로 끌고 들어가는 물질이 생체 시계의 핵심 역할을 하는 Period2 단백질임을 예측했다.
이러한 김 교수의 수리모델을 통한 예측들은 핀키엘스타인교수 연구팀에 의해서 실험으로 검증돼 생체시계와 암 사이의 핵심 연결 고리를 발견할 수 있었다.
이번 연구는 p53 단백질을 정상화하는 수많은 항암제들이 투약 시간에 따라 효과가 달라졌던 원인을 규명하고 최적의 항암제 투약 시간을 밝히는 데 중요한 역할을 할 것으로 기대된다.
연구팀은 생체시계가 불안정한 교대 근무 직종 종사자들이 암 발병 확률이 높아지는 원인 규명 및 치료법 개발에 역할을 할 것으로 예상된다고 밝혔다.
김 교수는 “간호사, 경찰 등 교대 근무로 인해 고생하시는 분들이 좀 더 건강한 생활을 할 수 있도록 수학을 통해 조그만 기여를 하게 돼 기쁘다”며 “이번 성과를 통해 우리나라에서 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”고 말했다.
미국 버지니아 공대와 공동으로 진행한 이번 연구는 포스코 청암 재단, 미국과학연구재단, 한국연구재단의 신진연구자 지원 사업 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학과 실험을 통해서 밝혀진 생체시계의 핵심 단백질 Period2(Per2)와 암 억제 핵심 물질인 p53의 복잡한 상호작용
그림2. 이번 연구에서 사용된 수리모델의 일부
김재경 교수, 수학 통해 암과 생체시계의 핵심 연결고리 발견
〈 이번 연구에 참여한 김재경 교수와 버지니아 공대 연구팀 〉
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 생체시계가 암 억제 핵심 물질인 p53을 24시간 주기로 변화시키는 원리를 예측했다.
그리고 김재경 교수의 수학적 모델링은 미국 버지니아 공대 칼라 핀키엘스타인(Carla Finkielstein, 아르헨티나) 교수 연구팀의 실험을 통해 검증돼 생체시계와 암 사이에 중요한 연결고리가 있음이 증명됐다.
이번 연구 결과는 미국의 저명 학술지 미국국립과학원회보(PNAS) 11월 9일자 온라인 판에 게재됐다.
뇌 속의 생체 시계는 우리가 24시간 주기에 맞춰 살 수 있도록 행동과 생리작용을 조절한다. 밤 9시가 되면 뇌 속의 멜라토닌 호르몬이 분비를 유발해 일정 시간에 수면을 취하게 하는 등 세포분열부터 운동 및 학습 능력 등 다양한 생리 작용에 관여한다.
만성적 야근, 교대 근무 등으로 인해 생체 시계와 실제 시간이 충돌해 생체 시계의 교란이 생기면 당뇨, 암, 심장병 등 다양한 질병을 유발할 수 있다.
지난 2014년 김 교수가 버지니아 공대의 칼라 핀키엘스타인 교수 연구팀과 만났을 때 핀키엘스타인 교수 연구팀은 암 억제물질인 p53이 24시간을 주기로 변화함을 관찰했지만 어떤 원리로 생체시계가 p53의 24시간 주기 리듬을 만들어내는지는 알지 못하는 상태였다.
p53이 세포의 조절 시스템 중에서도 매우 복잡한 시스템으로 구성돼 실험만을 통해 원리를 밝혀내기엔 많은 시간과 인력이 소모되기 때문이다.
김 교수는 문제 해결을 위해 수리모델링을 이용한 컴퓨터 시뮬레이션을 통해 수백만 경우의 가상 실험을 실시했다. 시행착오에 기반한 전통적 실험 대신 수리모델을 이용함으로써 비용, 시간, 인력 등을 줄일 수 있었다.
김 교수는 이 과정에서 생체 시계의 핵심 역할을 하는 물질인 Period2 단백질이 p53의 생체리듬과 깊은 관련이 있음을 밝혔다. 세포는 크게 핵과 세포질 두 가지 성분으로 나뉜다. p53은 핵과 세포질에 모두 존재할 수 있는데 이 중 핵 안으로 p53이 들어가면 안정화돼 분해가 느리게 일어난다.
김 교수는 p53 단백질을 핵 안으로 끌고 들어가는 물질이 생체 시계의 핵심 역할을 하는 Period2 단백질임을 예측했다.
이러한 김 교수의 수리모델을 통한 예측들은 핀키엘스타인교수 연구팀에 의해서 실험으로 검증돼 생체시계와 암 사이의 핵심 연결 고리를 발견할 수 있었다.
이번 연구는 p53 단백질을 정상화하는 수많은 항암제들이 투약 시간에 따라 효과가 달라졌던 원인을 규명하고 최적의 항암제 투약 시간을 밝히는 데 중요한 역할을 할 것으로 기대된다.
연구팀은 생체시계가 불안정한 교대 근무 직종 종사자들이 암 발병 확률이 높아지는 원인 규명 및 치료법 개발에 역할을 할 것으로 예상된다고 밝혔다.
김 교수는 “간호사, 경찰 등 교대 근무로 인해 고생하시는 분들이 좀 더 건강한 생활을 할 수 있도록 수학을 통해 조그만 기여를 하게 돼 기쁘다”며 “이번 성과를 통해 우리나라에서 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”고 말했다.
미국 버지니아 공대와 공동으로 진행한 이번 연구는 포스코 청암 재단, 미국과학연구재단, 한국연구재단의 신진연구자 지원 사업 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학과 실험을 통해서 밝혀진 생체시계의 핵심 단백질 Period2(Per2)와 암 억제 핵심 물질인 p53의 복잡한 상호작용
그림2. 이번 연구에서 사용된 수리모델의 일부
2016.11.10
조회수 49807
-
 조용훈 교수, 피라미드 구조로 방향성과 집광 효율을 높인 고성능 반도체 양자 광원 개발
우리 대학 물리학과 조용훈 교수 연구팀이 반도체 피라미드 구조의 양자점이 피라미드 밑면으로 강한 빛을 방출함을 발견하고 이 빛을 높은 효율로 모을 수 있는 기술을 개발했다.
김세정, 공수현 박사가 공동 1저자로 참여한 이번 연구 결과는 나노분야 국제 학술지 ‘나노 레터스(Nano Letters)’ 10월 12일자에 게재됐다.
반도체 양자점은 빛 알갱이를 하나씩 내뿜는 단일광자원(양자광원)으로 활용가능하다. 단일광자원은 미래의 양자컴퓨터 또는 양자암호기술 등을 구현하기 위한 필수 요소이다.
일반적인 양자점은 불규칙적인 위치에 형성되는 반면 3차원 피라미드 구조에 얇게 양자우물(Quantum well)을 성장시키면 정확히 피라미드 꼭짓점 위치에 양자점(Quantum dot)을 형성할 수 있다. 이 기술을 활용하면 위치가 제어된 단일광자원을 높은 수율로 얻을 수 있다.
하지만 양자점에서 나오는 빛은 빛 알갱이 개수가 적고 양자점이 굴절률 높은 반도체 물질에 갇혀 있기 때문에 일반적으로 구조 바깥으로 빠져나오기 어렵다. 반도체 단일광자원 소자가 상용화 단계로 나아가려면 빛의 집광 효율을 높여야만 한다.
연구팀은 일반적으로 가지고 있는 고정관념을 벗어나 문제를 해결했다. 피라미드 구조의 빛의 지향성(directionality)을 관찰했고 이를 이용했다. 그 동안 피라미드 양자점에서 나오는 빛은 피라미드의 위, 즉 꼭짓점 방향으로 나오는 신호만을 측정했다. 피라미드 밑면 방향으로는 성장 과정상 두꺼운 기판이 반드시 존재하기 때문이다.
하지만 연구팀은 시뮬레이션을 통해 양자점이 피라미드 위쪽보다 밑면 방향으로 더 많은 빛을 방출함을 확인했다.
또한 피라미드 밑면 방향으로 진행하는 빛은 가우시안 형태의 전기장 분포 형태를 갖고 있어, 광도파로 또는 광섬유의 단일 모드와 잘 일치한다. 이는 제품과 전선을 결합하듯이 광원과 광도파로 간의 결합 효율을 높일 수 있다.
이에 연구팀은 폴리머를 이용해 피라미드 구조체를 기판에서 떼어냈다. 피라미드의 밑면으로 나오는 빛이 두꺼운 반도체 기판을 거치지 않고 공기 중으로 직접 방출되도록 한 것이다.
연구팀이 떼어낸 피라미드는 쉽게 다른 광학 소자들과 직접 결합할 수 있어 피라미드 양자점의 응용분야가 확대될 수 있는 발판이 될 것으로 기대된다.
조 교수는 “이번 연구 내용은 양자 광원 뿐 아니라 LED와 같은 광원 소자에도 적용 가능해 활용도가 높을 것으로 기대된다.”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 기후변화연구 허브사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 폴리머로 떼어낸 피라미드 양자점의 모식도
그림2. 피라미드 양자점에서 방출된 빛의 상반구 및 하반구 먼장 (far-field) 방출 패턴(좌)와 폴리머로 떼어내기 전후의 나노 피라미드 구조체(후)
조용훈 교수, 피라미드 구조로 방향성과 집광 효율을 높인 고성능 반도체 양자 광원 개발
우리 대학 물리학과 조용훈 교수 연구팀이 반도체 피라미드 구조의 양자점이 피라미드 밑면으로 강한 빛을 방출함을 발견하고 이 빛을 높은 효율로 모을 수 있는 기술을 개발했다.
김세정, 공수현 박사가 공동 1저자로 참여한 이번 연구 결과는 나노분야 국제 학술지 ‘나노 레터스(Nano Letters)’ 10월 12일자에 게재됐다.
반도체 양자점은 빛 알갱이를 하나씩 내뿜는 단일광자원(양자광원)으로 활용가능하다. 단일광자원은 미래의 양자컴퓨터 또는 양자암호기술 등을 구현하기 위한 필수 요소이다.
일반적인 양자점은 불규칙적인 위치에 형성되는 반면 3차원 피라미드 구조에 얇게 양자우물(Quantum well)을 성장시키면 정확히 피라미드 꼭짓점 위치에 양자점(Quantum dot)을 형성할 수 있다. 이 기술을 활용하면 위치가 제어된 단일광자원을 높은 수율로 얻을 수 있다.
하지만 양자점에서 나오는 빛은 빛 알갱이 개수가 적고 양자점이 굴절률 높은 반도체 물질에 갇혀 있기 때문에 일반적으로 구조 바깥으로 빠져나오기 어렵다. 반도체 단일광자원 소자가 상용화 단계로 나아가려면 빛의 집광 효율을 높여야만 한다.
연구팀은 일반적으로 가지고 있는 고정관념을 벗어나 문제를 해결했다. 피라미드 구조의 빛의 지향성(directionality)을 관찰했고 이를 이용했다. 그 동안 피라미드 양자점에서 나오는 빛은 피라미드의 위, 즉 꼭짓점 방향으로 나오는 신호만을 측정했다. 피라미드 밑면 방향으로는 성장 과정상 두꺼운 기판이 반드시 존재하기 때문이다.
하지만 연구팀은 시뮬레이션을 통해 양자점이 피라미드 위쪽보다 밑면 방향으로 더 많은 빛을 방출함을 확인했다.
또한 피라미드 밑면 방향으로 진행하는 빛은 가우시안 형태의 전기장 분포 형태를 갖고 있어, 광도파로 또는 광섬유의 단일 모드와 잘 일치한다. 이는 제품과 전선을 결합하듯이 광원과 광도파로 간의 결합 효율을 높일 수 있다.
이에 연구팀은 폴리머를 이용해 피라미드 구조체를 기판에서 떼어냈다. 피라미드의 밑면으로 나오는 빛이 두꺼운 반도체 기판을 거치지 않고 공기 중으로 직접 방출되도록 한 것이다.
연구팀이 떼어낸 피라미드는 쉽게 다른 광학 소자들과 직접 결합할 수 있어 피라미드 양자점의 응용분야가 확대될 수 있는 발판이 될 것으로 기대된다.
조 교수는 “이번 연구 내용은 양자 광원 뿐 아니라 LED와 같은 광원 소자에도 적용 가능해 활용도가 높을 것으로 기대된다.”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 기후변화연구 허브사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 폴리머로 떼어낸 피라미드 양자점의 모식도
그림2. 피라미드 양자점에서 방출된 빛의 상반구 및 하반구 먼장 (far-field) 방출 패턴(좌)와 폴리머로 떼어내기 전후의 나노 피라미드 구조체(후)
2016.10.18
조회수 21080
-
 이해신 교수, 찔러도 출혈 없는 주사바늘 개발
우리 대학 화학과 이해신 교수 연구팀이 홍합이 가진 접착 기능을 모방한 생체 재료를 이용해 찔러도 출혈이 없는 주사바늘을 개발했다.
이번 연구결과는 재료 분야의 네이처 자매지 ‘네이처 머티리얼즈(Nature Materials)’ 10월 3일자 온라인 판에 게재됐다.
모든 의료 처치에서 주사바늘의 사용은 필수이다. 혈액채취, 링거, 카테터, 스텐트 삽입, 약물 및 백신 주사 등 상당수 의료적 처치는 모두 주사바늘을 통해 이뤄진다. 처치 후에는 환부를 수 분 가량 압박해 지혈을 한다.
압박만으로도 건강한 일반인들은 3분 내외로 효과적 지혈을 할 수 있지만 장기입원중인 암 환자, 당뇨병, 혈우병, 아스피린 장기 복용 환자 등은 정상적인 지혈이 어렵거나 불가능한 경우가 많다.
주사바늘에 코팅되는 지혈 재료는 주사 전에는 주사바늘의 표면에 단단히 코팅돼야 하고 주사 후에는 혈관내벽 또는 피부에 부착돼 지혈 기능을 수행해야 한다. 따라서 기계적 물성이 강한 필름형태의 지혈 재료를 사용하는 것이 중요하다.
그러나 기존의 지혈 재료들은 기계적 물성이 약해 주사 과정에서 발생하는 마찰력을 견디지 못하는 한계를 가졌다.
연구팀은 문제 해결을 위해 홍합의 특성을 이용했다. 홍합이 섬유 형태의 족사(어패류의 몸에서 나오는 경단백질의 강인한 섬유다발, )를 이용해 강한 파도가 치는 해안가의 바위에서도 단단히 붙어 생존하는 현상에 착안해 홍합 족사의 구조를 모방했다.
이러한 접착성을 의료기술과 결합하면 수분이 70% 이상 존재하는 생체 환경에서도 우수한 접착 능력을 기대할 수 있다. 연구팀은 이전에도 이를 이용한 다양한 지혈 재료들을 개발해 왔다.
연구팀의 찔러도 피가 나지 않는 주사바늘은 일반 주사바늘에 지혈재료를 코팅해 주사 후에 상처부위를 물리적으로 막아 자발적으로 지혈할 수 있게 만드는 기술이다.
홍합 족사 구조에 존재하는 카테콜아민 성분을 도입한 접착성 키토산을 이용해 주사바늘 위에 지혈기능성 필름을 형성했다. 이후 혈액에 필름이 닿으면 하이드로젤 형태로 순간적으로 전이되면서 지혈 현상이 발생하는 것이다.
이 기술은 지혈 기능에 문제를 갖는 당뇨병, 혈우병, 암 환자와 아스피린 복용자 등에게 적용 가능할 것으로 기대된다.
이해신 교수는 “개발된 기술은 모든 혈관 및 근육 주사에 효과를 보이고 혈우병 모델에서도 효과적인 기능을 보이기 때문에 혈액응고장애가 있는 환자들에게 유용할 것이다”며 “카테터 및 생검바늘 등 다양한 침습 의료기기들과 결합해 새로운 기술의 발전이 가능할 것으로 기대된다”고 말했다.
안전성평가연구소의 강선웅, 김기석 박사 연구팀과 ㈜이노테라피(대표 이문수)와의 공동 연구로 진행된 이번 연구는 한국연구재단 중견연구자도약사업, 보건복지부 암정복추진연구개발사업, 암중개융합연구의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 일반동물모델에대한 근육주사후 지혈효과
그림2. 혈우병동물모델에대한 지혈효과
그림3. 주사기 제조과정 및 표면 특성분석
이해신 교수, 찔러도 출혈 없는 주사바늘 개발
우리 대학 화학과 이해신 교수 연구팀이 홍합이 가진 접착 기능을 모방한 생체 재료를 이용해 찔러도 출혈이 없는 주사바늘을 개발했다.
이번 연구결과는 재료 분야의 네이처 자매지 ‘네이처 머티리얼즈(Nature Materials)’ 10월 3일자 온라인 판에 게재됐다.
모든 의료 처치에서 주사바늘의 사용은 필수이다. 혈액채취, 링거, 카테터, 스텐트 삽입, 약물 및 백신 주사 등 상당수 의료적 처치는 모두 주사바늘을 통해 이뤄진다. 처치 후에는 환부를 수 분 가량 압박해 지혈을 한다.
압박만으로도 건강한 일반인들은 3분 내외로 효과적 지혈을 할 수 있지만 장기입원중인 암 환자, 당뇨병, 혈우병, 아스피린 장기 복용 환자 등은 정상적인 지혈이 어렵거나 불가능한 경우가 많다.
주사바늘에 코팅되는 지혈 재료는 주사 전에는 주사바늘의 표면에 단단히 코팅돼야 하고 주사 후에는 혈관내벽 또는 피부에 부착돼 지혈 기능을 수행해야 한다. 따라서 기계적 물성이 강한 필름형태의 지혈 재료를 사용하는 것이 중요하다.
그러나 기존의 지혈 재료들은 기계적 물성이 약해 주사 과정에서 발생하는 마찰력을 견디지 못하는 한계를 가졌다.
연구팀은 문제 해결을 위해 홍합의 특성을 이용했다. 홍합이 섬유 형태의 족사(어패류의 몸에서 나오는 경단백질의 강인한 섬유다발, )를 이용해 강한 파도가 치는 해안가의 바위에서도 단단히 붙어 생존하는 현상에 착안해 홍합 족사의 구조를 모방했다.
이러한 접착성을 의료기술과 결합하면 수분이 70% 이상 존재하는 생체 환경에서도 우수한 접착 능력을 기대할 수 있다. 연구팀은 이전에도 이를 이용한 다양한 지혈 재료들을 개발해 왔다.
연구팀의 찔러도 피가 나지 않는 주사바늘은 일반 주사바늘에 지혈재료를 코팅해 주사 후에 상처부위를 물리적으로 막아 자발적으로 지혈할 수 있게 만드는 기술이다.
홍합 족사 구조에 존재하는 카테콜아민 성분을 도입한 접착성 키토산을 이용해 주사바늘 위에 지혈기능성 필름을 형성했다. 이후 혈액에 필름이 닿으면 하이드로젤 형태로 순간적으로 전이되면서 지혈 현상이 발생하는 것이다.
이 기술은 지혈 기능에 문제를 갖는 당뇨병, 혈우병, 암 환자와 아스피린 복용자 등에게 적용 가능할 것으로 기대된다.
이해신 교수는 “개발된 기술은 모든 혈관 및 근육 주사에 효과를 보이고 혈우병 모델에서도 효과적인 기능을 보이기 때문에 혈액응고장애가 있는 환자들에게 유용할 것이다”며 “카테터 및 생검바늘 등 다양한 침습 의료기기들과 결합해 새로운 기술의 발전이 가능할 것으로 기대된다”고 말했다.
안전성평가연구소의 강선웅, 김기석 박사 연구팀과 ㈜이노테라피(대표 이문수)와의 공동 연구로 진행된 이번 연구는 한국연구재단 중견연구자도약사업, 보건복지부 암정복추진연구개발사업, 암중개융합연구의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 일반동물모델에대한 근육주사후 지혈효과
그림2. 혈우병동물모델에대한 지혈효과
그림3. 주사기 제조과정 및 표면 특성분석
2016.10.06
조회수 15579
-
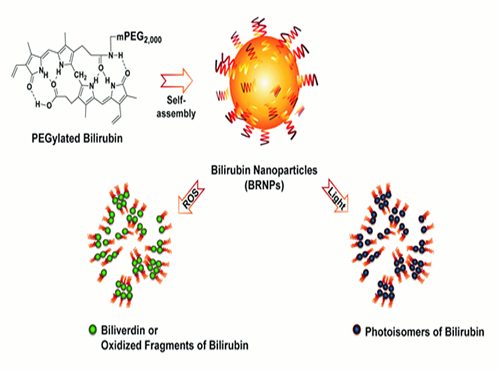 전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18
조회수 18433
-
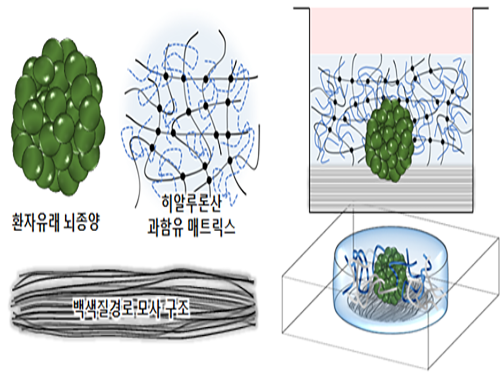 김필남 교수, 악성 뇌종양의 내성 발생 원리 밝혀
〈 김 필 남 교수 〉
우리 대학 바이오및뇌공학과 김필남 교수 연구팀이 3차원 체외 종양 모델을 제작해 악성 뇌종양의 약물 저항성(내성) 발생 원리를 밝혔다.이번에 제작된 뇌종양 3차원 모델은 실제로 중요한 영향을 미치는 종양의 미세환경(tumor microenvironment)을 고려해 제작함으로써 실질적 암 치료에 적용 가능할 것으로 기대된다.
이번 연구는 네이처 자매지인 ‘사이언티픽 리포트(Scientific Reports)’ 4월 26일자 온라인 판에 게재됐다. (논문명: Strategies of Mesenchymal Invasion of Patient-derived Brain Tumors: Microenvironmental Adaptation)
악성 뇌종양은 주변 조직으로 침윤하는 특성이 매우 강해 치료하기 힘든 질병 중 하나이다. 수술을 통해 종양을 절제해도 주변 조직에 넓게 침윤한 잔여 세포들이 재발하는 경우가 많다.
따라서 악성 뇌종양의 치료 효율 및 생존율을 높이기 위해서는 남아있는 침윤 세포를 표적으로 한 치료법을 개발해야 한다.
그러나 종양의 악성화 및 침윤 특성의 주요 원인인 주변 미세환경(tumor microenvironment)을 고려하지 않은 항암제 개발이 주로 이뤄졌기 때문에 종양의 침윤 및 약물 저항의 원리를 밝히기 어려웠다.
연구팀은 문제 해결을 위해 체외에서 종양 주변 미세환경의 특성을 반영한 3차원 암 모델을 구현했다. 이는 뇌종양 미세환경의 주요 구성요소인 과함유 히알루론산(hyaluronic acid) 기질과 백색질 경로(white matter tract)를 모사한 생체모방체외종양 모델이다.
연구팀은 체내에 존재하는 악성 뇌종양의 특성을 체외에서도 유사하게 유지시켜 환자를 대체할 수 있는 종양 모델로 활용 가능함을 확인했다.
연구팀은 뇌종양 세포가 침윤하는 데 중요한 역할을 하는 히알루론산 합성 단백질을 억제하는 약물을 투입했다. 초기에는 뇌종양 침윤이 억제됐지만 시간이 흐르며 미세환경 적응(microenvironmental adaptation) 과정에서 뇌종양이 새 기전을 통해 약물에 대한 내성이 생기는 현상을 발견했다.
이 모든 과정을 체외 종양 모델을 통해 진행함으로써 동물실험을 대체하여 다양한 항암제를 조합하고 검증할 수 있어 실질적인 암 치료에 도움이 될 것으로 기대된다.
연구팀이 제시한 3차원 체외 암 모델은 기존 약물의 저항 원인을 규명하는 기반이 될 것으로 예상된다. 또한 추후 정밀 암 치료를 위한 핵심 기반 기술로 환자맞춤 약물 검증 및 신약 발굴 모델 등으로 다각적 활용이 가능할 것으로 기대된다.
김 교수는 “뇌종양의 체외 종양모델로서 공학적 기술 기반의 3차원 미세환경 암 모델을 제시했다”며 “이를 바탕으로 뇌종양 환자 개별 치료의 가능성을 높여 생존율 개선에 힘이 되겠다”고 말했다.
바이오및뇌공학과 차정화 박사과정 학생이 1저자로 참여한 이번 연구는 한국연구재단 신진연구자지원사업 및 보건복지부 중개중점 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 악성 뇌종양 주변 미세환경
그림2. 환자 대체치료용 3차원 체외뇌암모델의 모식도
그림3. 환자유래 뇌종양 세포의 미세환경 적응 과정에 의한 약물 저항 메커니즘
김필남 교수, 악성 뇌종양의 내성 발생 원리 밝혀
〈 김 필 남 교수 〉
우리 대학 바이오및뇌공학과 김필남 교수 연구팀이 3차원 체외 종양 모델을 제작해 악성 뇌종양의 약물 저항성(내성) 발생 원리를 밝혔다.이번에 제작된 뇌종양 3차원 모델은 실제로 중요한 영향을 미치는 종양의 미세환경(tumor microenvironment)을 고려해 제작함으로써 실질적 암 치료에 적용 가능할 것으로 기대된다.
이번 연구는 네이처 자매지인 ‘사이언티픽 리포트(Scientific Reports)’ 4월 26일자 온라인 판에 게재됐다. (논문명: Strategies of Mesenchymal Invasion of Patient-derived Brain Tumors: Microenvironmental Adaptation)
악성 뇌종양은 주변 조직으로 침윤하는 특성이 매우 강해 치료하기 힘든 질병 중 하나이다. 수술을 통해 종양을 절제해도 주변 조직에 넓게 침윤한 잔여 세포들이 재발하는 경우가 많다.
따라서 악성 뇌종양의 치료 효율 및 생존율을 높이기 위해서는 남아있는 침윤 세포를 표적으로 한 치료법을 개발해야 한다.
그러나 종양의 악성화 및 침윤 특성의 주요 원인인 주변 미세환경(tumor microenvironment)을 고려하지 않은 항암제 개발이 주로 이뤄졌기 때문에 종양의 침윤 및 약물 저항의 원리를 밝히기 어려웠다.
연구팀은 문제 해결을 위해 체외에서 종양 주변 미세환경의 특성을 반영한 3차원 암 모델을 구현했다. 이는 뇌종양 미세환경의 주요 구성요소인 과함유 히알루론산(hyaluronic acid) 기질과 백색질 경로(white matter tract)를 모사한 생체모방체외종양 모델이다.
연구팀은 체내에 존재하는 악성 뇌종양의 특성을 체외에서도 유사하게 유지시켜 환자를 대체할 수 있는 종양 모델로 활용 가능함을 확인했다.
연구팀은 뇌종양 세포가 침윤하는 데 중요한 역할을 하는 히알루론산 합성 단백질을 억제하는 약물을 투입했다. 초기에는 뇌종양 침윤이 억제됐지만 시간이 흐르며 미세환경 적응(microenvironmental adaptation) 과정에서 뇌종양이 새 기전을 통해 약물에 대한 내성이 생기는 현상을 발견했다.
이 모든 과정을 체외 종양 모델을 통해 진행함으로써 동물실험을 대체하여 다양한 항암제를 조합하고 검증할 수 있어 실질적인 암 치료에 도움이 될 것으로 기대된다.
연구팀이 제시한 3차원 체외 암 모델은 기존 약물의 저항 원인을 규명하는 기반이 될 것으로 예상된다. 또한 추후 정밀 암 치료를 위한 핵심 기반 기술로 환자맞춤 약물 검증 및 신약 발굴 모델 등으로 다각적 활용이 가능할 것으로 기대된다.
김 교수는 “뇌종양의 체외 종양모델로서 공학적 기술 기반의 3차원 미세환경 암 모델을 제시했다”며 “이를 바탕으로 뇌종양 환자 개별 치료의 가능성을 높여 생존율 개선에 힘이 되겠다”고 말했다.
바이오및뇌공학과 차정화 박사과정 학생이 1저자로 참여한 이번 연구는 한국연구재단 신진연구자지원사업 및 보건복지부 중개중점 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 악성 뇌종양 주변 미세환경
그림2. 환자 대체치료용 3차원 체외뇌암모델의 모식도
그림3. 환자유래 뇌종양 세포의 미세환경 적응 과정에 의한 약물 저항 메커니즘
2016.05.11
조회수 16565
-
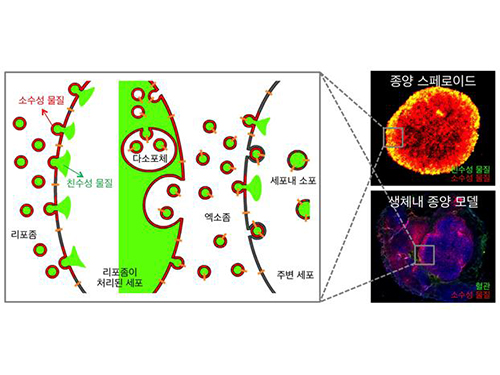 종양 전역에 약물 전달하는 항암치료나노기술 개발
<박 지 호 교수>
우리 대학 바이오 및 뇌공학과 박지호 교수 연구팀이 종양의 전역에 약물이 골고루 전달되게 해 항암효과를 현저히 높일 수 있는 새 항암치료 나노기술을 개발했다.
이번 연구는 나노분야 학술지 ‘나노 레터스(Nano Letters)’3월 31일자 온라인 판에 게재됐다.
일반적으로 수술이 어려운 종양의 치료를 위해 항암약물치료법이 사용된다. 하지만 종양이 외부로 들어오는 약물의 접근을 여러 방법으로 막기 때문에 종양 전체에 항암효과를 보기 어려웠다. 혈류로 투여된 약물들의 대부분이 혈관주위의 종양세포들에만 전달되고, 중심부의 종양세포에는 전달되지 않아 재발 문제가 자주 발생한 것이다.
연구팀은 문제 해결을 위해 리포좀과 엑소좀이라는 소포체를 이용했다. 리포좀은 인공나노소포체로서 혈류를 통해 혈관 주위의 종양 세포 부위까지 약물을 전달한다. 종양 세포에서 자연적으로 분비되는 생체나노소포체인 엑소좀에 약물을 무사히 탑재하는 것이 리포좀의 역할이다.
엑소좀은 종양에서 세포 내부의 생물학적 물질들을 전달하기 때문에 종양의 진행 및 전이에 중요한 요소로 알려져 있다. 리포좀이 항암 약물을 엑소좀에 탑재하면, 엑소좀이 이동하는 종양 내의 모든 위치로 약물이 전달됨으로써 질병이 치료되는 것이 연구의 핵심이다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 노출시켜 항암효과를 유도한 후 분석한 결과 종양조직 전역에서 항암효과를 관찰할 수 있었다.
연구팀의 핵심 성과는 종양 및 다른 질병들의 미세 환경을 파악해 질병에 대항하는 맞춤형 약물전달 기술 개발의 발판을 마련한 것이다.
연구팀은 이 기술을 제약회사에서 개발 중인 항암제에 적용해 약물전달이 어려운 악성 종양의 치료효과를 실험 진행 중이다.
박 교수는 “엑소좀이 세포에서 끊임없이 분비되는 특성과 주변 세포로 생물학적 물질을 전달하는 특성을 응용해 종양 중심부까지 약물을 전달 가능하게 만든 최초의 연구”라고 말했다.
박지호 교수 지도아래 이준성 박사, 김지영 석사가 주 저자로 참여한 이번 연구는 한국연구재단이 추진하는 신진연구자지원사업, 글로벌프론티어사업, 미래유망융합기술파이오니어사업의 지원을 받아 수행됐다.
□ 그림설명
그림 1. 종양 전역에 약물이 골고루 전달되게 해 항암효과를 높이는 새 종양투과 약물전달 나노기술
세포막과 결합하는 리포좀에 의해서 세포로 전달된 물질이 그 세포가 분비하는 엑소좀에 효율적으로 탑재돼 주변세포로 전달되는 과정을 보여주는 모식도(좌). 이러한 엑소좀기반 세포간 약물전달이 실제로 종양 스페로이드 및 생체 내 종양모델에서 관찰된 결과들 (우).
종양 전역에 약물 전달하는 항암치료나노기술 개발
<박 지 호 교수>
우리 대학 바이오 및 뇌공학과 박지호 교수 연구팀이 종양의 전역에 약물이 골고루 전달되게 해 항암효과를 현저히 높일 수 있는 새 항암치료 나노기술을 개발했다.
이번 연구는 나노분야 학술지 ‘나노 레터스(Nano Letters)’3월 31일자 온라인 판에 게재됐다.
일반적으로 수술이 어려운 종양의 치료를 위해 항암약물치료법이 사용된다. 하지만 종양이 외부로 들어오는 약물의 접근을 여러 방법으로 막기 때문에 종양 전체에 항암효과를 보기 어려웠다. 혈류로 투여된 약물들의 대부분이 혈관주위의 종양세포들에만 전달되고, 중심부의 종양세포에는 전달되지 않아 재발 문제가 자주 발생한 것이다.
연구팀은 문제 해결을 위해 리포좀과 엑소좀이라는 소포체를 이용했다. 리포좀은 인공나노소포체로서 혈류를 통해 혈관 주위의 종양 세포 부위까지 약물을 전달한다. 종양 세포에서 자연적으로 분비되는 생체나노소포체인 엑소좀에 약물을 무사히 탑재하는 것이 리포좀의 역할이다.
엑소좀은 종양에서 세포 내부의 생물학적 물질들을 전달하기 때문에 종양의 진행 및 전이에 중요한 요소로 알려져 있다. 리포좀이 항암 약물을 엑소좀에 탑재하면, 엑소좀이 이동하는 종양 내의 모든 위치로 약물이 전달됨으로써 질병이 치료되는 것이 연구의 핵심이다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 노출시켜 항암효과를 유도한 후 분석한 결과 종양조직 전역에서 항암효과를 관찰할 수 있었다.
연구팀의 핵심 성과는 종양 및 다른 질병들의 미세 환경을 파악해 질병에 대항하는 맞춤형 약물전달 기술 개발의 발판을 마련한 것이다.
연구팀은 이 기술을 제약회사에서 개발 중인 항암제에 적용해 약물전달이 어려운 악성 종양의 치료효과를 실험 진행 중이다.
박 교수는 “엑소좀이 세포에서 끊임없이 분비되는 특성과 주변 세포로 생물학적 물질을 전달하는 특성을 응용해 종양 중심부까지 약물을 전달 가능하게 만든 최초의 연구”라고 말했다.
박지호 교수 지도아래 이준성 박사, 김지영 석사가 주 저자로 참여한 이번 연구는 한국연구재단이 추진하는 신진연구자지원사업, 글로벌프론티어사업, 미래유망융합기술파이오니어사업의 지원을 받아 수행됐다.
□ 그림설명
그림 1. 종양 전역에 약물이 골고루 전달되게 해 항암효과를 높이는 새 종양투과 약물전달 나노기술
세포막과 결합하는 리포좀에 의해서 세포로 전달된 물질이 그 세포가 분비하는 엑소좀에 효율적으로 탑재돼 주변세포로 전달되는 과정을 보여주는 모식도(좌). 이러한 엑소좀기반 세포간 약물전달이 실제로 종양 스페로이드 및 생체 내 종양모델에서 관찰된 결과들 (우).
2015.04.06
조회수 17425
 김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17 조회수 22702
김유천 교수, 부작용 낮춘 레이저 치료제 개발
〈 노 일 구 박사과정, 김 유 천 교수 〉
우리 대학 생명화학공학과 김유천 교수 연구팀이 기존 광역학 치료제(PhotoDynamic Therapy, 이하 PDT)의 단점을 보완한 근적외선 형광물질 기반의 PDT를 개발했다.
노일구 박사과정이 1저자로 참여하고 바이오및뇌공학과 박지호 교수 연구팀이 공동으로 참여한 이번 연구 결과는 국제 학술지 ‘어드밴스드 사이언스(Advanced Science)’ 2018년도 3월 25일자 표지논문에 게재됐다.
PDT는 약물이나 유전자가 아닌 빛을 이용하는 치료법으로 레이저를 특정부위에 쬐어 산소를 독성을 갖는 활성산소로 변화시켜 세포를 자가 사멸(apoptosis)로 유도할 수 있는 기술이다.
이 기술은 피부병 치료 등 일상에서도 많이 활용되는 치료법이다. 그러나 기존에 이용하는 PDT 조영제의 경우 낮은 효율을 가질 때 오히려 암세포의 유전변형이 발생해 치료효과 감소 등의 부작용이 나올 수 있다.
따라서 치료효과를 극대화하기 위해선 원하는 위치에 많은 물질을 전달하는 것이 중요하며 이를 위해 세포 소기관인 미토콘드리아에 치료효과를 집중시키는 연구가 진행 중이다.
PDT 조영제로 인해 만들어진 활성산소는 미토콘드리아의 막을 공격해 세포 사멸을 일으킨다. 암세포의 미토콘드리아는 일반 세포와 비교했을 때 미토콘드리아 막의 전위 차이가 높아 양전하의 소수성 물질이 더 잘 투입되는 특성이 있다.
연구팀은 이러한 PDT 조영제 효과를 극대화하기 위해 미토콘드리아 타겟팅 그룹인 트리페닐포스포늄, PDT 증강제인 브롬화물, 그리고 용해도 증가를 위한 아민 그룹으로 구성된 물질을 개발했다.
연구팀은 이 기술을 종양이 이식된 실험용 쥐에 주입한 후 종양 부위에 빛을 조사해 항암효과를 유도했고 이를 분석했을 때 효과적으로 표적 치료가 이뤄지는 것을 확인했다.
이 물질은 근적외선 영역에서의 흡광 및 발광을 통한 662 나노미터(nm) 영역 레이저를 사용한다. 이를 통해 기존 가시광선 조영제가 마이크로미터 수준의 깊이를 보였다면 연구팀의 기술은 밀리미터까지 투과성을 가지며 진단 시 가시광역 조영제 보다 100배 이상 감도가 우수한 특성을 갖고 있다고 밝혔다.
연구를 주도한 노일구 박사과정은 “암세포 미토콘드리아에 오래 머물러 있어 레이저를 조사했을 때 원하는 부분에만 부작용 없이 효과적인 치료가 가능하다는 장점이 있다”며 “치료 후 독성이 없이 분해돼 기존 조영제의 단점을 극복할 수 있을 것이다”고 말했다.
김유천 교수는 “기존에 이용되는 진단 및 치료제를 한 단계 더 발전시킨 새로운 플랫폼의 개발을 통해 부작용을 최소화하고 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 글로벌프론티어 지원사업 ABC 바이오매스 사업단 및 한국연구재단의 중견연구자지원사업, 바이오의료기술개발지원사업을 통해 수행됐다.
□ 그림 설명
그림1. Advanced science 3월 25일자 3호 표지
그림2. 완성된 물질의 화학구조, 미토콘드리아 타겟팅 효과 및 레이저에 따른 ROS 생성 그래프
2018.04.17 조회수 22702 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 24241
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 24241 조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07 조회수 24663
조광현 교수, 대장암 유발하는 돌연변이 유전자의 네트워크 원리 규명
〈 왼쪽위부터 시계방향으로 이종훈 박사과정, 공정렬 박사과정, 조광현 교수, 신동관 연구교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암이 발병하는 과정에서 생기는 유전자 네트워크의 원리를 규명하는 데 성공했다.
이를 통해 대장암의 근본적인 발병 원리를 밝혀낼 뿐 아니라 향후 새로운 개념의 효과적인 항암제의 분자표적을 찾는데 활용될 것으로 기대된다. 또한 4차 산업혁명의 핵심 기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명해냈다는 의의를 갖는다.
신동관 박사, 이종훈, 공정렬 학생연구원 등이 함께 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 2일자 온라인 판에 게재됐다.
인간의 암은 유전자 돌연변이에 의해 발생한다. 이 돌연변이의 빈도는 암종에 따라 차이가 나는데 백혈병, 소아암은 10여 개 정도이지만 성인 고형암은 평균 50여 개, 폐암 등의 외부인자로 인한 경우는 수백 개에 이른다.
전 세계 암연구자들은 암 치료를 위해 환자들에게서 빈번하게 발견되는 유전자 돌연변이들을 파악하고 이 중 주요 암 유발 유전자를 찾아내 표적 항암제를 개발하고자 노력했다.
그러나 유전자 돌연변이는 해당 유전자의 기능에만 영향을 주는 게 아니라 그 유전자와 상호작용하는 다른 유전자에게도 영향을 끼친다. 따라서 이러한 유전자 네트워크의 원리를 모른 채 소수의 암 유발 유전자를 대상으로 하는 현재의 치료법은 일부에게만 효과가 있고 쉽게 약물의 내성을 일으키는 한계가 있다.
조 교수 연구팀은 대장암 환자의 대규모 유전체 데이터를 이용해 유전자 상호작용 네트워크에서 나타나는 다중 돌연변이의 협력적 효과에 대한 수학모형을 구축했다.
이는 국제 암유전체컨소시엄에서 발표한 전암 유전체데이터베이스(TCGA: The Cancer Genome Atlas)를 토대로 구축한 것으로, 유전자 네트워크에서 나타나는 돌연변이의 영향력을 정량화하고 이를 이용해 대장암 환자 군을 임상 특징에 따라 군집화 하는데 성공했다.
또한 대규모 컴퓨터 시뮬레이션 분석을 통해 암 발생 과정에서 나타나는 임계전이(critical transition) 현상을 밝혀내 숨겨진 유전자 네트워크의 원리를 최초로 규명했다.
임계전이란 상전이와 같이 물질의 상태가 갑작스럽게 변화하는 현상을 말한다. 암 발생 과정에서는 유전자 돌연변이의 발생 순서를 추적하기 어렵기 때문에 전이 현상이 존재하는지 확인할 수 없었다.
연구팀은 시스템생물학 기반의 연구방법을 이용해 확인한 결과 기존의 대장암에서 잘 알려진 암 유발 유전자 돌연변이의 발생 순서를 따르는 경우에 임계전이 현상을 보임을 발견했다.
이번에 개발한 수학모형을 활용하면 암환자에게 발생하는 다수 유전자 돌연변이의 영향을 가장 효과적으로 저해할 수 있는 새로운 항암 표적 약물이 개발될 것으로 기대된다.
특히 주요 암 유발 유전자 뿐 아니라 돌연변이의 영향을 받는 다른 모든 유전자들을 대상으로 종합적으로 평가해 효과적인 약물 표적을 찾아낼 수 있다.
조 교수는 “지금껏 다수 유전자들의 돌연변이가 암 발생에 어떻게 기여하는지 밝혀진 바가 없었다”며 “이번 연구에서는 시스템생물학으로 암세포의 발달과정에서 유전자 네트워크의 원리를 최초로 밝힘으로써 새로운 차원의 항암제 표적을 발굴할 수 있는 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유전자 돌연변이의 영향력 전파에 의한 거대 클러스터의 형성
그림2. 암발생 과정에서 돌연변이 협력효과의 임계전이 현상
2017.11.07 조회수 24663 전상용 교수, 인체 담석형성반응 이용한 항암치료 시스템 개발
〈 전상용 교수, 이동윤 박사과정 〉
우리 대학 생명과학과 전상용 교수 연구팀이 인간 체내의 물질을 이용해 광학영상 진단 및 광열 치료가 가능한 항암시스템을 개발했다.
연구팀은 빌리루빈이라는 체내 물질과 그 빌리루빈으로 인해 발생하는 담석형성반응을 응용했다. 인체 내 강력한 항산화제인 빌리루빈의 담석 형성 과정에서 관찰되는 자체 금속 결합 기능과 신생아 황달 치료에 쓰이는 푸른빛에 반응하는 성질을 동시에 이용했다.
이를 통해 높은 생체 적합성과 우수한 광음향 진단 기능 및 광열 치료 효능을 보여 항암 치료 분야에서 적합한 치료 시스템이 될 것으로 기대된다.
이동윤 박사과정이 1저자로 참여한 이번 연구는 응용화학분야 저명학술지 앙케반테 케미(Angewandte Chemie International Edition) 9월 4일자 온라인 판에 게재됐다.
전 교수 연구팀은 과거 연구에서 물과 화합하지 않는 소수성을 갖는 빌리루빈과, 그 반대로 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’ 기반의 나노입자 시스템을 개발한 경험이 있다.
이는 빌리루빈의 항산화 기능을 그대로 유지하면서 체내로 축적되지 않게 해 빌리루빈의 장점만을 취하는 기술이다. 이를 바탕으로 염증성 장 질환, 허혈/재관류, 췌도세포 이식, 천식 등의 동물 질병 모델에서 효능 및 안정성을 확인했다.
이번 연구에서는 앞선 연구의 접근 방식과 다르게 빌리루빈이 갖고 있는 다른 물리 화학적 성질을 이용해 항암 치료에 적용했다.
먼저 황달의 주요 원인체인 노란색 빌리루빈에 특정 파장대의 빛(푸른 빛)을 쬐어주면 이에 반응해 광이성질체(빛에 의해 모양이 변형된 물체)가 되고 배설이 활성화돼 신생아 황달 치료에 널리 쓰일 수 있는 광학물질인 점을 첫 번째 근거로 활용했다.
두 번째로는 인체 내의 쓸개관 혹은 쓸개 등에서 병이 생길 때 종종 발견할 수 있는 검은 색소 담석의 주성분 또한 빌리루빈이라는 점에 주목했다. 빌리루빈이 칼슘이나 구리 등 양이온과 중간 매개체 없이도 결합할 때 검은 색소 담석이 형성되는 점을 응용했다.
연구팀은 구리나 칼슘 대신 시스플라틴이라는 백금 금속 기반 항암제와 빌리루빈을 결합해 노란색의 빌리루빈을 보라색의 복합체로 변환시켰다.
이후 근적외선 파장대의 빛을 쬐었을 때 기존에 비해 크게 향상된 광감응성을 보였고, 실제 정맥 주사된 대장암 동물 모델에서도 종양 부분에서의 유의미한 광음향 신호 증가를 확인했다. 이 기술로 향후 더 향상된 종양 진단을 할 수 있을 것으로 기대된다.
또한 종양 부위에 근적외선 빛을 쬐었을 때 광열 효과에 의해 5분 내에 25℃ 이상의 온도 상승을 확인했고, 2주 후 다른 그룹에 비해 종양 크기의 감소 및 괴사를 확인했다.
전 교수는 “현재 개발된 물질들은 생체 적합성이 낮고 잠재적 생체 독성 가능성이 있는 인공소재 위주이기 때문에 임상으로 이어지는 데 한계가 있었다”며 “이번에 개발한 인체 유래 빌리루빈 기반의 광학물질은 광음향 영상 및 광열 치료의 전임상 중개연구 및 임상 적용에 새로운 플랫폼이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈의 담석형성반응 및 광감응성을 이용한 본 연구의 모식도
그림2. 빌리루빈 나노입자 (왼쪽)와 시스플라틴이 결합된 빌리루빈 나노입자 (오른쪽) 수용액
2017.09.20 조회수 20782
전상용 교수, 인체 담석형성반응 이용한 항암치료 시스템 개발
〈 전상용 교수, 이동윤 박사과정 〉
우리 대학 생명과학과 전상용 교수 연구팀이 인간 체내의 물질을 이용해 광학영상 진단 및 광열 치료가 가능한 항암시스템을 개발했다.
연구팀은 빌리루빈이라는 체내 물질과 그 빌리루빈으로 인해 발생하는 담석형성반응을 응용했다. 인체 내 강력한 항산화제인 빌리루빈의 담석 형성 과정에서 관찰되는 자체 금속 결합 기능과 신생아 황달 치료에 쓰이는 푸른빛에 반응하는 성질을 동시에 이용했다.
이를 통해 높은 생체 적합성과 우수한 광음향 진단 기능 및 광열 치료 효능을 보여 항암 치료 분야에서 적합한 치료 시스템이 될 것으로 기대된다.
이동윤 박사과정이 1저자로 참여한 이번 연구는 응용화학분야 저명학술지 앙케반테 케미(Angewandte Chemie International Edition) 9월 4일자 온라인 판에 게재됐다.
전 교수 연구팀은 과거 연구에서 물과 화합하지 않는 소수성을 갖는 빌리루빈과, 그 반대로 초 친수성 고분자인 폴리에틸렌글리콜(PEG)을 결합한 ‘페길화된 빌리루빈’ 기반의 나노입자 시스템을 개발한 경험이 있다.
이는 빌리루빈의 항산화 기능을 그대로 유지하면서 체내로 축적되지 않게 해 빌리루빈의 장점만을 취하는 기술이다. 이를 바탕으로 염증성 장 질환, 허혈/재관류, 췌도세포 이식, 천식 등의 동물 질병 모델에서 효능 및 안정성을 확인했다.
이번 연구에서는 앞선 연구의 접근 방식과 다르게 빌리루빈이 갖고 있는 다른 물리 화학적 성질을 이용해 항암 치료에 적용했다.
먼저 황달의 주요 원인체인 노란색 빌리루빈에 특정 파장대의 빛(푸른 빛)을 쬐어주면 이에 반응해 광이성질체(빛에 의해 모양이 변형된 물체)가 되고 배설이 활성화돼 신생아 황달 치료에 널리 쓰일 수 있는 광학물질인 점을 첫 번째 근거로 활용했다.
두 번째로는 인체 내의 쓸개관 혹은 쓸개 등에서 병이 생길 때 종종 발견할 수 있는 검은 색소 담석의 주성분 또한 빌리루빈이라는 점에 주목했다. 빌리루빈이 칼슘이나 구리 등 양이온과 중간 매개체 없이도 결합할 때 검은 색소 담석이 형성되는 점을 응용했다.
연구팀은 구리나 칼슘 대신 시스플라틴이라는 백금 금속 기반 항암제와 빌리루빈을 결합해 노란색의 빌리루빈을 보라색의 복합체로 변환시켰다.
이후 근적외선 파장대의 빛을 쬐었을 때 기존에 비해 크게 향상된 광감응성을 보였고, 실제 정맥 주사된 대장암 동물 모델에서도 종양 부분에서의 유의미한 광음향 신호 증가를 확인했다. 이 기술로 향후 더 향상된 종양 진단을 할 수 있을 것으로 기대된다.
또한 종양 부위에 근적외선 빛을 쬐었을 때 광열 효과에 의해 5분 내에 25℃ 이상의 온도 상승을 확인했고, 2주 후 다른 그룹에 비해 종양 크기의 감소 및 괴사를 확인했다.
전 교수는 “현재 개발된 물질들은 생체 적합성이 낮고 잠재적 생체 독성 가능성이 있는 인공소재 위주이기 때문에 임상으로 이어지는 데 한계가 있었다”며 “이번에 개발한 인체 유래 빌리루빈 기반의 광학물질은 광음향 영상 및 광열 치료의 전임상 중개연구 및 임상 적용에 새로운 플랫폼이 될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈의 담석형성반응 및 광감응성을 이용한 본 연구의 모식도
그림2. 빌리루빈 나노입자 (왼쪽)와 시스플라틴이 결합된 빌리루빈 나노입자 (오른쪽) 수용액
2017.09.20 조회수 20782 조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24 조회수 22013
조광현 교수, 간암 표적 치료제 내성 극복 위한 최적 약물조합 발견
〈 조 광 현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 간암 약물 치료의 효과를 높이는 새로운 방법을 찾아냈다. 특히 이번 연구는 바이오분야의 4차 산업혁명을 견인하고 있는 IT와 BT의 융합연구인 시스템생물학(Systems Biology) 연구로 이뤄졌다.
서울대병원 내과 윤정환 교수팀과 공동연구를 통해 이루어낸 이번 연구 결과는 국제 간 전문지인 헤파톨로지(Hepatology)에 게재됐다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 바이오의료기술개발사업과 중견연구자지원사업의 지원을 받아 수행됐다.
간암은 전 세계적으로 남성에게는 다섯 번째, 여성에게는 일곱 번째로 발생률이 높은 암이며 암 사망원인의 두 번째를 차지한다. 특히 우리나라의 간암 사망률은 인구 10만 명 당 28.4명으로 경제협력개발기구(OECD) 국가 중 압도적인 1위이며 2위인 일본의 2배에 이르고 있다.
우리나라에서만 간암 환자가 매년 평균 1만 6000명이 새로 발생하고 있지만 5년 생존율이 12%에 미치지 못한다. 국가암정보센터에 따르면 지난해 암으로 사망한 사람 가운데 폐암이 1만 7399명으로 가장 많았고 간암은 1만 1311명으로 그 뒤를 이었다.
간암은 우리나라의 암 가운데 사회적 비용이 1위인 암이다. 그 이유는 다른 암에 비해 사망자가 많고 더 젊은 나이(40, 50대)에 사망하기 때문이다. 이에 부작용이 적고 생존율을 높여줄 수 있는 새로운 치료법 개발이 시급한 실정이다.
간암의 치료로는 수술 및 색전술, 약물 치료가 있지만 수술이 어려운 진행성 간암에서는 치료 방법이 극히 제한적이다.
진행성 간암의 표적 항암제로 소라페닙(Sorafenib)이 유일하게 승인돼 임상에서 쓰이고 있는데 국내에서만 매년 200억 원 이상 처방되고 있지만 일부 환자에서만 효능을 나타내며 또한 대부분의 경우 약제 내성이 발생한다.
소라페닙은 말기 간암 환자의 생존 기간을 약 3개월 정도 밖에 늘리지 못하지만 다국적 제약회사에 의해 개발된 많은 후발주자 약물들이 그 효과를 뛰어 넘는데 실패했다.
소라페닙은 다중타겟을 치료표적으로 하여 그 작용 기전이 모호하고 따라서 약제의 내성기전 또한 아직 잘 알려져 있지 않다.
조광현 교수가 이끈 융합 연구팀은 소라페닙 작용 및 내성 기전을 규명하기 위해 소라페닙을 간암 세포에 처리하였을 때 세포내 분자 발현이 변화하는 것을 분석했다.
이를 통해 암세포가 소라페닙에 대항하는 기전을 알아냈고 시스템생물학적 분석을 실시하여 암세포내 단백질 이황화 이성질화 효소(protein disulfide isomerase, PDI)가 암세포가 소라페닙에 대항하는데 핵심적 역할을 하는 것을 발견했으며 이 효소를 차단했을 때 소라페닙의 효능이 훨씬 증가함을 관찰했다.
공동연구를 수행한 서울대병원 내과 윤정환 교수 연구팀은 쥐를 이용한 동물실험에서 소라페닙과 단백질 이황화 이성질화 효소 차단제를 같이 처리하면 간암 증식 억제에 시너지가 있음을 관찰하였고 소라페닙에 저항성을 가진 간암 환자의 조직에서 이 효소가 증가되어 있음을 관찰하여, 향후 임상 적용을 위한 가능성을 확인하였다.
조광현 교수는 “세포내 중요한 역할을 담당하는 분자들은 대부분 복잡한 조절관계 속에 놓여있기 때문에 기존의 직관적인 생물학 연구로 그 원리를 밝히는 것은 근본적인 한계가 있다. 이번 연구는 IT와 BT의 융합연구인 시스템생물학으로 그 한계를 극복할 수 있음을 보여주는 대표적인 사례로, 특히 암에 대한 표적 치료제 작용을 네트워크 차원에서 분석하여 내성을 극복할 수 있는 새로운 치료법을 개발할 수 있는 가능성을 제시하였다”고 말했다.
□ 사진 설명
사진1. 간암세포를 이용한 세포실험을 이용해 시뮬레이션 결과를 확인
사진2. 구축된 ER stress 네트워크를 이용한 네트워크 분석 및 컴퓨터 시뮬레이션 결과
사진3. 간암 세포가 소라페닙에 반응할 때 전사체 변화를 분석하여 ER stress 반응이 주요하게 나타남을 발견하게 된 ER stress 네트워크 모델
2017.08.24 조회수 22013 박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06 조회수 19848
박지호 교수, 인공수용체 종양에 전달해 표적치료하는 기술 개발
〈 박 지 호 교수 〉
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 종양 전체에 인공수용체를 전달해 효과적으로 종양을 표적 치료하는 기술을 개발했다.
김희곤 석박사통합과정이 1저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 6월 19일자 온라인 판에 게재됐다.
종양 표적치료란 일반적으로 종양의 성장과 발생에 관여하는 특정 분자, 즉 수용체를 표적으로 삼아 종양의 성장을 저해하는 치료를 말한다.
하지만 표적치료는 종양 내 특정 수용체가 존재하는 환자에게만 효과가 있고 표적 분자가 소량이거나 불균일하게 존재할 경우 치료 효과에 한계가 있다.
연구팀은 문제 해결을 위해 리포좀이라는 인공나노입자와 세포에서 자연적으로 분비되는 엑소좀이라는 생체나노입자를 동시에 이용했다. 먼저 세포막과 효율적으로 결합하는 인공나노입자인 세포막결합성 리포좀을 개발했다.
〈 이번 연구를 주도한 김희곤 학생과 오찬희 학생〉
리포좀은 특정 분자를 표적하는 것이 가능한 인공수용체를 싣고 혈류를 통해 종양으로 침투한다. 그리고 혈관 주변의 종양 세포에 인공수용체를 전달하는데 여기서 종양 세포가 분비하는 엑소좀에 인공수용체를 탑재시키는 것이 리포좀의 역할이다.
중요한 점은 세포막결합성 리포좀은 정상 세포보다 암세포에 더 효과적으로 인공수용체를 전달함으로써 종양 표적치료를 용이하게 한다.
엑소좀은 일반적으로 세포 간 여러 생체 분자를 전달하는 역할을 한다. 혈관 주변의 세포를 통해 리포좀에 의해서 전달된 인공 수용체가 엑소좀에 탑재하게 되면 엑소좀이 이동하는 종양 내 모든 위치로 인공 수용체가 자연적이고 효율적으로 전달된다.
연구팀은 이렇게 종양 전체에 퍼진 인공 수용체를 표적할 수 있는 물질에 약물을 결합시켜 효과적인 종양 표적치료를 하는 것을 목표로 삼고 있다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 조사해 항암효과를 유도한 후 분석한 결과 효과적으로 표적치료가 이뤄짐을 확인했다.
연구팀은 이번 연구가 표적이 어렵거나 불가능한 종양 표적치료를 가능하게 하는 기술 개발의 발판을 마련했다는 의의를 갖는다고 밝혔다.
박 교수는 “리포좀은 종양 미세 환경에서 종양세포들이 분비하는 생체나노입자인 엑소좀에 효율적으로 인공수용체를 탑재한다. 그리고 엑소좀은 고유 이동경로를 통해 인공수용체가 종양 전역으로 전달되도록 한다.”며 “표적치료가 어려운 다양한 질병을 치료하는 데 유용하게 사용될 것으로 기대한다”고 말했다.
이번 연구는 한국연구재단의 신진연구자지원사업, 보건복지부의 암정복추진연구개발사업 및 KAIST연구소의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 종양 내 인공수용체 전달을 통한 협동 표적치료를 보여주는 모식도
그림2. 종양 내 인공수용체 전달을 통한 협동 표적을 보여주는 종양 조직 사진
2017.07.06 조회수 19848 김재경 교수, 수학 통해 암과 생체시계의 핵심 연결고리 발견
〈 이번 연구에 참여한 김재경 교수와 버지니아 공대 연구팀 〉
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 생체시계가 암 억제 핵심 물질인 p53을 24시간 주기로 변화시키는 원리를 예측했다.
그리고 김재경 교수의 수학적 모델링은 미국 버지니아 공대 칼라 핀키엘스타인(Carla Finkielstein, 아르헨티나) 교수 연구팀의 실험을 통해 검증돼 생체시계와 암 사이에 중요한 연결고리가 있음이 증명됐다.
이번 연구 결과는 미국의 저명 학술지 미국국립과학원회보(PNAS) 11월 9일자 온라인 판에 게재됐다.
뇌 속의 생체 시계는 우리가 24시간 주기에 맞춰 살 수 있도록 행동과 생리작용을 조절한다. 밤 9시가 되면 뇌 속의 멜라토닌 호르몬이 분비를 유발해 일정 시간에 수면을 취하게 하는 등 세포분열부터 운동 및 학습 능력 등 다양한 생리 작용에 관여한다.
만성적 야근, 교대 근무 등으로 인해 생체 시계와 실제 시간이 충돌해 생체 시계의 교란이 생기면 당뇨, 암, 심장병 등 다양한 질병을 유발할 수 있다.
지난 2014년 김 교수가 버지니아 공대의 칼라 핀키엘스타인 교수 연구팀과 만났을 때 핀키엘스타인 교수 연구팀은 암 억제물질인 p53이 24시간을 주기로 변화함을 관찰했지만 어떤 원리로 생체시계가 p53의 24시간 주기 리듬을 만들어내는지는 알지 못하는 상태였다.
p53이 세포의 조절 시스템 중에서도 매우 복잡한 시스템으로 구성돼 실험만을 통해 원리를 밝혀내기엔 많은 시간과 인력이 소모되기 때문이다.
김 교수는 문제 해결을 위해 수리모델링을 이용한 컴퓨터 시뮬레이션을 통해 수백만 경우의 가상 실험을 실시했다. 시행착오에 기반한 전통적 실험 대신 수리모델을 이용함으로써 비용, 시간, 인력 등을 줄일 수 있었다.
김 교수는 이 과정에서 생체 시계의 핵심 역할을 하는 물질인 Period2 단백질이 p53의 생체리듬과 깊은 관련이 있음을 밝혔다. 세포는 크게 핵과 세포질 두 가지 성분으로 나뉜다. p53은 핵과 세포질에 모두 존재할 수 있는데 이 중 핵 안으로 p53이 들어가면 안정화돼 분해가 느리게 일어난다.
김 교수는 p53 단백질을 핵 안으로 끌고 들어가는 물질이 생체 시계의 핵심 역할을 하는 Period2 단백질임을 예측했다.
이러한 김 교수의 수리모델을 통한 예측들은 핀키엘스타인교수 연구팀에 의해서 실험으로 검증돼 생체시계와 암 사이의 핵심 연결 고리를 발견할 수 있었다.
이번 연구는 p53 단백질을 정상화하는 수많은 항암제들이 투약 시간에 따라 효과가 달라졌던 원인을 규명하고 최적의 항암제 투약 시간을 밝히는 데 중요한 역할을 할 것으로 기대된다.
연구팀은 생체시계가 불안정한 교대 근무 직종 종사자들이 암 발병 확률이 높아지는 원인 규명 및 치료법 개발에 역할을 할 것으로 예상된다고 밝혔다.
김 교수는 “간호사, 경찰 등 교대 근무로 인해 고생하시는 분들이 좀 더 건강한 생활을 할 수 있도록 수학을 통해 조그만 기여를 하게 돼 기쁘다”며 “이번 성과를 통해 우리나라에서 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”고 말했다.
미국 버지니아 공대와 공동으로 진행한 이번 연구는 포스코 청암 재단, 미국과학연구재단, 한국연구재단의 신진연구자 지원 사업 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학과 실험을 통해서 밝혀진 생체시계의 핵심 단백질 Period2(Per2)와 암 억제 핵심 물질인 p53의 복잡한 상호작용
그림2. 이번 연구에서 사용된 수리모델의 일부
2016.11.10 조회수 49807
김재경 교수, 수학 통해 암과 생체시계의 핵심 연결고리 발견
〈 이번 연구에 참여한 김재경 교수와 버지니아 공대 연구팀 〉
우리 대학 수리과학과 김재경 교수가 미분방정식을 이용한 수학적 모델링을 통해 생체시계가 암 억제 핵심 물질인 p53을 24시간 주기로 변화시키는 원리를 예측했다.
그리고 김재경 교수의 수학적 모델링은 미국 버지니아 공대 칼라 핀키엘스타인(Carla Finkielstein, 아르헨티나) 교수 연구팀의 실험을 통해 검증돼 생체시계와 암 사이에 중요한 연결고리가 있음이 증명됐다.
이번 연구 결과는 미국의 저명 학술지 미국국립과학원회보(PNAS) 11월 9일자 온라인 판에 게재됐다.
뇌 속의 생체 시계는 우리가 24시간 주기에 맞춰 살 수 있도록 행동과 생리작용을 조절한다. 밤 9시가 되면 뇌 속의 멜라토닌 호르몬이 분비를 유발해 일정 시간에 수면을 취하게 하는 등 세포분열부터 운동 및 학습 능력 등 다양한 생리 작용에 관여한다.
만성적 야근, 교대 근무 등으로 인해 생체 시계와 실제 시간이 충돌해 생체 시계의 교란이 생기면 당뇨, 암, 심장병 등 다양한 질병을 유발할 수 있다.
지난 2014년 김 교수가 버지니아 공대의 칼라 핀키엘스타인 교수 연구팀과 만났을 때 핀키엘스타인 교수 연구팀은 암 억제물질인 p53이 24시간을 주기로 변화함을 관찰했지만 어떤 원리로 생체시계가 p53의 24시간 주기 리듬을 만들어내는지는 알지 못하는 상태였다.
p53이 세포의 조절 시스템 중에서도 매우 복잡한 시스템으로 구성돼 실험만을 통해 원리를 밝혀내기엔 많은 시간과 인력이 소모되기 때문이다.
김 교수는 문제 해결을 위해 수리모델링을 이용한 컴퓨터 시뮬레이션을 통해 수백만 경우의 가상 실험을 실시했다. 시행착오에 기반한 전통적 실험 대신 수리모델을 이용함으로써 비용, 시간, 인력 등을 줄일 수 있었다.
김 교수는 이 과정에서 생체 시계의 핵심 역할을 하는 물질인 Period2 단백질이 p53의 생체리듬과 깊은 관련이 있음을 밝혔다. 세포는 크게 핵과 세포질 두 가지 성분으로 나뉜다. p53은 핵과 세포질에 모두 존재할 수 있는데 이 중 핵 안으로 p53이 들어가면 안정화돼 분해가 느리게 일어난다.
김 교수는 p53 단백질을 핵 안으로 끌고 들어가는 물질이 생체 시계의 핵심 역할을 하는 Period2 단백질임을 예측했다.
이러한 김 교수의 수리모델을 통한 예측들은 핀키엘스타인교수 연구팀에 의해서 실험으로 검증돼 생체시계와 암 사이의 핵심 연결 고리를 발견할 수 있었다.
이번 연구는 p53 단백질을 정상화하는 수많은 항암제들이 투약 시간에 따라 효과가 달라졌던 원인을 규명하고 최적의 항암제 투약 시간을 밝히는 데 중요한 역할을 할 것으로 기대된다.
연구팀은 생체시계가 불안정한 교대 근무 직종 종사자들이 암 발병 확률이 높아지는 원인 규명 및 치료법 개발에 역할을 할 것으로 예상된다고 밝혔다.
김 교수는 “간호사, 경찰 등 교대 근무로 인해 고생하시는 분들이 좀 더 건강한 생활을 할 수 있도록 수학을 통해 조그만 기여를 하게 돼 기쁘다”며 “이번 성과를 통해 우리나라에서 아직은 부족한 생물학과 수학의 교류가 활발해지길 기대한다”고 말했다.
미국 버지니아 공대와 공동으로 진행한 이번 연구는 포스코 청암 재단, 미국과학연구재단, 한국연구재단의 신진연구자 지원 사업 등의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 수학과 실험을 통해서 밝혀진 생체시계의 핵심 단백질 Period2(Per2)와 암 억제 핵심 물질인 p53의 복잡한 상호작용
그림2. 이번 연구에서 사용된 수리모델의 일부
2016.11.10 조회수 49807 조용훈 교수, 피라미드 구조로 방향성과 집광 효율을 높인 고성능 반도체 양자 광원 개발
우리 대학 물리학과 조용훈 교수 연구팀이 반도체 피라미드 구조의 양자점이 피라미드 밑면으로 강한 빛을 방출함을 발견하고 이 빛을 높은 효율로 모을 수 있는 기술을 개발했다.
김세정, 공수현 박사가 공동 1저자로 참여한 이번 연구 결과는 나노분야 국제 학술지 ‘나노 레터스(Nano Letters)’ 10월 12일자에 게재됐다.
반도체 양자점은 빛 알갱이를 하나씩 내뿜는 단일광자원(양자광원)으로 활용가능하다. 단일광자원은 미래의 양자컴퓨터 또는 양자암호기술 등을 구현하기 위한 필수 요소이다.
일반적인 양자점은 불규칙적인 위치에 형성되는 반면 3차원 피라미드 구조에 얇게 양자우물(Quantum well)을 성장시키면 정확히 피라미드 꼭짓점 위치에 양자점(Quantum dot)을 형성할 수 있다. 이 기술을 활용하면 위치가 제어된 단일광자원을 높은 수율로 얻을 수 있다.
하지만 양자점에서 나오는 빛은 빛 알갱이 개수가 적고 양자점이 굴절률 높은 반도체 물질에 갇혀 있기 때문에 일반적으로 구조 바깥으로 빠져나오기 어렵다. 반도체 단일광자원 소자가 상용화 단계로 나아가려면 빛의 집광 효율을 높여야만 한다.
연구팀은 일반적으로 가지고 있는 고정관념을 벗어나 문제를 해결했다. 피라미드 구조의 빛의 지향성(directionality)을 관찰했고 이를 이용했다. 그 동안 피라미드 양자점에서 나오는 빛은 피라미드의 위, 즉 꼭짓점 방향으로 나오는 신호만을 측정했다. 피라미드 밑면 방향으로는 성장 과정상 두꺼운 기판이 반드시 존재하기 때문이다.
하지만 연구팀은 시뮬레이션을 통해 양자점이 피라미드 위쪽보다 밑면 방향으로 더 많은 빛을 방출함을 확인했다.
또한 피라미드 밑면 방향으로 진행하는 빛은 가우시안 형태의 전기장 분포 형태를 갖고 있어, 광도파로 또는 광섬유의 단일 모드와 잘 일치한다. 이는 제품과 전선을 결합하듯이 광원과 광도파로 간의 결합 효율을 높일 수 있다.
이에 연구팀은 폴리머를 이용해 피라미드 구조체를 기판에서 떼어냈다. 피라미드의 밑면으로 나오는 빛이 두꺼운 반도체 기판을 거치지 않고 공기 중으로 직접 방출되도록 한 것이다.
연구팀이 떼어낸 피라미드는 쉽게 다른 광학 소자들과 직접 결합할 수 있어 피라미드 양자점의 응용분야가 확대될 수 있는 발판이 될 것으로 기대된다.
조 교수는 “이번 연구 내용은 양자 광원 뿐 아니라 LED와 같은 광원 소자에도 적용 가능해 활용도가 높을 것으로 기대된다.”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 기후변화연구 허브사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 폴리머로 떼어낸 피라미드 양자점의 모식도
그림2. 피라미드 양자점에서 방출된 빛의 상반구 및 하반구 먼장 (far-field) 방출 패턴(좌)와 폴리머로 떼어내기 전후의 나노 피라미드 구조체(후)
2016.10.18 조회수 21080
조용훈 교수, 피라미드 구조로 방향성과 집광 효율을 높인 고성능 반도체 양자 광원 개발
우리 대학 물리학과 조용훈 교수 연구팀이 반도체 피라미드 구조의 양자점이 피라미드 밑면으로 강한 빛을 방출함을 발견하고 이 빛을 높은 효율로 모을 수 있는 기술을 개발했다.
김세정, 공수현 박사가 공동 1저자로 참여한 이번 연구 결과는 나노분야 국제 학술지 ‘나노 레터스(Nano Letters)’ 10월 12일자에 게재됐다.
반도체 양자점은 빛 알갱이를 하나씩 내뿜는 단일광자원(양자광원)으로 활용가능하다. 단일광자원은 미래의 양자컴퓨터 또는 양자암호기술 등을 구현하기 위한 필수 요소이다.
일반적인 양자점은 불규칙적인 위치에 형성되는 반면 3차원 피라미드 구조에 얇게 양자우물(Quantum well)을 성장시키면 정확히 피라미드 꼭짓점 위치에 양자점(Quantum dot)을 형성할 수 있다. 이 기술을 활용하면 위치가 제어된 단일광자원을 높은 수율로 얻을 수 있다.
하지만 양자점에서 나오는 빛은 빛 알갱이 개수가 적고 양자점이 굴절률 높은 반도체 물질에 갇혀 있기 때문에 일반적으로 구조 바깥으로 빠져나오기 어렵다. 반도체 단일광자원 소자가 상용화 단계로 나아가려면 빛의 집광 효율을 높여야만 한다.
연구팀은 일반적으로 가지고 있는 고정관념을 벗어나 문제를 해결했다. 피라미드 구조의 빛의 지향성(directionality)을 관찰했고 이를 이용했다. 그 동안 피라미드 양자점에서 나오는 빛은 피라미드의 위, 즉 꼭짓점 방향으로 나오는 신호만을 측정했다. 피라미드 밑면 방향으로는 성장 과정상 두꺼운 기판이 반드시 존재하기 때문이다.
하지만 연구팀은 시뮬레이션을 통해 양자점이 피라미드 위쪽보다 밑면 방향으로 더 많은 빛을 방출함을 확인했다.
또한 피라미드 밑면 방향으로 진행하는 빛은 가우시안 형태의 전기장 분포 형태를 갖고 있어, 광도파로 또는 광섬유의 단일 모드와 잘 일치한다. 이는 제품과 전선을 결합하듯이 광원과 광도파로 간의 결합 효율을 높일 수 있다.
이에 연구팀은 폴리머를 이용해 피라미드 구조체를 기판에서 떼어냈다. 피라미드의 밑면으로 나오는 빛이 두꺼운 반도체 기판을 거치지 않고 공기 중으로 직접 방출되도록 한 것이다.
연구팀이 떼어낸 피라미드는 쉽게 다른 광학 소자들과 직접 결합할 수 있어 피라미드 양자점의 응용분야가 확대될 수 있는 발판이 될 것으로 기대된다.
조 교수는 “이번 연구 내용은 양자 광원 뿐 아니라 LED와 같은 광원 소자에도 적용 가능해 활용도가 높을 것으로 기대된다.”고 말했다.
이번 연구는 한국연구재단의 중견연구자지원사업과 KAIST 기후변화연구 허브사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 폴리머로 떼어낸 피라미드 양자점의 모식도
그림2. 피라미드 양자점에서 방출된 빛의 상반구 및 하반구 먼장 (far-field) 방출 패턴(좌)와 폴리머로 떼어내기 전후의 나노 피라미드 구조체(후)
2016.10.18 조회수 21080 이해신 교수, 찔러도 출혈 없는 주사바늘 개발
우리 대학 화학과 이해신 교수 연구팀이 홍합이 가진 접착 기능을 모방한 생체 재료를 이용해 찔러도 출혈이 없는 주사바늘을 개발했다.
이번 연구결과는 재료 분야의 네이처 자매지 ‘네이처 머티리얼즈(Nature Materials)’ 10월 3일자 온라인 판에 게재됐다.
모든 의료 처치에서 주사바늘의 사용은 필수이다. 혈액채취, 링거, 카테터, 스텐트 삽입, 약물 및 백신 주사 등 상당수 의료적 처치는 모두 주사바늘을 통해 이뤄진다. 처치 후에는 환부를 수 분 가량 압박해 지혈을 한다.
압박만으로도 건강한 일반인들은 3분 내외로 효과적 지혈을 할 수 있지만 장기입원중인 암 환자, 당뇨병, 혈우병, 아스피린 장기 복용 환자 등은 정상적인 지혈이 어렵거나 불가능한 경우가 많다.
주사바늘에 코팅되는 지혈 재료는 주사 전에는 주사바늘의 표면에 단단히 코팅돼야 하고 주사 후에는 혈관내벽 또는 피부에 부착돼 지혈 기능을 수행해야 한다. 따라서 기계적 물성이 강한 필름형태의 지혈 재료를 사용하는 것이 중요하다.
그러나 기존의 지혈 재료들은 기계적 물성이 약해 주사 과정에서 발생하는 마찰력을 견디지 못하는 한계를 가졌다.
연구팀은 문제 해결을 위해 홍합의 특성을 이용했다. 홍합이 섬유 형태의 족사(어패류의 몸에서 나오는 경단백질의 강인한 섬유다발, )를 이용해 강한 파도가 치는 해안가의 바위에서도 단단히 붙어 생존하는 현상에 착안해 홍합 족사의 구조를 모방했다.
이러한 접착성을 의료기술과 결합하면 수분이 70% 이상 존재하는 생체 환경에서도 우수한 접착 능력을 기대할 수 있다. 연구팀은 이전에도 이를 이용한 다양한 지혈 재료들을 개발해 왔다.
연구팀의 찔러도 피가 나지 않는 주사바늘은 일반 주사바늘에 지혈재료를 코팅해 주사 후에 상처부위를 물리적으로 막아 자발적으로 지혈할 수 있게 만드는 기술이다.
홍합 족사 구조에 존재하는 카테콜아민 성분을 도입한 접착성 키토산을 이용해 주사바늘 위에 지혈기능성 필름을 형성했다. 이후 혈액에 필름이 닿으면 하이드로젤 형태로 순간적으로 전이되면서 지혈 현상이 발생하는 것이다.
이 기술은 지혈 기능에 문제를 갖는 당뇨병, 혈우병, 암 환자와 아스피린 복용자 등에게 적용 가능할 것으로 기대된다.
이해신 교수는 “개발된 기술은 모든 혈관 및 근육 주사에 효과를 보이고 혈우병 모델에서도 효과적인 기능을 보이기 때문에 혈액응고장애가 있는 환자들에게 유용할 것이다”며 “카테터 및 생검바늘 등 다양한 침습 의료기기들과 결합해 새로운 기술의 발전이 가능할 것으로 기대된다”고 말했다.
안전성평가연구소의 강선웅, 김기석 박사 연구팀과 ㈜이노테라피(대표 이문수)와의 공동 연구로 진행된 이번 연구는 한국연구재단 중견연구자도약사업, 보건복지부 암정복추진연구개발사업, 암중개융합연구의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 일반동물모델에대한 근육주사후 지혈효과
그림2. 혈우병동물모델에대한 지혈효과
그림3. 주사기 제조과정 및 표면 특성분석
2016.10.06 조회수 15579
이해신 교수, 찔러도 출혈 없는 주사바늘 개발
우리 대학 화학과 이해신 교수 연구팀이 홍합이 가진 접착 기능을 모방한 생체 재료를 이용해 찔러도 출혈이 없는 주사바늘을 개발했다.
이번 연구결과는 재료 분야의 네이처 자매지 ‘네이처 머티리얼즈(Nature Materials)’ 10월 3일자 온라인 판에 게재됐다.
모든 의료 처치에서 주사바늘의 사용은 필수이다. 혈액채취, 링거, 카테터, 스텐트 삽입, 약물 및 백신 주사 등 상당수 의료적 처치는 모두 주사바늘을 통해 이뤄진다. 처치 후에는 환부를 수 분 가량 압박해 지혈을 한다.
압박만으로도 건강한 일반인들은 3분 내외로 효과적 지혈을 할 수 있지만 장기입원중인 암 환자, 당뇨병, 혈우병, 아스피린 장기 복용 환자 등은 정상적인 지혈이 어렵거나 불가능한 경우가 많다.
주사바늘에 코팅되는 지혈 재료는 주사 전에는 주사바늘의 표면에 단단히 코팅돼야 하고 주사 후에는 혈관내벽 또는 피부에 부착돼 지혈 기능을 수행해야 한다. 따라서 기계적 물성이 강한 필름형태의 지혈 재료를 사용하는 것이 중요하다.
그러나 기존의 지혈 재료들은 기계적 물성이 약해 주사 과정에서 발생하는 마찰력을 견디지 못하는 한계를 가졌다.
연구팀은 문제 해결을 위해 홍합의 특성을 이용했다. 홍합이 섬유 형태의 족사(어패류의 몸에서 나오는 경단백질의 강인한 섬유다발, )를 이용해 강한 파도가 치는 해안가의 바위에서도 단단히 붙어 생존하는 현상에 착안해 홍합 족사의 구조를 모방했다.
이러한 접착성을 의료기술과 결합하면 수분이 70% 이상 존재하는 생체 환경에서도 우수한 접착 능력을 기대할 수 있다. 연구팀은 이전에도 이를 이용한 다양한 지혈 재료들을 개발해 왔다.
연구팀의 찔러도 피가 나지 않는 주사바늘은 일반 주사바늘에 지혈재료를 코팅해 주사 후에 상처부위를 물리적으로 막아 자발적으로 지혈할 수 있게 만드는 기술이다.
홍합 족사 구조에 존재하는 카테콜아민 성분을 도입한 접착성 키토산을 이용해 주사바늘 위에 지혈기능성 필름을 형성했다. 이후 혈액에 필름이 닿으면 하이드로젤 형태로 순간적으로 전이되면서 지혈 현상이 발생하는 것이다.
이 기술은 지혈 기능에 문제를 갖는 당뇨병, 혈우병, 암 환자와 아스피린 복용자 등에게 적용 가능할 것으로 기대된다.
이해신 교수는 “개발된 기술은 모든 혈관 및 근육 주사에 효과를 보이고 혈우병 모델에서도 효과적인 기능을 보이기 때문에 혈액응고장애가 있는 환자들에게 유용할 것이다”며 “카테터 및 생검바늘 등 다양한 침습 의료기기들과 결합해 새로운 기술의 발전이 가능할 것으로 기대된다”고 말했다.
안전성평가연구소의 강선웅, 김기석 박사 연구팀과 ㈜이노테라피(대표 이문수)와의 공동 연구로 진행된 이번 연구는 한국연구재단 중견연구자도약사업, 보건복지부 암정복추진연구개발사업, 암중개융합연구의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 일반동물모델에대한 근육주사후 지혈효과
그림2. 혈우병동물모델에대한 지혈효과
그림3. 주사기 제조과정 및 표면 특성분석
2016.10.06 조회수 15579 전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18 조회수 18433
전상용 교수, 황달 유발 물질 이용해 암 표적치료 기술개발
우리 대학 생명과학과 전상용 교수, 이용현 박사 연구팀이 몸속에서 황달을 유발하는 물질인 빌리루빈을 항암약물 전달체로 이용하는 기술을 개발했다.
이 연구는 동물실험에서의 높은 생체적합성과 우수한 항암 효능을 보여 기존 암 치료법의 새로운 대안이 될 것으로 기대된다.
이번 연구 성과는 응용화학분야 학술지 ‘앙케반테 케미(Angewandte chemie)’의 에디터 선정 가장 주목받는 화제의 논문(Hot Paper)으로 선정돼 8월 3일자 온라인 판에 게재됐다.
약물전달시스템은 환부와 정상조직에서의 pH, 활성산소 등의 병태생리학적 차이를 분석해 빛, 자기장, 초음파 등 외부자극을 국소적으로 조사하는 방법이다. 이를 통해 효과적으로 선택적으로 표적에만 약물을 방출할 수 있다.
약물전달시스템은 기존 합성의약품 기반의 항암 치료제에 비해 독성을 크게 낮출 수 있기 때문에 자극감응성 약물전달체에 대한 개발이 활발하게 이뤄지고 있다.
하지만 고분자, 무기 나노입자같은 인공소재 기반의 자극감응성 약물전달체는 공정이 복잡해 상용화가 어렵고, 잠재적 독성을 유발할 가능성이 높다.
연구팀은 문제 해결을 위해 몸속 물질인 빌리루빈을 이용했다. 연구팀은 지난 5월 빌리루빈은 황달을 일으킬 수 있지만 적절하게 조절된다면 심혈관 질환이나 암 발병 가능성이 현저히 낮아져 난치성 염증을 치료할 수 있다는 연구결과를 발표했었다.
빌리루빈은 노란 색소로 혈중 농도가 높아지면 황달의 원인이 된다. 특히 신생아의 경우 간 기능이 미성숙하고 뇌혈관장벽이 미성숙하기 때문에 황달 치료를 위해 추가적 외부요법이 필요하다.
이것이 임상에서 널리 이용되는 광선치료인데 빌리루빈에 빛을 조사하면 친수성(親水性)이 강해져 빌리루빈 조직이 해체되고 배설이 촉진된다. 또한 빌리루빈은 강한 항산화작용 특성을 갖고 있어 빌리루빈이 산화될 때 친수성이 큰 빌리버딘이라는 물질로 전환되거나 작은 빌리루빈 산화물질로 깨져 역시 배설이 촉진된다.
연구팀은 위와 같은 빌리루빈의 특성을 이용했다. 우선 지난 5월의 연구를 토대로 빌리루빈의 배설이 잘 이뤄지도록 친수성을 갖는 물질과 결합시켜 나노입자로 만든 후 항암제인 독소루비신을(Doxorubicin) 선적시켰다.
그 후 암 부위에 빛을 노출시키면 빛에 의해 빌리루빈이 와해돼 선적된 항암제가 암 조직을 공격하는 원리이다.
연구팀은 이 시스템이 인간 폐암 동물모델에서 기존 항암치료 그룹에 비해 우수한 치료 효능을 보이는 것을 규명했다. 빛으로 암 부위를 국소적으로 조사했을 때 더 향상된 치료 효능이 나타났고, 운반체인 빌리루빈 나노입자 자체도 일정량의 항암효과를 나타냄을 확인했다.
이 기술은 최초로 빌리루빈을 활용한 항암치료용 다중자극감응형 약물전달시스템을 개발함으로써 원천기술 확보했다는 의의를 갖는다.
전 교수는 “물체 유래 천연 물질 빌리루빈을 사용해 독성이 없고 간단한 시스템으로 구성된 약물전달시스템을 개발해 상업화에 큰 장점을 가질 것이다”고 말했다.
이용현 박사는 “향후 임상 연구와 적용 가능성을 평가해 궁극적으로 암을 치료하는 새 방안으로 개발되길 기대한다”고 말했다.
이번 연구는 한국연구재단 글로벌연구실사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 빌리루빈 나노입자가 빛과 활성산소에 의하여 와해됨을 보여주는 결과
그림2. 인간 폐암 동물모델에서 약물이 로딩된 빌리루빈 나노입자가 실제 작용하는 모식도
2016.08.18 조회수 18433 김필남 교수, 악성 뇌종양의 내성 발생 원리 밝혀
〈 김 필 남 교수 〉
우리 대학 바이오및뇌공학과 김필남 교수 연구팀이 3차원 체외 종양 모델을 제작해 악성 뇌종양의 약물 저항성(내성) 발생 원리를 밝혔다.이번에 제작된 뇌종양 3차원 모델은 실제로 중요한 영향을 미치는 종양의 미세환경(tumor microenvironment)을 고려해 제작함으로써 실질적 암 치료에 적용 가능할 것으로 기대된다.
이번 연구는 네이처 자매지인 ‘사이언티픽 리포트(Scientific Reports)’ 4월 26일자 온라인 판에 게재됐다. (논문명: Strategies of Mesenchymal Invasion of Patient-derived Brain Tumors: Microenvironmental Adaptation)
악성 뇌종양은 주변 조직으로 침윤하는 특성이 매우 강해 치료하기 힘든 질병 중 하나이다. 수술을 통해 종양을 절제해도 주변 조직에 넓게 침윤한 잔여 세포들이 재발하는 경우가 많다.
따라서 악성 뇌종양의 치료 효율 및 생존율을 높이기 위해서는 남아있는 침윤 세포를 표적으로 한 치료법을 개발해야 한다.
그러나 종양의 악성화 및 침윤 특성의 주요 원인인 주변 미세환경(tumor microenvironment)을 고려하지 않은 항암제 개발이 주로 이뤄졌기 때문에 종양의 침윤 및 약물 저항의 원리를 밝히기 어려웠다.
연구팀은 문제 해결을 위해 체외에서 종양 주변 미세환경의 특성을 반영한 3차원 암 모델을 구현했다. 이는 뇌종양 미세환경의 주요 구성요소인 과함유 히알루론산(hyaluronic acid) 기질과 백색질 경로(white matter tract)를 모사한 생체모방체외종양 모델이다.
연구팀은 체내에 존재하는 악성 뇌종양의 특성을 체외에서도 유사하게 유지시켜 환자를 대체할 수 있는 종양 모델로 활용 가능함을 확인했다.
연구팀은 뇌종양 세포가 침윤하는 데 중요한 역할을 하는 히알루론산 합성 단백질을 억제하는 약물을 투입했다. 초기에는 뇌종양 침윤이 억제됐지만 시간이 흐르며 미세환경 적응(microenvironmental adaptation) 과정에서 뇌종양이 새 기전을 통해 약물에 대한 내성이 생기는 현상을 발견했다.
이 모든 과정을 체외 종양 모델을 통해 진행함으로써 동물실험을 대체하여 다양한 항암제를 조합하고 검증할 수 있어 실질적인 암 치료에 도움이 될 것으로 기대된다.
연구팀이 제시한 3차원 체외 암 모델은 기존 약물의 저항 원인을 규명하는 기반이 될 것으로 예상된다. 또한 추후 정밀 암 치료를 위한 핵심 기반 기술로 환자맞춤 약물 검증 및 신약 발굴 모델 등으로 다각적 활용이 가능할 것으로 기대된다.
김 교수는 “뇌종양의 체외 종양모델로서 공학적 기술 기반의 3차원 미세환경 암 모델을 제시했다”며 “이를 바탕으로 뇌종양 환자 개별 치료의 가능성을 높여 생존율 개선에 힘이 되겠다”고 말했다.
바이오및뇌공학과 차정화 박사과정 학생이 1저자로 참여한 이번 연구는 한국연구재단 신진연구자지원사업 및 보건복지부 중개중점 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 악성 뇌종양 주변 미세환경
그림2. 환자 대체치료용 3차원 체외뇌암모델의 모식도
그림3. 환자유래 뇌종양 세포의 미세환경 적응 과정에 의한 약물 저항 메커니즘
2016.05.11 조회수 16565
김필남 교수, 악성 뇌종양의 내성 발생 원리 밝혀
〈 김 필 남 교수 〉
우리 대학 바이오및뇌공학과 김필남 교수 연구팀이 3차원 체외 종양 모델을 제작해 악성 뇌종양의 약물 저항성(내성) 발생 원리를 밝혔다.이번에 제작된 뇌종양 3차원 모델은 실제로 중요한 영향을 미치는 종양의 미세환경(tumor microenvironment)을 고려해 제작함으로써 실질적 암 치료에 적용 가능할 것으로 기대된다.
이번 연구는 네이처 자매지인 ‘사이언티픽 리포트(Scientific Reports)’ 4월 26일자 온라인 판에 게재됐다. (논문명: Strategies of Mesenchymal Invasion of Patient-derived Brain Tumors: Microenvironmental Adaptation)
악성 뇌종양은 주변 조직으로 침윤하는 특성이 매우 강해 치료하기 힘든 질병 중 하나이다. 수술을 통해 종양을 절제해도 주변 조직에 넓게 침윤한 잔여 세포들이 재발하는 경우가 많다.
따라서 악성 뇌종양의 치료 효율 및 생존율을 높이기 위해서는 남아있는 침윤 세포를 표적으로 한 치료법을 개발해야 한다.
그러나 종양의 악성화 및 침윤 특성의 주요 원인인 주변 미세환경(tumor microenvironment)을 고려하지 않은 항암제 개발이 주로 이뤄졌기 때문에 종양의 침윤 및 약물 저항의 원리를 밝히기 어려웠다.
연구팀은 문제 해결을 위해 체외에서 종양 주변 미세환경의 특성을 반영한 3차원 암 모델을 구현했다. 이는 뇌종양 미세환경의 주요 구성요소인 과함유 히알루론산(hyaluronic acid) 기질과 백색질 경로(white matter tract)를 모사한 생체모방체외종양 모델이다.
연구팀은 체내에 존재하는 악성 뇌종양의 특성을 체외에서도 유사하게 유지시켜 환자를 대체할 수 있는 종양 모델로 활용 가능함을 확인했다.
연구팀은 뇌종양 세포가 침윤하는 데 중요한 역할을 하는 히알루론산 합성 단백질을 억제하는 약물을 투입했다. 초기에는 뇌종양 침윤이 억제됐지만 시간이 흐르며 미세환경 적응(microenvironmental adaptation) 과정에서 뇌종양이 새 기전을 통해 약물에 대한 내성이 생기는 현상을 발견했다.
이 모든 과정을 체외 종양 모델을 통해 진행함으로써 동물실험을 대체하여 다양한 항암제를 조합하고 검증할 수 있어 실질적인 암 치료에 도움이 될 것으로 기대된다.
연구팀이 제시한 3차원 체외 암 모델은 기존 약물의 저항 원인을 규명하는 기반이 될 것으로 예상된다. 또한 추후 정밀 암 치료를 위한 핵심 기반 기술로 환자맞춤 약물 검증 및 신약 발굴 모델 등으로 다각적 활용이 가능할 것으로 기대된다.
김 교수는 “뇌종양의 체외 종양모델로서 공학적 기술 기반의 3차원 미세환경 암 모델을 제시했다”며 “이를 바탕으로 뇌종양 환자 개별 치료의 가능성을 높여 생존율 개선에 힘이 되겠다”고 말했다.
바이오및뇌공학과 차정화 박사과정 학생이 1저자로 참여한 이번 연구는 한국연구재단 신진연구자지원사업 및 보건복지부 중개중점 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 악성 뇌종양 주변 미세환경
그림2. 환자 대체치료용 3차원 체외뇌암모델의 모식도
그림3. 환자유래 뇌종양 세포의 미세환경 적응 과정에 의한 약물 저항 메커니즘
2016.05.11 조회수 16565 종양 전역에 약물 전달하는 항암치료나노기술 개발
<박 지 호 교수>
우리 대학 바이오 및 뇌공학과 박지호 교수 연구팀이 종양의 전역에 약물이 골고루 전달되게 해 항암효과를 현저히 높일 수 있는 새 항암치료 나노기술을 개발했다.
이번 연구는 나노분야 학술지 ‘나노 레터스(Nano Letters)’3월 31일자 온라인 판에 게재됐다.
일반적으로 수술이 어려운 종양의 치료를 위해 항암약물치료법이 사용된다. 하지만 종양이 외부로 들어오는 약물의 접근을 여러 방법으로 막기 때문에 종양 전체에 항암효과를 보기 어려웠다. 혈류로 투여된 약물들의 대부분이 혈관주위의 종양세포들에만 전달되고, 중심부의 종양세포에는 전달되지 않아 재발 문제가 자주 발생한 것이다.
연구팀은 문제 해결을 위해 리포좀과 엑소좀이라는 소포체를 이용했다. 리포좀은 인공나노소포체로서 혈류를 통해 혈관 주위의 종양 세포 부위까지 약물을 전달한다. 종양 세포에서 자연적으로 분비되는 생체나노소포체인 엑소좀에 약물을 무사히 탑재하는 것이 리포좀의 역할이다.
엑소좀은 종양에서 세포 내부의 생물학적 물질들을 전달하기 때문에 종양의 진행 및 전이에 중요한 요소로 알려져 있다. 리포좀이 항암 약물을 엑소좀에 탑재하면, 엑소좀이 이동하는 종양 내의 모든 위치로 약물이 전달됨으로써 질병이 치료되는 것이 연구의 핵심이다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 노출시켜 항암효과를 유도한 후 분석한 결과 종양조직 전역에서 항암효과를 관찰할 수 있었다.
연구팀의 핵심 성과는 종양 및 다른 질병들의 미세 환경을 파악해 질병에 대항하는 맞춤형 약물전달 기술 개발의 발판을 마련한 것이다.
연구팀은 이 기술을 제약회사에서 개발 중인 항암제에 적용해 약물전달이 어려운 악성 종양의 치료효과를 실험 진행 중이다.
박 교수는 “엑소좀이 세포에서 끊임없이 분비되는 특성과 주변 세포로 생물학적 물질을 전달하는 특성을 응용해 종양 중심부까지 약물을 전달 가능하게 만든 최초의 연구”라고 말했다.
박지호 교수 지도아래 이준성 박사, 김지영 석사가 주 저자로 참여한 이번 연구는 한국연구재단이 추진하는 신진연구자지원사업, 글로벌프론티어사업, 미래유망융합기술파이오니어사업의 지원을 받아 수행됐다.
□ 그림설명
그림 1. 종양 전역에 약물이 골고루 전달되게 해 항암효과를 높이는 새 종양투과 약물전달 나노기술
세포막과 결합하는 리포좀에 의해서 세포로 전달된 물질이 그 세포가 분비하는 엑소좀에 효율적으로 탑재돼 주변세포로 전달되는 과정을 보여주는 모식도(좌). 이러한 엑소좀기반 세포간 약물전달이 실제로 종양 스페로이드 및 생체 내 종양모델에서 관찰된 결과들 (우).
2015.04.06 조회수 17425
종양 전역에 약물 전달하는 항암치료나노기술 개발
<박 지 호 교수>
우리 대학 바이오 및 뇌공학과 박지호 교수 연구팀이 종양의 전역에 약물이 골고루 전달되게 해 항암효과를 현저히 높일 수 있는 새 항암치료 나노기술을 개발했다.
이번 연구는 나노분야 학술지 ‘나노 레터스(Nano Letters)’3월 31일자 온라인 판에 게재됐다.
일반적으로 수술이 어려운 종양의 치료를 위해 항암약물치료법이 사용된다. 하지만 종양이 외부로 들어오는 약물의 접근을 여러 방법으로 막기 때문에 종양 전체에 항암효과를 보기 어려웠다. 혈류로 투여된 약물들의 대부분이 혈관주위의 종양세포들에만 전달되고, 중심부의 종양세포에는 전달되지 않아 재발 문제가 자주 발생한 것이다.
연구팀은 문제 해결을 위해 리포좀과 엑소좀이라는 소포체를 이용했다. 리포좀은 인공나노소포체로서 혈류를 통해 혈관 주위의 종양 세포 부위까지 약물을 전달한다. 종양 세포에서 자연적으로 분비되는 생체나노소포체인 엑소좀에 약물을 무사히 탑재하는 것이 리포좀의 역할이다.
엑소좀은 종양에서 세포 내부의 생물학적 물질들을 전달하기 때문에 종양의 진행 및 전이에 중요한 요소로 알려져 있다. 리포좀이 항암 약물을 엑소좀에 탑재하면, 엑소좀이 이동하는 종양 내의 모든 위치로 약물이 전달됨으로써 질병이 치료되는 것이 연구의 핵심이다.
연구팀은 이 기술을 이용해 빛에 반응해 항암효과를 내는 광과민제를 종양이 이식된 실험용 쥐에 주입했다. 이후 종양 부위에 빛을 노출시켜 항암효과를 유도한 후 분석한 결과 종양조직 전역에서 항암효과를 관찰할 수 있었다.
연구팀의 핵심 성과는 종양 및 다른 질병들의 미세 환경을 파악해 질병에 대항하는 맞춤형 약물전달 기술 개발의 발판을 마련한 것이다.
연구팀은 이 기술을 제약회사에서 개발 중인 항암제에 적용해 약물전달이 어려운 악성 종양의 치료효과를 실험 진행 중이다.
박 교수는 “엑소좀이 세포에서 끊임없이 분비되는 특성과 주변 세포로 생물학적 물질을 전달하는 특성을 응용해 종양 중심부까지 약물을 전달 가능하게 만든 최초의 연구”라고 말했다.
박지호 교수 지도아래 이준성 박사, 김지영 석사가 주 저자로 참여한 이번 연구는 한국연구재단이 추진하는 신진연구자지원사업, 글로벌프론티어사업, 미래유망융합기술파이오니어사업의 지원을 받아 수행됐다.
□ 그림설명
그림 1. 종양 전역에 약물이 골고루 전달되게 해 항암효과를 높이는 새 종양투과 약물전달 나노기술
세포막과 결합하는 리포좀에 의해서 세포로 전달된 물질이 그 세포가 분비하는 엑소좀에 효율적으로 탑재돼 주변세포로 전달되는 과정을 보여주는 모식도(좌). 이러한 엑소좀기반 세포간 약물전달이 실제로 종양 스페로이드 및 생체 내 종양모델에서 관찰된 결과들 (우).
2015.04.06 조회수 17425