%EC%BB%A4%EB%AE%A4%EB%8B%88%EC%BC%80%EC%9D%B4%EC%85%98
-
 새 인공 형광 단백질 나노 조립체 개발
정 용 원 교수
우리 대학 화학과 정용원 교수 연구팀이 새로운 모양과 다양한 크기의 인공적 형광 단백질 나노 조립체를 개발했다.
이 단백질 나노 조립체 연구로 단백질 기반 신약 및 백신 개발 등 새로운 나노구조체 분야에 활발한 적용이 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 14일자 온라인 판에 게재됐다.
우리 몸의 필수 구성요소인 단백질은 나노미터 크기의 특성과 더불어 무한한 기능과 구조를 갖고 있다는 점에서 새로운 물질 및 구조체 개발에 매우 적합한 것으로 알려져 있다.
특히 단백질 다수가 조립된 다중 조립체는 새로운 성질과 모양, 크기를 가지며 생체친화적인 나노 구조체이기 때문에 많은 관심을 받고 있다. 단백질 다중 조립체는 다수의 단백질이 동시에 작용하기 때문에 결합력을 극대화 해 신약, 백신 기능 향상 연구에 중요한 방법론을 제시할 것으로 기대되기 때문이다.
이 조립체의 상업적, 연구적 이용을 위해선 조립된 단백질의 수가 정확히 조절되고, 다양한 크기의 조립체를 제작할 수 있어야 한다. 하지만 현재의 기술로는 조립체의 크기에 따라 정밀히 분리하는 것이 쉽지 않다.
연구팀은 문제 해결을 위해 인공적 형광 단백질 조립체를 세포 내 합성을 통해 다양한 크기로 제작했다. 또한 조립체 표면 개량을 통해 거대 생체분자의 안정성을 향상시켰고, 다양한 크기의 조립체를 분리할 수 있는 방법을 최초로 개발했다.
이 방법을 이용해 다각형 및 선형 배열을 갖는 형광 단백질 조립체 또한 제작해 관찰했다. 이 과정에서 나노크기 공간에서의 결합 단백질의 개수를 증가시켰고, 기존 단일 단백질보다 비약적으로 향상된 결합력을 확인했다.
정 교수는 “이번 단백질 조립체 제작 기술은 다양한 모양과 크기, 기능성을 갖는 새 조립체 제작의 기반이 될 것이다”며 “비약적으로 향상된 기능을 가진 단백질 신약, 백신, 혹은 결합 리셉터 연구에 핵심적 역할을 할 것”이라 말했다.
정용원 교수 지도 아래 김영은 박사과정 학생이 1저자로 참여한 이번 연구는 우리 대학 김호민 교수 연구팀이 참여했으며, 한국연구재단이 추진하는 글로벌프론티어사업(바이오나노 헬스가드 연구단) 및 기초연구실지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림 1. 형광단백질 조립체 모식도 및 전자현미경 사진
2015.05.26 조회수 15886
새 인공 형광 단백질 나노 조립체 개발
정 용 원 교수
우리 대학 화학과 정용원 교수 연구팀이 새로운 모양과 다양한 크기의 인공적 형광 단백질 나노 조립체를 개발했다.
이 단백질 나노 조립체 연구로 단백질 기반 신약 및 백신 개발 등 새로운 나노구조체 분야에 활발한 적용이 가능할 것으로 기대된다.
이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 14일자 온라인 판에 게재됐다.
우리 몸의 필수 구성요소인 단백질은 나노미터 크기의 특성과 더불어 무한한 기능과 구조를 갖고 있다는 점에서 새로운 물질 및 구조체 개발에 매우 적합한 것으로 알려져 있다.
특히 단백질 다수가 조립된 다중 조립체는 새로운 성질과 모양, 크기를 가지며 생체친화적인 나노 구조체이기 때문에 많은 관심을 받고 있다. 단백질 다중 조립체는 다수의 단백질이 동시에 작용하기 때문에 결합력을 극대화 해 신약, 백신 기능 향상 연구에 중요한 방법론을 제시할 것으로 기대되기 때문이다.
이 조립체의 상업적, 연구적 이용을 위해선 조립된 단백질의 수가 정확히 조절되고, 다양한 크기의 조립체를 제작할 수 있어야 한다. 하지만 현재의 기술로는 조립체의 크기에 따라 정밀히 분리하는 것이 쉽지 않다.
연구팀은 문제 해결을 위해 인공적 형광 단백질 조립체를 세포 내 합성을 통해 다양한 크기로 제작했다. 또한 조립체 표면 개량을 통해 거대 생체분자의 안정성을 향상시켰고, 다양한 크기의 조립체를 분리할 수 있는 방법을 최초로 개발했다.
이 방법을 이용해 다각형 및 선형 배열을 갖는 형광 단백질 조립체 또한 제작해 관찰했다. 이 과정에서 나노크기 공간에서의 결합 단백질의 개수를 증가시켰고, 기존 단일 단백질보다 비약적으로 향상된 결합력을 확인했다.
정 교수는 “이번 단백질 조립체 제작 기술은 다양한 모양과 크기, 기능성을 갖는 새 조립체 제작의 기반이 될 것이다”며 “비약적으로 향상된 기능을 가진 단백질 신약, 백신, 혹은 결합 리셉터 연구에 핵심적 역할을 할 것”이라 말했다.
정용원 교수 지도 아래 김영은 박사과정 학생이 1저자로 참여한 이번 연구는 우리 대학 김호민 교수 연구팀이 참여했으며, 한국연구재단이 추진하는 글로벌프론티어사업(바이오나노 헬스가드 연구단) 및 기초연구실지원사업의 지원을 받아 수행됐다.
□ 그림 설명
그림 1. 형광단백질 조립체 모식도 및 전자현미경 사진
2015.05.26 조회수 15886 -
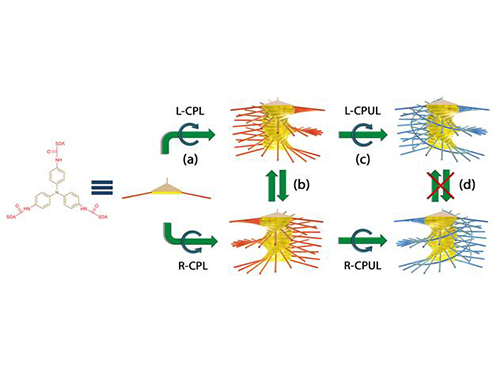 빛 이용 나선형 구조체 방향조절 기술 개발
김 상 율 교수
우리 대학 화학과 김상율 교수, 서명은 교수 연구팀이 빛의 파동을 이용해 특정한 방향으로 꼬인 나선형 나노 구조체를 형성하는 데 성공했다.
연구 결과는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 23일자 온라인 판에 게재됐다.
키랄성이란 오른손과 왼손처럼 모양은 같지만 서로 거울에 비친 형태를 가지는 물질을 말한다. 키랄성 물질은 돌리고 방향을 바꾸어도 서로 겹칠 수 없는 구조적 특성을 갖는다. 자연에 존재하는 DNA나 단백질 등을 구성하는 분자들은 이 중 한쪽 형태로만 이루어져 있다.
다량의 특정 키랄성 물질이 자연계에 존재하는 이유는 명백히 밝혀지지 않았다. 한 가지 가설은 유기 물질이 처음 생성될 시점에 우주로부터 나선을 따라 진동하는 빛의 파동인 원편광이 쬐어져, 원편광의 나선 방향이 유기 물질에 전달되어 한쪽 키랄성을 갖는 분자가 보다 많이 만들어 지게 됐다는 것이다.
연구팀은 이 가설에 입각해 원편광의 키랄성이 비키랄성 분자에 전달 및 증폭이 가능한지 알아보기 위해 빛에 반응하는 비키랄성 분자를 이용했다.
그리고 비키랄성 분자에 오른원편광, 왼원편광을 따로 노출시켜 분자들이 원편광의 방향에 따라 다른 방향의 나선을 그리며 쌓이는 것을 확인했다. 기존의 방법으로 나선형 구조체를 만들 때 반드시 키랄성 분자가 필요했던 것을 뒤집는 결과가 나온 것이다.
이처럼 단순히 특정 방향의 원편광을 비추는 것만으로 원하는 방향의 나선형 구조체를 만들 수 있고, 다시 반대 방향의 원편광을 비추면 나선의 방향을 뒤집는 것 또한 가능하다는 것을 증명했다.
뿐만 아니라 광중합을 이용해 나선형 구조체를 굳히는 방법을 개발해 구조체의 제작부터 방향을 고정시키는 전 과정을 빛을 이용해 제어하는 데 성공했다.
김상율 교수는 “원평광의 방향에 따라 비키랄성 분자의 자기조립 경로가 좌우되고, 자기조립을 통해 키랄성이 증폭되므로 결국 원편광의 방향이 나선 방향을 결정할 수 있다는 것이다”며 “키랄성의 기원에 대해 흥미로운 가능성을 제시하고 있다”고 말했다.
연구팀은 키랄성 센서를 만들거나 키랄성 분자를 분리하는 등의 응용 분야에 개발된 나선형 나노 구조체가 유용하게 사용될 것으로 전망했다.
한국연구재단 중견연구자 지원사업과 선도연구센터 육성사업의 지원을 받아 진행된 이번 연구는 김상율 교수와 서명은 교수가 교신 저자로, 김지성 학생이 제1저자로 참여했다.
□ 그림 설명
그림1. 빛에 의해 형성된 나노 구조체의 주사전자현미경 사진
그림2. 전체 실험과정 모식도
2015.04.30 조회수 12604
빛 이용 나선형 구조체 방향조절 기술 개발
김 상 율 교수
우리 대학 화학과 김상율 교수, 서명은 교수 연구팀이 빛의 파동을 이용해 특정한 방향으로 꼬인 나선형 나노 구조체를 형성하는 데 성공했다.
연구 결과는 국제 학술지 네이처 커뮤니케이션(Nature Communications) 23일자 온라인 판에 게재됐다.
키랄성이란 오른손과 왼손처럼 모양은 같지만 서로 거울에 비친 형태를 가지는 물질을 말한다. 키랄성 물질은 돌리고 방향을 바꾸어도 서로 겹칠 수 없는 구조적 특성을 갖는다. 자연에 존재하는 DNA나 단백질 등을 구성하는 분자들은 이 중 한쪽 형태로만 이루어져 있다.
다량의 특정 키랄성 물질이 자연계에 존재하는 이유는 명백히 밝혀지지 않았다. 한 가지 가설은 유기 물질이 처음 생성될 시점에 우주로부터 나선을 따라 진동하는 빛의 파동인 원편광이 쬐어져, 원편광의 나선 방향이 유기 물질에 전달되어 한쪽 키랄성을 갖는 분자가 보다 많이 만들어 지게 됐다는 것이다.
연구팀은 이 가설에 입각해 원편광의 키랄성이 비키랄성 분자에 전달 및 증폭이 가능한지 알아보기 위해 빛에 반응하는 비키랄성 분자를 이용했다.
그리고 비키랄성 분자에 오른원편광, 왼원편광을 따로 노출시켜 분자들이 원편광의 방향에 따라 다른 방향의 나선을 그리며 쌓이는 것을 확인했다. 기존의 방법으로 나선형 구조체를 만들 때 반드시 키랄성 분자가 필요했던 것을 뒤집는 결과가 나온 것이다.
이처럼 단순히 특정 방향의 원편광을 비추는 것만으로 원하는 방향의 나선형 구조체를 만들 수 있고, 다시 반대 방향의 원편광을 비추면 나선의 방향을 뒤집는 것 또한 가능하다는 것을 증명했다.
뿐만 아니라 광중합을 이용해 나선형 구조체를 굳히는 방법을 개발해 구조체의 제작부터 방향을 고정시키는 전 과정을 빛을 이용해 제어하는 데 성공했다.
김상율 교수는 “원평광의 방향에 따라 비키랄성 분자의 자기조립 경로가 좌우되고, 자기조립을 통해 키랄성이 증폭되므로 결국 원편광의 방향이 나선 방향을 결정할 수 있다는 것이다”며 “키랄성의 기원에 대해 흥미로운 가능성을 제시하고 있다”고 말했다.
연구팀은 키랄성 센서를 만들거나 키랄성 분자를 분리하는 등의 응용 분야에 개발된 나선형 나노 구조체가 유용하게 사용될 것으로 전망했다.
한국연구재단 중견연구자 지원사업과 선도연구센터 육성사업의 지원을 받아 진행된 이번 연구는 김상율 교수와 서명은 교수가 교신 저자로, 김지성 학생이 제1저자로 참여했다.
□ 그림 설명
그림1. 빛에 의해 형성된 나노 구조체의 주사전자현미경 사진
그림2. 전체 실험과정 모식도
2015.04.30 조회수 12604 -
 3차원 형상 제조 포토리소그래피 공정 기술 개발
<김신현 교수>
우리 대학 생명화학공학과 김신현(33) 교수 연구팀이 산소의 확산 원리를 이용해 3차원의 형상을 구현할 수 있는 포토리소그래피(photolithography) 공정 기술을 개발했다.
연구 결과는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 온라인 판에 게재됐으며, 동일 저널의 대표 그림(featured image)으로 선정됐다.
포토리소그래피는 빛을 노출시켜 원하는 상을 얻는 필름 카메라의 원리와 같다. 감광물질(photoresist)을 원판에 바르고 자외선을 노출시켜 빛을 받은 부분만 굳게 만든 뒤, 나머지 부분은 깎아내는 방식이다. 이는 반도체, 집적회로 등 미세패턴을 다루는 대부분의 산업계에서 널리 사용되고 있다.
하지만 기존 포토리소그래피 공정은 자외선이 항상 수직방향으로 내리쬐기 때문에 빛의 노출 방향에 따라 형성되는 미세패턴이 2차원으로만 제조되는 한계가 있었다.
연구팀은 3차원 패턴 제조를 위해 산소를 사용했다. 일반적으로 빛을 이용한 중합반응에서 산소는 물질이 굳게 되는 경화작용을 방해하는 요소로 알려져 있다. 하지만 김 교수 연구팀은 이 특성을 역으로 이용했다.
일부 영역에만 자외선을 노출시키면 그 부분만 산소의 농도가 감소하게 되고 그 외 영역의 산소의 농도는 유지된다. 농도의 차이로 인해 자외선이 노출된 영역으로 산소의 확산 현상이 발생한다.
이를 통해 기존에는 동일한 속도로 발생한 경화작용이 시간차를 두고 이뤄진다. 물질의 형성이 일정하지 않기 때문에 미세패턴의 모양도 다양해지고, 확산 방향과 속도를 의도적으로 조절함으로써 3차원 형상의 패턴 제작도 가능해지는 것이다.
이러한 신규 기술을 연속적으로 융합해 사용하면 더욱 복잡한 형상과 다양한 성분으로 구성이 가능하다. 자성 입자를 삽입해 자기장을 이용한 의료용 패치를 만들거나, 온도에 따라 팽창하고 수축하는 젤을 삽입해 곡면을 갖는 형태의 필름도 제작할 수 있다.
이 기술로 디스플레이 소자를 포함한 다양한 전자기기의 광학소자, 패치형 약물 전달체, 물과 기름에 젖지 않는 표면 등 3차원 미세패턴 및 미세입자 연구를 통해 구현 가능한 기술들의 상용화가 기대된다.
김 교수는 “3D 프린팅 기술은 혁신적이지만 미세형상 제어와 대량생산이 어려운 반면, 이 기술은 3차원의 미세패턴을 대량생산할 수 있다”며 “대부분의 학계와 산업계에서 포토리소그래피 장비를 쓰기 때문에 큰 파급효과가 있을 것”이라고 말했다.
연구팀은 연구 결과를 2013년 불의의 사고로 고인이 된 콜로이드 및 유체역학 분야의 세계적 대가 故 양승만 교수(前 생명화학공학과 교수)에게 헌정했다.
이번 연구는 심태섭 박사(현 펜실베니아 대학 연구원)가 주도했으며, 미래창조과학부 산하 한국연구재단의 중견연구자 지원사업으로 수행됐다.
□ 그림 설명
그림 1. 기존의 포토리소그래피 공정
그림 2. 기존 포토리소그래피 공정과 새로 개발된 포토리소그래피 공정
그림 3. 개발된 포토리소그래피 공정을 이용해 형성된 미세 구조 및 패턴
그림 4. 복잡한 형상과 성분 조합으로 이루어진 구조체
2015.03.25 조회수 15272
3차원 형상 제조 포토리소그래피 공정 기술 개발
<김신현 교수>
우리 대학 생명화학공학과 김신현(33) 교수 연구팀이 산소의 확산 원리를 이용해 3차원의 형상을 구현할 수 있는 포토리소그래피(photolithography) 공정 기술을 개발했다.
연구 결과는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 온라인 판에 게재됐으며, 동일 저널의 대표 그림(featured image)으로 선정됐다.
포토리소그래피는 빛을 노출시켜 원하는 상을 얻는 필름 카메라의 원리와 같다. 감광물질(photoresist)을 원판에 바르고 자외선을 노출시켜 빛을 받은 부분만 굳게 만든 뒤, 나머지 부분은 깎아내는 방식이다. 이는 반도체, 집적회로 등 미세패턴을 다루는 대부분의 산업계에서 널리 사용되고 있다.
하지만 기존 포토리소그래피 공정은 자외선이 항상 수직방향으로 내리쬐기 때문에 빛의 노출 방향에 따라 형성되는 미세패턴이 2차원으로만 제조되는 한계가 있었다.
연구팀은 3차원 패턴 제조를 위해 산소를 사용했다. 일반적으로 빛을 이용한 중합반응에서 산소는 물질이 굳게 되는 경화작용을 방해하는 요소로 알려져 있다. 하지만 김 교수 연구팀은 이 특성을 역으로 이용했다.
일부 영역에만 자외선을 노출시키면 그 부분만 산소의 농도가 감소하게 되고 그 외 영역의 산소의 농도는 유지된다. 농도의 차이로 인해 자외선이 노출된 영역으로 산소의 확산 현상이 발생한다.
이를 통해 기존에는 동일한 속도로 발생한 경화작용이 시간차를 두고 이뤄진다. 물질의 형성이 일정하지 않기 때문에 미세패턴의 모양도 다양해지고, 확산 방향과 속도를 의도적으로 조절함으로써 3차원 형상의 패턴 제작도 가능해지는 것이다.
이러한 신규 기술을 연속적으로 융합해 사용하면 더욱 복잡한 형상과 다양한 성분으로 구성이 가능하다. 자성 입자를 삽입해 자기장을 이용한 의료용 패치를 만들거나, 온도에 따라 팽창하고 수축하는 젤을 삽입해 곡면을 갖는 형태의 필름도 제작할 수 있다.
이 기술로 디스플레이 소자를 포함한 다양한 전자기기의 광학소자, 패치형 약물 전달체, 물과 기름에 젖지 않는 표면 등 3차원 미세패턴 및 미세입자 연구를 통해 구현 가능한 기술들의 상용화가 기대된다.
김 교수는 “3D 프린팅 기술은 혁신적이지만 미세형상 제어와 대량생산이 어려운 반면, 이 기술은 3차원의 미세패턴을 대량생산할 수 있다”며 “대부분의 학계와 산업계에서 포토리소그래피 장비를 쓰기 때문에 큰 파급효과가 있을 것”이라고 말했다.
연구팀은 연구 결과를 2013년 불의의 사고로 고인이 된 콜로이드 및 유체역학 분야의 세계적 대가 故 양승만 교수(前 생명화학공학과 교수)에게 헌정했다.
이번 연구는 심태섭 박사(현 펜실베니아 대학 연구원)가 주도했으며, 미래창조과학부 산하 한국연구재단의 중견연구자 지원사업으로 수행됐다.
□ 그림 설명
그림 1. 기존의 포토리소그래피 공정
그림 2. 기존 포토리소그래피 공정과 새로 개발된 포토리소그래피 공정
그림 3. 개발된 포토리소그래피 공정을 이용해 형성된 미세 구조 및 패턴
그림 4. 복잡한 형상과 성분 조합으로 이루어진 구조체
2015.03.25 조회수 15272 -
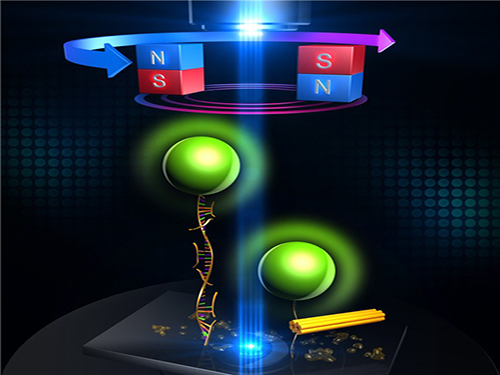 신개념 DNA 나노구조 형성법 개발
우리 학교 물리학과 윤태영 교수 연구팀이 자기집게를 이용해 DNA 나노구조의 형성을 실시간으로 관측 및 유도하며 새로운 DNA 나노구조를 형성하는 방법을 개발했다.
이 기술은 열처리를 사용하는 기존의 방법과는 전혀 다른 역학적 방법을 이용해 DNA 나노구조 형성을 10분 이내로 빠르게 끝낼 수 있는 게 큰 특징이다.
2006년 개발된 DNA 오리가미 기술은 하나의 긴 뼈대 DNA를 여러 개의 짧은 ‘스테이플러’ DNA들을 이용해 종이접기 하듯 접어서 임의의 형태를 가지는 DNA 기반의 나노구조를 만들어 낼 수 있는 방법으로 DNA 나노기술에서 중요한 위치를 차지하는 기법이었다.
하지만 현재까지 사용되는 열처리 과정을 통한 DNA 나노구조 형성 방법에서는 DNA들 사이의 모든 상호작용들이 동시에 일어나기 때문에 DNA의 상태를 도중에 제어하기가 매우 어려웠다. 따라서 일반적으로 수십 시간이 걸리는 열처리 과정을 여러 번 반복해 최적의 조건을 찾아야 했다.
윤 교수 연구팀은 DNA 분자 하나에 역학적 힘을 가하면서 동시에 DNA의 상태도 측정할 수 있는 단분자 자기집게 기술을 이용해 DNA 나노구조의 형성과정을 유도하는 동시에 관측했다.
기존 열처리 과정의 첫 단계인 고온 열처리에서는 긴 뼈대 DNA의 내부구조가 풀리게 되는데 연구팀은 이 상태를 유도하기 위해 긴 뼈대 DNA의 한쪽을 유리 표면에 부착하고 다른 쪽에 자성체를 부착한 뒤 자기력을 이용해 잡아당겨 뼈대 DNA의 내부구조를 풀어냈다.
이렇게 뼈대 DNA의 내부구조를 풀어내면 숨겨져 있던 반응부위들이 상온에서 드러나기 때문에 열처리 과정과는 달리 스테이플러 DNA들이 1분 안에 빠르게 붙을 수 있다.
스테이플러 DNA들이 모두 붙은 이후에 자기력을 제거하면 자가조립과정을 통해 하나의 스테이플러 DNA가 뼈대 DNA의 다른 여러 부분에 붙게 되면서 구조가 접히게 되는 것이다.
윤태영 교수는 “기존의 열처리 방법에서는 DNA들의 반응이 동시에 섞여서 일어나기 때문에 어떤 온도에서 어떤 반응이 일어나는지 구분할 수 없었다”며 “자기집게를 이용해 구조형성 과정을 일련의 잘 연구된 DNA 반응들로 분해하면서 동시에 구조형성에 걸리는 시간도 10분 정도로 단축할 수 있었다”고 말했다.
더불어 “이번에 개발한 나노구조 형성방법을 이용하면 더욱 고도로 프로그램된 DNA 나노구조의 형성이 가능할 것”이라고 덧붙였다.
한편, 물리학과 윤태영 교수 지도하에 배우리 박사가 주도한 이번 연구는 세계적인 과학저널 네이처가 발행하는 자매지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 4일자 온라인판에 게재됐다.
그림1. 단분자 자기집게를 이용해 DNA 나노구조의 형성을 프로그램 하는 것에 대한 개념도
그림2. 단분자 자기집게를 이용하여 DNA 나노구조의 형성을 실시간으로 유도하고 관찰한 결과. 약 8분 만에 21 나노미터 크기의 DNA나노구조 형성이 완료 된 것을 볼 수 있다.
2015.01.02 조회수 13173
신개념 DNA 나노구조 형성법 개발
우리 학교 물리학과 윤태영 교수 연구팀이 자기집게를 이용해 DNA 나노구조의 형성을 실시간으로 관측 및 유도하며 새로운 DNA 나노구조를 형성하는 방법을 개발했다.
이 기술은 열처리를 사용하는 기존의 방법과는 전혀 다른 역학적 방법을 이용해 DNA 나노구조 형성을 10분 이내로 빠르게 끝낼 수 있는 게 큰 특징이다.
2006년 개발된 DNA 오리가미 기술은 하나의 긴 뼈대 DNA를 여러 개의 짧은 ‘스테이플러’ DNA들을 이용해 종이접기 하듯 접어서 임의의 형태를 가지는 DNA 기반의 나노구조를 만들어 낼 수 있는 방법으로 DNA 나노기술에서 중요한 위치를 차지하는 기법이었다.
하지만 현재까지 사용되는 열처리 과정을 통한 DNA 나노구조 형성 방법에서는 DNA들 사이의 모든 상호작용들이 동시에 일어나기 때문에 DNA의 상태를 도중에 제어하기가 매우 어려웠다. 따라서 일반적으로 수십 시간이 걸리는 열처리 과정을 여러 번 반복해 최적의 조건을 찾아야 했다.
윤 교수 연구팀은 DNA 분자 하나에 역학적 힘을 가하면서 동시에 DNA의 상태도 측정할 수 있는 단분자 자기집게 기술을 이용해 DNA 나노구조의 형성과정을 유도하는 동시에 관측했다.
기존 열처리 과정의 첫 단계인 고온 열처리에서는 긴 뼈대 DNA의 내부구조가 풀리게 되는데 연구팀은 이 상태를 유도하기 위해 긴 뼈대 DNA의 한쪽을 유리 표면에 부착하고 다른 쪽에 자성체를 부착한 뒤 자기력을 이용해 잡아당겨 뼈대 DNA의 내부구조를 풀어냈다.
이렇게 뼈대 DNA의 내부구조를 풀어내면 숨겨져 있던 반응부위들이 상온에서 드러나기 때문에 열처리 과정과는 달리 스테이플러 DNA들이 1분 안에 빠르게 붙을 수 있다.
스테이플러 DNA들이 모두 붙은 이후에 자기력을 제거하면 자가조립과정을 통해 하나의 스테이플러 DNA가 뼈대 DNA의 다른 여러 부분에 붙게 되면서 구조가 접히게 되는 것이다.
윤태영 교수는 “기존의 열처리 방법에서는 DNA들의 반응이 동시에 섞여서 일어나기 때문에 어떤 온도에서 어떤 반응이 일어나는지 구분할 수 없었다”며 “자기집게를 이용해 구조형성 과정을 일련의 잘 연구된 DNA 반응들로 분해하면서 동시에 구조형성에 걸리는 시간도 10분 정도로 단축할 수 있었다”고 말했다.
더불어 “이번에 개발한 나노구조 형성방법을 이용하면 더욱 고도로 프로그램된 DNA 나노구조의 형성이 가능할 것”이라고 덧붙였다.
한편, 물리학과 윤태영 교수 지도하에 배우리 박사가 주도한 이번 연구는 세계적인 과학저널 네이처가 발행하는 자매지인 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 4일자 온라인판에 게재됐다.
그림1. 단분자 자기집게를 이용해 DNA 나노구조의 형성을 프로그램 하는 것에 대한 개념도
그림2. 단분자 자기집게를 이용하여 DNA 나노구조의 형성을 실시간으로 유도하고 관찰한 결과. 약 8분 만에 21 나노미터 크기의 DNA나노구조 형성이 완료 된 것을 볼 수 있다.
2015.01.02 조회수 13173 -
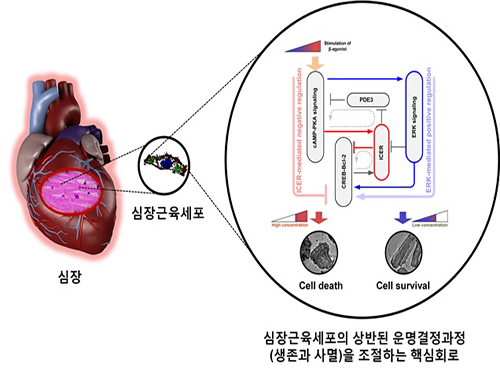 심장세포의 핵심 신호전달경로 스위치 규명
심장근육세포내 베타수용체 신호전달경로의 자극 세기에 따라 세포의 생존과 사멸이라는 상반된 운명이 어떻게 결정되는지 그 근본원리가 우리 학교 연구진에 의해 규명되었다. 향후 심부전을 비롯한 다양한 심장질환의 치료에 활용될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 신성영 박사(제1저자), 이호성 박사과정학생, 강준혁 박사과정학생이 참여하였으며, 광주과학기술원 생명과학부 김도한 교수팀이 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약/전략연구)과 바이오·의료기술개발사업 및 KAIST 미래형 시스템헬스케어사업의 지원으로 수행되었고, 연구결과는 네이처(Nature) 자매지인 네이처 커뮤니케이션스(Nature Communications)지에 12월 17일자로 게재되었다. * (논문명) The switching role of β-adrenergic receptor signalling in cell survival or death decision of cardiomyocytes
베타수용체 신호전달경로는 심장근육세포의 생존을 촉진(베타2수용체 매개)하지만 동시에 심장근육세포의 사멸을 유도하기도 하여 심장독성을 유발(베타1수용체 매개)함으로써 심부전 등 다양한 심장질환을 일으킨다. 지금까지 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정(생존 혹은 사멸)에 대한 근본 원리를 밝히고자 하는 많은 시도가 있어왔으나 아직 밝혀지지 않았다. ※ 베타수용체(β-adrenergic receptor): 심장근육세포의 세포막에 존재하는 단백질로서 에피네프린이나 노르에피네프린 등의 신경호르몬에 의해 자극받으면 심장근육세포가 더 강하고 빠르게 수축하도록 촉진하는 신호를 전달한다.
연구팀은 대규모 컴퓨터시뮬레이션 분석과 세포생물학 실험의 융합연구인 시스템생물학 연구를 통하여 ERK* 신호전달경로와 ICER** 신호전달경로가 매개하는 피드포워드회로가 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치임을 밝혀냈다.
* ERK(Extracellular signal-regulated kinases): 세포생존에 관여하는 신호전달분자 ** ICER(Inducible cAMP early repressor): 세포사멸에 관여하는 신호전달분자
약한 베타수용체의 자극에 대해서는 ERK 신호전달경로가 활성화되고 이로 인하여 Bcl-2*** 단백질의 발현량이 증가되어 심장근육세포의 생존이 촉진되지만, 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로가 활성화되고 Bcl-2 단백질의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발되는 것이다. *** Bcl-2(B-cell lymphoma 2): 세포생존 촉진에 핵심적인 역할을 하는 신호전달분자
또한 연구팀은 시스템생물학적 접근을 통해 실제 심부전 환자에게 널리 사용되는 약물인 베타차단제(β-blocker)****의 작동원리를 밝혀내었다. 심장근육세포에 베타1차단제를 처리하였을 때 강한 베타수용체 자극에서의 Bcl-2 발현량이 증가하고 이로 인하여 심장근육세포의 생존율이 향상되어 세포보호효과가 일어난다는 것을 발견함으로써, 베타차단제의 근본약리기전을 신호전달경로 수준에서 규명하였다. **** 베타차단제(β-blocker): 베타수용체의 활성화를 저해하는 약물이며, 심부전의 진행을 억제시키는 효과가 있어서 임상에서 가장 널리 처방되는 심부전 치료약물이다.
조광현 교수는 “정보기술(IT)과 생명과학(BT)의 융합연구인 시스템생물학 연구를 통해 지금껏 밝혀지지 않았던 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정에 대한 핵심 원리를 성공적으로 규명한 것으로 향후 심장근육세포운명의 제어 및 이를 통한 심부전 등의 다양한 심장질환 치료에 널리 활용될 것으로 기대된다.”고 밝혔다.
조광현 교수 연구팀은 IT와 BT가 융합된 시스템생물학 분야를 세계 최초로 개척해왔으며 특히 인체의 복잡한 질병과 관련된 신호전달네트워크의 모델링과 시뮬레이션 분석, 실험적 증명에 관한 혁신적인 연구를 수행해오고 있다. 지금까지 140여편의 국제저널논문을 게재하였으며, 2014년에는 Cell, Science, Nature 자매지에 연이어 연구성과를 게재하였다.
심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명 및 제어기술 개발: 수학모델링과 대규모 컴퓨터시뮬레이션 분석을 통해 규명된 심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명. ERK 신호전달경로와 ICER 신호전달경로가 매개하는 피드포워드회로는 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치이다. 약한 베타수용체의 자극에 대해서는 ERK 신호전달경로(파란색 화살표)가 활성화되고 이로 인하여 Bcl-2의 발현량이 증가되어 결과적으로 심장근육세포의 생존이 촉진된다. 반면 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로(빨간색 화살표)가 활성화되고, 이로 인해 Bcl-2의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발된다. 이로서 심장근육세포의 사멸을 방지하면서 심장박동의 기능을 유지시킬 수 있는 원천제어기술의 토대가 마련되었다.
2014.12.26 조회수 20978
심장세포의 핵심 신호전달경로 스위치 규명
심장근육세포내 베타수용체 신호전달경로의 자극 세기에 따라 세포의 생존과 사멸이라는 상반된 운명이 어떻게 결정되는지 그 근본원리가 우리 학교 연구진에 의해 규명되었다. 향후 심부전을 비롯한 다양한 심장질환의 치료에 활용될 것으로 기대된다.
우리 학교 바이오및뇌공학과 조광현 석좌교수(교신저자)가 주도하고 신성영 박사(제1저자), 이호성 박사과정학생, 강준혁 박사과정학생이 참여하였으며, 광주과학기술원 생명과학부 김도한 교수팀이 공동으로 수행한 이번 연구는 미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업(도약/전략연구)과 바이오·의료기술개발사업 및 KAIST 미래형 시스템헬스케어사업의 지원으로 수행되었고, 연구결과는 네이처(Nature) 자매지인 네이처 커뮤니케이션스(Nature Communications)지에 12월 17일자로 게재되었다. * (논문명) The switching role of β-adrenergic receptor signalling in cell survival or death decision of cardiomyocytes
베타수용체 신호전달경로는 심장근육세포의 생존을 촉진(베타2수용체 매개)하지만 동시에 심장근육세포의 사멸을 유도하기도 하여 심장독성을 유발(베타1수용체 매개)함으로써 심부전 등 다양한 심장질환을 일으킨다. 지금까지 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정(생존 혹은 사멸)에 대한 근본 원리를 밝히고자 하는 많은 시도가 있어왔으나 아직 밝혀지지 않았다. ※ 베타수용체(β-adrenergic receptor): 심장근육세포의 세포막에 존재하는 단백질로서 에피네프린이나 노르에피네프린 등의 신경호르몬에 의해 자극받으면 심장근육세포가 더 강하고 빠르게 수축하도록 촉진하는 신호를 전달한다.
연구팀은 대규모 컴퓨터시뮬레이션 분석과 세포생물학 실험의 융합연구인 시스템생물학 연구를 통하여 ERK* 신호전달경로와 ICER** 신호전달경로가 매개하는 피드포워드회로가 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치임을 밝혀냈다.
* ERK(Extracellular signal-regulated kinases): 세포생존에 관여하는 신호전달분자 ** ICER(Inducible cAMP early repressor): 세포사멸에 관여하는 신호전달분자
약한 베타수용체의 자극에 대해서는 ERK 신호전달경로가 활성화되고 이로 인하여 Bcl-2*** 단백질의 발현량이 증가되어 심장근육세포의 생존이 촉진되지만, 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로가 활성화되고 Bcl-2 단백질의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발되는 것이다. *** Bcl-2(B-cell lymphoma 2): 세포생존 촉진에 핵심적인 역할을 하는 신호전달분자
또한 연구팀은 시스템생물학적 접근을 통해 실제 심부전 환자에게 널리 사용되는 약물인 베타차단제(β-blocker)****의 작동원리를 밝혀내었다. 심장근육세포에 베타1차단제를 처리하였을 때 강한 베타수용체 자극에서의 Bcl-2 발현량이 증가하고 이로 인하여 심장근육세포의 생존율이 향상되어 세포보호효과가 일어난다는 것을 발견함으로써, 베타차단제의 근본약리기전을 신호전달경로 수준에서 규명하였다. **** 베타차단제(β-blocker): 베타수용체의 활성화를 저해하는 약물이며, 심부전의 진행을 억제시키는 효과가 있어서 임상에서 가장 널리 처방되는 심부전 치료약물이다.
조광현 교수는 “정보기술(IT)과 생명과학(BT)의 융합연구인 시스템생물학 연구를 통해 지금껏 밝혀지지 않았던 베타수용체 신호전달경로에 의해 조절되는 심장근육세포의 상반된 운명결정과정에 대한 핵심 원리를 성공적으로 규명한 것으로 향후 심장근육세포운명의 제어 및 이를 통한 심부전 등의 다양한 심장질환 치료에 널리 활용될 것으로 기대된다.”고 밝혔다.
조광현 교수 연구팀은 IT와 BT가 융합된 시스템생물학 분야를 세계 최초로 개척해왔으며 특히 인체의 복잡한 질병과 관련된 신호전달네트워크의 모델링과 시뮬레이션 분석, 실험적 증명에 관한 혁신적인 연구를 수행해오고 있다. 지금까지 140여편의 국제저널논문을 게재하였으며, 2014년에는 Cell, Science, Nature 자매지에 연이어 연구성과를 게재하였다.
심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명 및 제어기술 개발: 수학모델링과 대규모 컴퓨터시뮬레이션 분석을 통해 규명된 심장근육세포의 상반된 운명결정과정을 조절하는 핵심회로의 규명. ERK 신호전달경로와 ICER 신호전달경로가 매개하는 피드포워드회로는 심장근육세포의 생존과 사멸을 결정하는 핵심 분자스위치이다. 약한 베타수용체의 자극에 대해서는 ERK 신호전달경로(파란색 화살표)가 활성화되고 이로 인하여 Bcl-2의 발현량이 증가되어 결과적으로 심장근육세포의 생존이 촉진된다. 반면 강한 베타수용체의 자극에 대해서는 ICER 신호전달경로(빨간색 화살표)가 활성화되고, 이로 인해 Bcl-2의 발현량이 감소하게 되어 심장근육세포의 사멸이 유발된다. 이로서 심장근육세포의 사멸을 방지하면서 심장박동의 기능을 유지시킬 수 있는 원천제어기술의 토대가 마련되었다.
2014.12.26 조회수 20978 -
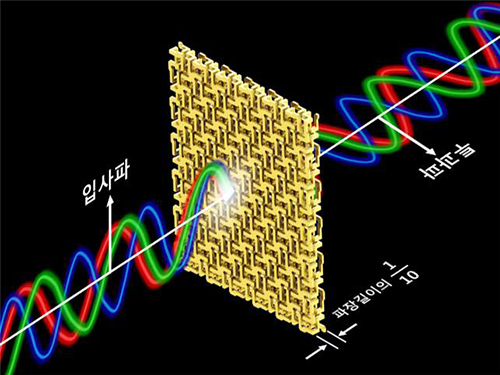 초광대역 편광 회전 3D 메타물질 개발
우리 학교 기계공학전공 민범기 교수는 자연에 존재하지 않는 인공적인 메타물질*을 통해 빛의 편광을 광대역에서 제어하는데 성공했다.
*메타물질 : 자연계에 존재하지 않는 특성을 구현하기 위해 빛의 파장보다 작은 인공원자로 구성된 물질
향후 이 기술을 활용해 광대역 통신 및 디스플레이에 적용 가능한 다양한 광대역 광소자가 개발될 수 있을 것으로 기대된다.
레이저와 같이 편광돼 있는 빛으로 어떠한 물질이나 구조를 분석할 때는 일반적으로 빛의 편광 상태에 따라 결과가 달라지기 때문에 광학 실험실에서는 여러 가지 방법으로 빛의 편광을 조절해 사용한다.
이때 흔히 사용되는 것이 파장판이나 광활성 물질인데 이러한 광학 소자들의 성능은 파장에 따라 크게 달라지기 때문에 광대역에서 빛의 편광 조절기로 사용하기에는 한계가 있었다.
최근까지 강한 공진을 갖는 메타물질을 통해 매우 큰 광활성을 보이는 인공 물질을 개발하려는 연구가 활발히 진행돼 왔으나, 공진 주파수 부근에서 필연적으로 나타나는 분산으로 인해 광대역에서의 활용이 불가능했다.
* 광활성 : 특정 물질에서 빛이 진행할 때 빛의 편광면이 회전하는 현상 * 분산 : 파장에 따라 굴절률 등 빛의 성질이 달라지는 현상
민 교수 연구팀은 빛의 파장보다 매우 작은 크기의 나선형 구조들을 원대칭을 이루어 배열하고 연결해 빛의 파장 대비 약 1/10의 매우 얇은 두께에서도 편광을 파장에 상관없이 일정하게 회전 시킬 수 있음을 이론적, 실험적으로 증명했다. 이론 검증을 위한 실험은 마이크로파 대역에서 이뤄졌다.
‘광대역 편광 회전 3D 메타물질’은 입사된 마이크로파의 편광을 0.1GHz 부터 40GHz 까지 주파수에 상관없이 45도 회전시키는 것으로 나타났다. 이러한 비분산 성질은 매우 비자연적인 것으로, 이 정도의 넓은 파장 대역에서 성질이 변하지 않는 물질은 자연계에서 찾기 힘들다.
이와 함께 민 교수팀은 편광 회전량을 결정하는 성질인 ‘나사선성(chirality)’을 파장에 비례한 값을 갖도록 메타 물질의 구조를 인위적으로 설계해 광대역 비분산 편광 회전 성질을 구현해냈다.
민 교수는 “이번 연구는 파장보다 매우 얇은 두께에서도 빛의 편광을 광대역에서 효과적으로 조절할 수 있어 초박형 광대역 광소자를 구현하기 위한 가능성을 열었다”고 연구 의의를 밝혔다.
미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업과 파동에너지 극한제어 사업의 지원을 받아 민범기 교수 지도아래 박현성 박사과정 학생(제1저자, 27)이 주도한 이번 연구결과는 네이처(Nature)의 자매지인 네이처 커뮤니케이션즈(Nature Communications) 11월 17일자 온라인 판에 게재됐다.
그림1. 3D 프린터를 통해 제작된 ‘초광대역 편광 회전 3D 메타물질’
그림2. ‘초광대역 편광 회전 3D 메타물질’의 개념도
2014.11.25 조회수 17139
초광대역 편광 회전 3D 메타물질 개발
우리 학교 기계공학전공 민범기 교수는 자연에 존재하지 않는 인공적인 메타물질*을 통해 빛의 편광을 광대역에서 제어하는데 성공했다.
*메타물질 : 자연계에 존재하지 않는 특성을 구현하기 위해 빛의 파장보다 작은 인공원자로 구성된 물질
향후 이 기술을 활용해 광대역 통신 및 디스플레이에 적용 가능한 다양한 광대역 광소자가 개발될 수 있을 것으로 기대된다.
레이저와 같이 편광돼 있는 빛으로 어떠한 물질이나 구조를 분석할 때는 일반적으로 빛의 편광 상태에 따라 결과가 달라지기 때문에 광학 실험실에서는 여러 가지 방법으로 빛의 편광을 조절해 사용한다.
이때 흔히 사용되는 것이 파장판이나 광활성 물질인데 이러한 광학 소자들의 성능은 파장에 따라 크게 달라지기 때문에 광대역에서 빛의 편광 조절기로 사용하기에는 한계가 있었다.
최근까지 강한 공진을 갖는 메타물질을 통해 매우 큰 광활성을 보이는 인공 물질을 개발하려는 연구가 활발히 진행돼 왔으나, 공진 주파수 부근에서 필연적으로 나타나는 분산으로 인해 광대역에서의 활용이 불가능했다.
* 광활성 : 특정 물질에서 빛이 진행할 때 빛의 편광면이 회전하는 현상 * 분산 : 파장에 따라 굴절률 등 빛의 성질이 달라지는 현상
민 교수 연구팀은 빛의 파장보다 매우 작은 크기의 나선형 구조들을 원대칭을 이루어 배열하고 연결해 빛의 파장 대비 약 1/10의 매우 얇은 두께에서도 편광을 파장에 상관없이 일정하게 회전 시킬 수 있음을 이론적, 실험적으로 증명했다. 이론 검증을 위한 실험은 마이크로파 대역에서 이뤄졌다.
‘광대역 편광 회전 3D 메타물질’은 입사된 마이크로파의 편광을 0.1GHz 부터 40GHz 까지 주파수에 상관없이 45도 회전시키는 것으로 나타났다. 이러한 비분산 성질은 매우 비자연적인 것으로, 이 정도의 넓은 파장 대역에서 성질이 변하지 않는 물질은 자연계에서 찾기 힘들다.
이와 함께 민 교수팀은 편광 회전량을 결정하는 성질인 ‘나사선성(chirality)’을 파장에 비례한 값을 갖도록 메타 물질의 구조를 인위적으로 설계해 광대역 비분산 편광 회전 성질을 구현해냈다.
민 교수는 “이번 연구는 파장보다 매우 얇은 두께에서도 빛의 편광을 광대역에서 효과적으로 조절할 수 있어 초박형 광대역 광소자를 구현하기 위한 가능성을 열었다”고 연구 의의를 밝혔다.
미래창조과학부와 한국연구재단이 추진하는 중견연구자지원사업과 파동에너지 극한제어 사업의 지원을 받아 민범기 교수 지도아래 박현성 박사과정 학생(제1저자, 27)이 주도한 이번 연구결과는 네이처(Nature)의 자매지인 네이처 커뮤니케이션즈(Nature Communications) 11월 17일자 온라인 판에 게재됐다.
그림1. 3D 프린터를 통해 제작된 ‘초광대역 편광 회전 3D 메타물질’
그림2. ‘초광대역 편광 회전 3D 메타물질’의 개념도
2014.11.25 조회수 17139 -
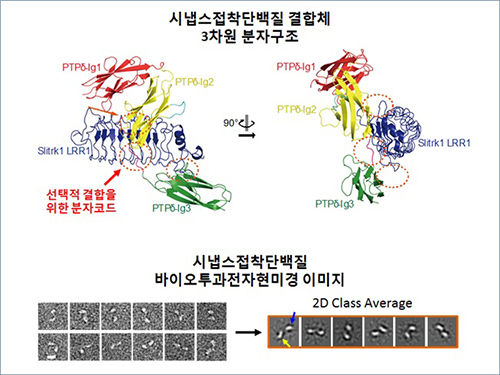 신경세포 연결해주는 접착단백질 결합구조 규명
국내 연구진이 신경세포 연결을 주관하는 시냅스접착단백질**의 3차원 복합체 구조를 규명함으로써, 시냅스* 형성초기 기전을 제시하였다. 시냅스 이상으로 인한 강박증이나 조울증 등 다양한 뇌질환의 발병기전 규명과 치료제 개발에 활용될 것으로 기대된다.
* 시냅스 : 신경전달물질의 분비와 흡수가 일어나는 1,000억 여 개에 달하는 신경세포의 접합부위로 학습과 기억, 감각, 운동 등을 조절하는 뇌 활동의 기본단위이다. ** 시냅스접착단백질 : 벨크로처럼 두 개의 신경세포를 단단하게 연결해 시냅스 형성을 돕는 신경세포막에 존재하는 단백질
우리 학교 의과학대학원 김호민 교수와 연세대 생화학과 고재원 교수 (이상 교신저자)가 주도하고, 연세대 엄지원 연구교수, KAIST 김기훈 석사과정 연구원 및 을지대 박범석 교수(이상 제1저자)가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 지원하는 신진연구자지원사업, 중견연구자지원사업(핵심연구) 및 교육부 학문후속세대양성사업의 지원으로 수행되었고 자연과학 분야 국제학술지 네이처 커뮤니케이션스(Nature Communications)지 온라인판 11월 14일자에 게재되었다. (논문명 : Structural basis for LAR-RPTP/Slitrk complex-mediated synaptic adhesion)
신경세포막에 존재하는 단백질 슬릿트랙*은 다른 신경세포의 막에 존재하는 단백질 LAR-RPTP**와 복합체를 이뤄 초기 시냅스 형성과 신경세포의 흥분과 억제간의 균형 유지에 관여하는 것으로 알려져 있었다.
* 슬릿트랙(Slitrk) : 뇌의 중추신경계에서 강하게 발현되는 단백질. 이 유전자가 결핍된 형질전환생쥐의 경우 다양한 뇌질환 표현형을 나타냄. 최근 LAR-RPTP와 결합하여 시냅스 형성을 조절하는 시냅스접착단백질임이 밝혀짐
** LAR-RPTP : 신경세포의 초기 발달과정에서 중요한 역할을 하는 단백질 군. 최근 시냅스 형성에 관계된 주요 기능들이 조금씩 밝혀지면서 새롭게 주목 받기 시작한시냅스접착단백질
이들 두 단백질의 이상은 시냅스의 기능이상을 유발해 자폐증, 정신분열증, 간질, 강박증 및 조울증 같은 다양한 신경·정신질환을 유발하는 것으로 알려져 있지만 두 단백질의 결합구조와 구체적인 작용기전이 규명되지 않아 치료제 개발에 한계가 있었다.
연구팀은 단백질 결정학기술과 바이오투과전자현미경을 활용해 두 시냅스접착단백질(슬릿트랙(Slitrk)과 LAR-RPTP)이 결합된 3차원 구조를 밝혀내고 이들 상호간의 결합의 핵심이 되는 부위를 찾아냈다.
나아가 두 시냅스접착 단백질이 결합한 후 클러스터를 형성하면서 시냅스 생성이 유도된다는 것을 규명하였다.
김호민 교수는 “시냅스접착단백질의 기능 이상으로 나타나는 다양한 뇌질환의 발병기전 이해에 큰 밑거름이 될 것. 특히, 단백질 구조생물학과 신경생물학의 유기적인 협력연구를 통하여 우수한 성과를 거둔 대표적 사례가 될 것”이라고 밝혔다. 고재원 교수는 “시냅스접착단백질 분자기전을 이해함으로써 시냅스 형성 관련 연구의 새로운 방향을 제시할 것”이라고 연구의의를 밝혔다.
그림 1. 시냅스접착단백질 결합체 구조 및 슬릿트랫 바이오투과전자현미경 이미지
(위) 시냅스접착단백질 슬릿트랙(Slitrk)과 LAR-RPTP 결합체 분자구조
단백질결정학을 통해 시냅스접착단백질 결합체 분자구조를 분석한 결과 두 시냅스접착단백질의 결합에 중추적인 역할을 하는 핵심적인 아미노산을 도출할 수 있었다.
특히 LAR-RPTP 단백질에 위치한 선택적 접합(Alternative splicing) 부위(붉은색 화살표)가 슬릿트랙 (Slitrk)과 선택적으로 결합하기 위한 분자코드임을 규명하였다.
(아래) 슬릿트랙의 바이오투과전자현미경 이미지 단백질결정학으로는 규명이 어려운 전체 슬릿트랙 단백질 구조(세포막 바깥쪽부위)를 바이오투과전자현미경을 사용하여 분석하였다. 그림에서 보듯 전체 슬릿트랙은 땅콩처럼 생긴 비슷한 두 개의 단백질 모듈(푸른색, 노란색 화살표)로 구성되어 있고, 이들 중 한 부분(파란색 화살표)만 LAR-RPTP와 결합하게 된다는 것을 규명하였다.
그림 2. 시냅스접착단백질 결합에 의해 유도되는 시냅스형성 분자기전
전시냅스의 LAR-RPTP과 후시냅스의 슬릿트랙(Slitrk)의 결합이 단순한 결합에 그치는 것이 아니라 결합 이후 신경세포 막에서의 배열변화를 통해 단백질 클러스터 형성을 유도할 수 있음을 보였다.
그림 3. 시냅스 및 시냅스접착단백질 개요
시냅스는 1000 억여 개에 달하는 신경세포들의 접합 부위인 뇌기능의 기본단위로서 신경세포 간 교환되는 신경전달물질들에 의하여 학습 및 기억, 감각, 운동 등이 원활히 조절된다. 시냅스에는 약 1,000여종 단백질이 존재하며, 이들 중 신경세포 막에 존재하며 벨크로처럼 두 개의 신경세포를 단단하게 연결하여 시냅스 형성을 돕는 단백질을 시냅스접착단백질이라 한다. 현재 불과 10여개의 시냅스접착단백질만이 밝혀져 있고, 이중 최근에 주목받기 시작한 시냅스접착단백질이 슬릿트랫과 LAR-RPTP이다.
2014.11.20 조회수 20599
신경세포 연결해주는 접착단백질 결합구조 규명
국내 연구진이 신경세포 연결을 주관하는 시냅스접착단백질**의 3차원 복합체 구조를 규명함으로써, 시냅스* 형성초기 기전을 제시하였다. 시냅스 이상으로 인한 강박증이나 조울증 등 다양한 뇌질환의 발병기전 규명과 치료제 개발에 활용될 것으로 기대된다.
* 시냅스 : 신경전달물질의 분비와 흡수가 일어나는 1,000억 여 개에 달하는 신경세포의 접합부위로 학습과 기억, 감각, 운동 등을 조절하는 뇌 활동의 기본단위이다. ** 시냅스접착단백질 : 벨크로처럼 두 개의 신경세포를 단단하게 연결해 시냅스 형성을 돕는 신경세포막에 존재하는 단백질
우리 학교 의과학대학원 김호민 교수와 연세대 생화학과 고재원 교수 (이상 교신저자)가 주도하고, 연세대 엄지원 연구교수, KAIST 김기훈 석사과정 연구원 및 을지대 박범석 교수(이상 제1저자)가 참여한 이번 연구는 미래창조과학부와 한국연구재단이 지원하는 신진연구자지원사업, 중견연구자지원사업(핵심연구) 및 교육부 학문후속세대양성사업의 지원으로 수행되었고 자연과학 분야 국제학술지 네이처 커뮤니케이션스(Nature Communications)지 온라인판 11월 14일자에 게재되었다. (논문명 : Structural basis for LAR-RPTP/Slitrk complex-mediated synaptic adhesion)
신경세포막에 존재하는 단백질 슬릿트랙*은 다른 신경세포의 막에 존재하는 단백질 LAR-RPTP**와 복합체를 이뤄 초기 시냅스 형성과 신경세포의 흥분과 억제간의 균형 유지에 관여하는 것으로 알려져 있었다.
* 슬릿트랙(Slitrk) : 뇌의 중추신경계에서 강하게 발현되는 단백질. 이 유전자가 결핍된 형질전환생쥐의 경우 다양한 뇌질환 표현형을 나타냄. 최근 LAR-RPTP와 결합하여 시냅스 형성을 조절하는 시냅스접착단백질임이 밝혀짐
** LAR-RPTP : 신경세포의 초기 발달과정에서 중요한 역할을 하는 단백질 군. 최근 시냅스 형성에 관계된 주요 기능들이 조금씩 밝혀지면서 새롭게 주목 받기 시작한시냅스접착단백질
이들 두 단백질의 이상은 시냅스의 기능이상을 유발해 자폐증, 정신분열증, 간질, 강박증 및 조울증 같은 다양한 신경·정신질환을 유발하는 것으로 알려져 있지만 두 단백질의 결합구조와 구체적인 작용기전이 규명되지 않아 치료제 개발에 한계가 있었다.
연구팀은 단백질 결정학기술과 바이오투과전자현미경을 활용해 두 시냅스접착단백질(슬릿트랙(Slitrk)과 LAR-RPTP)이 결합된 3차원 구조를 밝혀내고 이들 상호간의 결합의 핵심이 되는 부위를 찾아냈다.
나아가 두 시냅스접착 단백질이 결합한 후 클러스터를 형성하면서 시냅스 생성이 유도된다는 것을 규명하였다.
김호민 교수는 “시냅스접착단백질의 기능 이상으로 나타나는 다양한 뇌질환의 발병기전 이해에 큰 밑거름이 될 것. 특히, 단백질 구조생물학과 신경생물학의 유기적인 협력연구를 통하여 우수한 성과를 거둔 대표적 사례가 될 것”이라고 밝혔다. 고재원 교수는 “시냅스접착단백질 분자기전을 이해함으로써 시냅스 형성 관련 연구의 새로운 방향을 제시할 것”이라고 연구의의를 밝혔다.
그림 1. 시냅스접착단백질 결합체 구조 및 슬릿트랫 바이오투과전자현미경 이미지
(위) 시냅스접착단백질 슬릿트랙(Slitrk)과 LAR-RPTP 결합체 분자구조
단백질결정학을 통해 시냅스접착단백질 결합체 분자구조를 분석한 결과 두 시냅스접착단백질의 결합에 중추적인 역할을 하는 핵심적인 아미노산을 도출할 수 있었다.
특히 LAR-RPTP 단백질에 위치한 선택적 접합(Alternative splicing) 부위(붉은색 화살표)가 슬릿트랙 (Slitrk)과 선택적으로 결합하기 위한 분자코드임을 규명하였다.
(아래) 슬릿트랙의 바이오투과전자현미경 이미지 단백질결정학으로는 규명이 어려운 전체 슬릿트랙 단백질 구조(세포막 바깥쪽부위)를 바이오투과전자현미경을 사용하여 분석하였다. 그림에서 보듯 전체 슬릿트랙은 땅콩처럼 생긴 비슷한 두 개의 단백질 모듈(푸른색, 노란색 화살표)로 구성되어 있고, 이들 중 한 부분(파란색 화살표)만 LAR-RPTP와 결합하게 된다는 것을 규명하였다.
그림 2. 시냅스접착단백질 결합에 의해 유도되는 시냅스형성 분자기전
전시냅스의 LAR-RPTP과 후시냅스의 슬릿트랙(Slitrk)의 결합이 단순한 결합에 그치는 것이 아니라 결합 이후 신경세포 막에서의 배열변화를 통해 단백질 클러스터 형성을 유도할 수 있음을 보였다.
그림 3. 시냅스 및 시냅스접착단백질 개요
시냅스는 1000 억여 개에 달하는 신경세포들의 접합 부위인 뇌기능의 기본단위로서 신경세포 간 교환되는 신경전달물질들에 의하여 학습 및 기억, 감각, 운동 등이 원활히 조절된다. 시냅스에는 약 1,000여종 단백질이 존재하며, 이들 중 신경세포 막에 존재하며 벨크로처럼 두 개의 신경세포를 단단하게 연결하여 시냅스 형성을 돕는 단백질을 시냅스접착단백질이라 한다. 현재 불과 10여개의 시냅스접착단백질만이 밝혀져 있고, 이중 최근에 주목받기 시작한 시냅스접착단백질이 슬릿트랫과 LAR-RPTP이다.
2014.11.20 조회수 20599 -
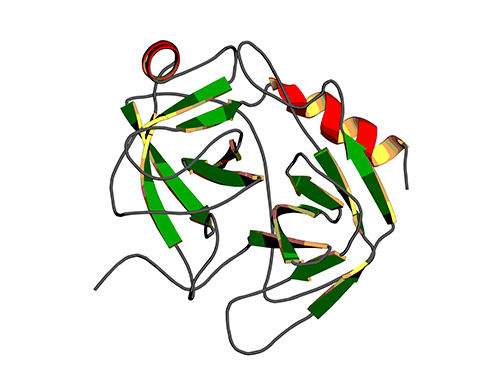 단백질의 생체분자에 대한 결합력 조절기작 규명
우리 학교 생명과학과 김학성 교수와 서문형 박사 연구팀은 단백질이 생체 내 분자를 인식하고 기능을 수행하는데 중요한 단백질의 생체분자에 대한 결합력을 조절하는 메커니즘을 새롭게 밝혀냈다 .
연구 결과는 과학 분야의 권위지인 ‘ 네이처 커뮤니케이션즈 (Nature Communications)’ 24일자 온라인판에 게재됐다.
연구팀은 지난해에 단백질의 생체분자 인식 메커니즘을 최초로 밝혀내 Nature Chemical Biology 에 발표한데 이어 , 이번 연구를 통해 단백질이 생체분자에 대한 결합력을 조절하는 핵심 원리를 규명함으로써 생체 내 단백질의 기능과 조절 기작을 보다 명확하게 이해하는 데 크게 기여할 것으로 전망된다 .
효소나 항체 , 호르몬 등으로 대표되는 단백질은 모든 생명체 내에서 다양한 생체 분자를 특이적으로 인식하여 신호전달 , 면역반응 등을 정교하게 진행시켜 생명현상을 유지하고 조절하는데 가장 중요한 역할을 담당한다 . 이런 과정에서 단백질이 생체분자에 대한 결합력은 두 분자 사이의 결합지속 시간이 정해지고 , 단백질의 생체 내 기능을 결정하고 조절하는 핵심 요인이다 . 이번 연구 결과를 바탕으로 단백질 활성을 보다 정교하게 조절하는 것이 가능해질 것으로 예상된다 .
연구팀은 단백질들이 생체분자를 인식하는 과정에서 , 단백질의 생체분자에 대한 결합력은 두 분자 사이의 비 공유 상호작용의 크기뿐만 아니라 단백질의 고유한 동역학적 성질도 긴밀하게 연관되어 있다는 점에 주목했다 .
김 교수 연구팀은 단백질의 생체분자에 대한 결합력을 결정하는 기본 기작을 규명하기 위해 , 단백질의 allosteric site 에 돌연변이를 가하여 동일한 화학적 접촉면을 가지고 있지만 수십 배에서 수백 배의 결합력 차이를 보이는 다양한 돌연변이 단백질을 제작하였다 . 단백질의 allosteric site 는 생체분자와 직접 결합하는 부위는 아니지만 생체 분자 인식에 영향을 미치는 부위를 지칭한다 .
제작된 돌연변이 단백질들의 고유한 동역학적 성질을 단 분자 수준에서 실시간으로 분석하여 , 생체분자에 대한 결합력이 단백질의 고유한 동력학적 특성인 구조 열림 속도에 직접적으로 연관되어 있음을 밝혀냈다 .
또한 , 단백질이 생체 분자와 직접 결합하는 부위가 아닌 allosteric site 에서 단백질의 고유한 특성을 변화시킬 수 있음을 증명함으로써 , 생체 내 단백질들의 기능을 조절하는 새로운 방법론을 제시하였다 .
연구팀의 이번 결과는 다양한 생명현상을 관장하는 단백질의 특성을 보다 깊이 이해하는데 큰 역할을 하였으며 , 단백질의 생체분자에 대한 결합력을 결정하는 원리를 단백질의 동력학적 관점에서 입증한 것으로 평가되고 있다 .
김 학성 교수는 이번 연구에 대해 “ 지금까지는 단백질의 생체분자에 대한 결합력은 두 분자 사이의 직접적인 상호작용에 의해 결정되는 것으로 알려져 왔지만 , 본 연구를 통해 단백질의 고유한 동력학적 특성 , 즉 구조 열림 속도도 결합력을 결정하는 데 핵심적인 역할을 한다는 새로운 사실을 밝힌 것이 큰 의미가 있다 ” 라고 의의를 밝혔다 .
그림 1. 단백질의 안정한 상태인 열린 구조 (open) 와 불안정한 상태인 부분적으로 열린 구조 (partially closed) 사이의 전환 속도 (kopening; opening rate) 와 결합력 (Kd) 사이의 상관관계 그래프
2014.04.25 조회수 20474
단백질의 생체분자에 대한 결합력 조절기작 규명
우리 학교 생명과학과 김학성 교수와 서문형 박사 연구팀은 단백질이 생체 내 분자를 인식하고 기능을 수행하는데 중요한 단백질의 생체분자에 대한 결합력을 조절하는 메커니즘을 새롭게 밝혀냈다 .
연구 결과는 과학 분야의 권위지인 ‘ 네이처 커뮤니케이션즈 (Nature Communications)’ 24일자 온라인판에 게재됐다.
연구팀은 지난해에 단백질의 생체분자 인식 메커니즘을 최초로 밝혀내 Nature Chemical Biology 에 발표한데 이어 , 이번 연구를 통해 단백질이 생체분자에 대한 결합력을 조절하는 핵심 원리를 규명함으로써 생체 내 단백질의 기능과 조절 기작을 보다 명확하게 이해하는 데 크게 기여할 것으로 전망된다 .
효소나 항체 , 호르몬 등으로 대표되는 단백질은 모든 생명체 내에서 다양한 생체 분자를 특이적으로 인식하여 신호전달 , 면역반응 등을 정교하게 진행시켜 생명현상을 유지하고 조절하는데 가장 중요한 역할을 담당한다 . 이런 과정에서 단백질이 생체분자에 대한 결합력은 두 분자 사이의 결합지속 시간이 정해지고 , 단백질의 생체 내 기능을 결정하고 조절하는 핵심 요인이다 . 이번 연구 결과를 바탕으로 단백질 활성을 보다 정교하게 조절하는 것이 가능해질 것으로 예상된다 .
연구팀은 단백질들이 생체분자를 인식하는 과정에서 , 단백질의 생체분자에 대한 결합력은 두 분자 사이의 비 공유 상호작용의 크기뿐만 아니라 단백질의 고유한 동역학적 성질도 긴밀하게 연관되어 있다는 점에 주목했다 .
김 교수 연구팀은 단백질의 생체분자에 대한 결합력을 결정하는 기본 기작을 규명하기 위해 , 단백질의 allosteric site 에 돌연변이를 가하여 동일한 화학적 접촉면을 가지고 있지만 수십 배에서 수백 배의 결합력 차이를 보이는 다양한 돌연변이 단백질을 제작하였다 . 단백질의 allosteric site 는 생체분자와 직접 결합하는 부위는 아니지만 생체 분자 인식에 영향을 미치는 부위를 지칭한다 .
제작된 돌연변이 단백질들의 고유한 동역학적 성질을 단 분자 수준에서 실시간으로 분석하여 , 생체분자에 대한 결합력이 단백질의 고유한 동력학적 특성인 구조 열림 속도에 직접적으로 연관되어 있음을 밝혀냈다 .
또한 , 단백질이 생체 분자와 직접 결합하는 부위가 아닌 allosteric site 에서 단백질의 고유한 특성을 변화시킬 수 있음을 증명함으로써 , 생체 내 단백질들의 기능을 조절하는 새로운 방법론을 제시하였다 .
연구팀의 이번 결과는 다양한 생명현상을 관장하는 단백질의 특성을 보다 깊이 이해하는데 큰 역할을 하였으며 , 단백질의 생체분자에 대한 결합력을 결정하는 원리를 단백질의 동력학적 관점에서 입증한 것으로 평가되고 있다 .
김 학성 교수는 이번 연구에 대해 “ 지금까지는 단백질의 생체분자에 대한 결합력은 두 분자 사이의 직접적인 상호작용에 의해 결정되는 것으로 알려져 왔지만 , 본 연구를 통해 단백질의 고유한 동력학적 특성 , 즉 구조 열림 속도도 결합력을 결정하는 데 핵심적인 역할을 한다는 새로운 사실을 밝힌 것이 큰 의미가 있다 ” 라고 의의를 밝혔다 .
그림 1. 단백질의 안정한 상태인 열린 구조 (open) 와 불안정한 상태인 부분적으로 열린 구조 (partially closed) 사이의 전환 속도 (kopening; opening rate) 와 결합력 (Kd) 사이의 상관관계 그래프
2014.04.25 조회수 20474 -
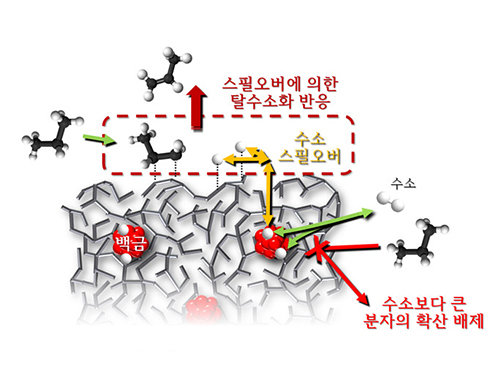 모델 촉매 시스템을 이용한 스필오버 현상 규명
- 새로운 메커니즘의 상업촉매 개발을 위한 원천기술 확보 -
1960년대 초 발견된 이래 오늘날까지도 학계에서 논란이 되고 있는 물리학적 현상이 KAIST 연구진에 의해 세계 최초로 규명됐다.
KAIST(총장 강성모) 생명화학공학과 최민기(34) 교수팀은 비결정질 알루미노실리케이트 내부에 백금이 선택적으로 위치한 모델 촉매 시스템을 개발해 ‘스필오버(spillover)’ 현상을 규명했다.
연구 결과는 네이처 커뮤니케이션즈(Nature Communications) 25일자 온라인 판에 실렸다.
스필오버 현상은 백금과 같은 금속 표면에서 활성화된 수소원자가 촉매 표면으로 이동하는 현상이다.
이 현상을 이용하면 높은 활성과 안정성을 갖는 촉매를 설계하는데 이용될 수 있을 것이라고 믿어져 지난 50여년간 촉매 분야에서 활발히 연구됐다.
하지만 기존에 알려진 촉매들의 경우에는 노출된 금속 표면에서 여러 가지 다른 경로로 경쟁반응이 일어나기 때문에 스필오버의 존재 및 생성 메커니즘을 직접적으로 규명하는 것이 불가능했다.
연구팀이 개발한 촉매는 백금 나노입자가 수소 분자만 통과할 수 있는 알루미노실리케이트로 덮여있어 다른 경쟁 반응들이 일어나는 것을 원천 차단, 스필오버 현상을 효과적으로 연구하는데 이용할 수 있었다.
연구팀은 촉매에 대한 다양한 구조분석, 촉매 반응성 분석, 컴퓨터 모델링을 통해 알루미노실리케이트에 존재하는 브뢴스테드 산점이 스필오버에 결정적인 역할을 함을 밝혀냈다.
그동안 학계에서 50여년간 정립되지 않은 ‘스필오버’라는 현상을 최초로 규명했다는 점에서 학술적으로 큰 영향력을 발휘할 수 있을 것으로 기대된다.
이와 함께 이번 연구에서 제안된 스필오버에 기반한 수소화 촉매의 경우 높은 수소화·탈수소화 활성을 보임과 동시에 석유화학공정에서 일반적으로 원치 않는 부반응인 수소화 분해(hydrogenolysis) 반응을 확연하게 억제할 수 있다는 점에서 산업적으로도 그 잠재력이 매우 크다고 연구팀은 전했다.
최민기 교수는 “스필오버 현상만으로 반응이 진행되는 해당 촉매의 경우 촉매구조를 적절하게 설계하면 기존 금속촉매를 훨씬 능가하는 촉매를 구현할 수 있을 것”이라며 “향후 높은 활성 및 선택성을 가지는 꿈의 촉매를 만들 것”이라고 말했다.
SK이노베이션 오승훈 수석연구위원은 “촉매계의 오랜 논쟁거리였던 스필오버 현상을 이론과 실험을 통해 규명하고 이에 대한 이해를 높였다는 점이 이번 연구의 가장 큰 성과”라며 “SK이노베이션에서는 이번 연구를 통해 확보한 기술을 바탕으로 새로운 상업촉매 개발 연구를 계속할 것”이라고 말했다.
SK이노베이션(대표 구자영)과 미래창조과학부의 지원을 받아 수행된 이번 연구는 KAIST 최민기 교수 지도아래 임주환 연구원, 신혜영 연구원이 공동 제1저자로 참여했으며 EEWS 대학원 김형준 교수가 컴퓨터 모델링을 수행했다.
2014.02.26 조회수 19765
모델 촉매 시스템을 이용한 스필오버 현상 규명
- 새로운 메커니즘의 상업촉매 개발을 위한 원천기술 확보 -
1960년대 초 발견된 이래 오늘날까지도 학계에서 논란이 되고 있는 물리학적 현상이 KAIST 연구진에 의해 세계 최초로 규명됐다.
KAIST(총장 강성모) 생명화학공학과 최민기(34) 교수팀은 비결정질 알루미노실리케이트 내부에 백금이 선택적으로 위치한 모델 촉매 시스템을 개발해 ‘스필오버(spillover)’ 현상을 규명했다.
연구 결과는 네이처 커뮤니케이션즈(Nature Communications) 25일자 온라인 판에 실렸다.
스필오버 현상은 백금과 같은 금속 표면에서 활성화된 수소원자가 촉매 표면으로 이동하는 현상이다.
이 현상을 이용하면 높은 활성과 안정성을 갖는 촉매를 설계하는데 이용될 수 있을 것이라고 믿어져 지난 50여년간 촉매 분야에서 활발히 연구됐다.
하지만 기존에 알려진 촉매들의 경우에는 노출된 금속 표면에서 여러 가지 다른 경로로 경쟁반응이 일어나기 때문에 스필오버의 존재 및 생성 메커니즘을 직접적으로 규명하는 것이 불가능했다.
연구팀이 개발한 촉매는 백금 나노입자가 수소 분자만 통과할 수 있는 알루미노실리케이트로 덮여있어 다른 경쟁 반응들이 일어나는 것을 원천 차단, 스필오버 현상을 효과적으로 연구하는데 이용할 수 있었다.
연구팀은 촉매에 대한 다양한 구조분석, 촉매 반응성 분석, 컴퓨터 모델링을 통해 알루미노실리케이트에 존재하는 브뢴스테드 산점이 스필오버에 결정적인 역할을 함을 밝혀냈다.
그동안 학계에서 50여년간 정립되지 않은 ‘스필오버’라는 현상을 최초로 규명했다는 점에서 학술적으로 큰 영향력을 발휘할 수 있을 것으로 기대된다.
이와 함께 이번 연구에서 제안된 스필오버에 기반한 수소화 촉매의 경우 높은 수소화·탈수소화 활성을 보임과 동시에 석유화학공정에서 일반적으로 원치 않는 부반응인 수소화 분해(hydrogenolysis) 반응을 확연하게 억제할 수 있다는 점에서 산업적으로도 그 잠재력이 매우 크다고 연구팀은 전했다.
최민기 교수는 “스필오버 현상만으로 반응이 진행되는 해당 촉매의 경우 촉매구조를 적절하게 설계하면 기존 금속촉매를 훨씬 능가하는 촉매를 구현할 수 있을 것”이라며 “향후 높은 활성 및 선택성을 가지는 꿈의 촉매를 만들 것”이라고 말했다.
SK이노베이션 오승훈 수석연구위원은 “촉매계의 오랜 논쟁거리였던 스필오버 현상을 이론과 실험을 통해 규명하고 이에 대한 이해를 높였다는 점이 이번 연구의 가장 큰 성과”라며 “SK이노베이션에서는 이번 연구를 통해 확보한 기술을 바탕으로 새로운 상업촉매 개발 연구를 계속할 것”이라고 말했다.
SK이노베이션(대표 구자영)과 미래창조과학부의 지원을 받아 수행된 이번 연구는 KAIST 최민기 교수 지도아래 임주환 연구원, 신혜영 연구원이 공동 제1저자로 참여했으며 EEWS 대학원 김형준 교수가 컴퓨터 모델링을 수행했다.
2014.02.26 조회수 19765 -
 배추 절이는 원리로 광결정 미세캡슐 개발
- “반사형 컬러 디스플레이 소자 및 인체 주입 바이오센서에 응용가능” -- 콜로이드 및 유체역학 분야의 대가 故 양승만 교수에게 연구결과 헌정 -
우리 학교 생명화학공학과 김신현 교수 연구팀이 하버드대와 공동으로 삼투압 원리를 이용해 차세대 광학소재로 주목받는 광결정의 미세캡슐화 기술을 개발했다.
연구결과는 네이처 자매지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7일자 온라인 판에 게재됐다.
남미 열대림에서 서식하는 몰포(Morpho)나비의 날개는 파란 색으로 보이지만 색소가 없다. 날개 표면에 있는 규칙적인 나노 구조로 인해 파란색 파장의 빛만을 반사하기 때문에 우리 눈에는 파란 색으로 보이는 것이다.
이처럼 물질의 광구조가 특정 파장의 빛만 반사하고 나머지는 통과하는 배열을 갖도록 만들어낸 물질을 ‘광결정’이라고 한다.
광결정은 빛의 파장 절반 수준에서 굴절률이 주기적으로 변하는데 특정 파장의 빛만을 제어할 수 있는 특성과 다양한 응용가능성을 갖고 있어 ‘빛의 반도체’라고도 불린다.
1987년 미국 벨연구소 이론 물리학자 엘리 야블로노비치(Eli Yablonovitch)와 프린스턴대학 사지브 존(Sajeev John)이 광결정 개념을 최초로 보고한 이래 지난 27년 동안 많은 과학자들이 광결정을 인공적으로 제조하기 위해 노력해왔다. 그러나 반사색이 대부분 고정된 구조에 의해 발현돼 색을 바꾸는 것이 불가능하고 제조 공정이 까다로워 상용화가 어려웠다.김 교수 연구팀은 △액체 상태의 광결정을 잉크처럼 캡슐화하고 △광결정을 덩어리 형태가 아닌 머리카락 굵기(약 100나노미터) 수준의 미세캡슐형태로 제조해 제작의 공정성을 높였으며 △고무재질의 캡슐막을 적용해 모양을 자유자재로 바꿀 수 있도록 제작했다.
연구팀은 배추를 소금물에 절일 때 발생하는 ‘삼투압현상’을 활용했다. 배춧잎은 물 분자만을 투과시키는 반투막으로 이뤄져있는데 배추가 소금물에 잠기면 높은 삼투압을 갖는 소금물이 배춧잎 내부의 물 분자를 반투막 밖으로 꺼내고 배춧잎은 부피가 줄어드는 원리를 이용한 것이다.
연구팀은 이 현상을 나노입자를 담은 미세 물방울에 적용했다. 삼투압현상에 의해 물방울의 부피가 줄어듦에 따라 나노입자가 스스로 규칙적인 구조로 배열돼 캡슐막 내부에 액상의 광결정을 만들었다. 이 과정에서 머리카락 굵기 수준의 작은 통로를 구현한 미세유체소자를 활용해 광결정 미세캡슐을 균일한 크기로 제조하는데 성공했다.
김신현 교수는 “미세 광결정 잉크캡슐은 상용화 가능한 수준으로 향후 구부리거나 접을 수 있는 차세대 반사형 컬러 디스플레이 소자 및 인체 내로 주입 가능한 바이오센서 등을 구성하는 핵심 광학소재로 사용될 수 있을 것”이라고 이번 연구 의의를 설명했다.
KAIST 및 하버드 연구진들은 이번 연구 결과를 지난해 9월 불의의 사고로 고인이 된 콜로이드 및 유체역학 분야의 세계적 대가 故 양승만 교수(前 KAIST 생명화학공학과 교수)에게 헌정했다고 전했다.
한편, 이번 연구는 산업통상자원부에서 지원하는 선진기술국가 국제공동기술개발사업으로 진행됐다.
□ 용어설명- 광결정 (Photonic crystals): 빛의 파장의 절반 수준에서 굴절률이 규칙적으로 변하는 물질로써 특정 에너지를 갖는 광자가 물질 내에 존재할 수 없는 광밴드갭 (photonic bandgap)을 갖는 물질을 말함. 광밴드갭에 해당하는 파장이 가시광선 영역에 있을 때, 외부에서 입사하는 백색광 중 광밴드갭에 해당하는 파장의 빛이 선택적으로 반사되어 금속 광택과 흡사한 느낌의 색깔을 보임.
- 미세유체소자(Microfluidic device) : 머리카락 굵기 수준의 미세한 유로를 집적화함으로써 유체 흐름을 매우 정교하게 제어할 수 있게 해주고, 균일한 크기와 구조의 이멀젼(emulsion) 을 생성시킬 수 있는 소자.
□ 그림설명
그림1. 삼투압 차에 따른 캡슐 크기 감소를 보여주는 모식도
그림2. 균일한 크기의 광결정 캡슐을 제조할 수 있는 미세유체소자
그림3. 초록색 및 파란색 반사색을 보이는 광결정 캡슐의 광학현미경 사진
그림4. 광결정캡슐의 변색 및 변형을 보여주는 광학현미경 사진
그림5. 자연계에 존재하는 광결정의 예: 오팔보석, 공작새 깃털, 극락조의 날개
2014.01.15 조회수 29767
배추 절이는 원리로 광결정 미세캡슐 개발
- “반사형 컬러 디스플레이 소자 및 인체 주입 바이오센서에 응용가능” -- 콜로이드 및 유체역학 분야의 대가 故 양승만 교수에게 연구결과 헌정 -
우리 학교 생명화학공학과 김신현 교수 연구팀이 하버드대와 공동으로 삼투압 원리를 이용해 차세대 광학소재로 주목받는 광결정의 미세캡슐화 기술을 개발했다.
연구결과는 네이처 자매지 ‘네이처 커뮤니케이션즈(Nature Communications)’ 7일자 온라인 판에 게재됐다.
남미 열대림에서 서식하는 몰포(Morpho)나비의 날개는 파란 색으로 보이지만 색소가 없다. 날개 표면에 있는 규칙적인 나노 구조로 인해 파란색 파장의 빛만을 반사하기 때문에 우리 눈에는 파란 색으로 보이는 것이다.
이처럼 물질의 광구조가 특정 파장의 빛만 반사하고 나머지는 통과하는 배열을 갖도록 만들어낸 물질을 ‘광결정’이라고 한다.
광결정은 빛의 파장 절반 수준에서 굴절률이 주기적으로 변하는데 특정 파장의 빛만을 제어할 수 있는 특성과 다양한 응용가능성을 갖고 있어 ‘빛의 반도체’라고도 불린다.
1987년 미국 벨연구소 이론 물리학자 엘리 야블로노비치(Eli Yablonovitch)와 프린스턴대학 사지브 존(Sajeev John)이 광결정 개념을 최초로 보고한 이래 지난 27년 동안 많은 과학자들이 광결정을 인공적으로 제조하기 위해 노력해왔다. 그러나 반사색이 대부분 고정된 구조에 의해 발현돼 색을 바꾸는 것이 불가능하고 제조 공정이 까다로워 상용화가 어려웠다.김 교수 연구팀은 △액체 상태의 광결정을 잉크처럼 캡슐화하고 △광결정을 덩어리 형태가 아닌 머리카락 굵기(약 100나노미터) 수준의 미세캡슐형태로 제조해 제작의 공정성을 높였으며 △고무재질의 캡슐막을 적용해 모양을 자유자재로 바꿀 수 있도록 제작했다.
연구팀은 배추를 소금물에 절일 때 발생하는 ‘삼투압현상’을 활용했다. 배춧잎은 물 분자만을 투과시키는 반투막으로 이뤄져있는데 배추가 소금물에 잠기면 높은 삼투압을 갖는 소금물이 배춧잎 내부의 물 분자를 반투막 밖으로 꺼내고 배춧잎은 부피가 줄어드는 원리를 이용한 것이다.
연구팀은 이 현상을 나노입자를 담은 미세 물방울에 적용했다. 삼투압현상에 의해 물방울의 부피가 줄어듦에 따라 나노입자가 스스로 규칙적인 구조로 배열돼 캡슐막 내부에 액상의 광결정을 만들었다. 이 과정에서 머리카락 굵기 수준의 작은 통로를 구현한 미세유체소자를 활용해 광결정 미세캡슐을 균일한 크기로 제조하는데 성공했다.
김신현 교수는 “미세 광결정 잉크캡슐은 상용화 가능한 수준으로 향후 구부리거나 접을 수 있는 차세대 반사형 컬러 디스플레이 소자 및 인체 내로 주입 가능한 바이오센서 등을 구성하는 핵심 광학소재로 사용될 수 있을 것”이라고 이번 연구 의의를 설명했다.
KAIST 및 하버드 연구진들은 이번 연구 결과를 지난해 9월 불의의 사고로 고인이 된 콜로이드 및 유체역학 분야의 세계적 대가 故 양승만 교수(前 KAIST 생명화학공학과 교수)에게 헌정했다고 전했다.
한편, 이번 연구는 산업통상자원부에서 지원하는 선진기술국가 국제공동기술개발사업으로 진행됐다.
□ 용어설명- 광결정 (Photonic crystals): 빛의 파장의 절반 수준에서 굴절률이 규칙적으로 변하는 물질로써 특정 에너지를 갖는 광자가 물질 내에 존재할 수 없는 광밴드갭 (photonic bandgap)을 갖는 물질을 말함. 광밴드갭에 해당하는 파장이 가시광선 영역에 있을 때, 외부에서 입사하는 백색광 중 광밴드갭에 해당하는 파장의 빛이 선택적으로 반사되어 금속 광택과 흡사한 느낌의 색깔을 보임.
- 미세유체소자(Microfluidic device) : 머리카락 굵기 수준의 미세한 유로를 집적화함으로써 유체 흐름을 매우 정교하게 제어할 수 있게 해주고, 균일한 크기와 구조의 이멀젼(emulsion) 을 생성시킬 수 있는 소자.
□ 그림설명
그림1. 삼투압 차에 따른 캡슐 크기 감소를 보여주는 모식도
그림2. 균일한 크기의 광결정 캡슐을 제조할 수 있는 미세유체소자
그림3. 초록색 및 파란색 반사색을 보이는 광결정 캡슐의 광학현미경 사진
그림4. 광결정캡슐의 변색 및 변형을 보여주는 광학현미경 사진
그림5. 자연계에 존재하는 광결정의 예: 오팔보석, 공작새 깃털, 극락조의 날개
2014.01.15 조회수 29767 -
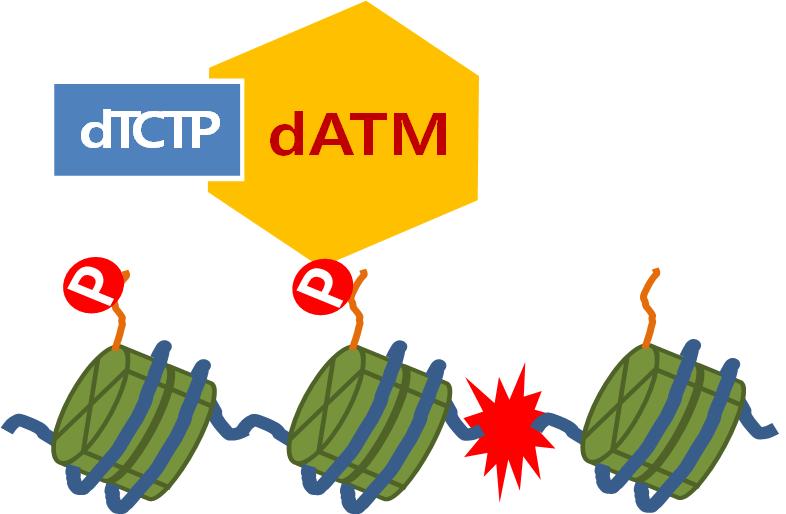 손상된 DNA의 돌연변이 수리과정 규명
- DNA 손상을 복구하는 암 관련 핵심 효소 ATM의 조절 메커니즘 밝혀 -
우리 학교 생명과학과 최광욱 교수와 홍성태 박사 연구팀은 생체정보를 저장하는 DNA가 손상됐을 때 이를 수리하는 핵심효소의 기능에 필수적인 단백질 ‘ATM(Ataxia telangiectasia mutated)’의 작동 메커니즘을 규명했다.
연구결과는 네이처 자매지인 ‘네이처 커뮤니케이션즈(Nature communications)’ 19일자 온라인판에 게재됐다.
인간을 포함해 DNA를 갖고 있는 모든 생명체는 자신의 DNA정보를 지키기 위해 끊임없이 노력하고 있으며 이들이 살아가고 있는 자연환경에는 DNA를 손상시킬 수 있는 수많은 요소들이 존재한다.
예를 들면, 우리가 매일 섭취하는 음식물속에 들어있는 탄화물질이나 건물의 시멘트에서 나오는 라돈과 같은 방사선 물질, 강한 태양빛에 포함된 자외선 등 수많은 발암물질들과 함께 살아가고 있다.
생명체는 발암물질들로부터 DNA정보를 일정하게 유지하기 위해 복잡하고 정교한 DNA 수리작업을 항상 수행하고 있는데 이 과정에서 ‘ATM’이라고 하는 DNA 손상복구 단백질이 핵심적인 역할을 한다. 따라서 ATM이 제대로 작동하지 않으면 암 발병 확률이 높아진다.
지금까지 학계에서는 TCTP(Translationally controlled tumor protein)라는 단백질이 ATM의 기능을 조절하는데 중요할 것이라고 추정해 왔다. 그러나 이에 대한 주된 연구결과가 배양된 세포수준에서 확인했기 때문에 정확히 어떠한 방식으로 TCTP가 ATM의 기능을 조절하는지 알 수 없었다.
연구팀은 TCTP에 결합하는 아미노산 조각의 정보를 활용해 TCTP가 ATM과 결합을 할 수 있고, 다양한 분자생화학적인 방법들을 이용해 TCTP가 ATM의 효소기능을 높여준다는 사실을 밝혀냈다.
이와 함께 분자 유전학의 모델동물로 널리 사용되는 초파리를 이용해 TCTP와 ATM이 방사선에 의해 손상된 DNA를 수리하는데 매우 중요한 역할을 하고 있다는 점도 규명했다.
이를 통해 연구팀은 TCTP가 세포배양 수준은 물론 고등생명체에서도 DNA 정보를 일정하게 유지하는데 중요한 역할을 하며, TCTP가 ATM의 기능을 조절하는 방법에 대한 중요하고 구체적인 단초를 제시했다.
최광욱 교수는 이번 연구에 대해 “초파리 모델동물을 이용한 기초연구가 암 등 질병의 과정을 이해하고 치료방법을 개발하는데 중요한 기여를 할 수 있음을 보여주는 좋은 사례”라고 말했다.
이번 연구는 미래창조과학부(장관 최문기)와 한국연구재단이 추진하는 중견연구자지원사업(도약 연구)과 일반연구자지원(대통령포스닥펠로우십)의 지원을 받아 수행됐다.
□ 보충자료
1. ATM(Ataxia telangiectasia mutated)ATM 유전자의 이상은 Louis-Bar syndrome 이라는 희귀 퇴행성 신경질환을 유발하는 것으로 알려져 있다. 운동기능이상, 눈의 흰자위나 피부에 비정상적으로 나타나는 혈관 확장, 약화된 면역반응, 혈액암 (림프종, 백혈병) 과 같은 질병증상을 추가로 일으킬 수 있다. ATM 유전자는 인산화 효소(kinase)의 기능을 가지고 있으며, ATM 단백질은 DNA의 이중나선이 모두 끊어질 경우, 이를 연결하는데 중요한 역할을 수행한다.
2. TCTP(Translationally controlled tumor protein)1988년 처음으로 발견된 단백질로, 이 유전자의 이름은 종양 세포에서 그 양이 비정상적으로 많아지기 때문에 붙여졌다. 그 기능이 본격적으로 밝혀진 것은 2000 초반부터이며, 세포의 생존과 성장에 중요한 역할을 한다. 최근에서야 DNA 정보를 유지하는데 중요하다는 것이 밝혀졌다.
3. Nature communcations네이처를 출간하는 Nature Publishing Group (NPG)에서 발간하는 온라인 전용 과학저널. 생물학, 물리학, 화학, 공학, 천문학, 고고학 등 다양한 분야의 수준 높은 과학연구 주제를 다루고 있다. 2012년을 기준으로 하는 SCI (Science citation index, 과학분야 인용지수)는 10.015 이다.
4. 초파리1900년대 초반, Charles W. Woodworth, William E. Castle, Thomas H. Morgan등이 멘델유전학을 연구하기 위해 처음으로 사용하기 시작한 모델 동물. 진핵세포에서 일어나는 생명현상을 연구하기 위해 오랫동안 사용되어온 대표적인 모델 동물이다.
□ 그림설명
그림1. TCTP단백질의 양이 줄어들면 방사능에 의해 쉽게 초파리 눈 세포의 형태가 비정상적으로 변형된다. (화살촉). Scale bars = 200mm
그림2. TCTP 단백질의 양이 줄어들면, 방사능에 의해 초파리의 염색체가 쉽게 끊어진다 (화살촉 표시). Scale bars = 10 mm.
그림3. TCTP와 ATM의 유전자발현이 줄어들면 눈의 정상적인 발생에 큰 결함이 생긴다.(왼쪽 : 초파리의 정상적인 눈, 오른쪽 : 성장이 결핍된 눈)
그림4. ATM은 끊어진 DNA의 위치를 표시하며, TCTP는 이 작용이 원활히 일어나도록 돕는다. 세포 핵 안에 들어있는 DNA(파란 선)는 히스톤 단백질(녹색 원통)에 감겨있다. DNA가 끊어지면(붉은 번개표시) 끊어진 자리에 ATM 단백질이 인산기(P)를 부착한다. 다양한 DNA 수리 단백질들은 이 인산기를 DNA에 수리가 필요하다는 신호로 인식하고 모여든다.
2013.12.20 조회수 23603
손상된 DNA의 돌연변이 수리과정 규명
- DNA 손상을 복구하는 암 관련 핵심 효소 ATM의 조절 메커니즘 밝혀 -
우리 학교 생명과학과 최광욱 교수와 홍성태 박사 연구팀은 생체정보를 저장하는 DNA가 손상됐을 때 이를 수리하는 핵심효소의 기능에 필수적인 단백질 ‘ATM(Ataxia telangiectasia mutated)’의 작동 메커니즘을 규명했다.
연구결과는 네이처 자매지인 ‘네이처 커뮤니케이션즈(Nature communications)’ 19일자 온라인판에 게재됐다.
인간을 포함해 DNA를 갖고 있는 모든 생명체는 자신의 DNA정보를 지키기 위해 끊임없이 노력하고 있으며 이들이 살아가고 있는 자연환경에는 DNA를 손상시킬 수 있는 수많은 요소들이 존재한다.
예를 들면, 우리가 매일 섭취하는 음식물속에 들어있는 탄화물질이나 건물의 시멘트에서 나오는 라돈과 같은 방사선 물질, 강한 태양빛에 포함된 자외선 등 수많은 발암물질들과 함께 살아가고 있다.
생명체는 발암물질들로부터 DNA정보를 일정하게 유지하기 위해 복잡하고 정교한 DNA 수리작업을 항상 수행하고 있는데 이 과정에서 ‘ATM’이라고 하는 DNA 손상복구 단백질이 핵심적인 역할을 한다. 따라서 ATM이 제대로 작동하지 않으면 암 발병 확률이 높아진다.
지금까지 학계에서는 TCTP(Translationally controlled tumor protein)라는 단백질이 ATM의 기능을 조절하는데 중요할 것이라고 추정해 왔다. 그러나 이에 대한 주된 연구결과가 배양된 세포수준에서 확인했기 때문에 정확히 어떠한 방식으로 TCTP가 ATM의 기능을 조절하는지 알 수 없었다.
연구팀은 TCTP에 결합하는 아미노산 조각의 정보를 활용해 TCTP가 ATM과 결합을 할 수 있고, 다양한 분자생화학적인 방법들을 이용해 TCTP가 ATM의 효소기능을 높여준다는 사실을 밝혀냈다.
이와 함께 분자 유전학의 모델동물로 널리 사용되는 초파리를 이용해 TCTP와 ATM이 방사선에 의해 손상된 DNA를 수리하는데 매우 중요한 역할을 하고 있다는 점도 규명했다.
이를 통해 연구팀은 TCTP가 세포배양 수준은 물론 고등생명체에서도 DNA 정보를 일정하게 유지하는데 중요한 역할을 하며, TCTP가 ATM의 기능을 조절하는 방법에 대한 중요하고 구체적인 단초를 제시했다.
최광욱 교수는 이번 연구에 대해 “초파리 모델동물을 이용한 기초연구가 암 등 질병의 과정을 이해하고 치료방법을 개발하는데 중요한 기여를 할 수 있음을 보여주는 좋은 사례”라고 말했다.
이번 연구는 미래창조과학부(장관 최문기)와 한국연구재단이 추진하는 중견연구자지원사업(도약 연구)과 일반연구자지원(대통령포스닥펠로우십)의 지원을 받아 수행됐다.
□ 보충자료
1. ATM(Ataxia telangiectasia mutated)ATM 유전자의 이상은 Louis-Bar syndrome 이라는 희귀 퇴행성 신경질환을 유발하는 것으로 알려져 있다. 운동기능이상, 눈의 흰자위나 피부에 비정상적으로 나타나는 혈관 확장, 약화된 면역반응, 혈액암 (림프종, 백혈병) 과 같은 질병증상을 추가로 일으킬 수 있다. ATM 유전자는 인산화 효소(kinase)의 기능을 가지고 있으며, ATM 단백질은 DNA의 이중나선이 모두 끊어질 경우, 이를 연결하는데 중요한 역할을 수행한다.
2. TCTP(Translationally controlled tumor protein)1988년 처음으로 발견된 단백질로, 이 유전자의 이름은 종양 세포에서 그 양이 비정상적으로 많아지기 때문에 붙여졌다. 그 기능이 본격적으로 밝혀진 것은 2000 초반부터이며, 세포의 생존과 성장에 중요한 역할을 한다. 최근에서야 DNA 정보를 유지하는데 중요하다는 것이 밝혀졌다.
3. Nature communcations네이처를 출간하는 Nature Publishing Group (NPG)에서 발간하는 온라인 전용 과학저널. 생물학, 물리학, 화학, 공학, 천문학, 고고학 등 다양한 분야의 수준 높은 과학연구 주제를 다루고 있다. 2012년을 기준으로 하는 SCI (Science citation index, 과학분야 인용지수)는 10.015 이다.
4. 초파리1900년대 초반, Charles W. Woodworth, William E. Castle, Thomas H. Morgan등이 멘델유전학을 연구하기 위해 처음으로 사용하기 시작한 모델 동물. 진핵세포에서 일어나는 생명현상을 연구하기 위해 오랫동안 사용되어온 대표적인 모델 동물이다.
□ 그림설명
그림1. TCTP단백질의 양이 줄어들면 방사능에 의해 쉽게 초파리 눈 세포의 형태가 비정상적으로 변형된다. (화살촉). Scale bars = 200mm
그림2. TCTP 단백질의 양이 줄어들면, 방사능에 의해 초파리의 염색체가 쉽게 끊어진다 (화살촉 표시). Scale bars = 10 mm.
그림3. TCTP와 ATM의 유전자발현이 줄어들면 눈의 정상적인 발생에 큰 결함이 생긴다.(왼쪽 : 초파리의 정상적인 눈, 오른쪽 : 성장이 결핍된 눈)
그림4. ATM은 끊어진 DNA의 위치를 표시하며, TCTP는 이 작용이 원활히 일어나도록 돕는다. 세포 핵 안에 들어있는 DNA(파란 선)는 히스톤 단백질(녹색 원통)에 감겨있다. DNA가 끊어지면(붉은 번개표시) 끊어진 자리에 ATM 단백질이 인산기(P)를 부착한다. 다양한 DNA 수리 단백질들은 이 인산기를 DNA에 수리가 필요하다는 신호로 인식하고 모여든다.
2013.12.20 조회수 23603 -
 소금쟁이 착안해 나노박막 물성 측정법 개발
-“수 nm 두께 나노박막의 기계적 물성도 손쉽게 측정할 수 있어”-- 네이처 커뮤니케이션즈 3일자 게재 -
우리 학교 기계공학과 김택수 교수와 한국기계연구원(원장 최태인) 나노역학연구실 현승민 박사 공동연구팀은 물 표면의 특성을 이용해 나노박막의 기계적 물성을 평가하는 새로운 방법을 개발했다.
연구결과는 세계적 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)" 3일자 온라인판에 게재됐다.
이번에 개발된 기술을 활용하면 직접 측정하기 어려운 나노박막의 강도, 탄성 등 기계적 물성을 직접 측정해 정확한 결과 값을 얻을 수 있다. 또 방법이 간단해 나노박막 기계적 물성 평가의 새로운 패러다임을 제시한 것으로 학계와 산업계는 평가하고 있다.
나노박막의 기계적 물성 평가는 반도체, 디스플레이 등의 신뢰성을 예측하는데 중요한 것은 물론 나노 세계의 새로운 현상을 발견하는데도 필요하다. 그러나 기계적 강도는 구조물이 바닥으로부터 떨어져 측정을 하는데 나노박막의 경우 쉽게 부서지는 문제점이 있어 시험이 어려웠다.
연구팀은 소금쟁이와 같은 곤충이 물의 표면 위를 자유로이 떠다니는 것에 착안했다.
연구팀은 표면 장력이 크고 낮은 점성을 갖는 물의 특성을 이용해 물 표면에 약 55nm(나노미터) 금나노박막을 띄워 놓고 손상 없이 기계적 물성을 정확하게 특정하는데 성공했다.
이 기술을 이용하면 다양한 종류의 나노박막 뿐만 아니라 두께가 수 나노미터에 이르는 박막의 기계적 물성까지도 측정할 수 있을 것으로 기대된다.
김택수 교수는 이번 연구에 대해 “물의 특성을 이용한 새로운 강도 시험 방법의 개발을 통해 기존에 접근하기 어려웠던 나노박막의 기계적 물성 평가를 효과적으로 수행할 수 있게 됐다”고 의의를 밝혔다.
또 “향후 기존의 강도 시험법으로는 측정이 불가능했던 그래핀과 같은 2차원 나노박막의 기계적 물성을 밝혀나갈 계획”이라고 말했다.
KAIST 기계공학전공 김재한 박사과정(제1저자) 학생이 KAIST 김택수 교수, 한국기계연구원 현승민 박사의 지도를 받아 수행한 이번 연구는 한국연구재단 신진연구지원사업, 한국기계연구원 주요연구 사업과 21세기 프론티어 사업의 지원으로 수행됐다.
<물 표면을 이용한 나노박막의 기계적 물성 평가 과정>
<왼쪽에서부터 현승민 박사, 김재한 박사과정생, 김택수 교수 (카이스트, 한국기계연구원 공동 연구팀)>
2013.10.14 조회수 19964
소금쟁이 착안해 나노박막 물성 측정법 개발
-“수 nm 두께 나노박막의 기계적 물성도 손쉽게 측정할 수 있어”-- 네이처 커뮤니케이션즈 3일자 게재 -
우리 학교 기계공학과 김택수 교수와 한국기계연구원(원장 최태인) 나노역학연구실 현승민 박사 공동연구팀은 물 표면의 특성을 이용해 나노박막의 기계적 물성을 평가하는 새로운 방법을 개발했다.
연구결과는 세계적 학술지 ‘네이처 커뮤니케이션즈(Nature Communications)" 3일자 온라인판에 게재됐다.
이번에 개발된 기술을 활용하면 직접 측정하기 어려운 나노박막의 강도, 탄성 등 기계적 물성을 직접 측정해 정확한 결과 값을 얻을 수 있다. 또 방법이 간단해 나노박막 기계적 물성 평가의 새로운 패러다임을 제시한 것으로 학계와 산업계는 평가하고 있다.
나노박막의 기계적 물성 평가는 반도체, 디스플레이 등의 신뢰성을 예측하는데 중요한 것은 물론 나노 세계의 새로운 현상을 발견하는데도 필요하다. 그러나 기계적 강도는 구조물이 바닥으로부터 떨어져 측정을 하는데 나노박막의 경우 쉽게 부서지는 문제점이 있어 시험이 어려웠다.
연구팀은 소금쟁이와 같은 곤충이 물의 표면 위를 자유로이 떠다니는 것에 착안했다.
연구팀은 표면 장력이 크고 낮은 점성을 갖는 물의 특성을 이용해 물 표면에 약 55nm(나노미터) 금나노박막을 띄워 놓고 손상 없이 기계적 물성을 정확하게 특정하는데 성공했다.
이 기술을 이용하면 다양한 종류의 나노박막 뿐만 아니라 두께가 수 나노미터에 이르는 박막의 기계적 물성까지도 측정할 수 있을 것으로 기대된다.
김택수 교수는 이번 연구에 대해 “물의 특성을 이용한 새로운 강도 시험 방법의 개발을 통해 기존에 접근하기 어려웠던 나노박막의 기계적 물성 평가를 효과적으로 수행할 수 있게 됐다”고 의의를 밝혔다.
또 “향후 기존의 강도 시험법으로는 측정이 불가능했던 그래핀과 같은 2차원 나노박막의 기계적 물성을 밝혀나갈 계획”이라고 말했다.
KAIST 기계공학전공 김재한 박사과정(제1저자) 학생이 KAIST 김택수 교수, 한국기계연구원 현승민 박사의 지도를 받아 수행한 이번 연구는 한국연구재단 신진연구지원사업, 한국기계연구원 주요연구 사업과 21세기 프론티어 사업의 지원으로 수행됐다.
<물 표면을 이용한 나노박막의 기계적 물성 평가 과정>
<왼쪽에서부터 현승민 박사, 김재한 박사과정생, 김택수 교수 (카이스트, 한국기계연구원 공동 연구팀)>
2013.10.14 조회수 19964