%EC%88%98%EB%A6%AC%EA%B3%BC%ED%95%99%EA%B3%BC
-
 정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
2025.07.03 조회수 107
정확도·효율성 높인 생명과학 데이터 분석 도구 'scICE' 개발
기존보다 최대 30배 빠른 속도로 안정적인 결과만을 자동으로 선별하여 대규모 생명과학 데이터 분석의 정확도와 효율성을 획기적으로 향상하는 방법이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀은 세포 분류(클러스터링) 결과의 안정성을 수학적으로 평가해 불안정한 결과를 걸러내는 새로운 분석 도구인 ‘scICE(single-cell Inconsistency Clustering Estimator)’를 개발했다.
단일세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석법(scRNA-seq)은 현대 생명과학 연구의 핵심 도구로 자리 잡았다. 이 과정에서 클러스터링은 유사한 유전자 발현 특성을 가진 세포들을 그룹으로 묶는 작업으로, 암세포와 정상 세포를 구분하거나 새로운 세포 유형을 발견하는 데 중요한 첫걸음이다. 하지만 클러스터링 알고리즘은 무작위로 세포를 분류해 같은 데이터를 분석해도 결과가 달라지는 경우가 많다.
제1 저자인 김현 선임연구원은 “일부 정상 세포가 암세포로 잘못 분류되거나 중요한 세포 유형이 누락되는 불안정성으로 인해 연구자들은 다시 분석하거나 복잡한 계산을 통해 신뢰도가 높은 결과를 선별해야 했다”며, “기존 방법들은 분석을 여러 번 반복해 합의된 결과를 도출하는 방식으로, 계산량이 방대하고 수만 개 이상의 세포가 포함된 대용량 데이터에는 적합하지 않다”고 말했다.
연구팀이 개발한 scICE는 한 번의 분석만으로도 얼마나 일관성 있게 결과가 도출됐는지를 수학적으로 평가한다. 새로 도입한 ‘불일치 계수(Inconsistency Coefficient, IC)’를 통해 많은 계산량이 요구되는 연산 없이도 클러스터 간 안정성을 정량적으로 판단할 수 있다. 모든 세포를 일일이 비교하던 기존 방식과 달리, 불일치 계수를 활용한 안정성 평가는 클러스터 구조 간 유사성만 평가해 비교 대상을 획기적으로 줄일 수 있어 분석 시간을 크게 단축한다.
연구팀은 뇌, 폐, 혈액 등 다양한 조직에서 수집된 48개의 실제 및 모의 scRNA-seq 데이터에 scICE를 적용하여 그 유효성을 입증했다. 그 결과, 기존 분석 결과 중 약 3분의 2는 통계적으로 불안정하며 신뢰하기 어렵다는 사실을 밝혀냈다. 반면, scICE는 신뢰할 수 있는 결과만을 선별해 연구자의 시간과 계산 자원을 절약하면서도 정확도를 한층 높였다.
또한, scICE는 일반적인 클러스터링으로는 놓치기 쉬운 희귀한 세포 유형을 효과적으로 탐지했다. 실제로 일부 데이터에서 찾기 어려웠던 희귀 면역세포들을 scICE 기반의 서브클러스터링을 통해 안정적으로 식별해냈다. 예를 들어, 매우 복잡한 분석을 거쳐야만 식별할 수 있던 여러 대식세포(macrophage) 아형들을 훨씬 간편하고 정확하게 구분해냈다.
scICE에 관심 있는 연구자는 누구나 깃허브 사이트(https://github.com/Mathbiomed/scICE)를 통해 쉽게 활용해볼 수 있다.
김재경 교수는 “이번 연구는 수학적 아이디어가 어떻게 생명과학의 핵심 문제를 해결하고 분석 과정을 혁신할 수 있는지를 보여주는 성과”라며, “클러스터링 신뢰도의 중요성이 간과되어 온 측면이 있는데, 이번 기회로 scICE가 생명과학 분야에서 신뢰도 높은 데이터 해석을 가능케 하는 표준 도구로 자리 잡기를 기대한다”고 전했다.
우리 대학 박종은 교수 연구팀, POSTECH 김종경 교수 연구팀, 고려대 서민석 교수 연구팀과 공동으로 참여한 이번 연구결과는 세계적인 국제학술지 네이처 커뮤니케이션즈(Nature Communications, IF 14.7)에 7월 2일 온라인 게재됐다.
2025.07.03 조회수 107 -
 6만 편 논문 대신할 ‘한번의 실험’으로 약물 저해효과 정확 예측
기존 신약 개발에서는 수많은 농도 조건에서 반복 실험을 거쳐 약물 간 상호작용을 분석하고, 저해상수를 추정하는 방식이 사용돼 왔다. 이 방법은 지금까지 6만 편 이상의 논문에 활용될 만큼 널리 쓰였다. 그런데 최근, 학부생이 제 1저자로 참여한 국내 연구진이 단 하나의 저해제 농도만으로 저해상수를 정확히 추정할 수 있는 획기적인 분석법을 제안해 주목을 받고 있다.
우리 대학 수리과학과 김재경 교수 연구팀(IBS 의생명 수학 그룹 CI)이 충남대(총장 김정겸) 약대 김상겸 교수팀과 기초과학연구원(원장 노도영, IBS) 의생명수학그룹과 공동연구를 통해, 단 하나의 실험으로 약물 저해 효과*를 예측할 수 있다고 26일 밝혔다.
*약물 저해 효과: 한 약물이 특정 효소의 작용을 억제함으로써 다른 약물의 대사(분해 및 처리 과정) 또는 생리학적 효과에 영향을 주는 현상
공동 연구팀은 수학적 모델링과 오차 지형 분석을 통해 정확도 향상에 기여하지 않는 저해제 농도를 제거하고, 단 하나의 농도만으로도 저해상수를 정확하게 추정할 수 있는 새로운 분석법 ‘50-BOA’를 제안했다. 이 기법을 실제 실험 데이터에 적용한 결과, 기존보다 75% 이상 실험 효율이 향상됐으며, 정확도 역시 개선됐다.
이번 연구는 반복 실험에 따른 자원 소모를 줄이고 해석의 편차를 최소화함으로써, 신약 개발 과정의 효율성을 높일 수 있는 새로운 접근법을 제시했다는 점에서 큰 의의가 있다. 또한, 수학적 접근이 생명과학 실험 설계를 어떻게 혁신할 수 있는지를 보여주는 대표적인 성과로 평가된다.
저해상수는 약물 효과뿐 아니라, 병용 투여 시 발생할 수 있는 약물상호작용을 예측하고 방지하는 데 핵심적인 지표로 활용된다. 실제로 미국 식품의약국(FDA)은 신약 개발 과정에서 약물상호작용의 가능성을 예측하기 위해 저해상수를 포함한 효소의 저해 특성을 사전에 평가할 것을 권고하고 있다.
전통적으로 저해상수는 다양한 기질 및 저해제 농도에서 측정된 대사 속도 데이터에 수학 모델을 적합해 추정해왔다. 그러나 이러한 방식에도 불구하고, 동일한 기질-저해제 조합에 대해 연구마다 추정값이 10배 이상 차이나는 사례들이 보고돼, 신약 개발 과정에서 약물의 효과와 부작용을 정확히 예측하는 데 어려움이 있었다.
연구팀은 저해상수 추정 과정을 수학적으로 분석한 결과, 기존 방식에서 활용되는 데이터의 절반 이상이 실제 추정에 불필요하거나, 오히려 왜곡을 초래할 수 있음을 밝혀냈다.
즉, 저해제 농도를 다양하게 사용하는 기존 방식보다, 충분히 높은 저해제 농도 하나에서 추정한 결과가 더 정확하고 효율적일 수 있다는 점을 규명한 것이다. 나아가 저해제 농도와 저해상수 간의 관계를 나타내는 식을 정칙화로 추가해, 정확도를 더욱 높인 새로운 분석법, ‘50-BOA’를 개발했다.
50-BOA는 단 하나의 저해제 농도만으로도 저해상수를 정확하게 추정할 수 있어, 실험 횟수를 크게 줄이면서도 오히려 정확도를 높인 획기적인 기법이다. 연구팀은 이 방법을 실제 약물 데이터에 적용해, 기존보다 75% 이상 적은 데이터만으로도 저해상수를 정확하게 추정해냈다.
또한, 누구나 쉽게 활용할 수 있도록 엑셀 기반의 사용자 친화적인 분석 소프트웨어도 개발자 플랫폼인 깃허브(https://github.com/Mathbiomed/50-BOA)에 함께 공개했다.
충남대 김상겸 교수는 “이번 연구는 수십 년간 정형화된 약물 실험 설계를 근본적으로 재검토하게 만들었다”며, “단순한 실험 효율 향상을 넘어, 약효와 부작용 예측의 정확도를 높일 수 있는 새로운 표준이 될 것으로 기대한다”고 밝혔다.
또한, 우리 대학 김재경 교수는 “수학이 실험 설계를 바꾸고, 생명과학 분야의 연구 효율성과 재현성을 근본적으로 높일 수 있음을 보여주는 대표적 사례다”고 밝혔다.
이번 연구 논문은 우리 대학 융합인재학부 장형준 학사과정과 수리과학과 송윤민 박사가 공동 제1 저자로 참여하였고 국제 학술지 네이처 커뮤니케이션즈(Nature Communications)에 2025년 6월 5일 자에 게재됐다.
※ 논문명 : Optimizing enzyme inhibition analysis: precise estimation with a single inhibitor concentration
※ 저자 정보 : 장형준 (KAIST 융합인재학부, 공동 제1 저자), 송윤민 (IBS 의생명수학그룹 (전 KAIST 수리과학과 소속), 공동 제1저자), 전장수(충남대 약대, 연구교수, 공동저자), 윤휘열(충남대 약대, 교수, 공동저자), 김상겸(충남대 약대, 교수, 교신저자), 김재경 (KAIST 수리과학과, 교신저자)
※ DOI: https://doi.org/10.1038/s41467-025-60468-z
한편 이번 연구는 한국연구재단, 기초과학연구원, KAIST의 지원을 받아 수행됐다.
2025.06.16 조회수 1902
6만 편 논문 대신할 ‘한번의 실험’으로 약물 저해효과 정확 예측
기존 신약 개발에서는 수많은 농도 조건에서 반복 실험을 거쳐 약물 간 상호작용을 분석하고, 저해상수를 추정하는 방식이 사용돼 왔다. 이 방법은 지금까지 6만 편 이상의 논문에 활용될 만큼 널리 쓰였다. 그런데 최근, 학부생이 제 1저자로 참여한 국내 연구진이 단 하나의 저해제 농도만으로 저해상수를 정확히 추정할 수 있는 획기적인 분석법을 제안해 주목을 받고 있다.
우리 대학 수리과학과 김재경 교수 연구팀(IBS 의생명 수학 그룹 CI)이 충남대(총장 김정겸) 약대 김상겸 교수팀과 기초과학연구원(원장 노도영, IBS) 의생명수학그룹과 공동연구를 통해, 단 하나의 실험으로 약물 저해 효과*를 예측할 수 있다고 26일 밝혔다.
*약물 저해 효과: 한 약물이 특정 효소의 작용을 억제함으로써 다른 약물의 대사(분해 및 처리 과정) 또는 생리학적 효과에 영향을 주는 현상
공동 연구팀은 수학적 모델링과 오차 지형 분석을 통해 정확도 향상에 기여하지 않는 저해제 농도를 제거하고, 단 하나의 농도만으로도 저해상수를 정확하게 추정할 수 있는 새로운 분석법 ‘50-BOA’를 제안했다. 이 기법을 실제 실험 데이터에 적용한 결과, 기존보다 75% 이상 실험 효율이 향상됐으며, 정확도 역시 개선됐다.
이번 연구는 반복 실험에 따른 자원 소모를 줄이고 해석의 편차를 최소화함으로써, 신약 개발 과정의 효율성을 높일 수 있는 새로운 접근법을 제시했다는 점에서 큰 의의가 있다. 또한, 수학적 접근이 생명과학 실험 설계를 어떻게 혁신할 수 있는지를 보여주는 대표적인 성과로 평가된다.
저해상수는 약물 효과뿐 아니라, 병용 투여 시 발생할 수 있는 약물상호작용을 예측하고 방지하는 데 핵심적인 지표로 활용된다. 실제로 미국 식품의약국(FDA)은 신약 개발 과정에서 약물상호작용의 가능성을 예측하기 위해 저해상수를 포함한 효소의 저해 특성을 사전에 평가할 것을 권고하고 있다.
전통적으로 저해상수는 다양한 기질 및 저해제 농도에서 측정된 대사 속도 데이터에 수학 모델을 적합해 추정해왔다. 그러나 이러한 방식에도 불구하고, 동일한 기질-저해제 조합에 대해 연구마다 추정값이 10배 이상 차이나는 사례들이 보고돼, 신약 개발 과정에서 약물의 효과와 부작용을 정확히 예측하는 데 어려움이 있었다.
연구팀은 저해상수 추정 과정을 수학적으로 분석한 결과, 기존 방식에서 활용되는 데이터의 절반 이상이 실제 추정에 불필요하거나, 오히려 왜곡을 초래할 수 있음을 밝혀냈다.
즉, 저해제 농도를 다양하게 사용하는 기존 방식보다, 충분히 높은 저해제 농도 하나에서 추정한 결과가 더 정확하고 효율적일 수 있다는 점을 규명한 것이다. 나아가 저해제 농도와 저해상수 간의 관계를 나타내는 식을 정칙화로 추가해, 정확도를 더욱 높인 새로운 분석법, ‘50-BOA’를 개발했다.
50-BOA는 단 하나의 저해제 농도만으로도 저해상수를 정확하게 추정할 수 있어, 실험 횟수를 크게 줄이면서도 오히려 정확도를 높인 획기적인 기법이다. 연구팀은 이 방법을 실제 약물 데이터에 적용해, 기존보다 75% 이상 적은 데이터만으로도 저해상수를 정확하게 추정해냈다.
또한, 누구나 쉽게 활용할 수 있도록 엑셀 기반의 사용자 친화적인 분석 소프트웨어도 개발자 플랫폼인 깃허브(https://github.com/Mathbiomed/50-BOA)에 함께 공개했다.
충남대 김상겸 교수는 “이번 연구는 수십 년간 정형화된 약물 실험 설계를 근본적으로 재검토하게 만들었다”며, “단순한 실험 효율 향상을 넘어, 약효와 부작용 예측의 정확도를 높일 수 있는 새로운 표준이 될 것으로 기대한다”고 밝혔다.
또한, 우리 대학 김재경 교수는 “수학이 실험 설계를 바꾸고, 생명과학 분야의 연구 효율성과 재현성을 근본적으로 높일 수 있음을 보여주는 대표적 사례다”고 밝혔다.
이번 연구 논문은 우리 대학 융합인재학부 장형준 학사과정과 수리과학과 송윤민 박사가 공동 제1 저자로 참여하였고 국제 학술지 네이처 커뮤니케이션즈(Nature Communications)에 2025년 6월 5일 자에 게재됐다.
※ 논문명 : Optimizing enzyme inhibition analysis: precise estimation with a single inhibitor concentration
※ 저자 정보 : 장형준 (KAIST 융합인재학부, 공동 제1 저자), 송윤민 (IBS 의생명수학그룹 (전 KAIST 수리과학과 소속), 공동 제1저자), 전장수(충남대 약대, 연구교수, 공동저자), 윤휘열(충남대 약대, 교수, 공동저자), 김상겸(충남대 약대, 교수, 교신저자), 김재경 (KAIST 수리과학과, 교신저자)
※ DOI: https://doi.org/10.1038/s41467-025-60468-z
한편 이번 연구는 한국연구재단, 기초과학연구원, KAIST의 지원을 받아 수행됐다.
2025.06.16 조회수 1902 -
 기후 변화가 뎅기열 확산 가속한다
뎅기열이 전 세계적으로 역대 최고 확산세를 기록하고 있는 가운데, 기후 변화가 뎅기열 확산을 가속한다는 분석이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀이 자체 개발한 수학 모델로 기후 변화가 뎅기열 발병에 미치는 영향을 분석한 결과, 필리핀의 기온 상승과 강우 패턴 변화가 뎅기열 발생 증가와 밀접한 관련이 있음을 밝혀냈다.
뎅기열은 모기를 통해 전파되는 바이러스성 감염병이다. 세계보건기구(WHO)에 보고된 감염 사례만 2000년 50만 명에서 2019년 520만 명으로 20년 만에 10배가량 가까이 증가했다. 급격한 증가의 주요 원인으로는 기후 변화가 지목된다. 이상 고온 현상과 극단 강우 현상이 모기 번식에 유리한 환경을 조성하기 때문이다.
하지만 기후 요인과 뎅기열 발병 사이의 복잡한 상호작용에 대한 이해는 아직 제한적이다. 특히, 강우량의 영향에 대해서는 학계의 오랜 논쟁이 있어 왔다. 높은 강우량이 뎅기열 발병을 유발한다는 결과와 억제한다는 결과가 비슷한 숫자로 존재하기 때문이다.
제1 저자인 올리비아 카위딩 연구원은 “이런 모순된 결과는 기존 연구가 기후와 뎅기열 간의 상호작용을 단순히 상관관계나 선형 회귀 모델에 기반해 분석했기 때문”이라며 “우리 연구진은 기존 방식을 넘어 비선형적이고 복합적인 기후 요인의 영향이 정확히 예측할 수 있는 도구를 활용해 연구를 진행했다”고 설명했다.
연구진은 자체 개발한 인과관계 추정 방법론인 ‘GOBI(General ODE-Based Inference)’를 활용해 2015~2019년 필리핀 16개 지역의 기후 및 뎅기열 데이터를 분석했다. 분석 결과, 모든 지역에서 기온 상승이 뎅기열 발병을 증가시키는 주요 요인으로 작용했다.
반면, 강우량의 경우 지역에 따라 서로 다른 영향을 미쳤다. 동부 지역에서는 강우량 증가가 뎅기열 발병을 증가시키는 경향을 보였으나, 서부 지역에서는 감소시키는 경향이 나타났다.
이어 연구진은 강우의 효과가 지역별로 달라지는 원인도 찾아냈다. ‘건기의 규칙성’이 강우와 뎅기열 발병 간의 관계를 결정짓는 중요한 요인이었다. 건기가 규칙적으로 유지되는 지역(서부)에서는 강우가 뎅기열 발병을 억제했지만, 규칙성이 약화된 지역(동부)에서는 강우가 뎅기열 발병을 촉진했다.
건기가 규칙적인 지역에서는 건기 동안 물이 고여 있는 모기 서식지가 강우에 의해 쉽게 제거돼 뎅기열 발생을 억제하는 ‘플러싱 효과(Flushing Effect)’가 강하게 나타난다. 이와 달리 건기가 불규칙적인 지역에서는 강우가 산발적으로 발생해 플러싱 효과가 약화되고, 오히려 모기 번식지를 형성해 뎅기열 발생을 촉진한다는 것이다.
이번 연구는 기후 변화가 뎅기열 발병에 미치는 복잡한 영향을 이해하고, 지역별 특성을 고려한 맞춤형 공중보건 전략을 설계하는 데 중요한 과학적 근거를 제공했다는 의미가 있다. 연구진은 필리핀 외의 지역으로 확장해 푸에르토리코 등 다른 지역에서도 유사한 패턴이 나타남을 확인했다. 다양한 기후 환경에 적용 가능한 일반성을 지닌다는 의미다.
연구를 이끈 김재경 교수는 “‘건기의 규칙성’은 기존 연구에서 간과된 부분으로 우리 연구는 뎅기열 발병에 대한 새로운 해석을 제공했다는 의미가 높다”며 “기후 변화가 뎅기열, 말라리아, 독감, 지카 등 기후 민감 질병에 미치는 영향을 이해하는 데 중요한 전환점을 제시한 것으로, 향후 자원 배분 및 예방 전략 수립을 위한 핵심 정보로 사용되길 바란다”고 말했다.
연구결과는 2월 13일(목) 04시(한국시간) 국제학술지 ‘사이언스 어드밴시스(Science Advances)’온라인판에 실렸다.
2025.02.13 조회수 3342
기후 변화가 뎅기열 확산 가속한다
뎅기열이 전 세계적으로 역대 최고 확산세를 기록하고 있는 가운데, 기후 변화가 뎅기열 확산을 가속한다는 분석이 나왔다. 우리 대학 수리과학과 김재경 교수 연구팀이 자체 개발한 수학 모델로 기후 변화가 뎅기열 발병에 미치는 영향을 분석한 결과, 필리핀의 기온 상승과 강우 패턴 변화가 뎅기열 발생 증가와 밀접한 관련이 있음을 밝혀냈다.
뎅기열은 모기를 통해 전파되는 바이러스성 감염병이다. 세계보건기구(WHO)에 보고된 감염 사례만 2000년 50만 명에서 2019년 520만 명으로 20년 만에 10배가량 가까이 증가했다. 급격한 증가의 주요 원인으로는 기후 변화가 지목된다. 이상 고온 현상과 극단 강우 현상이 모기 번식에 유리한 환경을 조성하기 때문이다.
하지만 기후 요인과 뎅기열 발병 사이의 복잡한 상호작용에 대한 이해는 아직 제한적이다. 특히, 강우량의 영향에 대해서는 학계의 오랜 논쟁이 있어 왔다. 높은 강우량이 뎅기열 발병을 유발한다는 결과와 억제한다는 결과가 비슷한 숫자로 존재하기 때문이다.
제1 저자인 올리비아 카위딩 연구원은 “이런 모순된 결과는 기존 연구가 기후와 뎅기열 간의 상호작용을 단순히 상관관계나 선형 회귀 모델에 기반해 분석했기 때문”이라며 “우리 연구진은 기존 방식을 넘어 비선형적이고 복합적인 기후 요인의 영향이 정확히 예측할 수 있는 도구를 활용해 연구를 진행했다”고 설명했다.
연구진은 자체 개발한 인과관계 추정 방법론인 ‘GOBI(General ODE-Based Inference)’를 활용해 2015~2019년 필리핀 16개 지역의 기후 및 뎅기열 데이터를 분석했다. 분석 결과, 모든 지역에서 기온 상승이 뎅기열 발병을 증가시키는 주요 요인으로 작용했다.
반면, 강우량의 경우 지역에 따라 서로 다른 영향을 미쳤다. 동부 지역에서는 강우량 증가가 뎅기열 발병을 증가시키는 경향을 보였으나, 서부 지역에서는 감소시키는 경향이 나타났다.
이어 연구진은 강우의 효과가 지역별로 달라지는 원인도 찾아냈다. ‘건기의 규칙성’이 강우와 뎅기열 발병 간의 관계를 결정짓는 중요한 요인이었다. 건기가 규칙적으로 유지되는 지역(서부)에서는 강우가 뎅기열 발병을 억제했지만, 규칙성이 약화된 지역(동부)에서는 강우가 뎅기열 발병을 촉진했다.
건기가 규칙적인 지역에서는 건기 동안 물이 고여 있는 모기 서식지가 강우에 의해 쉽게 제거돼 뎅기열 발생을 억제하는 ‘플러싱 효과(Flushing Effect)’가 강하게 나타난다. 이와 달리 건기가 불규칙적인 지역에서는 강우가 산발적으로 발생해 플러싱 효과가 약화되고, 오히려 모기 번식지를 형성해 뎅기열 발생을 촉진한다는 것이다.
이번 연구는 기후 변화가 뎅기열 발병에 미치는 복잡한 영향을 이해하고, 지역별 특성을 고려한 맞춤형 공중보건 전략을 설계하는 데 중요한 과학적 근거를 제공했다는 의미가 있다. 연구진은 필리핀 외의 지역으로 확장해 푸에르토리코 등 다른 지역에서도 유사한 패턴이 나타남을 확인했다. 다양한 기후 환경에 적용 가능한 일반성을 지닌다는 의미다.
연구를 이끈 김재경 교수는 “‘건기의 규칙성’은 기존 연구에서 간과된 부분으로 우리 연구는 뎅기열 발병에 대한 새로운 해석을 제공했다는 의미가 높다”며 “기후 변화가 뎅기열, 말라리아, 독감, 지카 등 기후 민감 질병에 미치는 영향을 이해하는 데 중요한 전환점을 제시한 것으로, 향후 자원 배분 및 예방 전략 수립을 위한 핵심 정보로 사용되길 바란다”고 말했다.
연구결과는 2월 13일(목) 04시(한국시간) 국제학술지 ‘사이언스 어드밴시스(Science Advances)’온라인판에 실렸다.
2025.02.13 조회수 3342 -
 전염병 확산 예측하는 더 정확한 수학 공식 나왔다
인류와 전염병의 전쟁에서 수학은 최적의 방어막 구축을 위한 과학적 근거를 제시해왔다. 우리 대학 김재경 교수 연구팀은 국가수리과학연구소 최선화 선임연구원, 고려대 최보승 교수, 경북대 이효정 교수팀과 공동으로 정확도를 획기적으로 높인 전염병 확산 예측 모델을 새롭게 제시했다.
미지의 바이러스가 나타나면 과학자들은 구조와 실체를 파악하고, 제약사는 바이러스에 대항할 백신과 치료제를 개발한다. 바이러스를 제압할 무기를 만드는 동안, 방역은 국민을 보호하고 피해를 최소화하는 방어막 역할을 한다. 피해를 정확하게 예측하고, 의료진을 배치하고, 병상을 확보하는 등 대책 수립에 수학이 쓰인다.
코로나19 팬데믹은 수리 모델 기반 전염병 확산 모델의 중요성을 재조명하게 해준 사례다. 이를 통해 추정한 감염재생산지수(R값), 잠복기, 감염기 등 변수들은 질병의 확산 양상을 이해하고, 방역 정책을 설계하는 데 중요한 요소로 작용했다.
그러나 기존 모델에는 한계가 있었다. 기존 대부분 모델은 감염자와 접촉한 시점에 상관없이 모든 접촉자가 동일 확률로 감염력이 발현된다고 가정한다. 미래 상태가 현재 상태에 의해서만 결정되고, 과거의 영향을 받지 않는다는 마르코프(Markovian) 시스템에 기반하여 미래를 추정해왔다.
하지만 실제 환경에서는 현재뿐 아니라 과거 상태도 미래에 영향을 준다(비마르코프(non-Markovian) 시스템). 감염자와 접촉 이후 잠복기를 거쳐 감염되기 때문에, 접촉 시점이 오래된 사람일수록 감염력이 발현될 확률이 높다.
최보승 교수는 “현재와 과거를 모두 고려해야 하는 비마르코프 시스템은 수학적 추정과 모델링이 복잡하고, 계산이 어려워서 기존 전염병 확산 모델은 마르코프 시스템을 가정하고 추정을 진행해왔다”며 “즉, 실제 감염병 확산 양상을 정확하게 반영하지는 못했다”고 설명했다.
공동 연구팀은 현재와 과거를 모두 고려하는 새로운 감염병 확산 모델을 개발했다. 미래의 변화를 현재의 상태만으로 설명하는 상미분방정식 대신, 미래의 변화를 현재와 과거의 상태를 모두 이용하여 설명하는 지연미분방정식을 도입해 기존 모델의 한계를 극복했다.
연구진은 2020년 1월 20일부터 11월 25일까지 서울의 누적 코로나19 확진자 정보를 활용해 새로 제시한 모델의 정확도를 평가했다. 초기 바이러스의 전파로 확진자가 급증했던 시기(2020.1.20.~3.3)의 감염재생산지수를 기존 모델은 4.9, 새 모델은 2.7로 추정했다. 확진자 전염 경로를 추적해 얻은 실제 값은 2.7이었다. 즉, 기존 모델이 감염재생산지수를 2배 가까이 과대 추정하는 상황이 생길 수 있고, 이에 따라 코로나19 감염력을 과대 예측할 수 있다는 것을 보여준다.
최선화 선임연구원은 “과대 예측 문제를 해결하기 위해 기존 모델은 감염기(감염자가 다른 사람에게 전염을 일으킬 수 있는 기간) 등 추가 역학 정보를 사용해 값을 보정해 사용해왔다”며 “새로운 모델은 추가 역학 정보 없이도 감염재생산지수를 정확히 추정할 수 있다는 장점이 있다”고 설명했다.
연구를 이끈 김재경 교수는 “우리 연구진은 새로운 모델을 바탕으로 ‘IONISE(Inference Of Non-markovIan SEir model)’라는 프로그램을 개발하여, 분야 연구자들이 활용할 수 있도록 무료로 공개했다”며 “향후 공중보건 전문가들이 전염병 확산 양상을 보다 깊이 이해하고, 효과적인 방역 전략을 수립하도록 도울 것으로 기대한다”고 말했다.
연구 결과는 10월 9일 국제학술지 ‘네이처 커뮤니케이션스(Nature Communications, IF 14.7)’에 실렸다.
※ 논문명: Overcoming Bias in Estimating Epidemiological Parameters with Realistic History-Dependent Disease Spread Dynamics(제1저자: 홍혁표, 엄은진)
2024.10.17 조회수 17261
전염병 확산 예측하는 더 정확한 수학 공식 나왔다
인류와 전염병의 전쟁에서 수학은 최적의 방어막 구축을 위한 과학적 근거를 제시해왔다. 우리 대학 김재경 교수 연구팀은 국가수리과학연구소 최선화 선임연구원, 고려대 최보승 교수, 경북대 이효정 교수팀과 공동으로 정확도를 획기적으로 높인 전염병 확산 예측 모델을 새롭게 제시했다.
미지의 바이러스가 나타나면 과학자들은 구조와 실체를 파악하고, 제약사는 바이러스에 대항할 백신과 치료제를 개발한다. 바이러스를 제압할 무기를 만드는 동안, 방역은 국민을 보호하고 피해를 최소화하는 방어막 역할을 한다. 피해를 정확하게 예측하고, 의료진을 배치하고, 병상을 확보하는 등 대책 수립에 수학이 쓰인다.
코로나19 팬데믹은 수리 모델 기반 전염병 확산 모델의 중요성을 재조명하게 해준 사례다. 이를 통해 추정한 감염재생산지수(R값), 잠복기, 감염기 등 변수들은 질병의 확산 양상을 이해하고, 방역 정책을 설계하는 데 중요한 요소로 작용했다.
그러나 기존 모델에는 한계가 있었다. 기존 대부분 모델은 감염자와 접촉한 시점에 상관없이 모든 접촉자가 동일 확률로 감염력이 발현된다고 가정한다. 미래 상태가 현재 상태에 의해서만 결정되고, 과거의 영향을 받지 않는다는 마르코프(Markovian) 시스템에 기반하여 미래를 추정해왔다.
하지만 실제 환경에서는 현재뿐 아니라 과거 상태도 미래에 영향을 준다(비마르코프(non-Markovian) 시스템). 감염자와 접촉 이후 잠복기를 거쳐 감염되기 때문에, 접촉 시점이 오래된 사람일수록 감염력이 발현될 확률이 높다.
최보승 교수는 “현재와 과거를 모두 고려해야 하는 비마르코프 시스템은 수학적 추정과 모델링이 복잡하고, 계산이 어려워서 기존 전염병 확산 모델은 마르코프 시스템을 가정하고 추정을 진행해왔다”며 “즉, 실제 감염병 확산 양상을 정확하게 반영하지는 못했다”고 설명했다.
공동 연구팀은 현재와 과거를 모두 고려하는 새로운 감염병 확산 모델을 개발했다. 미래의 변화를 현재의 상태만으로 설명하는 상미분방정식 대신, 미래의 변화를 현재와 과거의 상태를 모두 이용하여 설명하는 지연미분방정식을 도입해 기존 모델의 한계를 극복했다.
연구진은 2020년 1월 20일부터 11월 25일까지 서울의 누적 코로나19 확진자 정보를 활용해 새로 제시한 모델의 정확도를 평가했다. 초기 바이러스의 전파로 확진자가 급증했던 시기(2020.1.20.~3.3)의 감염재생산지수를 기존 모델은 4.9, 새 모델은 2.7로 추정했다. 확진자 전염 경로를 추적해 얻은 실제 값은 2.7이었다. 즉, 기존 모델이 감염재생산지수를 2배 가까이 과대 추정하는 상황이 생길 수 있고, 이에 따라 코로나19 감염력을 과대 예측할 수 있다는 것을 보여준다.
최선화 선임연구원은 “과대 예측 문제를 해결하기 위해 기존 모델은 감염기(감염자가 다른 사람에게 전염을 일으킬 수 있는 기간) 등 추가 역학 정보를 사용해 값을 보정해 사용해왔다”며 “새로운 모델은 추가 역학 정보 없이도 감염재생산지수를 정확히 추정할 수 있다는 장점이 있다”고 설명했다.
연구를 이끈 김재경 교수는 “우리 연구진은 새로운 모델을 바탕으로 ‘IONISE(Inference Of Non-markovIan SEir model)’라는 프로그램을 개발하여, 분야 연구자들이 활용할 수 있도록 무료로 공개했다”며 “향후 공중보건 전문가들이 전염병 확산 양상을 보다 깊이 이해하고, 효과적인 방역 전략을 수립하도록 도울 것으로 기대한다”고 말했다.
연구 결과는 10월 9일 국제학술지 ‘네이처 커뮤니케이션스(Nature Communications, IF 14.7)’에 실렸다.
※ 논문명: Overcoming Bias in Estimating Epidemiological Parameters with Realistic History-Dependent Disease Spread Dynamics(제1저자: 홍혁표, 엄은진)
2024.10.17 조회수 17261 -
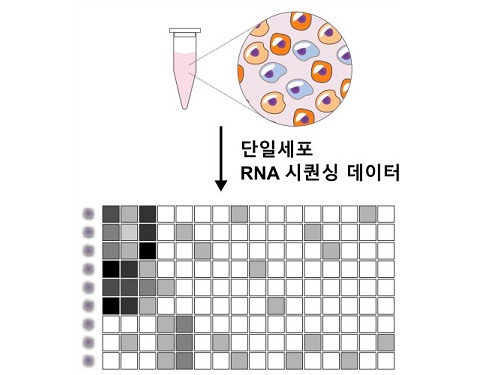 개인 맞춤형 정밀 의학 정확도 높일 ‘렌즈’ 개발
평균이 아닌 개인차를 고려하는 정밀 의학 시대가 열렸다. 사람마다 다른 유전적 특징을 알아내는 기술이 비약적으로 발전한 덕분이다. 더 빠르고, 정확하게 전사체를 해독할 수 있는 새로운 도구가 개발됐다. 우리 대학 수리과학과 김재경 교수(IBS 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 전사체 분석 빅데이터에서 유용한 생물학적 정보만 골라내는 새로운 도구인 ‘scLENS(single-cell Low-dimension Embedding using Effective Noise Subtraction)’를 개발했다.
단일세포 전사체 분석은 최근 생물학, 신약 개발, 임상 연구 등 여러 분야에서 주목받는 도구다. 개별 세포 단위에서 유전적 변화를 확인할 수 있기 때문이다. 가령, 단일세포 전사체 분석을 이용하면 암 조직 내 수십 가지 종류의 세포를 구분하고, 유전적 변이가 발생한 세포만 표적하는 정밀 치료가 가능해진다.
단일세포 전사체 분석 기술이 임상에 광범위하게 이용되려면, 도출되는 빅데이터에서 유용한 생물학적 신호를 찾아내는 효율적인 분석 도구 개발이 선행돼야 한다. 단일세포 전사체 분석은 수백~수천 개에 이르는 개별 세포의 수만 개에 이르는 다양한 유전자 발현량을 측정하기 때문에 데이터 용량이 수~수십 GB에 달한다. 이 방대한 데이터 중 생물학적으로 유용한 신호는 3% 내외에 불과하다.
이 방대하고 노이즈(잡신호)가 많은 데이터에서 유용한 생물학적 신호를 골라내기 위해 지금까지 여러 데이터 처리 도구가 개발됐다. 하지만 기존 도구는 사용자가 생물학적 신호와 노이즈의 ‘경계선’을 직접 설정해야 해서 주관이 개입됐다. 즉, 분석가에 따라 결과가 크게 달라지고, 정확도가 떨어진다는 한계가 있었다.
우선, 연구진은 기존 분석 도구들이 부정확한 근본적인 원인을 규명하고 해결책을 제시했다. 사용자가 노이즈의 임계값을 결정하는 데이터 전처리 방식 자체가 생물학적 신호를 왜곡시킨다는 것을 규명하고, 왜곡 없는 새로운 전처리 방식을 개발했다. 나아가 연구진은 수학적 방법론인 ‘랜덤 행렬 이론’을 이용해 사용자의 주관적 선택 없이 자동으로 단일세포 전사체 분석 데이터에서 신호와 노이즈를 구별하는 프로그램인 ‘scLENS’를 개발했다.
제1 저자인 김현 연구원은 “scLENS는 사용자의 선택 없이 데이터에 내재된 구조만을 이용해 자동으로 신호와 노이즈를 구별하기 때문에 사용자 편향성 문제를 원천 차단할 수 있다”며 “연구자들의 노동집약적인 신호 선택 과정을 없애면서도 분석 정확성은 높였다”고 설명했다.
이어 연구진은 기존 개발된 11가지 데이터 분석 프로그램과 scLENS의 상대적 성능을 비교했다. 이를 통해 scLENS가 다른 모든 프로그램보다 우수한 성능을 보인다는 점을 확인할 수 있었다. 널리 쓰이는 프로그램인 ‘Seurat’과 비교했을 때 scLENS는 세포 그룹화 성능이 약 10% 이상 우수하며, 데이터에 내재된 국소 구조를 43% 더 효과적으로 포착하는 것으로 나타났다.
특히, scLENS는 기존 프로그램보다 많은 계산을 하지만 메모리 사용 최적화를 통해 10만 개의 세포와 2만 개의 유전자로 이뤄진 대규모 데이터를 3시간 만에 분석하는 경쟁력 있는 분석 속도를 보였다.
연구를 이끈 김재경 CI는 “지난 십여 년간 단일세포 전사체를 분석할 수 있는 실험 기술의 비약적인 발전했지만, 데이터 분석 방법의 한계로 인해 큰 비용과 시간을 투자해 얻은 데이터를 최대한 활용하지 못하는 경우가 많았다”며 “기초 수학 이론이 생명과학 연구의 혁신을 견인하고, 감춰졌던 생명의 비밀을 빠르고 정확하게 밝히는 데 쓰일 수 있음을 보여주는 연구”라고 말했다.
연구결과는 4월 27일(한국시간) 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 16.6)’ 온라인판에 실렸다.
2024.05.09 조회수 7378
개인 맞춤형 정밀 의학 정확도 높일 ‘렌즈’ 개발
평균이 아닌 개인차를 고려하는 정밀 의학 시대가 열렸다. 사람마다 다른 유전적 특징을 알아내는 기술이 비약적으로 발전한 덕분이다. 더 빠르고, 정확하게 전사체를 해독할 수 있는 새로운 도구가 개발됐다. 우리 대학 수리과학과 김재경 교수(IBS 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 전사체 분석 빅데이터에서 유용한 생물학적 정보만 골라내는 새로운 도구인 ‘scLENS(single-cell Low-dimension Embedding using Effective Noise Subtraction)’를 개발했다.
단일세포 전사체 분석은 최근 생물학, 신약 개발, 임상 연구 등 여러 분야에서 주목받는 도구다. 개별 세포 단위에서 유전적 변화를 확인할 수 있기 때문이다. 가령, 단일세포 전사체 분석을 이용하면 암 조직 내 수십 가지 종류의 세포를 구분하고, 유전적 변이가 발생한 세포만 표적하는 정밀 치료가 가능해진다.
단일세포 전사체 분석 기술이 임상에 광범위하게 이용되려면, 도출되는 빅데이터에서 유용한 생물학적 신호를 찾아내는 효율적인 분석 도구 개발이 선행돼야 한다. 단일세포 전사체 분석은 수백~수천 개에 이르는 개별 세포의 수만 개에 이르는 다양한 유전자 발현량을 측정하기 때문에 데이터 용량이 수~수십 GB에 달한다. 이 방대한 데이터 중 생물학적으로 유용한 신호는 3% 내외에 불과하다.
이 방대하고 노이즈(잡신호)가 많은 데이터에서 유용한 생물학적 신호를 골라내기 위해 지금까지 여러 데이터 처리 도구가 개발됐다. 하지만 기존 도구는 사용자가 생물학적 신호와 노이즈의 ‘경계선’을 직접 설정해야 해서 주관이 개입됐다. 즉, 분석가에 따라 결과가 크게 달라지고, 정확도가 떨어진다는 한계가 있었다.
우선, 연구진은 기존 분석 도구들이 부정확한 근본적인 원인을 규명하고 해결책을 제시했다. 사용자가 노이즈의 임계값을 결정하는 데이터 전처리 방식 자체가 생물학적 신호를 왜곡시킨다는 것을 규명하고, 왜곡 없는 새로운 전처리 방식을 개발했다. 나아가 연구진은 수학적 방법론인 ‘랜덤 행렬 이론’을 이용해 사용자의 주관적 선택 없이 자동으로 단일세포 전사체 분석 데이터에서 신호와 노이즈를 구별하는 프로그램인 ‘scLENS’를 개발했다.
제1 저자인 김현 연구원은 “scLENS는 사용자의 선택 없이 데이터에 내재된 구조만을 이용해 자동으로 신호와 노이즈를 구별하기 때문에 사용자 편향성 문제를 원천 차단할 수 있다”며 “연구자들의 노동집약적인 신호 선택 과정을 없애면서도 분석 정확성은 높였다”고 설명했다.
이어 연구진은 기존 개발된 11가지 데이터 분석 프로그램과 scLENS의 상대적 성능을 비교했다. 이를 통해 scLENS가 다른 모든 프로그램보다 우수한 성능을 보인다는 점을 확인할 수 있었다. 널리 쓰이는 프로그램인 ‘Seurat’과 비교했을 때 scLENS는 세포 그룹화 성능이 약 10% 이상 우수하며, 데이터에 내재된 국소 구조를 43% 더 효과적으로 포착하는 것으로 나타났다.
특히, scLENS는 기존 프로그램보다 많은 계산을 하지만 메모리 사용 최적화를 통해 10만 개의 세포와 2만 개의 유전자로 이뤄진 대규모 데이터를 3시간 만에 분석하는 경쟁력 있는 분석 속도를 보였다.
연구를 이끈 김재경 CI는 “지난 십여 년간 단일세포 전사체를 분석할 수 있는 실험 기술의 비약적인 발전했지만, 데이터 분석 방법의 한계로 인해 큰 비용과 시간을 투자해 얻은 데이터를 최대한 활용하지 못하는 경우가 많았다”며 “기초 수학 이론이 생명과학 연구의 혁신을 견인하고, 감춰졌던 생명의 비밀을 빠르고 정확하게 밝히는 데 쓰일 수 있음을 보여주는 연구”라고 말했다.
연구결과는 4월 27일(한국시간) 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 16.6)’ 온라인판에 실렸다.
2024.05.09 조회수 7378 -
 항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17 조회수 5948
항암 효과 낮추는 ‘세포 간 이질성’ 극복 전략 찾았다
효과가 높은 신약 및 치료법 개발을 위한 단서가 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 수리 및 계산 과학 연구단 의생명 수학 그룹 CI(Chief Investigator)) 연구팀은 인공지능(AI)을 이용해 동일 외부 자극에 개별 세포마다 반응하는 정도가 다른 ‘세포 간 이질성’의 근본적인 원인을 찾아내고, 이질성을 최소화할 수 있는 전략을 제시했다.
우리 몸속 세포는 약물, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계(signaling pathway)가 있다. 신호 전달 체계는 세포가 외부 환경과 상호작용하며 생존하는 데 핵심적인 역할을 한다. 세포의 신호 전달 체계는 노벨생리의학상의 단골 주제일 정도로 중요하지만, 규명을 위해서는 수십 년에 걸친 연구가 필요하다.
신호 전달 체계는 세포 간 이질성에도 영향을 미친다. 세포 간 이질성은 똑같은 유전자를 가진 세포들이 동일 외부 자극에 다르게 반응하는 정도를 뜻한다. 하지만 복잡한 신호 전달 체계의 전 과정을 직접 관측하는 일이 현재 기술로는 어렵기 때문에 지금까지는 신호 전달 체계와 세포 간 이질성의 명확한 연결고리를 알지 못했다.
세포 간 이질성은 질병 치료에 있어 더욱 중요한 고려 요소다. 가령, 항암제를 투여했을 때 세포 간 이질성으로 인해 일부 암세포만 사멸되고, 일부는 살아남는다면 완치가 되지 않는다. 세포 간 이질성의 근본적인 원인을 찾고, 이질성을 최소화할 수 있는 전략을 도출해야 치료 효과를 높인 신약 설계가 가능해진다.
제1 저자인 홍혁표 IBS 전(前) 학생연수원(現 미국 위스콘신 메디슨대 방문조교수)은 “우리 연구진은 선행 연구(Science Advances, 2022)에서 세포 내 신호 전달 체계를 묘사한 수리 모델을 개발한 바 있다”며 “당시엔 신호 전달 체계의 중간 과정이 한 개의 경로만 있다고 가정해 얻을 수 있는 정보도 한계가 있었지만, 이번 연구에서는 AI를 활용해 중간 과정의 비밀까지 풀어냈다”고 말했다.
연구진은 기계 학습 방법론인 ‘Density-PINNs(Density Physics-Informed Neural Networks)’를 개발해 신호 전달 체계와 세포 간 이질성의 연결고리를 찾았다. 세포가 외부 자극에 노출되면 신호 전달 체계를 거쳐 반응 단백질이 생성된다. 시간에 따라 축적된 반응 단백질의 양을 이용하면 신호 전달 소요 시간의 분포를 추론할 수 있다. 이 분포는 신호 전달 체계가 몇 개의 경로로 구성됐는지를 알려준다. 즉, Density-PINNs를 이용하면 쉽게 관측할 수 있는 반응 단백질의 시계열 데이터로부터 직접 관찰하기 어려운 신호 전달 체계에 대한 정보를 추정할 수 있다는 의미다.
이어 연구진은 실제 대장균의 항생제에 대한 반응 실험 데이터에 Density-PINNs를 적용하여 세포 간 이질성의 원인도 찾았다. 신호 전달 체계가 단일 경로로 이뤄진 때(직렬)에 비해 여러 경로로 이뤄졌을 때(병렬)가 세포 간 이질성이 적다는 것을 알아냈다.
제1 저자인 조현태 연구원은 “추가 연구가 필요하지만, 신호 전달 체계가 병렬 구조일 경우 극단적인 신호가 서로 상쇄되어서 세포 간 이질성이 적어지는 것으로 보인다”며 “신호 전달 체계가 병렬 구조를 보이도록 약물이나 화학 요법 치료 전략을 세우면 치료 효과를 높일 수 있다는 의미”라고 설명했다.
연구를 이끈 김재경 교수는 “복잡한 세포 신호 전달 체계의 전 과정을 파악하려면 수십 년의 연구가 필요하지만, 우리 연구진이 제시한 방법론은 수 시간 내에 치료에 필요한 핵심 정보만 알아내 치료에 활용할 수 있다”며 “이번 연구를 실제 현장에서 사용되는 약물에 적용하여 치료 효과를 개선할 수 있기를 기대한다”고 말했다.
연구 결과는 지난해 12월 26일 국제학술지 셀(Cell)의 자매지인 ‘패턴스(Patterns)’에 실렸다.
※ 논문명: Density physics-informed neural networks reveal sources of cell heterogeneity in signal transduction
2024.01.17 조회수 5948 -
 인과관계 추정 정확도 높인 새로운 방법론 개발
우리 대학 수리과학과 김재경 교수 연구팀이 수학 모델을 기반으로 시계열 데이터의 인과관계를 추정하는 새로운 방법론을 개발했다. 복잡한 계산 과정을 없애 기존보다 빠른 속도로 추론이 가능하면서도, 정확도는 획기적으로 높였다.
매 순간 다양한 데이터가 기록되고 있다. 그중 시간의 흐름을 기준으로 기록된 ‘시계열 데이터’는 일기 예보와 경제 분야뿐만 아니라 의학 분야에서도 가치 있게 쓰인다. 입원 환자의 심전도 측정을 통해 심장 발작의 직접적인 요인을 찾는 것과 같이 인과관계를 추정하는 것이 대표적이다. 최근에는 스마트 워치 등 웨어러블 기기를 통해 일상에서 건강 데이터를 쉽게 수집할 수 있게 되면서, 의학 분야에서 시계열 데이터 분석의 중요성이 더 커지고 있다.
시계열 데이터에서 인과관계를 추정하는 대표적인 방법으로는 2003년 노벨 경제학상을 수상한 클라이브 그레인저 미국 샌디에이고캘리포니아대(UC샌디에이고) 교수가 제시한 ‘그레인저 인과관계 검정(Granger causality test)’이 있다. 이는 미래 경제지표 예측, 질병 요인분석, 지구온난화의 원인 등 수많은 분야에 걸쳐 응용됐다. 그레인저 인과관계 검정을 개선한 정보 이론 기반의 다양한 인과관계 추정 방법이 개발됐지만, 일련의 방법들은 시계열 데이터가 비슷한 주기로 변화하는 동시성을 가지기만 하면, 인과관계가 있다고 잘못 예측하는 경우가 많았다. 또한, 직접적인 인과관계와 간접적인 인과관계를 구별하지 못한다는 한계도 있었다.
이러한 한계를 극복하기 위해 최근 수리 모델을 기반으로 하는 방법론들이 등장했다. 수리 모델로 주어진 시계열 데이터를 잘 맞출 수 있는지 확인하는 방법을 통해 인과관계를 예측한다. 수리 모델이 정확하기만 하면 기존 그레인저 인과관계 검정의 한계인 동시성과 간접적인 영향을 인과관계와 혼동하지 않는다는 장점이 있다. 그러나 정확한 수리 모델을 알기 힘들고, 현재까지 제시된 수리 모델 기반 방법론들은 복잡한 계산이 필요해 추정 시간이 많이 걸린다는 단점이 있다.
이러한 상황에서 연구팀은 기존 방법론들의 한계를 모두 해결한 새로운 방법론 ‘GOBI(General ODE-Based Inference)’를 개발했다. 우선, 연구팀은 시계열 데이터가 일반적인 수학 모델로 표현될 수 있는지 확인하는 수학 이론을 만들었다. 그리고 이 이론을 바탕으로 정확한 수리 모델이나 복잡한 계산 없이도 시계열 데이터로부터 인과관계를 추정하는 방법론을 개발했다.
개발한 방법론을 인과관계 분석에 적용해 본 결과 세포 내 분자들의 상호작용, 생태계 네트워크, 기상 시스템 등 다양한 분야의 데이터에서 기존 방법론에 비해 월등한 성능을 보여줬다. 특히, 동시성 및 간접적인 영향을 가지는 시계열 데이터에서도 인과관계를 성공적으로 추론했다. 연구진은 GOBI를 통해서 여러 오염 물질 중 이산화질소와 호흡기로 유입되는 부유 미립자(직경 10㎛ 이하의 입자)가 심혈관계 질환에 영향을 미친다는 것을 확인할 수 있었다.
김재경 교수는 “수학과 통계를 결합하여 정확하면서도 다양한 시스템에 유연하게 적용할 수 있는 새로운 인과관계 추정 방법론을 개발했다”며 “사회 및 자연과학 분야에 걸쳐 두루 사용되는 인과관계 추정 연구에 새로운 패러다임을 제시할 것으로 예상된다”고 말했다.
연구결과는 7월 24일 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 17.694)’ 온라인판에 실렸으며, 우리 대학 박세호 학사과정(제1저자)과 하석민 학사과정(제2저자)이 참여했다.
2023.07.26 조회수 8802
인과관계 추정 정확도 높인 새로운 방법론 개발
우리 대학 수리과학과 김재경 교수 연구팀이 수학 모델을 기반으로 시계열 데이터의 인과관계를 추정하는 새로운 방법론을 개발했다. 복잡한 계산 과정을 없애 기존보다 빠른 속도로 추론이 가능하면서도, 정확도는 획기적으로 높였다.
매 순간 다양한 데이터가 기록되고 있다. 그중 시간의 흐름을 기준으로 기록된 ‘시계열 데이터’는 일기 예보와 경제 분야뿐만 아니라 의학 분야에서도 가치 있게 쓰인다. 입원 환자의 심전도 측정을 통해 심장 발작의 직접적인 요인을 찾는 것과 같이 인과관계를 추정하는 것이 대표적이다. 최근에는 스마트 워치 등 웨어러블 기기를 통해 일상에서 건강 데이터를 쉽게 수집할 수 있게 되면서, 의학 분야에서 시계열 데이터 분석의 중요성이 더 커지고 있다.
시계열 데이터에서 인과관계를 추정하는 대표적인 방법으로는 2003년 노벨 경제학상을 수상한 클라이브 그레인저 미국 샌디에이고캘리포니아대(UC샌디에이고) 교수가 제시한 ‘그레인저 인과관계 검정(Granger causality test)’이 있다. 이는 미래 경제지표 예측, 질병 요인분석, 지구온난화의 원인 등 수많은 분야에 걸쳐 응용됐다. 그레인저 인과관계 검정을 개선한 정보 이론 기반의 다양한 인과관계 추정 방법이 개발됐지만, 일련의 방법들은 시계열 데이터가 비슷한 주기로 변화하는 동시성을 가지기만 하면, 인과관계가 있다고 잘못 예측하는 경우가 많았다. 또한, 직접적인 인과관계와 간접적인 인과관계를 구별하지 못한다는 한계도 있었다.
이러한 한계를 극복하기 위해 최근 수리 모델을 기반으로 하는 방법론들이 등장했다. 수리 모델로 주어진 시계열 데이터를 잘 맞출 수 있는지 확인하는 방법을 통해 인과관계를 예측한다. 수리 모델이 정확하기만 하면 기존 그레인저 인과관계 검정의 한계인 동시성과 간접적인 영향을 인과관계와 혼동하지 않는다는 장점이 있다. 그러나 정확한 수리 모델을 알기 힘들고, 현재까지 제시된 수리 모델 기반 방법론들은 복잡한 계산이 필요해 추정 시간이 많이 걸린다는 단점이 있다.
이러한 상황에서 연구팀은 기존 방법론들의 한계를 모두 해결한 새로운 방법론 ‘GOBI(General ODE-Based Inference)’를 개발했다. 우선, 연구팀은 시계열 데이터가 일반적인 수학 모델로 표현될 수 있는지 확인하는 수학 이론을 만들었다. 그리고 이 이론을 바탕으로 정확한 수리 모델이나 복잡한 계산 없이도 시계열 데이터로부터 인과관계를 추정하는 방법론을 개발했다.
개발한 방법론을 인과관계 분석에 적용해 본 결과 세포 내 분자들의 상호작용, 생태계 네트워크, 기상 시스템 등 다양한 분야의 데이터에서 기존 방법론에 비해 월등한 성능을 보여줬다. 특히, 동시성 및 간접적인 영향을 가지는 시계열 데이터에서도 인과관계를 성공적으로 추론했다. 연구진은 GOBI를 통해서 여러 오염 물질 중 이산화질소와 호흡기로 유입되는 부유 미립자(직경 10㎛ 이하의 입자)가 심혈관계 질환에 영향을 미친다는 것을 확인할 수 있었다.
김재경 교수는 “수학과 통계를 결합하여 정확하면서도 다양한 시스템에 유연하게 적용할 수 있는 새로운 인과관계 추정 방법론을 개발했다”며 “사회 및 자연과학 분야에 걸쳐 두루 사용되는 인과관계 추정 연구에 새로운 패러다임을 제시할 것으로 예상된다”고 말했다.
연구결과는 7월 24일 국제학술지 ‘네이처 커뮤니케이션즈(Nature Communications, IF 17.694)’ 온라인판에 실렸으며, 우리 대학 박세호 학사과정(제1저자)과 하석민 학사과정(제2저자)이 참여했다.
2023.07.26 조회수 8802 -
 약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09 조회수 10102
약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09 조회수 10102 -
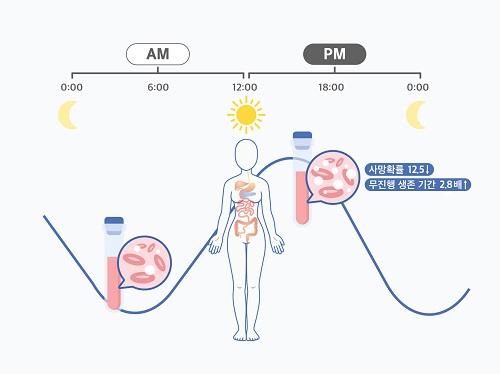 여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다.
세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다.
김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이자(Pfizer)와 함께 수면장애 치료 신약의 효과를 수학 모형을 통해 분석해, 하루 중 최적의 투약 시간을 찾는 ‘조정시간요법(Adaptive chronotherapy)’을 개발한 바 있다. 투약 시간에 따라 약물의 효능이 달라질 수 있다는 점에 주목한 고영일 교수팀의 제안으로 시작된 이번 연구에서는 암 환자를 위한 시간항암요법의 효과를 검증하는 연구를 진행했다.
연구진은 서울대병원에서 광범위 B형 대세포 림프종 치료를 진행 중인 환자들이 오전 8시 30분과 오후 2시 30분 중 시간을 선택해서 항암 치료를 받고 있다는 점에 착안하여, 210명의 환자를 대상으로 관측 연구를 진행했다. 이들은 오전이나 오후 시간에 약 3주 간격으로 표적치료제와 항암화학요법을 결합한 암 치료(R-CHOP)를 4~6회 받았다.
관측 결과, 남성 환자의 경우 시간에 따른 치료 효율 차이가 없었다. 반면, 여성 환자는 오후 치료를 주로 받을 시 60개월 이후 사망률이 12.5배 감소하고, 무진행 생존 기간이 2.8배 증가하는 것으로 나타났다. 또한, 오전 치료를 주로 받은 여성 환자들에게서 백혈구 감소증과 같은 항암치료 부작용이 더 많이 나타났다.
이어 연구진은 성별에 따른 차이가 나타나는 원인을 규명하기 위해 서울대병원 건강검진센터에서 수집된 1만4000여 명의 혈액 샘플을 분석했다. 이 과정에서 정상 여성은 백혈구 수가 오전에 감소하고, 오후에 늘어난다는 사실을 찾아냈다. 여성의 골수 기능이 24시간을 주기로 늘어났다 줄어들기를 반복하는 일주기 리듬(Circadian rhythms)을 가진다는 의미다.
이에 따라 여성 환자가 골수 기능이 활발한 오전에 림프종 치료를 받으면, 항암 부작용으로 골수 기능이 억제되며 부작용 발생 가능성이 증가할 수 있다. 반면, 남성은 하루 중 백혈구 수 및 골수세포 확산 속도 변화가 크지 않아 오전과 오후의 치료 효과 차이가 유의미하게 나타나지 않는다.
고영일 교수는 “혼재변수를 완벽히 통재한 대규모 후속연구로 이번 연구의 결론을 재차 검증하고, 다른 암에서도 비슷한 효과가 있는지 확인하는 후속연구를 진행할 계획”이라며 “이번 연구가 시간항암요법의 국내 의료 현장 도입을 촉진하는 데 큰 역할을 하길 기대한다”고 말했다.
김재경 CI는 “개인의 수면 패턴에 따라 생체시계의 시간은 크게 차이가 날 수 있기 때문에 현재 수면 패턴으로부터 생체시계의 시간을 추정하는 기술을 개발하고 있다”며 “이를 통해 최종적으로는 개인 맞춤형 시간항암요법 개발이 가능해질 것”이라고 말했다.
연구결과는 12월 13일(한국시간) 미국 임상학회 학술지 ‘JCI 인사이트(JCI Insight‧IF 9.08)’에 실렸다.
※ 논문명 : Chemotherapy delivery time affects treatment outcomes of female patients with diffuse large B-cell lymphoma
2022.12.15 조회수 8640
여성 암 환자, 오후 항암치료가 효과 더 좋다
여성 암 환자의 경우 오전보다 오후에 받는 항암치료가 더 효과적이라는 가능성이 제시됐다. 우리 대학 수리과학과 김재경 교수(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI) 연구팀은 고영일 서울대병원 혈액종양내과 교수팀과 공동으로 광범위 B형 대세포 림프종을 앓고 있는 여성 환자를 오후에 치료할 시 예후가 더 좋아진다는 가능성을 확인했다.
세포 증식과 분화를 포함한 인간의 생리학적 현상은 뇌에 위치한 생체 시계(Circadian clock)에 의해 24시간 주기로 조절된다. 암세포를 사멸시키는 항암제의 효능과 부작용 역시 생체 시계로 인해 투약 시간에 따라 달라진다. 이 때문에 약리효과가 가장 좋은 특정 시간에 항암 치료를 진행하는 ‘시간항암요법’이 주목받고 있다. 하지만 최적 치료 시간을 찾기 위한 체계적인 방법이 없어 아직 실제 의료 현장에서는 널리 시행되지 않고 있는 상황이다.
김 교수 연구팀은 지난 2019년 글로벌 제약회사인 화이자(Pfizer)와 함께 수면장애 치료 신약의 효과를 수학 모형을 통해 분석해, 하루 중 최적의 투약 시간을 찾는 ‘조정시간요법(Adaptive chronotherapy)’을 개발한 바 있다. 투약 시간에 따라 약물의 효능이 달라질 수 있다는 점에 주목한 고영일 교수팀의 제안으로 시작된 이번 연구에서는 암 환자를 위한 시간항암요법의 효과를 검증하는 연구를 진행했다.
연구진은 서울대병원에서 광범위 B형 대세포 림프종 치료를 진행 중인 환자들이 오전 8시 30분과 오후 2시 30분 중 시간을 선택해서 항암 치료를 받고 있다는 점에 착안하여, 210명의 환자를 대상으로 관측 연구를 진행했다. 이들은 오전이나 오후 시간에 약 3주 간격으로 표적치료제와 항암화학요법을 결합한 암 치료(R-CHOP)를 4~6회 받았다.
관측 결과, 남성 환자의 경우 시간에 따른 치료 효율 차이가 없었다. 반면, 여성 환자는 오후 치료를 주로 받을 시 60개월 이후 사망률이 12.5배 감소하고, 무진행 생존 기간이 2.8배 증가하는 것으로 나타났다. 또한, 오전 치료를 주로 받은 여성 환자들에게서 백혈구 감소증과 같은 항암치료 부작용이 더 많이 나타났다.
이어 연구진은 성별에 따른 차이가 나타나는 원인을 규명하기 위해 서울대병원 건강검진센터에서 수집된 1만4000여 명의 혈액 샘플을 분석했다. 이 과정에서 정상 여성은 백혈구 수가 오전에 감소하고, 오후에 늘어난다는 사실을 찾아냈다. 여성의 골수 기능이 24시간을 주기로 늘어났다 줄어들기를 반복하는 일주기 리듬(Circadian rhythms)을 가진다는 의미다.
이에 따라 여성 환자가 골수 기능이 활발한 오전에 림프종 치료를 받으면, 항암 부작용으로 골수 기능이 억제되며 부작용 발생 가능성이 증가할 수 있다. 반면, 남성은 하루 중 백혈구 수 및 골수세포 확산 속도 변화가 크지 않아 오전과 오후의 치료 효과 차이가 유의미하게 나타나지 않는다.
고영일 교수는 “혼재변수를 완벽히 통재한 대규모 후속연구로 이번 연구의 결론을 재차 검증하고, 다른 암에서도 비슷한 효과가 있는지 확인하는 후속연구를 진행할 계획”이라며 “이번 연구가 시간항암요법의 국내 의료 현장 도입을 촉진하는 데 큰 역할을 하길 기대한다”고 말했다.
김재경 CI는 “개인의 수면 패턴에 따라 생체시계의 시간은 크게 차이가 날 수 있기 때문에 현재 수면 패턴으로부터 생체시계의 시간을 추정하는 기술을 개발하고 있다”며 “이를 통해 최종적으로는 개인 맞춤형 시간항암요법 개발이 가능해질 것”이라고 말했다.
연구결과는 12월 13일(한국시간) 미국 임상학회 학술지 ‘JCI 인사이트(JCI Insight‧IF 9.08)’에 실렸다.
※ 논문명 : Chemotherapy delivery time affects treatment outcomes of female patients with diffuse large B-cell lymphoma
2022.12.15 조회수 8640 -
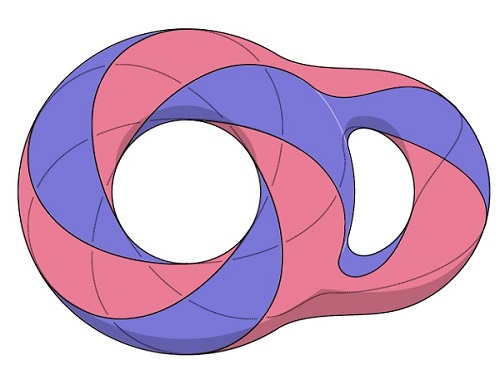 4차원에서 다른 두 2차원 곡면 발견
우리 대학 수리과학과 박정환 교수가 카일 헤이든(Kyle Hayden) 콜롬비아 대학교 교수, 김승원 서울대학교 연구원, 매기 밀러(Maggie Miller) 스탠포드 대학교 연구원, 아이작 선버그(Isaac Sundberg) 막스플랑크 연구소 연구원과 함께 40년간 해결되지 않았던 위상수학계 난제를 해결했다고 5일 밝혔다.
매듭이란 3차원 공간 안에 원이 꼬여서 들어가 있는 형태를 말한다. 물리적으로는 신발 끈을 복잡하게 묶은 후에 끈의 양 끝을 하나로 붙인 원을 생각하면 된다. 매듭은 1차원적 기하학적 대상이다. 그리하여 모든 매듭은 사이퍼트 곡면이라는 2차원 곡면의 경계가 되는데 하나의 매듭이 여러 개의 서로 다른 사이퍼트 곡면의 경계가 되기도 한다. 많은 경우 위상수학에서는 하나의 차원이 더 해지면 서로 달랐던 기하학적 대상들이 같아지고는 한다. 현재 인디애나 대학교에서 명예교수로 있는 찰스 리빙스턴(Charles Livingston)은 이런 현상이 사이퍼트 곡면에서도 일어날 것이라고 1982년에 추측하였다. 즉, 그는 어떤 매듭의 두 사이퍼트 곡면이 3차원에서는 다르더라도 4차원 공간에서는 항상 같아질 것으로 추측한 것이다. 이 추측의 하나의 배경은 다년간 3차원 공간에서 다르다고 증명되었던 수많은 사이퍼트 곡면들을 많은 수학자가 4차원 공간에서 관찰하였지만, 대부분의 경우 4차원 공간에서는 같아진다는 사실을 증명하였기 때문이다.
박 교수는 동료 연구자와 함께 리빙스턴 추측이 거짓이라는 사실의 증명을 하였다. 이 증명을 포함하고 있는 ‘4차원 공안의 사이퍼트 곡면(Seifert surfaces in the 4-ball)’ 논문을 최근 프리프린트(학술지 출판 전에 사전 공개되는 논문)로 공개했다.
이들은 <그림 1>에서 보이는 두 개의 사이퍼트 곡면을 사용하였다. 이 두 개의 사이퍼트 곡면은 <그림 2>의 닫힌곡면을 두 개로 나누어서 얻어진 것이다. 즉, <그림 2>는 이 두 개의 사이퍼트 곡면이 같은 매듭을 경계로 한다는 사실을 설명해 주고 있다.
이 두 개의 사이퍼트 곡면이 다르다는 사실은 두 가지의 다른 방법을 사용하여 증명하였다. 첫 번째 방법은 위상수학에서 기본적으로 사용되는 피폭 공간이라는 개념을 사용하였다. 두 번째 방법은 존스 다항식(Jones polynomial)을 일반화한 코바노프 호몰로지(Khovanov homology)를 사용하였다. 특히, 위 연구자들은 코바노프 호몰로지를 이용하여 4차원 공간 안의 2차원 곡면들에 관한 다양한 연구를 진행하고 있다. 예를 들어, 이번에 발표한 논문에는 위상적으로는 4차원에서 같아지지만 매끄러운 구조를 유지하면서 같아질 수 없는 두 개의 사이퍼트 곡면의 존재성도 증명하였다. 이는 4차원 공간에서만 일어나는 미묘하고 신비한 현상을 대변한다. 박 교수와 연구자들은 이 논문은 계기로 앞으로 4차원 공간의 2차원 곡면에 대한 더 활발한 연구를 할 수 있을 것으로 기대하고 있다.
2022.07.05 조회수 6924
4차원에서 다른 두 2차원 곡면 발견
우리 대학 수리과학과 박정환 교수가 카일 헤이든(Kyle Hayden) 콜롬비아 대학교 교수, 김승원 서울대학교 연구원, 매기 밀러(Maggie Miller) 스탠포드 대학교 연구원, 아이작 선버그(Isaac Sundberg) 막스플랑크 연구소 연구원과 함께 40년간 해결되지 않았던 위상수학계 난제를 해결했다고 5일 밝혔다.
매듭이란 3차원 공간 안에 원이 꼬여서 들어가 있는 형태를 말한다. 물리적으로는 신발 끈을 복잡하게 묶은 후에 끈의 양 끝을 하나로 붙인 원을 생각하면 된다. 매듭은 1차원적 기하학적 대상이다. 그리하여 모든 매듭은 사이퍼트 곡면이라는 2차원 곡면의 경계가 되는데 하나의 매듭이 여러 개의 서로 다른 사이퍼트 곡면의 경계가 되기도 한다. 많은 경우 위상수학에서는 하나의 차원이 더 해지면 서로 달랐던 기하학적 대상들이 같아지고는 한다. 현재 인디애나 대학교에서 명예교수로 있는 찰스 리빙스턴(Charles Livingston)은 이런 현상이 사이퍼트 곡면에서도 일어날 것이라고 1982년에 추측하였다. 즉, 그는 어떤 매듭의 두 사이퍼트 곡면이 3차원에서는 다르더라도 4차원 공간에서는 항상 같아질 것으로 추측한 것이다. 이 추측의 하나의 배경은 다년간 3차원 공간에서 다르다고 증명되었던 수많은 사이퍼트 곡면들을 많은 수학자가 4차원 공간에서 관찰하였지만, 대부분의 경우 4차원 공간에서는 같아진다는 사실을 증명하였기 때문이다.
박 교수는 동료 연구자와 함께 리빙스턴 추측이 거짓이라는 사실의 증명을 하였다. 이 증명을 포함하고 있는 ‘4차원 공안의 사이퍼트 곡면(Seifert surfaces in the 4-ball)’ 논문을 최근 프리프린트(학술지 출판 전에 사전 공개되는 논문)로 공개했다.
이들은 <그림 1>에서 보이는 두 개의 사이퍼트 곡면을 사용하였다. 이 두 개의 사이퍼트 곡면은 <그림 2>의 닫힌곡면을 두 개로 나누어서 얻어진 것이다. 즉, <그림 2>는 이 두 개의 사이퍼트 곡면이 같은 매듭을 경계로 한다는 사실을 설명해 주고 있다.
이 두 개의 사이퍼트 곡면이 다르다는 사실은 두 가지의 다른 방법을 사용하여 증명하였다. 첫 번째 방법은 위상수학에서 기본적으로 사용되는 피폭 공간이라는 개념을 사용하였다. 두 번째 방법은 존스 다항식(Jones polynomial)을 일반화한 코바노프 호몰로지(Khovanov homology)를 사용하였다. 특히, 위 연구자들은 코바노프 호몰로지를 이용하여 4차원 공간 안의 2차원 곡면들에 관한 다양한 연구를 진행하고 있다. 예를 들어, 이번에 발표한 논문에는 위상적으로는 4차원에서 같아지지만 매끄러운 구조를 유지하면서 같아질 수 없는 두 개의 사이퍼트 곡면의 존재성도 증명하였다. 이는 4차원 공간에서만 일어나는 미묘하고 신비한 현상을 대변한다. 박 교수와 연구자들은 이 논문은 계기로 앞으로 4차원 공간의 2차원 곡면에 대한 더 활발한 연구를 할 수 있을 것으로 기대하고 있다.
2022.07.05 조회수 6924 -
 수학 모델로 개별 세포 간 이질성의 원인 밝혀
우리 연구진이 항생제와 같은 동일한 외부 자극에도 개별 세포마다 반응하는 정도가 다른 근본적인 원인을 밝혔다.
우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 의생명수학 그룹 겸임) 연구팀이 외부 자극에 대한 세포 간 이질성(cell-to-cell heterogeneity)의 크기가 세포 내 신호 전달 과정의 반응 속도 제한 단계(rate-limiting step)의 수에 비례한다는 사실을 규명했다고 21일 밝혔다.
똑같은 유전자를 가진 세포들이 동일한 외부 자극에 다르게 반응하는 이유는 오랫동안 미스터리였다. 특히, 외부 자극에 대한 반응의 이질성은 항암 치료 시 화학 요법을 적용할 때 암세포의 완전 사멸을 막는 원인이 되기도 한다. 따라서, 세포 간 이질성을 유발하는 요인으로서 속도 제한 단계를 제시한 이번 연구는 화학 요법 치료의 효과를 개선하는 데에 이용될 수 있을 것으로 기대된다.
우리 대학 수리과학과 김대욱 박사와 홍혁표 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `사이언스 어드밴시스(Science Advances)' 3월 18일 字 온라인판에 실렸다. (논문명 : Systematic inference identifies a major source of heteogeneity in cell signaling dynamics: the rate-limiting step number)
우리 몸속에 있는 세포는 항생제, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계를 갖고 있다. 이러한 신호 전달 체계는 세포가 외부 환경과 상호 작용하는 데에 가장 핵심적인 역할을 한다.
동일한 외부 자극을 세포들에 가했을 때 반응하는 정도가 다르기 때문에 약물에 대한 이질적인 반응과 약물 내성이 강한 존속성 세균(persister cell)이 발생한다. 이러한 현상을 유발하는 세포 간 이질성의 원인을 찾기 위해 많은 시도가 있었다. 특히, 신호 전달 체계를 이루는 많은 중간 과정들이 영향을 미친다는 것이 제안됐으나, 실험적으로 모든 중간 과정을 직접 관측하는 것이 현재 기술로는 불가능하기에 난제로 남아 있었다.
김 교수 연구팀은 이 난제 해결을 위해 세포 내 신호 전달 체계를 묘사하는 큐잉 모형(Queueing model)을 개발했다. 개발된 큐잉 모형을 바탕으로 통계적인 추정 방법론인 베이지안 모형(Bayesian model)과 혼합 효과 모형(Mixed-effects model)을 결합해 신호 체계의 중간 과정에 대한 관측 없이도 신호 체계를 분석할 수 있는 컴퓨터 소프트웨어(MBI; Moment-based Bayesian Inference method)를 개발했다. 이를 이용해 분석한 결과, 연구팀은 외부 자극에 반응하는 세포 간 이질성이 신호 전달 체계를 구성하는 속도 제한 단계의 수에 비례한다는 사실을 밝혔다.
김 교수는 "신호 전달 체계를 이루는 속도 제한 단계의 수가 늘어날수록 유전적으로 같은 세포 집단일지라도 전달하는 신호가 더 다양하게 나타날 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 수리 모델 분석을 위한 이론적 토대를 마련하는 것에서 그치지 않고, 실제 대장균(E. coli)의 항생제 반응 실험 데이터를 이용해 이론적 결과를 검증했다. 이러한 연구 결과는 항생제 내성 세균 연구에 새로운 패러다임을 제시할 것으로 예상된다.
김 교수는 "항암 치료시 중요하게 고려되는 세포 간 이질성에 대한 이해를 수리 모델을 통해서 높인 연구ˮ라고 소개하면서 "이번 성과를 통해 항암 치료 개선 방안이 개발되기를 기대한다ˮ라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.03.21 조회수 11477
수학 모델로 개별 세포 간 이질성의 원인 밝혀
우리 연구진이 항생제와 같은 동일한 외부 자극에도 개별 세포마다 반응하는 정도가 다른 근본적인 원인을 밝혔다.
우리 대학 수리과학과 김재경 교수(기초과학연구원(IBS) 의생명수학 그룹 겸임) 연구팀이 외부 자극에 대한 세포 간 이질성(cell-to-cell heterogeneity)의 크기가 세포 내 신호 전달 과정의 반응 속도 제한 단계(rate-limiting step)의 수에 비례한다는 사실을 규명했다고 21일 밝혔다.
똑같은 유전자를 가진 세포들이 동일한 외부 자극에 다르게 반응하는 이유는 오랫동안 미스터리였다. 특히, 외부 자극에 대한 반응의 이질성은 항암 치료 시 화학 요법을 적용할 때 암세포의 완전 사멸을 막는 원인이 되기도 한다. 따라서, 세포 간 이질성을 유발하는 요인으로서 속도 제한 단계를 제시한 이번 연구는 화학 요법 치료의 효과를 개선하는 데에 이용될 수 있을 것으로 기대된다.
우리 대학 수리과학과 김대욱 박사와 홍혁표 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 `사이언스 어드밴시스(Science Advances)' 3월 18일 字 온라인판에 실렸다. (논문명 : Systematic inference identifies a major source of heteogeneity in cell signaling dynamics: the rate-limiting step number)
우리 몸속에 있는 세포는 항생제, 삼투압 변화 등 다양한 외부 자극에 반응하는 신호 전달 체계를 갖고 있다. 이러한 신호 전달 체계는 세포가 외부 환경과 상호 작용하는 데에 가장 핵심적인 역할을 한다.
동일한 외부 자극을 세포들에 가했을 때 반응하는 정도가 다르기 때문에 약물에 대한 이질적인 반응과 약물 내성이 강한 존속성 세균(persister cell)이 발생한다. 이러한 현상을 유발하는 세포 간 이질성의 원인을 찾기 위해 많은 시도가 있었다. 특히, 신호 전달 체계를 이루는 많은 중간 과정들이 영향을 미친다는 것이 제안됐으나, 실험적으로 모든 중간 과정을 직접 관측하는 것이 현재 기술로는 불가능하기에 난제로 남아 있었다.
김 교수 연구팀은 이 난제 해결을 위해 세포 내 신호 전달 체계를 묘사하는 큐잉 모형(Queueing model)을 개발했다. 개발된 큐잉 모형을 바탕으로 통계적인 추정 방법론인 베이지안 모형(Bayesian model)과 혼합 효과 모형(Mixed-effects model)을 결합해 신호 체계의 중간 과정에 대한 관측 없이도 신호 체계를 분석할 수 있는 컴퓨터 소프트웨어(MBI; Moment-based Bayesian Inference method)를 개발했다. 이를 이용해 분석한 결과, 연구팀은 외부 자극에 반응하는 세포 간 이질성이 신호 전달 체계를 구성하는 속도 제한 단계의 수에 비례한다는 사실을 밝혔다.
김 교수는 "신호 전달 체계를 이루는 속도 제한 단계의 수가 늘어날수록 유전적으로 같은 세포 집단일지라도 전달하는 신호가 더 다양하게 나타날 수 있음을 확인했다ˮ고 설명했다.
김 교수팀은 수리 모델 분석을 위한 이론적 토대를 마련하는 것에서 그치지 않고, 실제 대장균(E. coli)의 항생제 반응 실험 데이터를 이용해 이론적 결과를 검증했다. 이러한 연구 결과는 항생제 내성 세균 연구에 새로운 패러다임을 제시할 것으로 예상된다.
김 교수는 "항암 치료시 중요하게 고려되는 세포 간 이질성에 대한 이해를 수리 모델을 통해서 높인 연구ˮ라고 소개하면서 "이번 성과를 통해 항암 치료 개선 방안이 개발되기를 기대한다ˮ라고 말했다.
한편 이번 연구는 삼성미래기술육성사업의 지원을 받아 수행됐다.
2022.03.21 조회수 11477 -
 수학과 실험을 결합하여 생체시계의 역설 규명
수학과 실험을 결합한 융합연구를 통해 생체시계가 안정적 리듬을 유지하면서도 환경변화에 쉽게 적응할 수 있는 원리가 밝혀졌다. 우리 대학 수리과학과 김재경 교수가 이끄는 기초과학연구원(IBS) 수리 및 계산과학 연구단 의생명 수학 그룹과 우리 대학 수리과학과 연구팀, 그리고 아주대 의과대학 뇌과학과 김은영 교수 연구팀은 공동연구를 통해 초파리 뇌의 생체시계 뉴런들의 생체시계 작동원리를 분석했다.
생체시계(Circadian clock)는 생명체가 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 예를 들어, 생체시계는 밤 9시경이 되면 뇌에서 멜라토닌 호르몬 분비를 유발해 일정 시간이 되면 수면을 취할 수 있도록 하는 등 우리 운동 능력이나 학습 능력에 이르는 거의 모든 생리 작용에 관여한다. 따라서, 평소에는 일정한 시간을 안정적으로 몸에 제시하면서, 동시에 계절 변화에 따른 낮밤의 길이 변화나 해외여행으로 인한 시차 등 환경변화가 생겼을 때는 새로운 환경에 유연하게 적응해서 변화한 시간을 몸에 제시해주어야 한다. 이러한 안정성과 유연성을 동시에 유지하는 생체시계의 역설적인 성질의 원리는 지금까지 알려져 있지 않았다.
초파리 생체시계 뉴런들의 경우, 마스터 뉴런(master neuron)이 외부로부터 들어오는 빛 정보를 취합하여 시간 정보를 슬레이브 뉴런(slave neuron)에 전달하면, 이에 맞춰 슬레이브 뉴런이 일주기 행동을 조절하는 계층구조를 형성하고 있다. 이러한 역할 차이에도 불구하고, 두 뉴런의 생체시계는 동일한 원리로 작동한다고 알려져 있었다. 2017년 노벨 생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
연구진은 초파리에서 CLK에 변이가 생겼을 때 마스터 뉴런과 슬레이브 뉴런에서 서로 다른 PER변화 양상이 나타나는 것에 착안하여 마스터 뉴런과 슬레이브 뉴런이 만들어내는 PER 단백질의 변화 양상을 1000여 개 수리 모델을 개발하여 분석한 결과, 마스터 뉴런의 PER이 슬레이브 뉴런의 PER에 비해 빠르게 합성되었다 분해되고 있음을 예측하였다. 이러한 마스터 뉴런의 독특한 성질 덕분에, 평소에 강한 PER 리듬을 생성해서 안정적인 시계 역할을 하다가 외부 환경에 변화가 일어났을 때 빠르게 적응할 수 있음 역시 가상 시뮬레이션을 통해 예측하였다. 이러한 마스터 뉴런에 관한 수리모델링 예측은 초파리 생체 실험을 통해서도 검증되었다.
김재경 교수는 “모든 세포의 생체시계는 당연히 비슷한 방식으로 작동될 것이란 오래된 믿음이 수학을 이용한 분석 덕분에 틀렸음을 알게 되었다”며 “수학과 실험을 융합한 방식으로 문제에 접근하였기 때문에 문제를 해결할 수 있었다”고 말했다. 또한, 김은영 교수는 “마스터 뉴런 생체시계의 독특한 성질 덕분에 생체시계가 안정성과 유연성이라는 역설적인 성질을 모두 가질 수 있었다”며 “모든 세포의 생체시계가 천편일률적으로 작동하는 대신 자신의 역할에 맞게 다른 작동 방식을 취한다는 점이 놀라웠다”고 말했다.
생체시계가 안정성과 유연성을 동시에 유지하지 못하면 다양한 환경에서 일정한 수면패턴을 유지할 수 없고, 일주기 리듬 수면장애가 발생한다. 이번 연구결과는 일주기 리듬 수면장애의 원인을 규명하고 치료법을 찾는 새로운 패러다임을 제시할 수 있을 것으로 예상된다.
정의민, 권미리, 조은주 박사가 공동 제 1저자로 참여한 이번 연구결과는 2월 15일 오후 5시(한국시간) 자연과학 분야의 저명 국제학술지인 미국국립과학원회보(Proceedings Of The National Academy Of Sciences, PNAS, IF 11.205)에 게재됐다.
* 논문명: Systematic modeling-driven experiments identify distinct molecular clockworks underlying hierarchically organized pacemaker neurons
2022.02.16 조회수 15282
수학과 실험을 결합하여 생체시계의 역설 규명
수학과 실험을 결합한 융합연구를 통해 생체시계가 안정적 리듬을 유지하면서도 환경변화에 쉽게 적응할 수 있는 원리가 밝혀졌다. 우리 대학 수리과학과 김재경 교수가 이끄는 기초과학연구원(IBS) 수리 및 계산과학 연구단 의생명 수학 그룹과 우리 대학 수리과학과 연구팀, 그리고 아주대 의과대학 뇌과학과 김은영 교수 연구팀은 공동연구를 통해 초파리 뇌의 생체시계 뉴런들의 생체시계 작동원리를 분석했다.
생체시계(Circadian clock)는 생명체가 24시간 주기에 맞춰 살아갈 수 있도록 행동과 생리 작용을 조절하는 역할을 한다. 예를 들어, 생체시계는 밤 9시경이 되면 뇌에서 멜라토닌 호르몬 분비를 유발해 일정 시간이 되면 수면을 취할 수 있도록 하는 등 우리 운동 능력이나 학습 능력에 이르는 거의 모든 생리 작용에 관여한다. 따라서, 평소에는 일정한 시간을 안정적으로 몸에 제시하면서, 동시에 계절 변화에 따른 낮밤의 길이 변화나 해외여행으로 인한 시차 등 환경변화가 생겼을 때는 새로운 환경에 유연하게 적응해서 변화한 시간을 몸에 제시해주어야 한다. 이러한 안정성과 유연성을 동시에 유지하는 생체시계의 역설적인 성질의 원리는 지금까지 알려져 있지 않았다.
초파리 생체시계 뉴런들의 경우, 마스터 뉴런(master neuron)이 외부로부터 들어오는 빛 정보를 취합하여 시간 정보를 슬레이브 뉴런(slave neuron)에 전달하면, 이에 맞춰 슬레이브 뉴런이 일주기 행동을 조절하는 계층구조를 형성하고 있다. 이러한 역할 차이에도 불구하고, 두 뉴런의 생체시계는 동일한 원리로 작동한다고 알려져 있었다. 2017년 노벨 생리의학상을 수상한 마이클 영, 제프리 홀 그리고 마이클 로스바쉬 교수는 PER 단백질이 매일 일정한 시간에 세포핵 안으로 들어가 PER 유전자의 전사를 일정 시간에 스스로 억제하는 음성피드백 루프를 통해 24시간 주기의 리듬을 만드는 것이 생체시계의 핵심 원리임을 밝혔다.
연구진은 초파리에서 CLK에 변이가 생겼을 때 마스터 뉴런과 슬레이브 뉴런에서 서로 다른 PER변화 양상이 나타나는 것에 착안하여 마스터 뉴런과 슬레이브 뉴런이 만들어내는 PER 단백질의 변화 양상을 1000여 개 수리 모델을 개발하여 분석한 결과, 마스터 뉴런의 PER이 슬레이브 뉴런의 PER에 비해 빠르게 합성되었다 분해되고 있음을 예측하였다. 이러한 마스터 뉴런의 독특한 성질 덕분에, 평소에 강한 PER 리듬을 생성해서 안정적인 시계 역할을 하다가 외부 환경에 변화가 일어났을 때 빠르게 적응할 수 있음 역시 가상 시뮬레이션을 통해 예측하였다. 이러한 마스터 뉴런에 관한 수리모델링 예측은 초파리 생체 실험을 통해서도 검증되었다.
김재경 교수는 “모든 세포의 생체시계는 당연히 비슷한 방식으로 작동될 것이란 오래된 믿음이 수학을 이용한 분석 덕분에 틀렸음을 알게 되었다”며 “수학과 실험을 융합한 방식으로 문제에 접근하였기 때문에 문제를 해결할 수 있었다”고 말했다. 또한, 김은영 교수는 “마스터 뉴런 생체시계의 독특한 성질 덕분에 생체시계가 안정성과 유연성이라는 역설적인 성질을 모두 가질 수 있었다”며 “모든 세포의 생체시계가 천편일률적으로 작동하는 대신 자신의 역할에 맞게 다른 작동 방식을 취한다는 점이 놀라웠다”고 말했다.
생체시계가 안정성과 유연성을 동시에 유지하지 못하면 다양한 환경에서 일정한 수면패턴을 유지할 수 없고, 일주기 리듬 수면장애가 발생한다. 이번 연구결과는 일주기 리듬 수면장애의 원인을 규명하고 치료법을 찾는 새로운 패러다임을 제시할 수 있을 것으로 예상된다.
정의민, 권미리, 조은주 박사가 공동 제 1저자로 참여한 이번 연구결과는 2월 15일 오후 5시(한국시간) 자연과학 분야의 저명 국제학술지인 미국국립과학원회보(Proceedings Of The National Academy Of Sciences, PNAS, IF 11.205)에 게재됐다.
* 논문명: Systematic modeling-driven experiments identify distinct molecular clockworks underlying hierarchically organized pacemaker neurons
2022.02.16 조회수 15282