%EB%B6%84%EC%9E%90%EB%84%A4%ED%8A%B8%EC%9B%8C%ED%81%AC
-
 염증없이 체내·외 측정 가능한 전자 신소재 개발
생체전자 의료기기는 체내에서 발생하는 신호를 읽어 생물학적 활동을 감지하거나, 조직을 자극해 질병 등을 치료하는 데 사용된다. 하지만 의료기기에 사용되는 전극 물질은 딱딱한 물성을 가지고 있어 체내에 염증반응을 일으키고 조직에 다량의 손상으로 이어질 수 있다. 따라서 조직과 같이 부드러운 성질을 가지면서도 전도성을 띠는 하이드로겔과 같은 연성 물질에 생체적합성이 높은 전도성 고분자를 체내 전극으로 사용하는 연구들이 활발하게 진행되고 있다.
우리 대학 신소재공학과 강지형 교수와 바이오및뇌공학과 박성준 교수 공동연구팀이 기존에 없었던 고전도성, 유사 조직 접착성 하이드로겔이란 신소재를 개발해 고성능 생체전자 기기를 구현했다고 4일 밝혔다.
대부분 전기 전도도가 높을수록 전도성 도메인들의 결정성이 높아지는 원리에 의해, 전도성이 높은 하이드로겔은 딱딱해지고, 부드러운 하이드로겔은 전도성이 낮을 수밖에 없다는 한계를 가진다. 이에 따라 전도성 고분자를 사용하는 하이드로겔 중, 전기 전도도가 높으면서도(10 S/cm 이상) 부드러운 물성(100 kPa 이하)을 가진 하이드로겔은 지금까지 보고된 바 없었다.
강지형 교수 연구팀은 기존에 없었던 고전도성, 유사 조직 물성 하이드로겔을 개발했다. 이 하이드로겔은 보고된 전도성 고분자 하이드로겔 중 가장 높은 전기 전도도(247 S/cm)를 띄며, 조직과 비슷한 물성(탄성율 = 60 kPa, 파괴변형률 = 410%)을 갖는다. 또한, 본 재료는 지속적인 움직임과 팽창, 수축이 있는 심장, 위와 같은 조직에서 안정적으로 기기가 작동하기 위해 필수조건인 조직에 쉽게 접착되는 장점을 가지고 있다.
공동연구팀은 원하는 생체 조직에 맞게 조정하고 그 형태에 맞추는 주형의 그물 구조에 따라 높은 질서도를 가지는 고분자 주형 네트워크를 도입했다.
따라서 주형에 맞추어 형성된 그물 네트워크는 기존 네트워크 대비 100배 이상 높은 전기 전도도를 보이며, 동시에 주형 고분자의 부드러운 특성 때문에 조직과 비슷한 물성을 지니게 된다. 변형에도 저항이 바뀌지 않아 생체전극으로서 최적의 성능을 갖는다.
또한 연구팀은 개발한 하이드로겔을 전극을 기반으로 한 높은 전기 전도도를 가진 다양한 고성능 생체전자 기기를 제작, 그 기능성을 검증했다. 높은 전기 전도도를 가진 특성으로 좌골신경 자극을 대상으로 하는 디바이스의 경우, 매우 낮은 전압(40 mV)에서 다리 근육의 움직임을 성공적으로 유도할 수 있었다. 또한 심전도 측정(ECG)을 위한 디바이스의 경우에도 매우 높은 신호 대 잡음 비(61 dB)로 신호를 측정하는 데 성공함으로써, 초고품질 생체 신호 측정을 위한 연성 기기 개발 가능성을 입증하였다.
이번 연구를 주도한 강지형 교수는 "이번 연구는 고전도성을 갖고 생체조직과 유사한 기계적 물성을 갖는 하이드로겔 개발을 위한 합성 방향을 새롭게 제시했다는 점에서 의미가 있다고 하면서, "이번에 개발된 전도성 하이드로겔은 급속도로 성장하고 있는 전자약 시장에 게임 체인저가 될 것으로 기대된다고 말했다.
우리 대학 신소재공학과 정주은 박사과정과 바이오및뇌공학과 성창훈 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션스 (Nature Communications)’에 4월 18일 게재됐다. (논문명: Highly conductive tissue-like hydrogel interface through template-directed assembly)
한편 이번 연구는 한국연구재단의 나노소재기술개발 미래기술연구실 사업을 받아 수행됐다.
2023.05.04 조회수 11700
염증없이 체내·외 측정 가능한 전자 신소재 개발
생체전자 의료기기는 체내에서 발생하는 신호를 읽어 생물학적 활동을 감지하거나, 조직을 자극해 질병 등을 치료하는 데 사용된다. 하지만 의료기기에 사용되는 전극 물질은 딱딱한 물성을 가지고 있어 체내에 염증반응을 일으키고 조직에 다량의 손상으로 이어질 수 있다. 따라서 조직과 같이 부드러운 성질을 가지면서도 전도성을 띠는 하이드로겔과 같은 연성 물질에 생체적합성이 높은 전도성 고분자를 체내 전극으로 사용하는 연구들이 활발하게 진행되고 있다.
우리 대학 신소재공학과 강지형 교수와 바이오및뇌공학과 박성준 교수 공동연구팀이 기존에 없었던 고전도성, 유사 조직 접착성 하이드로겔이란 신소재를 개발해 고성능 생체전자 기기를 구현했다고 4일 밝혔다.
대부분 전기 전도도가 높을수록 전도성 도메인들의 결정성이 높아지는 원리에 의해, 전도성이 높은 하이드로겔은 딱딱해지고, 부드러운 하이드로겔은 전도성이 낮을 수밖에 없다는 한계를 가진다. 이에 따라 전도성 고분자를 사용하는 하이드로겔 중, 전기 전도도가 높으면서도(10 S/cm 이상) 부드러운 물성(100 kPa 이하)을 가진 하이드로겔은 지금까지 보고된 바 없었다.
강지형 교수 연구팀은 기존에 없었던 고전도성, 유사 조직 물성 하이드로겔을 개발했다. 이 하이드로겔은 보고된 전도성 고분자 하이드로겔 중 가장 높은 전기 전도도(247 S/cm)를 띄며, 조직과 비슷한 물성(탄성율 = 60 kPa, 파괴변형률 = 410%)을 갖는다. 또한, 본 재료는 지속적인 움직임과 팽창, 수축이 있는 심장, 위와 같은 조직에서 안정적으로 기기가 작동하기 위해 필수조건인 조직에 쉽게 접착되는 장점을 가지고 있다.
공동연구팀은 원하는 생체 조직에 맞게 조정하고 그 형태에 맞추는 주형의 그물 구조에 따라 높은 질서도를 가지는 고분자 주형 네트워크를 도입했다.
따라서 주형에 맞추어 형성된 그물 네트워크는 기존 네트워크 대비 100배 이상 높은 전기 전도도를 보이며, 동시에 주형 고분자의 부드러운 특성 때문에 조직과 비슷한 물성을 지니게 된다. 변형에도 저항이 바뀌지 않아 생체전극으로서 최적의 성능을 갖는다.
또한 연구팀은 개발한 하이드로겔을 전극을 기반으로 한 높은 전기 전도도를 가진 다양한 고성능 생체전자 기기를 제작, 그 기능성을 검증했다. 높은 전기 전도도를 가진 특성으로 좌골신경 자극을 대상으로 하는 디바이스의 경우, 매우 낮은 전압(40 mV)에서 다리 근육의 움직임을 성공적으로 유도할 수 있었다. 또한 심전도 측정(ECG)을 위한 디바이스의 경우에도 매우 높은 신호 대 잡음 비(61 dB)로 신호를 측정하는 데 성공함으로써, 초고품질 생체 신호 측정을 위한 연성 기기 개발 가능성을 입증하였다.
이번 연구를 주도한 강지형 교수는 "이번 연구는 고전도성을 갖고 생체조직과 유사한 기계적 물성을 갖는 하이드로겔 개발을 위한 합성 방향을 새롭게 제시했다는 점에서 의미가 있다고 하면서, "이번에 개발된 전도성 하이드로겔은 급속도로 성장하고 있는 전자약 시장에 게임 체인저가 될 것으로 기대된다고 말했다.
우리 대학 신소재공학과 정주은 박사과정과 바이오및뇌공학과 성창훈 박사과정이 공동 제1 저자로 참여한 이번 연구 결과는 국제 학술지 ‘네이처 커뮤니케이션스 (Nature Communications)’에 4월 18일 게재됐다. (논문명: Highly conductive tissue-like hydrogel interface through template-directed assembly)
한편 이번 연구는 한국연구재단의 나노소재기술개발 미래기술연구실 사업을 받아 수행됐다.
2023.05.04 조회수 11700 -
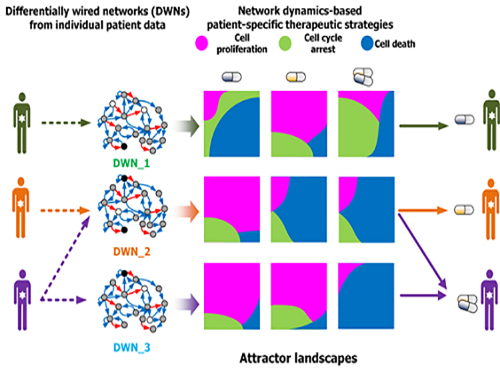 조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 24341
조광현 교수, 암세포 유형별 최적 약물표적 발굴기술 개발
〈 최민수 박사, 조광현 교수 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 암세포의 유형에 따라 최적의 약물 표적을 찾는 기술을 개발했다.
이는 시스템생물학을 이용해 암세포의 유전자변이가 반영된 분자네트워크의 다이나믹스(동역학)를 분석해 약물의 반응을 예측하는 기술로 향후 암 관련 신약 개발에 크게 기여할 것으로 기대된다.
최민수, 시 주 (Shi Jue), 주 양팅 (Zhu Yanting), 양 루젠 (Yang Ruizhen)이 참여한 이번 연구는 ‘네이처 커뮤니케이션즈(Nature Communications)’ 12월 5일자 온라인 판에 게재됐다.
인간의 암세포는 유전자 돌연변이, 유전체 단위의 반복적 변이 등 여러 형태의 유전자 변이가 있다. 이러한 변이는 같은 암종에서도 암세포에 따라 많은 차이를 보이기 때문에 약물에 대한 반응도 다양하다.
암 연구자들은 암 환자에게서 빈번하게 발견되는 유전자변이를 파악하고 이 중 특정 약물의 지표로 사용될 수 있는 유전자변이를 찾기 위해 노력해 왔다. 이러한 연구는 단일 유전자변이의 발견 또는 유전자네트워크의 구조적 특징 분석에 초점이 맞춰져 있다.
하지만 이러한 접근 방법은 암세포 내 다양한 유전자 및 단백질의 상호작용에 의해 유발되는 암의 생물학적 특성과 이로 인한 약물반응의 차이를 설명하지 못하는 한계가 있다.
암세포의 유전자변이는 해당 유전자 기능 뿐 아니라 이 유전자와 상호작용하는 다른 유전자, 단백질에 영향을 미치기 때문에 결과적으로 분자네트워크의 다이나믹스(동역학) 특성에 변화를 일으킨다.
이로 인해 항암제에 대한 암세포의 반응이 변화하게 된다. 따라서 분자네트워크의 다이나믹스(동역학) 특성을 무시하고 소수의 암 관련 유전자를 표적으로 하는 현재의 치료법은 일부 환자에게만 유용하고 약물저항성을 갖는 대다수 환자에게는 효과적으로 적용되지 못한다.
조 교수 연구팀은 문제 해결을 위해 슈퍼컴퓨팅을 이용한 대규모 컴퓨터시뮬레이션과 세포 실험을 융합해 암세포 분자네트워크의 다이나믹스(동역학) 변화를 분석했다.
이를 통해 약물반응을 예측해 유형별 암세포의 최적 약물 표적을 발굴하는 기술을 개발했다. 이 기술은 대다수 암 발생에 관여하는 것으로 알려진 암 억제 유전자 p53의 분자조절네트워크에 시범적으로 적용됐다.
연구팀은 국제 컨소시엄인 암 세포주 백과사전(CCLE : The Cancer Cell Line Encyclopedia)에 공개된 대규모 암세포 유전체 데이터를 분자네트워크에 반영해 구축했으며 유전변이의 특성에 따라 서로 다른 분자네트워크를 생성했다.
각 분자네트워크에 대해 약물반응을 모사한 섭동분석을 수행해 약물반응을 나타내는 암세포의 변화를 정량화하고 군집화했다. 그 후 컴퓨터시뮬레이션 분석을 통해 효능, 조합에 따른 시너지효과 등 약물반응정도를 예측했다.
이러한 컴퓨터시뮬레이션 결과를 토대로 폐암, 유방암, 골종양, 피부암, 신장암, 난소암 등 다양한 암세포주를 대상으로 약물반응 실험을 수행해 비교 검증했다.
이 기술은 임의의 분자네트워크에 대해서 동일한 방식으로 적용할 수 있고 최적의 약물 표적을 발굴해 개인 맞춤치료에 활용가능하다.
연구팀은 암세포의 이질성에 따른 다양한 약물반응의 원인을 특정 유전자나 단백질뿐만 아니라 상호조절작용을 종합적으로 고려해 분석할 수 있게 됐다고 밝혔다.
또한 약물저항성의 원인을 사전에 예측하고 이를 억제할 수 있는 최적의 약물 표적을 발굴할 수 있게 됐고 기존 약물의 새로운 적용대상을 찾는 약물재창출에 활용될 수 있는 핵심 원천기술을 확보하게 됐다고 말했다.
조 교수는 “암세포별 유전변이는 약물반응 다양성의 원인이지만 지금까지 이에 대한 총체적 분석이 이뤄지지 못했다”며 “시스템생물학을 통해 암세포 유형별 분자네트워크의 약물반응을 시뮬레이션으로 분석해 약물 반응의 근본적 원리를 파악하고 새로운 개념의 최적 약물 타겟을 발굴할 수 있게 됐다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 컴퓨터시뮬레이션을 통한 암세포 유형별 약물반응 예측 및 세포실험 비교 검증
그림2. 암세포별 분자네트워크의 동역학 분석에 기반한 약물반응 예측 및 군집화
그림3. 세포 분자네트워크 분석에 따른 암세포 유형별 약물타겟 발굴 및 암환자별 맞춤치료 전략 수립
2017.12.07 조회수 24341 -
 생명의 기원과 진화의 비밀 풀 수 있는 열쇠(커널) 찾아내다
- Science 자매지 표지논문발표,“인간 세포의 주요기능 그대로 보존한 최소 핵심구조 규명”-
세포를 구성하는 복잡하고 거대한 분자네트워크의 주요기능을 그대로 보존한 최소 핵심구조(커널)가 국내 연구진에 의해 규명되었다.
특히 커널에는 진화적․유전적․임상적으로 매우 중요한 조절분자들이 대거 포함되어 있다는 사실이 밝혀짐에 따라, 향후 생명의 기원에 관한 기초연구와 신약 타겟 발굴 등에 큰 파급효과가 있을 것으로 기대된다.
우리 학교 조광현 교수 연구팀(김정래, 김준일, 권영근, 이황열, 팻헤슬롭해리슨)의 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구), 기초연구실육성사업, 시스템인포메틱스사업(칼슘대사시스템생물학) 및 WCU육성사업의 지원으로 수행되었다.
이번 연구결과는 세계적인 학술지인 ‘사이언스’의 첫 번째 자매지로서 세포신호전달분야의 권위지인 ‘사이언스 시그널링(Science Signaling)’지(5월 31일자) 표지논문에 게재되는 영예를 얻었다.
(논문명 : Reduction of Complex Signaling Networks to a Representative Kernel)
생명체를 구성하는 다양한 분자들은 사람과 마찬가지로 복잡한 관계로 얽혀 거대한 네트워크를 형성한다.
현대 생물학의 화두로 떠오른 IT와 BT의 융합학문인 ‘시스템생물학’의 발전에 따라, 생명현상은 복잡한 네트워크로 연결된 수많은 분자들의 집단 조절작용으로 이루어진다는 사실이 점차 밝혀지고 있다. 즉, 특정기능을 담당하는 단일 유전자나 단백질의 관점에서 벗어나 생명체를 하나의 ‘시스템’으로 바라보게 된 것이다.
그러나 생명체 네트워크의 방대한 규모와 복잡성으로 근본적인 작동원리를 이해하는데 여전히 한계가 있다. 일례로, 세포의 다양한 정보처리를 위해 진화해 온 인간세포 신호전달 네트워크는 현재까지 약 2,000여개의 단백질과 8,000여 가지의 상호작용으로 이루어져 있다고 알려졌고, 아직 확인되지 않은 부분까지 고려하면 실제 더욱 복잡한 네트워크일 것으로 추정된다.
생명체의 조절네트워크는 태초에 어떻게 만들어졌고, 어떻게 진화되어 왔을까? 그 복잡한 네트워크의 기능을 그대로 보존하는 단순한 핵심구조가 존재하고 그것을 찾아낼 수 있다면, 인류는 복잡한 네트워크에 대한 수많은 수수께끼를 풀 수 있을 것이다.
조광현 KAIST지정석좌교수 연구팀은 이 수수께끼의 열쇠인 복잡하고 거대한 세포 신호전달 네트워크의 기능을 그대로 보존하는 최소 핵심구조인 커널을 찾아냈다.
연구팀은 새로운 알고리즘을 개발하고, 이를 대규모 컴퓨터시뮬레이션을 통해 대장균과 효모 및 인간의 신호전달 네트워크에 적용한 결과, 각각의 커널을 확인할 수 있었다.
매우 흥미로운 사실은 이번에 찾아낸 커널이 진화적으로 가장 먼저 형성된 네트워크의 뼈대구조임이 밝혀진 것이다. 또한 커널에는 생명유지에 반드시 필요한 필수유전자뿐만 아니라 질병발생과 관련된 유전자들이 대거 포함되어 있었다.
이번 연구를 주도한 조광현 교수는 “특히 이번에 찾은 커널에는 현재까지 FDA(미국식품의양국)에서 승인한 약물의 타겟 단백질이 대량 포함되어 있어, 커널 내의 단백질들을 대상으로 향후 새로운 신약 타겟이 발굴될 가능성이 높아, 산업적으로도 큰 파급효과가 있을 것으로 기대한다”고 연구의의를 밝혔다.
<세포내 신호전달네트워크에 존재하는 최소 핵심구조 "커널">
<논문표지>
2011.06.22 조회수 21786
생명의 기원과 진화의 비밀 풀 수 있는 열쇠(커널) 찾아내다
- Science 자매지 표지논문발표,“인간 세포의 주요기능 그대로 보존한 최소 핵심구조 규명”-
세포를 구성하는 복잡하고 거대한 분자네트워크의 주요기능을 그대로 보존한 최소 핵심구조(커널)가 국내 연구진에 의해 규명되었다.
특히 커널에는 진화적․유전적․임상적으로 매우 중요한 조절분자들이 대거 포함되어 있다는 사실이 밝혀짐에 따라, 향후 생명의 기원에 관한 기초연구와 신약 타겟 발굴 등에 큰 파급효과가 있을 것으로 기대된다.
우리 학교 조광현 교수 연구팀(김정래, 김준일, 권영근, 이황열, 팻헤슬롭해리슨)의 이번 연구는 교육과학기술부(장관 이주호)와 한국연구재단(이사장 오세정)이 추진하는 중견연구자지원사업(도약연구), 기초연구실육성사업, 시스템인포메틱스사업(칼슘대사시스템생물학) 및 WCU육성사업의 지원으로 수행되었다.
이번 연구결과는 세계적인 학술지인 ‘사이언스’의 첫 번째 자매지로서 세포신호전달분야의 권위지인 ‘사이언스 시그널링(Science Signaling)’지(5월 31일자) 표지논문에 게재되는 영예를 얻었다.
(논문명 : Reduction of Complex Signaling Networks to a Representative Kernel)
생명체를 구성하는 다양한 분자들은 사람과 마찬가지로 복잡한 관계로 얽혀 거대한 네트워크를 형성한다.
현대 생물학의 화두로 떠오른 IT와 BT의 융합학문인 ‘시스템생물학’의 발전에 따라, 생명현상은 복잡한 네트워크로 연결된 수많은 분자들의 집단 조절작용으로 이루어진다는 사실이 점차 밝혀지고 있다. 즉, 특정기능을 담당하는 단일 유전자나 단백질의 관점에서 벗어나 생명체를 하나의 ‘시스템’으로 바라보게 된 것이다.
그러나 생명체 네트워크의 방대한 규모와 복잡성으로 근본적인 작동원리를 이해하는데 여전히 한계가 있다. 일례로, 세포의 다양한 정보처리를 위해 진화해 온 인간세포 신호전달 네트워크는 현재까지 약 2,000여개의 단백질과 8,000여 가지의 상호작용으로 이루어져 있다고 알려졌고, 아직 확인되지 않은 부분까지 고려하면 실제 더욱 복잡한 네트워크일 것으로 추정된다.
생명체의 조절네트워크는 태초에 어떻게 만들어졌고, 어떻게 진화되어 왔을까? 그 복잡한 네트워크의 기능을 그대로 보존하는 단순한 핵심구조가 존재하고 그것을 찾아낼 수 있다면, 인류는 복잡한 네트워크에 대한 수많은 수수께끼를 풀 수 있을 것이다.
조광현 KAIST지정석좌교수 연구팀은 이 수수께끼의 열쇠인 복잡하고 거대한 세포 신호전달 네트워크의 기능을 그대로 보존하는 최소 핵심구조인 커널을 찾아냈다.
연구팀은 새로운 알고리즘을 개발하고, 이를 대규모 컴퓨터시뮬레이션을 통해 대장균과 효모 및 인간의 신호전달 네트워크에 적용한 결과, 각각의 커널을 확인할 수 있었다.
매우 흥미로운 사실은 이번에 찾아낸 커널이 진화적으로 가장 먼저 형성된 네트워크의 뼈대구조임이 밝혀진 것이다. 또한 커널에는 생명유지에 반드시 필요한 필수유전자뿐만 아니라 질병발생과 관련된 유전자들이 대거 포함되어 있었다.
이번 연구를 주도한 조광현 교수는 “특히 이번에 찾은 커널에는 현재까지 FDA(미국식품의양국)에서 승인한 약물의 타겟 단백질이 대량 포함되어 있어, 커널 내의 단백질들을 대상으로 향후 새로운 신약 타겟이 발굴될 가능성이 높아, 산업적으로도 큰 파급효과가 있을 것으로 기대한다”고 연구의의를 밝혔다.
<세포내 신호전달네트워크에 존재하는 최소 핵심구조 "커널">
<논문표지>
2011.06.22 조회수 21786 -
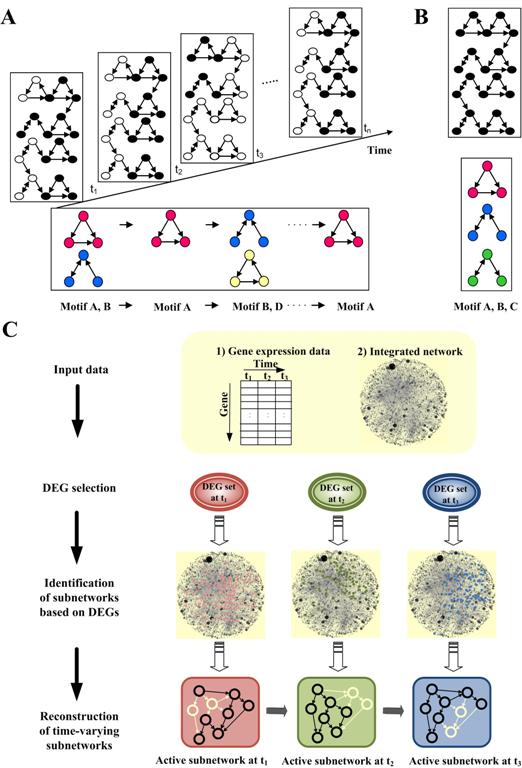 조광현교수 생체 분자네트워크의 다이나믹한 조절회로 규명
- 조광현 교수연구팀, IT와 BT를 융합한 시스템생물학 연구 통해- 초파리 발달과정의 다이나믹한 조절메커니즘을 시스템차원에서 규명
우리학교 바이오및뇌공학과 조광현 교수 연구팀은 IT와 BT를 융합한 시스템생물학 연구를 통해, 시간에 따라 변화하는 유전자 네트워크의 동역학 개념을 최초로 제시했다. 이 개념을 이용하면 초파리 발달과정 중 단계별로 중요한 조절작용을 하는 동적 네트워크 모티프를 찾아내어, 발달과정의 다이나믹한 조절메커니즘을 시스템차원에서 규명할 수 있다.
측정기술이 발달한 현대생명과학은 유전체나 단백질체 등 세포내 분자발현량의 집단 관측이 가능하다. 이러한 오믹스(Omics) 기술의 발전에 힘입어 생체 분자들 간 상호작용을 거대한 네트워크로 모사하고, 집합적 조절작용을 시스템 차원에서 분석 이해하고자 하는 시도가 이어지고 있다.
특히, 거대 생체 분자상호작용 네트워크를 이해하는 유용한 방법으로 네트워크를 구성하는 작은 모듈, 즉 네트워크 모티프를 찾아내고 그 역할을 분석하여 이들의 조합으로 이루어진 전체 네트워크의 거동을 추정하는 연구가 각광받고 있다. 그러나 지금까지 이런 조절 네트워크는 시간축 상에 고정된 정적 개념으로만 다루어져 왔다.
조교수 연구팀은 실제의 시간 흐름에 따라 다이나믹하게(동적으로) 변화하는 분자발현을 추적했다. 그리고 이 데이터로부터 거대 네트워크의 일부분만이 특정 시간대의 조절작용에 참여함을 밝히고 이 관점에서 동적 조절네트워크 모티프 개념을 도입해 4차원에서 생체분자 조절작용을 규명하는 새로운 시도를 했다.
이 개념을 이용해 초파리 발달과정에서 단계별 발달의 조절작용에 기여하는 동적 네트워크 모티프를 찾아내어 다이나믹하게 조절되는 발달과정의 메커니즘을 시스템관점에서 새롭게 규명한 것이다.
조교수는 “이번 연구에서 제안된 개념은 암과 같은 복잡한 인체질환의 발달과정을 분석하고 새로운 진단과 예측방법의 개발에 폭넓게 응용될 수 있을 것으로 보인다”고 말했다.
이 연구는 교육과학기술부가 지원하는 한국연구재단 연구사업의 일환으로 수행됐으며, 연구 결과는 국제저널 <바이오에세이(BioEssays)> 5월 18일자 온라인판 표지논문으로 소개됐다.
[그림설명]
발달유전학의 4차원 분해: 초파리 발달과정의 다이나믹 네트워크 모티프 원리 규명. 정적 조절네트워크 관점에서만 다뤄져 온 초파리 발달과정의 유전자 상호작용 네트워크에 시간축을 더해 4차원의 다이나믹한 관점으로 분석하는 새 개념의 연구가 조광현 교수 연구팀에 의해 제안되었다. 이 개념에 따르면 초파리 발달과정에서 단계별로 주요 역할을 하는 일련의 유전자집단을 새롭게 규명할 수 있다. 이 그림은 초파리 배아로부터 성체에 이르는 발달과정별로 주요 조절작용을 하는 네트워크 모티프의 개념을 설명한 것.
시간에 따라 변화하는 동적 조절네트워크의 개념도
A. 시간축으로 분해한 동적 조절네트워크 모티프
B. 시간축을 없애고 한 평면에 투영한 정적 조절네트워크 (섞여진 네트워크로부터 특정시간에 조절작용하는 요소를 식별하기 어려움).C. 마이크로어레이 실험을 통해 측정된 유전자 발현량으로부터 유전자 조절네트워크를 추론하고 시간대별로 작동하는 각각의 조절네트워크 모티프를 규명하는 과정의 모식도.
2010.06.07 조회수 19148
조광현교수 생체 분자네트워크의 다이나믹한 조절회로 규명
- 조광현 교수연구팀, IT와 BT를 융합한 시스템생물학 연구 통해- 초파리 발달과정의 다이나믹한 조절메커니즘을 시스템차원에서 규명
우리학교 바이오및뇌공학과 조광현 교수 연구팀은 IT와 BT를 융합한 시스템생물학 연구를 통해, 시간에 따라 변화하는 유전자 네트워크의 동역학 개념을 최초로 제시했다. 이 개념을 이용하면 초파리 발달과정 중 단계별로 중요한 조절작용을 하는 동적 네트워크 모티프를 찾아내어, 발달과정의 다이나믹한 조절메커니즘을 시스템차원에서 규명할 수 있다.
측정기술이 발달한 현대생명과학은 유전체나 단백질체 등 세포내 분자발현량의 집단 관측이 가능하다. 이러한 오믹스(Omics) 기술의 발전에 힘입어 생체 분자들 간 상호작용을 거대한 네트워크로 모사하고, 집합적 조절작용을 시스템 차원에서 분석 이해하고자 하는 시도가 이어지고 있다.
특히, 거대 생체 분자상호작용 네트워크를 이해하는 유용한 방법으로 네트워크를 구성하는 작은 모듈, 즉 네트워크 모티프를 찾아내고 그 역할을 분석하여 이들의 조합으로 이루어진 전체 네트워크의 거동을 추정하는 연구가 각광받고 있다. 그러나 지금까지 이런 조절 네트워크는 시간축 상에 고정된 정적 개념으로만 다루어져 왔다.
조교수 연구팀은 실제의 시간 흐름에 따라 다이나믹하게(동적으로) 변화하는 분자발현을 추적했다. 그리고 이 데이터로부터 거대 네트워크의 일부분만이 특정 시간대의 조절작용에 참여함을 밝히고 이 관점에서 동적 조절네트워크 모티프 개념을 도입해 4차원에서 생체분자 조절작용을 규명하는 새로운 시도를 했다.
이 개념을 이용해 초파리 발달과정에서 단계별 발달의 조절작용에 기여하는 동적 네트워크 모티프를 찾아내어 다이나믹하게 조절되는 발달과정의 메커니즘을 시스템관점에서 새롭게 규명한 것이다.
조교수는 “이번 연구에서 제안된 개념은 암과 같은 복잡한 인체질환의 발달과정을 분석하고 새로운 진단과 예측방법의 개발에 폭넓게 응용될 수 있을 것으로 보인다”고 말했다.
이 연구는 교육과학기술부가 지원하는 한국연구재단 연구사업의 일환으로 수행됐으며, 연구 결과는 국제저널 <바이오에세이(BioEssays)> 5월 18일자 온라인판 표지논문으로 소개됐다.
[그림설명]
발달유전학의 4차원 분해: 초파리 발달과정의 다이나믹 네트워크 모티프 원리 규명. 정적 조절네트워크 관점에서만 다뤄져 온 초파리 발달과정의 유전자 상호작용 네트워크에 시간축을 더해 4차원의 다이나믹한 관점으로 분석하는 새 개념의 연구가 조광현 교수 연구팀에 의해 제안되었다. 이 개념에 따르면 초파리 발달과정에서 단계별로 주요 역할을 하는 일련의 유전자집단을 새롭게 규명할 수 있다. 이 그림은 초파리 배아로부터 성체에 이르는 발달과정별로 주요 조절작용을 하는 네트워크 모티프의 개념을 설명한 것.
시간에 따라 변화하는 동적 조절네트워크의 개념도
A. 시간축으로 분해한 동적 조절네트워크 모티프
B. 시간축을 없애고 한 평면에 투영한 정적 조절네트워크 (섞여진 네트워크로부터 특정시간에 조절작용하는 요소를 식별하기 어려움).C. 마이크로어레이 실험을 통해 측정된 유전자 발현량으로부터 유전자 조절네트워크를 추론하고 시간대별로 작동하는 각각의 조절네트워크 모티프를 규명하는 과정의 모식도.
2010.06.07 조회수 19148