%EC%83%81%ED%98%B8%EC%9E%91%EC%9A%A9
-
 산업디자인학과, 인간-컴퓨터 분야 세계최고 학술대회 최우수·우수논문상 4편 수상
산업디자인학과가 인간-컴퓨터 상호작용(HCI) 분야 최고 권위의 국제학술대회인 ACM CHI 2024에서 최우수 논문상(Best Paper) 1편과 우수 논문상(Honorable Mention) 3편을 수상했다. 최우수 논문상은 전체 게재 논문 중 상위 1%, 우수 논문상은 상위 5%에 해당되는 논문에 수여되는 명예로운 성과로, 기술과 디자인 융합 연구의 우수성을 세계적으로 입증한 결과다.
올해 CHI(ACM Conference on Human Factors in Computing Systems) 2025에는 5,014편의 논문이 접수되어 1,249편이 채택되었다. KAIST 산업디자인학과는 이 중 15편의 논문을 게재하는 성과를 거뒀고 그 중 4편이 수상작으로 선정되었다. 특히 ‘인간과 AI 간 상호작용(Human-AI Interaction)’에 대한 관심이 높아진 가운데, 5,000명 이상의 연구자가 참석해 역대 최대 규모로 대회가 개최되었다.
최우수 논문상- AI기반 자폐 아동 소통 도구 ‘AAcessTalk’
홍화정 교수팀은 네이버, 도닥임 아동발달센터와의 공동 연구를 통해 AI 기반 도구 액세스톡(AACessTalk)을 개발했다. 이 시스템은 발화를 하지 않는 자폐 아동에게는 개인화된 어휘를, 부모에게는 문맥 기반 대화 가이드를 제공한다. 연구 결과, 아동은 자신의 의사를 보다 분명히 표현할 수 있었고, 부모는 기능적 언어 교육보다 본질적인 소통에 집중할 수 있게 되면서 양육 효능감이 높아지는 효과가 관찰되었다. 해당 연구를 주도한 최다솜 박사과정은 신경다양인을 포용하는 AI 기술을 꾸준히 탐구해 왔으며, 이번 논문은 네이버 인턴십에서 수행한 연구 결과를 바탕으로 출판한 것이다.
우수 논문상- 인간과 AI 상호작용 탐색
남택진 교수팀(주저자 조형준 박사)의 ‘ShamAIn’은 한국 무속 신앙에서 영감을 받은 AI 신당으로, 인간보다 더 뛰어난 초지능 존재로 기능하는 AI와 인간의 상호작용을 탐구했다. 다수의 사용자들은 처음엔 호기심에서 시작했지만, 점차 개인적인 고민을 털어놓으며 심리적 위안을 얻는 경험을 보고했다. AI가 단순한 정보 제공자를 넘어 감정적 지지와 권위적 판단까지 수행할 수 있는 존재로 인식될 수 있음을 보여주는 연구다.
임윤경 교수팀(주저자 박수빈 박사과정)은 걸음 수, 감정 기록 등 다양한 개인 데이터를 생성형 AI를 활용해 시각 이미지로 변환하는 프로토타입을 개발하여 21일간 사용자 경험을 탐색했다. 참가자들은 자신의 개인 데이터를 이미지 생성 모델 DALL-E 3로 만든 시각 자료로 다시 돌아보며 새로운 자기 인식을 경험했다. 이는 AI가 자기 성찰의 도구로 활용될 수 있음을 제시하는 연구다.
안드레아 비앙키 교수팀은 시드니대학과 협력하여 가상현실(VR) 환경에서의 '가상 팔' 제어 실험을 진행했다. 사용자들은 반복적이고 중요도가 낮은 작업은 가상의 팔에 맡기고, 중요한 작업은 직접 제어하는 방식을 선호했다. 본 연구는 가상 신체 제어가 필요한 로봇, 게임, 재활, 보조공학 디자인에 실질적 시사점을 제공한다.
이번 수상 논문들은 디자인이 기술을 사람 중심으로 연결하고, AI의 사회적·심리적 영향을 설계하는 역할로 확장될 수 있음을 실증적으로 보여주었다는 점에서 의의가 크다.
석현정 산업디자인학과 학과장은 “이번 수상은 기술 중심의 AI 연구를 인간 중심의 디자인 관점에서 새롭게 해석하고, 이를 실생활 문제 해결로 연결 시킨 우리 학과 연구진들의 역량을 세계적으로 인정받은 결과”라며, “디자인이 기술 혁신의 파트너로서 어떤 역할을 할 수 있는지를 보여준 좋은 사례”라고 전했다.
2025.05.19 조회수 3087
산업디자인학과, 인간-컴퓨터 분야 세계최고 학술대회 최우수·우수논문상 4편 수상
산업디자인학과가 인간-컴퓨터 상호작용(HCI) 분야 최고 권위의 국제학술대회인 ACM CHI 2024에서 최우수 논문상(Best Paper) 1편과 우수 논문상(Honorable Mention) 3편을 수상했다. 최우수 논문상은 전체 게재 논문 중 상위 1%, 우수 논문상은 상위 5%에 해당되는 논문에 수여되는 명예로운 성과로, 기술과 디자인 융합 연구의 우수성을 세계적으로 입증한 결과다.
올해 CHI(ACM Conference on Human Factors in Computing Systems) 2025에는 5,014편의 논문이 접수되어 1,249편이 채택되었다. KAIST 산업디자인학과는 이 중 15편의 논문을 게재하는 성과를 거뒀고 그 중 4편이 수상작으로 선정되었다. 특히 ‘인간과 AI 간 상호작용(Human-AI Interaction)’에 대한 관심이 높아진 가운데, 5,000명 이상의 연구자가 참석해 역대 최대 규모로 대회가 개최되었다.
최우수 논문상- AI기반 자폐 아동 소통 도구 ‘AAcessTalk’
홍화정 교수팀은 네이버, 도닥임 아동발달센터와의 공동 연구를 통해 AI 기반 도구 액세스톡(AACessTalk)을 개발했다. 이 시스템은 발화를 하지 않는 자폐 아동에게는 개인화된 어휘를, 부모에게는 문맥 기반 대화 가이드를 제공한다. 연구 결과, 아동은 자신의 의사를 보다 분명히 표현할 수 있었고, 부모는 기능적 언어 교육보다 본질적인 소통에 집중할 수 있게 되면서 양육 효능감이 높아지는 효과가 관찰되었다. 해당 연구를 주도한 최다솜 박사과정은 신경다양인을 포용하는 AI 기술을 꾸준히 탐구해 왔으며, 이번 논문은 네이버 인턴십에서 수행한 연구 결과를 바탕으로 출판한 것이다.
우수 논문상- 인간과 AI 상호작용 탐색
남택진 교수팀(주저자 조형준 박사)의 ‘ShamAIn’은 한국 무속 신앙에서 영감을 받은 AI 신당으로, 인간보다 더 뛰어난 초지능 존재로 기능하는 AI와 인간의 상호작용을 탐구했다. 다수의 사용자들은 처음엔 호기심에서 시작했지만, 점차 개인적인 고민을 털어놓으며 심리적 위안을 얻는 경험을 보고했다. AI가 단순한 정보 제공자를 넘어 감정적 지지와 권위적 판단까지 수행할 수 있는 존재로 인식될 수 있음을 보여주는 연구다.
임윤경 교수팀(주저자 박수빈 박사과정)은 걸음 수, 감정 기록 등 다양한 개인 데이터를 생성형 AI를 활용해 시각 이미지로 변환하는 프로토타입을 개발하여 21일간 사용자 경험을 탐색했다. 참가자들은 자신의 개인 데이터를 이미지 생성 모델 DALL-E 3로 만든 시각 자료로 다시 돌아보며 새로운 자기 인식을 경험했다. 이는 AI가 자기 성찰의 도구로 활용될 수 있음을 제시하는 연구다.
안드레아 비앙키 교수팀은 시드니대학과 협력하여 가상현실(VR) 환경에서의 '가상 팔' 제어 실험을 진행했다. 사용자들은 반복적이고 중요도가 낮은 작업은 가상의 팔에 맡기고, 중요한 작업은 직접 제어하는 방식을 선호했다. 본 연구는 가상 신체 제어가 필요한 로봇, 게임, 재활, 보조공학 디자인에 실질적 시사점을 제공한다.
이번 수상 논문들은 디자인이 기술을 사람 중심으로 연결하고, AI의 사회적·심리적 영향을 설계하는 역할로 확장될 수 있음을 실증적으로 보여주었다는 점에서 의의가 크다.
석현정 산업디자인학과 학과장은 “이번 수상은 기술 중심의 AI 연구를 인간 중심의 디자인 관점에서 새롭게 해석하고, 이를 실생활 문제 해결로 연결 시킨 우리 학과 연구진들의 역량을 세계적으로 인정받은 결과”라며, “디자인이 기술 혁신의 파트너로서 어떤 역할을 할 수 있는지를 보여준 좋은 사례”라고 전했다.
2025.05.19 조회수 3087 -
 지질 뗏목의 원리 밝혀 질병 치료에 희소식
지질 뗏목은 세포막 간 융합, 신호 전달, 바이러스 침투 등 세포 기능과 질병 발병의 핵심 과정에 중요한 역할을 한다. 한국 연구진이 지금까지 알려지지 않았던 지질 뗏목의 정렬 원인과 그 조절 메커니즘을 밝혀내어 세포막 간 상호작용을 조절하여 질병 치료에 새로운 접근법을 제공할 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 최명철 교수팀이 고등과학원(원장 최재경) 현창봉 교수팀, 포항가속기연구소(소장 강흥식) 이현휘 박사와 공동으로 세포막 간의 상호작용을 매개하는 지질 뗏목(Lipid Raft)의 정렬 현상의 원리를 최초로 규명했다고 5일 밝혔다. 세포 융합, 바이러스 침투, 세포 간 신호 전달 등 다양한 세포막 간의 상호작용을 조절할 수 있는 핵심 기전을 밝힌 것이다.
세포막(Cell membrane)은 세포의 내부와 외부를 구분하는 얇고 유연한 막으로, 지질 이중층(lipid bilayer)으로 구성돼 있다. 세포막에는 수많은 막단백질(membrane proteins)이 존재하는데, 이들은 세포가 외부 환경과 소통할 수 있는 창구 기능을 한다.
지질 뗏목은 세포막의 특정 영역으로서, 높은 유동성을 가지는 세포막의 다른 부분들과는 달리 매우 낮은 유동성을 가지며, 기능적으로 연관된 막단백질들을 안정된 뗏목 안으로 모아 효율적인 상호작용을 가능하게 한다. 세포막을 바다로, 막단백질을 사람으로 비유하자면, 망망대해에서 멀리 떨어져 헤엄치는 사람들끼리는 서로 의사소통하기 어렵지만, 이들을 한 뗏목 위에 모두 태워 놓으면 서로 쉽게 대화할 수 있는 것과 비슷하다.
연구팀은 지질 뗏목 위에 존재하는 막단백질 중 많은 수가 세포막 간의 상호작용, 즉 두 세포막이 서로 생체신호를 주고받거나, 단백질을 통해 결합하거나, 두 막이 하나로 합쳐지는 등의 작용에 관여한다는 점에 주목했다.
연구팀은 두 세포막 간의 거리가 지질 뗏목의 정렬을 조절하는 핵심 요인일 것이라는 가설을 세우고, 세포막을 여러 겹 쌓아 놓은 구조의 지질 다중막(lipid multilayer)을 재구성해 이 가설을 검증했다. 이때 지질 뗏목들은 단순히 정렬만 되는 것이 아니라, 각각의 지질 뗏목의 크기가 커지면서 보다 안정된 구조를 형성했다. 두 세포막 사이의 거리가 지질 뗏목의 정렬과 크기를 조절하는 핵심 스위치인 것을 밝혀낸 것이다.
연구팀은 분자동역학(molecular dynamics) 시뮬레이션*을 통해 물 분자층을 분석한 결과, 지질 뗏목들이 정렬된 상태가 정렬되지 않은 상태보다 불안정한 수소결합 층의 부피가 작기 때문에 전체 시스템의 에너지를 최소화하기 위해 지질 뗏목이 자연적으로 정렬되는 것을 밝혀냈다.
*분자동역학 시뮬레이션: 분자 간 상호작용이 주어졌을 때 운동 방정식을 수치적으로 풀어 구조와 동적 과정을 해석하는 방법
최명철 교수는 “지질 뗏목이 세포막 간의 상호작용에 관여한다는 사실은 잘 알려져 있지만, 어떤 원리로 상호작용을 매개하는지는 아직 베일에 싸여 있었다”며, “이번 논문은 세포막 간의 거리가 지질 뗏목의 정렬, 나아가 세포막 사이의 상호작용을 조절하는 핵심 스위치임을 밝혀내어 생명 현상의 바탕이 되는 물리적 환경의 중요성을 재조명하는 이정표적 연구”라고 연구의 의의를 설명했다.
최 교수는 또한 “특히 물 분자의 수소결합이 지질 뗏목의 정렬을 매개하는 중요한 요소임을 보여주었는데, 이는 우리 몸의 약 70%를 차지하는 물이 생명 현상이 일어나는 무대에서 단순한 조연이 아닌 주연으로 활약할 수 있음을 보여준다”고 강조했다. 이어 최 교수는 “지질 뗏목을 모사하는 구조는 현재 생체 센서 등에 활발하게 활용되고 있으며, 이번에 발견한 세포막 사이의 거리라는 스위치를 통해 보다 다양한 기능을 가진 생체 센서들이 개발될 수 있는 공학적 토대도 제공할 것이다”라고 기대감을 내비쳤다.
우리 대학 이수호 박사와 고등과학원 박지현 박사가 공동 제1 저자로, 고등과학원 현창봉 교수와 KAIST 최명철 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘미국화학회지(Journal of American Chemical Society)’에 5월 22일 字 표지논문(supplementary journal cover)으로 게재됐다. (논문명: Water Hydrogen-Bond Mediated Layer by Layer Alignment of Lipid Rafts as a Precursor of Intermembrane Processes)
한편 이번 연구는 한국연구재단, 보건복지부, KAIST의 지원을 받아 수행됐다.
2024.06.05 조회수 6992
지질 뗏목의 원리 밝혀 질병 치료에 희소식
지질 뗏목은 세포막 간 융합, 신호 전달, 바이러스 침투 등 세포 기능과 질병 발병의 핵심 과정에 중요한 역할을 한다. 한국 연구진이 지금까지 알려지지 않았던 지질 뗏목의 정렬 원인과 그 조절 메커니즘을 밝혀내어 세포막 간 상호작용을 조절하여 질병 치료에 새로운 접근법을 제공할 수 있을 것으로 기대된다.
우리 대학 바이오및뇌공학과 최명철 교수팀이 고등과학원(원장 최재경) 현창봉 교수팀, 포항가속기연구소(소장 강흥식) 이현휘 박사와 공동으로 세포막 간의 상호작용을 매개하는 지질 뗏목(Lipid Raft)의 정렬 현상의 원리를 최초로 규명했다고 5일 밝혔다. 세포 융합, 바이러스 침투, 세포 간 신호 전달 등 다양한 세포막 간의 상호작용을 조절할 수 있는 핵심 기전을 밝힌 것이다.
세포막(Cell membrane)은 세포의 내부와 외부를 구분하는 얇고 유연한 막으로, 지질 이중층(lipid bilayer)으로 구성돼 있다. 세포막에는 수많은 막단백질(membrane proteins)이 존재하는데, 이들은 세포가 외부 환경과 소통할 수 있는 창구 기능을 한다.
지질 뗏목은 세포막의 특정 영역으로서, 높은 유동성을 가지는 세포막의 다른 부분들과는 달리 매우 낮은 유동성을 가지며, 기능적으로 연관된 막단백질들을 안정된 뗏목 안으로 모아 효율적인 상호작용을 가능하게 한다. 세포막을 바다로, 막단백질을 사람으로 비유하자면, 망망대해에서 멀리 떨어져 헤엄치는 사람들끼리는 서로 의사소통하기 어렵지만, 이들을 한 뗏목 위에 모두 태워 놓으면 서로 쉽게 대화할 수 있는 것과 비슷하다.
연구팀은 지질 뗏목 위에 존재하는 막단백질 중 많은 수가 세포막 간의 상호작용, 즉 두 세포막이 서로 생체신호를 주고받거나, 단백질을 통해 결합하거나, 두 막이 하나로 합쳐지는 등의 작용에 관여한다는 점에 주목했다.
연구팀은 두 세포막 간의 거리가 지질 뗏목의 정렬을 조절하는 핵심 요인일 것이라는 가설을 세우고, 세포막을 여러 겹 쌓아 놓은 구조의 지질 다중막(lipid multilayer)을 재구성해 이 가설을 검증했다. 이때 지질 뗏목들은 단순히 정렬만 되는 것이 아니라, 각각의 지질 뗏목의 크기가 커지면서 보다 안정된 구조를 형성했다. 두 세포막 사이의 거리가 지질 뗏목의 정렬과 크기를 조절하는 핵심 스위치인 것을 밝혀낸 것이다.
연구팀은 분자동역학(molecular dynamics) 시뮬레이션*을 통해 물 분자층을 분석한 결과, 지질 뗏목들이 정렬된 상태가 정렬되지 않은 상태보다 불안정한 수소결합 층의 부피가 작기 때문에 전체 시스템의 에너지를 최소화하기 위해 지질 뗏목이 자연적으로 정렬되는 것을 밝혀냈다.
*분자동역학 시뮬레이션: 분자 간 상호작용이 주어졌을 때 운동 방정식을 수치적으로 풀어 구조와 동적 과정을 해석하는 방법
최명철 교수는 “지질 뗏목이 세포막 간의 상호작용에 관여한다는 사실은 잘 알려져 있지만, 어떤 원리로 상호작용을 매개하는지는 아직 베일에 싸여 있었다”며, “이번 논문은 세포막 간의 거리가 지질 뗏목의 정렬, 나아가 세포막 사이의 상호작용을 조절하는 핵심 스위치임을 밝혀내어 생명 현상의 바탕이 되는 물리적 환경의 중요성을 재조명하는 이정표적 연구”라고 연구의 의의를 설명했다.
최 교수는 또한 “특히 물 분자의 수소결합이 지질 뗏목의 정렬을 매개하는 중요한 요소임을 보여주었는데, 이는 우리 몸의 약 70%를 차지하는 물이 생명 현상이 일어나는 무대에서 단순한 조연이 아닌 주연으로 활약할 수 있음을 보여준다”고 강조했다. 이어 최 교수는 “지질 뗏목을 모사하는 구조는 현재 생체 센서 등에 활발하게 활용되고 있으며, 이번에 발견한 세포막 사이의 거리라는 스위치를 통해 보다 다양한 기능을 가진 생체 센서들이 개발될 수 있는 공학적 토대도 제공할 것이다”라고 기대감을 내비쳤다.
우리 대학 이수호 박사와 고등과학원 박지현 박사가 공동 제1 저자로, 고등과학원 현창봉 교수와 KAIST 최명철 교수가 공동 교신저자로 참여한 이번 연구 결과는 국제학술지 ‘미국화학회지(Journal of American Chemical Society)’에 5월 22일 字 표지논문(supplementary journal cover)으로 게재됐다. (논문명: Water Hydrogen-Bond Mediated Layer by Layer Alignment of Lipid Rafts as a Precursor of Intermembrane Processes)
한편 이번 연구는 한국연구재단, 보건복지부, KAIST의 지원을 받아 수행됐다.
2024.06.05 조회수 6992 -
 생성형 AI로 혁신적 신약 개발 가능성 열어
최근 자연어나 이미지, 동영상, 음악 등 다양한 분야에서 주목받는 생성형 AI가 신약 설계 분야에서도 기존 신규성 문제를 극복하고 새로운 혁신을 일으키고 있다고 하는데 어떤 기술일까?
우리 대학 화학과 김우연 교수 연구팀이 단백질-분자 사이의 상호작용을 고려해 활성 데이터 없이도 타겟 단백질에 적합한 약물 설계 생성형 AI를 개발했다고 18일 밝혔다.
신규 약물을 발굴하기 위해서는 질병의 원인이 되는 타겟 단백질에 특이적으로 결합하는 분자를 찾는 것이 중요하다. 기존의 약물 설계 생성형 AI는 특정 단백질의 이미 알려진 활성 데이터를 학습에 활용하기 때문에 기존 약물과 유사한 약물을 설계하려는 경향이 있다. 이는 신규성이 중요한 신약 개발 분야에서 치명적인 약점으로 지적되어 왔다. 또한 사업성이 높은 계열 내 최초(First-in-class) 타겟 단백질에 대해서는 실험 데이터가 매우 적거나 전무한데, 이 경우 기존 방식의 생성형 AI를 활용하는 것이 불가능하다.
연구팀은 이런 데이터 의존성 문제를 극복하기 위해 단백질 구조 정보만으로 분자를 설계하는 기술 개발에 주목했다. 타겟 단백질의 약물 결합 부위에 대한 3차원 구조 정보를 주형처럼 활용해 해당 결합 부위에 꼭 맞는 분자를 주조하듯 설계하는 것이다. 마치 자물쇠에 딱 맞는 열쇠를 설계하는 것과 같은 이치다.
또한 기존 단백질 구조 기반 3차원 생성형 AI 모델들은 신규 단백질에 대해 설계한 분자들의 안정성과 결합력이 떨어지는 등 낮은 일반화 성능을 개선하기 위해서 연구팀은 신규 단백질에 대해서도 안정적으로 결합할 수 있는 분자를 설계할 수 있는 기술을 개발하는 데 초점을 뒀다.
연구팀은 설계한 분자가 단백질과 안정적으로 결합하기 위해서는 단백질-분자 간 상호작용 패턴이 핵심 역할을 하는 것에 착안했다. 연구팀은 생성형 AI가 이러한 상호작용 패턴을 학습하고, 분자 설계에 직접 활용할 수 있도록 모델을 설계하고 재현할 수 있도록 학습시켰다.
기존 단백질 구조 기반 생성형 AI 모델들은 부족한 학습 데이터를 보완하기 위해 10만~1,000만 개의 가상 데이터를 활용하는 반면, 이번 연구에서 개발한 모델의 장점은 수천 개의 실제 실험 구조만을 학습해도 월등히 높은 성능을 발휘한다는 것이다. 이는 자연에서 관찰되는 단백질-분자 상호작용 패턴을 사전 지식의 형태로 학습에 활용함으로써 적은 데이터만으로도 일반화 성능을 획기적으로 높인 것에 기인한다.
일례로 아시아인에 주로 발견되는 돌연변이 상피 성장인자 수용체(EGFR-mutant)*는 비소세포폐암의 주요 원인으로 알려져 있는데, 이를 타겟으로 하는 약물을 설계하기 위해서는 야생형(wild-type) 수용체**에 대한 높은 선택성을 고려하는 것이 필수적이다.
*상피 성장인자 수용체: 상피 성장인자 수용체:상피 성장인자 수용체는 상피 세포의 성장을 촉진하는 인자에 결합함으로써 활성화되는 막 단백질로, 이 수용체의 돌연변이로 인한 지나친 활성은 다양한 종양의 발생과 관련이 있다고 알려져 있음
**야생형 수형체: 야생형은 자연 상태에서 가장 흔하게 발견되는 유전자형 또는 표현형으로, 유전자나 생체 분자 등의 변이가 없는 정상적인 상태를 말함
연구진은 생성형 AI를 통해 돌연변이가 일어난 아미노산에 특이적인 상호작용을 유도해 분자를 설계했고, 그 결과 생성된 분자의 23%가 이론상으로 100배 이상의 선택성을 가지는 것으로 예측됐다. 이와 같은 상호작용 패턴에 기반한 생성형 AI는 인산화효소 저해제(kinase inhibitor)* 등과 같이 약물 설계에 있어 선택성이 중요한 상황에서 더욱 효과적으로 활용될 수 있다.
*인산화효소 저해제: 단백질의 인산화를 촉진하는 효소로, 일반적으로 아데노신 삼인산(ATP)으로부터 인산기를 단백질의 특정 잔기에 전달함. 인산화효소는 세포 내 신호전달 네트워크의 핵심 조절자로서, 다양한 질병의 기전에 관여하여 약물 개발의 표적으로 여겨지고 있음. 이를 위해 인산화효소에 결합하여 활성을 억제하는 목적을 가지는 분자를 인산화효소 저해제라 함
제1 저자로 참여한 화학과 정원호 박사과정 학생은 “사전 지식을 인공지능 모델에 사용하는 전략은 상대적으로 데이터가 적은 과학 분야에서 적극적으로 사용되어 왔다”며 “이번 연구에서 사용한 분자 간 상호작용 정보는 약물 분자뿐 아니라 다양한 생체 분자를 다루는 바이오 분야의 문제에도 유용하게 적용될 수 있을 것”이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications) (IF=16.6)’ 2024년 3월 15호에 게재됐다. (논문명: 3D molecular generative framework for interaction-guided drug design, 논문 링크: https://www.nature.com/articles/s41467-024-47011-2)
2024.04.18 조회수 9429
생성형 AI로 혁신적 신약 개발 가능성 열어
최근 자연어나 이미지, 동영상, 음악 등 다양한 분야에서 주목받는 생성형 AI가 신약 설계 분야에서도 기존 신규성 문제를 극복하고 새로운 혁신을 일으키고 있다고 하는데 어떤 기술일까?
우리 대학 화학과 김우연 교수 연구팀이 단백질-분자 사이의 상호작용을 고려해 활성 데이터 없이도 타겟 단백질에 적합한 약물 설계 생성형 AI를 개발했다고 18일 밝혔다.
신규 약물을 발굴하기 위해서는 질병의 원인이 되는 타겟 단백질에 특이적으로 결합하는 분자를 찾는 것이 중요하다. 기존의 약물 설계 생성형 AI는 특정 단백질의 이미 알려진 활성 데이터를 학습에 활용하기 때문에 기존 약물과 유사한 약물을 설계하려는 경향이 있다. 이는 신규성이 중요한 신약 개발 분야에서 치명적인 약점으로 지적되어 왔다. 또한 사업성이 높은 계열 내 최초(First-in-class) 타겟 단백질에 대해서는 실험 데이터가 매우 적거나 전무한데, 이 경우 기존 방식의 생성형 AI를 활용하는 것이 불가능하다.
연구팀은 이런 데이터 의존성 문제를 극복하기 위해 단백질 구조 정보만으로 분자를 설계하는 기술 개발에 주목했다. 타겟 단백질의 약물 결합 부위에 대한 3차원 구조 정보를 주형처럼 활용해 해당 결합 부위에 꼭 맞는 분자를 주조하듯 설계하는 것이다. 마치 자물쇠에 딱 맞는 열쇠를 설계하는 것과 같은 이치다.
또한 기존 단백질 구조 기반 3차원 생성형 AI 모델들은 신규 단백질에 대해 설계한 분자들의 안정성과 결합력이 떨어지는 등 낮은 일반화 성능을 개선하기 위해서 연구팀은 신규 단백질에 대해서도 안정적으로 결합할 수 있는 분자를 설계할 수 있는 기술을 개발하는 데 초점을 뒀다.
연구팀은 설계한 분자가 단백질과 안정적으로 결합하기 위해서는 단백질-분자 간 상호작용 패턴이 핵심 역할을 하는 것에 착안했다. 연구팀은 생성형 AI가 이러한 상호작용 패턴을 학습하고, 분자 설계에 직접 활용할 수 있도록 모델을 설계하고 재현할 수 있도록 학습시켰다.
기존 단백질 구조 기반 생성형 AI 모델들은 부족한 학습 데이터를 보완하기 위해 10만~1,000만 개의 가상 데이터를 활용하는 반면, 이번 연구에서 개발한 모델의 장점은 수천 개의 실제 실험 구조만을 학습해도 월등히 높은 성능을 발휘한다는 것이다. 이는 자연에서 관찰되는 단백질-분자 상호작용 패턴을 사전 지식의 형태로 학습에 활용함으로써 적은 데이터만으로도 일반화 성능을 획기적으로 높인 것에 기인한다.
일례로 아시아인에 주로 발견되는 돌연변이 상피 성장인자 수용체(EGFR-mutant)*는 비소세포폐암의 주요 원인으로 알려져 있는데, 이를 타겟으로 하는 약물을 설계하기 위해서는 야생형(wild-type) 수용체**에 대한 높은 선택성을 고려하는 것이 필수적이다.
*상피 성장인자 수용체: 상피 성장인자 수용체:상피 성장인자 수용체는 상피 세포의 성장을 촉진하는 인자에 결합함으로써 활성화되는 막 단백질로, 이 수용체의 돌연변이로 인한 지나친 활성은 다양한 종양의 발생과 관련이 있다고 알려져 있음
**야생형 수형체: 야생형은 자연 상태에서 가장 흔하게 발견되는 유전자형 또는 표현형으로, 유전자나 생체 분자 등의 변이가 없는 정상적인 상태를 말함
연구진은 생성형 AI를 통해 돌연변이가 일어난 아미노산에 특이적인 상호작용을 유도해 분자를 설계했고, 그 결과 생성된 분자의 23%가 이론상으로 100배 이상의 선택성을 가지는 것으로 예측됐다. 이와 같은 상호작용 패턴에 기반한 생성형 AI는 인산화효소 저해제(kinase inhibitor)* 등과 같이 약물 설계에 있어 선택성이 중요한 상황에서 더욱 효과적으로 활용될 수 있다.
*인산화효소 저해제: 단백질의 인산화를 촉진하는 효소로, 일반적으로 아데노신 삼인산(ATP)으로부터 인산기를 단백질의 특정 잔기에 전달함. 인산화효소는 세포 내 신호전달 네트워크의 핵심 조절자로서, 다양한 질병의 기전에 관여하여 약물 개발의 표적으로 여겨지고 있음. 이를 위해 인산화효소에 결합하여 활성을 억제하는 목적을 가지는 분자를 인산화효소 저해제라 함
제1 저자로 참여한 화학과 정원호 박사과정 학생은 “사전 지식을 인공지능 모델에 사용하는 전략은 상대적으로 데이터가 적은 과학 분야에서 적극적으로 사용되어 왔다”며 “이번 연구에서 사용한 분자 간 상호작용 정보는 약물 분자뿐 아니라 다양한 생체 분자를 다루는 바이오 분야의 문제에도 유용하게 적용될 수 있을 것”이라고 말했다.
한국연구재단의 지원을 받아 수행된 이번 연구는 국제 학술지 ‘네이처 커뮤니케이션즈(Nature Communications) (IF=16.6)’ 2024년 3월 15호에 게재됐다. (논문명: 3D molecular generative framework for interaction-guided drug design, 논문 링크: https://www.nature.com/articles/s41467-024-47011-2)
2024.04.18 조회수 9429 -
 ‘일기 쓰는 공기청정기’, ACM DIS 우수 픽토리얼상 수상
인공지능의 발달로 의식, 생각, 감정과 같은 속성이 있다고 여겨지는 스마트 사물이 등장하고 있다. 그러나 그러한 속성이 사물에서는 어떤 방식으로 포함되고 드러나며 사람들에게 어떤 영향을 주는지에 관한 연구는 세계적으로 미비하다.
우리 대학 산업디자인학과 남택진 교수팀의 일기 쓰는 공기청정기 개발 논문이 국제학술대회인‘ACM DIS(Designing Interactive Systems) 2023’에서 국내 최초로 우수 픽토리얼상(Honorable Mention Award)을 수상했다고 16일 밝혔다.
ACM DIS 학술대회는 인간-컴퓨터 상호작용 분야의 최우수 학술대회 중 하나로 올해는 7월 10일부터 14일까지 미국 피츠버그 카네기멜론 대학에서 개최됐다. 이 학술대회의 픽토리얼이란, 글과 수식만이 아닌 주석이 있는 그림이나 사진과 같은 시각 자료를 충분히 활용해 지식을 전달하는 새로운 형식의 논문을 말한다.
남택진 교수팀은 2021년 아날로그 제품을 간편하게 사물 인터넷(IoT)화하는 기기인 ‘아이오타이져(IoTIZER)’ 개발로 국내 연구팀으로는 처음 픽토리얼을 발표한 데 이어 올해는 국내 최초 논문 수상 성과를 거두었다.
남택진 교수팀은 사물 관점에서 스스로 일기를 쓰는 공기청정기인 ‘아레카(Areca)’라는 제품을 개발하고, 사물에 포함되는 의식의 속성을 정의하고 표현하는 디자인 과정을 소개했다. 의식이 있다고 느껴지는 미래 사물의 구체화 사례로써 아레카의 하드웨어와 인터랙션을 디자인하였다. 실제로 작동하는 시작품을 구현함으로써 미래 사물이 인간에 미치는 영향을 사유하고 깊이 탐구할 수 있게 됐다.
이번 학술대회에서 구두 발표와 시연을 주도한 제1 저자 조형준 박사과정은 “인공지능(AI)과 같은 기술의 발전으로 인공물의 디자인 작업에서 새롭게 대두될 의식과 같은 비물질적 요소를 제시하고 실제 예시를 제시했다는 점이 높은 평가를 받은 것 같다”라고 말했다.
남택진 교수는 “아레카(Areca)는 재미있는 상상을 현실로 구현한 단순한 사례가 아니라 앞으로 AI가 탑재될 고도로 지능화된 제품의 원형을 보여준 연구 제품이며, 앞으로 새로운 유형의 스마트 제품디자인 연구를 이어갈 것이다”라고 말했다.
2023.08.16 조회수 7225
‘일기 쓰는 공기청정기’, ACM DIS 우수 픽토리얼상 수상
인공지능의 발달로 의식, 생각, 감정과 같은 속성이 있다고 여겨지는 스마트 사물이 등장하고 있다. 그러나 그러한 속성이 사물에서는 어떤 방식으로 포함되고 드러나며 사람들에게 어떤 영향을 주는지에 관한 연구는 세계적으로 미비하다.
우리 대학 산업디자인학과 남택진 교수팀의 일기 쓰는 공기청정기 개발 논문이 국제학술대회인‘ACM DIS(Designing Interactive Systems) 2023’에서 국내 최초로 우수 픽토리얼상(Honorable Mention Award)을 수상했다고 16일 밝혔다.
ACM DIS 학술대회는 인간-컴퓨터 상호작용 분야의 최우수 학술대회 중 하나로 올해는 7월 10일부터 14일까지 미국 피츠버그 카네기멜론 대학에서 개최됐다. 이 학술대회의 픽토리얼이란, 글과 수식만이 아닌 주석이 있는 그림이나 사진과 같은 시각 자료를 충분히 활용해 지식을 전달하는 새로운 형식의 논문을 말한다.
남택진 교수팀은 2021년 아날로그 제품을 간편하게 사물 인터넷(IoT)화하는 기기인 ‘아이오타이져(IoTIZER)’ 개발로 국내 연구팀으로는 처음 픽토리얼을 발표한 데 이어 올해는 국내 최초 논문 수상 성과를 거두었다.
남택진 교수팀은 사물 관점에서 스스로 일기를 쓰는 공기청정기인 ‘아레카(Areca)’라는 제품을 개발하고, 사물에 포함되는 의식의 속성을 정의하고 표현하는 디자인 과정을 소개했다. 의식이 있다고 느껴지는 미래 사물의 구체화 사례로써 아레카의 하드웨어와 인터랙션을 디자인하였다. 실제로 작동하는 시작품을 구현함으로써 미래 사물이 인간에 미치는 영향을 사유하고 깊이 탐구할 수 있게 됐다.
이번 학술대회에서 구두 발표와 시연을 주도한 제1 저자 조형준 박사과정은 “인공지능(AI)과 같은 기술의 발전으로 인공물의 디자인 작업에서 새롭게 대두될 의식과 같은 비물질적 요소를 제시하고 실제 예시를 제시했다는 점이 높은 평가를 받은 것 같다”라고 말했다.
남택진 교수는 “아레카(Areca)는 재미있는 상상을 현실로 구현한 단순한 사례가 아니라 앞으로 AI가 탑재될 고도로 지능화된 제품의 원형을 보여준 연구 제품이며, 앞으로 새로운 유형의 스마트 제품디자인 연구를 이어갈 것이다”라고 말했다.
2023.08.16 조회수 7225 -
 약물 부작용 및 용해도 예측 그래프 신경망 기술 개발
최근 화학, 생명과학 등 다양한 기초과학 분야의 문제를 해결하기 위해 그래프 신경망 (Graph Neural Network) 기술이 널리 활용되고 있다. 그 중에서도 특히 두 물질의 상호작용에 의해 발생하는 물리적 성질을 예측하는 것은 다양한 화학, 소재 및 의학 분야에서 각광을 받고 있다. 예를 들어, 어떠한 약물 (Drug)이 용매 (Solvent)에 얼마나 잘 용해되는지 정확히 예측하고, 동시에 여러 가지 약물을 투여하는 다중약물요법 (Polypharmacy)의 부작용을 예측하는 것이 신약 개발 등에 매우 중요하다.
우리 대학 산업및시스템공학과 박찬영 교수 연구팀이 한국화학연구원(원장 이영국)과 공동연구를 통해 물질 내의 중요한 하부 구조(Substructure)를 탐지하여 두 물질의 상호작용에 의해 발생하는 물리적 성질 예측의 높은 정확도를 달성할 수 있는 새로운 그래프 신경망 기법을 개발했다고 18일 밝혔다.
기존 연구에서는 두 분자 쌍이 있을 때, 각 분자내에 존재하는 원자들 사이의 상호 작용만을 고려해 그래프 신경망 모델을 학습하였다. 예를 들어 특정 발색체의 물(H2O)에 대한 용해도를 예측하고자 할 때, 발색체 내의 각 원자들에 대해 물 분자의 원자들 (즉, H, O)이 갖는 영향력을 고려하는 것이다. 연구팀이 이에 반해, 연구팀이 착안한 점은 분자 구조의 화학적 특성을 결정하는 데 있어서 원자뿐만 아니라 작용기(Functional group)와 같은 분자내 하부 구조들이 중요한 역할을 한다는 점이었다. 예를 들어, 알코올이나 예를 들어, 알코올이나 포도당과 같이 하이드록실기 (Hydroxyl group)를 포함하는 분자들은 일반적으로 물에 대한 용해도가 높은 것으로 알려져 있다. 즉, 하이드록실기라는 작용기가 물에 대한 용해도를 결정하는데 중요한 역할을 한다는 것이다.
연구팀은 분자의 특성을 결정하는데 큰 영향을 끼치는 하부 구조를 추론하는 기술을 분자내의 중요한 정보를 최대한 압축하여 보존하는 ‘정보 병목 이론’과, 분자 내의 어떤 하부 구조가 분자의 고유한 특성을 결정 짓는데 큰 역할을 했는지 대한 인과 관계를 추론하는 ‘인과 추론 모형’을 활용하여 개발했다. 이를 통해 분자의 고유한 특성에 가장 큰 영향을 미치는 하부 구조를 찾아내었다. 또한 분자 간 관계를 추론하는 문제에서는 상대방 분자에 따라 대상 분자의 중요한 하부 구조가 달라질 수 있다는 점을 착안하여 물질 간 관계를 예측하는 모델을 제안했다.
이번 새로운 그래프 신경망 기법을 의학에 적용하여 정보 병목 현상을 기반으로 한 연구는 기존 연구에 비해 약물 용해도 예측에서 11%의 성능 향상, 다중약물요법 부작용 예측에서 4%의 정확도 향상을 이뤄냈다. 또한, 인과 추론 모형을 기반으로 한 연구는 약물 용해도 예측에서 17%의 성능 향상, 약물 부작용 예측에서 2%의 정확도 향상을 이뤄냈다.
박찬영 교수팀은 정보 병목 이론을 기반으로 중요한 하부 구조를 탐지해 분자 구조 관계의 높은 예측 정확도를 달성할 수 있는 그래프 신경망 모델을 개발해 기계학습 분야 최고권위 국제학술대회 ‘국제 기계 학습 학회 International Conference on Machine Learning (ICML 2023)’에서 올 7월 발표할 예정이다. (논문명: Conditional Graph Information Bottleneck for Molecular Relational Learning). 또한 인과 추론 모형을 기반으로 중요한 하부 구조를 탐지해 분포 변화에도 모델의 성능이 강건하게 유지되는 그래프 신경망 모델을 개발해 데이터마이닝 최고권위 국제학술 대회 ‘국제 데이터 마이닝 학회 ACM SIGKDD Conference on Knowledge Discovery and Data Mining (KDD 2023)’에서 올 8월에 발표할 예정이다. (논문명: Shift-Robust Molecular Relational Learning with Causal Substructure). 두 연구 모두 KAIST 산업및시스템공학과 대학원에 재학 중인 이남경 박사과정 학생이 제1 저자, 화학연구원의 나경석 연구원이 공동 저자, 우리 대학 산업및시스템공학과의 박찬영 교수가 교신저자로 참여했다.
두 연구의 제1 저자인 이남경 박사과정은 “제안한 기술은 분자의 성질을 결정하는 데 있어 큰 영향을 미치는 하부 구조가 존재한다는 화학적 지식에 기반해 그래프 신경망을 학습할 수 있는 새로운 방법”이라면서 “상대편 분자를 고려해 대상 분자의 중요한 구조를 찾는 방법론은 이미지-텍스트 멀티 모달 학습 방법에서도 적용될 수 있어, 심층 학습 전반적인 성능 개선에 기여할 수 있다”고 밝혔다.
연구팀을 지도한 박찬영 교수도 “제안한 기술은 화학과 생명과학을 포함한 다양한 분야에서 새로운 물질을 발견하는데 널리 사용될 것으로 기대하며, 특히 환경 친화적인 소재 개발, 질병 치료를 위한 신약 발굴 등에 있어서 본 기술의 가치가 더욱 부각될 것으로 보인다”라고 밝혔다.
한편 이번 연구는 정보통신기획평가원의 지원을 받은 사람중심 인공지능 핵심원천기술개발 사업과 한국화학연구원 기본사업 (KK2351-10)의 지원을 받아 수행됐다.
2023.07.18 조회수 9785
약물 부작용 및 용해도 예측 그래프 신경망 기술 개발
최근 화학, 생명과학 등 다양한 기초과학 분야의 문제를 해결하기 위해 그래프 신경망 (Graph Neural Network) 기술이 널리 활용되고 있다. 그 중에서도 특히 두 물질의 상호작용에 의해 발생하는 물리적 성질을 예측하는 것은 다양한 화학, 소재 및 의학 분야에서 각광을 받고 있다. 예를 들어, 어떠한 약물 (Drug)이 용매 (Solvent)에 얼마나 잘 용해되는지 정확히 예측하고, 동시에 여러 가지 약물을 투여하는 다중약물요법 (Polypharmacy)의 부작용을 예측하는 것이 신약 개발 등에 매우 중요하다.
우리 대학 산업및시스템공학과 박찬영 교수 연구팀이 한국화학연구원(원장 이영국)과 공동연구를 통해 물질 내의 중요한 하부 구조(Substructure)를 탐지하여 두 물질의 상호작용에 의해 발생하는 물리적 성질 예측의 높은 정확도를 달성할 수 있는 새로운 그래프 신경망 기법을 개발했다고 18일 밝혔다.
기존 연구에서는 두 분자 쌍이 있을 때, 각 분자내에 존재하는 원자들 사이의 상호 작용만을 고려해 그래프 신경망 모델을 학습하였다. 예를 들어 특정 발색체의 물(H2O)에 대한 용해도를 예측하고자 할 때, 발색체 내의 각 원자들에 대해 물 분자의 원자들 (즉, H, O)이 갖는 영향력을 고려하는 것이다. 연구팀이 이에 반해, 연구팀이 착안한 점은 분자 구조의 화학적 특성을 결정하는 데 있어서 원자뿐만 아니라 작용기(Functional group)와 같은 분자내 하부 구조들이 중요한 역할을 한다는 점이었다. 예를 들어, 알코올이나 예를 들어, 알코올이나 포도당과 같이 하이드록실기 (Hydroxyl group)를 포함하는 분자들은 일반적으로 물에 대한 용해도가 높은 것으로 알려져 있다. 즉, 하이드록실기라는 작용기가 물에 대한 용해도를 결정하는데 중요한 역할을 한다는 것이다.
연구팀은 분자의 특성을 결정하는데 큰 영향을 끼치는 하부 구조를 추론하는 기술을 분자내의 중요한 정보를 최대한 압축하여 보존하는 ‘정보 병목 이론’과, 분자 내의 어떤 하부 구조가 분자의 고유한 특성을 결정 짓는데 큰 역할을 했는지 대한 인과 관계를 추론하는 ‘인과 추론 모형’을 활용하여 개발했다. 이를 통해 분자의 고유한 특성에 가장 큰 영향을 미치는 하부 구조를 찾아내었다. 또한 분자 간 관계를 추론하는 문제에서는 상대방 분자에 따라 대상 분자의 중요한 하부 구조가 달라질 수 있다는 점을 착안하여 물질 간 관계를 예측하는 모델을 제안했다.
이번 새로운 그래프 신경망 기법을 의학에 적용하여 정보 병목 현상을 기반으로 한 연구는 기존 연구에 비해 약물 용해도 예측에서 11%의 성능 향상, 다중약물요법 부작용 예측에서 4%의 정확도 향상을 이뤄냈다. 또한, 인과 추론 모형을 기반으로 한 연구는 약물 용해도 예측에서 17%의 성능 향상, 약물 부작용 예측에서 2%의 정확도 향상을 이뤄냈다.
박찬영 교수팀은 정보 병목 이론을 기반으로 중요한 하부 구조를 탐지해 분자 구조 관계의 높은 예측 정확도를 달성할 수 있는 그래프 신경망 모델을 개발해 기계학습 분야 최고권위 국제학술대회 ‘국제 기계 학습 학회 International Conference on Machine Learning (ICML 2023)’에서 올 7월 발표할 예정이다. (논문명: Conditional Graph Information Bottleneck for Molecular Relational Learning). 또한 인과 추론 모형을 기반으로 중요한 하부 구조를 탐지해 분포 변화에도 모델의 성능이 강건하게 유지되는 그래프 신경망 모델을 개발해 데이터마이닝 최고권위 국제학술 대회 ‘국제 데이터 마이닝 학회 ACM SIGKDD Conference on Knowledge Discovery and Data Mining (KDD 2023)’에서 올 8월에 발표할 예정이다. (논문명: Shift-Robust Molecular Relational Learning with Causal Substructure). 두 연구 모두 KAIST 산업및시스템공학과 대학원에 재학 중인 이남경 박사과정 학생이 제1 저자, 화학연구원의 나경석 연구원이 공동 저자, 우리 대학 산업및시스템공학과의 박찬영 교수가 교신저자로 참여했다.
두 연구의 제1 저자인 이남경 박사과정은 “제안한 기술은 분자의 성질을 결정하는 데 있어 큰 영향을 미치는 하부 구조가 존재한다는 화학적 지식에 기반해 그래프 신경망을 학습할 수 있는 새로운 방법”이라면서 “상대편 분자를 고려해 대상 분자의 중요한 구조를 찾는 방법론은 이미지-텍스트 멀티 모달 학습 방법에서도 적용될 수 있어, 심층 학습 전반적인 성능 개선에 기여할 수 있다”고 밝혔다.
연구팀을 지도한 박찬영 교수도 “제안한 기술은 화학과 생명과학을 포함한 다양한 분야에서 새로운 물질을 발견하는데 널리 사용될 것으로 기대하며, 특히 환경 친화적인 소재 개발, 질병 치료를 위한 신약 발굴 등에 있어서 본 기술의 가치가 더욱 부각될 것으로 보인다”라고 밝혔다.
한편 이번 연구는 정보통신기획평가원의 지원을 받은 사람중심 인공지능 핵심원천기술개발 사업과 한국화학연구원 기본사업 (KK2351-10)의 지원을 받아 수행됐다.
2023.07.18 조회수 9785 -
 인공지능으로 코로나19 치료제 팍스로비드와 기존 약물간 반응 예측 고도화
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 인공지능 기반 약물 상호작용 예측 기술을 고도화해, 코로나19 치료제로 사용되는 팍스로비드(PaxlovidTM) 성분과 기존 승인된 약물 간의 상호작용 분석 결과를 논문으로 발표했다고 16일 밝혔다. 이번 논문은 국제저명학술지인 「미국국립과학원회보 (PNAS)」誌’ 3월 13일자 온라인판에 게재됐다.
※ 논문명 : Computational prediction of interactions between Paxlovid and prescription drugs
※ 저자 정보 : 김예지(한국과학기술원, 공동 제1 저자), 류재용(덕성여자대학교, 공동 제1 저자), 김현욱(한국과학기술원, 공동 제1 저자), 이상엽(한국과학기술원, 교신저자) 포함 총 4명
연구팀은 이번 연구에서 2018년에 개발한 인공지능 기반의 약물 상호작용 예측 모델인 딥디디아이(DeepDDI)를 고도화한 딥디디아이2(DeepDDI2)를 개발했다. 딥디디아이2는 기존 딥디디아이가 예측하는 86가지 약물 상호작용 종류보다 더 많은, 총 113가지의 약물 상호작용 종류를 예측한다.
연구팀은 딥디디아이2를 이용하여 코로나19 치료제인 팍스로비드*의 성분(리토나비르, 니르마트렐비르)과 기존에 승인된 약물 간의 상호작용 가능성을 예측하였다. 연구팀은 코로나19 환자 중 고위험군인 고혈압, 당뇨병 등을 앓고 있는 만성질환자가 이미 약물을 복용하고 있어, 약물 상호작용 및 약물 이상 반응이 충분히 분석되지 않은 팍스로비드를 복용 시 문제가 될 수 있다는 점에 착안해 이번 연구를 수행했다.
* 팍스로비드 : 팍스로비드는 미국 제약사인 화이자가 개발한 코로나19 치료제로, 2021년 12월 미국 식품의약국(FDA)의 긴급사용승인을 받았다.
연구팀은 팍스로비드의 성분인 리토나비르와 니르마트렐비르가 2,248개의 승인된 약물과 어떤 상호작용을 하는지, 딥디디아이2를 이용해 예측했다. 예측 결과 리토나비르는 1,403개의 승인된 약물과, 니르마트렐비르는 673개의 승인된 약물과 상호작용이 있을 것으로 예측됐다.
또한, 연구팀은 예측 결과를 활용해, 약물 상호작용 가능성이 높은 승인 약물에 대해, 동일 기전을 갖되 약물 상호작용 가능성이 낮은 대체 약물들을 제안했다. 이에 따라, 리토나비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 124개와 니르마트렐비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 239개를 제안했다.
이번 연구 성과를 통해 약물 상호작용을 정확하게 예측할 수 있는 인공지능 모델을 활용하는 것이 가능해졌으며, 이는 신약 개발 및 약물 처방 시 유용한 정보를 제공함으로써, 디지털 헬스케어, 정밀의료 산업 및 제약 산업에서 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 "이번 연구 결과는 실험과 임상을 통해 검증된 것은 아니므로 100% 의존해서는 안된다“고 강조하면서 ”팬데믹과 같이 긴급한 상황에서 신속하게 개발된 약물을 사용할 때, 예측된 약물 상호작용 유래 약물 이상 반응결과를 전문의가 미리 검토하여 약을 처방할 때 도움을 줄 수 있다는 점에서 의미가 있다"고 말했다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2023.03.16 조회수 9423
인공지능으로 코로나19 치료제 팍스로비드와 기존 약물간 반응 예측 고도화
우리 대학 생명화학공학과 이상엽 특훈교수 연구팀이 인공지능 기반 약물 상호작용 예측 기술을 고도화해, 코로나19 치료제로 사용되는 팍스로비드(PaxlovidTM) 성분과 기존 승인된 약물 간의 상호작용 분석 결과를 논문으로 발표했다고 16일 밝혔다. 이번 논문은 국제저명학술지인 「미국국립과학원회보 (PNAS)」誌’ 3월 13일자 온라인판에 게재됐다.
※ 논문명 : Computational prediction of interactions between Paxlovid and prescription drugs
※ 저자 정보 : 김예지(한국과학기술원, 공동 제1 저자), 류재용(덕성여자대학교, 공동 제1 저자), 김현욱(한국과학기술원, 공동 제1 저자), 이상엽(한국과학기술원, 교신저자) 포함 총 4명
연구팀은 이번 연구에서 2018년에 개발한 인공지능 기반의 약물 상호작용 예측 모델인 딥디디아이(DeepDDI)를 고도화한 딥디디아이2(DeepDDI2)를 개발했다. 딥디디아이2는 기존 딥디디아이가 예측하는 86가지 약물 상호작용 종류보다 더 많은, 총 113가지의 약물 상호작용 종류를 예측한다.
연구팀은 딥디디아이2를 이용하여 코로나19 치료제인 팍스로비드*의 성분(리토나비르, 니르마트렐비르)과 기존에 승인된 약물 간의 상호작용 가능성을 예측하였다. 연구팀은 코로나19 환자 중 고위험군인 고혈압, 당뇨병 등을 앓고 있는 만성질환자가 이미 약물을 복용하고 있어, 약물 상호작용 및 약물 이상 반응이 충분히 분석되지 않은 팍스로비드를 복용 시 문제가 될 수 있다는 점에 착안해 이번 연구를 수행했다.
* 팍스로비드 : 팍스로비드는 미국 제약사인 화이자가 개발한 코로나19 치료제로, 2021년 12월 미국 식품의약국(FDA)의 긴급사용승인을 받았다.
연구팀은 팍스로비드의 성분인 리토나비르와 니르마트렐비르가 2,248개의 승인된 약물과 어떤 상호작용을 하는지, 딥디디아이2를 이용해 예측했다. 예측 결과 리토나비르는 1,403개의 승인된 약물과, 니르마트렐비르는 673개의 승인된 약물과 상호작용이 있을 것으로 예측됐다.
또한, 연구팀은 예측 결과를 활용해, 약물 상호작용 가능성이 높은 승인 약물에 대해, 동일 기전을 갖되 약물 상호작용 가능성이 낮은 대체 약물들을 제안했다. 이에 따라, 리토나비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 124개와 니르마트렐비르와의 약물 상호작용 가능성을 낮출 수 있는 대체 약물 239개를 제안했다.
이번 연구 성과를 통해 약물 상호작용을 정확하게 예측할 수 있는 인공지능 모델을 활용하는 것이 가능해졌으며, 이는 신약 개발 및 약물 처방 시 유용한 정보를 제공함으로써, 디지털 헬스케어, 정밀의료 산업 및 제약 산업에서 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 "이번 연구 결과는 실험과 임상을 통해 검증된 것은 아니므로 100% 의존해서는 안된다“고 강조하면서 ”팬데믹과 같이 긴급한 상황에서 신속하게 개발된 약물을 사용할 때, 예측된 약물 상호작용 유래 약물 이상 반응결과를 전문의가 미리 검토하여 약을 처방할 때 도움을 줄 수 있다는 점에서 의미가 있다"고 말했다.
한편 이번 연구는 과기정통부가 지원하는 KAIST 코로나대응 과학기술 뉴딜사업과 바이오·의료기술개발사업의 지원을 받아 수행됐다.
2023.03.16 조회수 9423 -
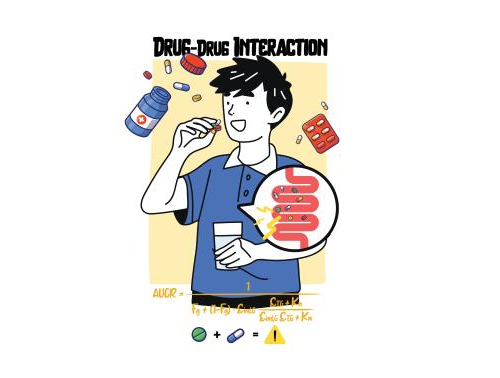 약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09 조회수 10154
약물 상호작용 예측하는 美 FDA 수식, 틀렸다
여러 약물을 동시에 복용하면, 약물간의 상호작용에 의해 약효가 달라질 수 있다. 우리 대학 수리과학과 김재경 교수 연구팀(기초과학연구원 수리 및 계산 과학 연구단 의생명 수학 그룹 CI)은 채정우‧김상겸 충남대약대 교수팀과 공동으로 미국 식품의약국(FDA)이 사용을 권장하는 약물 상호작용 예측 수식이 부정확했던 원인을 규명하고, 정확도를 2배 이상 높인 새로운 수식을 제시했다.
체내 흡수된 약물은 간을 비롯한 여러 장기의 효소에 의해 대사되어 체내에서 사라진다. 두 가지 이상의 약을 함께 복용할 경우, 하나의 약이 다른 약의 대사를 변화시켜 체외 배설을 촉진하거나 억제할 수 있다. 목표로 한 치료 효과를 내지 못하거나 부작용이 발생할 가능성이 있다. 이를 ‘약물 상호작용(DDI)’이라고 한다.
약물 상호작용에 따라 약물의 제거 속도를 정확하게 예측하는 것은 의약품 처방 및 신약 개발에 있어 매우 중요하다. 의료진은 약물을 복합처방할 때 의약품 사용설명서에 명시된 약물 상호작용 정보를 토대로 처방을 내린다. 신약 개발 과정에서도 약물 상호작용을 필수로 연구하여 표시하도록 되어 있다.
FDA는 약물 상호작용을 평가하고, 다약제 복용 과정의 부작용을 최소화하기 위한 가이던스(Guidance‧지침서)를 1997년 처음 발행했다(2020년 1월 개정). 신약 개발과정에서 신약 후보물질과 시판된 모든 약물의 상호작용을 모두 평가하는 것이 현실적으로 불가능하기 때문에 FDA는 가이던스에서 제시한 수식을 활용해 약물 상호작용을 간접적으로 평가하도록 권고하고 있다.
문제는 이 수식의 정확도가 떨어진다는 점이다. FDA가 제시하는 수식은 효소의 반응속도를 설명하는 ‘미카엘레스-멘텐 식’을 기반으로 한다. 이 수식은 약물 대사에 관여하는 체내 효소의 농도가 낮다는 것을 전재로 한다. 연구진은 실제 간에서 약물 대사에 관여하는 효소 농도는 예측에 사용돼온 값보다 1000배 이상 높은 것으로 확인함으로써 기존 FDA 수식이 부정확한 원인을 찾았다.
채정우 충남대약대 교수는 “연구자들은 과학적인 근거가 부족한 인위적인 수를 곱하는 식으로 FDA의 수식을 보정해서 사용해왔다”며 “과거의 과학자들이 당시의 정설이던 천동설을 기반으로 행성의 움직임을 설명하기 위해 복잡한 궤도를 도입했던 것과 유사한 상황”이라고 말했다.
연구진은 수학-약학 협력연구를 통해 약물 상호작용을 설명할 수 있는 새로운 수식을 개발했다. 의심 없이 사용돼 온 기존 식 대신 효소의 농도에 상관없이 정확하게 약물의 대사 속도를 예측할 수 있는 새로운 수식을 유도했다.
이후, 새로 쓰인 수식을 이용해 약물 상호작용을 예측하고, 실제 실험으로 측정된 값과 비교했다. 그 결과, 인위적인 보정 없이도 예측 정확도가 2배 이상 증가한 것으로 확인됐다. 기존 FDA 수식은 약물 상호작용을 2배의 오차범위 내에서 예측한 비율이 38%인데 반해, 수정된 식은 80%에 달했다.
생물학적 제제를 제외한 대부분의 의약품은 FDA 가이던스에 따라 약물의 상호작용을 평가한다. 이 결과는 약효와 부작용에 직결된다. 정확한 수식을 활용한 약물 상호작용 연구 및 약물 처방이 필요한 이유다.
김상겸 충남대약대 교수는 “약물 상호작용 예측 정확도의 개선은 신약개발의 성공률과 임상에서의 약물 효율을 높이는데 기여할 것”이라며 “임상약리학 분야 최고의 저널에 논문을 발표한 만큼, 이번 연구결과에 따라 FDA 가이던스가 수정될 것으로 기대한다”고 말했다.
김재경 교수는 “수학과 약학의 협력 연구 덕분에 당연히 정답이라고 생각했던 수식을 수정하고, 인류의 건강한 삶을 위한 단서를 찾을 수 있었다”며 “미국 FDA 가이던스에 ‘K-수식’이 들어가길 꿈꿔본다”고 말했다.
이번 연구결과는 2022년 12월 15일(한국시간) 임상약리학 분야 권위지인 ‘임상약리학 및 약물치료학(Clinical Pharmacology and Therapeutics, IF 7.051)’ 온라인 판에 실렸다.
※ 논문명: Beyond the Michaelis-Menten: Accurate Prediction of Drug Interactions through Cytochrome P450 3A4 Induction
2023.01.09 조회수 10154 -
 이병주 교수, 게임의 랙 현상 해소 기술 개발
〈 이병주 교수, 이인정 박사과정 〉
우리 대학 문화기술대학원 이병주 교수와 핀란드 알토 대학교(Aalto Univ) 공동 연구팀이 게임의 겉보기 형태를 변화시켜 게임 내 레이턴시 효과, 일명 랙(lag)을 없앨 수 있는 기술을 개발했다.
이인정 박사과정이 1 저자로 참여하고 알토대학교 김선준 연구원이 공동으로 개발한 이번 연구는 지난 5월 4일 열린 인간-컴퓨터 상호작용 분야 최고권위 국제 학술대회 CHI 2019(The ACM CHI Conference on Human Factors in Computing Systems)에서 풀 페이퍼로 발표됐다. (논문명 : Geometrically Compensating Effects of End-to-End Latency in Moving-Target Selection Games)
레이턴시는 장치, 네트워크, 프로세싱 등 다양한 이유로 인해 발생하는 지연(delay) 현상을 말한다. 사용자가 명령을 입력했을 때부터 출력 결과가 모니터 화면에 나타날 때까지 걸리는 지연을 엔드-투-엔드 레이턴시(end-to-end latency)라 한다.
상호작용의 실시간성이 중요한 요소인 게임 환경에서는 이러한 현상이 플레이어의 능력에 부정적 영향을 미치는 것으로 알려져 있다.
연구팀은 레이턴시가 있는 게임 환경에서도 플레이어의 본래 실력으로 게임을 할 수 있도록 돕는 레이턴시 보정 기술을 개발했다. 이 기술은 레이턴시의 양에 따라 게임의 디자인 요소, 즉 장애물의 크기 등의 형태를 변화시킴으로써, 레이턴시가 있음에도 레이턴시가 없는 것처럼 느껴지는 환경에서 플레이할 수 있다.
연구팀은 레이턴시가 플레이어에 미치는 영향을 분석해 플레이어의 행동을 예측하는 수학적 모델을 제시했다. 시간제한이 있는 상황에서 게임 플레이를 위해 버튼 입력을 해야 하는 ‘움직이는 타겟 선택’ 과업에 레이턴시가 있을 때 사용자의 성공률을 예측할 수 있는 인지 모델이다.
이후에는 이 모델을 활용해 게임 환경에 레이턴시가 발생할 경우의 플레이어 과업 성공률을 예측한다. 이를 통해 레이턴시가 없는 환경에서의 플레이어 성공률과 비슷한 수준으로 만들기 위해 게임의 디자인 요소를 변형한다.
연구팀은 ‘플래피 버드(Flappy Bird)’라는 게임에서 기둥의 높이를 변형해 레이턴시가 추가됐음에도 기존 환경에서의 플레이 실력을 유지함을 확인했다. 연구팀은 후속 연구를 통해 게임 속 장애물 등의 크기를 변형함으로써 레이턴시를 없애는 등의 확장 연구를 기대하고 있다.
이 교수는 “이번 기술은 비 간섭적 레이턴시의 보정 기술로, 레이턴시의 양만큼 게임 시계를 되돌려 보상하는 기존의 랙 보상 방법과는 다르게 플레이어의 게임 흐름을 방해하지 않는 장점이 있다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업(프로게이머 역량 극대화를 위한 게임 입력장치의 설계 최적화) 및 KAIST 자체 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 게임의 겉보기 형태를 변화시킴으로써, 플레이어가 제로 레이턴시 환경과 레이턴시가 있는 환경에서 같은 실력을 유지
2019.07.02 조회수 21800
이병주 교수, 게임의 랙 현상 해소 기술 개발
〈 이병주 교수, 이인정 박사과정 〉
우리 대학 문화기술대학원 이병주 교수와 핀란드 알토 대학교(Aalto Univ) 공동 연구팀이 게임의 겉보기 형태를 변화시켜 게임 내 레이턴시 효과, 일명 랙(lag)을 없앨 수 있는 기술을 개발했다.
이인정 박사과정이 1 저자로 참여하고 알토대학교 김선준 연구원이 공동으로 개발한 이번 연구는 지난 5월 4일 열린 인간-컴퓨터 상호작용 분야 최고권위 국제 학술대회 CHI 2019(The ACM CHI Conference on Human Factors in Computing Systems)에서 풀 페이퍼로 발표됐다. (논문명 : Geometrically Compensating Effects of End-to-End Latency in Moving-Target Selection Games)
레이턴시는 장치, 네트워크, 프로세싱 등 다양한 이유로 인해 발생하는 지연(delay) 현상을 말한다. 사용자가 명령을 입력했을 때부터 출력 결과가 모니터 화면에 나타날 때까지 걸리는 지연을 엔드-투-엔드 레이턴시(end-to-end latency)라 한다.
상호작용의 실시간성이 중요한 요소인 게임 환경에서는 이러한 현상이 플레이어의 능력에 부정적 영향을 미치는 것으로 알려져 있다.
연구팀은 레이턴시가 있는 게임 환경에서도 플레이어의 본래 실력으로 게임을 할 수 있도록 돕는 레이턴시 보정 기술을 개발했다. 이 기술은 레이턴시의 양에 따라 게임의 디자인 요소, 즉 장애물의 크기 등의 형태를 변화시킴으로써, 레이턴시가 있음에도 레이턴시가 없는 것처럼 느껴지는 환경에서 플레이할 수 있다.
연구팀은 레이턴시가 플레이어에 미치는 영향을 분석해 플레이어의 행동을 예측하는 수학적 모델을 제시했다. 시간제한이 있는 상황에서 게임 플레이를 위해 버튼 입력을 해야 하는 ‘움직이는 타겟 선택’ 과업에 레이턴시가 있을 때 사용자의 성공률을 예측할 수 있는 인지 모델이다.
이후에는 이 모델을 활용해 게임 환경에 레이턴시가 발생할 경우의 플레이어 과업 성공률을 예측한다. 이를 통해 레이턴시가 없는 환경에서의 플레이어 성공률과 비슷한 수준으로 만들기 위해 게임의 디자인 요소를 변형한다.
연구팀은 ‘플래피 버드(Flappy Bird)’라는 게임에서 기둥의 높이를 변형해 레이턴시가 추가됐음에도 기존 환경에서의 플레이 실력을 유지함을 확인했다. 연구팀은 후속 연구를 통해 게임 속 장애물 등의 크기를 변형함으로써 레이턴시를 없애는 등의 확장 연구를 기대하고 있다.
이 교수는 “이번 기술은 비 간섭적 레이턴시의 보정 기술로, 레이턴시의 양만큼 게임 시계를 되돌려 보상하는 기존의 랙 보상 방법과는 다르게 플레이어의 게임 흐름을 방해하지 않는 장점이 있다”라고 말했다.
이번 연구는 한국연구재단 신진연구자지원사업(프로게이머 역량 극대화를 위한 게임 입력장치의 설계 최적화) 및 KAIST 자체 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 게임의 겉보기 형태를 변화시킴으로써, 플레이어가 제로 레이턴시 환경과 레이턴시가 있는 환경에서 같은 실력을 유지
2019.07.02 조회수 21800 -
 김학성 교수, 세포 내 단백질 전달 효율 높이는 DNA 기반 나노구조체 개발
우리 대학 생명과학과 김학성 교수, 류이슬 박사 연구팀이 강원대 이중재 교수, 한국원자력연구원 강정애 박사와의 공동 연구를 통해 DNA를 기반으로 나노 구조체를 개발해 세포 속으로의 단백질 전달 효율을 높이는 기술을 개발했다.
이번 연구 결과는 국제 학술지 ‘스몰(Small)’에 2018년 12월 28일일자 표지논문으로 게재됐다.
단백질 치료제는 저분자 화합물에 비해 반응 부위를 구별해내는 특이성이 우수해 차세대 의약품으로 활발히 개발되고 있다. 단백질 치료제가 탁월한 효과를 내기 위해서는 치료용 단백질이 세포 내로 효율적으로 전달되는 기술이 선행돼야 한다.
지금까지는 화학적 합성법 등으로 단백질 전달체를 제작해 왔지만 생체 독성, 낮은 전달 효율, 복잡한 제조공정과 효과가 일관적이지 않은 재현성 등이 해결돼야 할 과제로 남아있다.
연구팀은 생체 분자인 DNA를 기반으로 나노 구조체를 제작해 생체 친화적이면서 특정 세포로의 높은 전달 효율을 보였다. 특히 다양한 단백질을 전달할 수 있는 범용적인 기술로서 폐암 동물 모델에서도 항암 물질을 전달해 높은 항암 효과를 입증했다.
제조공정도 복잡하지 않다. 먼저 금 나노입자 표면에 DNA를 부착한다. 다음으로 징크 핑거를 이용해 각 DNA 가닥에 암세포를 표적하는 생체 분자와 항암 단백질을 결합해 제작했다.
DNA와 징크 핑거 간의 상호작용을 이용하므로 DNA 서열과 길이를 조절해 나노 구조체에 탑재되는 단백질의 양을 손쉽게 조절할 수 있다.
김학성 교수는 “생체 적합한 소재인 DNA와 단백질의 상호작용을 이용해 세포 내로 단백질을 효율적으로 전달하는 새로운 나노 구조체를 개발한 것이다”라며, “세포 내 단백질 치료제의 전달뿐 아니라 동반 진단용으로 광범위하게 활용될 것으로 기대된다”라고 말했다.
이번 연구 성과는 과학기술정보통신부‧한국연구재단 기초연구사업(글로벌연구실, 중견연구, 생애첫연구) 지원으로 수행됐다.
□ 그림 설명
그림1. small 표지
그림2. 나노 구조체 제조 과정 모식도
그림3. 나노 구조체의 세포 내 단백질 전달 효과
그림4. 나노 구조체의 현미경 관찰 사진
2019.01.21 조회수 15007
김학성 교수, 세포 내 단백질 전달 효율 높이는 DNA 기반 나노구조체 개발
우리 대학 생명과학과 김학성 교수, 류이슬 박사 연구팀이 강원대 이중재 교수, 한국원자력연구원 강정애 박사와의 공동 연구를 통해 DNA를 기반으로 나노 구조체를 개발해 세포 속으로의 단백질 전달 효율을 높이는 기술을 개발했다.
이번 연구 결과는 국제 학술지 ‘스몰(Small)’에 2018년 12월 28일일자 표지논문으로 게재됐다.
단백질 치료제는 저분자 화합물에 비해 반응 부위를 구별해내는 특이성이 우수해 차세대 의약품으로 활발히 개발되고 있다. 단백질 치료제가 탁월한 효과를 내기 위해서는 치료용 단백질이 세포 내로 효율적으로 전달되는 기술이 선행돼야 한다.
지금까지는 화학적 합성법 등으로 단백질 전달체를 제작해 왔지만 생체 독성, 낮은 전달 효율, 복잡한 제조공정과 효과가 일관적이지 않은 재현성 등이 해결돼야 할 과제로 남아있다.
연구팀은 생체 분자인 DNA를 기반으로 나노 구조체를 제작해 생체 친화적이면서 특정 세포로의 높은 전달 효율을 보였다. 특히 다양한 단백질을 전달할 수 있는 범용적인 기술로서 폐암 동물 모델에서도 항암 물질을 전달해 높은 항암 효과를 입증했다.
제조공정도 복잡하지 않다. 먼저 금 나노입자 표면에 DNA를 부착한다. 다음으로 징크 핑거를 이용해 각 DNA 가닥에 암세포를 표적하는 생체 분자와 항암 단백질을 결합해 제작했다.
DNA와 징크 핑거 간의 상호작용을 이용하므로 DNA 서열과 길이를 조절해 나노 구조체에 탑재되는 단백질의 양을 손쉽게 조절할 수 있다.
김학성 교수는 “생체 적합한 소재인 DNA와 단백질의 상호작용을 이용해 세포 내로 단백질을 효율적으로 전달하는 새로운 나노 구조체를 개발한 것이다”라며, “세포 내 단백질 치료제의 전달뿐 아니라 동반 진단용으로 광범위하게 활용될 것으로 기대된다”라고 말했다.
이번 연구 성과는 과학기술정보통신부‧한국연구재단 기초연구사업(글로벌연구실, 중견연구, 생애첫연구) 지원으로 수행됐다.
□ 그림 설명
그림1. small 표지
그림2. 나노 구조체 제조 과정 모식도
그림3. 나노 구조체의 세포 내 단백질 전달 효과
그림4. 나노 구조체의 현미경 관찰 사진
2019.01.21 조회수 15007 -
 조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14 조회수 20680
조광현 교수, 뇌파 생성, 변조 담당하는 신경회로 원리 규명
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 뇌파의 생성 및 변조를 담당하는 핵심 신경회로를 규명하는 데 성공했다.
이를 통해 뇌의 동작원리를 밝힐 뿐 아니라 향후 여러 뇌질환 환자에게서 발생하는 비정상적 뇌파활동을 신경세포 네트워크 수준에서 규명하는 데 활용 가능할 것으로 기대된다. 이번 연구는 4차 산업혁명의 핵심기술로 주목받는 IT와 BT의 융합연구인 시스템생물학 연구로 규명했다는 의미를 갖는다.
이병욱 박사과정, 신동관 박사, 스티븐 그로스 박사가 함께 참여한 이번 연구는 국제 학술지 ‘셀 리포트(Cell Reports)’ 11월 6일자 온라인 판에 게재됐다.
뇌의 다양한 기능은 신경세포(뉴런) 사이의 복잡한 상호작용을 통해 이뤄진다. 특히 뉴런들의 동시다발적인 발화에 의해 형성되는 뇌파는 뇌의 활동 상태를 측정하는 가장 중요한 지표이며, 특정 기능을 수행하기 위해 영역 간 선택적 통신의 매개체 역할을 하는 것으로 알려져 있다.
또한 뇌파의 비정상적인 생성 및 변조 현상은 다양한 뇌질환과 밀접한 관계를 갖는 것으로 밝혀지고 있다. 이에 따라 전 세계 신경생물학 연구자들은 뇌파의 생성 및 변조 원리를 파악하기 위해 노력해 왔다.
그러나 뇌파의 생성 및 변조는 수많은 뉴런 사이의 복잡한 상호작용을 통해 발생하는 예측할 수 없는 창발적 특성(emergent property)을 갖기 때문에 기존의 신경 생물학 실험을 통해 그 원리를 규명하기에는 한계가 있었다.
조 교수 연구팀은 시스템생물학 기반의 연구방법을 통해 뇌파의 생성 및 변조 원리를 분석했다. 연구팀은 여러 뇌 영역 중 특히 감각 피질(sensory cortex)에 주목했다. 감각 피질은 외부 감각 정보를 처리하고 통합, 조절하는 핵심 영역으로 여러 주파수 대역의 뇌파와 변조를 관측할 수 있다.
연구팀은 최근 커넥토믹스 (connectomics) 연구를 통해 밝혀진 쥐의 감각피질 내 뉴런의 종류 및 뉴런 간 연결성 정보를 이용해 감각피질을 구성하는 뉴런들과 이들을 연결하는 시냅스를 수학 모델을 통해 표현하고 이로부터 신경회로를 구축해 뇌파의 생성 및 변조 과정을 분석했다.
연구팀은 대규모 컴퓨터 시뮬레이션 분석을 통해 흥분성 뉴런과 억제성 뉴런으로 구성된 양성피드백과 음성피드백의 중첩된 구조(interlinked positive and negative feedback)가 뇌파의 생성 및 주파수 변조 현상의 핵심회로임을 최초로 규명했다.
특히 연구팀은 기존의 전기생리학 실험을 통해 측정된 뉴런 간 시냅스의 특정 연결강도가 신경회로의 뇌파 생성 및 변조 기능을 극대화시킬 수 있는 최적의 조합임을 밝혀냈다.
이번에 개발한 수학모형을 활용하면 전통적 생물학 실험을 통해 파악이 어려웠던 뉴런들 간의 다양한 상호작용을 이해하고 신경회로의 복잡한 설계원리를 파악할 수 있을 것으로 기대된다.
또한 여러 뇌질환 환자의 뇌에서 관측되는 비정상적인 뇌파 활동을 신경네트워크 차원에서 분석하고 규명할 수 있을 것으로 예상된다.
시스템생물학 접근을 통한 신경회로의 구조 및 기능 분석은 인공지능의 발전에도 기여할 것으로 기대된다. 두뇌 신경회로의 작동원리에 대한 이해를 높인다면 컴퓨터 과학자들이 이를 이용해 새로운 인공지능 기술을 개발할 수 있다. 자폐증이나 집중력 조절장애 등과 관련된 신경회로 규명, 두뇌 치료 기술 개발 등의 원천 의료기술 개발에도 혁신으로 이어질 수 있다.
조 교수는 “지금껏 뇌파의 생성 및 변조를 담당하는 핵심 신경회로가 밝혀진 바가 없었다”며 “이번 연구에서는 최근 커넥토믹스 (connectomcis) 연구를 통해 점차 밝혀지고 있는 뉴런간의 복잡한 연결성에 숨겨진 설계원리를 시스템생물학 연구를 통해 찾아냄으로써 뇌의 동작원리를 파악할 수 있는 새로운 가능성을 제시했다”고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업, 그리고 삼성전자 미래기술육성센터의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 뉴런 간 연결 강도에 내제된 기능적 설계원리 파악
그림2. 뇌파의 생성 및 변조를 담당하는 핵심 신경회로
2018.11.14 조회수 20680 -
 이상엽, 김현욱 교수, 약물 상호작용 예측기술 DeepDDI 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수 공동 연구팀이 약물-약물 및 약물-음식 간 상호작용을 정확하게 예측하기 위해 딥 러닝(deep learning)을 이용해 약물 상호작용 예측 방법론인 딥디디아이 (DeepDDI)를 개발했다.
김현욱 교수, 류재용 연구원이 공동 1저자로 참여한 이번 연구는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 4월 16일자 온라인판에 게재됐다.
기존의 약물 상호작용 예측 방법론은 약물-약물 간의 상호작용 가능성만을 예측할 뿐, 두 약물 간의 구체적인 약리작용에 대한 정보는 제공하지 못했다. 이러한 이유로 맞춤형 약물 처방, 식이요법 등 응용 연구에서 체계적인 근거를 제시하거나 가설을 세우는 데에 한계가 있었다.
연구팀은 딥 러닝(deep learning) 기술을 적용해 19만 2천 284개의 약물-약물 상호작용을 아우르는 86가지의 약물 상호작용을 92.4%의 정확도로 예측하는 시스템 딥디디아이 (DeepDDI)를 개발했다.
딥디디아이는 두 약물 A, B 간의 상호작용에 대한 예측 결과를 다음과 같이 사람이 읽을 수 있는 영문 문장으로 출력한다 : “The metabolism of Drug B can be decreased when combined with Drug A (약물 A를 약물 B와 함께 복용 시 약물 B의 약물 대사가 감소 될 수 있다)”
연구팀은 딥디디아이를 이용해 두 약물 복용 시 일어날 수 있는 유해반응의 원인, 보고된 인체 부작용을 최소화시킬 수 있는 대체 약물, 특정 약물의 약효를 떨어뜨릴 수 있는 음식 및 음식 성분, 지금껏 알려지지 않은 음식 성분의 활성 등을 예측했다.
이번 연구성과로 약물-약물 및 약물-음식 상호작용을 정확하게 예측할 수 있는 시스템을 활용하는 것이 가능해졌으며 이는 신약개발, 복합적 약의 처방, 투약시의 음식조절 등을 포함해 헬스케어, 정밀의료 산업 및 제약 산업에 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 “이번 연구결과는 4차 산업혁명 시대의 정밀의료를 선도할 수 있는 기반 기술을 개발한 것이다”며, “복합 투여되는 약물들의 부작용을 낮추고 환자 맞춤형 약물 처방과 식이요법 제안을 통한 효과적인 약물치료 전략을 수립할 수 있다. 특히 고령화 사회에서 건강한 삶을 유지하는데 필요한 약-음식 궁합에 대한 제안을 해 줄 수 있는 시스템으로 발전해 나갈 것이다”고 말했다.
이 연구성과는 과학기술정보통신부의 바이오리파이너리를 위한 시스템대사공학 연구사업, KAIST의 4차 산업혁명 인공지능 플래그십 이니셔티브 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 딥디디아이 (DeepDDI)의 모식도 및 예측된다양한 약물-음식성분의 상호작용들의 시각화
2018.04.18 조회수 21267
이상엽, 김현욱 교수, 약물 상호작용 예측기술 DeepDDI 개발
우리 대학 생명화학공학과 이상엽 특훈교수와 김현욱 교수 공동 연구팀이 약물-약물 및 약물-음식 간 상호작용을 정확하게 예측하기 위해 딥 러닝(deep learning)을 이용해 약물 상호작용 예측 방법론인 딥디디아이 (DeepDDI)를 개발했다.
김현욱 교수, 류재용 연구원이 공동 1저자로 참여한 이번 연구는 국제학술지 ‘미국 국립과학원 회보(PNAS)’ 4월 16일자 온라인판에 게재됐다.
기존의 약물 상호작용 예측 방법론은 약물-약물 간의 상호작용 가능성만을 예측할 뿐, 두 약물 간의 구체적인 약리작용에 대한 정보는 제공하지 못했다. 이러한 이유로 맞춤형 약물 처방, 식이요법 등 응용 연구에서 체계적인 근거를 제시하거나 가설을 세우는 데에 한계가 있었다.
연구팀은 딥 러닝(deep learning) 기술을 적용해 19만 2천 284개의 약물-약물 상호작용을 아우르는 86가지의 약물 상호작용을 92.4%의 정확도로 예측하는 시스템 딥디디아이 (DeepDDI)를 개발했다.
딥디디아이는 두 약물 A, B 간의 상호작용에 대한 예측 결과를 다음과 같이 사람이 읽을 수 있는 영문 문장으로 출력한다 : “The metabolism of Drug B can be decreased when combined with Drug A (약물 A를 약물 B와 함께 복용 시 약물 B의 약물 대사가 감소 될 수 있다)”
연구팀은 딥디디아이를 이용해 두 약물 복용 시 일어날 수 있는 유해반응의 원인, 보고된 인체 부작용을 최소화시킬 수 있는 대체 약물, 특정 약물의 약효를 떨어뜨릴 수 있는 음식 및 음식 성분, 지금껏 알려지지 않은 음식 성분의 활성 등을 예측했다.
이번 연구성과로 약물-약물 및 약물-음식 상호작용을 정확하게 예측할 수 있는 시스템을 활용하는 것이 가능해졌으며 이는 신약개발, 복합적 약의 처방, 투약시의 음식조절 등을 포함해 헬스케어, 정밀의료 산업 및 제약 산업에 중요한 역할을 할 것으로 기대된다.
이상엽 특훈교수는 “이번 연구결과는 4차 산업혁명 시대의 정밀의료를 선도할 수 있는 기반 기술을 개발한 것이다”며, “복합 투여되는 약물들의 부작용을 낮추고 환자 맞춤형 약물 처방과 식이요법 제안을 통한 효과적인 약물치료 전략을 수립할 수 있다. 특히 고령화 사회에서 건강한 삶을 유지하는데 필요한 약-음식 궁합에 대한 제안을 해 줄 수 있는 시스템으로 발전해 나갈 것이다”고 말했다.
이 연구성과는 과학기술정보통신부의 바이오리파이너리를 위한 시스템대사공학 연구사업, KAIST의 4차 산업혁명 인공지능 플래그십 이니셔티브 연구사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 딥디디아이 (DeepDDI)의 모식도 및 예측된다양한 약물-음식성분의 상호작용들의 시각화
2018.04.18 조회수 21267 -
 이의진 교수, 스마트폰으로 문서 촬영 시 발생하는 회전 오류 문제 해결
〈 이의진 교수(좌)와 오정민 박사과정(우) 〉
우리 대학 산업및시스템공학과 이의진 교수 연구팀이 스마트폰 카메라로 문서를 촬영할 때 자동으로 발생하는 불규칙적인 회전 오류 현상의 원인을 밝히고 해결책을 개발했다.
연구팀은 스마트폰의 방위 추적 알고리즘의 한계가 회전 오류의 원인임을 규명했다.
이번 연구 결과는 인간-컴퓨터 상호작용 학회의 국제 학술지인 ‘인터내셔널 저널 오브 휴먼 컴퓨터 스터디(International Journal of Human-Computer Studies)’ 4월 4일자 온라인 판에 게재됐고 8월호 저널에 게재될 예정이다.
스마트폰을 통해 책자, 문서 등을 촬영해 업무에 활용하는 것은 자연스러운 일상이 됐다. 하지만 촬영한 문서가 자동으로 90도 회전하는 현상으로 인해 불편을 겪는 사람들이 많다.
특히 여러 장의 사진을 찍었을 때 각기 다른 방향으로 회전돼 일일이 스마트폰을 돌리거나 파일을 편집해야 하는 현상이 발생한다.
스마트폰으로 문서를 촬영할 때는 대부분 스마트폰과 책상 위 문서가 평행 상태이다.
이 때 스마트폰을 회전시키면 스마트폰의 방위 추적 알고리즘이 작동하지 않는다. 방위 추적 알고리즘은 기본적으로 사용자가 스마트폰을 세워서 사용한다는 가정 하에 한 방향으로 가해지는 중력가속도를 측정해 현재 방위를 추정하는 방식으로 설계됐기 때문이다.
연구팀은 실험을 통해 오류 발생 수치를 측정했다. 실험 결과 문서를 가로로 촬영 시 방위 추적 오류가 93%의 높은 확률로 발생함을 확인했다.
일반 사용자는 오류의 원인을 파악하기 어렵다. 대부분의 카메라 앱은 셔터 버튼에 있는 카메라 모양의 아이콘 방향을 통해 실시간 방위를 표시하고 있지만 이러한 기능에 대해서도 사용자들은 인지하지 못한 것으로 파악됐다.
연구팀은 스마트폰의 모션센서 데이터를 활용해 문서 촬영 중에 방위를 정확하게 추적해 문제를 해결했다.
모션센서 데이터의 핵심 기술은 두 가지로 구분할 수 있다. 일반적으로 스마트폰으로 문서를 촬영할 때는 스마트폰이 지면과 평행을 이루기 때문에 스마트폰에 장착된 중력 가속도 센서를 관측해 이러한 문서 촬영 의도를 쉽게 알 수 있다.
두 번째로 문서 촬영 중에 발생하는 스마트폰 회전은 회전 각속도를 측정하는 센서를 활용해 추적할 수 있다. 카메라 앱 실행 후에 문서 촬영을 위해 스마트폰을 회전시키기 때문에 이를 측정해 회전각이 일정 임계치를 넘으면 방위를 변경하는 것으로 파악할 수 있고 이를 통해 방향을 알 수 있는 것이다.
또한 연구팀은 문서 촬영 시 촬영자 쪽으로 스마트폰이 미세하게 기울어지는 마이크로 틸트(micro-tilt) 현상을 발견했다.
이 현상으로 인해 스마트폰으로 가해지는 중력가속도가 스마트폰 측면으로 분산된다. 눈에는 잘 보이지 않을 정도로 작은 기울기지만 모션센서 데이터를 활용해 마이크로 틸트 행동 패턴의 기계학습 알고리즘을 훈련시킬 수 있다. 이를 통해 정확한 방위 추적이 가능하다.
연구 팀의 실험 결과에 따르면 모션센서 데이터를 활용한 방위 추적 방식의 정확도는 93%로 매우 높아 안드로이드 및 iOS등 상용 스마트폰에도 적용 가능하다.
이 기술들은 기존 방위 추적 알고리즘의 사각지대였던 수평 촬영 상황에서 작동하기 때문에 기존 방위 추적 알고리즘과 겹치는 부분 없이 상호 보완적으로 작동할 수 있다.
이 교수는 “스마트폰을 활용한 문서 촬영은 필수가 됐지만 회전 오류의 원인 규명과 해결책이 어려워 불편함이 많았다”며 “모션센서 데이터를 통해 촬영의 의도를 파악하고 자동으로 오류를 바로잡는 기술은 사용자의 불편을 해결하고 문서 촬영에 특화된 다양한 응용서비스 개발의 기초가 될 것이다”고 말했다.
미래창조과학부의 지원을 통해 수행된 이번 기술 중 국내 특허 2건이 등록이 완료됐고 미국 특허가 3월 1일에 수락됐다.
□ 그림 설명
그림1. 방위 오류 발생으로 인해 생기는 불편함
그림2. 평면촬영시 발생하는 방위 오류 상태
그림3. 자이로스코프를 활용한 스마트폰 회전 추적 모식도
그림4. 마이크로틸트현상
2017.06.27 조회수 16866
이의진 교수, 스마트폰으로 문서 촬영 시 발생하는 회전 오류 문제 해결
〈 이의진 교수(좌)와 오정민 박사과정(우) 〉
우리 대학 산업및시스템공학과 이의진 교수 연구팀이 스마트폰 카메라로 문서를 촬영할 때 자동으로 발생하는 불규칙적인 회전 오류 현상의 원인을 밝히고 해결책을 개발했다.
연구팀은 스마트폰의 방위 추적 알고리즘의 한계가 회전 오류의 원인임을 규명했다.
이번 연구 결과는 인간-컴퓨터 상호작용 학회의 국제 학술지인 ‘인터내셔널 저널 오브 휴먼 컴퓨터 스터디(International Journal of Human-Computer Studies)’ 4월 4일자 온라인 판에 게재됐고 8월호 저널에 게재될 예정이다.
스마트폰을 통해 책자, 문서 등을 촬영해 업무에 활용하는 것은 자연스러운 일상이 됐다. 하지만 촬영한 문서가 자동으로 90도 회전하는 현상으로 인해 불편을 겪는 사람들이 많다.
특히 여러 장의 사진을 찍었을 때 각기 다른 방향으로 회전돼 일일이 스마트폰을 돌리거나 파일을 편집해야 하는 현상이 발생한다.
스마트폰으로 문서를 촬영할 때는 대부분 스마트폰과 책상 위 문서가 평행 상태이다.
이 때 스마트폰을 회전시키면 스마트폰의 방위 추적 알고리즘이 작동하지 않는다. 방위 추적 알고리즘은 기본적으로 사용자가 스마트폰을 세워서 사용한다는 가정 하에 한 방향으로 가해지는 중력가속도를 측정해 현재 방위를 추정하는 방식으로 설계됐기 때문이다.
연구팀은 실험을 통해 오류 발생 수치를 측정했다. 실험 결과 문서를 가로로 촬영 시 방위 추적 오류가 93%의 높은 확률로 발생함을 확인했다.
일반 사용자는 오류의 원인을 파악하기 어렵다. 대부분의 카메라 앱은 셔터 버튼에 있는 카메라 모양의 아이콘 방향을 통해 실시간 방위를 표시하고 있지만 이러한 기능에 대해서도 사용자들은 인지하지 못한 것으로 파악됐다.
연구팀은 스마트폰의 모션센서 데이터를 활용해 문서 촬영 중에 방위를 정확하게 추적해 문제를 해결했다.
모션센서 데이터의 핵심 기술은 두 가지로 구분할 수 있다. 일반적으로 스마트폰으로 문서를 촬영할 때는 스마트폰이 지면과 평행을 이루기 때문에 스마트폰에 장착된 중력 가속도 센서를 관측해 이러한 문서 촬영 의도를 쉽게 알 수 있다.
두 번째로 문서 촬영 중에 발생하는 스마트폰 회전은 회전 각속도를 측정하는 센서를 활용해 추적할 수 있다. 카메라 앱 실행 후에 문서 촬영을 위해 스마트폰을 회전시키기 때문에 이를 측정해 회전각이 일정 임계치를 넘으면 방위를 변경하는 것으로 파악할 수 있고 이를 통해 방향을 알 수 있는 것이다.
또한 연구팀은 문서 촬영 시 촬영자 쪽으로 스마트폰이 미세하게 기울어지는 마이크로 틸트(micro-tilt) 현상을 발견했다.
이 현상으로 인해 스마트폰으로 가해지는 중력가속도가 스마트폰 측면으로 분산된다. 눈에는 잘 보이지 않을 정도로 작은 기울기지만 모션센서 데이터를 활용해 마이크로 틸트 행동 패턴의 기계학습 알고리즘을 훈련시킬 수 있다. 이를 통해 정확한 방위 추적이 가능하다.
연구 팀의 실험 결과에 따르면 모션센서 데이터를 활용한 방위 추적 방식의 정확도는 93%로 매우 높아 안드로이드 및 iOS등 상용 스마트폰에도 적용 가능하다.
이 기술들은 기존 방위 추적 알고리즘의 사각지대였던 수평 촬영 상황에서 작동하기 때문에 기존 방위 추적 알고리즘과 겹치는 부분 없이 상호 보완적으로 작동할 수 있다.
이 교수는 “스마트폰을 활용한 문서 촬영은 필수가 됐지만 회전 오류의 원인 규명과 해결책이 어려워 불편함이 많았다”며 “모션센서 데이터를 통해 촬영의 의도를 파악하고 자동으로 오류를 바로잡는 기술은 사용자의 불편을 해결하고 문서 촬영에 특화된 다양한 응용서비스 개발의 기초가 될 것이다”고 말했다.
미래창조과학부의 지원을 통해 수행된 이번 기술 중 국내 특허 2건이 등록이 완료됐고 미국 특허가 3월 1일에 수락됐다.
□ 그림 설명
그림1. 방위 오류 발생으로 인해 생기는 불편함
그림2. 평면촬영시 발생하는 방위 오류 상태
그림3. 자이로스코프를 활용한 스마트폰 회전 추적 모식도
그림4. 마이크로틸트현상
2017.06.27 조회수 16866