%EC%83%9D%ED%99%94%ED%95%99
-
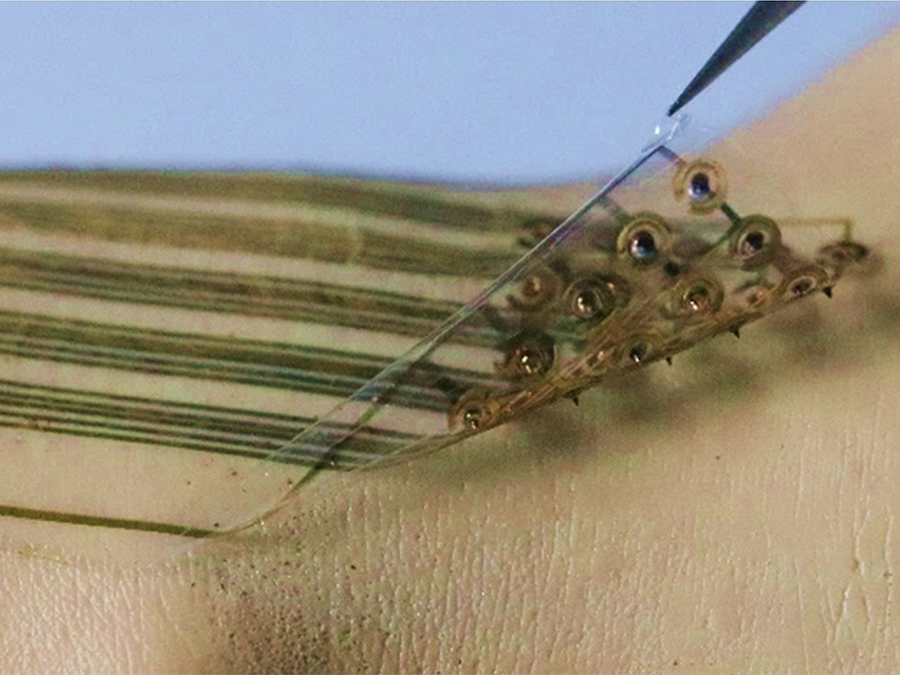 부드러운 웨어러블 마이크로니들 센서 플랫폼 기술 개발
우리 대학 웨어러블 플랫폼소재 기술센터 배병수 교수(교신저자)가 KIST 이원령 박사(제1 저자, 교신저자), 서울대학교병원 정승환 박사 (공동 제1 저자)와 공동으로 유연한 기판상에 기계적으로 안정적인 마이크로니들이 접합돼 말초동맥질환 진단에 응용할 수 있는 메디컬 센서 플랫폼 기술을 개발했다고 1일 밝혔다.
연구팀은 이번 기술을 통해 일반적인 웨어러블 진단 기기의 한계점이던 바이오 체액의 접근 제한성을 마이크로니들을 이용해 최소 침습으로 해결했고, 이는 생화학적 질병 진단을 가능하게 했다. 이번 연구에서는 웨어러블 마이크로니들 센서를 활용해 말초동맥질환 모델의 pH(산성, 알칼리성의 정도) 분포도를 측정해 진단 가능성을 확인했다.
이번 연구 결과는 국제학술지 `사이언스 어드밴시스(Science Advances)'에 온라인으로 출시됐다. (논문명: Conformable Microneedle pH Sensors via the Integration of two Different Siloxane Polymers for Mapping Peripheral Artery Disease)
웨어러블 진단 기기는 부드러운 기판 소재 위에 얇은 막 형태의 센서를 제작해 생체 전기신호(심전도, 근전도, 뇌파 등)와 생화학 신호(포도당, 젖산, pH 등)를 측정해 심장질환, 뇌 질환, 당뇨병, 대사질환 등 다양한 질병의 진단에 활용이 기대되어 의료기기용 소자로서 주목을 받고 있다. 하지만, 접근할 수 있는 체액이 땀, 눈물 등으로 제한됨에 따라 상시 모니터링에 대한 제한점이 있었다.
연구팀은 이를 해결하기 위해 자체적으로 개발한 솔-젤(Sol-Gel) 합성공정을 통해 만들어진 실록산(Si-O-Si)골조 기반의 폴리머를 마이크로니들 소재로 활용해 웨어러블 디바이스 플랫폼에 적용하고, 마이크로니들을 통해 상시 체액 모니터링이 가능한 웨어러블 마이크로니들 생화학 센싱 플랫폼을 완성했다.
연구팀은 웨어러블 마이크로니들 생화학센싱 플랫폼의 유용성을 보여주기 위해 마이크로니들에 pH에 대해 표면에너지의 변화를 보이는 폴리어날린 을 증착해 독립적인 pH 센서 어레이로 응용 가능한 것을 보였다. 폴리어날린을 이용한 마이크로니들 pH 센서는, 돼지 피부 1000번 삽입 실험, 1.5 mm의 굽힘 변형 실험 후에도 80% 이상의 센서 감도를 유지하는 높은 기계적 안정성을 보여주었다.
연구팀은 웨어러블 마이크로니들 pH 센서를 활용해, 말초동맥질환 모델의 피부 근접 체액의 pH 분포도를 측정해 질병 진단기기로서의 유용성을 검증했다. 경증 또는 만성 말초동맥질환이 있는 환자 대부분은 질병의 발생이나 진행을 인지할 수 있는 임상 증상을 나타내지 않는다. 그러나 pH 변화를 모니터링하면 저산소증으로 인한 젖산증을 감지할 수 있고, 결과적으로 허혈성 손상으로 인한 조직 손상을 적절히 감지할 수 있다.
연구팀은 우측 다리로 이어지는 고관절에 위치한 동맥혈을 수술용 실로 조인 다음 혈류를 인공적으로 악화시켜 말초동맥질환 모델을 만들었다. 이후 마이크로니들을 통해 피하 체액의 pH를 측정한 결과 말단으로 갈수록, 산성화된 결과를 보여줌으로써, 웨어러블 마이크로니들 센서의 활용성을 증명했다.
연구를 주도한 배병수 교수는“딱딱한 마이크로니들을 부드러운 유연한 기재에 접합시킨 질병 진단 마이크로 니들 필름을 피부에 부착해서 말초동맥질환은 물론 당뇨병, 대사질환 등에 생화학 진단을 하는 웨어러블 디바이스로 활용될 수 있을 것으로 기대된다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 선도연구센터 웨어러블 플랫폼 소재 기술센터의 지원을 받아 수행됐다.
2021.12.03 조회수 12843
부드러운 웨어러블 마이크로니들 센서 플랫폼 기술 개발
우리 대학 웨어러블 플랫폼소재 기술센터 배병수 교수(교신저자)가 KIST 이원령 박사(제1 저자, 교신저자), 서울대학교병원 정승환 박사 (공동 제1 저자)와 공동으로 유연한 기판상에 기계적으로 안정적인 마이크로니들이 접합돼 말초동맥질환 진단에 응용할 수 있는 메디컬 센서 플랫폼 기술을 개발했다고 1일 밝혔다.
연구팀은 이번 기술을 통해 일반적인 웨어러블 진단 기기의 한계점이던 바이오 체액의 접근 제한성을 마이크로니들을 이용해 최소 침습으로 해결했고, 이는 생화학적 질병 진단을 가능하게 했다. 이번 연구에서는 웨어러블 마이크로니들 센서를 활용해 말초동맥질환 모델의 pH(산성, 알칼리성의 정도) 분포도를 측정해 진단 가능성을 확인했다.
이번 연구 결과는 국제학술지 `사이언스 어드밴시스(Science Advances)'에 온라인으로 출시됐다. (논문명: Conformable Microneedle pH Sensors via the Integration of two Different Siloxane Polymers for Mapping Peripheral Artery Disease)
웨어러블 진단 기기는 부드러운 기판 소재 위에 얇은 막 형태의 센서를 제작해 생체 전기신호(심전도, 근전도, 뇌파 등)와 생화학 신호(포도당, 젖산, pH 등)를 측정해 심장질환, 뇌 질환, 당뇨병, 대사질환 등 다양한 질병의 진단에 활용이 기대되어 의료기기용 소자로서 주목을 받고 있다. 하지만, 접근할 수 있는 체액이 땀, 눈물 등으로 제한됨에 따라 상시 모니터링에 대한 제한점이 있었다.
연구팀은 이를 해결하기 위해 자체적으로 개발한 솔-젤(Sol-Gel) 합성공정을 통해 만들어진 실록산(Si-O-Si)골조 기반의 폴리머를 마이크로니들 소재로 활용해 웨어러블 디바이스 플랫폼에 적용하고, 마이크로니들을 통해 상시 체액 모니터링이 가능한 웨어러블 마이크로니들 생화학 센싱 플랫폼을 완성했다.
연구팀은 웨어러블 마이크로니들 생화학센싱 플랫폼의 유용성을 보여주기 위해 마이크로니들에 pH에 대해 표면에너지의 변화를 보이는 폴리어날린 을 증착해 독립적인 pH 센서 어레이로 응용 가능한 것을 보였다. 폴리어날린을 이용한 마이크로니들 pH 센서는, 돼지 피부 1000번 삽입 실험, 1.5 mm의 굽힘 변형 실험 후에도 80% 이상의 센서 감도를 유지하는 높은 기계적 안정성을 보여주었다.
연구팀은 웨어러블 마이크로니들 pH 센서를 활용해, 말초동맥질환 모델의 피부 근접 체액의 pH 분포도를 측정해 질병 진단기기로서의 유용성을 검증했다. 경증 또는 만성 말초동맥질환이 있는 환자 대부분은 질병의 발생이나 진행을 인지할 수 있는 임상 증상을 나타내지 않는다. 그러나 pH 변화를 모니터링하면 저산소증으로 인한 젖산증을 감지할 수 있고, 결과적으로 허혈성 손상으로 인한 조직 손상을 적절히 감지할 수 있다.
연구팀은 우측 다리로 이어지는 고관절에 위치한 동맥혈을 수술용 실로 조인 다음 혈류를 인공적으로 악화시켜 말초동맥질환 모델을 만들었다. 이후 마이크로니들을 통해 피하 체액의 pH를 측정한 결과 말단으로 갈수록, 산성화된 결과를 보여줌으로써, 웨어러블 마이크로니들 센서의 활용성을 증명했다.
연구를 주도한 배병수 교수는“딱딱한 마이크로니들을 부드러운 유연한 기재에 접합시킨 질병 진단 마이크로 니들 필름을 피부에 부착해서 말초동맥질환은 물론 당뇨병, 대사질환 등에 생화학 진단을 하는 웨어러블 디바이스로 활용될 수 있을 것으로 기대된다”고 이번 연구의 의의를 설명했다.
한편 이번 연구는 한국연구재단의 선도연구센터 웨어러블 플랫폼 소재 기술센터의 지원을 받아 수행됐다.
2021.12.03 조회수 12843 -
 조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
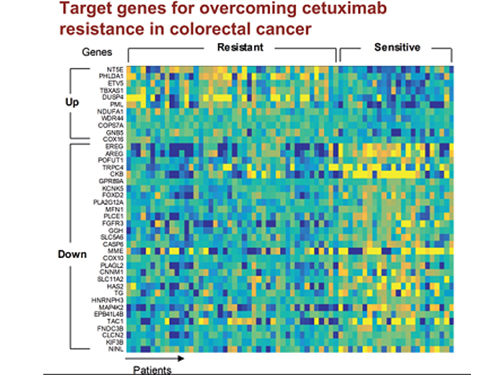
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 24171
조광현 교수, 대장암 항암제 내성 극복할 병용 치료타겟 발굴
〈 조광현 교수 연구팀 〉
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암의 항암제 내성을 극복할 수 있는 새로운 병용치료 타겟을 발굴하는 데 성공했다.
연구팀은 암세포의 복잡한 생체데이터를 분자 네트워크 관점에서 분석하는 시스템생물학 접근법의 중요성을 제시했다. 이 방법을 통해 암세포가 가지는 약제 내성의 원리를 시스템 차원에서 파악하고, 새로운 약물 타겟을 체계적으로 발굴할 수 있을 것으로 기대된다.
박상민 박사과정, 황채영 박사 등이 참여한 이번 연구결과는 국제학술지 ‘유럽생화학회저널(FEBS Journal)’의 4월호 표지논문으로 게재됐다. (논문명 : Systems analysis identifies potential target genes to overcome cetuximab resistance in colorectal cancer cells)
암은 흔하게 발생하는 대표적인 난치병으로 특히 대장암은 전 세계적으로 환자 수가 100만 명을 넘어섰고, 국내의 경우 서구화된 식습관과 비만 등으로 인해 발병률 증가 속도가 10년간 가장 높게 나타났다. 최근 급격한 고령화에 따라 대장암 환자의 발생률 및 사망률이 가파르게 증가할 것으로 예상되고 있다.
최근 암세포의 특정 분자만을 표적으로 하는 표적항암제가 개발돼 부작용을 크게 줄이고 효과를 높일 수 있지만, 여전히 약물에 반응하는 환자가 매우 제한적이며 그나마 반응을 보이더라도 표적 항암치료 후 약물에 대한 내성이 생겨 암이 재발하는 문제를 안고 있다.
또한, 환자별로 항암제에 대한 반응이 매우 달라 환자의 암 조직 내 유전자 변이의 특징에 따라 적합한 치료를 선택하는 정밀의학의 필요성이 커지고 있다. 대장암 역시 약물의 효과를 예측할 수 있는 유전자 바이오마커의 여부에 따라 적합한 표적항암제를 처방하는 시도가 이뤄지고 있다.
FDA 승인을 받은 대표적인 대장암 치료제인 세툭시맙(cetuximab)의 경우 약물 반응성을 예측하는 바이오마커로 KRAS 유전자 돌연변이의 유무가 활용되고 있는데 이 유전자 돌연변이가 없는 환자에게 처방을 권고하고 있다.
그러나 KRAS 돌연변이가 없는 환자도 세툭시맙 반응률은 절반 정도에 불과하고 기존 항암 화학요법 단독시행과 비교해도 평균 5개월의 수명을 연장하는 데 그치고 있다. 오히려 KRAS 돌연변이가 있는 환자에게서 반응성이 있는 경우가 보고되고 있다.
따라서 KRAS 돌연변이 유무 이외의 새 바이오마커가 요구되고 있으며 KRAS 돌연변이가 존재해도 내성을 극복할 수 있는 병용치료 타겟의 발굴이 필요하다.
조 교수 연구팀은 유전체 데이터 분석, 수학 모델링, 컴퓨터 시뮬레이션 분석과 암 세포주 실험을 융합한 시스템생물학 연구를 통해 세툭시맙 반응성에 대한 바이오마커로 다섯 개의 새로운 유전자(DUSP4, ETV5, GNB5, NT5E, PHLDA1)를 찾아냈다.
그리고 대장암세포에서 각 유전자를 실험적으로 억제한 결과 KRAS 정상 세포에서 발생하는 세툭시맙 내성을 모두 극복할 수 있었다.
특히 GNB5를 억제하면 KRAS 돌연변이가 있는 세포주에서도 세툭시맙 처리에 따른 약물내성을 극복할 수 있음을 밝혔다. 따라서 GNB5의 억제를 통해 대장암 환자의 KRAS 돌연변이 유무와 관계없이 세툭시맙에 대한 내성을 극복할 수 있어 GNB5가 효과적인 병용치료 분자 타겟이 될 수 있음을 증명했다.
연구팀이 제시한 유전자를 바이오마커로 활용하면 세툭시맙에 잘 반응할 수 있는 민감 환자군을 미리 선별해 치료할 수 있는 정밀의학의 실현을 앞당길 수 있다.
또한, 발굴된 유전자들을 표적화하는 신약개발을 통해 내성을 가지는 환자군에 대해서도 새로운 치료전략을 제시할 수 있다. 특히 세툭시맙 치료 대상에서 제외됐던 KRAS 돌연변이가 있는 환자군에 대해서도 GNB5의 억제를 통해 치료 효과를 가져올 수 있을 것으로 기대된다.
조 교수는 “지금껏 GNB5 유전자 조절을 대장암의 조합치료에 활용한 예는 없었다”라며 “시스템생물학으로 암세포가 가지는 약제 내성의 원리를 밝히고, 내성 환자군에 대한 바이오마커 동정 및 내성 극복을 위한 병행치료 타겟 발굴을 통해 정밀의학을 실현할 수 있는 새로운 가능성을 제시했다”라고 말했다.
이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구자지원사업과 바이오의료기술개발사업의 지원을 받아 수행됐다.
□ 그림 설명
그림1. 유럽생화학회저널 4월 표지
2019.05.07 조회수 24171 -
 조광현 교수, 컴퓨터시뮬레이션 통해 세포 조절회로의 숨겨진 메커니즘 규명
바이오및뇌공학과 조광현(曺光鉉, 38) 교수 연구팀이 컴퓨터시뮬레이션을 통해 세포의 증식과 분화 조절회로에 숨겨진 동역학 메커니즘을 규명하였다. 연구결과는 세포생물학계의 권위지인 저널오브셀사이언스(Journal of Cell Science)지 21일자 온라인판에 표지논문(Cover Paper)으로 선정, 출판되었다.
이번 연구는 특히 수학 모델과 컴퓨터 시뮬레이션을 이용해 세포내 복잡한 메커니즘을 해석해 내고 이를 생화학실험을 통해 재차 검증함으로서 완성되었다. 이는 IT를 BT에 접목시킨 시스템생물학(Systems Biology) 연구를 통해 기존 생명과학의 한계를 극복한 중요한 BIT 융합 연구사례로 평가된다.
세포내 어크(ERK) 신호전달경로는 세포의 증식과 분화를 조절하는 주요 회로로 알려져 왔으며, 최종단의 인산화된 어크 단백질의 시간에 따른 농도변화 프로화일은 세포의 운명을 결정하는 핵심인자로 여겨져 왔다. 그러나 이 회로의 복잡한 동역학적 특성으로 인해 조절메커니즘은 아직껏 잘 밝혀지지 않았다. 曺 교수 연구팀은 어크 신호전달경로 가운데 라프(Raf) 단백질의 신호를 선택적으로 차단하는 알킵(RKIP) 단백질이 매개하여 형성하는 양성피드백과 어크에서 에스오에스(SOS)로 이어지는 신호에 의해 형성되는 음성피드백이 최종 어크 단백질의 동역학 패턴을 결정짓는 주요 조절회로임을 규명해 냈다. 특히 양성피드백은 이 신호전달과정이 외부노이즈에 둔감하도록 스위칭동작을 유발하고 음성피드백은 어크 프로파일의 진동현상을 유발함으로써 다이나믹한 동역학 특성이 결정됨을 밝혀냈다. 이러한 컴퓨터 시뮬레이션 분석결과는 공동연구팀인 영국 글라스고우 암연구소에서 생화학실험을 통해 증명되었다.
이번 연구는 인간의 주요 질환과 관련된 세포내의 근원적인 조절메커니즘을 규명함으로써 차후 생명과학 응용연구의 중요한 발판을 마련하였으며, 또한 BIT 융합연구로서 시스템생물학의 새로운 가능성을 제시하게 됐다. 이번 연구는 교육과학기술부지원 연구사업의 일환으로 수행되었다.
<2009년 1월 21일자 온라인판, 인터넷주소>
http://jcs.biologists.org/content/vol122/issue3/cover.shtml
2009.01.29 조회수 24414
조광현 교수, 컴퓨터시뮬레이션 통해 세포 조절회로의 숨겨진 메커니즘 규명
바이오및뇌공학과 조광현(曺光鉉, 38) 교수 연구팀이 컴퓨터시뮬레이션을 통해 세포의 증식과 분화 조절회로에 숨겨진 동역학 메커니즘을 규명하였다. 연구결과는 세포생물학계의 권위지인 저널오브셀사이언스(Journal of Cell Science)지 21일자 온라인판에 표지논문(Cover Paper)으로 선정, 출판되었다.
이번 연구는 특히 수학 모델과 컴퓨터 시뮬레이션을 이용해 세포내 복잡한 메커니즘을 해석해 내고 이를 생화학실험을 통해 재차 검증함으로서 완성되었다. 이는 IT를 BT에 접목시킨 시스템생물학(Systems Biology) 연구를 통해 기존 생명과학의 한계를 극복한 중요한 BIT 융합 연구사례로 평가된다.
세포내 어크(ERK) 신호전달경로는 세포의 증식과 분화를 조절하는 주요 회로로 알려져 왔으며, 최종단의 인산화된 어크 단백질의 시간에 따른 농도변화 프로화일은 세포의 운명을 결정하는 핵심인자로 여겨져 왔다. 그러나 이 회로의 복잡한 동역학적 특성으로 인해 조절메커니즘은 아직껏 잘 밝혀지지 않았다. 曺 교수 연구팀은 어크 신호전달경로 가운데 라프(Raf) 단백질의 신호를 선택적으로 차단하는 알킵(RKIP) 단백질이 매개하여 형성하는 양성피드백과 어크에서 에스오에스(SOS)로 이어지는 신호에 의해 형성되는 음성피드백이 최종 어크 단백질의 동역학 패턴을 결정짓는 주요 조절회로임을 규명해 냈다. 특히 양성피드백은 이 신호전달과정이 외부노이즈에 둔감하도록 스위칭동작을 유발하고 음성피드백은 어크 프로파일의 진동현상을 유발함으로써 다이나믹한 동역학 특성이 결정됨을 밝혀냈다. 이러한 컴퓨터 시뮬레이션 분석결과는 공동연구팀인 영국 글라스고우 암연구소에서 생화학실험을 통해 증명되었다.
이번 연구는 인간의 주요 질환과 관련된 세포내의 근원적인 조절메커니즘을 규명함으로써 차후 생명과학 응용연구의 중요한 발판을 마련하였으며, 또한 BIT 융합연구로서 시스템생물학의 새로운 가능성을 제시하게 됐다. 이번 연구는 교육과학기술부지원 연구사업의 일환으로 수행되었다.
<2009년 1월 21일자 온라인판, 인터넷주소>
http://jcs.biologists.org/content/vol122/issue3/cover.shtml
2009.01.29 조회수 24414