-
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01
조회수 362
-
 암 조직 ‘3D·가상염색’ 혁신기술로 절개 없이 관찰 가능
기존에 암 조직을 얇게 절단하여 염색한 뒤 관찰하던 전통 방식에서 벗어나, 우리 대학과 국제공동연구진이 첨단 광학 기술을 활용해 절개없이 암 조직의 3차원 구조를 인공지능 기반 딥러닝 알고리즘을 접목시켜 실제처럼 가상 염색 영상으로 구현하는 기술을 성공하여 향후 차세대 비침습 병리 진단의 혁신을 기대할 수 있게 됐다.
물리학과 박용근 교수 연구팀이 연세대 강남세브란스병원 신수진 교수팀, 미국 메이오클리닉(Mayo Clinic) 황태현 교수팀, 토모큐브 인공지능 연구팀과의 공동연구를 통해, 별도의 염색 없이도 암 조직의 3차원 구조를 생생하게 보여줄 수 있는 혁신적인 기술을 개발했다고 26일 밝혔다.
200여년간 사용되어 온 기존 병리학에서는 암 조직을 현미경으로 관찰하던 방식은 3차원으로 이루어진 암 조직의 특정 단면만을 보여주기 때문에, 세포간의 입체적 연결 구조나 공간적 배치를 파악하는데 한계가 있었다.
이에 연구팀은‘홀로토모그래피(Holotomography, HT)’라는 첨단 광학 기술을 활용해 조직의 3차원 굴절률 정보를 측정하고, 여기에 인공지능 기반 딥러닝 알고리즘을 접목시켜 마치 가상의 염색(H&E)* 이미지 생성하는데 성공했다.
* H&E(Hematoxylin & Eosin): 병리 조직을 관찰할 때 가장 널리 사용되는 염색법으로, 세포의 핵은 헤마톡실린(Hematoxylin)으로 파란색, 세포질은 에오신(Eosin)으로 분홍색으로 염색된다.
연구팀은 이 기술이 생성한 영상이 실제 염색된 조직 영상과 매우 유사하다는 점을 정량적으로 입증했으며, 다양한 장기와 조직에서도 일관된 성능을 보여줌으로써 차세대 병리 분석 도구로서의 범용성과 신뢰성을 입증했다.
또한, 토모큐브사의 홀로토모그래피 장비를 활용해 한국과 미국의 병원 및 연구기관과 공동으로 기술 실현 가능성을 검증함으로써, 이 기술이 실제 병리 연구 현장에 본격적으로 도입될 수 있음을 보여주었다.
박용근 교수는 “이번 연구는 병리학의 분석 단위를 2차원에서 3차원으로 확장한 매우 의미 있는 성과”라며, “앞으로 미세 종양 환경 내에서 암 종양의 경계나 주변 변역 세포들의 공간 분포를 분석할 수 있는 등 다양한 생의학 연구와 임상 진단에 널리 활용될 수 있을 것”이라고 전했다.
이번 연구는 박주연 석박사통합과정 학생이 제1 저자로 참여했으며, 세계적 학술지 네이처 커뮤니케이션즈(Nature Communications)에 5월 22일자로 온라인 게재되었다.
(논문명: Revealing 3D microanatomical structures of unlabeled thick cancer tissues using holotomography and virtual H&E staining. https://doi.org/10.1038/s41467-025-59820-0)
본 연구는 한국연구재단 리더연구사업, 한국산업기술진흥원의 글로벌산업기술협력센터사업, 보건산업진흥원의 지원을 받았다.
암 조직 ‘3D·가상염색’ 혁신기술로 절개 없이 관찰 가능
기존에 암 조직을 얇게 절단하여 염색한 뒤 관찰하던 전통 방식에서 벗어나, 우리 대학과 국제공동연구진이 첨단 광학 기술을 활용해 절개없이 암 조직의 3차원 구조를 인공지능 기반 딥러닝 알고리즘을 접목시켜 실제처럼 가상 염색 영상으로 구현하는 기술을 성공하여 향후 차세대 비침습 병리 진단의 혁신을 기대할 수 있게 됐다.
물리학과 박용근 교수 연구팀이 연세대 강남세브란스병원 신수진 교수팀, 미국 메이오클리닉(Mayo Clinic) 황태현 교수팀, 토모큐브 인공지능 연구팀과의 공동연구를 통해, 별도의 염색 없이도 암 조직의 3차원 구조를 생생하게 보여줄 수 있는 혁신적인 기술을 개발했다고 26일 밝혔다.
200여년간 사용되어 온 기존 병리학에서는 암 조직을 현미경으로 관찰하던 방식은 3차원으로 이루어진 암 조직의 특정 단면만을 보여주기 때문에, 세포간의 입체적 연결 구조나 공간적 배치를 파악하는데 한계가 있었다.
이에 연구팀은‘홀로토모그래피(Holotomography, HT)’라는 첨단 광학 기술을 활용해 조직의 3차원 굴절률 정보를 측정하고, 여기에 인공지능 기반 딥러닝 알고리즘을 접목시켜 마치 가상의 염색(H&E)* 이미지 생성하는데 성공했다.
* H&E(Hematoxylin & Eosin): 병리 조직을 관찰할 때 가장 널리 사용되는 염색법으로, 세포의 핵은 헤마톡실린(Hematoxylin)으로 파란색, 세포질은 에오신(Eosin)으로 분홍색으로 염색된다.
연구팀은 이 기술이 생성한 영상이 실제 염색된 조직 영상과 매우 유사하다는 점을 정량적으로 입증했으며, 다양한 장기와 조직에서도 일관된 성능을 보여줌으로써 차세대 병리 분석 도구로서의 범용성과 신뢰성을 입증했다.
또한, 토모큐브사의 홀로토모그래피 장비를 활용해 한국과 미국의 병원 및 연구기관과 공동으로 기술 실현 가능성을 검증함으로써, 이 기술이 실제 병리 연구 현장에 본격적으로 도입될 수 있음을 보여주었다.
박용근 교수는 “이번 연구는 병리학의 분석 단위를 2차원에서 3차원으로 확장한 매우 의미 있는 성과”라며, “앞으로 미세 종양 환경 내에서 암 종양의 경계나 주변 변역 세포들의 공간 분포를 분석할 수 있는 등 다양한 생의학 연구와 임상 진단에 널리 활용될 수 있을 것”이라고 전했다.
이번 연구는 박주연 석박사통합과정 학생이 제1 저자로 참여했으며, 세계적 학술지 네이처 커뮤니케이션즈(Nature Communications)에 5월 22일자로 온라인 게재되었다.
(논문명: Revealing 3D microanatomical structures of unlabeled thick cancer tissues using holotomography and virtual H&E staining. https://doi.org/10.1038/s41467-025-59820-0)
본 연구는 한국연구재단 리더연구사업, 한국산업기술진흥원의 글로벌산업기술협력센터사업, 보건산업진흥원의 지원을 받았다.
2025.05.26
조회수 1874
-
 교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다.
우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다.
이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을 만들어 암이 재발하는 중심축 역할을 한다는 사실도 밝혔다.
특히, 교모세포종 같은 악성 뇌종양에서는 암세포들이 매우 다양한 형태로 공존하고, 각각이 치료에 다르게 반응하는데, 이를 ‘종양 내 이질성’(intratumoral heterogeneity)이라고 한다. 이 이질성은 교모세포종 치료의 가장 큰 걸림돌로 꼽히는데, 이번 연구는 종양 내 이질성 현상을 일으키는 뿌리가 전암세포 때문이라는 것을 세계 최초로 밝혀낸 것이다.
이번 연구를 통해 교모세포종의 전암세포를 표적으로 삼아 암 진화와 재발을 효과적으로 억제할 수 있는 새로운 치료 패러다임의 기초를 마련할 것으로 예상된다. 이는 기존의 암 세포 자체를 겨냥한 치료에서 벗어나 악성 뇌종양의 근원인 전암 세포를 선제적으로 제거함으로써 암의 진화와 재발을 막는 정밀 맞춤형 치료가 가능할 것으로 평가된다.
이를 바탕으로, 교원창업기업 소바젠(주) (대표이사 박철원)은 암 진화와 재발을 억제하는 교모세포종 RNA 치료제 혁신 신약을 연구 개발하고 있다.
여성 의사 과학자이자 논문의 단독 제1 저자인 KAIST 의과학대학원 김현정 박사(현, 고려대학교 의과대학 교수)는 “전암세포는 종양을 더욱 복잡하고 공격적인 형태로 진화시키는 ‘암 이질성의 씨앗’과 같은 존재이다”라며, “이 전암세포를 이해하고 표적화하는 것이 교모세포종을 근본적으로 극복할 열쇠가 될 수 있다”라고 설명했다.
해당 논문은 암 분야 세계적 권위지인 ‘캔서 디스커버리(Cancer Discovery, IF=30.6)’지에 4월 16일 字로 게재됐다.
※ 논문명: Precancerous cells initiate glioblastoma evolution and contribute to intratumoral heterogeneity DOI: https://doi.org/10.1158/2159-8290.CD-24-0234
※ 저자정보: 김현정(카이스트 의과학대학원, 현 고려대학교 의과대학, 제1 저자), 이정호(카이스트 의과학대학원, 소바젠, 교신저자)
한편, 이번 연구는 한국연구재단, 서경배과학재단 등의 지원을 받아 수행됐다.
교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다.
우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다.
이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을 만들어 암이 재발하는 중심축 역할을 한다는 사실도 밝혔다.
특히, 교모세포종 같은 악성 뇌종양에서는 암세포들이 매우 다양한 형태로 공존하고, 각각이 치료에 다르게 반응하는데, 이를 ‘종양 내 이질성’(intratumoral heterogeneity)이라고 한다. 이 이질성은 교모세포종 치료의 가장 큰 걸림돌로 꼽히는데, 이번 연구는 종양 내 이질성 현상을 일으키는 뿌리가 전암세포 때문이라는 것을 세계 최초로 밝혀낸 것이다.
이번 연구를 통해 교모세포종의 전암세포를 표적으로 삼아 암 진화와 재발을 효과적으로 억제할 수 있는 새로운 치료 패러다임의 기초를 마련할 것으로 예상된다. 이는 기존의 암 세포 자체를 겨냥한 치료에서 벗어나 악성 뇌종양의 근원인 전암 세포를 선제적으로 제거함으로써 암의 진화와 재발을 막는 정밀 맞춤형 치료가 가능할 것으로 평가된다.
이를 바탕으로, 교원창업기업 소바젠(주) (대표이사 박철원)은 암 진화와 재발을 억제하는 교모세포종 RNA 치료제 혁신 신약을 연구 개발하고 있다.
여성 의사 과학자이자 논문의 단독 제1 저자인 KAIST 의과학대학원 김현정 박사(현, 고려대학교 의과대학 교수)는 “전암세포는 종양을 더욱 복잡하고 공격적인 형태로 진화시키는 ‘암 이질성의 씨앗’과 같은 존재이다”라며, “이 전암세포를 이해하고 표적화하는 것이 교모세포종을 근본적으로 극복할 열쇠가 될 수 있다”라고 설명했다.
해당 논문은 암 분야 세계적 권위지인 ‘캔서 디스커버리(Cancer Discovery, IF=30.6)’지에 4월 16일 字로 게재됐다.
※ 논문명: Precancerous cells initiate glioblastoma evolution and contribute to intratumoral heterogeneity DOI: https://doi.org/10.1158/2159-8290.CD-24-0234
※ 저자정보: 김현정(카이스트 의과학대학원, 현 고려대학교 의과대학, 제1 저자), 이정호(카이스트 의과학대학원, 소바젠, 교신저자)
한편, 이번 연구는 한국연구재단, 서경배과학재단 등의 지원을 받아 수행됐다.
2025.04.21
조회수 3644
-
 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08
조회수 2869
-
 ‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19
조회수 4635
-
 수소 경제 핵심, 세계 최고 수준 암모니아 촉매 개발
신재생 에너지를 이용한 수소 생산은 친환경 에너지 및 화학물질 생산의 핵심적인 기술이다. 하지만 이렇게 생산된 수소는 저장과 운송이 어렵기 때문에 탄소 배출이 없고, 액화가 쉬운 암모니아(NH3) 형태로 수소를 저장하려는 연구가 세계적으로 널리 진행되고 있다. 우리 연구진은 매우 낮은 온도와 압력에서도 에너지 손실 없이 암모니아를 합성할 수 있는 고성능 촉매를 개발했다.
우리 대학 생명화학공학과 최민기 교수 연구팀이 에너지 소비와 이산화탄소 배출량을 크게 줄이면서도 암모니아 생산성을 획기적으로 높일 수 있는 혁신적인 촉매 시스템을 개발했다고 11일 밝혔다.
현재 암모니아는 철(Fe) 기반 촉매를 이용해 하버-보슈 공정이라는 100년이 넘은 기술로 생산되고 있다. 하지만, 이 방식은 500℃ 이상의 고온과 100기압 이상의 고압이 필요해 엄청난 에너지를 소비하고, 세계 이산화탄소 배출량에서 상당한 비율을 차지하는 주범으로 지목됐다. 더구나 이렇게 생산된 암모니아는 대규모 공장에서 제조되기 때문에 유통 비용도 만만치 않다.
이에 대한 대안으로, 최근 물을 전기로 분해하는 기술인 수전해를 통해 생산된 그린 수소를 이용해 저온·저압(300도, 10기압)에서 암모니아를 합성하는 친환경 공정에 관한 관심이 급증하고 있다. 그러나 이러한 공정을 구현하려면 낮은 온도와 압력에서도 높은 암모니아 생산성을 확보할 수 있는 촉매 개발이 필수적이며, 현재의 기술로는 이 조건에서 암모니아 생산성이 낮아 이를 극복하는 것이 핵심 과제로 남아 있다.
연구팀은 루테늄(Ru) 촉매와 강한 염기성을 갖는 산화바륨(BaO) 입자를 전도성이 뛰어난 탄소 표면에 도입해 마치 ‘화학 축전지(chemical capacitor)*’처럼 작동하는 신개념 촉매를 개발했다.
*축전지: 전기 에너지를 +전하와 –전하로 나누어 저장하는 장치
암모니아 합성 반응 도중 수소 분자(H2)는 루테늄 촉매 위에서 수소 원자(H)로 분해 되며, 이 수소 원자는 양성자(H+)와 전자(e-) 쌍으로 한번 더 분해되게 된다. 산성을 띠는 양성자는 강한 염기성을 띠는 산화바륨에 저장되고 남은 전자는 루테늄과 탄소에 분리 저장되는 것으로 밝혀졌다.
이처럼 특이한 화학 축전 현상을 통해 전자가 풍부해진 루테늄 촉매는 암모니아 합성 반응의 핵심인 질소(N2) 분자의 분해 과정을 촉진해 촉매 활성을 비약적으로 증진시키는 것으로 밝혀졌다.
특히 이번 연구에서는 탄소의 나노구조를 조절함으로써 루테늄의 전자 밀도를 극대화해 촉매 활성을 증진시킬 수 있음을 발견했다. 이 촉매는 300도, 10기압인 온건한 조건에서 기존 최고 수준의 촉매와 비교하여 7배 이상 높은 암모니아 합성 성능을 나타냈다.
최민기 교수는 “이번 연구는 전기화학이 아닌 일반적인 열화학적 촉매 반응 과정에서도 촉매 내부의 전자 이동을 조절하면 촉매 활성을 크게 향상할 수 있음을 보여준 점에서 학계의 큰 주목을 받고 있다”고 밝혔다.
이어 “동시에 이번 연구를 통해 고성능 촉매를 활용하면 저온·저압 조건에서도 효율적인 암모니아 합성이 가능함이 확인되었다. 이를 통해 기존의 대규모 공장 중심 생산 방식에서 벗어나 분산형 소규모 암모니아 생산이 가능해지며, 친환경 수소 경제 시스템에 적합한 더욱 유연한 암모니아 생산·활용이 가능해질 것으로 기대된다.”라고 설명했다.
생명화학공학과 최민기 교수가 교신저자, 백예준 박사과정 학생이 제 1 저자로 연구에 참여하였으며, 연구 결과는 촉매 화학 분야에서 권위적인 국제 학술지인 ‘네이처 카탈리시스(Nature Catalysis)’에 지난 2월 24일 게재됐다.
(논문명 : Electron and proton storage on separate Ru and BaO domains mediated by conductive low-work-function carbon to accelerate ammonia synthesis, https://doi.org/10.1038/s41929-025-01302-z)
한편, 이 연구는 한국에너지기술연구원과 한국연구재단의 지원을 받아 수행되었다.
수소 경제 핵심, 세계 최고 수준 암모니아 촉매 개발
신재생 에너지를 이용한 수소 생산은 친환경 에너지 및 화학물질 생산의 핵심적인 기술이다. 하지만 이렇게 생산된 수소는 저장과 운송이 어렵기 때문에 탄소 배출이 없고, 액화가 쉬운 암모니아(NH3) 형태로 수소를 저장하려는 연구가 세계적으로 널리 진행되고 있다. 우리 연구진은 매우 낮은 온도와 압력에서도 에너지 손실 없이 암모니아를 합성할 수 있는 고성능 촉매를 개발했다.
우리 대학 생명화학공학과 최민기 교수 연구팀이 에너지 소비와 이산화탄소 배출량을 크게 줄이면서도 암모니아 생산성을 획기적으로 높일 수 있는 혁신적인 촉매 시스템을 개발했다고 11일 밝혔다.
현재 암모니아는 철(Fe) 기반 촉매를 이용해 하버-보슈 공정이라는 100년이 넘은 기술로 생산되고 있다. 하지만, 이 방식은 500℃ 이상의 고온과 100기압 이상의 고압이 필요해 엄청난 에너지를 소비하고, 세계 이산화탄소 배출량에서 상당한 비율을 차지하는 주범으로 지목됐다. 더구나 이렇게 생산된 암모니아는 대규모 공장에서 제조되기 때문에 유통 비용도 만만치 않다.
이에 대한 대안으로, 최근 물을 전기로 분해하는 기술인 수전해를 통해 생산된 그린 수소를 이용해 저온·저압(300도, 10기압)에서 암모니아를 합성하는 친환경 공정에 관한 관심이 급증하고 있다. 그러나 이러한 공정을 구현하려면 낮은 온도와 압력에서도 높은 암모니아 생산성을 확보할 수 있는 촉매 개발이 필수적이며, 현재의 기술로는 이 조건에서 암모니아 생산성이 낮아 이를 극복하는 것이 핵심 과제로 남아 있다.
연구팀은 루테늄(Ru) 촉매와 강한 염기성을 갖는 산화바륨(BaO) 입자를 전도성이 뛰어난 탄소 표면에 도입해 마치 ‘화학 축전지(chemical capacitor)*’처럼 작동하는 신개념 촉매를 개발했다.
*축전지: 전기 에너지를 +전하와 –전하로 나누어 저장하는 장치
암모니아 합성 반응 도중 수소 분자(H2)는 루테늄 촉매 위에서 수소 원자(H)로 분해 되며, 이 수소 원자는 양성자(H+)와 전자(e-) 쌍으로 한번 더 분해되게 된다. 산성을 띠는 양성자는 강한 염기성을 띠는 산화바륨에 저장되고 남은 전자는 루테늄과 탄소에 분리 저장되는 것으로 밝혀졌다.
이처럼 특이한 화학 축전 현상을 통해 전자가 풍부해진 루테늄 촉매는 암모니아 합성 반응의 핵심인 질소(N2) 분자의 분해 과정을 촉진해 촉매 활성을 비약적으로 증진시키는 것으로 밝혀졌다.
특히 이번 연구에서는 탄소의 나노구조를 조절함으로써 루테늄의 전자 밀도를 극대화해 촉매 활성을 증진시킬 수 있음을 발견했다. 이 촉매는 300도, 10기압인 온건한 조건에서 기존 최고 수준의 촉매와 비교하여 7배 이상 높은 암모니아 합성 성능을 나타냈다.
최민기 교수는 “이번 연구는 전기화학이 아닌 일반적인 열화학적 촉매 반응 과정에서도 촉매 내부의 전자 이동을 조절하면 촉매 활성을 크게 향상할 수 있음을 보여준 점에서 학계의 큰 주목을 받고 있다”고 밝혔다.
이어 “동시에 이번 연구를 통해 고성능 촉매를 활용하면 저온·저압 조건에서도 효율적인 암모니아 합성이 가능함이 확인되었다. 이를 통해 기존의 대규모 공장 중심 생산 방식에서 벗어나 분산형 소규모 암모니아 생산이 가능해지며, 친환경 수소 경제 시스템에 적합한 더욱 유연한 암모니아 생산·활용이 가능해질 것으로 기대된다.”라고 설명했다.
생명화학공학과 최민기 교수가 교신저자, 백예준 박사과정 학생이 제 1 저자로 연구에 참여하였으며, 연구 결과는 촉매 화학 분야에서 권위적인 국제 학술지인 ‘네이처 카탈리시스(Nature Catalysis)’에 지난 2월 24일 게재됐다.
(논문명 : Electron and proton storage on separate Ru and BaO domains mediated by conductive low-work-function carbon to accelerate ammonia synthesis, https://doi.org/10.1038/s41929-025-01302-z)
한편, 이 연구는 한국에너지기술연구원과 한국연구재단의 지원을 받아 수행되었다.
2025.03.11
조회수 4775
-
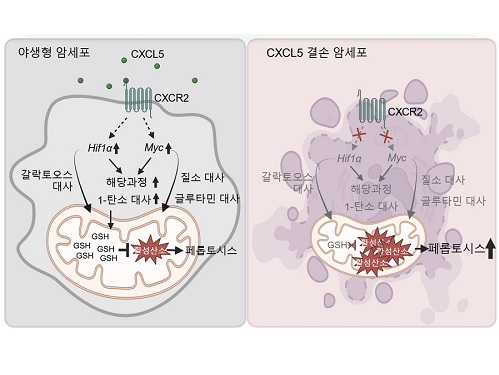 암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07
조회수 3152
-
 암세포 발생 순간 되돌리는 분자스위치 발견
조광현 교수 연구팀은 암세포를 죽이지 않고 그 상태만을 변환시켜 정상 세포와 유사한 상태로 되돌리는 암 가역 치료 원천기술을 개발한 바 있다. 이번에는 정상세포가 암세포로 변화되는 순간의 유전자 네트워크에 암 가역화를 유도할 수 있는 분자스위치가 숨겨져 있음을 최초로 밝히는데 성공하였다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 정상세포에서 암세포로 변화하는 순간의 임계 전이(臨界轉移, critical transition) 현상을 포착하고 이를 분석해 암세포를 다시 정상세포로 되돌릴 수 있는 분자스위치를 발굴하는 기술 개발에 성공했다고 5일 밝혔다.
임계 전이란 물이 섭씨 100도에서 증기로 변하는 것처럼 특정 시점에 갑작스러운 상태변화가 일어나는 현상을 말한다. 정상세포가 유전적, 후성유전적 변화의 축적으로 인해 특정 시점에 암세포로 변화되는 과정에도 이러한 임계 전이 현상이 나타난다.
연구팀은 암 발생 과정에서 정상세포가 암세포로 전환되기 직전, 정상세포와 암세포들이 공존하는 불안정한 임계 전이 상태에 놓일 수 있음을 발견하고 이러한 임계 전이 상태를 시스템생물학 방법으로 분석해 암화 과정을 역전시킬 수 있는 암 가역화 분자스위치 발굴 기술을 개발했다. 그리고 이를 대장암세포에 적용해 암세포가 정상세포의 특징을 회복할 수 있음을 분자세포실험으로 확인했다.
암 발생의 임계 전이를 관장하는 유전자 네트워크의 컴퓨터 모델을 단일세포 유전자 발현 데이터로부터 자동 추론해내고 이를 시뮬레이션 분석해 암 가역화 분자스위치를 체계적으로 찾아내는 원천기술을 개발한 것이어서 향후 다른 암종의 가역 치료제 개발에도 응용될 수 있을 것으로 기대된다.
조광현 교수는 "정상세포가 되돌릴 수 없는 암세포 상태로 변화되기 직전의 임계 전이 순간을 포착해 암세포의 운명을 다시 정상세포 상태로 되돌릴 수 있는 분자스위치를 발굴해 낸 것이다ˮ라고 말했다.
이어 “특히 이번 연구에서는 그동안 수수께끼로 여겨졌던 암 발생 과정 이면의 세포 내에 어떠한 변화가 일어나는지를 유전자 네트워크 차원에서 상세히 밝혀냈다”며 “암세포의 운명을 다시 정상세포로 되돌릴 수 있는 중요한 단서가 바로 이러한 변화의 순간에 숨어있다는 것을 처음으로 규명한 연구다”라고 강조했다.
우리 대학 신동관 박사(現 국립암센터), 공정렬 박사, 정서윤 박사과정 학생 등이 참여했으며 서울대학교 연구팀이 대장암 환자 오가노이드(체외배양조직)를 제공해 진행된 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 1월 22일 字 온라인판 논문으로 출판됐다. (논문명: Attractor landscape analysis reveals a reversion switch in the transition of colorectal tumorigenesis) (DOI: https://doi.org/10.1002/advs.202412503)
한편 이번 연구는 과학기술정보통신부 한국연구재단의 중견연구사업과 기초연구실사업, 그리고 보건복지부 한국보건산업진흥원의 질병중심 중개연구사업의 지원을 통해 수행됐다.
암세포 발생 순간 되돌리는 분자스위치 발견
조광현 교수 연구팀은 암세포를 죽이지 않고 그 상태만을 변환시켜 정상 세포와 유사한 상태로 되돌리는 암 가역 치료 원천기술을 개발한 바 있다. 이번에는 정상세포가 암세포로 변화되는 순간의 유전자 네트워크에 암 가역화를 유도할 수 있는 분자스위치가 숨겨져 있음을 최초로 밝히는데 성공하였다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 정상세포에서 암세포로 변화하는 순간의 임계 전이(臨界轉移, critical transition) 현상을 포착하고 이를 분석해 암세포를 다시 정상세포로 되돌릴 수 있는 분자스위치를 발굴하는 기술 개발에 성공했다고 5일 밝혔다.
임계 전이란 물이 섭씨 100도에서 증기로 변하는 것처럼 특정 시점에 갑작스러운 상태변화가 일어나는 현상을 말한다. 정상세포가 유전적, 후성유전적 변화의 축적으로 인해 특정 시점에 암세포로 변화되는 과정에도 이러한 임계 전이 현상이 나타난다.
연구팀은 암 발생 과정에서 정상세포가 암세포로 전환되기 직전, 정상세포와 암세포들이 공존하는 불안정한 임계 전이 상태에 놓일 수 있음을 발견하고 이러한 임계 전이 상태를 시스템생물학 방법으로 분석해 암화 과정을 역전시킬 수 있는 암 가역화 분자스위치 발굴 기술을 개발했다. 그리고 이를 대장암세포에 적용해 암세포가 정상세포의 특징을 회복할 수 있음을 분자세포실험으로 확인했다.
암 발생의 임계 전이를 관장하는 유전자 네트워크의 컴퓨터 모델을 단일세포 유전자 발현 데이터로부터 자동 추론해내고 이를 시뮬레이션 분석해 암 가역화 분자스위치를 체계적으로 찾아내는 원천기술을 개발한 것이어서 향후 다른 암종의 가역 치료제 개발에도 응용될 수 있을 것으로 기대된다.
조광현 교수는 "정상세포가 되돌릴 수 없는 암세포 상태로 변화되기 직전의 임계 전이 순간을 포착해 암세포의 운명을 다시 정상세포 상태로 되돌릴 수 있는 분자스위치를 발굴해 낸 것이다ˮ라고 말했다.
이어 “특히 이번 연구에서는 그동안 수수께끼로 여겨졌던 암 발생 과정 이면의 세포 내에 어떠한 변화가 일어나는지를 유전자 네트워크 차원에서 상세히 밝혀냈다”며 “암세포의 운명을 다시 정상세포로 되돌릴 수 있는 중요한 단서가 바로 이러한 변화의 순간에 숨어있다는 것을 처음으로 규명한 연구다”라고 강조했다.
우리 대학 신동관 박사(現 국립암센터), 공정렬 박사, 정서윤 박사과정 학생 등이 참여했으며 서울대학교 연구팀이 대장암 환자 오가노이드(체외배양조직)를 제공해 진행된 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 1월 22일 字 온라인판 논문으로 출판됐다. (논문명: Attractor landscape analysis reveals a reversion switch in the transition of colorectal tumorigenesis) (DOI: https://doi.org/10.1002/advs.202412503)
한편 이번 연구는 과학기술정보통신부 한국연구재단의 중견연구사업과 기초연구실사업, 그리고 보건복지부 한국보건산업진흥원의 질병중심 중개연구사업의 지원을 통해 수행됐다.
2025.02.05
조회수 8170
-
 암세포를 정상세포로 되돌려 치료하는 원천기술 개발
지금까지 다양한 항암 치료 기술이 개발됐음에도 현재 시행되고 있는 모든 항암치료의 공통점은 암세포를 사멸시켜서 치료하는 것을 목표로 하고 있다. 이로 인해 암세포가 내성을 획득해 재발하거나 정상세포까지 사멸시켜 큰 부작용을 유발하는 등 근본적인 한계를 지니고 있다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암세포를 죽이지 않고 그 상태만을 변환시켜 정상 대장세포와 유사한 상태로 되돌림으로써 부작용 없이 치료할 수 있는 대장암 가역 치료를 위한 원천기술을 개발하였다고 22일 밝혔다.
연구팀은 정상세포의 암화 과정에서 정상적인 세포분화 궤적을 역행한다는 관찰 결과에 주목하고, 이를 기반으로 정상세포의 분화궤적에 대한 유전자네트워크의 디지털트윈을 제작하는 기술을 개발했다.
그리고 이를 시뮬레이션 분석해 정상세포 분화를 유도하는 마스터 분자스위치를 체계적으로 탐색해 발굴한 뒤 대장암세포에 적용했을 때 대장암세포의 상태가 정상화된다는 것을 분자세포 실험과 동물실험을 통해 입증했다.
이번 연구성과는 암세포를 정상세포로 가역화 하는 것이 우연한 현상적 발견에 의존하는 것이 아니라 암세포 유전자 네트워크의 디지털 트윈을 제작하고 분석함으로써 체계적으로 접근해 이루어낼 수 있음을 보인 원천기술 개발이며 이 기술을 다른 다양한 암종에 응용하여 암 가역 치료제 개발이 가능함을 제시한 것에 큰 의미가 있다.
조광현 교수는 "암세포가 정상세포로 변환될 수 있다는 것은 놀라운 현상이다. 이번 성과는 이를 체계적으로 유도해낼 수 있음을 증명한 것이다ˮ라고 말했다.
이어 “이번 연구 결과는 암세포를 정상세포로 되돌리는 가역 치료 개념을 최초로 제시한 성과들을 바탕으로 정상세포의 분화궤적을 체계적으로 분석해 암 가역화 치료타겟을 발굴하는 원천기술을 개발한 것이다”라고 강조했다.
우리 대학 공정렬 박사, 이춘경 박사과정 학생, 김훈민 박사과정 학생, 김주희 박사과정 학생 등이 참여한 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 12월 11일 字 온라인판 논문으로 출판됐다. (논문명: Control of cellular differentiation trajectories for cancer reversion) DOI: https://doi.org/10.1002/advs.202402132
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 통해 수행되었으며 연구 성과는 바이오리버트(주)로 기술이전 되어 실제 암 가역치료제 개발에 활용될 예정이다.
암세포를 정상세포로 되돌려 치료하는 원천기술 개발
지금까지 다양한 항암 치료 기술이 개발됐음에도 현재 시행되고 있는 모든 항암치료의 공통점은 암세포를 사멸시켜서 치료하는 것을 목표로 하고 있다. 이로 인해 암세포가 내성을 획득해 재발하거나 정상세포까지 사멸시켜 큰 부작용을 유발하는 등 근본적인 한계를 지니고 있다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암세포를 죽이지 않고 그 상태만을 변환시켜 정상 대장세포와 유사한 상태로 되돌림으로써 부작용 없이 치료할 수 있는 대장암 가역 치료를 위한 원천기술을 개발하였다고 22일 밝혔다.
연구팀은 정상세포의 암화 과정에서 정상적인 세포분화 궤적을 역행한다는 관찰 결과에 주목하고, 이를 기반으로 정상세포의 분화궤적에 대한 유전자네트워크의 디지털트윈을 제작하는 기술을 개발했다.
그리고 이를 시뮬레이션 분석해 정상세포 분화를 유도하는 마스터 분자스위치를 체계적으로 탐색해 발굴한 뒤 대장암세포에 적용했을 때 대장암세포의 상태가 정상화된다는 것을 분자세포 실험과 동물실험을 통해 입증했다.
이번 연구성과는 암세포를 정상세포로 가역화 하는 것이 우연한 현상적 발견에 의존하는 것이 아니라 암세포 유전자 네트워크의 디지털 트윈을 제작하고 분석함으로써 체계적으로 접근해 이루어낼 수 있음을 보인 원천기술 개발이며 이 기술을 다른 다양한 암종에 응용하여 암 가역 치료제 개발이 가능함을 제시한 것에 큰 의미가 있다.
조광현 교수는 "암세포가 정상세포로 변환될 수 있다는 것은 놀라운 현상이다. 이번 성과는 이를 체계적으로 유도해낼 수 있음을 증명한 것이다ˮ라고 말했다.
이어 “이번 연구 결과는 암세포를 정상세포로 되돌리는 가역 치료 개념을 최초로 제시한 성과들을 바탕으로 정상세포의 분화궤적을 체계적으로 분석해 암 가역화 치료타겟을 발굴하는 원천기술을 개발한 것이다”라고 강조했다.
우리 대학 공정렬 박사, 이춘경 박사과정 학생, 김훈민 박사과정 학생, 김주희 박사과정 학생 등이 참여한 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 12월 11일 字 온라인판 논문으로 출판됐다. (논문명: Control of cellular differentiation trajectories for cancer reversion) DOI: https://doi.org/10.1002/advs.202402132
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 통해 수행되었으며 연구 성과는 바이오리버트(주)로 기술이전 되어 실제 암 가역치료제 개발에 활용될 예정이다.
2024.12.23
조회수 10145
-
 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11
조회수 4853
-
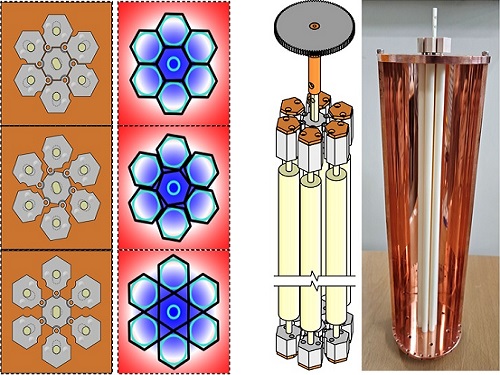 암흑 물질 액시온 탐색 가능성 획기적 높여
암흑 물질이란 질량은 있으나 관측이 불가능한 미지의 물질을 말하며, 우주 전체 에너지의 약 27% 정도를 차지하고 있다. 암흑 물질을 연구하는 주된 이유는 우주의 구조와 진화의 비밀을 밝히고 이를 통해 우주의 형성과 모습을 이해하고자 함이다. 한국 연구진이 암흑 물질 후보로 알려진 액시온의 탐색 효율을 크게 향상시킬 고주파 공진기 튜닝 기술을 개발했다.
우리 대학 물리학과 야니스 세메르치디스 교수 연구팀이 기초과학연구원(IBS)(원장 노도영) 산하 액시온 및 극한상호작용 연구단(이하 CAPP)(단장 야니스 세메르치디스)과 협력해 메타물질*을 이용, 암흑 물질인 액시온의 탐색 범위를 효율적으로 확장할 방법을 구현했다고 25일 밝혔다.
*메타물질: 아직 자연에서 발견되지 않은 특성을 갖도록 인공적으로 설계한 물질을 말함.
암흑물질의 존재와 더불어 또 다른 미스터리는 ‘오늘날 우주가 왜 물질로만 이루어져 있는가?’라는 점이다. 초기 우주에서는 물질과 반물질이 거의 같은 양으로 생성되었을 것이라 추정하고 있다. 따라서, 현재의 우주에 대해, 입자물리학에서는 물질이 반물질보다 압도적으로 우세한 이런 물질-반물질의 불균형을 CP*라고 불리는 대칭성의 깨짐으로 설명하려고 한다. *CP: 전하(Charge)와 공간 반전(Parity)
액시온은 강한 상호작용에서 발생하는 이 특정 대칭 불균형과 관련된 문제, 즉 대칭성이 깨져있을 거라는 이론적 예측과 이 대칭성이 보존되는 것처럼 보인다는 실험적 관측 사이의 차이를 해결해 줄 수 있는 가상의 입자이다. 즉, 액시온 입자의 존재는 우주의 물질-반물질 불균형과 암흑물질이라는 두 가지 근본적인 미스터리를 동시에 해결할 열쇠가 될 수 있다.
암흑 물질 액시온은 그 고유한 진동 주파수에 맞는 공진기를 통해 탐색할 수 있으며, 최근 암흑 물질 액시온의 질량을 예측하려는 이론적 연구들에 따르면, 현재 민감한 실험들이 다루고 있는 영역보다 더 높은 주파수대에서 탐색이 필요하다는 전망이 제기되고 있다.
이에 따라 고주파 탐색의 필요성이 대두되면서 다양한 공진기 개발이 이뤄졌고 고주파 액시온 탐색에서 높은 효율을 기대할 수 있게 됐지만, 고차 공명 모드를 효과적으로 튜닝할 방법은 여전히 부족한 상황이다.
이에 연구팀은 음팽창 메타물질 구조를 활용해 회전 운동을 2차원 팽창 및 수축 운동으로 전환하는 새로운 튜닝 메커니즘을 개발했다. 키리가미(kirigami)라는 종이접기/자르기 방식에서 영감을 얻은 음팽창 메타물질 구조체는 특유의 결합 배열 덕분에, 한쪽 면에 팽창·수축하는 힘이 가해질 때 다른 면도 함께 팽창·수축하는 특성을 갖는다.
이러한 성질을 이용하면 구조체의 중심이 회전할 때 전체 구조가 팽창하거나 수축하는 움직임으로 변환된다. 이를 통해 간단한 1차원 회전 움직임을 더 복잡한 2차원 움직임으로 확장할 수 있는 혁신적인 구조가 만들어진다.
또한 저온 환경에서 음팽창 구조체의 효율적인 움직임을 위해 기어 구조를 도입해 힘을 보강했다. 이를 통해 극저온 환경에서도 최소한의 힘과 열 발생으로 구조체를 효과적으로 구동하며 주파수를 조정할 수 있었다.
연구팀은 육각 음팽창 구조를 유전체 튜닝 구조체로 고려하고, 이를 공진기의 적용해 주파수를 효과적으로 조정할 수 있음을 확인했다. 나아가 이 공진기를 극저온으로 냉각한 상태에서 9T(테슬라, 자기장의 강도를 나타내는 단위, 1T는 지구 자기장의 약 2만 배) 자기장을 인가해 실제 액시온 검출 실험을 수행했고, 기존 민감도를 두 배로 향상하는 성과를 거뒀다.
연구팀이 개발한 이 독특한 구조체는 극저온과 강한 자기장 환경에서도 작동 가능한 메타물질 기반 주파수 조정 장치로, 향후 고주파 영역의 암흑 물질 액시온 탐색에 적극 활용될 것으로 기대된다. 또한, 이 시스템은 극한의 저온·고자기장 환경에서 로보틱스 분야로도 확장될 잠재력을 가지고 있다.
제1 저자인 KAIST 배성재 박사과정 학생은 “이 결과는 고차 공명모드를 실용적으로 활용할 수 있는 튜닝 메커니즘의 입증을 통해 고주파 액시온 탐색에 새로운 방향을 제시한 것”이라고 밝혔으며, 공동 제1 저자인 IBS 정준우 박사후 연구원은 “궁극적으로 액시온 암흑 물질의 비밀을 풀기 위해 보다 포괄적이고 효과적인 탐색 전략의 돌파구를 마련했다”라고 덧붙였다.
물리학과 배성재 박사과정과 IBS-CAPP 정준우 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘피지컬 리뷰 레터스(Physical Review Letters)’ 11월 22일 133호에 게재됐다. (논문명 : Search for Dark Matter Axions with Tunable TM020 mode)
한편 이번 연구는 기초과학연구원의 지원을 받아 수행됐다.
암흑 물질 액시온 탐색 가능성 획기적 높여
암흑 물질이란 질량은 있으나 관측이 불가능한 미지의 물질을 말하며, 우주 전체 에너지의 약 27% 정도를 차지하고 있다. 암흑 물질을 연구하는 주된 이유는 우주의 구조와 진화의 비밀을 밝히고 이를 통해 우주의 형성과 모습을 이해하고자 함이다. 한국 연구진이 암흑 물질 후보로 알려진 액시온의 탐색 효율을 크게 향상시킬 고주파 공진기 튜닝 기술을 개발했다.
우리 대학 물리학과 야니스 세메르치디스 교수 연구팀이 기초과학연구원(IBS)(원장 노도영) 산하 액시온 및 극한상호작용 연구단(이하 CAPP)(단장 야니스 세메르치디스)과 협력해 메타물질*을 이용, 암흑 물질인 액시온의 탐색 범위를 효율적으로 확장할 방법을 구현했다고 25일 밝혔다.
*메타물질: 아직 자연에서 발견되지 않은 특성을 갖도록 인공적으로 설계한 물질을 말함.
암흑물질의 존재와 더불어 또 다른 미스터리는 ‘오늘날 우주가 왜 물질로만 이루어져 있는가?’라는 점이다. 초기 우주에서는 물질과 반물질이 거의 같은 양으로 생성되었을 것이라 추정하고 있다. 따라서, 현재의 우주에 대해, 입자물리학에서는 물질이 반물질보다 압도적으로 우세한 이런 물질-반물질의 불균형을 CP*라고 불리는 대칭성의 깨짐으로 설명하려고 한다. *CP: 전하(Charge)와 공간 반전(Parity)
액시온은 강한 상호작용에서 발생하는 이 특정 대칭 불균형과 관련된 문제, 즉 대칭성이 깨져있을 거라는 이론적 예측과 이 대칭성이 보존되는 것처럼 보인다는 실험적 관측 사이의 차이를 해결해 줄 수 있는 가상의 입자이다. 즉, 액시온 입자의 존재는 우주의 물질-반물질 불균형과 암흑물질이라는 두 가지 근본적인 미스터리를 동시에 해결할 열쇠가 될 수 있다.
암흑 물질 액시온은 그 고유한 진동 주파수에 맞는 공진기를 통해 탐색할 수 있으며, 최근 암흑 물질 액시온의 질량을 예측하려는 이론적 연구들에 따르면, 현재 민감한 실험들이 다루고 있는 영역보다 더 높은 주파수대에서 탐색이 필요하다는 전망이 제기되고 있다.
이에 따라 고주파 탐색의 필요성이 대두되면서 다양한 공진기 개발이 이뤄졌고 고주파 액시온 탐색에서 높은 효율을 기대할 수 있게 됐지만, 고차 공명 모드를 효과적으로 튜닝할 방법은 여전히 부족한 상황이다.
이에 연구팀은 음팽창 메타물질 구조를 활용해 회전 운동을 2차원 팽창 및 수축 운동으로 전환하는 새로운 튜닝 메커니즘을 개발했다. 키리가미(kirigami)라는 종이접기/자르기 방식에서 영감을 얻은 음팽창 메타물질 구조체는 특유의 결합 배열 덕분에, 한쪽 면에 팽창·수축하는 힘이 가해질 때 다른 면도 함께 팽창·수축하는 특성을 갖는다.
이러한 성질을 이용하면 구조체의 중심이 회전할 때 전체 구조가 팽창하거나 수축하는 움직임으로 변환된다. 이를 통해 간단한 1차원 회전 움직임을 더 복잡한 2차원 움직임으로 확장할 수 있는 혁신적인 구조가 만들어진다.
또한 저온 환경에서 음팽창 구조체의 효율적인 움직임을 위해 기어 구조를 도입해 힘을 보강했다. 이를 통해 극저온 환경에서도 최소한의 힘과 열 발생으로 구조체를 효과적으로 구동하며 주파수를 조정할 수 있었다.
연구팀은 육각 음팽창 구조를 유전체 튜닝 구조체로 고려하고, 이를 공진기의 적용해 주파수를 효과적으로 조정할 수 있음을 확인했다. 나아가 이 공진기를 극저온으로 냉각한 상태에서 9T(테슬라, 자기장의 강도를 나타내는 단위, 1T는 지구 자기장의 약 2만 배) 자기장을 인가해 실제 액시온 검출 실험을 수행했고, 기존 민감도를 두 배로 향상하는 성과를 거뒀다.
연구팀이 개발한 이 독특한 구조체는 극저온과 강한 자기장 환경에서도 작동 가능한 메타물질 기반 주파수 조정 장치로, 향후 고주파 영역의 암흑 물질 액시온 탐색에 적극 활용될 것으로 기대된다. 또한, 이 시스템은 극한의 저온·고자기장 환경에서 로보틱스 분야로도 확장될 잠재력을 가지고 있다.
제1 저자인 KAIST 배성재 박사과정 학생은 “이 결과는 고차 공명모드를 실용적으로 활용할 수 있는 튜닝 메커니즘의 입증을 통해 고주파 액시온 탐색에 새로운 방향을 제시한 것”이라고 밝혔으며, 공동 제1 저자인 IBS 정준우 박사후 연구원은 “궁극적으로 액시온 암흑 물질의 비밀을 풀기 위해 보다 포괄적이고 효과적인 탐색 전략의 돌파구를 마련했다”라고 덧붙였다.
물리학과 배성재 박사과정과 IBS-CAPP 정준우 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘피지컬 리뷰 레터스(Physical Review Letters)’ 11월 22일 133호에 게재됐다. (논문명 : Search for Dark Matter Axions with Tunable TM020 mode)
한편 이번 연구는 기초과학연구원의 지원을 받아 수행됐다.
2024.11.25
조회수 3432
-
 난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06
조회수 5852
 장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 362
장내 미생물로 난치성 뇌종양 면역치료 효과 높인다
우리 몸의 면역세포인 T세포를 활성화시켜 암세포를 제거하도록 유도하는 첨단 치료법인 ‘면역항암제’는 가장 치명적인 뇌종양 ‘교모세포종(Glioblastoma)’에는 거의 반응하지 않고, 치료에 대한 저항성이 높아 단독 치료로는 효과가 매우 제한적이라는 한계가 있었다. 이에 우리 연구진이 장내 미생물과 그 대사산물을 활용해 뇌종양의 면역치료 효과를 높일 수 있는 새로운 치료 전략을 세계 최초로 입증했다. 향후 미생물을 기반으로 한 면역치료 보완제 개발에 대한 가능성도 보여줬다.
우리 대학 생명과학과 이흥규 교수 연구팀이 장내 미생물 생태계 변화에 주목해 교모세포종 면역치료의 효율을 크게 높이는 방법을 발굴하고 이를 입증했다고 1일 밝혔다.
연구팀은 교모세포종이 진행되면서 장내에서 중요한 아미노산인 ‘트립토판(tryptophan)’의 농도가 급격히 줄어들고, 이로 인해 장내 미생물 생태계가 변화한다는 점에 주목했다. 그리고 트립토판을 보충해 미생물 다양성을 회복시키면, 특정 유익한 균주가 면역세포 중 하나인 CD8 T세포를 활성화하고 종양 조직으로 다시 유도하는 역할을 한다는 사실을 밝혀냈다.
연구팀은 생쥐 교모세포종 모델을 통해, 트립토판을 보충하면 암을 공격하는 T세포(특히 CD8 T세포)의 반응이 향상되고, 이들이 림프절과 뇌 등 종양이 있는 부위로 더 많이 이동한다는 사실을 확인했다.
이 과정에서 장내에 존재하는 유익한 공생균인 ‘던카니엘라 두보시(Duncaniella dubosii)’가 핵심적인 역할을 한다는 점도 밝혀냈다. 해당 균주는 T세포가 몸 안에서 효과적으로 재분포하도록 도와줬고, 면역항암제(anti-PD-1)와 함께 사용할 때 생존율이 유의미하게 향상됐다.
또한, 장내 미생물이 전혀 없는 무균 생쥐에게 위 공생균을 단독으로 투입해도 교모세포종에 대한 생존율이 높아졌으며, 이는 이 균주가 트립토판을 활용해 장내 환경을 조절하고, 그 과정에서 생성되는 대사산물이 CD8 T세포의 암세포 공격 능력을 강화하기 때문임이 입증됐다.
이흥규 교수는 “이번 연구는 면역관문억제제가 효과를 보이지 않았던 난치성 뇌종양에서도, 장내 미생물을 활용한 병용 전략을 통해 치료 반응을 유의하게 높일 수 있음을 보여준 의미 있는 성과”라고 설명했다.
우리 대학 김현철 박사(現, 생명과학연구소 박사후연구원)가 제1 저자로 참여했고 연구 결과는 생명과학 분야 국제 학술지‘셀 리포츠(Cell Reports)’에 지난 6월 26 일자 온라인판에 게재됐다.
(논문명: Gut microbiota dysbiosis induced by brain tumor modulates the efficacy of immunotherapy, https://doi.org/10.1016/j.celrep.2025.115825)
한편, 이번 연구는 과학기술정보통신부와 한국연구재단이 지원하는 개인기초연구사업 및 바이오의료기술개발사업의 일환으로 수행됐다.
2025.07.01 조회수 362 암 조직 ‘3D·가상염색’ 혁신기술로 절개 없이 관찰 가능
기존에 암 조직을 얇게 절단하여 염색한 뒤 관찰하던 전통 방식에서 벗어나, 우리 대학과 국제공동연구진이 첨단 광학 기술을 활용해 절개없이 암 조직의 3차원 구조를 인공지능 기반 딥러닝 알고리즘을 접목시켜 실제처럼 가상 염색 영상으로 구현하는 기술을 성공하여 향후 차세대 비침습 병리 진단의 혁신을 기대할 수 있게 됐다.
물리학과 박용근 교수 연구팀이 연세대 강남세브란스병원 신수진 교수팀, 미국 메이오클리닉(Mayo Clinic) 황태현 교수팀, 토모큐브 인공지능 연구팀과의 공동연구를 통해, 별도의 염색 없이도 암 조직의 3차원 구조를 생생하게 보여줄 수 있는 혁신적인 기술을 개발했다고 26일 밝혔다.
200여년간 사용되어 온 기존 병리학에서는 암 조직을 현미경으로 관찰하던 방식은 3차원으로 이루어진 암 조직의 특정 단면만을 보여주기 때문에, 세포간의 입체적 연결 구조나 공간적 배치를 파악하는데 한계가 있었다.
이에 연구팀은‘홀로토모그래피(Holotomography, HT)’라는 첨단 광학 기술을 활용해 조직의 3차원 굴절률 정보를 측정하고, 여기에 인공지능 기반 딥러닝 알고리즘을 접목시켜 마치 가상의 염색(H&E)* 이미지 생성하는데 성공했다.
* H&E(Hematoxylin & Eosin): 병리 조직을 관찰할 때 가장 널리 사용되는 염색법으로, 세포의 핵은 헤마톡실린(Hematoxylin)으로 파란색, 세포질은 에오신(Eosin)으로 분홍색으로 염색된다.
연구팀은 이 기술이 생성한 영상이 실제 염색된 조직 영상과 매우 유사하다는 점을 정량적으로 입증했으며, 다양한 장기와 조직에서도 일관된 성능을 보여줌으로써 차세대 병리 분석 도구로서의 범용성과 신뢰성을 입증했다.
또한, 토모큐브사의 홀로토모그래피 장비를 활용해 한국과 미국의 병원 및 연구기관과 공동으로 기술 실현 가능성을 검증함으로써, 이 기술이 실제 병리 연구 현장에 본격적으로 도입될 수 있음을 보여주었다.
박용근 교수는 “이번 연구는 병리학의 분석 단위를 2차원에서 3차원으로 확장한 매우 의미 있는 성과”라며, “앞으로 미세 종양 환경 내에서 암 종양의 경계나 주변 변역 세포들의 공간 분포를 분석할 수 있는 등 다양한 생의학 연구와 임상 진단에 널리 활용될 수 있을 것”이라고 전했다.
이번 연구는 박주연 석박사통합과정 학생이 제1 저자로 참여했으며, 세계적 학술지 네이처 커뮤니케이션즈(Nature Communications)에 5월 22일자로 온라인 게재되었다.
(논문명: Revealing 3D microanatomical structures of unlabeled thick cancer tissues using holotomography and virtual H&E staining. https://doi.org/10.1038/s41467-025-59820-0)
본 연구는 한국연구재단 리더연구사업, 한국산업기술진흥원의 글로벌산업기술협력센터사업, 보건산업진흥원의 지원을 받았다.
2025.05.26 조회수 1874
암 조직 ‘3D·가상염색’ 혁신기술로 절개 없이 관찰 가능
기존에 암 조직을 얇게 절단하여 염색한 뒤 관찰하던 전통 방식에서 벗어나, 우리 대학과 국제공동연구진이 첨단 광학 기술을 활용해 절개없이 암 조직의 3차원 구조를 인공지능 기반 딥러닝 알고리즘을 접목시켜 실제처럼 가상 염색 영상으로 구현하는 기술을 성공하여 향후 차세대 비침습 병리 진단의 혁신을 기대할 수 있게 됐다.
물리학과 박용근 교수 연구팀이 연세대 강남세브란스병원 신수진 교수팀, 미국 메이오클리닉(Mayo Clinic) 황태현 교수팀, 토모큐브 인공지능 연구팀과의 공동연구를 통해, 별도의 염색 없이도 암 조직의 3차원 구조를 생생하게 보여줄 수 있는 혁신적인 기술을 개발했다고 26일 밝혔다.
200여년간 사용되어 온 기존 병리학에서는 암 조직을 현미경으로 관찰하던 방식은 3차원으로 이루어진 암 조직의 특정 단면만을 보여주기 때문에, 세포간의 입체적 연결 구조나 공간적 배치를 파악하는데 한계가 있었다.
이에 연구팀은‘홀로토모그래피(Holotomography, HT)’라는 첨단 광학 기술을 활용해 조직의 3차원 굴절률 정보를 측정하고, 여기에 인공지능 기반 딥러닝 알고리즘을 접목시켜 마치 가상의 염색(H&E)* 이미지 생성하는데 성공했다.
* H&E(Hematoxylin & Eosin): 병리 조직을 관찰할 때 가장 널리 사용되는 염색법으로, 세포의 핵은 헤마톡실린(Hematoxylin)으로 파란색, 세포질은 에오신(Eosin)으로 분홍색으로 염색된다.
연구팀은 이 기술이 생성한 영상이 실제 염색된 조직 영상과 매우 유사하다는 점을 정량적으로 입증했으며, 다양한 장기와 조직에서도 일관된 성능을 보여줌으로써 차세대 병리 분석 도구로서의 범용성과 신뢰성을 입증했다.
또한, 토모큐브사의 홀로토모그래피 장비를 활용해 한국과 미국의 병원 및 연구기관과 공동으로 기술 실현 가능성을 검증함으로써, 이 기술이 실제 병리 연구 현장에 본격적으로 도입될 수 있음을 보여주었다.
박용근 교수는 “이번 연구는 병리학의 분석 단위를 2차원에서 3차원으로 확장한 매우 의미 있는 성과”라며, “앞으로 미세 종양 환경 내에서 암 종양의 경계나 주변 변역 세포들의 공간 분포를 분석할 수 있는 등 다양한 생의학 연구와 임상 진단에 널리 활용될 수 있을 것”이라고 전했다.
이번 연구는 박주연 석박사통합과정 학생이 제1 저자로 참여했으며, 세계적 학술지 네이처 커뮤니케이션즈(Nature Communications)에 5월 22일자로 온라인 게재되었다.
(논문명: Revealing 3D microanatomical structures of unlabeled thick cancer tissues using holotomography and virtual H&E staining. https://doi.org/10.1038/s41467-025-59820-0)
본 연구는 한국연구재단 리더연구사업, 한국산업기술진흥원의 글로벌산업기술협력센터사업, 보건산업진흥원의 지원을 받았다.
2025.05.26 조회수 1874 교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다.
우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다.
이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을 만들어 암이 재발하는 중심축 역할을 한다는 사실도 밝혔다.
특히, 교모세포종 같은 악성 뇌종양에서는 암세포들이 매우 다양한 형태로 공존하고, 각각이 치료에 다르게 반응하는데, 이를 ‘종양 내 이질성’(intratumoral heterogeneity)이라고 한다. 이 이질성은 교모세포종 치료의 가장 큰 걸림돌로 꼽히는데, 이번 연구는 종양 내 이질성 현상을 일으키는 뿌리가 전암세포 때문이라는 것을 세계 최초로 밝혀낸 것이다.
이번 연구를 통해 교모세포종의 전암세포를 표적으로 삼아 암 진화와 재발을 효과적으로 억제할 수 있는 새로운 치료 패러다임의 기초를 마련할 것으로 예상된다. 이는 기존의 암 세포 자체를 겨냥한 치료에서 벗어나 악성 뇌종양의 근원인 전암 세포를 선제적으로 제거함으로써 암의 진화와 재발을 막는 정밀 맞춤형 치료가 가능할 것으로 평가된다.
이를 바탕으로, 교원창업기업 소바젠(주) (대표이사 박철원)은 암 진화와 재발을 억제하는 교모세포종 RNA 치료제 혁신 신약을 연구 개발하고 있다.
여성 의사 과학자이자 논문의 단독 제1 저자인 KAIST 의과학대학원 김현정 박사(현, 고려대학교 의과대학 교수)는 “전암세포는 종양을 더욱 복잡하고 공격적인 형태로 진화시키는 ‘암 이질성의 씨앗’과 같은 존재이다”라며, “이 전암세포를 이해하고 표적화하는 것이 교모세포종을 근본적으로 극복할 열쇠가 될 수 있다”라고 설명했다.
해당 논문은 암 분야 세계적 권위지인 ‘캔서 디스커버리(Cancer Discovery, IF=30.6)’지에 4월 16일 字로 게재됐다.
※ 논문명: Precancerous cells initiate glioblastoma evolution and contribute to intratumoral heterogeneity DOI: https://doi.org/10.1158/2159-8290.CD-24-0234
※ 저자정보: 김현정(카이스트 의과학대학원, 현 고려대학교 의과대학, 제1 저자), 이정호(카이스트 의과학대학원, 소바젠, 교신저자)
한편, 이번 연구는 한국연구재단, 서경배과학재단 등의 지원을 받아 수행됐다.
2025.04.21 조회수 3644
교모세포종 암의 씨앗‘전암 세포’첫 규명·정조준했다
교모세포종(Glioblastoma)은 가장 공격적이고 예후가 나쁜 대표적 악성 뇌종양으로, 광범위한 뇌 절제술을 포함한 표준 치료 후에도 1년 이내 대부분 재발하며 생존률이 매우 낮은 치명적인 질환이다. KAIST 연구진이 교모세포종에 암세포로 발전하는 가능성을 가진 전암세포가 있다는 것을 최초로 밝혔다.
우리 대학 의과학대학원 이정호 교수 연구팀은 세계 최초로 교모세포종의 진화와 재발 및 치료 저항성의 근원이 되는 ‘전암세포(Precancerous cell)’를 규명했다.
이정호 교수 연구팀은 2018년 교모세포종이 뇌 깊은 곳에 있는 돌연변이 줄기세포로부터 시작된다는 것을 최초로 밝혀내며 ‘네이쳐(Nature)’지에 게재한 바 있다. 이번 연구에서는 암의 씨앗과 같은 ‘전암 세포’가 어디서 유래하는지, 즉, 돌연변이 기원 세포가 어떻게 분화되는지를 규명하였고 이 전암 세포가 종양 내 세부 유형의 암세포들을 만들어 암이 재발하는 중심축 역할을 한다는 사실도 밝혔다.
특히, 교모세포종 같은 악성 뇌종양에서는 암세포들이 매우 다양한 형태로 공존하고, 각각이 치료에 다르게 반응하는데, 이를 ‘종양 내 이질성’(intratumoral heterogeneity)이라고 한다. 이 이질성은 교모세포종 치료의 가장 큰 걸림돌로 꼽히는데, 이번 연구는 종양 내 이질성 현상을 일으키는 뿌리가 전암세포 때문이라는 것을 세계 최초로 밝혀낸 것이다.
이번 연구를 통해 교모세포종의 전암세포를 표적으로 삼아 암 진화와 재발을 효과적으로 억제할 수 있는 새로운 치료 패러다임의 기초를 마련할 것으로 예상된다. 이는 기존의 암 세포 자체를 겨냥한 치료에서 벗어나 악성 뇌종양의 근원인 전암 세포를 선제적으로 제거함으로써 암의 진화와 재발을 막는 정밀 맞춤형 치료가 가능할 것으로 평가된다.
이를 바탕으로, 교원창업기업 소바젠(주) (대표이사 박철원)은 암 진화와 재발을 억제하는 교모세포종 RNA 치료제 혁신 신약을 연구 개발하고 있다.
여성 의사 과학자이자 논문의 단독 제1 저자인 KAIST 의과학대학원 김현정 박사(현, 고려대학교 의과대학 교수)는 “전암세포는 종양을 더욱 복잡하고 공격적인 형태로 진화시키는 ‘암 이질성의 씨앗’과 같은 존재이다”라며, “이 전암세포를 이해하고 표적화하는 것이 교모세포종을 근본적으로 극복할 열쇠가 될 수 있다”라고 설명했다.
해당 논문은 암 분야 세계적 권위지인 ‘캔서 디스커버리(Cancer Discovery, IF=30.6)’지에 4월 16일 字로 게재됐다.
※ 논문명: Precancerous cells initiate glioblastoma evolution and contribute to intratumoral heterogeneity DOI: https://doi.org/10.1158/2159-8290.CD-24-0234
※ 저자정보: 김현정(카이스트 의과학대학원, 현 고려대학교 의과대학, 제1 저자), 이정호(카이스트 의과학대학원, 소바젠, 교신저자)
한편, 이번 연구는 한국연구재단, 서경배과학재단 등의 지원을 받아 수행됐다.
2025.04.21 조회수 3644 면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 2869
면역항암 막는 핵심인자‘최초 발견’폐암 치료 새 길 열어
우리 몸의 면역세포가 암세포를 더 잘 공격할 수 있게 도와주는 면역관문억제제(면역항암치료)의 개발은 암 치료의 획기적인 도약을 불러왔다. 반면 실제로는 전체 환자의 20% 미만만이 반응하므로 면역항암치료에 반응하거나 비반응 환자를 위한 새로운 치료전략이 절실한 상황이다.
우리 대학 연구진은 면역항암치료를 방해하는 핵심인자(DDX54)를 최초로 발굴하여 폐암 치료의 새 길을 열었다. 이 기술은 교원창업기업 바이오리버트(주)로 기술이전되어 면역항암치료제의 실제 동반치료제로 개발 중이며 2028년 임상진행 예정이다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 폐암세포의 면역회피능력을 결정짓는 핵심인자(DDX54)를 발굴하는데 성공하였고, 이를 억제할 경우 암 조직으로의 면역세포 침투가 증가해 면역항암치료 효과가 크게 개선된다는 사실을 입증했다.
면역항암치료(Immunotherapy)는 면역세포의 공격을 도와주는 항PD-1(anti-PD-1) 또는 항PD-L1(anti-PD-L1) 항체를 이용한 뛰어난 치료법이다. 하지만 면역항암치료의 반응률이 낮아 실제 치료 혜택을 받는 환자군이 극히 제한적이었다.
이에 반응할 가능성이 높은 환자를 선별하기 위한 바이오마커 연구로 최근 종양돌연변이부담(Tumor Mutational Burden, TMB)이 FDA에서 면역항암치료의 주요 바이오마커로 승인되었다. 즉, 유전자 돌연변이가 많이 생긴 암일수록 면역항암치료에 반응할 가능성이 높다는 것이다.
그러나 TMB가 높아도 면역세포의 침윤이 극도로 제한되는 소위 ‘면역사막(Immune-desert)' 형태의 암이 여전히 다수 존재한다는 것이 밝혀졌으며 이 경우 면역항암치료 반응 또한 매우 낮은 것으로 보고되고 있다.
이번 연구성과는 특히 면역세포 침윤이 매우 낮은 폐암 조직을 대상으로, 발굴한 핵심인자를 억제함으로써 면역관문억제제를 활용한 면역항암치료의 내성을 극복할 수 있음을 확인한 것이다.
조광현 교수 연구팀은 면역회피가 발생된 폐암 환자 유래 전사체 및 유전체 데이터로부터 시스템생물학 연구를 통해 유전자 조절네트워크를 추론하고 이를 분석해 폐암세포가 면역회피능을 획득하는 핵심 조절인자를 찾아냈다.
그리고 이 핵심인자를 동종(Syngeneic) 폐암 마우스 모델에서 억제한 뒤 면역항암치료 반응성을 조사한 결과, T 세포, NK세포 등 항암 면역세포의 조직 내 침윤이 크게 증가함과 동시에 면역항암치료 반응성도 현저히 높아진다는 것을 확인하였다.
아울러 세포 수준에서 유전자 발현을 분석하는 기술인 단일세포 전사체 분석 및 공간전사체 분석 결과, 발굴된 핵심인자를 제어하는 동반치료가 면역항암치료를 통해 암을 억제하는 효과를 가지는 T 세포와 기억 T 세포의 분화를 촉진하였다. 동시에, 암세포 성장을 돕는 조절 T 세포와 탈진된 T 세포의 침윤을 억제하는 효과가 있음이 확인되었다.
이는 발굴된 핵심인자의 억제가 폐암세포의 신호 전달 경로인 JAK-STAT, MYC, NF-κB 경로를 불활성화해 면역회피에 도움을 주는 단백질들 CD38과 CD47 발현을 억제하고, 이들 분자의 억제가 암 발달을 촉진하는 순환 단핵구(Circulating monocyte)의 침윤을 억제하는 한편 항암 기능을 수행하는 M1 대식세포(M1 macrophage)의 분화를 유도하기 때문인 것으로 분석되었다.
조광현 교수는 "폐암세포가 면역회피능력을 획득하게 하는 핵심조절인자를 처음으로 찾아내 이를 제어함으로써 면역회피능을 되돌려 면역항암치료에 반응하지 않던 암의 반응을 유도해 낼 수 있는 새로운 치료전략을 개발한 것이 주요 성과”라며 말했다.
이에 "암세포내 복잡한 분자네트워크에 숨겨진 핵심인자인 DDX54를 시스템생물학이라는 IT와 BT의 융합연구를 통해 체계적으로 발굴하고 실험검증할 수 있었다”고 그 의의를 강조했다.
이번 연구에는 KAIST 공정렬 박사(제1저자), 이정은 연구원(공동 제1저자), 한영현 박사가 참여했으며, 미국 국립과학원(National Academy of Sciences, NAS)에서 출간하는 국제 저널 ‘미국국립과학원회보 (PNAS, Proceedings of the National Academy of Sciences of the United States of America)'에 4월 2일자로 게재되었다.
(논문 제목: DDX54 downregulation enhances anti-PD1 therapy in immune-desert lung tumors with high tumor mutational burden, DOI: https://doi.org/10.1073/pnas.2412310122)
본 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 받아 수행되었다.
2025.04.08 조회수 2869 ‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19 조회수 4635
‘카이랄 나노 페인트’ 기술로 항암, 코로나 치료 혁신
기존의 의료용 나노 소재는 체내에서 잘 전달되지 않거나 쉽게 분해되는 문제가 있었다. 우리 연구진은 카이랄 나노 페인트 기술로 의료용 나노 소재에 카이랄성을 부여한 자성 나노 입자를 개발했다. 그 결과 항암 온열 치료 효과가 기존보다 4배 이상 향상됐고, 약물 전달 시스템에도 적용하여 코로나 19 백신 등 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다.
신소재공학과 염지현 교수 연구팀이 바이오 나노 소재의 표면에 카이랄성*을 부여할 수 있는 ‘카이랄 나노 페인트’기술을 최초로 개발했고 후속 연구로 생명과학과 정현정 교수팀과 함께 mRNA를 전달하는 지질전달체** 표면에도 성공적으로 도입했다고 19일 밝혔다. 이 연구들은 각각 국제 학술지 ACS Nano와 ACS Applied Materials & Interfaces 에 게재됐다.
*카이랄성(Chirality): 카이랄성은 물체가 거울에 비친 모습과 겹치지 않는 성질을 의미함. 우리 몸에서도 카이랄성을 가진 분자들이 특정한 방식으로 작용하는데, 연구팀은 이를 활용해 나노 소재의 성능을 개선함
**지질전달체(Lipid Nanoparticle, LNP): mRNA, 유전자, 약물 등의 생체물질을 감싸서 세포 내부로 안전하게 전달하는 나노입자임. mRNA 백신(예: 코로나19 백신)과 같은 유전자 치료제에서 중요한 역할을 함.
염지현 교수 연구팀은 우리 몸은 왼손잡이(L-형)와 오른손잡이(D-형) 구조를 가진 분자들이 서로 다르게 작용하는 카이랄 선택성(Chiral Selectivity)에 주목하고 나노 소재의 표면에 ‘카이랄 나노 페인트’를 적용해 카이랄성을 부여하는 기술을 개발했다. 이를 통해 십수 나노미터(nm) 크기의 작은 나노 입자부터 수 마이크로미터 (μm) 크기의 큰 마이크로 구조체까지 다양한 크기의 소재에 카이랄성을 입히는 데 성공했다.
연구팀은 더 나아가 카이랄 나노 페인트 기술을 활용해 카이랄 자성 나노 입자를 합성하고, 이를 종양에 주입한 뒤 자기장 처리로 생성되는 열을 통해 종양 조직을 괴사시키는 항암 온열 치료 기술을 선보였다.
이 과정에서 D-카이랄성을 가진 자성 나노 입자가 L-카이랄성을 가진 자성 나노 입자보다 암세포에 더 많이 흡수되고, 그 결과 4배 이상 향상된 항암 치료 효과가 있음을 증명했다.
이와 같은 암세포 내부로의 흡수 효율 및 항암 치료 효율의 차이가 나노 입자 표면에 처리된 카이랄 나노 페인트와 세포 표면의 수용체 간의 ‘카이랄 선택적 상호작용’에 의한 것임을 컴퓨터 시뮬레이션과 세포 실험을 통해 밝혔다.
향후, 카이랄 나노 페인트 기술은 의료용 바이오 소재를 비롯해 차세대 약물 전달 시스템, 바이오 센서, 촉매 및 나노 효소 등 다양한 분야에 응용될 것으로 기대된다.
신소재공학과 정욱진 석박사통합과정 학생이 제1 저자인 이번 연구 결과는 지난 3월 2일 국제 학술지 ‘에이씨에스 나노(ACS Nano)’에 온라인 게재됐다. (논문명: Universal Chiral Nanopaint for Metal Oxide Biomaterials) DOI: 10.1021/acsnano.4c14460
후속 연구로 mRNA를 전달하는 지질전달체 표면에 카이랄 페인트 기술을 도입했다. mRNA 기반 치료제는 세포 내에서 단백질을 직접 합성할 수 있도록 유전 정보를 전달하는 방식이지만, 전달체의 불안정성으로 인해 치료 효과가 제한적이었다.
카이랄 나노 페인트 기술은 이러한 문제를 해결하여 mRNA 치료제의 효율성을 극대화할 수 있는 새로운 패러다임을 제시했다. 그 결과, D-카이랄성 페인트를 도입한 지질전달체를 사용한 경우 mRNA의 세포 내 발현을 2배 이상 안정적으로 증가시켰다.
이 연구는 생명과학과 이주희 연구원과 신소재공학과 정욱진 박사과정 학생이 공동 1 저자로 국제 학술지 ‘에이씨에스 응용 재료 및 인터페이스(ACS Applied Materials & Interfaces)’에 3월 17일 게재됐다. (논문명: Chirality-controlled Lipid Nanoparticles for mRNA Delivery, DOI: https://doi.org/10.1021/acsami.5c00920)
염지현 교수는 “이번 연구를 통해 바이오 나노 소재의 성능을 크게 향상시키고 다양한 크기 및 모양을 가진 혁신적 나노 소재 합성 방법론을 제시했다. 앞으로는 이러한 카이랄 나노 소재를 활용해 암, 코로나 등 다양한 질병을 예방하는 백신부터 진단 및 치료하는 차세대 바이오 플랫폼 개발 및 연구를 지속할 계획”이라고 설명했다.
이번 연구는 과학기술정보통신부의 재원으로 범부처전주기의료기기연구개발사업단, 연구재단 우수신진사업 등의 지원을 받아 수행됐다.
2025.03.19 조회수 4635 수소 경제 핵심, 세계 최고 수준 암모니아 촉매 개발
신재생 에너지를 이용한 수소 생산은 친환경 에너지 및 화학물질 생산의 핵심적인 기술이다. 하지만 이렇게 생산된 수소는 저장과 운송이 어렵기 때문에 탄소 배출이 없고, 액화가 쉬운 암모니아(NH3) 형태로 수소를 저장하려는 연구가 세계적으로 널리 진행되고 있다. 우리 연구진은 매우 낮은 온도와 압력에서도 에너지 손실 없이 암모니아를 합성할 수 있는 고성능 촉매를 개발했다.
우리 대학 생명화학공학과 최민기 교수 연구팀이 에너지 소비와 이산화탄소 배출량을 크게 줄이면서도 암모니아 생산성을 획기적으로 높일 수 있는 혁신적인 촉매 시스템을 개발했다고 11일 밝혔다.
현재 암모니아는 철(Fe) 기반 촉매를 이용해 하버-보슈 공정이라는 100년이 넘은 기술로 생산되고 있다. 하지만, 이 방식은 500℃ 이상의 고온과 100기압 이상의 고압이 필요해 엄청난 에너지를 소비하고, 세계 이산화탄소 배출량에서 상당한 비율을 차지하는 주범으로 지목됐다. 더구나 이렇게 생산된 암모니아는 대규모 공장에서 제조되기 때문에 유통 비용도 만만치 않다.
이에 대한 대안으로, 최근 물을 전기로 분해하는 기술인 수전해를 통해 생산된 그린 수소를 이용해 저온·저압(300도, 10기압)에서 암모니아를 합성하는 친환경 공정에 관한 관심이 급증하고 있다. 그러나 이러한 공정을 구현하려면 낮은 온도와 압력에서도 높은 암모니아 생산성을 확보할 수 있는 촉매 개발이 필수적이며, 현재의 기술로는 이 조건에서 암모니아 생산성이 낮아 이를 극복하는 것이 핵심 과제로 남아 있다.
연구팀은 루테늄(Ru) 촉매와 강한 염기성을 갖는 산화바륨(BaO) 입자를 전도성이 뛰어난 탄소 표면에 도입해 마치 ‘화학 축전지(chemical capacitor)*’처럼 작동하는 신개념 촉매를 개발했다.
*축전지: 전기 에너지를 +전하와 –전하로 나누어 저장하는 장치
암모니아 합성 반응 도중 수소 분자(H2)는 루테늄 촉매 위에서 수소 원자(H)로 분해 되며, 이 수소 원자는 양성자(H+)와 전자(e-) 쌍으로 한번 더 분해되게 된다. 산성을 띠는 양성자는 강한 염기성을 띠는 산화바륨에 저장되고 남은 전자는 루테늄과 탄소에 분리 저장되는 것으로 밝혀졌다.
이처럼 특이한 화학 축전 현상을 통해 전자가 풍부해진 루테늄 촉매는 암모니아 합성 반응의 핵심인 질소(N2) 분자의 분해 과정을 촉진해 촉매 활성을 비약적으로 증진시키는 것으로 밝혀졌다.
특히 이번 연구에서는 탄소의 나노구조를 조절함으로써 루테늄의 전자 밀도를 극대화해 촉매 활성을 증진시킬 수 있음을 발견했다. 이 촉매는 300도, 10기압인 온건한 조건에서 기존 최고 수준의 촉매와 비교하여 7배 이상 높은 암모니아 합성 성능을 나타냈다.
최민기 교수는 “이번 연구는 전기화학이 아닌 일반적인 열화학적 촉매 반응 과정에서도 촉매 내부의 전자 이동을 조절하면 촉매 활성을 크게 향상할 수 있음을 보여준 점에서 학계의 큰 주목을 받고 있다”고 밝혔다.
이어 “동시에 이번 연구를 통해 고성능 촉매를 활용하면 저온·저압 조건에서도 효율적인 암모니아 합성이 가능함이 확인되었다. 이를 통해 기존의 대규모 공장 중심 생산 방식에서 벗어나 분산형 소규모 암모니아 생산이 가능해지며, 친환경 수소 경제 시스템에 적합한 더욱 유연한 암모니아 생산·활용이 가능해질 것으로 기대된다.”라고 설명했다.
생명화학공학과 최민기 교수가 교신저자, 백예준 박사과정 학생이 제 1 저자로 연구에 참여하였으며, 연구 결과는 촉매 화학 분야에서 권위적인 국제 학술지인 ‘네이처 카탈리시스(Nature Catalysis)’에 지난 2월 24일 게재됐다.
(논문명 : Electron and proton storage on separate Ru and BaO domains mediated by conductive low-work-function carbon to accelerate ammonia synthesis, https://doi.org/10.1038/s41929-025-01302-z)
한편, 이 연구는 한국에너지기술연구원과 한국연구재단의 지원을 받아 수행되었다.
2025.03.11 조회수 4775
수소 경제 핵심, 세계 최고 수준 암모니아 촉매 개발
신재생 에너지를 이용한 수소 생산은 친환경 에너지 및 화학물질 생산의 핵심적인 기술이다. 하지만 이렇게 생산된 수소는 저장과 운송이 어렵기 때문에 탄소 배출이 없고, 액화가 쉬운 암모니아(NH3) 형태로 수소를 저장하려는 연구가 세계적으로 널리 진행되고 있다. 우리 연구진은 매우 낮은 온도와 압력에서도 에너지 손실 없이 암모니아를 합성할 수 있는 고성능 촉매를 개발했다.
우리 대학 생명화학공학과 최민기 교수 연구팀이 에너지 소비와 이산화탄소 배출량을 크게 줄이면서도 암모니아 생산성을 획기적으로 높일 수 있는 혁신적인 촉매 시스템을 개발했다고 11일 밝혔다.
현재 암모니아는 철(Fe) 기반 촉매를 이용해 하버-보슈 공정이라는 100년이 넘은 기술로 생산되고 있다. 하지만, 이 방식은 500℃ 이상의 고온과 100기압 이상의 고압이 필요해 엄청난 에너지를 소비하고, 세계 이산화탄소 배출량에서 상당한 비율을 차지하는 주범으로 지목됐다. 더구나 이렇게 생산된 암모니아는 대규모 공장에서 제조되기 때문에 유통 비용도 만만치 않다.
이에 대한 대안으로, 최근 물을 전기로 분해하는 기술인 수전해를 통해 생산된 그린 수소를 이용해 저온·저압(300도, 10기압)에서 암모니아를 합성하는 친환경 공정에 관한 관심이 급증하고 있다. 그러나 이러한 공정을 구현하려면 낮은 온도와 압력에서도 높은 암모니아 생산성을 확보할 수 있는 촉매 개발이 필수적이며, 현재의 기술로는 이 조건에서 암모니아 생산성이 낮아 이를 극복하는 것이 핵심 과제로 남아 있다.
연구팀은 루테늄(Ru) 촉매와 강한 염기성을 갖는 산화바륨(BaO) 입자를 전도성이 뛰어난 탄소 표면에 도입해 마치 ‘화학 축전지(chemical capacitor)*’처럼 작동하는 신개념 촉매를 개발했다.
*축전지: 전기 에너지를 +전하와 –전하로 나누어 저장하는 장치
암모니아 합성 반응 도중 수소 분자(H2)는 루테늄 촉매 위에서 수소 원자(H)로 분해 되며, 이 수소 원자는 양성자(H+)와 전자(e-) 쌍으로 한번 더 분해되게 된다. 산성을 띠는 양성자는 강한 염기성을 띠는 산화바륨에 저장되고 남은 전자는 루테늄과 탄소에 분리 저장되는 것으로 밝혀졌다.
이처럼 특이한 화학 축전 현상을 통해 전자가 풍부해진 루테늄 촉매는 암모니아 합성 반응의 핵심인 질소(N2) 분자의 분해 과정을 촉진해 촉매 활성을 비약적으로 증진시키는 것으로 밝혀졌다.
특히 이번 연구에서는 탄소의 나노구조를 조절함으로써 루테늄의 전자 밀도를 극대화해 촉매 활성을 증진시킬 수 있음을 발견했다. 이 촉매는 300도, 10기압인 온건한 조건에서 기존 최고 수준의 촉매와 비교하여 7배 이상 높은 암모니아 합성 성능을 나타냈다.
최민기 교수는 “이번 연구는 전기화학이 아닌 일반적인 열화학적 촉매 반응 과정에서도 촉매 내부의 전자 이동을 조절하면 촉매 활성을 크게 향상할 수 있음을 보여준 점에서 학계의 큰 주목을 받고 있다”고 밝혔다.
이어 “동시에 이번 연구를 통해 고성능 촉매를 활용하면 저온·저압 조건에서도 효율적인 암모니아 합성이 가능함이 확인되었다. 이를 통해 기존의 대규모 공장 중심 생산 방식에서 벗어나 분산형 소규모 암모니아 생산이 가능해지며, 친환경 수소 경제 시스템에 적합한 더욱 유연한 암모니아 생산·활용이 가능해질 것으로 기대된다.”라고 설명했다.
생명화학공학과 최민기 교수가 교신저자, 백예준 박사과정 학생이 제 1 저자로 연구에 참여하였으며, 연구 결과는 촉매 화학 분야에서 권위적인 국제 학술지인 ‘네이처 카탈리시스(Nature Catalysis)’에 지난 2월 24일 게재됐다.
(논문명 : Electron and proton storage on separate Ru and BaO domains mediated by conductive low-work-function carbon to accelerate ammonia synthesis, https://doi.org/10.1038/s41929-025-01302-z)
한편, 이 연구는 한국에너지기술연구원과 한국연구재단의 지원을 받아 수행되었다.
2025.03.11 조회수 4775 암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07 조회수 3152
암세포 사멸과 연관된 대사를 관장하는 최상위인자 규명
우리 대학 생명과학과 강석조 교수 연구팀이 3차원 종양미세환경에서 성장한 암세포에서 유래한 케모카인(Chemokine) CXCL5가 암세포의 대사 리프로그래밍(reprogramming)을 조절하며 이를 통하여 지질 과산화물의 축적으로 인해 유도되는 세포 사멸인 페롭토시스(ferroptosis)에 대한 저항성을 획득한다고 7일 밝혔다.
CXCL5는 수용체인 CXCR2와의 결합을 통해 세포의 이동(migration) 및 침습(invasion)을 촉진하는 역할을 하는 케모카인으로, 종양미세환경에서 면역세포들의 침윤에 관여함이 알려져왔다. CXCL5는 여러 암종에서 발현이 증가되어 있음이 보고되었으나 실제 3차원 종양미세환경 내 암세포에서 유래한 CXCL5의 역할에 대해서는 밝혀진 바가 없다.
강 교수 연구팀은 세포외기질의 침착과 대식세포의 침투가 특징적인 암 미세환경을 모사하는 3차원 배양 시스템을 구축해 세포 간, 세포와 세포외기질 간 상호작용 뿐 아니라 종양미세환경 내 암세포의 위치에 따라 생장에 필요한 산소와 영양분의 접근성 차이로 인한 비세포적 요소가 형성될 수 있도록 유도하였다. 연구팀은 IFNγ자극을 받은 대식세포의 분비물이 3차원 환경 특이적으로 암세포의 CXCL5 발현을 증가시킴을 확인하였고, 야생형 암세포와 CXCL5 결손 암세포의 성장을 2차원, 3차원에서 비교한 결과 암세포의 CXCL5의 발현은 3차원 성장에만 필수적임을 확인하였다.
연구팀은 2차원 배양 암세포와 3차원 배양 암세포의 유전자 발현과 대사체를 비교하여 3차원에서 광범위한 대사 과정의 리프로그래밍이 일어남을 확인하였고, CXCL5가 이런 3차원 특이적 대사 리프로그래밍을 관장하는 핵심적 역할을 수행함을 보였다. 기전적으로 CXCL5는 전사인자 HIF-1a와 MYC의 발현을 유도하여 대사 리프로그래밍을 조절하며, 특히 여러 대사 과정 중 해당과정과 1-탄소 대사과정에 영향을 주는 것을 확인하였다.
또한, 연구팀은 저해된 해당과정과 1-탄소 대사과정이 산화-환원 항상성 조절에 중요한 역할을 한다는 이전 연구결과를 바탕으로, 세포 내 산화손상 정도를 측정한 결과 CXCL5 결손 시 미토콘드리아 활성산소와 철분에 의존하여 페롭토시스를 유발하는 지질 과산화물이 증가한 것을 확인하였다. 흥미롭게도 세포자멸사(apoptosis), 염증성 세포사멸인 파이롭토시스(pyroptosis), 그리고 구리 의존적 세포사멸인 큐프롭티시스(cuproptosis)는 CXCL5 결손에 의해 영향을 받지 않는 것을 밝혔다. 또한, HIF-1a와 MYC의 과발현은 CXCL5 결손 세포에서 보이는 활성산소와 지질 과산화물의 증가를 감소시키고 효과적으로 페롭토시스를 억제함을 확인하였다. CXCL5 수용체인 CXCR2를 결손시켰을 경우 동일하게 HIF-1a와 MYC의 발현이 저해되는 것을 확인함으로써, 암세포의 CXCL5-CXCR2 경로 억제를 통한 페롭토시스의 유도는 현재 개발 중인 세포자멸사 유도제의 한계를 극복할 새로운 전략이 될 수 있음을 시사하였다.
강석조 교수는 “본 연구는 3차원 종양미세환경 특이적인 암세포 대사를 보다 광범위하게 밝히고, 암세포에서 유래한 CXCL5가 HIF-1a와 MYC의 발현을 유도하여 3차원 성장을 위한 암대사 리프로그래밍을 총괄하는 지휘자적인 역할을 수행함을 새롭게 밝힌 연구”라고 언급하면서, “본 연구 성과는 암세포 대사 과정과 세포사멸 저항성 획득의 연결고리를 끊을 수 있는 차별적인 기전을 제시함으로써 혁신적인 치료 전략을 제공할 것으로 기대한다”고 전했다.
이번 연구 결과는 세포사멸의 권위있는 국제 학술지 `셀 데쓰 앤 디퍼런시에이션(Cell Death and Differentiation)’에 3월 7일 字 온라인판으로 게재됐다 (논문명: Cancer-intrinsic Cxcl5 orchestrates a global metabolic reprogramming for resistance to oxidative cell death in 3D). KAIST 생명과학과 서라민 박사가 제 1저자로 연구를 주도하였고, 서울대학교 Arvie Camille V. de Guzman 박사와 박성혁 교수, 그리고 한국표준과학연구원의 이지연 박사가 함께 연구에 참여하였다.
이번 연구는 한국연구재단의 바이오∙의료기술개발사업과 개인기초연구사업(중견연구) 지원을 받아 수행됐다.
2025.03.07 조회수 3152 암세포 발생 순간 되돌리는 분자스위치 발견
조광현 교수 연구팀은 암세포를 죽이지 않고 그 상태만을 변환시켜 정상 세포와 유사한 상태로 되돌리는 암 가역 치료 원천기술을 개발한 바 있다. 이번에는 정상세포가 암세포로 변화되는 순간의 유전자 네트워크에 암 가역화를 유도할 수 있는 분자스위치가 숨겨져 있음을 최초로 밝히는데 성공하였다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 정상세포에서 암세포로 변화하는 순간의 임계 전이(臨界轉移, critical transition) 현상을 포착하고 이를 분석해 암세포를 다시 정상세포로 되돌릴 수 있는 분자스위치를 발굴하는 기술 개발에 성공했다고 5일 밝혔다.
임계 전이란 물이 섭씨 100도에서 증기로 변하는 것처럼 특정 시점에 갑작스러운 상태변화가 일어나는 현상을 말한다. 정상세포가 유전적, 후성유전적 변화의 축적으로 인해 특정 시점에 암세포로 변화되는 과정에도 이러한 임계 전이 현상이 나타난다.
연구팀은 암 발생 과정에서 정상세포가 암세포로 전환되기 직전, 정상세포와 암세포들이 공존하는 불안정한 임계 전이 상태에 놓일 수 있음을 발견하고 이러한 임계 전이 상태를 시스템생물학 방법으로 분석해 암화 과정을 역전시킬 수 있는 암 가역화 분자스위치 발굴 기술을 개발했다. 그리고 이를 대장암세포에 적용해 암세포가 정상세포의 특징을 회복할 수 있음을 분자세포실험으로 확인했다.
암 발생의 임계 전이를 관장하는 유전자 네트워크의 컴퓨터 모델을 단일세포 유전자 발현 데이터로부터 자동 추론해내고 이를 시뮬레이션 분석해 암 가역화 분자스위치를 체계적으로 찾아내는 원천기술을 개발한 것이어서 향후 다른 암종의 가역 치료제 개발에도 응용될 수 있을 것으로 기대된다.
조광현 교수는 "정상세포가 되돌릴 수 없는 암세포 상태로 변화되기 직전의 임계 전이 순간을 포착해 암세포의 운명을 다시 정상세포 상태로 되돌릴 수 있는 분자스위치를 발굴해 낸 것이다ˮ라고 말했다.
이어 “특히 이번 연구에서는 그동안 수수께끼로 여겨졌던 암 발생 과정 이면의 세포 내에 어떠한 변화가 일어나는지를 유전자 네트워크 차원에서 상세히 밝혀냈다”며 “암세포의 운명을 다시 정상세포로 되돌릴 수 있는 중요한 단서가 바로 이러한 변화의 순간에 숨어있다는 것을 처음으로 규명한 연구다”라고 강조했다.
우리 대학 신동관 박사(現 국립암센터), 공정렬 박사, 정서윤 박사과정 학생 등이 참여했으며 서울대학교 연구팀이 대장암 환자 오가노이드(체외배양조직)를 제공해 진행된 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 1월 22일 字 온라인판 논문으로 출판됐다. (논문명: Attractor landscape analysis reveals a reversion switch in the transition of colorectal tumorigenesis) (DOI: https://doi.org/10.1002/advs.202412503)
한편 이번 연구는 과학기술정보통신부 한국연구재단의 중견연구사업과 기초연구실사업, 그리고 보건복지부 한국보건산업진흥원의 질병중심 중개연구사업의 지원을 통해 수행됐다.
2025.02.05 조회수 8170
암세포 발생 순간 되돌리는 분자스위치 발견
조광현 교수 연구팀은 암세포를 죽이지 않고 그 상태만을 변환시켜 정상 세포와 유사한 상태로 되돌리는 암 가역 치료 원천기술을 개발한 바 있다. 이번에는 정상세포가 암세포로 변화되는 순간의 유전자 네트워크에 암 가역화를 유도할 수 있는 분자스위치가 숨겨져 있음을 최초로 밝히는데 성공하였다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 정상세포에서 암세포로 변화하는 순간의 임계 전이(臨界轉移, critical transition) 현상을 포착하고 이를 분석해 암세포를 다시 정상세포로 되돌릴 수 있는 분자스위치를 발굴하는 기술 개발에 성공했다고 5일 밝혔다.
임계 전이란 물이 섭씨 100도에서 증기로 변하는 것처럼 특정 시점에 갑작스러운 상태변화가 일어나는 현상을 말한다. 정상세포가 유전적, 후성유전적 변화의 축적으로 인해 특정 시점에 암세포로 변화되는 과정에도 이러한 임계 전이 현상이 나타난다.
연구팀은 암 발생 과정에서 정상세포가 암세포로 전환되기 직전, 정상세포와 암세포들이 공존하는 불안정한 임계 전이 상태에 놓일 수 있음을 발견하고 이러한 임계 전이 상태를 시스템생물학 방법으로 분석해 암화 과정을 역전시킬 수 있는 암 가역화 분자스위치 발굴 기술을 개발했다. 그리고 이를 대장암세포에 적용해 암세포가 정상세포의 특징을 회복할 수 있음을 분자세포실험으로 확인했다.
암 발생의 임계 전이를 관장하는 유전자 네트워크의 컴퓨터 모델을 단일세포 유전자 발현 데이터로부터 자동 추론해내고 이를 시뮬레이션 분석해 암 가역화 분자스위치를 체계적으로 찾아내는 원천기술을 개발한 것이어서 향후 다른 암종의 가역 치료제 개발에도 응용될 수 있을 것으로 기대된다.
조광현 교수는 "정상세포가 되돌릴 수 없는 암세포 상태로 변화되기 직전의 임계 전이 순간을 포착해 암세포의 운명을 다시 정상세포 상태로 되돌릴 수 있는 분자스위치를 발굴해 낸 것이다ˮ라고 말했다.
이어 “특히 이번 연구에서는 그동안 수수께끼로 여겨졌던 암 발생 과정 이면의 세포 내에 어떠한 변화가 일어나는지를 유전자 네트워크 차원에서 상세히 밝혀냈다”며 “암세포의 운명을 다시 정상세포로 되돌릴 수 있는 중요한 단서가 바로 이러한 변화의 순간에 숨어있다는 것을 처음으로 규명한 연구다”라고 강조했다.
우리 대학 신동관 박사(現 국립암센터), 공정렬 박사, 정서윤 박사과정 학생 등이 참여했으며 서울대학교 연구팀이 대장암 환자 오가노이드(체외배양조직)를 제공해 진행된 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 1월 22일 字 온라인판 논문으로 출판됐다. (논문명: Attractor landscape analysis reveals a reversion switch in the transition of colorectal tumorigenesis) (DOI: https://doi.org/10.1002/advs.202412503)
한편 이번 연구는 과학기술정보통신부 한국연구재단의 중견연구사업과 기초연구실사업, 그리고 보건복지부 한국보건산업진흥원의 질병중심 중개연구사업의 지원을 통해 수행됐다.
2025.02.05 조회수 8170 암세포를 정상세포로 되돌려 치료하는 원천기술 개발
지금까지 다양한 항암 치료 기술이 개발됐음에도 현재 시행되고 있는 모든 항암치료의 공통점은 암세포를 사멸시켜서 치료하는 것을 목표로 하고 있다. 이로 인해 암세포가 내성을 획득해 재발하거나 정상세포까지 사멸시켜 큰 부작용을 유발하는 등 근본적인 한계를 지니고 있다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암세포를 죽이지 않고 그 상태만을 변환시켜 정상 대장세포와 유사한 상태로 되돌림으로써 부작용 없이 치료할 수 있는 대장암 가역 치료를 위한 원천기술을 개발하였다고 22일 밝혔다.
연구팀은 정상세포의 암화 과정에서 정상적인 세포분화 궤적을 역행한다는 관찰 결과에 주목하고, 이를 기반으로 정상세포의 분화궤적에 대한 유전자네트워크의 디지털트윈을 제작하는 기술을 개발했다.
그리고 이를 시뮬레이션 분석해 정상세포 분화를 유도하는 마스터 분자스위치를 체계적으로 탐색해 발굴한 뒤 대장암세포에 적용했을 때 대장암세포의 상태가 정상화된다는 것을 분자세포 실험과 동물실험을 통해 입증했다.
이번 연구성과는 암세포를 정상세포로 가역화 하는 것이 우연한 현상적 발견에 의존하는 것이 아니라 암세포 유전자 네트워크의 디지털 트윈을 제작하고 분석함으로써 체계적으로 접근해 이루어낼 수 있음을 보인 원천기술 개발이며 이 기술을 다른 다양한 암종에 응용하여 암 가역 치료제 개발이 가능함을 제시한 것에 큰 의미가 있다.
조광현 교수는 "암세포가 정상세포로 변환될 수 있다는 것은 놀라운 현상이다. 이번 성과는 이를 체계적으로 유도해낼 수 있음을 증명한 것이다ˮ라고 말했다.
이어 “이번 연구 결과는 암세포를 정상세포로 되돌리는 가역 치료 개념을 최초로 제시한 성과들을 바탕으로 정상세포의 분화궤적을 체계적으로 분석해 암 가역화 치료타겟을 발굴하는 원천기술을 개발한 것이다”라고 강조했다.
우리 대학 공정렬 박사, 이춘경 박사과정 학생, 김훈민 박사과정 학생, 김주희 박사과정 학생 등이 참여한 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 12월 11일 字 온라인판 논문으로 출판됐다. (논문명: Control of cellular differentiation trajectories for cancer reversion) DOI: https://doi.org/10.1002/advs.202402132
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 통해 수행되었으며 연구 성과는 바이오리버트(주)로 기술이전 되어 실제 암 가역치료제 개발에 활용될 예정이다.
2024.12.23 조회수 10145
암세포를 정상세포로 되돌려 치료하는 원천기술 개발
지금까지 다양한 항암 치료 기술이 개발됐음에도 현재 시행되고 있는 모든 항암치료의 공통점은 암세포를 사멸시켜서 치료하는 것을 목표로 하고 있다. 이로 인해 암세포가 내성을 획득해 재발하거나 정상세포까지 사멸시켜 큰 부작용을 유발하는 등 근본적인 한계를 지니고 있다.
우리 대학 바이오및뇌공학과 조광현 교수 연구팀이 대장암세포를 죽이지 않고 그 상태만을 변환시켜 정상 대장세포와 유사한 상태로 되돌림으로써 부작용 없이 치료할 수 있는 대장암 가역 치료를 위한 원천기술을 개발하였다고 22일 밝혔다.
연구팀은 정상세포의 암화 과정에서 정상적인 세포분화 궤적을 역행한다는 관찰 결과에 주목하고, 이를 기반으로 정상세포의 분화궤적에 대한 유전자네트워크의 디지털트윈을 제작하는 기술을 개발했다.
그리고 이를 시뮬레이션 분석해 정상세포 분화를 유도하는 마스터 분자스위치를 체계적으로 탐색해 발굴한 뒤 대장암세포에 적용했을 때 대장암세포의 상태가 정상화된다는 것을 분자세포 실험과 동물실험을 통해 입증했다.
이번 연구성과는 암세포를 정상세포로 가역화 하는 것이 우연한 현상적 발견에 의존하는 것이 아니라 암세포 유전자 네트워크의 디지털 트윈을 제작하고 분석함으로써 체계적으로 접근해 이루어낼 수 있음을 보인 원천기술 개발이며 이 기술을 다른 다양한 암종에 응용하여 암 가역 치료제 개발이 가능함을 제시한 것에 큰 의미가 있다.
조광현 교수는 "암세포가 정상세포로 변환될 수 있다는 것은 놀라운 현상이다. 이번 성과는 이를 체계적으로 유도해낼 수 있음을 증명한 것이다ˮ라고 말했다.
이어 “이번 연구 결과는 암세포를 정상세포로 되돌리는 가역 치료 개념을 최초로 제시한 성과들을 바탕으로 정상세포의 분화궤적을 체계적으로 분석해 암 가역화 치료타겟을 발굴하는 원천기술을 개발한 것이다”라고 강조했다.
우리 대학 공정렬 박사, 이춘경 박사과정 학생, 김훈민 박사과정 학생, 김주희 박사과정 학생 등이 참여한 이번 연구 결과는 와일리(Wiley)에서 출간하는 국제저널 `어드밴스드 사이언스(Advanced Science)' 12월 11일 字 온라인판 논문으로 출판됐다. (논문명: Control of cellular differentiation trajectories for cancer reversion) DOI: https://doi.org/10.1002/advs.202402132
한편 이번 연구는 과학기술정보통신부와 한국연구재단의 중견연구사업 및 기초연구실사업의 지원을 통해 수행되었으며 연구 성과는 바이오리버트(주)로 기술이전 되어 실제 암 가역치료제 개발에 활용될 예정이다.
2024.12.23 조회수 10145 항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 4853
항암 면역세포를 체내에서 직접 만들 수 있다
우리 연구진이 종양 조직에서 세포를 분리하고 증식시키는 과정이 매우 복잡하고 시간이 많이 소요되며 고비용으로 인해 환자 접근성이 떨어지는 기존 항암 세포치료 방식의 한계를 극복하면서, 동시에 항암 세포치료제의 강력한 치료 효능을 기대할 수 있는 새로운 암 치료 방식을 개발하여 화제다.
우리 대학 바이오및뇌공학과 박지호 교수 연구팀이 항암 세포치료제의 항암 치료 효과를 체내에서 구현할 수 있는 mRNA 치료제를 개발했다고 11일 밝혔다.
연구팀이 개발한 해당 치료제는 강력한 암세포 사멸 능력을 기반으로 현재 유망한 항암 세포치료제로 개발되고 있는 종양 침윤 T세포를 종양 내에서 직접 증식시켜 항암효과를 유도할 수 있다.
개발된 치료제는 기존 세포치료제 대비 뛰어난 환자 접근성을 기반으로 대장암, 피부암과 같은 다양한 고형암 치료에 적용될 수 있을 것으로 기대된다.
연구팀은 종양 침윤 T세포의 효과적인 증식 및 높은 항암효과를 유도하기 위해 세포막에 발현하는 CD3 항체를 암호화하는 mRNA를 종양 조직 내 대식세포와 암세포에 전달했다.
또한, 암세포의 세포막에 발현된 항 CD3 항체는 현재 항암 치료제로 사용되어 종양 침윤 T세포의 암세포 상호작용 및 암세포 사멸 능력을 증진해 효과적인 항암 치료를 유도한다.
연구팀은 개발한 mRNA 치료제를 다양한 고형암 동물 모델에 종양 내 투여했을 때 부작용 없이 종양 침윤 T세포, 특히 암세포를 직접 사멸할 수 있음을 확인했다.
더 나아가 연구팀은 면역세포가 암세포를 효과적으로 공격하게 도와주는 PD-1 면역항암제가 잘 듣지 않는다고 알려진 흑색종 동물 모델에 개발한 mRNA 치료제와 PD-1 면역항암제를 병용 처리했을 때, 상승적 항암 치료 효과가 나타나는 것을 확인했다.
박지호 교수는 “이번 연구에서 기존에 체외에서 고비용으로 긴 시간 준비되어서 환자에게 주입되는 항암 세포치료제를 종양 내 mRNA 주입만으로 체내에서 구현할 수 있는 새로운 개념의 항암 mRNA 치료제를 제시했다”고 말했다.
이어 “기존 항암 치료제들로 치료하기 어려워 방법이 없던 고형암 환자들에게 새로운 치료법을 제시할 수 있다는 점에서 큰 의의를 가진다”고 강조했다.
바이오및뇌공학과 윤준용 박사와 에린 파간(Erinn Fagan) 석사과정이 제1 저자로 참여한 이번 연구 결과는 나노기술 분야 국제학술지 ‘ACS 나노(Nano)에 11월 11일 게재됐다.
(논문명: In Situ Tumor-Infiltrating Lymphocyte Therapy by Local Delivery of an mRNA Encoding Membrane-Anchored Anti-CD3 Single-Chain Variable Fragment)
DOI: 10.1021/acsnano.4c03518
이번 연구는 한국연구재단의 중견연구자지원사업의 지원을 받아 수행됐다.
2024.12.11 조회수 4853 암흑 물질 액시온 탐색 가능성 획기적 높여
암흑 물질이란 질량은 있으나 관측이 불가능한 미지의 물질을 말하며, 우주 전체 에너지의 약 27% 정도를 차지하고 있다. 암흑 물질을 연구하는 주된 이유는 우주의 구조와 진화의 비밀을 밝히고 이를 통해 우주의 형성과 모습을 이해하고자 함이다. 한국 연구진이 암흑 물질 후보로 알려진 액시온의 탐색 효율을 크게 향상시킬 고주파 공진기 튜닝 기술을 개발했다.
우리 대학 물리학과 야니스 세메르치디스 교수 연구팀이 기초과학연구원(IBS)(원장 노도영) 산하 액시온 및 극한상호작용 연구단(이하 CAPP)(단장 야니스 세메르치디스)과 협력해 메타물질*을 이용, 암흑 물질인 액시온의 탐색 범위를 효율적으로 확장할 방법을 구현했다고 25일 밝혔다.
*메타물질: 아직 자연에서 발견되지 않은 특성을 갖도록 인공적으로 설계한 물질을 말함.
암흑물질의 존재와 더불어 또 다른 미스터리는 ‘오늘날 우주가 왜 물질로만 이루어져 있는가?’라는 점이다. 초기 우주에서는 물질과 반물질이 거의 같은 양으로 생성되었을 것이라 추정하고 있다. 따라서, 현재의 우주에 대해, 입자물리학에서는 물질이 반물질보다 압도적으로 우세한 이런 물질-반물질의 불균형을 CP*라고 불리는 대칭성의 깨짐으로 설명하려고 한다. *CP: 전하(Charge)와 공간 반전(Parity)
액시온은 강한 상호작용에서 발생하는 이 특정 대칭 불균형과 관련된 문제, 즉 대칭성이 깨져있을 거라는 이론적 예측과 이 대칭성이 보존되는 것처럼 보인다는 실험적 관측 사이의 차이를 해결해 줄 수 있는 가상의 입자이다. 즉, 액시온 입자의 존재는 우주의 물질-반물질 불균형과 암흑물질이라는 두 가지 근본적인 미스터리를 동시에 해결할 열쇠가 될 수 있다.
암흑 물질 액시온은 그 고유한 진동 주파수에 맞는 공진기를 통해 탐색할 수 있으며, 최근 암흑 물질 액시온의 질량을 예측하려는 이론적 연구들에 따르면, 현재 민감한 실험들이 다루고 있는 영역보다 더 높은 주파수대에서 탐색이 필요하다는 전망이 제기되고 있다.
이에 따라 고주파 탐색의 필요성이 대두되면서 다양한 공진기 개발이 이뤄졌고 고주파 액시온 탐색에서 높은 효율을 기대할 수 있게 됐지만, 고차 공명 모드를 효과적으로 튜닝할 방법은 여전히 부족한 상황이다.
이에 연구팀은 음팽창 메타물질 구조를 활용해 회전 운동을 2차원 팽창 및 수축 운동으로 전환하는 새로운 튜닝 메커니즘을 개발했다. 키리가미(kirigami)라는 종이접기/자르기 방식에서 영감을 얻은 음팽창 메타물질 구조체는 특유의 결합 배열 덕분에, 한쪽 면에 팽창·수축하는 힘이 가해질 때 다른 면도 함께 팽창·수축하는 특성을 갖는다.
이러한 성질을 이용하면 구조체의 중심이 회전할 때 전체 구조가 팽창하거나 수축하는 움직임으로 변환된다. 이를 통해 간단한 1차원 회전 움직임을 더 복잡한 2차원 움직임으로 확장할 수 있는 혁신적인 구조가 만들어진다.
또한 저온 환경에서 음팽창 구조체의 효율적인 움직임을 위해 기어 구조를 도입해 힘을 보강했다. 이를 통해 극저온 환경에서도 최소한의 힘과 열 발생으로 구조체를 효과적으로 구동하며 주파수를 조정할 수 있었다.
연구팀은 육각 음팽창 구조를 유전체 튜닝 구조체로 고려하고, 이를 공진기의 적용해 주파수를 효과적으로 조정할 수 있음을 확인했다. 나아가 이 공진기를 극저온으로 냉각한 상태에서 9T(테슬라, 자기장의 강도를 나타내는 단위, 1T는 지구 자기장의 약 2만 배) 자기장을 인가해 실제 액시온 검출 실험을 수행했고, 기존 민감도를 두 배로 향상하는 성과를 거뒀다.
연구팀이 개발한 이 독특한 구조체는 극저온과 강한 자기장 환경에서도 작동 가능한 메타물질 기반 주파수 조정 장치로, 향후 고주파 영역의 암흑 물질 액시온 탐색에 적극 활용될 것으로 기대된다. 또한, 이 시스템은 극한의 저온·고자기장 환경에서 로보틱스 분야로도 확장될 잠재력을 가지고 있다.
제1 저자인 KAIST 배성재 박사과정 학생은 “이 결과는 고차 공명모드를 실용적으로 활용할 수 있는 튜닝 메커니즘의 입증을 통해 고주파 액시온 탐색에 새로운 방향을 제시한 것”이라고 밝혔으며, 공동 제1 저자인 IBS 정준우 박사후 연구원은 “궁극적으로 액시온 암흑 물질의 비밀을 풀기 위해 보다 포괄적이고 효과적인 탐색 전략의 돌파구를 마련했다”라고 덧붙였다.
물리학과 배성재 박사과정과 IBS-CAPP 정준우 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘피지컬 리뷰 레터스(Physical Review Letters)’ 11월 22일 133호에 게재됐다. (논문명 : Search for Dark Matter Axions with Tunable TM020 mode)
한편 이번 연구는 기초과학연구원의 지원을 받아 수행됐다.
2024.11.25 조회수 3432
암흑 물질 액시온 탐색 가능성 획기적 높여
암흑 물질이란 질량은 있으나 관측이 불가능한 미지의 물질을 말하며, 우주 전체 에너지의 약 27% 정도를 차지하고 있다. 암흑 물질을 연구하는 주된 이유는 우주의 구조와 진화의 비밀을 밝히고 이를 통해 우주의 형성과 모습을 이해하고자 함이다. 한국 연구진이 암흑 물질 후보로 알려진 액시온의 탐색 효율을 크게 향상시킬 고주파 공진기 튜닝 기술을 개발했다.
우리 대학 물리학과 야니스 세메르치디스 교수 연구팀이 기초과학연구원(IBS)(원장 노도영) 산하 액시온 및 극한상호작용 연구단(이하 CAPP)(단장 야니스 세메르치디스)과 협력해 메타물질*을 이용, 암흑 물질인 액시온의 탐색 범위를 효율적으로 확장할 방법을 구현했다고 25일 밝혔다.
*메타물질: 아직 자연에서 발견되지 않은 특성을 갖도록 인공적으로 설계한 물질을 말함.
암흑물질의 존재와 더불어 또 다른 미스터리는 ‘오늘날 우주가 왜 물질로만 이루어져 있는가?’라는 점이다. 초기 우주에서는 물질과 반물질이 거의 같은 양으로 생성되었을 것이라 추정하고 있다. 따라서, 현재의 우주에 대해, 입자물리학에서는 물질이 반물질보다 압도적으로 우세한 이런 물질-반물질의 불균형을 CP*라고 불리는 대칭성의 깨짐으로 설명하려고 한다. *CP: 전하(Charge)와 공간 반전(Parity)
액시온은 강한 상호작용에서 발생하는 이 특정 대칭 불균형과 관련된 문제, 즉 대칭성이 깨져있을 거라는 이론적 예측과 이 대칭성이 보존되는 것처럼 보인다는 실험적 관측 사이의 차이를 해결해 줄 수 있는 가상의 입자이다. 즉, 액시온 입자의 존재는 우주의 물질-반물질 불균형과 암흑물질이라는 두 가지 근본적인 미스터리를 동시에 해결할 열쇠가 될 수 있다.
암흑 물질 액시온은 그 고유한 진동 주파수에 맞는 공진기를 통해 탐색할 수 있으며, 최근 암흑 물질 액시온의 질량을 예측하려는 이론적 연구들에 따르면, 현재 민감한 실험들이 다루고 있는 영역보다 더 높은 주파수대에서 탐색이 필요하다는 전망이 제기되고 있다.
이에 따라 고주파 탐색의 필요성이 대두되면서 다양한 공진기 개발이 이뤄졌고 고주파 액시온 탐색에서 높은 효율을 기대할 수 있게 됐지만, 고차 공명 모드를 효과적으로 튜닝할 방법은 여전히 부족한 상황이다.
이에 연구팀은 음팽창 메타물질 구조를 활용해 회전 운동을 2차원 팽창 및 수축 운동으로 전환하는 새로운 튜닝 메커니즘을 개발했다. 키리가미(kirigami)라는 종이접기/자르기 방식에서 영감을 얻은 음팽창 메타물질 구조체는 특유의 결합 배열 덕분에, 한쪽 면에 팽창·수축하는 힘이 가해질 때 다른 면도 함께 팽창·수축하는 특성을 갖는다.
이러한 성질을 이용하면 구조체의 중심이 회전할 때 전체 구조가 팽창하거나 수축하는 움직임으로 변환된다. 이를 통해 간단한 1차원 회전 움직임을 더 복잡한 2차원 움직임으로 확장할 수 있는 혁신적인 구조가 만들어진다.
또한 저온 환경에서 음팽창 구조체의 효율적인 움직임을 위해 기어 구조를 도입해 힘을 보강했다. 이를 통해 극저온 환경에서도 최소한의 힘과 열 발생으로 구조체를 효과적으로 구동하며 주파수를 조정할 수 있었다.
연구팀은 육각 음팽창 구조를 유전체 튜닝 구조체로 고려하고, 이를 공진기의 적용해 주파수를 효과적으로 조정할 수 있음을 확인했다. 나아가 이 공진기를 극저온으로 냉각한 상태에서 9T(테슬라, 자기장의 강도를 나타내는 단위, 1T는 지구 자기장의 약 2만 배) 자기장을 인가해 실제 액시온 검출 실험을 수행했고, 기존 민감도를 두 배로 향상하는 성과를 거뒀다.
연구팀이 개발한 이 독특한 구조체는 극저온과 강한 자기장 환경에서도 작동 가능한 메타물질 기반 주파수 조정 장치로, 향후 고주파 영역의 암흑 물질 액시온 탐색에 적극 활용될 것으로 기대된다. 또한, 이 시스템은 극한의 저온·고자기장 환경에서 로보틱스 분야로도 확장될 잠재력을 가지고 있다.
제1 저자인 KAIST 배성재 박사과정 학생은 “이 결과는 고차 공명모드를 실용적으로 활용할 수 있는 튜닝 메커니즘의 입증을 통해 고주파 액시온 탐색에 새로운 방향을 제시한 것”이라고 밝혔으며, 공동 제1 저자인 IBS 정준우 박사후 연구원은 “궁극적으로 액시온 암흑 물질의 비밀을 풀기 위해 보다 포괄적이고 효과적인 탐색 전략의 돌파구를 마련했다”라고 덧붙였다.
물리학과 배성재 박사과정과 IBS-CAPP 정준우 박사가 공동 제1 저자로 참여한 이번 연구는 국제 학술지 ‘피지컬 리뷰 레터스(Physical Review Letters)’ 11월 22일 133호에 게재됐다. (논문명 : Search for Dark Matter Axions with Tunable TM020 mode)
한편 이번 연구는 기초과학연구원의 지원을 받아 수행됐다.
2024.11.25 조회수 3432 난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 5852
난치성 뇌종양 치료의 새로운 가능성 열다
면역항암제는 암세포를 제거하는 T세포의 항암 면역작용을 강화하는 가장 주목받는 항암치료 요법이다. 하지만 난치성 뇌종양인 교모세포종의 경우 면역관문억제제를 활용한 수차례 임상시험에서 그 효과를 확인할 수 없었다. 우리 연구진이 난치성 암종에서 T세포가 만성적 항원에 노출되어 기능이 상실되거나 약화된 원인을 분석하여 T세포 활성 제어 인자를 발굴하고 치료 효능 증진 원리를 규명했다.
우리 대학 생명과학과 이흥규 교수 연구팀이 한국화학연구원(원장 이영국) 감염병예방진단기술연구센터와 협력하여, 교모세포종 실험 쥐 모델에서 억제성 Fc 감마수용체(FcγRIIB)의 결손을 통한 면역관문억제제의 세포독성 T세포 불응성을 회복해, 항암 작용 증대를 유도함으로 생존율 개선 효능을 확인했다고 6일 밝혔다.
연구팀은 최근 세포독성 T세포에서 발견된 억제 수용체(FcγRIIB)가 종양 침윤 세포독성 T세포의 특성과 면역관문억제제(항 PD-1)의 치료 효능에 미치는 영향을 확인했다.
연구 결과, 억제 수용체(FcγRIIB)가 결손되었을때 종양항원 특이적 기억 T세포의 증가를 유도했다. 이 같은 T세포 아형은 탈진화를 억제하고 줄기세포 특성을 강화했고, 이를 통한 항 PD-1 치료의 회복된 T세포 항암 면역반응을 이끌었다. 또한, 연구팀은 항원 특이적 기억 T세포가 FcγRIIB 결손 시 상대적으로 높은 수의 증가와 함께 지속적인 종양 조직 내 T세포 침투를 이끈다는 결과를 확인했다.
해당 연구는 면역관문억제제에 불응성을 보이는 종양에 대한 새로운 치료 타깃을 제시했으며, 특히 교모세포종과 같은 항 PD-1 치료에 반응하지 않는 종양에 FcγRIIB 억제와 항 PD-1 치료를 병행함으로써 시너지 효과를 발휘할 수 있음을 증명했다.
연구팀은 이러한 FcγRIIB 억제를 통한 항암 면역작용 증진 전략이 면역관문억제제의 효능을 높이는 데 중요한 기여를 할 것으로 기대하고 있다.
생명과학과 이흥규 교수는 “면역관문 치료제를 이용한 뇌종양 치료 임상 실패를 극복할 가능성과 다른 난치성 종양으로의 범용적 적용 가능성을 제시한 결과로 추후 세포독성 T 세포의 종양 세포치료 활용과 접근 가능성도 확인한 결과”라고 소개했다.
우리 대학 구근본 박사(現, 한국화학연구원 감염병예방진단기술연구센터 선임연구원)가 제1 저자로 참여한 이번 연구는 암 면역치료 학회(Society for Immunotherapy of Cancer)에서 발간하는 종양면역 및 치료 분야 국제 학술지 `Journal for ImmunoTherapy of Cancer'에 10월 26일 온라인판에 게재됐다. (논문명: Inhibitory Fcγ receptor deletion enhances CD8 T cell stemness increasing anti-PD-1 therapy responsiveness against glioblastoma, http://dx.doi.org/10.1136/jitc-2024-009449)
한편 이번 연구는 한국연구재단 개인기초연구사업, 바이오의료기술개발사업 및 삼성미래육성재단의 지원을 받아 수행됐다.
2024.11.06 조회수 5852