%EC%95%94+%EC%9C%A0%EB%B0%9C
-
 암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7269
암 유발 물질 컴퓨터로 예측하다
암은 정상세포와 다르게 세포 내 비정상적인 축적을 통해 유발되는 대사 반응을 하며, 암의 치료 및 진단을 목적으로 이런 암 대사반응에 대해 다방면으로 연구되고 있다. 이에 우리 대학 연구진이 컴퓨터를 통해 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델 구축에 성공했다.
우리 대학 생명화학공학과 김현욱 교수, 이상엽 특훈교수 연구팀이 서울대학교병원 고영일 교수, 윤홍석 교수 및 정창욱 교수 연구팀과의 공동연구를 통해, 암 체세포 유전자 돌연변이와 연관된 새로운 대사물질 및 대사경로를 예측하는 컴퓨터 방법론을 개발했다고 18일 밝혔다.
최근 암 유발 대사물질(oncometabolite)*의 발견과 이를 표적으로 하는 신약들이 미국식품의약국(FDA)의 승인을 받으며 주목받고 있는데, 이에는 급성 골수성 백혈병의 치료제로 사용되고 있는 ‘팁소보(성분명: 아이보시데닙)’ 및 약물 ‘아이드하이파(성분명: 에나시데닙)’가 포함된다.
*암 유발 대사물질 (oncometabolite): 세포 내 비정상적인 축적을 통해 암을 유발하는 대사물질. 이러한 대사물질들은 특정 유전자 돌연변이의 영향으로 대사 과정 중에 비정상적으로 높은 농도로 축적되며, 이러한 축적은 암세포의 성장과 생존을 촉진함. 기존 연구에서 확인된 주요 암 유발 대사물질로는 2-하이드록시글루타레이트(2-hydroxyglutarate), 숙시네이트(succinate), 푸마레이트(fumarate) 등이 보고됨.
하지만, 암 대사 연구와 새로운 암 유발 대사물질 발굴에는 대사체학 등의 방법론이 필요하며, 이를 대규모 환자 샘플에 적용하기 위해서는 상당한 시간과 비용이 소요된다. 이러한 이유로, 암과 관련된 많은 유전자 돌연변이들이 밝혀졌음에도, 그에 상응하는 암 유발 대사물질은 극소수만 알려져 있다.
김현욱 교수 공동연구팀은 세포 대사 정보를 예측할 수 있는 게놈 수준의 대사 모델*에 국제 암 연구 컨소시엄에서 공개하고 있는 암 환자들의 전사체 데이터를 통합해, 24개 암종에 해당하는 1,043명의 암 환자에 대한 대사 모델을 성공적으로 구축했다.
*게놈 수준의 대사모델: 세포의 전체 대사 네트워크를 다루는 컴퓨터 모델로서, 세포 내 모든 대사반응에 대한 정보가 담겨 있으며, 다양한 조건에서 세포의 대사 활성을 예측하는 것이 가능
공동연구팀은 1,043명의 암 환자 특이 대사 모델과 동일 환자들의 암 체세포 돌연변이 데이터를 활용해, 다음의 4단계로 구성된 컴퓨터 방법론을 개발했다 (그림 1). 첫 단계에서는 암 환자 특이 대사 모델을 시뮬레이션해, 환자 별로 모든 대사물질들의 활성을 예측한다. 두 번째 단계로는 특정 유전자 돌연변이가 앞서 예측된 대사물질의 활성에 유의한 차이를 일으키는 짝을 선별한다. 세 번째 단계로, 특정 유전자 돌연변이와 연결된 대사물질들을 대상으로, 이들과 유의하게 연관된 대사경로를 추가로 선별한다. 마지막 단계로서, ‘유전자-대사물질-대사경로’ 조합을 완성해, 컴퓨터 방법론 결과로써 도출하게 된다.
이번 논문의 공동 제1 저자인 이가령 박사(現 다나파버 암센터 및 하버드 의과대학 박사후연구원)와 이상미 박사(現 하버드 의과대학 박사후연구원)는 “이번 연구에서 개발된 방법론은 암 환자 코호트의 돌연변이 및 전사체 데이터를 토대로 다른 암종에 대해서도 쉽게 적용될 수 있으며, 유전자 돌연변이가 대사경로를 통해 어떻게 세포대사에 변화를 일으키는지 체계적으로 예측할 수 있는 최초의 컴퓨터 방법론이라는 데 큰 의의가 있다” 한다고 말했다.
또한 김현욱 교수는 “이번 공동연구의 결과는 향후 암 대사 및 암 유발 대사물질 연구에서 중요한 참고 자료로 활용될 수 있을 것”이라고 강조했다.
한편 이번 논문은 바이오메드 센트럴(BioMed Central) 社가 발행하며, 생명공학 및 유전학 분야의 대표적 국제학술지인 게놈 바이올로지(Genome Biology, JCR 분야 상위 5% 이내)에 게재됐다.
※ 논문명 : Prediction of metabolites associated with somatic mutations in cancers by using genome-scale metabolic models and mutation data
※ 저자 정보 : 이가령(한국과학기술원, 공동 제1 저자), 이상미(한국과학기술원, 공동 제1 저자), 이성영(서울대학교병원, 공동저자), 정창욱(서울대학교병원, 공동저자), 송효진(서울대학교병원, 공동저자), 이상엽(한국과학기술원, 공동저자), 윤홍석(서울대학교병원, 교신저자), 고영일(서울대학교병원, 교신저자), 김현욱(한국과학기술원, 교신저자) 포함 총 9명
이번 연구는 과학기술정보통신부 한국연구재단의 지원을 받아 수행됐다.
2024.03.18 조회수 7269 -
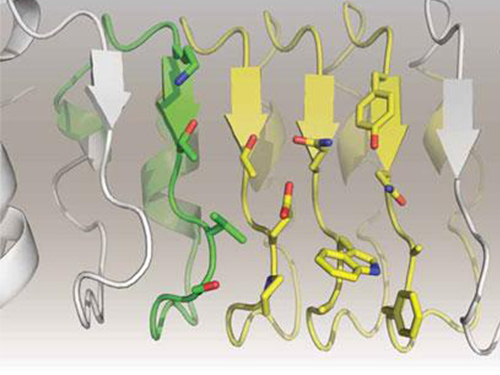 인공항체 기반 암 치료제 후보 개발
- 생명과학과 김학성 교수, Molecular Therapy에 표지 논문으로 발표
- 인공 항체 골격인 리피바디 기반 폐암 치료제 후보 개발- 리피바디 기반 단백질 신약 개발 가능성을 입증
우리 학교 생명과학과 김학성 교수는 충남대 의과대학 조은경 교수와 공동으로 인공 항체인 리피바디(Repebody) 기반 암 치료제 후보를 성공적으로 개발, 연구결과를 분자 치료(Molecular Therapy) 7월 호에 표지 논문으로 게재됐다.
김 교수팀은 암 유발 인자인 인터루킨-6 (Interleukin-6)와 강하게 결합하는 인공 항체인 리피바디를 개발했다. 또 리피바디가 비소 세포 폐암 동물 모델에서 암세포의 증식을 획기적으로 억제한다는 것을 확인했다.
많은 다국적 제약사 및 생명공학 기업들이 낮은 부작용과 높은 치료 효능을 갖는 단백질 치료제 개발에 천문학적인 연구비를 투자하고 있고 현재 20종 이상이 임상에 사용되고 있으며 100 여 종 이상이 임상실험 중이다. 이 중 항체 기반 치료제가 다수를 차지하고 있으며 많은 집중 투자가 진행되고 있다. 그러나 항체는 생산 비용이 매우 비싸고 큰 분자량과 복잡한 구조적 특성 때문에 설계가 어려우며 개발에 많은 시간과 비용이 소요된다.
이러한 기존 항체 기반 치료제의 한계점을 극복하고자, 김 교수팀은 신규 인공 항체 골격인 리피바디를 성공적으로 개발했다.(PNAS게재, 2012) 이를 기반으로 암 유발 인자인 인터루킨-6에 특이적으로 강한 결합력을 갖는 비소 세포 폐암 치료제 후보를 개발하는데 성공했다.
인터루킨-6는 면역 및 염증 관련 신호에 중요한 생체 내 물질로서, 비정상적으로 과 발현되는 경우에는 다양한 발암 경로를 활성화시켜 종양의 증식 및 전이를 촉진하는 것으로 알려져 있다. 이러한 중요성 때문에, 다국적 제약 업체들은 인터루킨-6에 의한 신호 전달을 억제할 수 있는 치료제 개발에 많은 연구를 집중하고 있다.
이번 연구에서 김 교수팀은 리피바디가 반복 모듈로 구성된 점에 착안, 질병 타겟에 대해 결합력을 효과적으로 증대시킬 수 있는 모듈 기반 친화력 증대 기술을 개발했다. 개발된 치료제 후보는 세포 및 동물 실험에서 낮은 면역원성과 비소세포 폐암의 증식을 탁월하게 억제한다는 것으로 확인됐다.
이와 함께 인터루킨-6와의 복합체 구조를 밝혀 리피바디의 작용기작을 규명해 치료제 개발 가능성을 입증했다. 김 교수팀은 현재 비 소세포 폐암 동물을 대상으로 임상 진입을 위한 전 임상 실험을 수행하고 있으며 향후 임상 시험을 통해 안정성 및 치료 효능을 입증해 단백질 신약으로 개발할 계획이다.
김 교수팀은 본 연구를 통해 인공항체 골격인 리피바디를 기반으로 단백질 신약을 개발할 수 있다는 것을 확인했고, 향후 국내의 단백질 신약 및 생명공학 산업 발전에 크게 기여할 것으로 기대하고 있다.
이번 연구결과는 미래창조과학부가 주관하는 미래 유망 파이오니어 사업의 지원을 받아 수행됐다.
그림 1. Molecular Therapy 7월 호 표지 논문 선정
그림 2. 동물 모델을 통한 리피바디의 암 성장 억제 효능 입증
2014.07.09 조회수 21235
인공항체 기반 암 치료제 후보 개발
- 생명과학과 김학성 교수, Molecular Therapy에 표지 논문으로 발표
- 인공 항체 골격인 리피바디 기반 폐암 치료제 후보 개발- 리피바디 기반 단백질 신약 개발 가능성을 입증
우리 학교 생명과학과 김학성 교수는 충남대 의과대학 조은경 교수와 공동으로 인공 항체인 리피바디(Repebody) 기반 암 치료제 후보를 성공적으로 개발, 연구결과를 분자 치료(Molecular Therapy) 7월 호에 표지 논문으로 게재됐다.
김 교수팀은 암 유발 인자인 인터루킨-6 (Interleukin-6)와 강하게 결합하는 인공 항체인 리피바디를 개발했다. 또 리피바디가 비소 세포 폐암 동물 모델에서 암세포의 증식을 획기적으로 억제한다는 것을 확인했다.
많은 다국적 제약사 및 생명공학 기업들이 낮은 부작용과 높은 치료 효능을 갖는 단백질 치료제 개발에 천문학적인 연구비를 투자하고 있고 현재 20종 이상이 임상에 사용되고 있으며 100 여 종 이상이 임상실험 중이다. 이 중 항체 기반 치료제가 다수를 차지하고 있으며 많은 집중 투자가 진행되고 있다. 그러나 항체는 생산 비용이 매우 비싸고 큰 분자량과 복잡한 구조적 특성 때문에 설계가 어려우며 개발에 많은 시간과 비용이 소요된다.
이러한 기존 항체 기반 치료제의 한계점을 극복하고자, 김 교수팀은 신규 인공 항체 골격인 리피바디를 성공적으로 개발했다.(PNAS게재, 2012) 이를 기반으로 암 유발 인자인 인터루킨-6에 특이적으로 강한 결합력을 갖는 비소 세포 폐암 치료제 후보를 개발하는데 성공했다.
인터루킨-6는 면역 및 염증 관련 신호에 중요한 생체 내 물질로서, 비정상적으로 과 발현되는 경우에는 다양한 발암 경로를 활성화시켜 종양의 증식 및 전이를 촉진하는 것으로 알려져 있다. 이러한 중요성 때문에, 다국적 제약 업체들은 인터루킨-6에 의한 신호 전달을 억제할 수 있는 치료제 개발에 많은 연구를 집중하고 있다.
이번 연구에서 김 교수팀은 리피바디가 반복 모듈로 구성된 점에 착안, 질병 타겟에 대해 결합력을 효과적으로 증대시킬 수 있는 모듈 기반 친화력 증대 기술을 개발했다. 개발된 치료제 후보는 세포 및 동물 실험에서 낮은 면역원성과 비소세포 폐암의 증식을 탁월하게 억제한다는 것으로 확인됐다.
이와 함께 인터루킨-6와의 복합체 구조를 밝혀 리피바디의 작용기작을 규명해 치료제 개발 가능성을 입증했다. 김 교수팀은 현재 비 소세포 폐암 동물을 대상으로 임상 진입을 위한 전 임상 실험을 수행하고 있으며 향후 임상 시험을 통해 안정성 및 치료 효능을 입증해 단백질 신약으로 개발할 계획이다.
김 교수팀은 본 연구를 통해 인공항체 골격인 리피바디를 기반으로 단백질 신약을 개발할 수 있다는 것을 확인했고, 향후 국내의 단백질 신약 및 생명공학 산업 발전에 크게 기여할 것으로 기대하고 있다.
이번 연구결과는 미래창조과학부가 주관하는 미래 유망 파이오니어 사업의 지원을 받아 수행됐다.
그림 1. Molecular Therapy 7월 호 표지 논문 선정
그림 2. 동물 모델을 통한 리피바디의 암 성장 억제 효능 입증
2014.07.09 조회수 21235